食用植物油是人们膳食结构中不可或缺的物质,它能够为人体提供能量、必需脂肪酸和脂溶性维生素等维持人体正常机能的物质。食用植物油常以干燥油料为原料通过压榨或浸提制取,但鉴于过度干燥对油脂氧化的影响以及油料在使用前贮藏运输过程中可能发生的吸潮等现象,成品食用植物油中都含有一定量的水分,会加速油脂水解、促进油脂氧化,严重影响食用植物油的稳定性和食用品质。此外,水分的存在还易导致有害微生物的大量繁殖。因此,检测和控制食用植物油的水分含量在油脂工业中具有重要意义[1]。
水分含量是食用植物油的关键质量指标。我国相关标准对不同等级食用植物油的水分含量有不同要求,一般一级、二级和三级食用植物油的水分含量分别不得超过0.10、0.15和0.20 g/100g[2-3]。由于食用植物油中水分含量较低,其检测方法要求具有检出限低、灵敏度高的特点。传统食用植物油中水分含量的检测方法有共沸蒸馏法、卡尔费休法、色谱法以及国家标准中使用的沙浴(电热板)法、电热干燥箱法[4]等,这些方法不同程度地存在测定过程耗时、检测过程繁琐、需要大型仪器设备、难于现场使用等缺点。红外光谱法和荧光探针法等新方法,致力于实现检测灵敏、便携、简单、低成本等目标,对革新食用植物油水分检测有重要作用,为推动其研究与应用,本文通过文献调研加以综述。
1 食用植物油水分检测经典方法的改进
1.1 卡尔费休法
卡尔费休法是测定水分的经典方法之一,也是目前检测食品中水分最常用、准确率最高的方法之一。该方法利用碘、二氧化硫的氧化还原反应需要水参与的特点,在吡啶和甲醇存在的情况下,生成氢碘酸吡啶和甲基硫酸吡啶,根据到达终点时卡尔费休试剂的消耗量计算得到样品中的水分含量。经典卡尔费休法经过改进可以实现自动化并且更加准确和直接进行测定。自动化卡尔费休法可以提高重现性以及精度,并且可以在更短的时间内处理更多的样品[5-6]。同时卡尔费休法也可以与其他方法相结合,如与直接注射焓法结合,能够降低检出限[7]。虽然卡尔费休法准确且易于自动化,但是其对于样品具有一定的选择性并且需要复杂仪器以及化学药品,因此随着其他方法的研究逐渐深入,卡尔费休法的应用逐渐减少。
1.2 顶空气相色谱法
顶空气相色谱法是将含有挥发性组分的样品置于密闭系统中,在一定温度下使样品中的挥发性组分在气-液两相中的分配达到平衡,然后取凝聚相上端的气体送入气相色谱仪进行分析的方法。该方法可以分析具有复杂干扰的液体样品中的挥发性物质,也可对食用油样品中的水分含量进行分析,其结果的精密度较高,并且具有较好的重复性,整体相对标准偏差小于1.13%,与干燥失重法相比,相对差异不超过1.62%。但是由于不同食用植物油极性存在差异,导致水分在不同使用植物油中具有不同的水油分配系数,这给顶空气相色谱法测定食用油脂水分含量带来一定的困难[8-9]。气相色谱-质谱联用的方法也常被用于经典共沸蒸馏测定水分含量的结果校正。由于水溶性挥发有机化合物的干扰,当食用植物油水分含量较高时,共沸蒸馏测定结果偏高,需经气相色谱-质谱校正,校正后的结果在99%置信区间范围内与卡尔费休法一致[10]。
1.3 电化学检测法
电化学检测方法是基于食用油中水分含量变化导致体系的电化学性质发生改变的原理进行检测的,采用电化学方法检测食用植物油中水分含量的研究报道相对较少。RAGNI等[11]使用基于多个平行电容器的电容技术对商品特级初榨橄榄油的水分含量进行了检测分析,发现由于特级初榨橄榄油水分含量极低,检测难度高,相对偏差较大,其主要误差来源于化学成分如脂肪酸的复杂变化以及挥发性化合物造成的影响。
2 食用植物油水分检测新兴检测技术
2.1 傅里叶红外光谱检测法
具体可以通过以下3种方式进行定量。表1总结了傅里叶红外光谱检测食用植物油水分含量的研究情况。第一种方式是通过水分在1 630 cm-1处的H—O—H弯曲吸收或者在3 629 cm-1处—OH的拉伸吸收条带进行分析。结果表明,上述2种特征吸收条带均可以实现定性与定量分析,但水分的弯曲吸收比拉伸吸收条带干扰少,准确性更高[12]。在实际应用中,可以根据所检测样品具体情况选择干扰相对较少的条带进行分析。在进行样品前处理时,水分的萃取可根据样品性质选择不同的萃取剂,如乙醇、二甲亚砜等。鉴于乙腈对水分的提取基本不受氢键影响,且提取物可在相对较长光程的样品池中进行分析[13],是最常用并且被认为是最佳的水分萃取剂。在测定时,常使用特征条带峰面积与相应纯乙腈峰面积之比进行定性分析[14-15]。为避免乙腈的影响以及提高实验精度,可以使用光谱稀释矫正程序、偏最小二乘法差谱的二阶导数等进行分析[12,16-17]。由于此方法可以通过调整乙腈和样品的比例调整灵敏度并且不需要其他方法进行校准,因此很容易实现自动化,通过自动进样器与傅里叶红外光谱仪进行耦合进行分析,其回归方程的决定系数(R2)可高达0.997,相对标准偏差仅为14 mg/kg,可以实现全自动分析并且满足大批量分析的要求[15]。通过此种方法进行食用油中水分的定量及定性分析,检测精度相对较高,并且有高灵敏度、高精度以及高自动化的发展潜力,有广阔的研究前景和应用价值。
表1 傅里叶红外光谱法在食用植物油水分检测中的应用效果
Table 1 Application effect of Fourier infrared spectroscopy in the moisture detection of edible vegetable oil
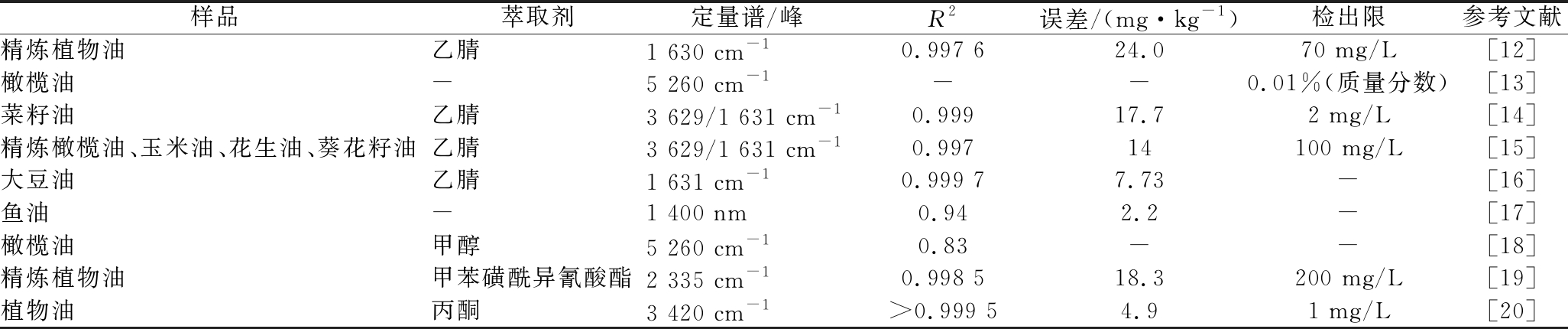
样品萃取剂定量谱/峰R2误差/(mg·kg-1)检出限参考文献精炼植物油乙腈1 630 cm-10.997 624.070 mg/L[12]橄榄油-5 260 cm-1--0.01%(质量分数)[13]菜籽油乙腈3 629/1 631 cm-10.99917.72 mg/L[14]精炼橄榄油、玉米油、花生油、葵花籽油乙腈3 629/1 631 cm-10.99714100 mg/L[15]大豆油乙腈1 631 cm-10.999 77.73-[16]鱼油-1 400 nm0.942.2-[17]橄榄油甲醇5 260 cm-10.83--[18]精炼植物油甲苯磺酰异氰酸酯2 335 cm-10.998 518.3200 mg/L[19]植物油丙酮3 420 cm-1>0.999 54.91 mg/L[20]
注:-表示无数据(下同)
第二种方式是食用油中的水分与特殊物质发生化学反应后的产物,经处理在红外光谱中产生特征峰以进行定量定性分析[20]。VOORT等[19]的研究表明,利用甲苯磺酰异氰酸酯与植物油中的水分发生反应生成二氧化碳再通过中红外光谱对2 335 cm-1处二氧化碳的响应峰进行检测,实现对水分含量的测定。由于二氧化碳的特征吸收波长与大多数有机物的吸收波长不同,因此该方法干扰小、灵敏度高、特异性好、准确度高,可实现自动化。但是,此方法需要进行校准,常通过比较不同含水量二恶烷与干燥二恶烷的标准图谱进行校准。
第三种方式是通过检测由于水分存在而导致食用油红外光谱的其他特征变化而实现对水分含量的分析。例如当橄榄油中存在水分时,其在5 260 cm-1处会出现弱的特征吸收峰,归因于水中O—H的影响[13,18]。与卡尔费休法对比可知,在95%的置信区间中,此方法与卡尔费休法的结果没有显著差异,并且其检测时间仅为1~2 min,且不需要样品的前处理以及化学试剂,可以作为一种相对高效低成本的替代方法进行使用。但是,这种方法对于水分含量以及油的种类有特殊要求,只有在5 260 cm-1处具有特征近红外带并且近红外光谱与橄榄油相似的其他食用油脂才可以使用,且只有在水分含量低于0.15 g/100g时才具有较高的定性定量能力[13,18]。
通过傅里叶红外光谱进行食用油中水分含量的分析的前提是需要了解样品油的红外光谱信息,以反映其化学组成和通过官能团吸收而引起的变化[21],从而选择合适的特征峰以及方法进行分析。通过红外光谱进行分析,其分析结果准确度基本与卡尔费休法类似,并且易于自动化,但是对于复杂样品的精度和准确度相对不稳定,近年来常被看为是卡尔费休法的一种替代方法进行使用,具有很好的研究前景。
2.2 荧光探针法
2.2.1 荧光染料探针法
在各类荧光检测中,有机荧光染料是最早应用的荧光探针,其通常由三部分组成[22]:荧光发色团、识别部位和连接基团。识别部位要求能够灵敏识别被检测物质并与其充分反应,连接基团将识别信号传递给荧光发色团,在特定激发波长照射时,荧光探针呈现出荧光增强、减弱、红蓝移等光学信号,并以此为检测结果定性或定量依据[23]。一般来说,具有连续共轭π键刚性平面结构的化学物质具有良好的荧光特性,常用做荧光探针的有氟化硼二吡咯类、香豆素类、荧光素和罗丹明类、花青素类、萘酰亚胺类以及一些新型的小分子染料。这些化合物在不同的激发波长下有明显的荧光效应,通常需要根据被检测物质的结构选择合适的荧光染料[24]。
以有机荧光染料作为探针检测痕量水分时,识别基团将化学信号转变为光信号的主要机理包括光诱导电子转移、分子内电荷转移和荧光共振能量转移等[24]。例如KUMAR等[22]以染料与氟离子结合化合物为探针,利用阴离子受体质子化和去质子化,即水破坏染料和阴离子之间的氢键,在脱质子化过程中,负电荷的大量离域通常会导致溶液的大红移,从而导致溶液颜色的剧烈变化,实现了对有机溶剂中微量水分的荧光检测。针对有机荧光探针在检测食品痕量水方面研究相对较少。大多方法的建立以有机溶剂为模型油脂,在实际测定时将一定量油脂溶于有机溶剂后测定。表2列出了有机荧光探针法在测定食用植物油中痕量水分的效果。ROY等[25]以4-甲基-2,6-二甲酰苯酚为荧光染料,二甲基亚砜为溶剂,分别检测了低水分含量的酥油、椰子油,高水分含量的黄油、奶酪中的含水量,结果显示该荧光探针的水诱导线性范围在0%~12%(体积分数)。KIM等[26]探索了氟化硼二吡咯类荧光染料探针可用于测定葡萄籽油中水分含量,其测定结果[0.153%(体积分数)]与经典卡尔费休法结果[0.16%(体积分数)]无显著差异。目前为止,荧光染料探针大部分还处于探索阶段,每种荧光发色团都存在一定局限性,且荧光染料具有合成步骤复杂、成本高、荧光现象不明显、容易受到温度和pH的影响等缺点。因此,荧光染料做探针虽然具有迅速、便携、检出限低等优点,但暂时还很难应用于食品领域的水分检测。
表2 有机荧光染料法在有机溶剂或食用植物油水分检测中的应用效果
Table 2 The application effect of organic fluorescent dye method in the water detection of edible vegetable oil and organic solvent
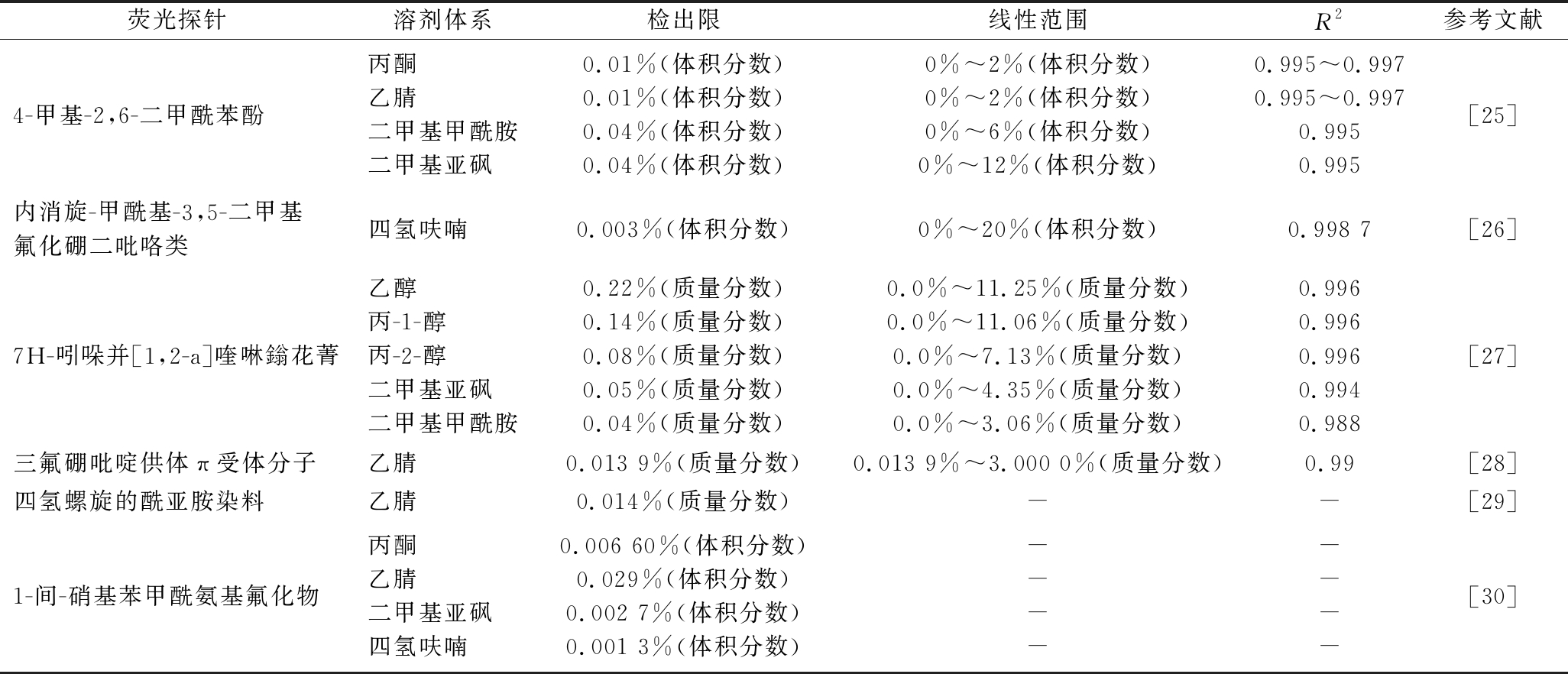
荧光探针溶剂体系检出限线性范围R2参考文献4-甲基-2,6-二甲酰苯酚丙酮乙腈二甲基甲酰胺二甲基亚砜0.01%(体积分数)0.01%(体积分数)0.04%(体积分数)0.04%(体积分数)0%~2%(体积分数)0%~2%(体积分数)0%~6%(体积分数)0%~12%(体积分数)0.995~0.9970.995~0.9970.9950.995[25]内消旋-甲酰基-3,5-二甲基氟化硼二吡咯类四氢呋喃0.003%(体积分数)0%~20%(体积分数)0.998 7[26]7H-吲哚并[1,2-a]喹啉鎓花菁乙醇丙-1-醇丙-2-醇二甲基亚砜二甲基甲酰胺0.22%(质量分数)0.14%(质量分数)0.08%(质量分数)0.05%(质量分数)0.04%(质量分数)0.0%~11.25%(质量分数)0.0%~11.06%(质量分数)0.0%~7.13%(质量分数)0.0%~4.35%(质量分数)0.0%~3.06%(质量分数)0.9960.9960.9960.9940.988[27]三氟硼吡啶供体π受体分子乙腈0.013 9%(质量分数)0.013 9%~3.000 0%(质量分数)0.99[28]四氢螺旋的酰亚胺染料乙腈0.014%(质量分数)--[29]1-间-硝基苯甲酰氨基氟化物丙酮乙腈二甲基亚砜四氢呋喃0.006 60%(体积分数)0.029%(体积分数)0.002 7%(体积分数)0.001 3%(体积分数)--------[30]
续表2

荧光探针溶剂体系检出限线性范围R2参考文献染料-氟离子结合(喹啉和硝基苯基为信号基团,以酰胺和胺基为结合基团染料)乙腈二甲基亚砜--0%~0.35%(体积分数)0.2%~0.5%(体积分数)0.999 40.990 1[31]萘二甲酰亚胺的衍生物二恶烷乙腈乙醇0.008%(体积分数)0.006%(体积分数)0.015%(体积分数)0%~4.40%(体积分数)0%~4.40%(体积分数)0%~4.40%(体积分数)0.995 00.986 60.997 0[32]
2.2.2 碳点探针法
碳点(carbon dot, CD)是一种尺寸在1~10 nm的碳纳米粒子,其荧光的产生是由于其表面缺陷而引起的发光,由于碳点的发光特性,常被用作荧光探针检测有机溶剂中的水分含量。根据合成原料和过程的不同,可以形成具有不同表面表征的碳点,不同表征不同溶剂均会影响其荧光特征以及水分检测原理、现象以及检测范围,具体见表3。
合成碳点的前体物质选择丰富,柠檬酸是常见的碳点前体原料。无水柠檬酸与邻苯二胺共同合成的碳纳米点在有机溶剂中对于发射峰没有明显的波长依赖性[33],柠檬酸不仅可以合成具有超高荧光量子产率(96.9%)的碳量子点[34],还可以与还原性谷胱甘肽共同合成碳点,并与水化学传感器结合,用于有机溶剂中水分含量的测定,其原理主要是由于水分子的存在破坏了原体系中的光诱导电子转移过程,使被光诱导电子转移猝灭的荧光强度恢复[35]。
在不同的有机溶剂体系中,碳点的发光特性以及水分的检测原理均有差异。以邻苯二酚作为原料可以合成一种具有溶剂依赖性的碳点,即在不同的有机溶剂体系中表现出不同颜色的荧光并且此种发光特性与荧光的激发无关,当有机体系中存在水分时,会导致最大发射波长红移,根据发射峰的位置与水分含量的线性关系进行水分含量的定量[36]。SENTHAMIZHAN等[37]研究了不同溶剂中碳点的水致变色原理,非质子传递溶剂,如乙腈、丙酮、四氢呋喃与电子传递溶剂,如异丙醇、丁醇中碳点的水致变色特性与原理不同,非质子传递溶剂中的水含量的增加,会使非辐射弛豫途径如与周围分子的振动耦合、分子内旋等增强,使荧光强度降低,并且会使碳点连续聚集,导致最大发射波长的红移;质子传递溶剂体系中水分的增加,会使核心的光致发光的辐射途径优于非辐射途径,表现为荧光强度的增强。
采用荧光碳点的方式进行水分含量的测定,合成简单、材料容易获取、检测方法简单快速,但是在由于其具有一定的溶剂依赖性,同时,不同方法合成的具有不同表征的碳点本身具有一定的差异,线性范围相对较窄,在定量方面存在一定的困难。在食品中常用于酒类产品的水分检测[38],而在食用油水分检测的可行性方面需要进一步的验证。
表3 碳点荧光探针法在食品及有机溶剂水分检测中的应用效果
Table 3 Application effect of carbon dot fluorescence probe method in food and organic solvent moisture detection

碳点合成材料溶剂体系检出限/%(体积分数)线性范围/%(体积分数)R2参考文献无水柠檬酸和邻苯二胺二甲基甲酰胺0.110~1000.987 6[33]柠檬酸钠,尿素和氯化铜二水合物四氢呋喃0.010.01~40.998 8[34]柠檬酸+谷胱甘肽甲苯0.000 120.000 12~0.020.995[35]邻苯二胺丙酮乙腈四氢呋喃乙醇0.190.180.130.01--------[36]红糖四氢呋喃0.2~5.0-0.944 15[37]1,3,6-三硝基芘丙酮0~40.0850.992[38]柠檬酸钠、尿素和氯化钴乙醇0.010.01~100.997 0[39]壳聚糖凝胶二甲基亚砜0.0230~680.99[40]无定形碳酸钙+固体柠檬酸铵乙腈0.001 510~350.992[41]
2.2.3 金属有机框架探针法
金属有机框架(metal organic frame, MOF)是由有机连接基和金属节点通过配位键形成的多孔晶体材料,部分金属元素作为配位中心合成的金属有机框架能够产生强烈的荧光发射,例如镧系元素离子(如Eu3+、Tb3+)和碱土元素离子(Mg2+、Zn2+)。在金属有机框架中引入能与水分子灵敏反应的化学结构,水分进入有机溶剂体系后,体系中的物质结构受到水的极性、氢键结构的影响,通过分子内质子转移、化学结构转变、能量转移等,使荧光探针的紫外发射光谱红移,体系最终在紫外光照射下发射的荧光颜色产生差异,从而对被检测样品中的水分含量定量具体见表4。
表4 金属有机框架探针法在食用植物油及有机溶剂水分检测中的应用效果
Table 4 The application effect of metal organic frame probe method in the moisture detection of edible vegetable oil and organic solvent
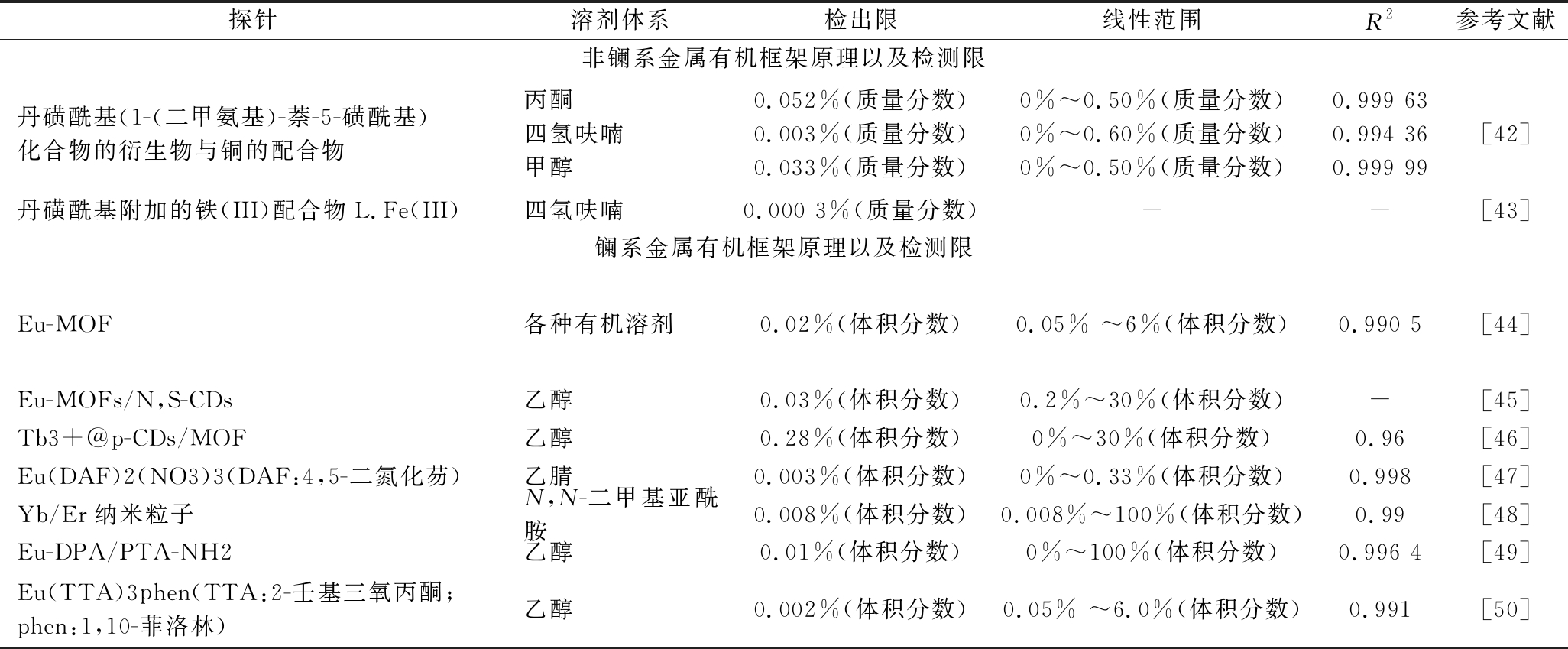
探针溶剂体系检出限线性范围R2参考文献非镧系金属有机框架原理以及检测限丹磺酰基(1-(二甲氨基)-萘-5-磺酰基)化合物的衍生物与铜的配合物丙酮四氢呋喃甲醇0.052%(质量分数)0.003%(质量分数)0.033%(质量分数)0%~0.50%(质量分数)0%~0.60%(质量分数)0%~0.50%(质量分数)0.999 630.994 360.999 99[42]丹磺酰基附加的铁(III)配合物L.Fe(III)四氢呋喃0.000 3%(质量分数)--[43]镧系金属有机框架原理以及检测限Eu-MOF各种有机溶剂0.02%(体积分数)0.05% ~6%(体积分数)0.990 5[44]Eu-MOFs/N,S-CDs乙醇0.03%(体积分数)0.2%~30%(体积分数)-[45]Tb3+@p-CDs/MOF乙醇0.28%(体积分数)0%~30%(体积分数)0.96[46]Eu(DAF)2(NO3)3(DAF:4,5-二氮化芴)乙腈0.003%(体积分数)0%~0.33%(体积分数)0.998[47]Yb/Er纳米粒子N,N-二甲基亚酰胺0.008%(体积分数)0.008%~100%(体积分数)0.99[48]Eu-DPA/PTA-NH2乙醇0.01%(体积分数)0%~100%(体积分数)0.996 4[49]Eu(TTA)3phen(TTA:2-壬基三氧丙酮;phen:1,10-菲洛林)乙醇0.002%(体积分数)0.05% ~6.0%(体积分数)0.991[50]
镧系金属用于有机溶剂体系的水分检测主要有2种原理:(1)水分子与镧系金属离子之间发生能量转移的相互作用,即水分子与配位的镧系金属离子重新发生配位反应,非辐射能转移到水分子的O—H振动,产生荧光猝灭现象;(2)水分子本身会直接吸收激发能量导致荧光强度的降低,产生荧光猝灭现象。现阶段多采用镧系金属与有机化合物配位反应形成的荧光晶体进行检测。氨基苯甲酸及其衍生物类化合物由于其具有良好的分子内电荷转移特性,能够促进荧光现象的发生,常被用于合成MOF。
非镧系金属的有机配位化合物在食品水分含检测中有所应用。基于丹磺酰基的非荧光铜配位化合物形成的探针,其分子内部具有电子转移行为,随着水分含量的增加,导致荧光发射行为的变化,从而定量检测水分含量,目前已成功应用于盐、糖、小麦中[42]。KUMAR等[43]基于丹磺酰基化合物的供体-受体特性,通过分子内电荷转移表现出溶剂致变色现象,可以定性和定量的检测油料作物(如花生、芥末、葵花籽、芝麻和杏仁)中的痕量水分。
为了更加显著地观察荧光变色,构成金属有机框架的连接基以及其客体可均由具有荧光特性的材料充当。DONG等[45]创造性的将金属有机框架与碳点结合,将发射蓝色荧光氮硫共掺的碳基点封装进有强红色荧光的Eu-MOF,在有机溶剂中体系呈现红色荧光,当微量水分进入有机溶剂体系时,由于O—H震荡破坏Eu-MOF,使体系呈现N,S-CDs的蓝色荧光,扩大了荧光的变色范围,便于观察。WU等[46]在此基础上进行了创新,制备出与碳点结合的双发射金属有机框架。用发绿色荧光的Tb-MOF封装发射红色荧光的碳点,该探针分散在乙醇溶液中,产生红光和绿光。p-CD的红色发光强度更强,最终显示出红色的发光颜色。当碳点分散在水溶液中,团聚作用使红光被熄灭,仅显示Tb3+的绿色荧光。
金属有机框架可同时拥有多色发光,这一特性显著扩大了MOF作为荧光探针检测食品中水分含量的检测范围,提高了检测结果的准确性。金属有机框架探针化学性质稳定,灵敏度高,成本低,每次使用后用指定的有机溶剂洗涤,干燥后即可反复使用,在现场、实时、快速检测方面充满潜力。
3 展望
食用油中的水分检测方法逐步朝向自动化、高准确度、高灵敏度并且绿色简单的方向发展。传统的检测方法,如卡尔费休法和顶空气色谱法均具有一定的样品选择性,电化学测定的准确度受到一定的限制,因此出现了许多新兴检测方法,其中以傅里叶红外光谱法和荧光比色检测法研究最多,在一定条件下检出限可达到10-4级。傅里叶红外光谱法需要专门的仪器,该法准确度高、易于自动化,适合实验室检测。荧光检测新材料如碳点,金属有机框架等的开发,不仅改善了荧光染料的发光易受到溶剂、温度和pH的影响的缺点,而且延长了荧光探针的使用寿命、提高了检测精度和灵敏度。荧光试纸条、荧光薄膜等的开发,使荧光检测更加适用于现场快速检测。食用油中的水分检测方面,红外检测技术的应用已经趋于成熟,而荧光检测技术虽然应用与研究都较少,但均取得了良好成果,可以看出其具有良好的研究和应用前景。
[1] 孔伟, 孟庆宇, 蒋甜燕, 等.卡尔·费休法测定食用油中的水分[J].现代食品, 2018(16):102-104;107.
KONG W, MENG Q Y, JIANG T Y, et al.Determination of moisture in edible oil by karl fischer method[J].Modern Food, 2018(16):102-104;107.
[2] 国家质量监督检验检疫总局, 中国国家标准化管理委员会.GB/T 1535—2017大豆油[S].北京:中国标准出版社, 2017.
State Administration of Quality Supervision, Inspection and Quarantine of the People′s Republic of China, China National Standardization Administration Committee.GB/T 1535—2017 Soya bean oil [S].Beijing:China Standards Press, 2009.
[3] 国家标准化管理委员会,国家质量监督检验检疫总局.GB/T 10464—2017葵花籽油[S].北京:中国标准出版社, 2017.
State Administration of Quality Supervision, Inspection and Quarantine of the People′s Republic of China, China National Standardization Administration Committee.GB/T 10464—2017 Sunflowerseed oil [S].Beijing:China Standards Press, 2017.
[4] 国家卫生和计划生育委员会. GB 5009.236—2016 食品安全国家标准 动植物油脂水分及挥发物的测定[S].北京:中国标准出版社, 2016.
National Health and Family Planning Commission of the People′s Republic of China.GB 5009.236—2016 National food safety standard Determination of moisture and volatile matter of animal and vegetable oils and fats[S].Beijing:China Standards Press, 2016.
[5] FELGNER A, SCHLINK R S, KIRSCHENBÜHLER P, et al.Automated karl fischer titration for liquid samples-water determination in edible oils[J].Food Chemistry.2007, 106(4):1 379-1 384.
[6] BERNREUTHER A.Determination of water content of butter oil by karl fischer titration[J].International Journal of Dairy Technology, 2007, 60(4):307-307.
[7] BARK L S, HADIPRANOTO H.Enthalpimetric assay of the water content of some oils and fats[J].Journal of Thermal Analysis, 1991, 37(3):657-666.
[8] 温江珊,郭兰,毛兆星.气相色谱法快速测定油脂中水分含量[J].四川粮油科技,2000(1):48-49.
WEN J S, GUO L, MAO Z X.Rapid Determination of moisture content in oils by gas chromatography[J].Sichuan Cereals and Oils Science and Technology,2000(1):48-49.
[9] XIE W Q, GONG Y X, YU K X.Efficient quantification of water content in edible oils by headspace gas chromatography with vapour phase calibration[J] Journal of the Science of Food and Agriculture,2017.DOI:10.1002/jsfa.8795
[10] SMETS K, ADRIAENSENS P, VANDEWIJNGAARDEN J, et al.Water content of pyrolysis oil:Comparison between karl fischer titration, GC/MS-corrected azeotropic distillation and 1h nmr spectroscopy[J].Journal of Analytical and Applied Pyrolysis, 2011, 90(2):100-105.
[11] RAGNI L, IACCHERI E, CEVOLI C, et al.A capacitive technique to assess water content in extra virgin olive oils[J].Journal of Food Engineering, 2013, 116(1):246-252.
[12] MENG X H, SEDMAN J, VAN DE VOORT F R.Improving the determination of moisture in edible oils by FTIR spectroscopy using acetonitrile extraction[J].Food Chemistry.2012, 135(2):722-729.
[13] FARDIN-KIA A R, KARUNATHILAKA S R, YAKES B J, et al.A rapid, univariate FT-NIR procedure to determine moisture concentration in olive oil[J].Journal of Oleo Science, 2019, 68(11):1 105-1 112.
[14] AL-ALAWI A, VAN DE VOORT F R, SEDMAN J.A new fourier transform infrared method for the determination of moisture in edible oils[J].Applied Spectroscopy.2005, 59(10):1 295-1 299.
[15] AL-ALAWI A, VAN DE VOORT F R, SEDMAN J, et al.Automated FTIR analysis of free fatty acids or moisture in edible oils[J].JALA: Journal of the Association for Laboratory Automation, 2006, 11(1):23-29.
[16] 叶建晨. FTIR技术分析食用油的水分以及反式脂肪酸含量的研究[D].杭州:浙江工业大学, 2015.
YE J C. Study on analysis of moisture content and trans fatty acid content in the edible oils by FTIR[D]. Hangzhou: Zhejiang University of Technology, 2015.
[17] COZZOLINO D, MURRAY I, CHREE A, et al.Multivariate determination of free fatty acids and moisture in fish oils by partial least-squares regression and near-infrared spectroscopy[J].LWT - Food Science and Technology, 2004, 38(8):821-828.
[18] KARUNATHILAKA S R, FARDIN-KIA A R, ROBERTS D, et al.Determination of moisture in olive oil:Rapid FT-NIR spectroscopic procedure based on the Karl-Fischer reference method[J].Journal of Oleo Science,2020, 69(11):1 373-1 380.
[19] VOORT F R, TAVASSOLI-KAFRANI M H, CURTIS J M.Stoichiometric determination of moisture in edible oils by Mid-FTIR spectroscopy[J].Analytica Chimica Acta.2016, 918:1-7.
[20] SALEH S H, TRIPP C P.A Reagentless and rapid method to measure water content in oils[J].Talanta,2021,225:121911.
[21] VOORT F R, GHETLER A, GARC A-GONZ
A-GONZ LEZ D L, et al.Perspectives on quantitative Mid-FTIR spectroscopy in relation to edible oil and lubricant analysis:Evolution and integration of analytical methodologies[J].Food Analytical Methods,2008, 1(3):153-163.
LEZ D L, et al.Perspectives on quantitative Mid-FTIR spectroscopy in relation to edible oil and lubricant analysis:Evolution and integration of analytical methodologies[J].Food Analytical Methods,2008, 1(3):153-163.
[22] KUMAR P, GHOSH A, JOSE D A.Chemical sensors for water detection in organic solvents and their applications[J].Chemistry Select, 2021, 6(4):820-842.
[23] 杨斌英. 邻苯二甲酰亚胺类染料和新型巯基类荧光探针的合成及应用[D].杭州:浙江理工大学,2020.
YANG B Y, Synthesis and application of phthalimide dyes and novel sulfhydryl fluorescent probes[D].Hangzhou:Zhejiang Sci-Tech University, 2020.
[24] 许龙斌. 新型功能化有机小分子荧光探针的制备及其性能与应用研究[D].长春:吉林大学,2019.
XU L B, Preparation, performance and application of novel functionalized organic small molecule fluorescent probes[D].Chuangchun:Jilin University, 2019.
[25] ROY S, DAS S, RAY A, et al.An inquisitive fluorescence method for the real-time detection of trace moisture in polar aprotic solvents with the application of water rancidity in foodstuffs[J].New Journal of Chemistry, 2021, 45(10):4 574-4 583.
[26] KIM T I, YOUNGMI K.A water indicator strip:Instantaneous fluorogenic detection of water in organic solvents, drugs, and foodstuffs[J].Analytical Chemistry, 2017, 89(6):3 768-3 772.
[27] SAWICKA M J, WR BLEWSKA E K.The application of 7H-indolo[1,2-a] quinolinium merocyanine as a new water sensor in organic solvents[J].Springer Open Choice, 2018, 72(3):741-752.
BLEWSKA E K.The application of 7H-indolo[1,2-a] quinolinium merocyanine as a new water sensor in organic solvents[J].Springer Open Choice, 2018, 72(3):741-752.
[28] TSUMURA S, ENOKI T, OOYAMA Y, et al.A colorimetric and fluorescent sensor for water in acetonitrile based on intramolecular charge transfer:D-(π-A)2-type pyridine-boron trifluoride complex[J].Chemical Communications, 2018, 54:10 144-10 147.
[29] CAI L F, SUN X Y, HE W, et al.A solvatochromic AIE tetrahydro[5] helicene derivative as fluorescent probes for water in organic solvents and highly sensitive sensors for glyceryl monostearate[J].Talanta, 2019, 206:120214.
[30] NANDI S K, HALDAR D.1-m-Nitrobenzoyl semicarbazide:Reversible colorimetric cascade indicators for fluoride and moisture[J].New Journal of Chemistry, 2020, 44(40):17 523-17 530.
[31] KIM Y H, HAN Y K, KANG J M.A new chromogenic water sensing system utilizing deprotonation and protonation of anion receptor[J].Bulletin- Korean Chemical Society, 2011, 32(12):4 244-4 246.
[32] NIU C G, QIN P Z, ZENG G M, et al.Fluorescence sensor for water in organic solvents prepared from covalent immobilization of 4-morpholinyl-1, 8-naphthalimide[J].Analytical and Bioanalytical Chemistry, 2007, 387(3):1 067-1 074.
[33] 潘鹏涛,邹凡雨,殷俊磊.碳纳米点荧光探针对有机溶剂中水含量的检测[J].激光与光电子学进展,2020,57(23):231602.
PAN P T, ZOU F Y, YIN J L.Detection of water content in organic solvents with carbon nanodot fluorescent probes[J].Progress in Laser and Optoelectronics,2020,57(23):231602.
[34] WEI J F, YUAN Y, LI H K, et al.A novel fluorescent sensor for water in organic solvents based on dynamic quenching of carbon quantum dots[J].New Journal of Chemistry, 2018, 42:18 787-18 793.
[35] ESPINA-CASADO J,FERN NDEZ-GONZ
NDEZ-GONZ LEZ A,D
LEZ A,D AZ-GARC
AZ-GARC A M E, et al.Smart carbon dots as chemosensor for control of water contamination in organic media[J].Sensors and Actuators B:Chemical, 2021, 329:129262.
A M E, et al.Smart carbon dots as chemosensor for control of water contamination in organic media[J].Sensors and Actuators B:Chemical, 2021, 329:129262.
[36] CHAO D Y, LYU W L, LIU Y B, et al.Solvent-dependent carbon dots and their applications in the detection of water in organic solvents[J].Journal of Materials Chemistry C, 2018,6:7 527-7 532.
[37] SENTHAMIZHAN A, FRAGOULI D, BALUSAMY B, et al.Hydrochromic carbon dots as smart sensors for water sensing in organic solvents[J].Nanoscale Advances, 2019,1(11):4 258-4 267.
[38] GENG B J, WANG X L, LI P, et al.Multifunctional carbon dots for trace water detection, white LEDs, and bioimaging[J].Chemistry Select, 2019, 4(48):14 162-14 168.
[39] WEI J F, LI H K, YUAN Y, et al.A sensitive fluorescent sensor for the detection of trace water in organic solvents based on carbon quantum dots with yellow fluorescence[J].RSC Advances, 2018, 8(65):37 028-37 034.
[40] PAWAR S, TOGITI U K, BHATTACHARYA A A, et al.Functionalized chitosan-carbon dots:A fluorescent probe for detecting trace amount of water in organic solvents[J].ACS Omega, 2019, 4(6):11 301-11 311.
[41] YU H J, LI H X, CHEN C, et al.Water-sensitive phase-transition of a carbon dots-calcium carbonate composite for moisture detection in organic solvents[J].Analytical Methods, 2019, 11(20):2 634-2 638.
[44] ZHOU Y, ZHANG D N, XING W Z, et al.Ratiometric and turn-on luminescence detection of water in organic solvents using a responsive europium-organic framework[J].Analytical Chemistry, 2019,91(7):4 845-4 851.
[42] KUMAR P, KAUSHIK R, GHOSH A, et al.Detection of moisture by fluorescent OFF-ON sensor in organic solvents and raw food products[J].Analytical Chemistry, 2016, 88(23):11 314-11 318.
[43] KUMAR P, GADIYARAM S, JOSE D.A.Simple iron (III) complex based highly sensitive fluorescent off-on sensor for the detection of trace amount of water in organic solvents and edible oilseeds[J].ChemistrySelect, 2020, 5(34):10 648-10 655.
[45] DONG Y Q, CAI J H, FANG Q Q, et al.Dual-emission of lanthanide metal-organic frameworks encapsulating carbon-based dots for ratiometric detection of water in organic solvents[J].Analytical Chemistry, 2016, 88(3):1 748-1 752.
[46] WU J X, YAN B.A Dual-emission probe to detect moisture and water in organic solvents based on green-Tb3+ post-coordinated metal-organic frameworks with red carbon dots[J].Dalton transactions (Cambridge, England:2003), 2017, 46(21):7 098-7 105.
[47] SONG L, WU Y W, CHAI W X, et al.Fluorescence quenching of a europium coordination compound for the detection of trace amounts of water:uncovering the response mechanism by structural confirmation[J].European Journal of Inorganic Chemistry, 2015, 2015(13):2 264-2 271.
[48] GUO S H, XIE X J, HUANG L, et al.Sensitive water probing through nonlinear photon upconversion of lanthanide-doped nanoparticles[J].ACS Applied Materials & Interfaces, 2016, 8(1):847-853.
[49] YU L, ZHENG Q T, WANG H, et al.Double color lanthanide metal-organic framework based logic device and visual ratiometric fluorescence water microsensor for solid pharmaceuticals[J].Analytical Chemistry, 2019, 92(1):1 402-1 408.
[50] GAO F, LUO F B, CHEN X X, et al.Fluorometric determination of water in organic solvents using europium ion-based luminescent nanospheres[J].Microchimica Acta, 2009, 166(1-2):163-167.