聚酮类化合物(polyketides)是天然产物中的一大类,是由真核生物及原核生物产生的一类次级代谢产物,其来源广泛、种类繁多。聚酮类化合物是由短链的酰基单元(乙酸酯,丙酸酯或丙二酸酯等)通过连续的Claisen缩合反应合成的,此过程由被称为聚酮合酶(polyketide synthase,PKS)的复杂酶催化,类似于脂肪酸的生物合成过程。过去的几十年中,基于其合成机制被逐渐揭示,为合理设计和操纵聚酮生物合成生产新化合物奠定了基础。目前已发现的天然聚酮类化合物已突破10 000种,由之衍生的新产物更是难以计数,部分聚酮类化合物及其衍生物已经实现商业化应用:洛伐他汀(lovastatin)在内的他汀类药物占到降血脂药物市场总额的80%以上;红霉素作为一种典型的聚酮类化合物,也是医药和畜牧业中常用的大环内酯类抗生素[1]。目前大量研究表明,聚酮类化合物的主要作用包括抗氧化、抗肿瘤、免疫抑制、抗菌活性、抗炎症和抗寄生虫,基于其广泛的生物学活性,独特的结构和合成机制以及良好的可塑性,这类化合物越来越受到国内外研究者的重视[2-3]。因此,本文主要综述了国内外对聚酮化合物生物合成机制以及其生物活性的研究进展,旨在为聚酮类化合物的研究和应用提供参考。
1 天然聚酮类化合物
天然聚酮类化合物是天然产物中的一大类,主要是由真菌、细菌、植物产生的次级代谢产物,其中部分可作为临床药物被应用。一些常见的聚酮类化合物及其天然宿主如表1所示。红霉素(erythromycin)是最早被发现的聚酮类抗生素之一,它是由MCGUIRE等从革兰氏阳性菌红色糖多孢菌(Saccharopolyspora erythraea)发酵液中提取出的一种次级代谢产物[4],其具有抗革兰氏阳性菌、毒性低等特点,因而在医药中被广泛应用。洛伐他汀是由紫红曲霉(Monascus purpureus)产生的一类次级代谢产物。1976年,DUJOVNE[5]研究发现它是一种具有降低血液中胆固醇功效的物质,引起了全世界的关注,随后洛伐他汀便被用于制作降胆固醇药物并沿用至今。最近的研究表明,洛伐他汀还具有其他诸如减轻糖尿病症状、缓解骨质疏松以及诱导癌细胞凋亡的功效,这也引起了广大学者的研究兴趣[6]。黄曲霉毒素(aflatoxin)是一类具有高毒性的次级代谢产物,主要由曲霉属(Aspergillus)中的黄曲霉(Aspergillus flavus)、寄生曲霉(Aspergillus parasiticus)、米曲霉(Aspergillus nomius)等产生[7]。该类天然化合物中毒性最强的是黄曲霉毒素B1,其具有毒性大、致癌性强、不易分解等特点,在饲料、食用油加工中难以去除,从而造成经济损失甚至影响人类的身体健康[8]。
四环素类(tetracyclines)物质是由土壤放线菌使用II型PKS合成的一类聚酮类化合物[9]。最早的四环素类物质是DUGGAR等在金色链霉菌(Streptomyces aureus)发现的金霉素(aureomycin),以及FINLAY从龟裂链霉菌(Streptomyces rimosus)提取出的土霉素(terramycin),它们在20世纪中叶被作为抗生素药物广泛使用。现在所熟知的四环素(tetracycline)是YU等[10]通过金霉素的催化氢化合成的去氯衍生物。相较于金霉素,它具有更好的药理活性以及溶解性,目前常以金黄色链霉菌作为生产菌发酵生产。
表1 部分天然聚酮类化合物及其宿主
Table 1 Some natural polyketides and their hosts

聚酮类化合物天然宿主红霉素 Saccharopolyspora erythraea洛伐他汀 Monascus purpureus黄曲霉毒素Aspergillus flavus、Aspergillus parasiticus等土霉素 Streptomyces rimosus四环素 Streptomyces aureus
2 “非天然”聚酮类化合物的生物合成
聚酮类化合物因其具有丰富的化学性质以及独特的生理活性而受到广大学者的青睐,但自然界中天然的聚酮类化合物难以完全满足人们的需要,因此通过人为改造方式获得聚酮类化合物逐渐成为一种研究趋势。由于聚酮类化合物化学、立体结构复杂,难以使用化学法对其进行改造,因此常使用基因工程法构建非天然聚酮类化合物,主要操作方法为在原基因上替换、引入、删除不同来源的基因,并导入合适的宿主,从而合成自然界本不存在的新化合物[11]。目前的研究方法主要是通过对聚酮合酶的结构域、亚基、作用模块等进行改造并在宿主中表达来获取新的非天然聚酮类化合物[12]。
2.1 结构域的改造
聚酮化合物合成途径中的底物选择、还原程度和产物的立体化学结构都是由聚酮合酶中相应模块上的结构域决定的,每个结构域的功能与结构一一对应,于是结构域的删除、替换、增加以及重新定位对于合成新的聚酮化合物具有指导意义。第一例成功报道的PKS基因工程改造就是对6-脱氧-红霉内酯B合成酶(6-deoxy-erythronolide B synthase,DEBS)模块5中酮体还原酶(keto reductase,KR)结构域的缺失失活。1991年,DONADIO等[13]通过缺失DEBS3中模块5的KR5结构域的80个氨基酸,合成了C5位是酮基的红霉素衍生物5,6-dideoxy-3α-mycarosyl-5-oxo-erythronolide B;随后,DONADIO等又将DEBS2模块4中的烯脂酰还原酶(enoyl reductase,ER4)结构域通过碱基替换失活,获得的衍生物中C6-C7的连键由单键变为双键(图1)。硫酯酶(thioesterase,TE)结构域一般催化产物的释放,通过将TE结构域重新定位到各个模块的末端可以人工释放产生的中间体。BÖHM等[14]通过将DEBS1链的末端与TE末端结合构建了DEBS1-TE模型,结果表明,在体内与体外均能有效合成三酮内酯。同样,将TE结构域定位到模块3与模块5中也能产生预期的截断产品,证明了单模块的PKS也具有催化活性。延伸单位的选择是由每个模块的酰基转移酶(acyltransferase,AT)结构域控制的,AT结构域的替换也可以导致新的聚酮化合物的产生。首次利用AT结构域替换得到新型非天然聚酮化合物的是LEADLAY课题组。OLIYNYK等[15]使用了曾经开发过的DEBS1-TE模型,通过将DEBS1-TE中的AT1替换为雷帕霉素PKS模块2中的AT2,成功获得了2种新型三酮内酯,且使2种衍生物均比原来的三酮内酯缺少一个甲基。
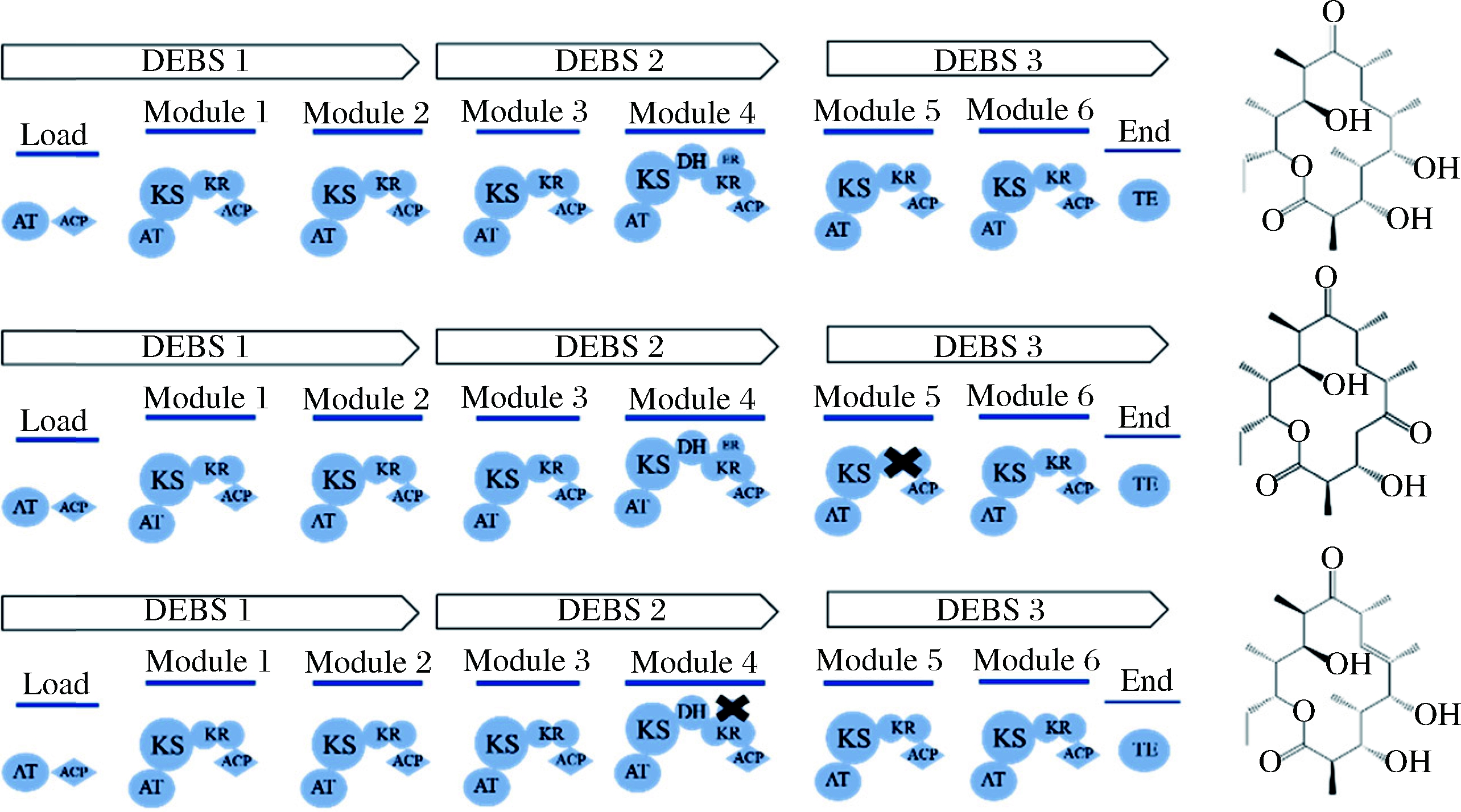
图1 DEBS结构域的删除
Fig.1 Deletion of domains of DEBS[14-15]
2.2 模块的改造
与结构域相同,聚酮合酶的模块对产物的立体化学结构及生物活性也起到决定性作用,这使得对模块改造以产生新的非天然聚酮化合物成为可能。RANGANATHAN等[16]通过将DEBS1-TE的整个模块2从酰基载体蛋白(acyl carrier protein,ACP)中间位置替换为雷帕霉素合酶的模块12,构建了三酮内酯合成酶TKS-AR2。还构建了将雷帕霉素合酶模块12中AT,KR以及ACP连接到DEBS模块2中KS2结构域羧基端的TKS-AR3。结果表明,TKS-AR3可以有效合成含甲基与乙基的2种三酮内酯(图2-a)。
2001年,ROWE等[17]将雷帕霉素合酶的模块2和模块5分别插入DEBS1-TE模块1和模块2间获得了预期的四酮化合物(图2-b)。进一步实验表明,即使插入的雷帕霉素合成酶的模块不从酮酰基合酶(keto-acyl synthase,KS)结构域延伸至ACP,而是从KS结构域末端延伸至下一模块的KS结构域的末端,获得产物的产率大致相同,表明了模块的插入并不依赖于唯一位置的正确插入。
2.3 亚基的改造
亚基交换以及亚基重排是改造亚基从而获取非天然聚酮类化合物的常见技术。XU等[18]通过把4组同源的、合成真菌苯二醇内酯(benzenediol lactone,BDL)所需要的迭代聚酮合酶(iPKSs)导入到酿酒酵母中,通过将不同的高度还原的聚酮合酶(highly reducing polyketide synthase,hrPKS)和非还原性聚酮合酶(nonreducing polyketide synthase,nrPKS)组合以表达自然界中不存在的聚酮类化合物,最终它们在ACP转酰酶结构域交换的辅助下成功表达了14种新型的聚酮类化合物,并在其中发现了1种对癌细胞具有显著细胞毒性的非天然聚酮类化合物radilarin。WANG等[19]在Rhytidhysteron rufulum中发现了1种不表达的BDL合酶基因,他们通过将基因中编码hrPKS的序列以及nrPKS的序列分别与其他4种BDL合酶基因编辑系统中互补的nrPKS和hrPKS基因序列配对,转入酿酒酵母中进行异源表达,同时对结构域进行调整,最终成功恢复了该BDL合成酶表达系统,获得了非天然的聚酮类化合物。

a-模块的替换;b-模块的插入
图2 模块的改造
Fig.2 Transformation of the module
2.4 定点突变
对已知三维结构的结构域进行定点突变不仅有助于证实已经提出的生物合成机理,也可以用于新型聚酮合酶的开发。KORYAKINA等[20]选择了DEBS3的AT6结构域中的3个残基Leu118,Tyr189和Ser191进行诱变,并发现,在DEBS3中引入一个突变体V187A与Y189R结合可以显著利用propargylmalonyl-CoA并产生新型化合物。JEZ等[21]通过检测CHS G256A、G256V、G256L和G256F突变体的X射线晶体结构,发现突变减少了活性位点腔的大小,但没有显著改变多肽骨架的构象。随后,JEZ等[22]用丝氨酸取代了在III型PKS中保守的Phe-215,使得F265V突变体优先使用N-甲基蒽基-CoA作为起始分子以生成新型生物碱N-甲基蒽基三乙酸内酯;而使用缬氨酸代替Phe-265并不会改变对起始分子的选择性。MORITA等[23]进行了进一步的研究,结果表明,HsPKS1中突变体S328G不仅延长了产物链长,而且改变了环化机制,可催化起始底物2-氨甲酰基苯甲酰-CoA与3分子丙二酰-CoA缩合形成一种新型聚酮骨架dibenzoazepine。
3 PKS酶研究进展
PKS是复杂的多酶体系的一种,是用于介导聚酮化合物生物合成的关键酶。PKS通常以脂酰-CoA为底物,通过多次Claisen脱羧缩合过程产生聚酮类化合物或环状酮内酯,其过程与脂肪酸合成类似。由于其结构和催化途径的不同,PKS大致可分为3个类型,即Ⅰ 型PKS、Ⅱ 型PKS和Ⅲ型PKS(图3)。其中,Ⅰ 型PKS包括Ⅰ型细菌PKS(BPKS-Ⅰ)和大多数真菌PKS(FPKS),BPKS-I是由多个模块组成的蛋白,每个模块包含1组结构域,在聚酮化合物链组装过程中,每组结构域仅行使1次功能,所以BPKS-I也可以称为模块化I型PKS。大多数FPKS仅为1个模块,模块内的结构域被重复使用以催化多轮反应,因此也被称为迭代I型PKS[24]。Ⅱ 型PKS是多功能酶复合体,由几个物理上离散的催化单元组成,只包含一套可重复使用的结构域,主要用于合成芳香族聚酮化合物[25]。Ⅲ 型PKS也称查尔酮型聚酮合酶,本质上与 Ⅰ 型PKS和 Ⅱ 型PKS的酮合酶(KS)结构域等效,迭代地合成具有各种链长的产物[26]。尽管3种PKS的结构与催化功能不同,但它们都利用KS诱导酰基-CoA产生的碳负离子在酰基硫脂上的进攻,以形成C—C键。除了聚酮合酶外,硫酯酶也可以迭代地催化非脱羧缩合反应,以产生聚酮骨架,故被认为是合成聚酮化合物的新途径[27]。

a-模块化I型PKS;b-迭代I型PKS;c-II型PKS;d-III型PKS
图3 四种聚酮合酶的基本结构
Fig.3 Basic structures of four polyketide synthases
3.1 I型PKS
3.1.1 模块化I型PKS
模块化I型PKS是一个拥有多个模块的巨型多功能多肽,它以结构域的形式参与聚酮化合物碳链的延伸。每个模块中的结构域均呈线性排列,按顺序催化单轮延伸和全部或部分还原,其结构如图3-a所示。它包括了KS、AT、脱水酶(dehydratase,DH)、甲基转移酶(methyltransferase,MT)、ER、KR、ACP和环化酶(cyclase,CYC)等结构域[28]。其中KS,AT和ACP可构成最小的模块。目前研究最透彻的模块化PKS是DEBS。DEBS是一个大小为1 039 kDa的酶复合物,它的6个模块由3个大的多肽DEBS1,DEBS2和DEBS3组成,每个多肽由2个模块组成[29]。红霉素的合成途径如图4所示,第一个模块前面是AT和ACP域,最后一个模块后面是一个TE域。AT负责将结构单元从酰基-CoA前体转移到ACP;KS负责链的延长;KR负责β酮的还原;DH负责脱去一分子水;ER负责还原不饱和键;最后由TE释放6-脱氧-红霉内酯B(6-deoxy-erythronolide B,6DEB)并经过一系列修饰作用,形成产品红霉素A[28]。
3.1.2 迭代I型PKS
与模块化I型PKS不同的是,迭代I型PKS只有一个在链合成过程中重复使用的模块。其结构如图3-b所示,在聚酮化合物合成途径中,当一个反应结束时,中间产物不转移到下一模块而是在同一模块上继续进行链的延长,直至获得终产物。多数真菌聚酮化合物如洛伐他汀,是由单个迭代PKS合成[30],但部分聚酮化合物如10,11-dehydrocurvularin需要2个协作的迭代PKS。如图5所示,hrPKS先合成线性聚酮化合物链,再通过起始单元起始酰基转移酶转移到nrPKS上进一步延伸,再由nrPKS提供的产物模板PT结构域进行C3-C8上的醇醛缩合,最终由TE进行产物释放[31]。
3.2 II型PKS
II型PKS是一个多酶复合体,由几个离散的可分离的蛋白质构成,也被称作芳香PKS,通过一套可重复使用的结构域在反应中多次催化同一性质的化学反应。其基本结构如图3-c所示。
BISANG等[32]发现,II型PKS主要由3个基本亚基构成,即KSα、KSβ以及ACP。尽管缺乏I型PKS系统中的AT结构域,但仍具有酰基转移酶活性。其中,KSα与KSβ的结构非常相似,区别仅在于其高度保守的活性中心上的氨基酸有所不同,这种细微的不同使得KSβ无法催化Claisen型C—C键的形成,但KSβ在合成过程中同样起到重要作用。MCDANIEL等[33]在CH999系统中进一步设计生物合成新型聚酮化合物的过程中,通过对结构域的部分组合发现,KSβ部分决定了产物链的长度,所以KSβ也被称为链长因子(chain length factor,CLF),而KSα起到实际的酮合酶作用。如图6所示,II型PKS催化链的延长主要以丙二酰CoA为底物,每轮脱羧缩合反应后,聚酮化合物链会增加2个碳单元,最后经KR,芳香酶(aromatases,ARO)以及CYC形成芳香族聚酮化合物。形成芳香族聚酮化合物后仍然需要通过后PKS酶(如加氧酶、糖基转移酶、甲基转移酶)进行进一步修饰,以产生最终产物[34](图7)。和I型PKS相比较,Ⅱ型PKS在起始单位和延长单位的选择方面变化不大,所以它的结构多样性主要来自于后PKS酶的修饰。

图4 红霉素合成途径
Fig.4 Synthesis pathway of erythromycin

图5 10,11-dehydrocurvularin合成途径
Fig.5 Synthesis pathway of 10,11-dehydrocurvularin
3.3 III型PKS
III型PKS,也称查尔酮型聚酮合酶,具有最简单的结构。如图3-d所示,其基本结构与其他2种PKS系统不同,III型PKS是单蛋白系统,没有结构域或模块。在其催化途径中,III型PKS不需要酰基载体蛋白ACP来活化酰基CoA,而是直接作用于游离的酰基-CoA[25]。1999年,日本学者发现了来自灰色链球菌(Streptomyces griseus)的RppA,后这种酶被称为III型PKS。它是一种酮二聚体,并可重复进行缩合反应。如图8所示,其合成途径是以丙二酰CoA作为起始物和底物,再由5分子的丙二酰CoA发生脱羧环化形成1,3,6,8-四羟基萘(1,3,6,8-tetrahydroxynaphthalene,THN)[35]。
通过对紫花苜蓿(M.sativa)CHS2的晶体结构解析[36],发现4个保守的残基Cys164,Phe215,His303和Asn336起到催化作用。其中Cys164是聚酮链形成过程中的亲核活性位点,His303和Asn336在丙二酰-CoA的脱羧反应中起重要作用,而Phe215可能在聚合酮链延伸过程中起了底物导向作用。这4个氨基酸残基在所有发现的III型PKS中均保守,对III型PKS催化机制的揭示起到重要作用。

图6 II型PKS催化过程
Fig.6 Catalytic process of type II PKS

图7 II型PKS反应模型
Fig.7 Catalytic model of type II PKS
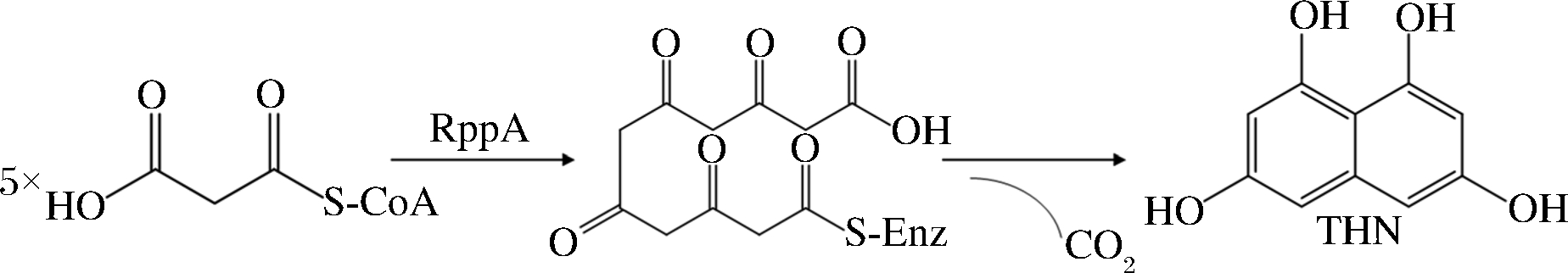
图8 RppA途径
Fig.8 Catalytic pathway of RppA
3.4 硫酯酶
一些TE被认为具有催化聚酮化合物合成的能力,于是也被称为聚酮酰-CoA硫酯酶(polyketoacyl-CoA thiolases,PKTs),它们可以通过重复催化非脱羧Claisen缩合反应形成聚酮化合物(图9)。TAN等[27]采用了5种非直接发酵途径,尝试通过β-酮硫酶(β-ketothiolase,BktB)基于PKT的途径产生三乙酸内酯(triacetate lactone,TAL)。结果表明,基于BktB的途径是一种与PKS无关的合成TAL的新途径,且含有BktB的工程菌JC01产生的TAL比使用III型PKS时的滴定度高7倍。与PKS催化途径相比,PKT途径简化了所需的结构域和催化步骤。此外,基于PKT的合成途径由于利用乙酰辅酶A作为延长单位,其通量远远高于丙二酰辅酶A延长单位,并可以有效避免与必需代谢途径竞争,实现了更高的ATP效率。
从结构上分析,TAN等[27]进一步发现BktB含有一个Cys90/His350/Cys380催化三联体,其催化的缩合反应依据两步乒乓机制,先由His350通过亲核攻击激活Cys90,使得Cys90攻击乙酰乙酰-CoA形成共价乙酰乙酰-酶中间体。再由Cys380对乙酰-CoA的α-碳进行去质子化,最后亲核攻击乙酰乙酰-酶中间体,形成3,5-二氧酰基-CoA。
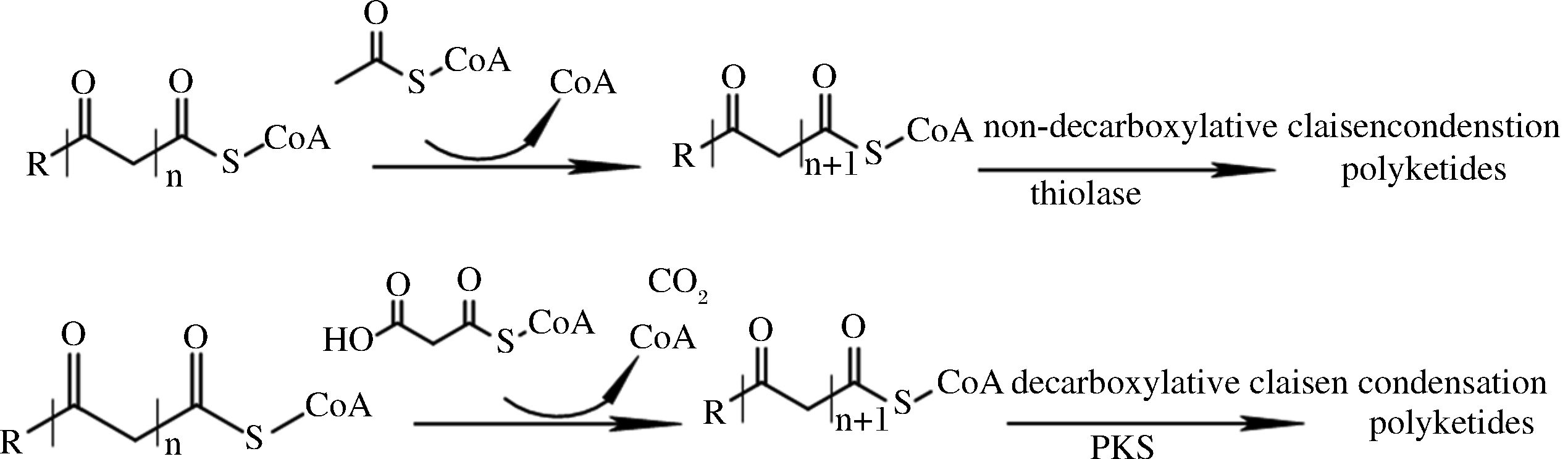
图9 硫酯酶与聚酮合酶催化合成聚酮化合物的途径对比
Fig.9 Comparison of catalytic synthesis of polyketide by thioesterase and polyketide synthase
4 聚酮类化合物的生物活性
聚酮类化合物因其具有独特的立体结构以及化学结构而具有广泛的生物活性和化学多样性,目前部分聚酮类化合物及其衍生物已经实现商业化应用。聚酮类化合物的生物活性包括抗菌、抗癌、抗氧化、抗寄生虫、抗炎症等活性[37]。该部分将结合国内外研究成果,对聚酮类化合物的生物活性进行概述。
4.1 抗菌活性
抗生素从被发现开始便因其抑菌作用而被广泛使用,到目前已有近百年的历史。但其过量使用也造成了大量耐药超级细菌的产生,严重危害了人类的健康。这迫使研究者不断寻找新型的抗生素,其中聚酮类化合物展现出了巨大潜力。
江宁宇等[38]从Actinomadura sp.FIM95-F26中分离出了芳香聚酮化合物95F26A(图10),并对其生物活性进行了研究,最终发现其具有较强的抗革兰氏阳性菌活性,对短小芽孢杆菌(Bacillus pumilus)以及金黄色葡萄球菌(Staphylococcus aureus)的最小抑菌浓度(minimum inhibitory concentration,MIC)值分别为0.031 2以及0.125 μg/mL。刘述春等[39]从一株毛壳属真菌(Chaetomium Kunze)分离出了聚酮类化合物毛豆素E(chaetomones E),并测得其对白色念珠菌(Monilia albican)的半数抑制浓度(IC50)值为20 μmol/L。刘凯[40]从中药材三七的土壤微生物中筛选出了拟康氏木霉(Trichoderma koningiopsis),并在其代谢产物得到了聚酮类化合物科尼格索普辛C(Koningiopsin C),通过抑菌实验测得其对黄瓜萎焉病菌(Plectosphaerella cucumerina)的MIC值可达到16 μg/mL,并显示出良好的广谱抗菌活性。NAKANO等[41]研究3-异丙烯基-环庚三烯酚酮(3-isopropenyl-tropolone)发现,它可以抑制某些致病菌荚膜多糖的生物合成从而达到抑菌作用,并验证了其对于金黄色葡萄球菌的抑制作用。SARWAR等[42]从Streptomyces A1RT中发现了一种聚酮类化合物伊沙托罗林C(isatropolone C),并通过实验证实了其对于马铃薯疮痂病链霉菌(Streptomyces scabies)具有抑制作用,因而可作为马铃薯疮痂病的一种生物防治策略。
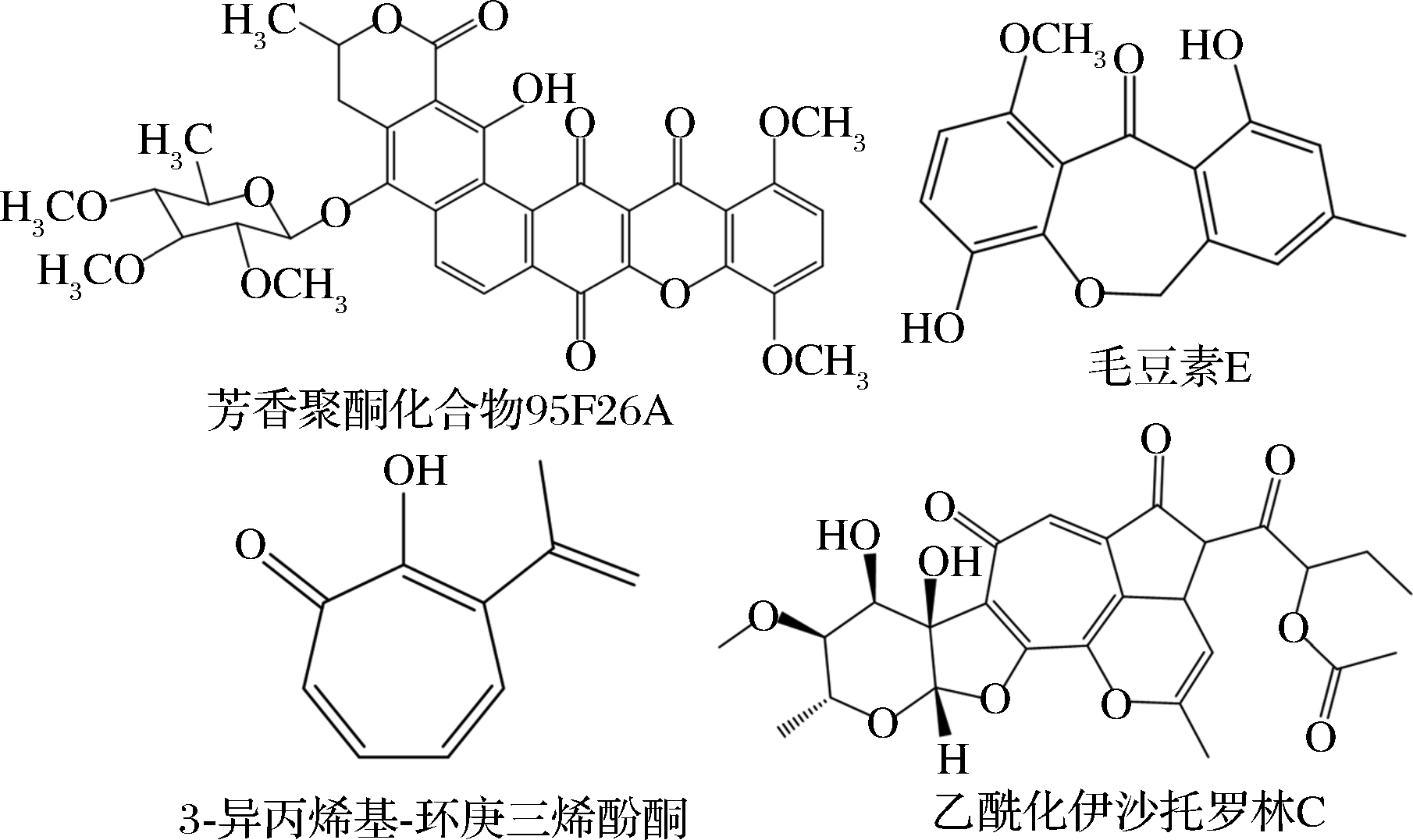
图10 四种具有抗菌活性的聚酮类化合物
Fig.10 Four polyketides with antibacterial activity
4.2 抗癌活性
癌症作为一种全球性疾病,已经成为世界人民健康的主要关注点。据调查每年都会有千万人患上癌症、因为癌症死亡。目前,治疗癌症主要方法有化疗和放疗,但其具有强烈的副作用,因此寻找作用温和有效的抗癌药物是目前抗癌研究的热点。聚酮类化合物由于其具有结构多样性以及丰富的生物活性,而成为抗癌药物研究的一个方向。
WILLIAMS等[43]从Salinispora arenicola中发现了聚酮类化合物沙林菌素A(arenicolides A),将其作用于人结肠癌HCT-116细胞后发现其对该癌细胞的IC50值达到30 mg/L(图11)。达里亚酰胺A-C(daryamides A-C)也是聚酮类化合物,它们是ASOLKAR等[44]从圣地亚哥海岸分离出的Streptomyces CNQ085中提取出的,其中daryamides A对HCT-116细胞具有中性的细胞毒性,其IC50值为3.15 μg/mL,因而有望作为抗癌药物使用。RATNAYAKE等[45]在澳大利亚微生物中检测到了一种罕见放线菌Kibdelosporangium MST-108465,其产生的杂环聚酮类化合物基布隆具有包括抗癌活性在内的多种生物活性。研究人员通过将基布隆与其他聚酮类化合物相比较,发现该类物质具有不同于F环芳构化或者额外缩醛环的抗癌机理,推测出该物质含有有效且具选择性的药效团,从而可能成为新一代抗癌药物。LI等[46]从真菌Lecanicillium antillanum的培养液中分离出了新型的非-β-烯酮化合物11-norbetaenone(11-降冰片烯酮),研究发现其具有较好的抗血管生成作用,因此可作为血管生成抑制剂而用于预防癌症转移。

图11 四种具有抗癌活性的聚酮类化合物
Fig.11 Four polyketides with anticancer activity
4.3 抗氧化活性
随着社会发展需要,抗衰药物成为研究的一大热潮,大量研究表明聚酮类化合物具有清除自由基和抗氧化的作用。韩鹏杰[47]等通过对菌株Emericella variecolor XSA-07-2进行诱变,筛选出了1种产新型聚酮类化合物的突变株,并通过采用DPPH法对聚酮类化合物进行分析研究,最终发现其中1种聚酮类化合物(化合物3,尚未命名)具有抗氧化活性,DPPH法测得其IC50值为13.58 μg/mL(图12)。
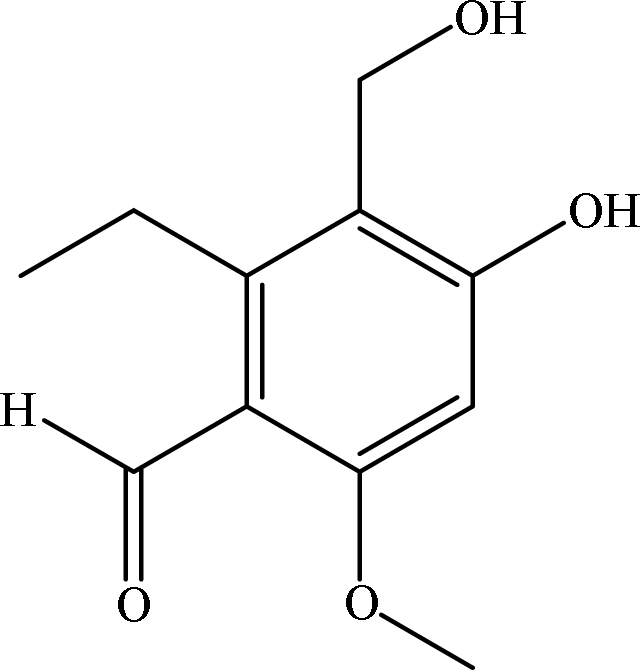
图12 Emericella variecolor XSA-07-2突变株产生的化合物3
Fig.12 Compound 3 produced by Emericella variecolor XSA-07-2 mutant
李杰[48]研究了蓝色丝膜菌(Cortinarius caerulescens)的次级代谢产物并采用DPPH清除法测定它们的抗氧化活性,最终得到了3种抗氧化活性较强的物质:芦氟霉素C(rufoolivacin C),芦氟霉素A(rufoolivacin A)以及氟哌啶醇(dirufoolivacin),测得的IC50值分别为8.63、7.50以及2.77 μg/mL(图13)。

图13 蓝色丝膜菌中产生的抗氧化性较强的3种物质
Fig.13 Three polyketides with strong antioxidant properties produced by Cortinarius caerulescens
4.4 抗寄生虫活性
寄生虫是一类对人体有害无益的寄生生物,它们掠夺人体营养物质、引起血管阻塞、引发炎症,严重影响人类正常生活,因此研发抗寄生虫药物对人体健康有重大意义。KOSSUGA等[49]研究了P.angulospiculatus产生的plakortide P的生物活性,发现在25 μg/mL 的浓度下可杀死100%的Leishmania chagasi前鞭毛体,IC50值为1.9 μg/mL,对克氏锥虫(Trypanosona cruzi)的IC50值为2.3 μg/mL,证明其对于部分寄生虫具有良好的抗性。海洋蓝藻产生的多种次级代谢产物如多肽、聚酮类化合物以及脂类往往具有抗菌、抗癌、免疫抑制剂等多种生物活性,MarinLitTM数据库中报道了近800种天然产物,但对抗寄生虫感染治疗方法的研究较少。SWEENEY-JONES等[50]对海洋蓝藻Moorea producens进行一系列冻干、提取,并进行真空液相色谱获得提取物,随后利用血期恶性疟原虫和肝期伯格氏疟原虫进行生物测定指导的分馏,经分离纯化得到了5种具有抗疟活性的天然产物(图14)。其中,化合物lynbyabellin A对血期恶性疟原虫Plasmodium falciparum的抑制效果最好,半最大效应浓度(EC50)达到了1.5 nmol/L,而化合物lyngbyaloside对肝期伯格氏疟原虫P.berghei具有更好的抑制效果,EC50值为4.5 μmol/L。

图14 斐济海洋蓝藻Moorea producens生产的天然产物
Fig.14 Natural products from the Fijian marine cyanobacterium Moorea producens
5 结论与展望
由于聚酮化合物所表现出的良好的生理活性,目前已广泛应用于农业,食品工业和医疗保健等领域,具有巨大的市场价值。本文综述了近年来已被发现的聚酮类化合物的结构及其生物活性,新的聚酮类化合物有待发掘。随着科学技术的不断发展,国内外对聚酮化合物的研究逐渐深入,人们对聚酮类化合物生物合成的分子机制的理解取得了重大进展,通过生物信息学鉴定出多种生物来源的PKS。根据其结构与作用机制的不同,大致将PKS分为三类,分别为I型PKS、II型PKS和III型PKS。通过对PKS晶体结构的分析,显著提升了人们对PKS生物合成机理的认识,也为研究者们对PKS进行合理的工程设计提供了思路,而目前采用各种改造技术诸如点突变、结构域交换、亚基交换也创造了不少新型聚酮类化合物,并在获得具有理想生物活性的聚酮类化合物中取得了不错的成果。
尽管目前对聚酮类化合物的研究取得了较大进展,但部分领域仍存在研究不足的问题。例如,非天然聚酮化合物的合成中,对I型PKS和III型PKS的研究较多,而对II型PKS改造的研究不足;此外,许多由PKS合成的聚酮类化合物在初期并不具有活性,通过后PKS酶修饰后才具有选择性和生物活性,这为组合生物合成新产物提供了机会;目前大多数研究的重点主要放在新型聚酮类化合物的合成上,对于现有的聚酮类化合物在临床上的应用较少,未来还需要更多大规模、精确、深入的临床研究加以验证。
[1] 刘卫兵, 叶邦策.放线菌聚酮类化合物的合成生物学研究及生物制造[J].化工进展, 2021, 40(3):1 226-1 237.
LIU W B, YE B C.Progress of synthetic biology research and biological manufacturing of actinomycetes polyketides[J].Chemical Industry and Engineering Progress, 2021, 40(3):1 226-1 237.
[2] 冯健飞, 周日成, 郭兴庭, 等.聚酮类化合物及其应用[J].现代农业科技, 2011(3):24-26.
FENG J F, ZHOU R C, GUO X T, et al.Polyketide and its application[J].Modern Agricultural Science and Technology, 2011(3):24-26.
[3] LIN Z J, PHADKE S, LU Z Y, et al.Onydecalins, fungal polyketides with anti-histoplasma and anti-TRP activity[J].Journal of Natural Products, 2018, 81(12):2 605-2 611.
[4] ZHANG Q, WU J, QIAN J, et al.Knocking out of tailoring genes eryK and eryG in an industrial erythromycin-producing strain of Saccharopolyspora erythraea leading to overproduction of erythromycin B, C and D at different conversion ratios[J].Letters in Applied Microbiology, 2011, 52(2):129-137.
[5] DUJOVNE C A.Red yeast rice preparations:Are they suitable substitutions for statins? [J].American Journal of Medicine, 2017, 130(10):1 148-1 150.
[6] KUROKAWA H, ITO H, MATSUI H.Monascus purpureus induced apoptosis on gastric cancer cell by scavenging mitochondrial reactive oxygen species[J].Journal of Clinical Biochemistry and Nutrition, 2017, 61(3):189-195.
[7] ISMAIL A, GONÇALVES B L, NEEFF D V, et al.Aflatoxin in foodstuffs:Occurrence and recent advances in decontamination[J].Food Research International, 2018, 113:74-85.
[8] 张禹, 王海荣.饲料中黄曲霉毒素的危害及脱毒方法进展[J].饲料研究, 2021(8):157-160.
ZHANG Y, WANG H R.The harm of aflatoxin in feed and the progress of detoxification methods[J].Feed Reasearch, 2021(8):157-160.
[9] ZHANG W J, AMES B D, TSAI S C, et al.Engineered biosynthesis of a novel amidated polyketide, using the malonamyl-specific initiation module from the oxytetracycline polyketide synthase[J].Applied and Environmental Microbiology, 2006, 72(4):2 573-2 580.
[10] YU L, CAO N, WANG L, et al.Oxytetracycline biosynthesis improvement in Streptomyces rimosus following duplication of minimal PKS genes[J].Enzyme and Microbial Technology, 2012, 50(6-7):318-324.
[11] YUZAWA S, BACKMAN T W H, KEASLING J D, et al.Synthetic biology of polyketide synthases[J].Journal of Industrial Microbiology & Biotechnology, 2018, 45(7):621-633.
[12] MASSICARD J M, SOLIGOT C, WEISSMAN K J, et al.Manipulating polyketide stereochemistry by exchange of polyketide synthase modules[J].Chemical Communications, 2020, 56(84):12 749-12 752.
[13] DONADIO S, MCALPINE J B, SHELDON P J, et al.An erythromycin analog produced by reprogramming of polyketide synthesis[J].Proceedings of the National Academy of Sciences of the United States of America, 1993, 90(15):7 119-7 123.
[14] BÖHM I, HOLZBAUR IE, HANEFELD U, et al.Engineering of a minimal modular polyketide synthase, and targeted alteration of the stereospecificity of polyketide chain extension[J].Chemistry & Biology, 1998, 5(8):407-412.
[15] OLIYNYK M, BROWN M J, CORTÉS J, et al.A hybrid modular polyketide synthase obtained by domain swapping[J].Chemistry & Biology, 1996, 3(10):833-839.
[16] RANGANATHAN A, TIMONEY M, BYCROFT M, et al.Knowledge-based design of bimodular and trimodular polyketide synthases based on domain and module swaps:A route to simple statin analogues[J].Chemistry & Biology, 1999, 6(10):731-741.
[17] ROWE C J, BÖHM I U, THOMAS I P, et al.Engineering a polyketide with a longer chain by insertion of an extra module into the erythromycin-producing polyketide synthase[J].Chemistry & Biology, 2001, 8(5):475-485.
[18] XU Y Q, ZHOU T, ZHANG S W, et al.Diversity-oriented combinatorial biosynthesis of benzenediol lactone scaffolds by subunit shuffling of fungal polyketide synthases[J].Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(34):12 354-12 359.
[19] WANG C, WANG X J, ZHANG L W, et al.Intrinsic and extrinsic programming of product chain length and release mode in fungal collaborating iterative polyketide synthases[J].Journal of the American Chemical Society, 2020, 142(40):17 093-17 104.
[20] KORYAKINA I, KASEY C, MCARTHUR J B, et al.Inversion of extender unit selectivity in the erythromycin polyketide synthase by acyltransferase domain engineering[J].ACS Chemical Biology, 2017, 12(1):114-123.
[21] JEZ J M, BOWMAN M E, NOEL J P.Structure-guided programming of polyketide chain-length determination in chalcone synthase[J].Biochemistry, 2001, 40(49):14 829-14 838.
[22] JEZ J M, BOWMAN M E, NOEL J P.Expanding the biosynthetic repertoire of plant type III polyketide synthases by altering starter molecule specificity[J].Proceedings of the National Academy of Sciences of the United States of America, 2002, 99(8):5 319-5 324.
[23] MORITA H, YAMASHITA M, SHI S P, et al.Synthesis of unnatural alkaloid scaffolds by exploiting plant polyketide synthase[J].Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(33):13 504-13 509.
[24] ZHU X C, JUSTIN H, RYAN G, et al.Biosynthesis and Genetic Engineering of Polyketides[J].Acta Botanica Yunnanica, 2008, 30(3):249-278.
[25] 孙宇辉, 邓子新.聚酮化合物及其组合生物合成[J].中国抗生素杂志, 2006, 31(1):6-14;18.
SUN Y H, DENG Z X.Polyketides and combinatorial biosynthetic approaches[J].Chinese Journal of Antibiotics, 2006, 31(1):6-14;18.
[26] KORNFUEHRER T, EUST QUIO A S.Diversification of polyketide structures via synthase engineering[J].Croyal Society of Chemistry, 2019, 10(8):1 256-1 272.
QUIO A S.Diversification of polyketide structures via synthase engineering[J].Croyal Society of Chemistry, 2019, 10(8):1 256-1 272.
[27] TAN Z G, CLOMBURG J M, CHEONG S, et al.A polyketoacyl-CoA thiolase-dependent pathway for the synthesis of polyketide backbones[J].Nature Catalysis, 2020, 3(7):593-603.
[28] TANG Y, CANE D E, KHOSLA C, et al.Structure and mechanism of the 6-deoxyerythronolide B synthase[J].Annual Review of Biochemistry, 2007, 76:195-221.
[29] ZHANG C B, KE D, DUAN Y J, et al.The combinatorial biosynthesis of “unnatural” products with polyketides[J].Transactions of Tianjin University, 2018, 24(6):501-512.
[30] 贾晓迪,李力.真菌聚酮合酶及相关化合物的应用[J].精细与专用化学品, 2020, 28(5):6-10.
JIA X D, LI L.Fungal polyketide synthase and application of related compounds[J].Fine and Specialty Chemicals, 2020, 28(5):6-10.
[31] XU Y Q, PATRICIA E A, SCHUBERT V, et al.Characterization of the biosynthetic genes for 10,11-dehydrocurvularin, a heat shock response-modulating anticancer fungal polyketide from Aspergillus terreus[J].Applied Microbiology and Biotechnology, 2013, 79(6):2 038-2 047.
[32] BISANG C, LONG P F, CORTÉS J, et al.A chain initiation factor common to both modular and aromatic polyketide synthases[J].Nature, 1999, 401(6752):502-505.
[33] MCDANIEL R, EBERT K S, HOPWOOD D A, et al.Rational design of aromatic polyketide natural products by recombinant assembly of enzymatic subunits[J].Nature, 1995, 375:549-554.
[34] HERTWECK C, LUZHETSKYY A, REBETS Y, et al.Type II polyketide synthases:Gaining a deeper insight into enzymatic teamwork[J].Natural product reports, 2001, 18(4):380-416.
[35] FUNA N, OHNISHI Y, FUJII I, et al.A new pathway for polyketide synthesis in microorganisms[J].Nature, 1999, 400(6 747):897-899.
[36] FERRER J L, JEZ J M, BOWMAN M E, et al.Structure of chalcone synthase and the molecular basis of plant polyketide biosynthesis[J].Nature structural biology, 1999, 6(8):775-784.
[37] 李济森, 李新汉, 段文文, 等.Claisen-Schmidt反应合成的查耳酮类化合物及其生物活性研究进展[J].云南民族大学学报(自然科学版), 2019, 28(5):444-451.
LI J S, LI X H, DUAN W W, et al.Research progress on bioactivities and chalcone derivatives synthesized by Claisen-Schmidt reaction[J].Journal of Henan University(natural science), 2019, 28(5):444-451.
[38] 江宁宇, 彭飞, 方志锴, 等.海洋来源马杜拉放线菌FIM95-F26产生的芳香聚酮类抗菌活性代谢产物的研究[J].中国抗生素杂志, 2015, 40(3):161-165.
JIANG N Y, PENG F, FANG Z K, et al.Study on aromatic polyketide metabolite with antibacterial activity from the marine-derived Actinomadura sp.FIM95-F26[J].Chinese Journal of Antibiotics, 2015, 40(3):161-165.
[39] 刘述春, 孙炳达, 旺姆, 等.一株毛壳霉属真菌中新结构活性聚酮类化合物研究[J].菌物学报, 2010, 29(5):726-731.
LIU S C, SUN B D, WANG M, et al.Chaetomones A-E, new bioactive polyketides from Chaetomium sp.[J].Mycosystema, 2010, 29(5):726-731.
[40] 刘凯. 三七源的两株真菌次生代谢产物及其生物活性研究[D].昆明:云南大学, 2015.
LIU K.Investigation on the secondary metabolites and their bioactivities of two fungi associated with Panax notoginseng[D].Kunming: Yunnan University, 2015.
[41] NAKANO K, CHIGIRA T, MIYAFUS T, et al.Discovery and characterization of natural tropolones as inhibitors of the antibacterial target CapF from Staphylococcus aureus[J].Scientific Reports, 2015, 5:15 337-15 346.
[42] SARWAR A, LATIF Z, ZHANG S Y, et al.Biological control of potato common Scab with rare isatropolone C compound produced by plant growth promoting Streptomyces A1RT[J].Frontiers in Microbiology, 2018, 9:1 126-1 135.
[43] WILLIAMS P G, MILLER E D, ASOLKAR R N, et al.Arenicolides A-C, 26-membered ring macrolides from the marine actinomycete Salinispora arenicola[J].The Journal of Organic Chemistry, 2007, 72(14):5 025-5 034.
[44] ASOLKAR R N, JENSEN P R, KAUFFMAN C A, et al.Daryamides A-C, weakly cytotoxic polyketides from a marine-derived actinomycete of the genus Streptomyces strain CNQ-085[J].Journal of Natural Products, 2006, 69(12):1 756-1 759.
[45] RATNAYAKE R, LACEY E, TENNANT S, et al.Kibdelones:Novel anticancer polyketides from a rare Australian actinomycete[J].Chemistry, 2007, 13(5):1 610-1 619.
[46] LI C Y, LO I W, WANG S W, et al.Novel 11-norbetaenone isolated from an entomopathogenic fungus Lecanicillium antillanum[J].Bioorganic and Medicinal Chemistry Letters, 2017, 27(9):1 978-1 982.
[47] 韩鹏杰, 龙海林, 刘东, 等.海绵共生真菌Emericella variecolor XSA-07-2化学诱变突变株中的新颖聚酮类化合物[J].中国药学杂志, 2019, 54(15):1 221-1 225.
HAN P J, LONG H L, LIU D, et al.New polyketides from chemical mutant strain of sponge-associated fungus Emericella variecolor XSA-07-2[J].Chinese Pharmaceutical Journal, 2019, 54(15):1 221-1 225.
[48] 李杰. 蓝色丝膜菌次生代谢产物及体外抗氧化活性研究[D].长春:吉林大学, 2019.
LI J.Study on secondary metabolites and in vitro antioxidant activity of Cortinarius caerulescens (Schaeff.) Fr.[D].Changchun:Jilin University, 2019.
[49] KOSSUGA M H, NASCIMENTO A M, REIM O J Q, et al.Antiparasitic, antineuroinflammatory, and cytotoxic polyketides from the marine sponge Plakortis angulospiculatus collected in Brazil[J].Journal of Natural Products, 2008, 71(3):334-339.
O J Q, et al.Antiparasitic, antineuroinflammatory, and cytotoxic polyketides from the marine sponge Plakortis angulospiculatus collected in Brazil[J].Journal of Natural Products, 2008, 71(3):334-339.
[50] SWEENEY-JONES A M, GAGARING K, ANTONOVA-KOCH J, et al.Antimalarial peptide and polyketide natural products from the Fijian marine cyanobacterium Moorea producens[J].Marine Drugs, 2020, 18(3):167-180.