竹筒酒是一种中国传统含酒精饮料,已有1 800余年的饮用历史,在傣族、客家族及土家族等少数民族聚居区尤其受欢迎[1]。近年来,竹筒酒消费群体日益扩大,已形成了一定的市场规模。其制作工艺是将基酒(白酒)注入活竹竹腔内,经过一段时间的陈酿,基酒的化学成分、颜色、口感和香气等均发生显著变化。通常成酒色如琥珀,自带竹香,口感清甜[1]。研究表明,富含多种矿质元素是竹筒酒突出的特征之一[2]。
酒中的矿质元素主要来源于酿酒原料及各个环节的引入,矿质元素种类及其含量不仅直接影响酒的颜色、口感等酒质特征,还与酒的功效和营养密切相关[3-7]。白酒中金属离子主要来自于贮酒器和加浆水,可作为乙醇代谢酶的活性中心和酶的激活剂,参与乙醇在人体的代谢过程;还会与醇、醛、酮、酸、酯等化合物结合形成大分子基团,改变酒的风味和口感等特征[3]。K离子能够增加酒的甜醇感,Cu离子则能去除新酒气,而Na、Zn、Fe、Mg等对酒的口感有不良影响[4]。发酵或陈酿过程,也影响酒中矿质元素含量。叶萌祺等[8]发现,苹果酒发酵过程中矿质元素含量波动较大。陶勇等[9]研究了剑南春不同窖龄窖泥的矿质元素含量变化,发现Cu含量随窖龄增加缓慢下降,其他元素变化不显著。姜忠军[10]研究发现白兰地陈酿过程中K元素含量差别最大,可用K元素作为描述不同陈酿年份白兰地特征的典型指标。
陈晨等[2]采集市售竹筒酒样品,检测发现竹筒酒含有丰富的矿质元素,K元素含量高达222.40~968.99 mg/L,并通过实验初步证实了竹筒酒中的K元素来源于竹秆。但是,竹筒酒中其他矿质元素是来源于竹秆还是基酒?陈酿过程中,竹秆与基酒中矿质元素如何变化?存在什么样的交换规律以及竹叶黄酮是否影响矿质元素的交换等问题,目前尚不清楚。
因此,本文参照典型竹筒酒生产方法,研究陈酿过程中,K、Ca、Na、Mg、Mn、Fe、Cu、Zn、Al、Se、Ni、As、Pb、Cd、Cr、Mo、Co 17种矿质元素在竹秆与基酒中的交换规律;通过添加外源黄酮,研究竹叶黄酮对竹秆与基酒中矿质元素转移的影响,以期为制定竹筒酒标准生产规程及产品标准提供依据。
1 材料与方法
1.1 材料、试剂与仪器
竹叶黄酮提取物,总黄酮含量为17.61%(质量分数),国际竹藤中心竹藤资源化学利用研究所提供;白酒,52%vol,四川不老谭酒业有限公司。
HNO3(优级纯),中国医药集团有限公司;实验用水(18.2 MΩ·cm),实验室超纯水仪制备;Ca、Cr、Cd、Co、Mg、Mn、Mo、Na、Ni、Pb、As、Fe、Cu、Se(1 000 μg/mL),国家有色金属及电子材料分析测试中心;K、Al(1 000 μg/mL),国家钢铁材料测试中心钢铁研究总院;Zn(1 000 μg/mL),中国计量科学研究院。
岛津ICP-MS 2030电感耦合等离子体质谱仪,日本岛津公司;普析TAS990原子吸收分光光度计,北京普析通用仪器有限责任公司;ETHOS UP微波消解仪,意大利Milestone公司;Cascada AN 实验室超纯水系统,美国Pall公司。
1.2 陈酿实验
试验地设在安徽省黄山市太平湖竹园(118.037 25°N,30.355 35°E)。选择自然生长环境条件基本一致的毛竹(竹龄1~3年),每根毛竹在距地表水平高度1.5 m内,间隔选取3个竹节,采用直径为2 mm的钻头,在竹节处斜向下45°开孔,向竹腔内注入100 mL基酒,采用热熔枪密封。
添加外源黄酮的处理,准确称取一定量的竹叶黄酮提取物,精确至0.000 1 g,添加入白酒中,配制成终质量浓度为2.5、5、10 mg/mL的基酒。其他处理同上。
分别陈酿0、3、7、10、14、21、28、35 d后,在注酒竹腔下部竹节上1 cm处开孔,用50 mL注射器取样,待检测。每个处理重复3次。
1.3 矿质元素检测
采用电感耦合等离子体质谱法,各元素的前处理及检测参数见表1。
表1 各元素前处理方法及仪器条件
Table 1 Pre-treatment methods and instrument conditions for the determination of 17 elements

元素前处理仪器条件K取1 mL样品,用1%硝酸稀释100倍。检测器:火焰原子化器;波长:766.5 nm;光谱带宽:2.0 nm;灯电流:2 mA;滤波系数:1.0;燃气流量:1.8 L/minCa取1 mL样品,用1%硝酸稀释10倍,再加入20 g/L氧化镧溶液0.5 mL。检测器:火焰原子化器;波长:422.7 nm;光谱带宽:0.4 nm;灯电流:3 mA;滤波系数:0.6;燃气流量:2.0 L/minNa取1 mL样品,用1%硝酸稀释10倍。检测器:火焰原子化器;波长:589.0 nm;光谱带宽:0.4 nm;灯电流:6 mA;滤波系数:0.6;燃气流量:1.3 L/minMg、Mn、Fe、Cu、Zn、Al、Se、Ni、As、Pb、Cd、Cr、Mo、Co取1 mL样品,用1%硝酸稀释10倍。射频功率:1 200 W;载气流量:0.7 L/min;等离子体气流量:8.0 L/min;雾化室温度:5 ℃;分析模式:碰撞反应池
1.4 结果计算与数据分析
将检测得到的结果代入标准曲线(表2),计算矿质元素含量,结果以均值±标准差表示。实验原始数
表2 17种矿质元素的标准曲线及检测限
Table 2 Regression equations and detection limits for 17 mineral elements

元素回归方程线性范围/(μg·L-1)相关系数R检测限/(μg·L-1)定量限/(μg·L-1)19Ky=2.61x-52.480~1 0000.998 46.78622.61920Cay=47.46x-103.710~1 0000.999 327.38991.29611Nay=2.03x-286.150~1 0000.998 834.632115.44012Mgy=4.06x-8.790~1 0000.999 82.4478.15725Mny=0.20x+3.200~1 0000.999 90.2660.88626Fey=0.17x-13.480~1 0000.999 714.71449.04729Cuy=0.10x+15.870~1 0000.999 40.1700.56630Zny=0.53x-25.730~1 0000.998 61.1853.95113Aly=10.64x-14.080~1 0000.999 85.15017.16734Sey=5.35x-0.130~100.999 70.0330.10928Niy=0.09x-0.160~100.999 70.1220.40733Asy=0.60x-0.020~100.999 90.0340.11382Pby=0.04x+0.030~100.999 60.0660.21948Cdy=0.27x-0.080~100.999 60.0040.01224Cry=0.12x-0.010~100.999 90.0130.06942Moy=0.10x-0.450~1000.999 90.0330.11027Coy=0.08x-0.720~1000.999 80.0030.010
据应用Microsoft Excel 2013进行处理,利用SPSS 22.0进行显著性差异分析,Origin 2018绘图。
2 结果与分析
2.1 基酒中矿质元素检测结果
检测表明,基酒中含有一定量的矿质元素,其中Na和Ca含量最多,分别为37.79 mg/L和32.49 mg/L;其次为Mn,含量为7.40 mg/L;Zn、Mn、Cu、Al的含量介于64.57~287.00 μg/L;Cr、As、Ni、Se、Cd含量介于0.98~6.70 μg/L;K、Fe、Pb、Mo和Co含量低于检测限(表3)。值得注意的是,Al、As、Pb和Cd对人体有潜在毒性,除Pb未检出外,其余3种均有检出,其中Al的含量最高,达64.57 μg/L,但均满足GB 2762—2017《食品安全国家标准 食品中污染物限量》、GB 2760—2014《食品安全国家标准 食品添加剂使用标准》和世界卫生组织关于食品添加剂和污染物的限量要求[11]。
2.2 竹筒酒陈酿过程中矿质元素变化规律
2.2.1 常量元素变化规律
陈酿过程显著影响竹筒酒中常量元素的含量,K元素含量变化最大。陈酿初期,竹筒酒中K的含量呈指数型增长(表4),14 d时达到峰值,含量为330.83 mg/L。随后逐渐降低,28 d后趋于平衡,含量稳定在190 mg/L左右(图1)。Ca、Na的含量逐渐降低,其变化符合一级动力学方程(表4),半衰期分别为26.05、9.40 d,21 d后,含量趋于稳定,Ca的含量由32.49 mg/L降至18.16 mg/L,Na的含量由37.79 mg/L降至10.84 mg/L。Mg的含量总体变化不大,基酒注入竹腔3 d后略有升高,14 d后达到最高,为10.60 mg/L,随后缓慢下降,28 d后趋于平衡,35 d时含量为6.56 mg/L。毛竹秆中富含K元素,1~5年生毛竹竹秆中K的平均含量为2.54 mg/g[12],远高于基酒中K的浓度,并且在陈酿初期,基酒中乙醇含量较高,提高了细胞膜的通透性,使竹秆中K迅速渗入酒中。经气相色谱-质谱联用法测定,14 d后,竹筒酒中乙醇含量逐渐降低,并稳定在10%vol左右,对细胞膜的通透性影响较小,因此酒中K的含量也逐渐降低,趋于相对稳定。
表3 基酒中的矿质元素含量
Table 3 Mineral element content in base liquor
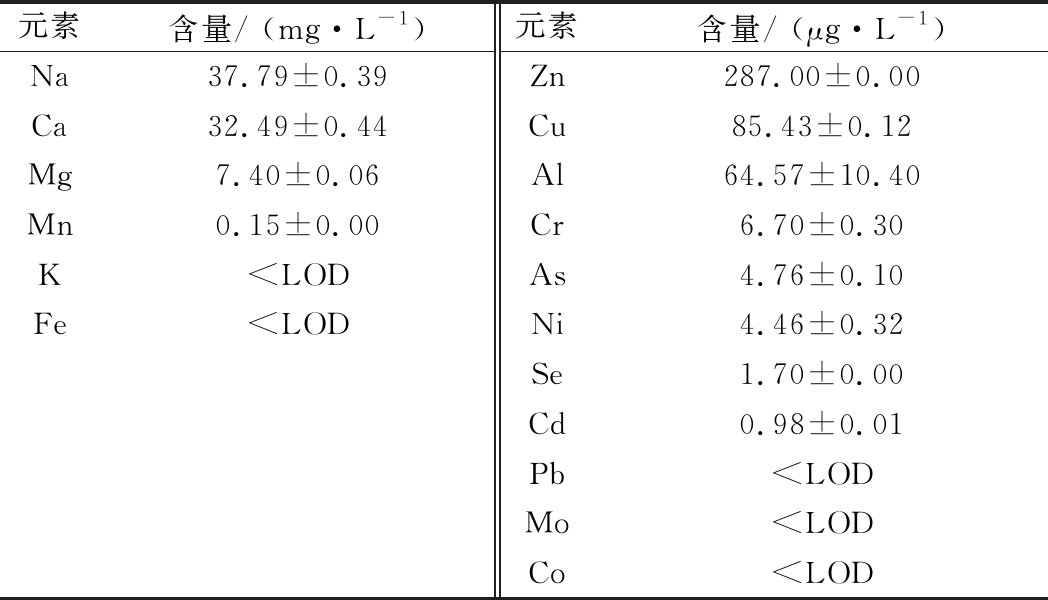
元素含量/ (mg·L-1)元素含量/ (μg·L-1)Na37.79±0.39Zn287.00±0.00Ca32.49±0.44Cu85.43±0.12Mg7.40±0.06Al64.57±10.40Mn0.15±0.00Cr6.70±0.30K
2.2.2 微量元素变化规律
微量元素含量在陈酿过程具有不同程度的变化。Mn的含量在10 d内快速增加,10 d时达到最高,为2.96 mg/L,随后缓慢下降,35 d时含量为1.36 mg/L。Cu的含量在陈酿初期变化剧烈,3 d内迅速升高并在第3天达到峰值,由85.43 μg/L升至178.67 μg/L,3~7 d保持在稳定水平,7~10 d大幅下降,14 d后趋于平衡,含量达到陈酿前相同水平。Zn和Ni的含量在7~35 d期间的变化规律相似,均在第14天达到谷值,Zn的含量为54.95 μg/L,Ni的含量为2.86 μg/L,14~28 d略有上升,28~35 d又大幅下降,到35 d还未达到平衡。与陈酿前比,Ni元素含量下降了60%,Zn元素含量的降幅高达90%。研究表明,Zn2+的添加使得酒的口味欠老练、单、涩,对酒质不利[4],因此Zn元素在竹筒酒陈酿期间的含量下降对酒质提升有一定的贡献。Cr的含量逐渐降低,其变化符合一级动力学方程(表4),半衰期为9.59 d,14 d后含量趋于稳定,含量由6.70 μg/L降至2.11 μg/L。Fe元素仅在第3和第7天有检出,Se在陈酿过程中均未检出,Mo、Co在基酒和陈酿全过程均未检出。
表4 Ca、Na、Cr、As、K元素的动力学方程
Table 4 Kinetic equations for Ca, Na, Cr, As and K elements

元素拟合方程相关系数Rt1/2/dCay = 14.23×exp(-x/8.81)+18.160.991 826.05Nay = 27.60×exp(-x/8.04)+10.330.997 49.40Cry = 5.22×exp(-x/5.98)+2.300.941 99.59Asy = 3.55×exp(-x/9.63)+1.370.977 711.92Ky=-400.54×exp(-x/7.75)+400.51(0~14 d)0.998 6-y = 512.14×exp(-x/13.53)+149.02(14~35 d)0.997 5-
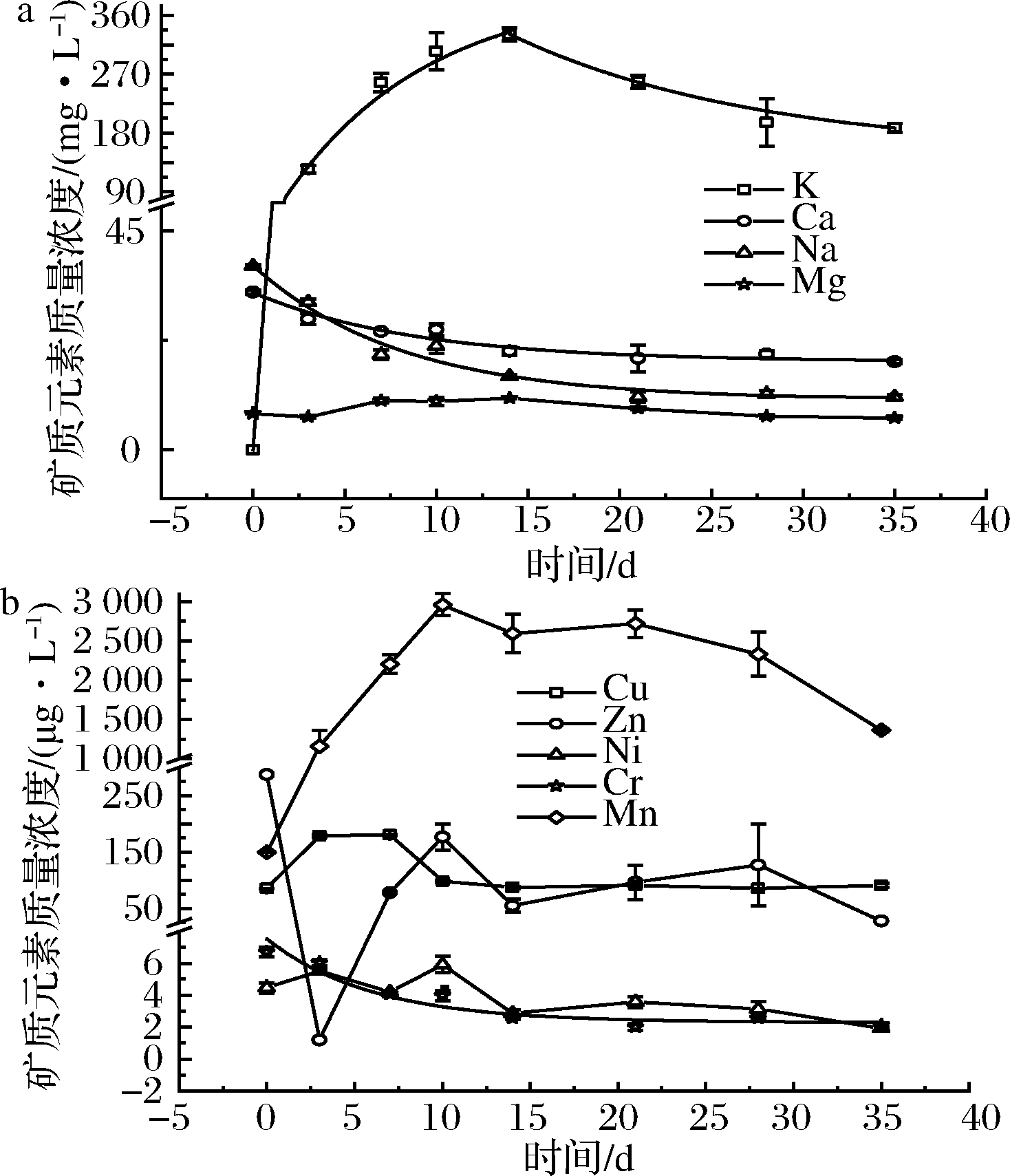
a-常量元素;b-微量元素
图1 竹筒酒中有益元素含量随时间变化
Fig.1 Dynamics of the content of beneficial elements in bamboo liquor over time
2.2.3 有害元素变化规律
Al、As、Pb和Cd对人体有潜在毒性,其在竹筒酒中的含量受陈酿时间的影响表现不同。如图2所示,Pb、Cd元素含量在陈酿初期迅速上升,Pb在7 d时达到峰值,为6.82 μg/L,Cd的含量在10 d时达到2.32 μg/L,随后二者缓慢下降,35 d时均降到0.50 μg/L以下,远低于食品安全国家标准及联合国粮农组织与世界卫生组织关于有毒重金属的限量标准。Al和As元素的含量随着陈酿时间的延长而不断降低,Al元素在2周后不再检出,这对酒质的提升有益,因为Al离子会使酒的口感单、涩[4]。As元素含量的变化规律符合一级动力学反应(表4),且在12 d左右下降至初始含量的一半,35 d时降至2 μg/L以下,远低于国家标准。
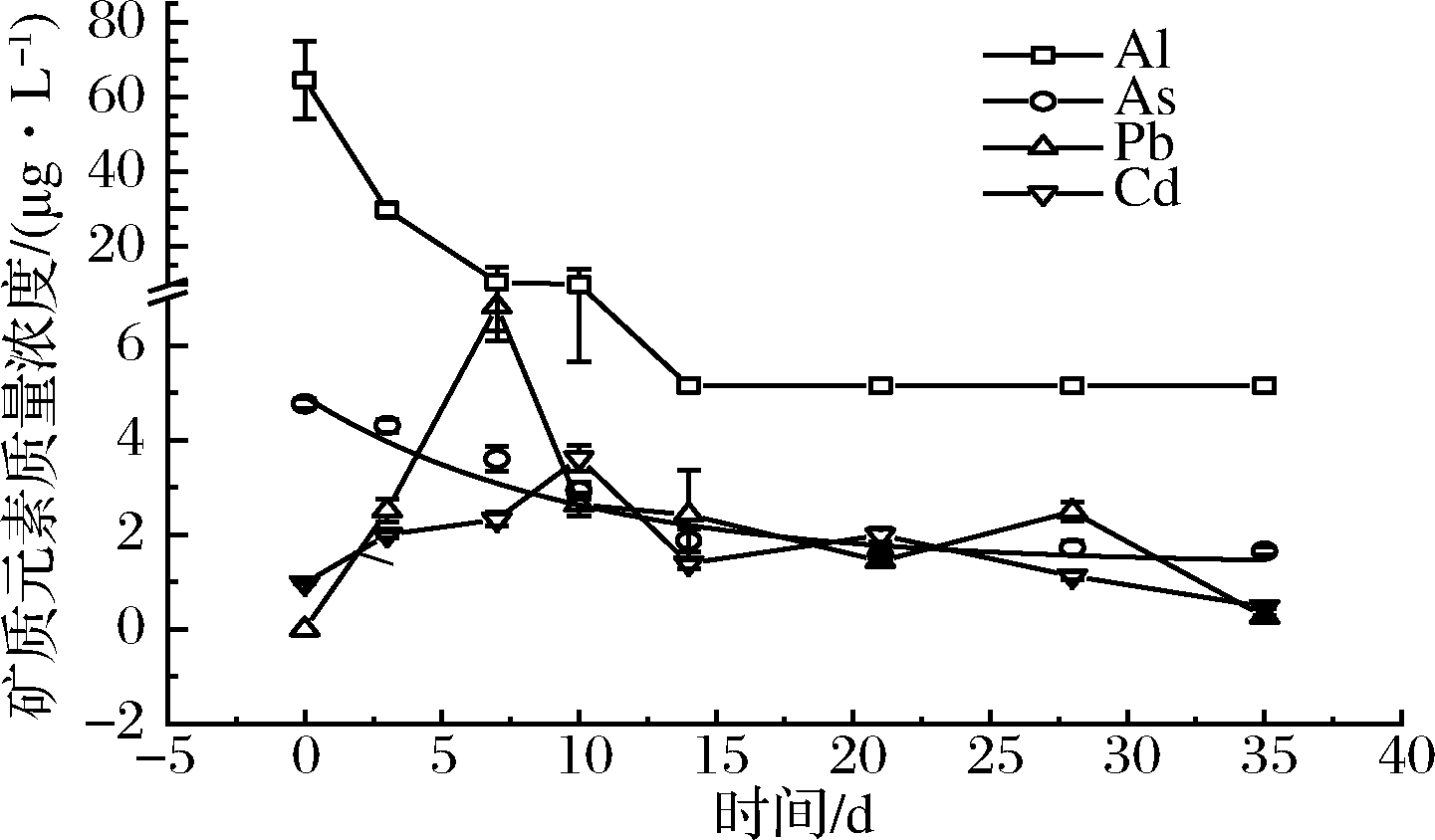
图2 竹筒酒中有害元素含量随时间变化
Fig.2 Dynamics of the content of harmful elements in bamboo liquor over time
2.3 外源黄酮对竹筒酒中矿质元素变化的影响
外源黄酮提取物中含有一定量Ca、Na、Ni、As等元素,随着添加直接进入基酒中,提高了基酒中相应矿质元素的初始含量。添加后,黄酮基酒中Ca元素含量为32.49~112.45 mg/L,Na元素含量为33.06~47.58 mg/L,K元素含量为9.94~43.73 mg/L,Ni元素含量为4.89~8.99 μg/L,As元素含量为8.96~38.80 μg/L,基本与外源黄酮含量成比例增长。
2.3.1 外源黄酮对常量元素的影响
外源黄酮显著影响竹筒酒中常量元素的含量(图3、图4)。2.5 mg/mL外源黄酮处理,大幅提高了K含量的峰值,14 d时达到1 044.90 mg/L,是空白基酒组的3.16倍(图3-a);10 mg/mL外源黄酮处理,K含量上升速度最快,10 d时达到峰值,其他3组均在14 d达到峰值;21 d后,除10 mg/mL外源黄酮处理组外,另外3组的K含量都达到了平衡(图3-a),2.5 mg/mL外源黄酮处理组比另外3组的含量高出近1.5倍(P<0.05)(图4);35 d时,10 mg/mL外源黄酮处理组K元素含量最高,其次是2.5 mg/mL外源黄酮处理组。Ca的变化趋势在不同黄酮添加量下基本一致(图3-b),其含量高低与竹叶黄酮添加量具有一定关系,21 d时,2.5 mg/mL外源黄酮处理组Ca元素含量显著较低(P<0.05),比空白基酒组低近50%,比5、10 mg/mL外源黄酮处理组低1~2倍(图4)。Mg的变化趋势受不同黄酮添加量影响不大(图3-d),外源黄酮处理仅对其含量高低有所影响。21 d时,Mg在2.5 mg/mL外源黄酮处理下的含量是其他3组的1.5倍左右,21 d后,除2.5 mg/mL外源黄酮处理组外,其他3组Mg的含量基本达到平衡。

a-K;b-Ca;c-Na;d-Mg;e-Mn;f-Cu;g-Ni;h-As
图3 外源黄酮对矿质元素变化规律的影响
Fig.3 Effect of exogenous flavonoids on variation of mineral elements
黄酮类化合物可以通过环上的酚羟基和羰基与金属离子配位,形成相应的黄酮-金属离子螯合物[13-16]。Na元素的含量随着竹叶黄酮添加量的增加不断提高(图3-c),21 d时,10 mg/mL外源黄酮处理下的Na元素含量高达26.02 mg/L,是空白组的2倍以上(图4),推测随着黄酮添加量的增加,酒中Na+与黄酮化合物生成螯合物,浓度下降,使得竹秆中Na+更趋向于向酒中扩散,导致酒中的Na元素含量升高。

a-常量元素;b-微量元素
图4 竹筒酒中有益元素含量随黄酮添加量变化
Fig.4 Dynamics of the content of beneficial elements in bamboo liquor with flavonoid addition
2.3.2 外源黄酮对微量元素的影响
与常量元素相比,外源黄酮对微量元素影响较小。21 d时,Zn元素在2.5 mg/mL外源黄酮处理组的含量最高,为188.67 μg/L,比空白组高出1倍,比5、10 mg/mL外源黄酮处理组高出0.5倍左右。外源黄酮对Cu的变化趋势和含量基本没有影响,21 d时,2.5 mg/mL外源黄酮处理组的Cu的含量为105.00 μg/L,仅高于其他3组10%左右。Ni元素的变化趋势也基本不受外源黄酮影响。21 d时,Ni元素的含量在5 mg/mL外源黄酮处理组最高,为4.27 μg/L,在2.5 mg/mL外源黄酮处理组最低,为3.43 μg/L。Cr元素含量受外源黄酮影响较为显著,21 d时,添加黄酮的处理组比空白组高出60%~115%。Se元素含量随黄酮添加量增加而增加,最高为0.34 μg/L,根据相关研究,这是由于Se与黄酮生成了配合物[17],酒中游离的Se离子浓度小于竹秆中,因此竹秆中的Se离子向酒中扩散,引起了竹筒酒中Se元素的升高。
与其他元素相反,陈酿的前21 d内,空白组的Mn元素含量高于3个添加外源黄酮的处理组(图3-e),21 d时,空白组Mn含量是3个外源黄酮处理组的1.46~3.28倍(图4)。2.5 mg/mL的外源黄酮处理组在35 d时,Mn的含量比开始陈酿前高出了15倍。据此推测竹筒酒在陈酿过程中,Mn会不断累积,而添加外源黄酮对竹筒酒陈酿过程中Mn的累积具有减少作用。
2.3.3 外源黄酮对有害元素的影响
外源黄酮对有害元素具有不同程度的影响。外源黄酮提取物中含有8.96~38.80 μg/L的As元素,随着陈酿过程逐渐降低,到21 d时趋于平衡。21 d时,As元素含量随外源黄酮添加量的升高不断升高(图3-h),2.5 mg/mL外源黄酮处理组含量较空白组增加较少,仅增加了10%,另外2组含量均为空白组的2倍左右。如图5所示,酒中的Cd元素的含量在2.5 mg/mL外源黄酮处理组比空白基酒组低90%,在5、10 mg/mL外源黄酮处理组比空白基酒组低约40%。竹叶黄酮对竹筒酒中Al和Pb元素含量影响不显著(P>0.05),21 d时,Al元素仅在10 mg/mL 外源黄酮处理组有检出,其原因是10 mg/mL 外源黄酮提取物中初始Al元素含量较高,为105.00 μg/L。

图5 竹筒酒中有害元素含量随黄酮添加量变化
Fig.5 Dynamics of the content of harmful elements in bamboo liquor with flavonoid addition
3 结论与讨论
(1)竹子中富含K[18]
在陈酿过程中,竹筒酒中的K含量变化除了与竹子中的K主动溶出有关外,还与竹筒酒中的乙醇有关。相关研究表明,植物的无氧呼吸也会产生乙醇,但最终会被自身的乙醇代谢途径代谢转化[19]。在陈酿初期,竹筒酒的乙醇含量较高,植物无法在短时间内代谢消耗,因乙醇对竹子的刺激作用,使竹筒酒中的K含量在陈酿初期呈指数型增长;陈酿15 d后,竹筒酒中乙醇含量趋于稳定,乙醇对竹子的刺激作用减少,酒中K含量受溶出作用影响,呈现缓慢下降趋势,在28 d左右达到了约190 mg/L的稳定含量。Ca、Na、Cr、As元素含量的变化符合一级动力学反应,Ca元素含量在陈酿过程中下降缓慢,降幅较小;Na、Cr、As元素含量均在10 d左右就下降到初始含量的一半。除K、Mn元素外,各元素在陈酿过程中总体呈下降趋势,最终在21 d左右趋于稳定水平,因此陈酿21 d比较合适。
(2)矿质元素对植物的生长调节具有重要作用[20]
K、Mg在自然界中属于大量元素,K是植物调节叶片气孔开闭,控制蒸腾作用的重要元素,Mg是植物光合作用酶的组成元素;Zn作为自然界中的微量元素,对植物生长调节过程中的酶具有活化作用;Pb、Cd在自然界中属于重金属元素,对多数植物生长具有胁迫作用。毛竹为禾本科植物,K、Mg、Zn是毛竹生长过程中的必需元素,Pb、Cd对毛竹根系细胞具有损伤作用[12,21-22]。本研究中添加外源黄酮对竹筒酒中各矿质元素含量具有不同程度的影响。2.5 mg/mL外源黄酮处理,大幅提高了K、Mg、Zn元素含量的峰值,有力地降低了有害元素Pb、Cd的含量,对As、Al元素含量无明显影响。因此,添加外源黄酮对竹筒酒中有益元素的积累和有害元素的降低有较好的作用,且最适的添加量和最佳陈酿时间分别为2.5 mg/mL和21 d。
[1] 刘宗鹤. 遂昌县志[M].杭州:浙江人民出版社, 1996:467-468.
LIU Z H.Suichang County Chronicles[M].Hangzhou:Zhejiang People′s Publishing House, 1996:467-468.
[2] 陈晨, 樊玮, 张保, 等.竹酒矿质元素评价及表征品质元素筛选[J].食品与发酵工业, 2020,46 (21):195-200.
CHEN C, FAN W, ZHANG B, et al.Mineral elements and characteristic as quality markers on bamboo liquor[J].Food and Fermentation Industries, 2020, 46 (21):195-200.
[3] 刘沛龙, 唐万裕, 练顺才, 等.白酒中金属元素的测定及其与酒质的关系(上)[J].酿酒科技, 1997 (6):23-28.
LIU P L, TANG W Y, LIAN S C, et al.Determination of metal elements in liquor and its relationship with liquor quality (I)[J].Liquor-Making Science & Technology,1997 (6):23-28.
[4] 刘沛龙, 唐万裕, 练顺才, 等.白酒中金属元素的测定及其与酒质的关系(下)[J].酿酒科技, 1998 (1):12-20.
LIU P L, TANG W Y, LIAN S C, et al.Determination of metal elements in liquor and its relationship with liquor quality (Ⅱ)[J].Liquor-Making Science & Technology,1998 (1):12-20.
[5] 曹智华, 余有贵, 何红梅.中国传统白酒中微量成分的来源与作用[J].食品与机械,2018, 34 (9):191-195;219.
CAO Z H,YU Y G,HE H M.Sources and effects of trace components in traditional Chinese liquor[J].Food & Machinery, 2018, 34 (9):191-195;219.
[6] ZHU J C, CHEN F, WANG L Y, et al.Comparison of aroma-active compounds and sensory characteristics of durian (Durio zibethinus L.) wines using strains of Saccharomyces cerevisiae with odor activity values and partial least-squares regression[J].Journal of Agricultural and Food Chemistry,2015, 63 (7):1 939-1 947.
[7] QIN H, HUO D Q, ZHANG L, et al.Colorimetric artificial nose for identification of Chinese liquor with different geographic origins[J].Food Research International,2012, 45 (1):45-51.
[8] 叶萌祺, 岳田利, 高振鹏, 等.基于ICP-MS法的苹果酒发酵过程矿质元素的动态分析[J].光谱学与光谱分析, 2015,35 (1):229-233.
YE M Q, YUE T L, GAO Z P, et al.Analysis of changes in minerals contents during cider fermentation process by inductively coupled plasma mass spectrometry[J].Spectroscopy and Spectral Analysis, 2015, 35 (1):229-233.
[9] 陶勇, 徐占成, 刘孟华, 等.剑南春窖泥理化特性及矿质元素变化趋势研究[J].酿酒科技, 2011 (7):51-54.
TAO Y, XU Z C, LIU M H, et al.Study on the physiochemical properties of pit mud from Jiannanchuan pit & the change trend of its mineral elements[J].Liquor-Making Science & Technology,2011 (7):51-54.
[10] 姜忠军. 白兰地酿造工艺及质量评价指标研究[D].无锡:江南大学,2006.
JIANG Z J.The study on the technology of brandy brewing and the parameters of quality evaluation[D].Wuxi:Jiangnan University, 2006.
[11] World Health Organization.Evaluation of Certain Food Additives and Contaminants:Forty-first Report of the Joint FAO/WHO Expert Committee on Food Additives[R].Geneva,1993.
[12] 封焕英, 范少辉, 苏文会, 等.毛竹竹节矿质营养特征的研究[J].热带作物学报, 2014,35 (2):317-322.
FENG H Y, FAN S H, SU W H, et al.Nutrition characteristics of moso bamboo node[J].Chinese Journal of Tropical Crops, 2014,35 (2):317-322.
[13] MAJID M, KHAN M R, SHAH N A, et al.Studies on phytochemical, antioxidant, anti-inflammatory and analgesic activities of Euphorbia dracunculoides[J].BMC Complementary and Alternative Medicine,2015, 15(1):349.
[14] OMOLOLU P A, ROCHA J B T, KADE I J.Attachment of rhamnosyl glucoside on quercetin confers potent iron-chelating ability on its antioxidant properties[J].Experimental and Toxicologic Pathology,2011, 63 (3):249-255.
[15] BINBUGA N, HENRY W P, SCHULTZ T P.Binding of hydroxychromones with Al3+ in methanol[J].Polyhedron,2007, 26 (1):6-10.
[16] ZHANG J, YUE L, HAYAT K, et al.Purification of flavonoid from Gingko biloba extract by zinc complexation method and its effect on antioxidant activity[J].Separation and Purification Technology,2010, 71 (3):273-278.
[17] 陈翔, 童育鹏, 仇佩虹.两种黄酮与硒配合物的合成及其结构分析[J].温州医学院学报, 2009,39 (1):63-65.
CHEN X, TONG Y P, QIU P H.Synthesis and structure analysis of two complexes of flavonoids with selenium[J].Journal of Wenzhou Medical University, 2009, 39 (1):63-65.
[18] 雷毅,蒋丽娟,陈宝宝,等.不同浓度乙醇溶液杀菌效果观察[J].中国消毒学杂志,2020,37(9):656-658.
LEI Y, JIANG L J, CHEN B B, et al.Observation on the disinfection effect of different concentrations of ethanol solutions[J].Chinese Journal of Disinfection,2020,37(9):656-658.
[19] 杨跃生,简玉瑜.植物的乙醇代谢及其在农业生产上的意义[J].华南理工大学学报(自然科学版),1996,24(S1):107-111.
YANG Y S, JIAN Y Y.The role of ethanol metabolism in plants[J].Journal of South China University of Technology(Natural Science Edition),1996,24(S1):107-111.
[20] 蔡永萍. 植物生理学[M].北京:中国农业大学出版社, 2008.
CAI Y P.Plant Physiology[M].Beijing:China Agricultural University Press, 2008.
[21] 苏文会. 基于生长和养分积累规律的毛竹林施肥理论与实践研究[D].北京:中国林业科学研究院,2012.
SU W H.Fertilization theory and practice for Phyllostachys edulis stand based on growth and nutrient accumulation rules[D].Beijing:Chinese Academy of Forestry, 2012.
[22] 张大鹏,蔡春菊,范少辉,等.重金属Pb2+和Cd2+对毛竹种子萌发及幼苗早期生长的影响[J].林业科学研究,2012,25(4):500-504.
ZHANG D P, CAI C J, FAN S H, et al.Effects of Pb2+, Cd2+ on germination and seedling early growth of moso bamboo(Phyllostachys edulis) seed [J].Forest Research, 2012, 25(4): 500-504.