茎瘤芥(Brassica juncea var.tumida Tsen et Lee)又名青菜头,为十字花科芸薹属茎用芥菜,是我国长江流域重要的农业和经济作物,作为主要原料腌制而成的涪陵榨菜,与法国酸黄瓜和德国甜酸甘蓝被誉为世界三大名腌菜[1]。茎瘤芥表皮青绿,肉质白嫩肥厚,富含蛋白质、糖分、胡萝卜素、氨基酸、核黄素以及多种维生素等人体所必需的营养成分,具有鲜嫩香脆的独特风味[2-4]。茎瘤芥主产于我国重庆、四川等地,浙江和江苏也有大面积种植,而四川和重庆的生态环境和气候条件最适宜茎瘤芥栽培,所形成的瘤状肉质茎尤为肥嫩。茎瘤芥的营养价值不仅取决于其有机成分,而且与其所含营养元素密切相关,作为茎瘤芥生长的物质基础,营养元素是茎瘤芥组织发育、维持和代谢所需的重要物质,也是人们通过食用茎瘤芥获取必需微量元素的重要来源。因此,建立适用于涵盖茎瘤芥中常量和微量营养元素的分析方法,并利用化学计量学等方法进行模式识别分析,有利于正确评价茎瘤芥的营养价值,通过探寻茎瘤芥中营养元素含量的特征指标,有利于茎瘤芥品种保护和产地溯源。
目前,有关茎瘤芥的研究主要集中于遗传育种和生理性状[5-7],而对于茎瘤芥中营养元素含量分布的研究报道不多。茎瘤芥中营养元素含量不仅受遗传基因控制,而且与产地环境如土壤、气候、水质、栽培条件、施肥方法等因素相关,因此,不同产地茎瘤芥中营养元素的组成差异能反映茎瘤芥的品质及其产地特征。通过化学分析方法获取植物中无机元素的组成和含量,结合化学计量学方法对元素特征进行模式识别分析,可用于植物的品质评价和产地判别,达到植物资源原产地保护的目的,已广泛应用于花椒、山银花、薰衣草、小麦、花茶等多种植物资源产地溯源的研究与应用[8-12]。电感耦合等离子体原子发射光谱(inductively coupled plasma optical emission spectrometry,ICP-OES)超高基质耐受能力可在较大浓度范围内进行植物资源中多种常量和微量元素的高通量分析,且具有高灵敏度、检测速度快和较低检测限等特点而备受青睐[13-15]。多元统计分析技术可以针对多个互相关联的对象和指标分析目标样品的统计规律,其中主成分分析(principal component analysis,PCA)和聚类分析(cluster analysis,CA)是常见的统计分析方法[16-18]。本研究选择产自重庆涪陵、四川沱江和湖南浏阳的茎瘤芥作为研究对象,具有较强代表性及地域特色,茎瘤芥样品经微波消解后采用ICP-OES测定其中常量营养元素(Mg、P、S、Ca、K)和微量营养元素(B、Mo、Mn、Fe、Cu、Zn、Sr)的含量,继而利用PCA技术对不同产地茎瘤芥中的营养元素进行判别分析,并对不同产地的关键差异性营养元素采用CA技术进行聚类,以期为茎瘤芥的营养价值评价提供依据,通过探寻茎瘤芥中营养元素含量的特征指标,为茎瘤芥的产地溯源提供参考。
1 材料与方法
1.1 材料与试剂
16个茎瘤芥样品在2021年1月分别采集于重庆涪陵(东经107°29′56″,北纬29°50′10″,海拨225~418 m)、四川沱江(东经 104°78′15″,北纬29°28′25″,海拨270~350 m)和湖南浏阳(东经113°60′22″,北纬28°01′56″,海拨202~369 m),其中重庆涪陵6个,四川沱江6个,湖南浏阳4个。
1 000 mg/L的Mg、P、S、Ca、K、B、Mo、Mn、Fe、Cu、Zn、Sr单元素标准储备溶液,国家标准物质中心;65%(体积分数)硝酸、30%(体积分数)双氧水,德国Merck公司;胡萝卜成分分析标准物质(GBW10047),中国地质科学院地球物理地球化学勘查研究所;实验用水为Milli超纯水。
1.2 仪器与设备
Agilent 5110电感耦合等离子体原子发射光谱仪,配备SeaSpray雾化器、单通道玻璃旋流雾化室和SPS 4自动进样器,美国Agilent公司;MARs 5微波消解系统,美国CEM公司;泰斯特FZ102微型植物粉碎机,天津泰斯特仪器有限公司;Milli-Q超纯水机,美国Millipore公司。
1.3 实验方法
1.3.1 ICP-OES工作条件
射频功率,1.5 kW;等离子体流量,12 L/min;雾化气流量,0.6 L/min;辅助气流量,1.0 L/min;观测高度,8 mm;泵速,15 r/min;读数时间,20 s;重复次数,3次;样品提升延迟时间,20 s;稳定时间,20 s;背景校正,快速自动曲线拟合技术。
1.3.2 样品微波消解
将采集的新鲜茎瘤芥样品经自来水冲洗干净后用超纯水清洗3次,沥干水分于80 ℃鼓风干燥箱中烘干至恒重,粉碎过40目筛。准确称取约0.2 g粉末样品于微波消解反应罐内,加入8 mL硝酸预反应30 min后按微波消解仪推荐程序进行消解。消解结束后转入50 mL容量瓶中,加入2 mL双氧水,用超纯水定容至刻度,摇匀后制得样品溶液。采用相同的消解方式处理标准物质、标准溶液和空白溶液。
1.3.3 ICP-OES分析
采用单元素标准储备溶液分别配制0.0、2.0、10、50、200 mg/L的工作标准溶液,按所设定的条件分别对工作标准溶液、消解空白溶液和样品消解溶液进行测定,计算样品溶液中营养元素的含量。
1.3.4 数据处理
运用ICP-OES自带的ICP Expert 软件对16个茎瘤芥中营养元素的含量数据进行处理,采用SPSS 26对ICP-OES分析数据标准化处理后进行统计分析。
2 结果与分析
2.1 ICP-OES分析性能评价
2.1.1 方法的校准数据与检出限
采用ICP-OES对系列工作标准溶液进行测定,建立标准曲线方程。通过连续测定11次消解空白溶液中分析元素的发射强度,计算标准偏差(σ),以3σ所对应的浓度为分析元素仪器的检出限,经稀释校正计算分析元素方法的检出限(method detection limit,MDL),分析元素的校准数据与检出限见表1。可以看出,所有分析元素的线性相关系数大于0.999 5,线性关系良好;本法的MDL为0.01~1.38 mg/kg,除S以外,其余所有分析元素的MDL均低于我国食品安全国家标准(GB 5009.268—2016)采用ICP-OES法制定的规定值[19]。
表1 元素的分析波长、校准曲线数据及方法的检出限
Table 1 Analysis results of national standard reference materials
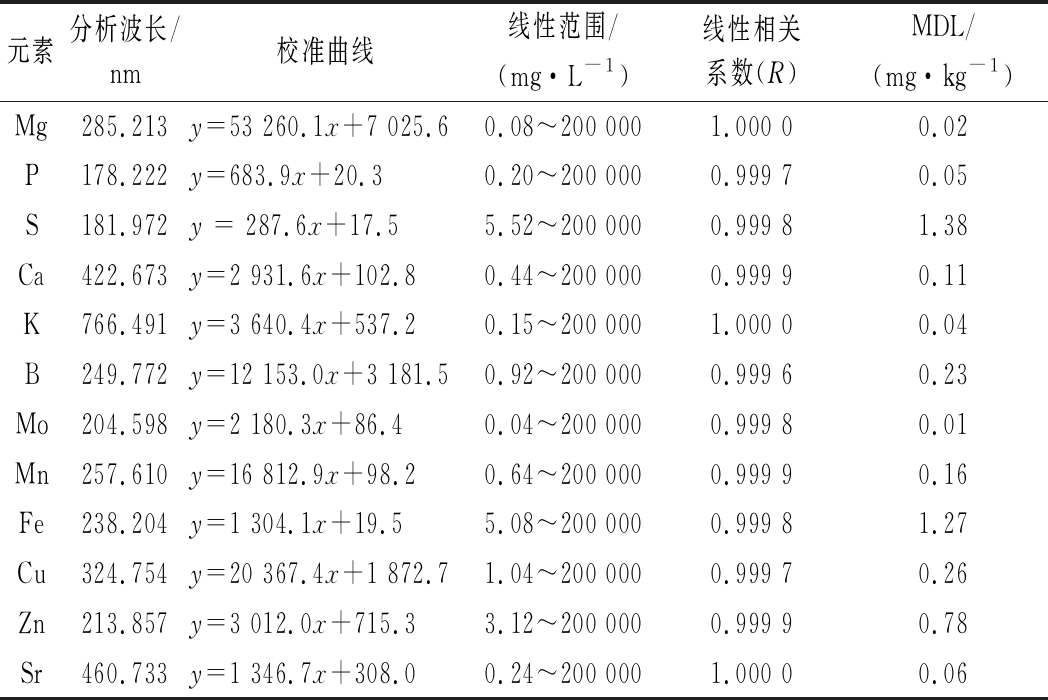
元素分析波长/nm校准曲线线性范围/(mg·L-1)线性相关系数(R)MDL/(mg·kg-1)Mg285.213y=53 260.1x+7 025.60.08~200 0001.000 00.02P178.222y=683.9x+20.30.20~200 0000.999 70.05S181.972y = 287.6x+17.55.52~200 0000.999 81.38Ca422.673y=2 931.6x+102.80.44~200 0000.999 90.11K766.491y=3 640.4x+537.20.15~200 0001.000 00.04B249.772y=12 153.0x+3 181.50.92~200 0000.999 60.23Mo204.598y=2 180.3x+86.40.04~200 0000.999 80.01Mn257.610y=16 812.9x+98.20.64~200 0000.999 90.16Fe238.204y=1 304.1x+19.55.08~200 0000.999 81.27Cu324.754y=20 367.4x+1 872.71.04~200 0000.999 70.26Zn213.857y=3 012.0x+715.33.12~200 0000.999 90.78Sr460.733y=1 346.7x+308.00.24~200 0001.000 00.06
2.1.2 方法准确性与精密度验证
应用有证国家标准物质胡萝卜(GBW10047)验证方法的准确性和精密度,标准物质经微波消解后重复测定6次,结果见表2。可以看出,对照标准参考物质的认证值,本法的测定值与认定值相吻合,相对误差(relative error,RE)为-3.0%~3.9%,回收率为97.0%~104%,相对标准偏差(relative standard deviation,RSD)为1.3%~4.1%。良好的回收率和RSD验证了方法能准确测定茎瘤芥中的12种营养元素,具有高精密度。
表2 方法的准确性和精密度评价(n=6)
Table 2 Accuracy and precision evaluation of the method(n=6)
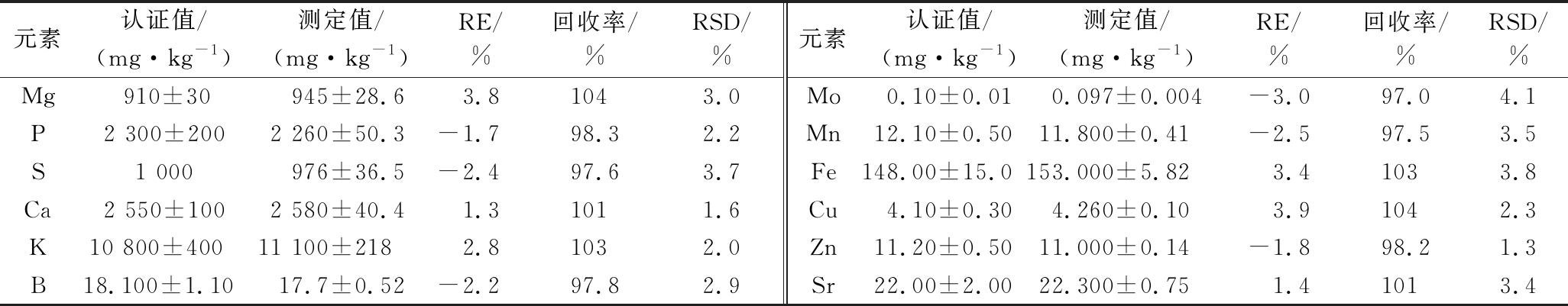
元素认证值/(mg·kg-1)测定值/(mg·kg-1)RE/%回收率/%RSD/%元素认证值/(mg·kg-1)测定值/(mg·kg-1)RE/%回收率/%RSD/%Mg 910±30945±28.63.81043.0Mo0.10±0.010.097±0.004-3.097.04.1P2 300±2002 260±50.3-1.798.32.2Mn12.10±0.5011.800±0.41-2.597.53.5S1 000976±36.5-2.497.63.7Fe148.00±15.0153.000±5.823.41033.8Ca2 550±1002 580±40.41.31011.6Cu4.10±0.304.260±0.103.91042.3K10 800±400 11 100±2182.81032.0Zn11.20±0.5011.000±0.14-1.898.21.3B18.100±1.10 17.7±0.52-2.297.82.9Sr22.00±2.0022.300±0.751.41013.4
2.2 茎瘤芥样品分析
采用本方法分别测定了来自重庆涪陵(样品编号CQFL1~6)、四川沱江(样品编号SCTJ1~6)和湖南浏阳(样品编号HNLY1~4)的16个茎瘤芥样品,每个样品重复测定6次,结果见表3。不同产地茎瘤芥中营养元素的含量差别很大,茎瘤芥中营养元素的含量不仅受控于其遗传特性,而且与其生长地理环境和栽培条件等因素有关。16个茎瘤芥样品中Mg的含量为997~3 350 mg/kg,P的含量为726~17 200 mg/kg,S的含量为390~8 350 mg/kg,Ca的含量为812~11 900 mg/kg,K的含量为4 360~78 300 mg/kg,B的含量为2.12~40.6 mg/kg,Mo的含量为0.02~0.68 mg/kg,Mn的含量为2.25~90.5 mg/kg,Fe的含量为11.0~166 mg/kg,Cu为含量在0.46~16.4 mg/kg,Zn的含量在1.61~69.0 mg/kg,Sr的含量为0.20~5.38 mg/kg。其中重庆涪陵茎瘤芥样品中Mg、P、S、Ca、K、B、Mn、Fe、Zn的含量显著高于其他2个产区,而四川沱江茎瘤芥样品中Mg、P、S、K、B、Mn的含量相差不大,四川沱江茎瘤芥样品中Ca、Fe、Zn的含量低于湖南浏阳茎瘤芥样品;重庆涪陵茎瘤芥样品中Mo和Sr的含量显著低于其他2个产区,四川沱江茎瘤芥样品中Mo的含量高于湖南浏阳茎瘤芥样品;湖南浏阳茎瘤芥样品中Cu的含量高于其他2个产区,重庆涪陵茎瘤芥样品中Cu的含量高于四川沱江茎瘤芥样品。
表3 茎瘤芥样品的分析结果(n=6) 单位:mg/kg
Table 3 Analysis results of tumorous stem mustard (Brassica juncea var. tumida Tsen et Lee)(n=6)
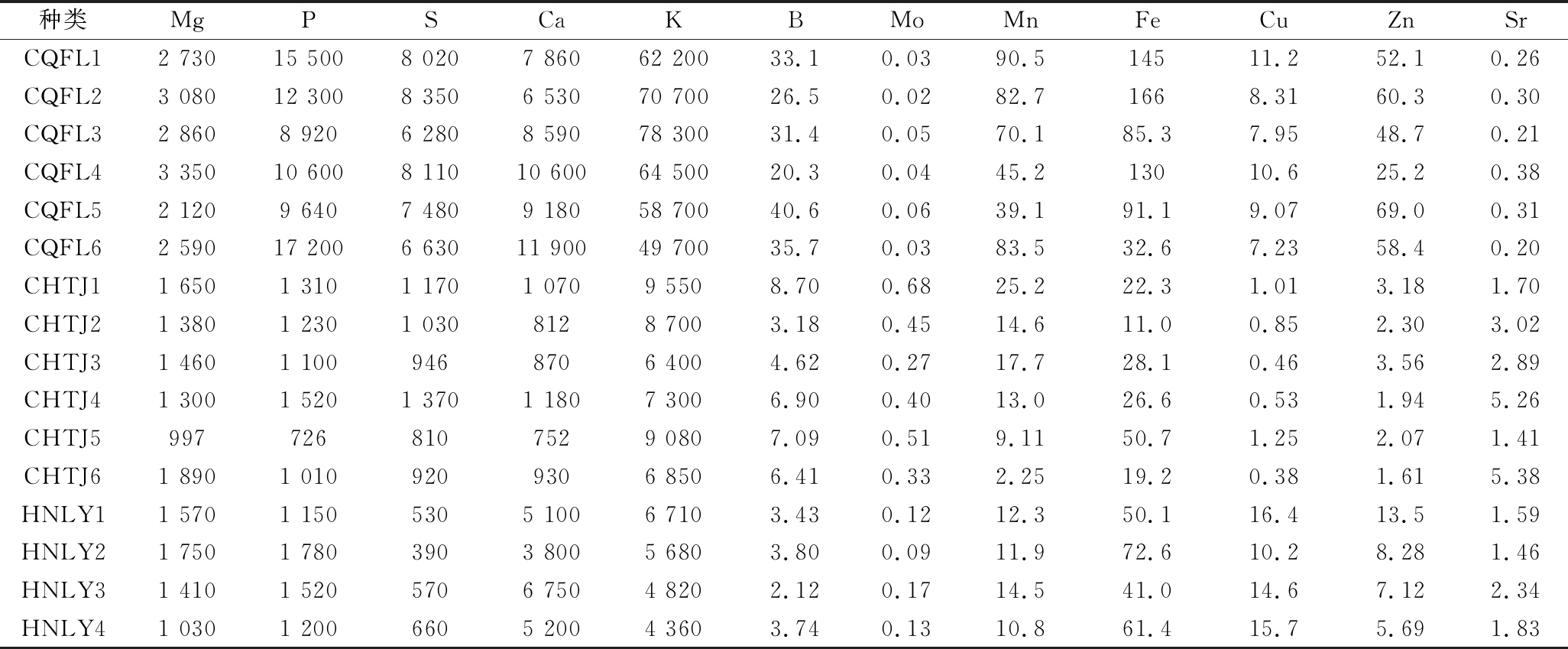
种类MgPSCaKBMoMnFeCuZnSrCQFL12 73015 5008 0207 86062 20033.10.0390.514511.252.10.26CQFL23 08012 3008 3506 53070 70026.50.0282.71668.3160.30.30CQFL32 8608 9206 2808 59078 30031.40.0570.185.37.9548.70.21CQFL43 35010 6008 11010 60064 50020.30.0445.213010.625.20.38CQFL52 1209 6407 4809 18058 70040.60.0639.191.19.0769.00.31CQFL62 59017 2006 63011 90049 70035.70.0383.532.67.2358.40.20CHTJ11 6501 3101 1701 0709 5508.700.6825.222.31.013.181.70CHTJ21 3801 2301 0308128 7003.180.4514.611.00.852.303.02CHTJ31 4601 1009468706 4004.620.2717.728.10.463.562.89CHTJ41 3001 5201 3701 1807 3006.900.4013.026.60.531.945.26CHTJ59977268107529 0807.090.519.1150.71.252.071.41CHTJ61 8901 0109209306 8506.410.332.2519.20.381.615.38HNLY11 5701 1505305 1006 7103.430.1212.350.116.413.51.59HNLY21 7501 7803903 8005 6803.800.0911.972.610.28.281.46HNLY31 4101 5205706 7504 8202.120.1714.541.014.67.122.34HNLY41 0301 2006605 2004 3603.740.1310.861.415.75.691.83
2.3 PCA
2.3.1 茎瘤芥中营养元素的相关性分析
由于茎瘤芥中营养元素繁多,且受茎瘤芥产地、气候、季节等其他因素的影响,很难通过利用简单的数据分析获取有效变量。PCA是将多维度的原始变量通过降低维度,重新组合成相互无关的综合变量来反映原始变量的统计方法,原始数据的相关性越高,PCA效果越好[20-22]。本实验采用KMO(Kaiser-Meyer-Olkin)和Bartlett 的球形度对茎瘤芥中12种营养元素(变量)之间的相关性进行检验,考察原始变量是否合适进行因子分析。检验结果显示,KMO为0.724,大于阈值0.5,Bartlett球形度检验的显著性(significance,Sig.)为0.000,小于0.05,说明茎瘤芥中12个变量之间具有相关性,可以进行因子分析。
通过分析茎瘤芥中营养元素的相关性矩阵(表4)发现,茎瘤芥对多种营养元素具有显著正相关(P<0.05),多数处于极显著正相关(P<0.01)。Mg、P、S、Ca、K、B、Mn、Fe、Zn之间呈极显著正相关,表明这些营养元素存在相互协同、促进吸收的关系,同时显示出茎瘤芥在富集以上营养元素时具有极好的协同效应,但其含量差异与茎瘤芥的品种、生长环境等因素相关;Mo和Sr与多数营养元素之间呈极显著负相关,表明Mo和Sr与这些营养元素之间存在相互拮抗关系;Cu与部分营养元素相关性较差,说明Cu元素的差异可能主要源于产区土壤的差异。不同产区的茎瘤芥样品由于含有相同的生长基因,从土壤中吸收并最终积累在茎瘤芥内的营养元素在种类和含量分布会存在一定规律,但不同产地茎瘤芥的营养元素存在较大差异,可能与土壤类型、气候条件等因素相关,同时,茎瘤芥的个体差异对营养元素的吸收和积累也不尽相同,但茎瘤芥中12种营养元素之间是相互影响的机理仍需进一步研究。
表4 茎瘤芥中营养元素的相关性矩阵
Table 4 Correlation matrix for the nutrient elements in tumorous stem mustard

MgPSCaKBMoMnFeCuZnSrMg1.000P0.842**1.000S0.901**0.933**1.000Ca0.729**0.823**0.782**1.000K0.909**0.881**0.969**0.767**1.000B0.758**0.910**0.921**0.763**0.907**1.000Mo-0.629**-0.656**-0.628**-0.820**-0.629**-0.565**1.000Mn0.828**0.948**0.890**0.717**0.886**0.861**-0.578**1.000Fe0.736**0.658**0.786**0.564**0.774**0.583**-0.647**0.677**1.000Cu0.2060.248*0.2100.632**0.2160.147-0.717**0.2030.443**1.000Zn0.753**0.901**0.906**0.795**0.894**0.959**-0.688**0.871**0.663**0.304*1.000Sr-0.588**-0.683**-0.678**-0.739**-0.705**-0.666**0.561**-0.696**-0.662**-0.516**-0.718**1.000
注:“**”表示极显著相关(P<0.01);“*”表示显著相关(P<0.05)
2.3.2 茎瘤芥中营养元素的因子分析
对茎瘤芥中营养元素含量原始数据标准化后,采用PCA提取公因子,进行因子分析。前2个公因子的累积方差贡献率分别为73.740%和12.231%,累积贡献率达到85.971%。因此,本实验提取第1主成分(PC1)和第2主成分(PC2)来评判茎瘤芥营养元素的总体特征。采用最大方差法对因子载荷矩阵旋转,构建PC1和PC2的数据得分模型:
PC1=0.867x1+0.921x2+0.953x3+0.653x4+0.940x5+0.934x6-0.464x7+0.918x8+0.650x9-0.029x10+0.885x11-0.609x12
PC2=0.246x1+0.275x2+0.241x3+0.662x4+0.249x5+0.168x6-0.787x7+0.213x8+0.474x9+0.982x10+0.329x11-0.552x12
2个主成分的数据得分模型显示,PC1在x1、x2、x3、x5、x6、x8、x11有较大荷载值(>0.800),对应元素为Mg、P、S、K、B、Mn、Zn,PC2在x10有较大荷载值,与元素Cu相对应。由于PC1和PC2能代表茎瘤芥中营养元素的大部分原始信息,因此,所对应的高度正相关元素Mg、P、S、K、B、Mn、Zn、Cu为茎瘤芥的特征元素。
图1所示为16个茎瘤芥样品主成分(或主因子)的PCA得分图,图中的每个样品分布点均为原12维空间的样品点经降维映射而来,反映出16个茎瘤芥样品的分类情况。可以看出,3种不同产地的茎瘤芥样品可以明显分成三大类,产于重庆涪陵的茎瘤芥样品(样品分布点1~6)分成一类,产于四川沱江的茎瘤芥样品(样品分布点7~12)分成一类,产于湖南浏阳的茎瘤芥样品(样品分布点13~16)分成一类,茎瘤芥中营养元素的含量能将不同产地的茎瘤芥样品进行有效区分,可用于茎瘤芥产地的判别。
2.4 聚类分析
本实验采用系统CA对不同产地茎瘤芥样品进行聚类,以12种营养元素含量为变量,CA采用组间连接法和欧氏距离平方,聚类树状图见图2。当距离选择7时,16个样品分为两类,重庆涪陵产地的茎瘤芥归为一类,四川沱江和湖南浏阳产地的茎瘤芥归为一类,表明涪陵产地与外地的茎瘤芥存在较大差异;距离选择5时,16个样品分为三类,能较好地将四川沱江和湖南浏阳产地的茎瘤芥正确归类。结果表明以12种营养元素为原始变量能对茎瘤芥的产地进行溯源。

图1 样品的PCA得分图
Fig.1 PCA score chart of samples
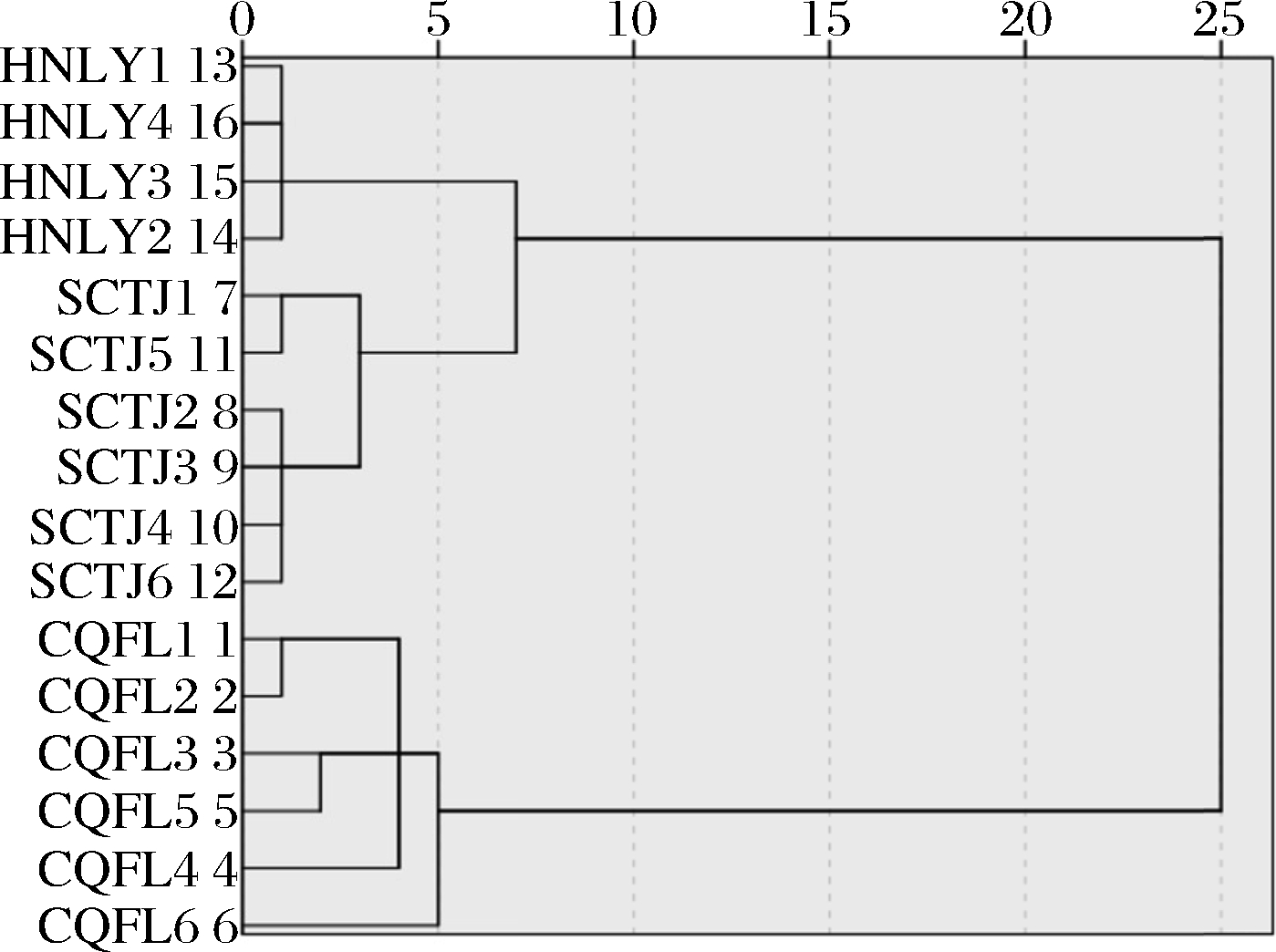
图2 茎瘤芥中营养元素含量的聚类树状图
Fig.2 Cluster dendrogram of nutrient element content in tumorous stem mustard
3 结论
采用ICP-OES法能有效分析茎瘤芥样品中的常量营养元素(Mg、P、S、Ca、K)和微量营养元素(B、Mo、Mn、Fe、Cu、Zn、Sr),可准确评价不同产地茎瘤芥的营养元素含量,不同产地茎瘤芥中营养元素的含量差别很大;通过PCA进行茎瘤芥产地与其营养元素含量之间的相关性研究,确定高度正相关元素Mg、P、S、K、B、Mn、Zn、Cu为茎瘤芥的特征元素;由PCA构建的2个主成分数据得分模型,可以将重庆涪陵、四川沱江和湖南浏阳3个产地的茎瘤芥区分;由CA进行茎瘤芥产地与营养元素含量的判别分析,对茎瘤芥产地的判别结果与PCA相吻合,可根据茎瘤芥中营养元素的含量差异进行产地溯源。因此,通过对茎瘤芥中营养元素含量的测定,运用PCA和CA可以区分茎瘤芥产地来源,研究结果为茎瘤芥产地的判别研究提供了快速、准确、可靠的统计分析方法。
[1] 孙勃, 夏雪, 辜金花, 等.笋子芥和茎瘤芥生物活性物质与抗氧化能力分析[J].核农学报, 2016, 30(3):485-492.
SUN B, XIA X, GU J H, et al.Analysis of bioactive compounds and antioxidant capacities in Brassica juncea var.Crassicauiis and Brassica juncea var.tumida[J].Journal of Nuclear Agricultural Sciences, 2016, 30(3):485-492.
[2] LI W F, YANG H Y, LI C M, et al.Chemical composition, antioxidant activity and antitumor activity of tumorous stem mustard leaf and stem extracts[J].CyTA-Journal of Food, 2019, 17(1):272-279.
[3] XIE Q L, HU Z L, ZHANG Y J, et al.Accumulation and molecular regulation of anthocyanin in purple tumorous stem mustard (Brassica juncea var.tumida Tsen et Lee)[J].Journal of Agricultural and Food Chemistry, 2014, 62(31):7 813-7 821.
[4] XIE Q L, YAN F, HU Z L, et al.Accumulation of anthocyanin and its associated gene expression in purple tumorous stem mustard (Brassica juncea var. tumida Tsen et Lee) sprouts when exposed to light, dark, sugar and methyl jasmonate[J].Journal of Agricultural and Food Chemistry, 2019, 67(3):856-866.
[5] SHI H, WANG L L, SUN L T, et al.Cell division and endoreduplication play important roles in stem swelling of tuber mustard (Brassica juncea Coss.var.tumida Tsen et Lee)[J].Plant Biology, 2012, 14(6):956-963.
[6] FANG P, CHEN F B, YAO Q L, et al.Analysis of genetic diversity in the tuber mustard (Brassica juncea var. tumida Tsen et Lee) in the Yangtze River Basin of China[J].Genetic Resources and Crop Evolution, 2013, 60:129-143.
[7] 赵亚南, 刘玉红, 唐振亚, 等.不同养分配比对茎瘤芥产量和营养品质的影响[J].西南大学学报(自然科学版), 2013, 35(1):49-52.
ZHAO Y N, LIU Y H, TANG Z Y, et al.Effects of different fertilizer ratios on the yield and nutrition quality of tumorous stem mustard[J].Journal of Southwest University (Natural Science), 2013, 35(1):49-52.
[8] 吴振, 李红, 杨勇, 等.基于无机元素的花椒产地溯源和品种聚类分析[J].食品科学, 2019, 40(16):213-219.
WU Z, LI H, YANG Y, et al.Geographical origin traceability and varietal classification of Zanthoxylum based on mineral profile[J].Food Science, 2019, 40(16):213-219.
[9] 申丽娟, 丁恩俊, 谢德体, 等.电感耦合等离子体原子发射光谱法测定不同产地山银花金属元素主成分及其聚类分析[J].食品科学, 2014, 35(2):173-176.
SHEN L J, DING E J, XIE D T, et al.Principal component analysis and cluster analysis of metal elements in Flos lonicerae from different areas using inductively coupled plasma-atomic emission spectrometry[J].Food Science, 2014, 35(2):173-176.
[10] 廖享, 高晶, 符继红, 等.ICP-AES法对新疆薰衣草无机元素主成分与聚类分析[J].计算机与应用化学, 2015, 32(7):841-844.
LIAO X, GAO J, FU J H, et al.Xinjiang lavender inorganic element principal components and cluster analysis based on ICP-AES method[J].Computers and Applied Chemistry, 2015, 32(7):841-844.
[11] ![]() N, CVEJANOV J.Principal component analysis of trace elements in Serbian wheat[J].Journal of Agricultural and Food Chemistry, 2005, 53(6):2 171-2 175.
N, CVEJANOV J.Principal component analysis of trace elements in Serbian wheat[J].Journal of Agricultural and Food Chemistry, 2005, 53(6):2 171-2 175.
[12] KARA D.Evaluation of trace metal concentrations in some herbs and herbal teas by principal component analysis[J].Food Chemistry, 2009, 114(1):347-354.
[13] KARASAKAL A.Determination of major, minor, and toxic elements in tropical fruits by ICP-OES after different microwave acid digestion methods [J].Food Analytical Methods, 2021, 14(2): 344-360.
[14] 庞敏. 明日叶中七种矿物质元素含量测定及营养质量指数分析[J].食品与发酵工业, 2020, 46(20):249-253.
PANG M.Quantitative detection of seven minerals in Ashitaba stem and leaf and the analysis of the index of nutritional quality[J].Food and Fermentation Industries, 2020, 46(20):249-253.
[15] FOSCHI M, D′ARCHIVIO A A, ROSSI L.Geographical discrimination and authentication of lentils (Lens culinaris Medik.) by ICP-OES elemental analysis and chemometrics[J].Food Control, 2020, 118:107438.
[16] 占敏宣, 魏清江, 林雄, 等.PCA再分析采收成熟度对桃溪蜜柚贮藏品质变化模式的影响[J].食品与发酵工业, 2021, 47(9):183-190.
ZHAN M X, WEI Q J, LIN X, et al.Comprehensively analyze the effect of harvest ripening degree maturity on storage quality of Taoxi pomelo based on PCA[J].Food and Fermentation Industries, 2021, 47(9):183-190.
[17] 张孟琴, 徐路, 孙亚真, 等.月季花瓣营养成分评价及主成分和聚类分析[J].食品与发酵工业, 2021, 47(2):274-278.
ZHANG M Q, XU L, SUN Y Z, et al.The evaluation of nutrient component of rose petals and the principal component analysis from different varieties[J].Food and Fermentation Industries, 2021, 47(2):274-278.
[18] 朱周俊, 袁德义, 邹锋, 等.不同锥栗农家种种仁中9 种矿质元素含量的因子分析与聚类分析[J].食品科学, 2019, 40(2):165-170.
ZHU Z J, YUAN D Y, ZOU F, et al.Factor analysis and cluster analysis of contents of 9 mineral elements in seed kernels of Castanea henryi from different varieties[J].Food Science, 2019, 40(2):165-170.
[19] 国家卫生和计划生育委员会,国家食品药品监督管理总局. GB 5009.268—2016 食品安全国家标准 食品中多元素的测定[S].北京:中国标准出版社, 2016.
State Health and Family Planning Commission of the People′s Republic of China, State Adiministration for Market Regulation.GB 5009.268—2016 National food safety standard determination of multielement in foods[S].Beijing:Standards Press of China, 2017.
[20] 开建荣, 王彩艳, 赵丹青, 等.红枸杞、黑枸杞和黄枸杞中49种无机元素比较研究[J].食品与发酵工业, 2020, 46(9):152-157.
KAI J R, WANG C Y, ZHAO D Q, et al.Comparative study of 49 inorganic elements in red, black and yellow Lycium barbarum[J].Food and Fermentation Industries, 2020, 46(9):152-157.
[21] BRO R, SMILDE A K.Principal component analysis[J].Analytical Methods, 2014, 6:2 812-2 831.
[22] 张彦聪, 李昀哲, 张军, 等.柠檬椰汁复合果酒的工艺研究及香气特征分析[J].食品与发酵工业, 2021, 47(4):173-181.
ZHANG Y C, LI Y Z, ZHANG J, et al.Fermentation optimization and aroma characteristic of lemon-coconut compound fruit wine[J].Food and Fermentation Industries, 2021, 47(4):173-181.