氧化应激是指在体内外有害因素刺激下,体内自由基增加或机体抗氧化保护能力减弱,导致氧化系统和抗氧化系统失衡[1]。在此状态下,过多积累的活性氧(reactive oxygen species,ROS)会造成核酸、蛋白质和脂质等生物大分子的损伤,进而可能导致慢性退行性疾病的发生[2-5]。抗氧化剂可通过中和自由基、清除氧化剂或防止氧化剂转变为毒性更强的化合物,减缓或抑制细胞损伤,达到抗氧化的目的[6]。抗氧化剂又可分为人工合成抗氧化剂和天然抗氧化剂。近几年来,因人工合成抗氧化剂的安全性受到质疑,所以寻找来源安全的天然抗氧化剂具有必要性。
玉米蛋白粉是玉米湿法生产淀粉的主要副产物之一,其中玉米谷蛋白含量占其总蛋白含量的22%左右[7],玉米谷蛋白中富含谷氨酰胺,谷氨酰胺是细胞增殖的主要能源,又是合成体内极其重要的抗氧化剂——还原型谷胱甘肽(glutathione,GSH)的前体物质[8]。然而由于玉米谷蛋白水溶性差等的原因,限制了其功能性的发挥和在食品工业中的应用[7-9]。有研究[10-11]表明,通过蛋白酶水解的方式可以改善蛋白质的溶解度。而目前有关玉米谷蛋白水解物(corn gluten hydrolysate,CGH)的研究主要集中于水解物的制备及其物性研究等方面。LI等[10]采用单酶水解玉米谷蛋白,探讨不同水解时间的谷蛋白酶解物抗氧化活性,得到具有较高抗氧化活性的CGH,本试验采用双酶协同水解玉米谷蛋白,不但减少了加酶量和水解时间,还提高了水解物的抗氧化活性。杨翠等[12]采用碱性蛋白酶水解玉米谷蛋白得到CGH,然后采用超滤、凝胶过滤层析和高效液相色谱法分离纯化CGH,发现CGH具有良好的抗氧化活性。以上的研究均使用化学法来评估CGH的抗氧化活性,化学法虽然快速,但无法反映体内复杂的生理过程和作用机理,而细胞模型法能准确模拟生物环境。目前,尚未见用细胞模型法评估CGH抗氧化活性的相关报道。本文采用双酶协同水解法获得CGH,采用乙醇诱导LO2细胞氧化损伤模型对CGH的抗氧化应激作用进行研究,为CGH在食品领域的应用提供基础数据。
1 材料与方法
1.1 材料与试剂
玉米蛋白粉,黑龙江龙凤玉米开发有限公司;α-淀粉酶(2.0×105 U/g),食品级,北京双旋微生物培养基制品厂;碱性蛋白酶(2.1×105 U/g)、复合蛋白酶(2.3×104 U/g),食品级,丹麦诺维信公司;DPPH(纯度≥95%)、2′,7′-二氯荧光黄双乙酸盐(2′, 7′-dichlorofluorescent yellow diacetate,DCFH-DA),美国Sigma公司;细胞培养基(dulbecco′s modified eagle medium,DMEM)(高糖)和胰蛋白酶,美国Gibco公司;胎牛血清(fetal bovine serum,FBS),德国PAN公司;噻唑兰(methyl thiazolyl tetrazolium,MTT),上海生工生物工程有限公司。
1.2 仪器与设备
TU-1810型紫外分光光度计,北京普析通用仪器有限责任公司;PB-10型pH计,赛多利斯科学仪器有限公司;PC/PLC-LD-53型冷冻干燥机,美国MILLROCK公司;NV4750E二氧化碳培养箱,NUAIRE(美国)公司;LX73荧光倒置显微镜,Olympus(日本东京)公司;EnSpire多功能酶标仪,珀金埃尔默(美国)公司产品;96孔板、6孔板、细胞培养瓶和移液管,Corning(美国)公司。
1.3 CGH的制备
精确称取一定量的玉米谷蛋白,配制成pH 7.0,底物质量浓度为5 g/100L的蛋白悬液,先后加入复合蛋白酶和碱性蛋白酶进行水解,复合蛋白酶加量为0.6 g/100g底物,水解(温度50 ℃,pH 7.0)60 min后立即用1 mol/L NaOH调节反应体系pH至8.5,升温至60 ℃,加入碱性蛋白酶,碱性蛋白酶加量为2 g/100g底物,水解(温度为60 ℃,pH 8.5)50 min,反应结束后于沸水中灭酶15 min,于4 000 r/min离心15 min,将上清液冷冻干燥后备用。
1.4 蛋白含量测定
采用微量凯式定氮法,按GB 5009.5—2010执行。
1.5 水解度(degree of hydrolysis,DH)测定
采用pH-stat法[7]测定水解度。当蛋白质被蛋白酶水解时,肽键断裂,有羧基和氨基产生,会使反应体系的pH值下降。通过滴加NaOH溶液使水解液维持pH稳定,再通过加入的NaOH溶液体积来衡量肽键的断裂情况,计算出玉米蛋白的DH。DH计算如公式(1)所示:
(1)
式中:VNaOH,反应中消耗的碱体积,mL;NNaOH,反应中维持pH稳定时碱当量浓度,mol/L;α,α-氨基酸解离度;Mp,反应体系中的蛋白总量,g;htot,1 g蛋白中肽键的克当量数,玉米蛋白取8.38。
1.6 抗氧化活性测定
将冻干后的CGH配成蛋白质量浓度为0.125、0.25、0.50、1.00、2.00 mg/mL的溶液,测定抗氧化活性。参考文献[7]的方法测定CGH的DPPH自由基清除能力、羟自由基(·OH)清除能力和Fe2+螯合能力。
1.7 细胞培养
LO2细胞培养于37 ℃、CO2含量为5 L/100L的培养箱中,参照文献[13]的方法进行传代培养。实验选用20~30代细胞。
1.8 MTT法测定CGH对LO2细胞存活率的影响
参照文献[13]的方法,将对数期LO2细胞,以细胞密度为1×105 cells/mL接种至96孔板中,每孔加入100 μL细胞悬液培养24 h,然后每孔加入100 μL终质量浓度为12.5、25、50、100、200、300、400、500、1 000、2 000 μg/mL的CGH培养液,培养细胞24 h后每孔加入终质量浓度为0.5 mg/mL的MTT溶液培养4 h,弃上清液,每孔加入150 μL二甲基亚砜(dimethylsulfoxide,DMSO),在37 ℃ 500 r/min微孔板振荡仪振荡10 min,在490 nm用酶标仪检测OD值,测定细胞存活率。
1.9 氧化应激模型构建
将对数期LO2细胞,以细胞密度为1×105 cells/mL接种至96孔板中,每孔加入100 μL细胞悬液培养24 h,实验分为样品组和对照组,样品组每孔加入100 μL乙醇溶液(1640培养基配制),使终体积分数为1%、2%、3%、4%、5%,对照组每孔加入100 μL不完全培养基,继续培养细胞24 h后测细胞存活率,测定方法同1.8。
1.10 CGH对乙醇诱导损伤LO2细胞的保护作用
取对数期LO2细胞,以细胞密度为1×105 cells/mL接种至96孔板中,每孔加入100 μL细胞悬液培养6 h,实验分为样品组、酒精组和对照组。待细胞贴壁后,样品组中每孔加入100 μL样品溶液,使样品终质量浓度为25、50、75、100、200 μg/mL,对照组和酒精组各加入100 μL不完全培养基,继续培养24 h,24 h 后对照组加入100 μL不完全培养基,样品组和酒精组加入100 μL终体积分数为4%的乙醇溶液,将96孔板继续培养24 h,24 h后测细胞存活率,测定方法同1.8。
1.11 CGH对LO2细胞内ROS的清除能力测定
参照文献[11]的方法测定细胞内ROS的清除能力。
1.12 数据处理
实验中的数据均以平均值±标准偏差表示。用SPSS Statistics19.0进行统计学分析,数据间的显著性差异采用单因素方差分析[最小显著差别(least significant difference,LSD)检验],P<0.05为差异性显著水平。用Graph Pad Prism 5绘制图表。
2 结果与分析
2.1 CGH体外抗氧化活性分析
如表1所示,CGH能够有效清除·OH、DPPH自由基和提高Fe2+螯合能力,且在一定范围浓度内,抗氧化活性随着CGH浓度的增加而递增;当CGH的蛋白质量浓度在2 mg/mL时,其对·OH清除率、DPPH自由基清除率和Fe2+螯合能力分别为(86.69±0.022)%、(60.56±0.369)%和(91.58±0.025)%,表明CGH具有良好的抗氧化活性。
表1 CGH的浓度对·OH清除能力、DPPH自由基清除能力和Fe2+螯合能力的影响 单位;%
Table 1 Effects of CGH concentration on ·OH scavenging rate,DPPH free radical scavenging rate and Fe2+ chelating rate

指标CGH浓度0.125 mg/mL0.25 mg/mL0.5 mg/mL1 mg/mL2 mg/mL4 mg/mL·OH清除率(IC50=0.61 mg/mL)26.4±0.131.8±0.138.1±0.156.2±0.186.7±0.176.1±0.1DPPH自由基清除率(IC50=3.96 mg/mL)11.0±0.122.2±0.134.7±0.139.5±0.160.6±0.431.4±0.1Fe2+螯合能力(IC50=0.78 mg/mL)3.1±0.17.8±0.123.8±0.172.4±0.191.6±0.187.3±0.1
从表1中可以看出,CGH具有很好的·OH清除能力、DPPH自由基清除能力和Fe2+螯合能力。酶法改性使得一些配位能力较强的基团例如羰基裸露出来,易于与Fe2+发生络合反应,使其具有更好的金属离子鳌合能力[14]。CGH良好的金属螯合能力可以通过螯合Fe2+来阻止Fe2+与H2O2反应产生·OH。同时,CGH中一些疏水性基团的暴露,增强了其与DPPH自由基反应能力,从而提升了对DPPH自由基的清除能力。这与王晓杰等[14]的研究一致。以上结果表明CGH既是良好的供氢体,也是Fe2+螯合剂,能通过抑制Fenton反应而减少羟基的生成,提高自由基的清除能力,从而消除自由基对机体造成的氧化性损伤。
2.2 CGH对LO2细胞存活率的影响
如图1所示,不同浓度的CGH对LO2细胞存活率存在显著性差异(P<0.05),与对照组相比,CGH质量浓度为12.5~2 000 μg/mL时,细胞存活率均大于对照组细胞存活率,即可在此浓度范围内进行后续试验研究。
从图1中可以看出质量浓度为25~2 000 μg/mL时,细胞存活率显著高于空白对照组(P<0.05),这是由于水解物中的一些小分子肽作为营养物质被细胞吸收,从而促进了LO2细胞的增殖。

图1 CGH对LO2细胞存活率的影响
Fig.1 The effect of CGH on the survival rate of LO2 cells
注:不同小写字母表示样本间差异有统计学意义(P<0.05)(下同)
2.3 乙醇诱导LO2细胞损伤的模型建立
乙醇在细胞代谢过程中会产生大量的ROS和超氧阴离子,过量的自由基可引起氧化应激,最终导致细胞凋亡[15-17]。
乙醇诱导损伤LO2细胞模型的建立,是利用一定浓度的乙醇溶液作用细胞,使细胞损伤程度在60%~70%,然后完成生物活性物质相应功能的评价。因此,有必要探索在不同浓度乙醇条件下,LO2细胞存活率的情况,确定乙醇诱导损伤LO2细胞的最佳作用浓度。通过MTT法测定不同体积分数0.5%、1%、2%、3%、4%、5%乙醇对LO2细胞存活率的影响,不同浓度乙醇作用LO2细胞24 h,然后测定细胞存活率,结果如图2所示。

图2 乙醇浓度对LO2细胞存活率的影响
Fig.2 The effect of ethanol concentration on the survival rate of LO2 cells
从图2中可以看出,不同浓度的乙醇对LO2细胞的生长均有一定抑制作用,且细胞存活率随乙醇浓度的增加而减小,各乙醇浓度处理组与对照组相比均有极显著差异(P<0.05)。在乙醇体积分数为4%时,LO2细胞的存活率为(73.22±3.88)%,此浓度下的乙醇溶液对细胞损伤效果显著(P<0.05)。在光学显微镜下观察不同浓度乙醇处理的细胞形态,发现正常培养的细胞呈梭形,形态完整,大小均一;乙醇体积分数为0.5%、1%、2%时,细胞的形态与正常组基本无差异,乙醇体积分数为3%、4%时,细胞密度显著减少(P<0.05),形态未有显著变化;乙醇体积分数为5%时,细胞密度显著减少(P<0.05)且大部分细胞已经失去原有细胞形态。因此建模时乙醇的最佳体积分数可选取4%。这与黄素琼等[13]的研究结果一致。
2.4 CGH对乙醇诱导LO2细胞氧化损伤的保护作用
利用前期已建立成功的乙醇诱导损伤LO2细胞模型,研究CGH对乙醇诱导氧化损伤LO2细胞的影响。实验中,乙醇体积分数为4%,样品的质量浓度梯度为25、50、75、100、200 μg/mL。结果如图3所示。
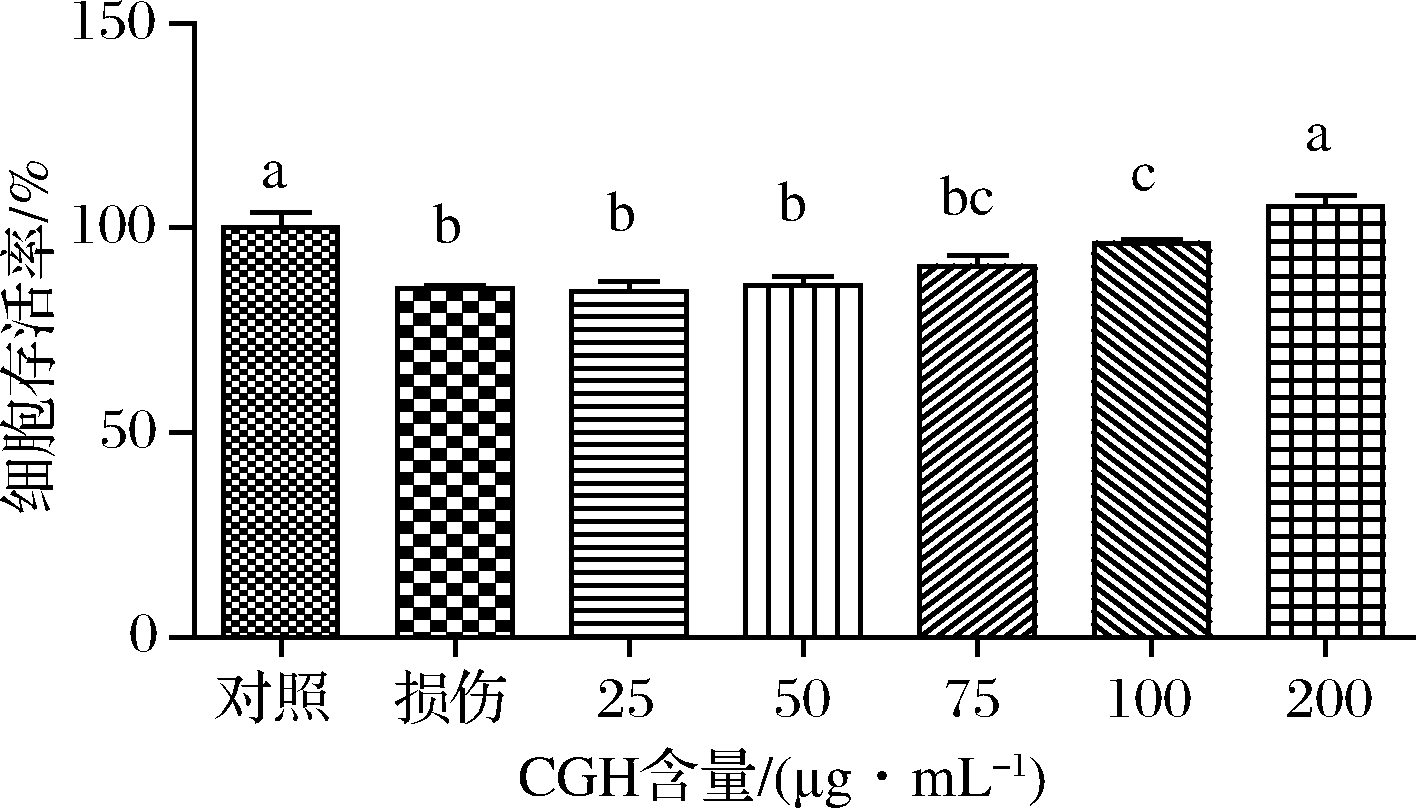
图3 CGH对乙醇诱导LO2细胞氧化损伤的影响
Fig.3 Effect of CGH on ethanol induced oxidative damage in LO2 cells
从图3中可以看出,模型组的LO2细胞存活率只有(87.58±4.37)%,而加入不同浓度CGH的LO2细胞存活率均高于(87.58±4.37)%,即适当浓度的CGH可显著提高LO2细胞存活率(P<0.05)。以上结果表明CGH可以有效降低乙醇诱导LO2细胞的氧化损伤作用,且随着CGH浓度的升高,其对LO2细胞的保护作用愈加明显。推测CGH能够增强细胞内抗氧化酶系活力,提高细胞抗氧化能力,进而抵御氧化损伤,保护细胞。任娇艳等[15]发现河蚬酶解物能够有效降低乙醇诱导LO2细胞的氧化损伤作用,且不同浓度酶解物作用细胞后的细胞存活率的趋势与本实验结果一致。
2.5 CGH对乙醇损伤后LO2细胞内ROS含量的调节作用
ROS是细胞内氧分子结合电子后的产物,包括超氧阴离子、H2O2和·OH等,在细胞中能与生物大分子结合,破坏其生理活性,进而对细胞造成损伤。图4为不同浓度CGH作用LO2细胞后,细胞内ROS相对水平。

图4 CGH对乙醇损伤后的LO2细胞内ROS含量的影响
Fig.4 Effect of CGH on ROS content in LO2 cells after ethanol injury
从图4中可以看出,与对照组相比,经4%乙醇诱导损伤后的LO2细胞中ROS含量显著提高(P<0.05),表明乙醇诱导氧化应激导致LO2细胞内ROS含量大量积累。与损伤组相比,经不同浓度CGH预处理后LO2细胞内ROS含量显著下降(P<0.05)。CGH在25 μg/mL时对处理组细胞内ROS清除能力较损伤组提高约3倍。
图5中的系列照片表示的是CGH在不同浓度下预处理LO2细胞后,用荧光倒置显微镜拍摄的细胞荧光照片。其中图5-a为对照组,图5-b为4%乙醇诱导损伤组,图5-c~图5-e依次为蛋白质量浓度为25、50、100 μg/mL CGH预处理组。
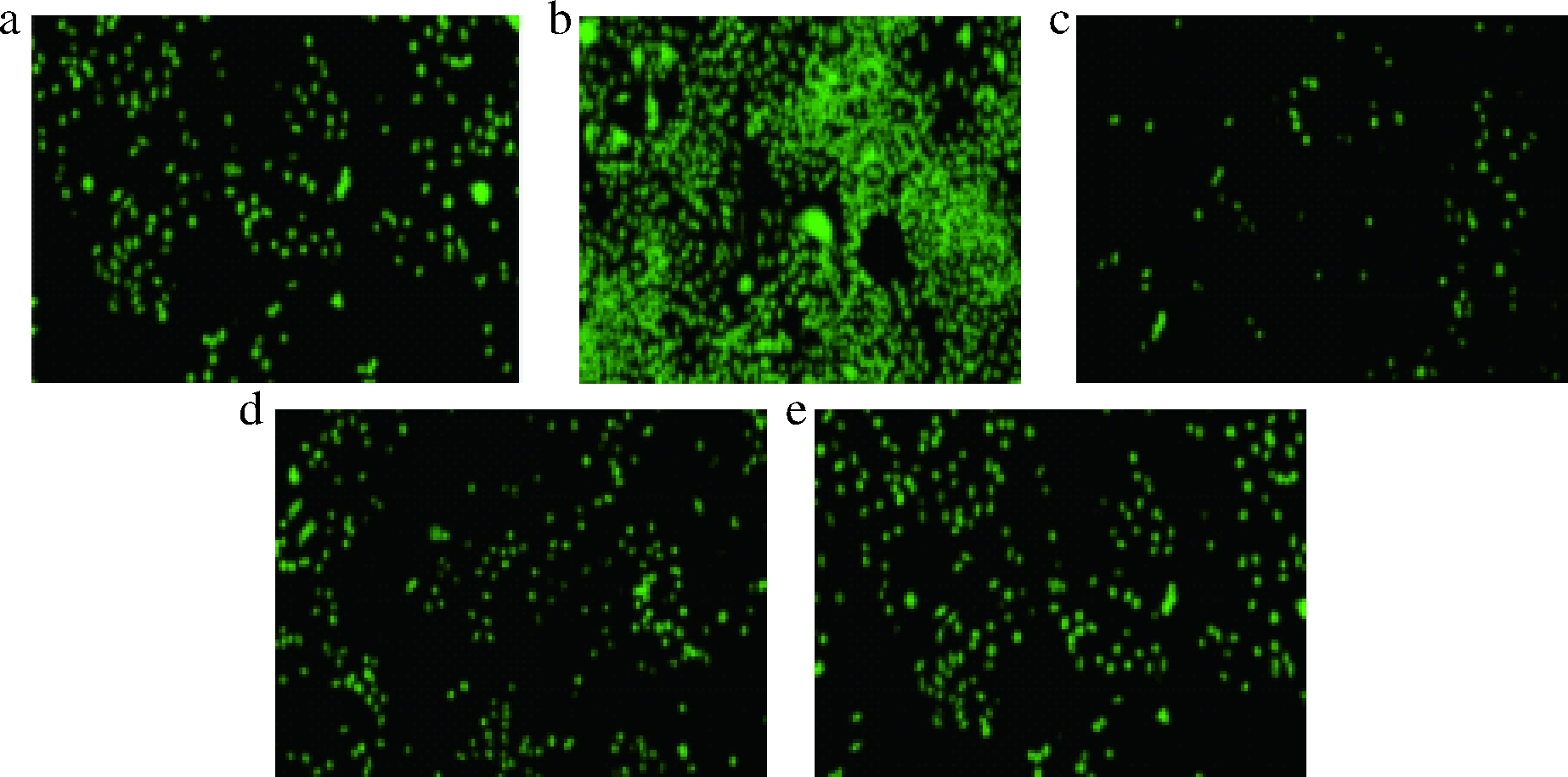
a-对照;b-损伤;c-25 μg/mL蛋白;d-50 μg/mL蛋白;e-100 μg/mL蛋白
图5 LO2荧光图片
Fig.5 LO2 cell fluoresence photograph
从图5中可以看出,LO2细胞经乙醇诱导损伤后,细胞内ROS含量较高,荧光强度强。可能是乙醇进入LO2细胞内,使细胞内ROS含量增加进而导致细胞氧化损伤,当DCFH进入细胞后,被细胞内ROS氧化成DCF,使细胞内荧光强度增强,ROS值变大。经不同浓度的CGH处理细胞,细胞内的荧光强度均有所减弱。综合图4和图5可以看出,当CGH质量浓度为25 μg/mL时,ROS含量最低,荧光强度最弱。可能是低浓度的CGH可以正向调节Nrf2通路,进而减少ROS的产生,而高浓度的CGH会激活Nrf2通路的逆反应,削弱CGH对ROS的清除能力。我们推测是CGH中含有一定量的谷氨酰胺,谷氨酰胺能够通过调节Nrf2通路减轻因乙醇引起的细胞氧化损伤,减少ROS的产生,进而保护细胞免受氧化应激损伤[16]。WANG等[17]以玉米蛋白为原料,研究玉米蛋白对氧化损伤的肝癌细胞的ROS清除能力的影响,发现玉米蛋白具有很好的ROS清除能力。
2.6 CGH对LO2细胞内SOD的影响
超氧化物歧化酶(superoxide dismutase,SOD)在人体氧化和抗氧化的平衡中起作用,可以通过清除过量的超氧阴离子自由基来保护细胞[18]。图6为不同浓度CGH作用乙醇诱导损伤的LO2细胞后,细胞内SOD活力。

图6 CGH对乙醇诱导损伤的LO2细胞内SOD活力的
影响
Fig.6 Effect of CGH on SOD activity in LO2 cells injured by ethanol
从图6中可以看出,LO2细胞在经乙醇诱导损伤后,细胞内SOD活力显著降低(P<0.05)。与氧化损伤组相比,CGH预处理后再进行氧化损伤,测得的细胞内SOD活力得到显著提高(P<0.05),CGH在50 μg/mL时,使损伤的细胞内SOD活力提高了24 U/mg prot。可以看出,一旦细胞内氧化还原状态失衡,CGH可提高SOD活力,使细胞免受氧化损伤。
2.7 CGH对LO2细胞内GR和GSH水平的影响
谷胱甘肽还原酶(glutathione reductase,GR)可以催化谷胱甘肽二硫化物(glutathione disulfide,GSSH)还原为GSH,GSH负责清除细胞内过量自由基[19],在保护细胞免受氧化损伤中发挥着重要的作用。不同浓度CGH作用LO2细胞后,细胞内GR活力和GSH水平如图7所示。

a-GR活力;b-GSH水平
图7 CGH对乙醇诱导损伤的LO2细胞内GR活力和GSH水平的影响
Fig.7 Effect of CGH on GR activity and GSH level in ethanol induced LO2 cells
从图7中可以看出,乙醇作用细胞后,细胞内的GR活力和GSH水平显著降低(P<0.05),经一定浓度的CGH预处理后的LO2细胞GR活力和GSH水平较损伤组显著升高(P<0.05)。表明CGH能够提高乙醇诱导损伤细胞内的GR活力和GSH水平,减轻乙醇对LO2细胞的氧化损伤,可能是CGH调控了谷胱甘肽系统,提升了GR的活性,清除细胞内过量自由基,进而起到保护细胞的作用。WANG等[19]研究了玉米蛋白抗氧化肽对HepG2细胞内抗氧化酶活力和总GSH水平的调控作用,结果表明玉米肽可以提高过氧化氢诱导损伤细胞的抗氧化酶活力。
3 结论
CGH具有良好的体外抗氧化活性,CGH的·OH清除率、DPPH自由基清除率和Fe2+螯合率的IC50值分别为0.61、3.96、0.79 mg/mL。细胞试验表明CGH对细胞无毒性作用,且能显著改善乙醇诱导LO2细胞氧化应激损伤。CGH能够降低细胞内的ROS水平,还能提高SOD和GR的活力及GSH水平,对乙醇诱导LO2细胞氧化损伤具有较为明显的保护作用。本研究为玉米源抗氧化功能食品及食品基料奠定理论基础。
[1] ZHAO P, LI T, LI Z, et al.Preparation of gold nanoparticles and its effect on autophagy and oxidative stress in chronic kidney disease cell model[J].Journal of Nanoscience and Nanotechnology, 2021, 21(2):1 266-1 271.
[2] CORDANI M, S NCHEZ-
NCHEZ- LVAREZ M, STRIPPOLI R, et al.Sestrins at the interface of ROS control and autophagy regulation in health and disease[J].Oxidative Medicine and Cellular Longerity, 2019. DOI:10.1155/2019/8794612.
LVAREZ M, STRIPPOLI R, et al.Sestrins at the interface of ROS control and autophagy regulation in health and disease[J].Oxidative Medicine and Cellular Longerity, 2019. DOI:10.1155/2019/8794612.
[3] 何福林, 黄丽佳, 游周敏, 等.蓬蒿籽多酚提取工艺的响应面优化及其对食用油脂抗氧化活性研究[J].中国油脂, 2020, 45(9):67-71;76.
HE F L, HUANG L J, YOU Z M, et al.Optimization of extraction process of polyphenols from Chrysanthemum coronarium seeds with response surface methodology and its antioxidant activity on edible oils[J].China Oils and Fats, 2020, 45(9):67-71;76.
[4] 陈加蓓, 李贵, 陈璇, 等.湘西“蒿菜粑粑”原料植物鼠麴草营养评价及抗氧化活性分析[J].食品与发酵工业, 2021,47(18):165-174.
CHEN J B, LI G, CHEN X, et al.Nutritional evaluation and antioxidant activity analysis of gnaphalium affine the raw material plant of "Haocaibaba" from Xiangxi region[J].Food and Fermentation Industries, 2021,47(18):165-174.
[5] 冯琳, 常明, 唐年初.不同菌种发酵枸杞酵素对酒精性肝损伤的保护作用[J].食品与发酵工业, 2021,47(17):98-104.
FENG L, CHANG M, TANG N C. Protective effects on alcoholic liver injury by fermented Lycium barbarum juice[J]. Food and Fermentation Industries, 2021, 47(17):98-104.
[6] MORENO-MACIAS H, ROMIEU I.Effects of antioxidant supplements and nutrients on patients with asthma and allergies[J].Journal of Allergy and Clinical Immunology, 2014, 133(5):1 237-1 244.
[7] 刘玥, 刘晓兰, 郑喜群, 等.复合蛋白酶水解玉米谷蛋白产物的抗氧化活性研究[J].食品与机械, 2015, 31(1):141-145.
LIU Y, LIU X L.ZHENG X Q,et al.Antioxidant activity of hydrolysate from corn glutelin by protamex[J].Food and Machinery, 2015, 31(1):141-145.
[8] 徐素玲, 卢帮贵, 李镁娟.木瓜蛋白酶改性玉米谷蛋白水溶性的工艺优化[J].食品与机械, 2013, 29(4):190-193.
XU S L, LU B G, LI M J.Optimization on modification technology of corn glutelin water-solubility with papain[J].Food and Machinery, 2013, 29(4):190-193.
[9] 刘洁, 孙小红, 郭兴凤.玉米谷蛋白酶解产物还原能力的影响因素研究[J].粮食与饲料工业, 2014, 12(1):30-34.
LIU J, SUN X H,GUO X F.The influcing factors of reducing capacity of corn glutelin hydrolysate[J].Cereal and Feed Industry, 2014, 12(1):30-34.
[10] LI H M, HU X, GUO P, et al.Antioxidant properties and possible mode of action of corn protein peptides and zein peptides[J].Journal of Food Biochemistry, 2010,34:44-60.
[11] LU C R, LI C, CHEN B, et al.Composition and, antioxidant, and anti-HepG2 cell activities of polyphenols from seed coat of Amygdalus pedunculata Pall[J].Food Chemistry, 2018, 265:111-119.
[12] 杨翠, 卓婷烨, 李祖明, 等.玉米谷蛋白抗氧化肽的分离纯化与活性研究[J].粮食与油脂, 2018, 31(3):45-48.
YANG C, ZHUO T Y, LI Z M, et al.Study on separation and purification of antioxidant peptides from corn glutelin and their activities[J].Cereals & Oils, 2018, 31(3):45-48.
[13] 黄素琼, 侯英, 王晓栋, 等.枳葛口服液含药血清对乙醇诱导LO2肝细胞氧化损伤的抗氧化作用[J].实用医学杂志, 2019, 35(10):1 550-1 554.
HUANG S Q, HOU Y, WANG X D, et al.Antioxidation of serum containing Zhige oral solution on ethanol induced oxidative injury in LO2 hepatocyte[J].The Journal of Practical Medicine, 2019, 35(10):1 550-1 554.
[14] 王晓杰, 刘晓兰, 丛万锁, 等.壳寡糖酶法糖基化修饰对玉米醇溶蛋白功能性质的影响[J].食品科学, 2018, 39(8):13-20.
WANG X J, LIU X L, CONG W S, et al.Effect of transglutaminase-catalyzed glycosylation with chitosan on the functional properties of zein[J].Food Science, 2018, 39(8):13-20.
[15] 任娇艳, 尚帅明, 梁明, 等.河蚬酶解物对乙醇诱导肝细胞LO2损伤的保护作用[J].华南理工大学学报(自然科学版), 2017, 45(12):20-26.
REN J Y, SHANG S M, LIANG M, et al.Protective effect of Corbicula fluminea hydrolyzates on ethanol-induced LO2 cells injury[J].Journal of South China University of Technology (Natural Science Edition), 2017, 45(12):20-26.
[16] VARONI M V, PASCIU V, GADAU S D, et al.Possible antioxidant effect of Lycium barum polysaccharides on hepatic cadmium-induced oxidative stress in rats[J].Environmental Science and Pollution Research, 2017, 24(3):2 946-2 955.
[17] WANG L Y, DING L, XUE C M, et al.Corn gluten hydrolysate regulates the expressions of antioxidant defense and ROS metabolism relevant genes in H2O2-induced HepG2 cells[J].Journal of Functional Foods, 2018, 42:362-370.
[18] 温斐婷. 基于HepG2细胞研究高浓度槲皮素促氧化的作用和机制[D].无锡:江南大学, 2016.
WEN P T.The prooxidant effect of high concentration quercetin on HepG2 cells and its potential mechanism[D].Wuxi:Jiangnan University, 2016.
[19] WANG L Y, DING L, YU Z P, et al.Intracellular ROS scavenging and antioxidant enzyme regulating capacities of corn gluten meal-derived antioxidant peptides in HepG2 cells[J].Food Research International, 2016, 90:33-41.