科技发展提高人类生活质量的同时,也形成了不良生活方式和不健康饮食习惯,大大增加了便秘、炎症性肠病等肠道疾病[1-3]。其中便秘的患病率最高,大约30%的人在一生中会经历便秘不适,老年人和妇女受之影响更甚[4]。长期便秘的患者,由于粪便在肠道内停留过久,导致肠道内有害物质增多,对肠黏膜完整和肝脏代谢造成损伤[5]。人类肠道中大约有1 014种微生物定植,统称为肠道菌群,它们相互制约,相互依存[6],在发挥宿主生理功能、抵抗感染和自身免疫性疾病的风险方面发挥着重要作用[7]。肠道菌群的多样性受到病理状况、遗传、饮食习惯、药物和环境等多因素的影响[8]。肠道菌群的变化与疾病的发生密切相关[9]。肠道菌群的破坏还会影响短链脂肪酸的产生,进而降低胰高血糖素肽的产生,抑制肠道的传递功能,进一步影响胃肠道动力学[10-11]。而肠道是重要的消化器官,对肠道的损伤可能导致营养吸收障碍和对身体的营养供应不足[12],进而引发其他疾病。
目前,顽固性便秘主要依赖药物治疗,但存在腹泻、腹痛、药物依赖等副作用[13]。临床实践证实,益生菌在治疗便秘过程中发挥较好的效果,安全无副作用。目前常用于治疗便秘的益生菌有干酪乳杆菌、副干酪乳杆菌、植物乳杆菌、鼠李糖乳杆菌、两歧双歧杆菌、嗜热链球菌等[14-16],缓解便秘效果较好。
在本研究中,我们通过16S rRNA基因的V3~V4可变区进行Miseq测序,分析复方地芬诺酯导致小鼠便秘后肠道菌群的变化,以及干酪乳杆菌干预便秘小鼠后肠道菌群变化。通过探究干酪乳杆菌对便秘小鼠肠道菌群结构及菌落丰富度的影响,推测干酪乳杆菌降解肠道毒素的益生途径。研究结果可为干酪乳杆菌缓解便秘作用机制提供科学依据,也能够拓宽干酪乳杆菌的益生功能和应用范围。
1 材料与方法
1.1 实验材料
1.1.1 实验动物
SPF级健康、昆明小鼠(生产许可证号:SYXK(川)2018-119)72只,4~5周龄,体重(20±2)g,成都达硕实验动物有限公司,饲养环境温度22 ℃,12 h 明暗交替,自由进食、饮水。
1.1.2 仪器与试剂
Arktik PCR仪、NanoDrop 2000超微量分光光度计,赛默飞世尔科技公司;MISEQ测序仪、Illumina高通量测序仪,Illumina公司;QuantiFluorTM-ST 蓝色荧光定量系统,Promega公司。
试验菌株为课题组前期从8名3~8岁健康儿童粪便中筛选的具有高效降解3-甲基吲哚能力的干酪乳杆菌。MS培养基,北京路桥技术有限公司;复方地芬诺酯片,河南鼎昌药业有限公司。
1.2 实验方法
1.2.1 饲料制备
基础饲料,成都达硕实验动物有限公司提供;营养成分具体为(质量分数):水分7.3%,粗蛋白质21.1%,粗纤维3.2%,粗脂肪5.4%,粗灰分6.0%,总磷0.94%,钙1.22%。
1.2.2 溶液的制备
复方地芬诺酯溶液:复方地芬诺酯片每片含复方地芬诺酯2.5 mg,小鼠便秘模型灌胃复方地芬诺酯溶液的计量为20 mg/(kg BW·d)。
1.2.3 小鼠便秘模型建立
昆明雄性小鼠72只,4周龄,体重(20±2)g,体形丰满,营养良好,行动灵敏,饮食、饮水及粪便正常。在实验环境下给予基础饲料,自由进食和饮水,适应性喂养1周后,随机选取12只小鼠作为正常对照组[平均体重为(26.12±0.63)g],灌胃0.5 mL生理盐水;其余60只小鼠作为便秘组[平均体重为(26.54±1.19)g],灌胃剂量为20 mg/(kg BW·d)复方地芬诺酯溶液,共计7 d。每天称量小鼠体重,并根据体重调整灌胃量。每天记录小鼠的饮食饮水量,收集每组小鼠在灌胃后6 h的粪便,计算小鼠粪便粒数、新鲜粪便质量及含水率,计算如公式(1)所示。以其均显著低于正常对照组,确定便秘小鼠造模成功,挑取造模成功的小鼠进行后续试验。
粪便中含水率![]()
(1)
式中:A,新鲜粪便质量,g;B,烘干后粪便质量,g。
1.2.4 小鼠分组
正常对照组12只小鼠,便秘小鼠按体重随机分成5组,每组12只。分组如表1所示。
表1 动物实验分组情况
Table 1 Experiments in rats grouping

序号组别数量/只受试物A正常对照组 12生理盐水B模型对照组 12复方地芬诺酯[20 mg/(kg BW·d)]+生理盐水C干酪乳杆菌低剂量组12复方地芬诺酯[20 mg/(kg BW·d)]+干酪乳杆菌(1×106 CFU/mL)D干酪乳杆菌中剂量组12复方地芬诺酯[20 mg/(kg BW·d)]+干酪乳杆菌(1×108 CFU/mL)E干酪乳杆菌高剂量组12复方地芬诺酯[20 mg/(kg BW·d)]+干酪乳杆菌(1×1010 CFU/mL)F阳性对照组 12复方地芬诺酯[20 mg/(kg BW·d)]+嗜热链球菌(1×108 CFU/mL)
饲喂时严格按实验动物操作规程进行,饲养环境温度22~27 ℃,相对湿度50%~70%,12 h明暗交替,每天上午9点称量与添加饲料、计算饮水量并更换饮水瓶,清洗托盘,即时清除粪便等。每天10点开始灌胃,正常对照组与模型对照组小鼠灌胃生理盐水,阳性对照组灌胃嗜热链球菌,其余各组便秘小鼠灌胃相应浓度的干酪乳杆菌。饲养时间共计3 d。
1.2.5 样本收集
实验期间,每天灌胃后将小鼠放入高压灭菌代谢笼,在灌胃6 h后收集各组小鼠粪便,称量粪便质量、计数粪便粒数,新鲜粪便于60 ℃烘箱中烘干后计算粪便含水率。同时,无菌收集10粒新鲜粪便,分装于2个灭菌EP管中,放入-80 ℃的冰箱保存。
1.2.6 小鼠粪便DNA提取
小鼠粪便中微生物群落总DNA抽提根据 E.Z.N.A.® soil DNA kit说明书进行。接着使用1%的琼脂糖凝胶电泳(5 V/cm,20 min)检测DNA的提取质量,使用NanoDrop 2000微量分光光度计测定DNA浓度和纯度(A260/230和A260/280)。
1.2.7 16S rRNA基因V3~V4可变区的PCR扩增
以1.2.6中提取的细菌基因组DNA为模板,引物为338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′),对16S rRNA基因V3~V4可变区进行PCR扩增。
1.2.8 PCR产物回收
PCR产物用2.0%琼脂糖凝胶电泳检测,使用AxyPrep DNA凝胶回收试剂盒回收纯化,并用QuantiFluorTM-ST蓝色荧光定量系统对回收产物进行检测定量,之后按照每个样本的测序量要求,进行相应比例的混合。
1.2.9 小鼠肠道微生物群落结构的高通量测序分析
构建PE 300文库,利用Illumina公司的Miseq PE300平台进行测序,由上海美吉生物医药科技有限公司完成测序。
1.3 小鼠肠道菌群Alpha多样性分析
使用UCHIME软件将嵌合体序列去除,抽平后根据UPARSE软件中相似度的默认值97%对序列进行操作分类单元(operational taxonomic units,OTU)的聚类。采用RDP classifier贝叶斯算法对97%相似水平的OUT代表序列进行分类学分析,并在各个分类水平统计各样本的群落组成。每组实验数据以平均数±标准差(x±δ)表示,多组间比较采用单因素方差分析最小显著差别(least significant difference,LSD)法,P<0.05为差异有统计学意义。
2 结果与分析
2.1 干酪乳杆菌对便秘小鼠粪便粒数、质量、含水率的影响
由表2可以看出,与正常对照组相比,各便秘组小鼠粪便粒数显著降低(P<0.05),粪便粒数仅为正常对照组的29.17%~34.38%。干酪乳杆菌干预后,小鼠粪便粒数逐渐稳步上升。干预3 d后,干酪乳杆菌低、中、高剂量组小鼠粪便粒数分别为模型对照组的1.78、1.67、1.60倍(P<0.05);其中效果最好的为低剂量组,优于阳性对照组(P>0.05)。
表2 干酪乳杆菌对便秘小鼠粪便粒数的影响
Table 2 Effect of Lactobacillus casei on fecal number of constipated mice

组别0 d1 d2 d3 dA192±2a194±7a190±4a174±4aB58±3b72±5b63±3c67±5cC56±5b73±3b94±4b119±4bD66±4b79±7b85±7b112±2bE63±4b83±6b100±7b107±7bF57±5b78±5b82±5b116±3b
注:不同小写字母表示差异显著(P<0.05)(下同)
由表3可知,与正常对照组相比,便秘组小鼠粪便重量明显减少,仅为正常对照组的31.31%~39.39%(P<0.05)。干酪乳杆菌干预后,各组便秘小鼠粪便重量均有增加趋势。干预3 d后,干酪乳杆菌低、中、高剂量组粪便质量分别为模型对照组的1.98、2.18、2.16 倍(P<0.05);干酪乳杆菌中、高剂量效果较好,且与阳性对照组无显著差异(P>0.05)。
表3 干酪乳杆菌对便秘小鼠粪便质量的影响 单位:g
Table 3 Effect of Lactobacillus casei on fecal weight of constipated mice
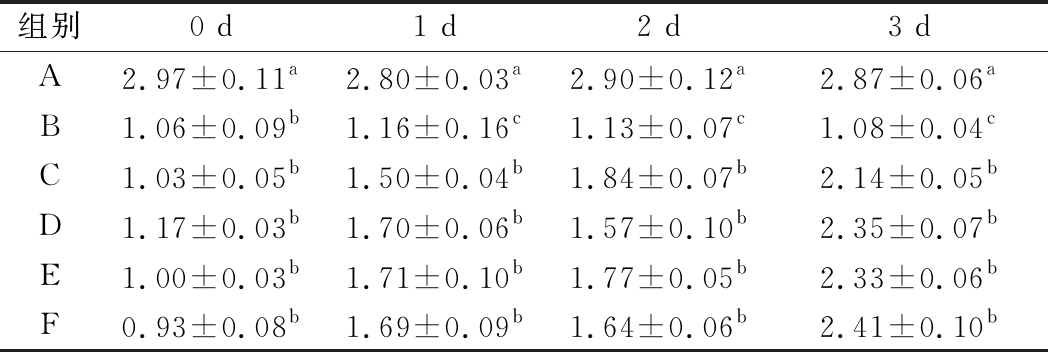
组别0 d1 d2 d3 dA2.97±0.11a2.80±0.03a2.90±0.12a2.87±0.06aB1.06±0.09b1.16±0.16c1.13±0.07c1.08±0.04cC1.03±0.05b1.50±0.04b1.84±0.07b2.14±0.05bD1.17±0.03b1.70±0.06b1.57±0.10b2.35±0.07bE1.00±0.03b1.71±0.10b1.77±0.05b2.33±0.06bF0.93±0.08b1.69±0.09b1.64±0.06b2.41±0.10b
从表4可以得出,与正常对照组相比,便秘小鼠粪便中的含水率显著降低,仅为正常对照组的61.41%~65.08%(P<0.05)。干酪乳杆菌干预3 d后,干酪乳杆菌低、中、高剂量组小鼠粪便含水率逐渐升高,分别为模型对照组的1.31、1.35、1.40倍(P<0.05),其中高剂量组效果最好,且均与阳性对照组无显著差异(P>0.05)。
造模结束时,便秘组小鼠粪便粒数、质量以及含水率均显著低于正常对照组。干酪乳杆菌干预3 d后,与模型对照组相比,干酪乳杆菌低、中、高剂量组小鼠的粪便粒数、质量以及含水率显著升高(P<0.05)。表明复方地芬诺酯可以通过促进肠道水分吸收,造成因肠蠕动抑制而致的小鼠便秘。干酪乳杆菌可以通过抑制肠道水分重吸收,从而增加粪便中的含水率,达到缓解便秘的作用。
表4 干酪乳杆菌对便秘小鼠粪便含水率的影响 单位:%
Table 4 Effect of Lactobacillus casei on fecal water content of constipated mice
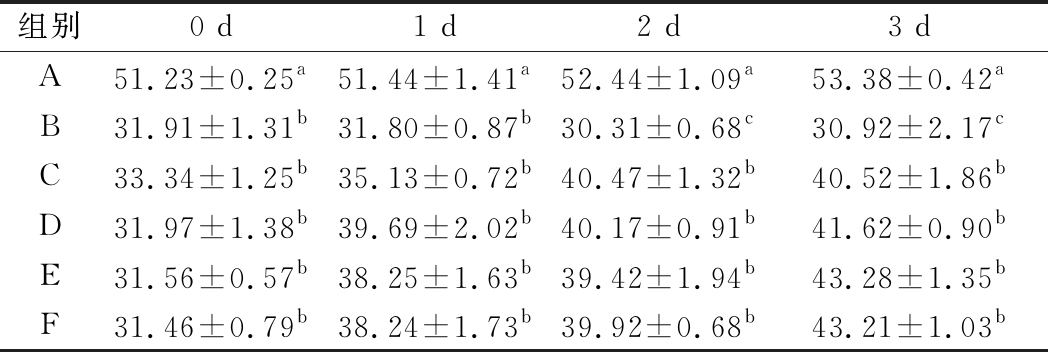
组别0 d1 d2 d3 dA51.23±0.25a51.44±1.41a52.44±1.09a53.38±0.42aB31.91±1.31b31.80±0.87b30.31±0.68c30.92±2.17cC33.34±1.25b35.13±0.72b40.47±1.32b40.52±1.86bD31.97±1.38b39.69±2.02b40.17±0.91b41.62±0.90bE31.56±0.57b38.25±1.63b39.42±1.94b43.28±1.35bF31.46±0.79b38.24±1.73b39.92±0.68b43.21±1.03b
2.2 小鼠肠道菌群Alpha多样性分析
样品中的细菌Shannon指数、Chao指数、Sobs指数、Simpson指数、Coverage指数等指标进行综合分析,实现对样品多样性进行分析。反映群落丰富度的指数有Sobs、Chao,反映群落多样性的指数有Shannon、Simpson,反映群落覆盖度的指数有Coverage。详细实验结果见表5、表6。
表5 造模结束时小鼠肠道菌群Alpha多样性分析
Table 5 Analysis of Alpha diversity of intestinal microflora in mice at the end of modeling
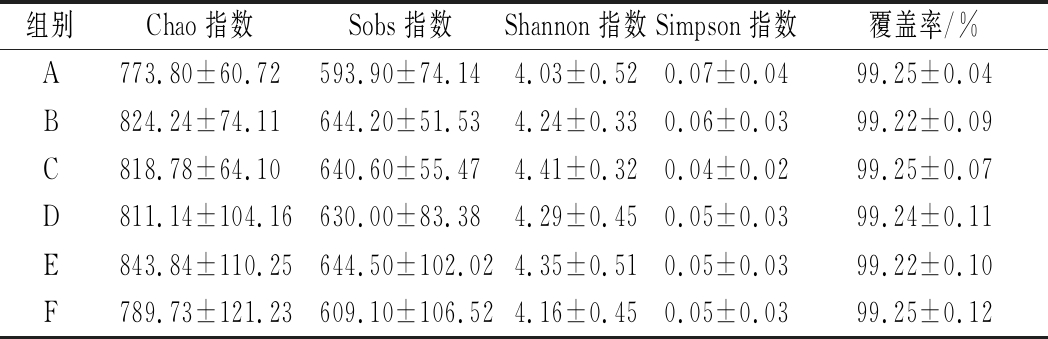
组别Chao 指数Sobs 指数Shannon 指数Simpson 指数覆盖率/%A773.80±60.72593.90±74.144.03±0.520.07±0.0499.25±0.04B824.24±74.11644.20±51.534.24±0.330.06±0.0399.22±0.09C818.78±64.10640.60±55.474.41±0.320.04±0.0299.25±0.07D811.14±104.16630.00±83.384.29±0.450.05±0.0399.24±0.11E843.84±110.25644.50±102.024.35±0.510.05±0.0399.22±0.10F789.73±121.23609.10±106.524.16±0.450.05±0.0399.25±0.12
表6 干酪乳杆菌干预后小鼠肠道菌群Alpha多样性分析
Table 6 Analysis of Alpha diversity of intestinal microflora in mice after intervention of Lactobacillus casei
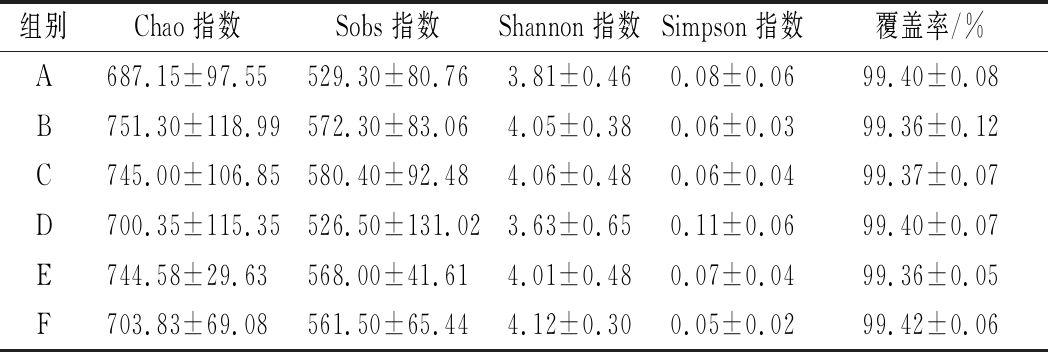
组别Chao 指数Sobs 指数Shannon 指数Simpson 指数覆盖率/%A687.15±97.55529.30±80.763.81±0.460.08±0.0699.40±0.08B751.30±118.99572.30±83.064.05±0.380.06±0.0399.36±0.12C745.00±106.85580.40±92.484.06±0.480.06±0.0499.37±0.07D700.35±115.35526.50±131.023.63±0.650.11±0.0699.40±0.07E744.58±29.63568.00±41.614.01±0.480.07±0.0499.36±0.05F703.83±69.08561.50±65.444.12±0.300.05±0.0299.42±0.06
在做干酪乳杆菌干预实验前,随机在各组小鼠中选择几只进行肠道菌群结构分析,无显著差异。造模后,与正常对照组相比,其余各组的Chao指数较高。此外,Chao指数是Sobs数目的1.3倍左右,表明本研究的细菌多样性测序深度达到了丰富度估计值的77%左右。便秘组小鼠Shannon指数、Simpson指数均高于正常对照组,表明小鼠便秘后肠道菌群多样性有所降低,且各组间差异不大。所有样品的覆盖率介于99.22%~99.25%,表明粪便中几乎所有的细菌物种信息都能被检测到。
与模型对照组相比,干酪乳杆菌干预的3组便秘小鼠的Chao指数是Sobs数目的1.3倍左右,表明本研究的细菌多样性测序深度达到了丰富度估计值的77%左右。与模型对照组相比,干酪乳杆菌低剂量组和阳性对照组的Shannon指数升高,而干酪乳杆菌中剂量组、高剂量组降低,表明干酪乳杆菌低剂量组、阳性对照组菌群多样性较高,而干酪乳杆菌中剂量组、高剂量组较低。Simpson指数介于0.05~0.11,菌群多样性差异不大。所有样品的覆盖率介于99.36%~99.42%,表明干预后小鼠粪便中几乎所有的细菌物种信息都能被检测到。
2.3 基于门水平上小鼠肠道菌群细菌分类学分析
便秘模型造模试验结束时,6组小鼠肠道菌群隶属于1域,1界,15门,21纲,41目,74科,180属,317种。与干酪乳杆菌干预后相比,在门水平上增加了梭杆菌门(Fusobacteria)和浮霉菌门(Planctomycetes)。在门水平上对优势菌群进行分析,结果如图1所示。优势菌群为拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)。

图1 门水平上便秘小鼠肠道细菌优势菌群分析
Fig.1 Analysis of predominant bacterial microflora in intestinal tract of constipated mice at phylum level
干酪乳杆菌干预试验完成后,6组小鼠的肠道菌群包含1域,1界,13门,19纲,39目,81科,198属,335种。其中13门分别为拟杆菌门、放线菌门(Actinobacteria)、厚壁菌门、变形菌门、疣微菌门(Verrucomicrobia)、柔膜菌门(Tenericutes)、螺旋体门(Spirochaetes)、Patescibacteria菌门、Epsilonbacteraeota门、异常球菌-栖热菌门(Deinococcus-Thermus)、脱铁杆菌门(Deferribacteres)、蓝细菌门(Cyanobacteria)和未分类到门的细菌(unclassified-k-norank-d-Bacteria)。在门水平上对优势菌群进行分析,结果如图2所示。优势菌群为拟杆菌门、厚壁菌门、变形菌门、放线菌门、Epsilonbacteraeota门。
以上结果提示干酪乳杆菌干预试验完成后,6组小鼠肠道菌群中优势菌群发生改变,灌胃干酪乳杆菌可以调节小鼠肠道菌群。

图2 门水平上干酪乳杆菌干预便秘小鼠后肠道细菌优势菌群分析
Fig.2 Analysis of predominant bacterial microflora in intestinal after intervention of Lactobacillus casei at phylum level in constipated mice
2.4 基于属水平上小鼠肠道菌群中优势菌群分析
如图3所示,便秘试验结束时,6组小鼠肠道菌群中的优势菌群为乳杆菌属(Lactobacillus)、norank_f_Muribaculaceae、另枝菌属(Alistipes)、Odoribacter。其中差异显著的物种有乳杆菌属、Rikenellaceae_RC9_gut_group(P<0.05),差异极显著的物种有另枝菌属、螺杆菌属(Helicobacter)、普雷沃氏菌属(Prevotellaceae-UCG-001)、嗜冷杆菌属(Psychrobacter)(P<0.01)、Prevotellaceae_NK3B31_group spp.(P<0.001)。造模后,与正常对照组相比,便秘小鼠肠道菌群中乳杆菌属、另枝菌属丰度有不同程度的降低,而普雷沃氏菌属、norank_f_Muribaculaceae spp.丰度升高。提示便秘可导致肠道菌群发生改变。

图3 属水平上便秘小鼠肠道细菌组间差异显著性检验
Fig.3 Significant difference test of intestinal bacteria between groups of constipated mice at genus level
注:*0.01<P≤0.05,**0.001<P≤0.01,***P≤0.001(下同)
如图4所示,干酪乳杆菌干预试验完成后,6组小鼠的肠道菌群中的优势菌群为norank_f_Muribaculaceae spp.、乳杆菌属、拟普雷沃菌属(Alloprevotella)、嗜冷杆菌属。其中差异显著的物种有嗜冷杆菌属、拟杆菌属(Bacteroides)、Odoribacter(P<0.05)、葡萄球菌属(Staphylococcus)(P<0.01)、螺杆菌属、普雷沃氏菌属、普雷沃氏菌科NK3B31群(Prevotellaceae_NK3B31_group)(P<0.001)。并且干酪乳杆菌干预后,与模型对照组相比,灌胃干酪乳杆菌的便秘小鼠肠道菌群中普雷沃氏菌属、norank_f_Muribaculaceae丰度降低,另枝菌属丰度升高;干酪乳杆菌中剂量组、干酪乳杆菌高剂量组、阳性对照组中乳杆菌属丰度升高。此结果表明干酪乳杆菌可以提高肠道中乳杆菌属、另枝菌属的丰度,并降低条件致病菌普雷沃氏菌属的丰度,从而改善肠道菌群。

图4 属水平上干酪乳杆菌干预便秘小鼠后肠道细菌组间
差异显著性检验
Fig.4 Significant difference test of intestinal bacteria between groups of constipated mice after intervention of Lactobacillus casei at genus level
3 结论与讨论
在动物的肠道中,各种菌群调节着肠道代谢和健康。很多研究表明新鲜粪便中菌群的变化能反映肠道内菌群的情况。通过菌群多样性分析,发现覆盖率指数越高,能够检测出样本中序列的概率也就越高;ACE指数、Chao l指数和Shannon指数越大,则表明菌群的多样性和丰富度越高;Simpson指数越大,说明群落多样性越低[17]。本研究通过高通量测序技术对便秘后小鼠和干酪乳杆菌干预后小鼠的120个粪便样品进行了测序,共获得6 132 570×2条序列。经过随机抽样将测序深度均一化、数据标准化后,有效序列数为6 132 570,每个样品的序列数为23 077,在97%的相似性水平上共划分出1 531个OTU。对菌群进行多样性分析发现,便秘组小鼠Shannon指数、Simpson指数均高于正常对照组,表明小鼠便秘后肠道菌群多样性有所降低。与模型对照组相比,干酪乳杆菌低剂量组和阳性对照组的Shannon指数升高,而干酪乳杆菌中剂量组、高剂量组降低,表明干酪乳杆菌低剂量组、阳性对照组菌群多样性较高,而干酪乳杆菌中剂量组、高剂量组的菌群多样性较低。这与靳志敏等[18]用不同剂量植物乳杆菌对小鼠肠道菌群影响的研究结果相似,说明乳杆菌对肠道微生物区系具有一定的调节作用。
研究发现,乳酸菌通过竞争肠道黏附位点及分泌抗菌物质等方式抑制病原菌的定植和生长繁殖,维持肠道健康[15]。本研究对便秘小鼠进行干酪乳杆菌干预后,乳杆菌属、另枝菌属的丰度增加,普雷沃氏菌属丰度降低。张董燕等[19]给实验动物喂卷曲乳杆菌,发现粪便菌群物种丰富度提高了,而且粪便中厚壁菌门、乳杆菌属和光岗菌属的比例也明显增加。乳杆菌属是公认的益生菌,可通过产生乳酸、乙酸、过氧化氢、细菌素等抗菌物质,在宿主肠道环境中发挥有益作用,并抑制肠道有害细菌的增长来改善宿主肠道菌群的平衡,增强宿主对病原体的防御屏障功能[20]。1项研究表明,与对照组相比,功能性便秘的成人粪便中双歧杆菌和乳酸杆菌数量明显减少[21]。在服用益生菌后,短双歧杆菌、长双歧杆菌和青春双歧杆菌的数量显著增加。对补充益生菌前后粪便的分析有助于检测益生菌引起的肠道菌群的确切变化[22]。乳杆菌属、另枝菌属属于肠道有益菌,可以保护肠道免疫系统不受外界环境刺激,增强肠道的黏膜功能,从而对炎症进行抵抗[23-24]。本实验发现便秘导致小鼠体内产生了炎症反应,在经过干酪乳杆菌干预后,干酪乳杆菌通过增加肠道中乳杆菌属、另枝菌属的丰度,以及降低条件致病菌普雷沃氏菌属的丰度,影响了肠道菌群与肠道病原体之间的竞争,从而改善肠道菌群,达到缓解便秘的作用。
对小鼠肠道菌群在属水平上进行优势菌群分析,并且进行组间差异分析发现,造模结束时6组小鼠肠道菌群中的优势菌群为乳杆菌属、norank_f_Muribaculaceae、另枝菌属、Odoribacter。其中差异显著的物种有乳杆菌属、Rikenellaceae_RC9_gut_group(P<0.05)、另枝菌属、螺杆菌属、普雷沃氏菌属、嗜冷杆菌属(P<0.01)、Prevotellaceae_NK3B31_group(P<0.001)。与正常对照组相比,便秘小鼠肠道菌群中乳杆菌属、另枝菌属丰度有不同程度的降低,而普雷沃氏菌属、norank_f_Muribaculaceae丰度升高。干酪乳杆菌干预后,小鼠肠道优势菌群为norank_f_Muribaculaceae、拟普雷沃菌属、嗜冷杆菌属、另枝菌属。其中差异显著的物种有嗜冷杆菌属、拟杆菌属、Odoribacter(P<0.05)、葡萄球菌属(P<0.01)、螺杆菌属、普雷沃氏菌属、普雷沃氏菌科NK3B31群(P<0.001)。与模型对照组相比,灌胃干酪乳杆菌的便秘小鼠肠道菌群中普雷沃氏菌属、norank_f_Muribaculaceae丰度降低,另枝菌属丰度升高;干酪乳杆菌中剂量组、干酪乳杆菌高剂量组、阳性对照组中乳杆菌属丰度升高。提示便秘可导致肠道菌群发生改变。此结果表明干酪乳杆菌可以提高肠道中乳杆菌属、另枝菌属的丰度,并降低条件致病菌普雷沃氏菌属的丰度,从而改善肠道菌群,达到缓解便秘作用。
[1] POUILLART P R, DÉPEINT F, ABDELNOUR A, et al.Nutriose, a prebiotic low-digestible carbohydrate, stimulates gut mucosal immunity and prevents TNBS-induced colitis in piglets[J].Inflammatory Bowel Diseases, 2009, 16(5):783-794.
[2] JIANG P P, SANGILD P T.Intestinal proteomics in pig models of necrotising enterocolitis, short bowel syndrome and intrauterine growth restriction[J].Proteomics Clinical Applications, 2014, 8(9-10):700-714.
[3] GONZALEZ L M, MOESER A J, BLIKSLAGER A T.Porcine models of digestive disease:The future of large animal translational research[J].Translational Research, 2015, 166(1):12-27.
[4] BHARUCHA A E, PEMBERTON J H, LOCKE G R L.American Gastroenterological Association technical review on constipation[J].Gastroenterology, 2013, 144(1):218-238.
[5] SHARMA N, DOERNER K C, ALOK P C, et al.Skatole remediation potential of Rhodopseudomonas palustris WKU-KDNS3 isolated from an animal waste lagoon[J].Letters in Applied Microbiology, 2015, 60(3):298-306.
[6] KHAN I, ULLAH N, ZHA L J, et al.Alteration of gut microbiota in inflammatory bowel disease (IBD):Cause or consequence? IBD treatment targeting the gut microbiome[J].Pathogens (Basel, Switzerland), 2019, 8(3):126-153.
[7] DELZENNE N M, KNUDSEN C, BEAUMONT M, et al.Contribution of the gut microbiota to the regulation of host metabolism and energy balance:A focus on the gut-liver axis[J].The Proceedings of the Nutrition Society, 2019, 78(3):319-328.
[8] ZHAO Y, ZHANG X.Interactions of tea polyphenols with intestinal microbiota and their implication for anti-obesity[J].Journal of the Science of Food and Agriculture, 2020, 100(3):897-903.
[9] FORD A C, LACY B E, TALLEY N J.Irritable bowel syndrome[J].The New England Journal of Medicine, 2017, 376(26):2 566-2 578.
[10] CHASSARD C, DAPOIGNY M, SCOTT K P, et al.Functional dysbiosis within the gut microbiota of patients with constipated-irritable bowel syndrome[J].Alimentary Pharmacology & Therapeutics, 2012, 35(7):828-838.
[11] WICHMANN A, ALLAHYAR A, GREINER T U, et al.Microbial modulation of energy availability in the colon regulates intestinal transit.[J].Cell Host & Microbe, 2013, 14(5):582-590.
[12] ZHANG Z, RAN C, DING Q W, et al.Ability of prebiotic polysaccharides to activate a HIF1α-antimicrobial peptide axis determines liver injury risk in zebrafish[J].Communications Biology, 2019, 2:274.
[13] NOGUERA A, CENTENO C, LIBRADA S, et al.Clinical use of oral laxatives in palliative care services in Spain[J].Supportive Care in Cancer, 2010, 18(11):1 491-1 494.
[14] 冯丽莉, 王华, 王世杰, 等.即食型乳酸菌菌粉改善肠道健康的研究[J].食品研究与开发, 2017, 38(9):34-37.
FENG L L, WANG H, WANG S J, et al.The study of the improvement of intestinal health by instant type Lactobacillus powder[J].Food Research and Development, 2017, 38(9):34-37.
[15] 田颖, 戴倩倩, 时明慧, 等.双歧杆菌BB12对便秘大鼠的通便作用及对胃肠激素的调节[J].食品科学, 2016, 37(13):204-208.
TIAN Y, DAI Q Q, SHI M H, et al.Bifidobacterium BB12 promotes defecation and regulates gastrointestinal hormones in constipated rats[J].Food Science, 2016, 37(13):204-208.
[16] 易若琨, 骞宇, 王强, 等.植物乳杆菌YS-1对活性炭诱导小鼠便秘的预防作用[J].食品科学, 2017, 38(17):238-243.
YI R K, QIAN Y, WANG Q, et al.Preventive effect of Lactobacillus plantarum YS-1 on activated carbon-induced constipation in mice[J].Food Science, 2017, 38(17):238-243.
[17] 陆文伟, 胡文兵, 曹文金, 等.干酪乳杆菌LC01对小鼠肠道菌群和肠道转运调节作用的剂量效应[J].食品科学, 2019, 40(15):211-217.
LU W W, HU W B, CAO W J, et al.Dose-dependent modulation of intestinal microbiota and peristalsis in mice by Lactobacillus casei LC01[J].Food Science, 2019, 40(15):211-217.
[18] 靳志敏, 张宏博, 刘夏炜, 等.不同剂量植物乳杆菌对小鼠肠道菌群的影响[J].食品工业科技, 2014, 35(24):342-345.
JIN Z M, ZHANG H B, LIU X W, et al.Effects of supplementation of Lactobacillus plantarum with different dosage on fecal microbiota[J].Science and Technology of Food Industry, 2014, 35(24):342-345.
[19] 张董燕, 季海峰, 刘辉,等.卷曲乳杆菌对生长猪生长性能、粪便菌群和短链脂肪酸组成以及血清长链脂肪酸组成的影响[J].动物营养学报, 2019, 31(4):1 564-1 573.
ZHANG D Y, JI H F, LIU H, et al.Effects of Lactobacillus crispatus on growth performance, fecal microbiota and short chain fatty acid composition and serum long chain fatty acid composition of growing pigs[J].Chinese Journal of Animal Nutrition, 2019, 31(4):1 564-1 573.
[20] 王琳琳. 双歧杆菌对便秘的影响及其作用机理研究[D].江苏无锡:江南大学, 2017.
WANG L L, Study of the effects and mechanisms of Bifidobacteria on constipation alleviation[D].Wuxi:Jiangnan University, 2017.
[21] DIMIDI E, CHRISTODOULIDES S, SCOTT S M, et al.Mechanisms of action of probiotics and the gastrointestinal microbiota on gut motility and constipation[J].Advances in Nutrition (Bethesda, Md), 2017, 8(3):484-494.
[22] 郑慧伶, 李艳霞, 张翠丽, 等.四种小鼠便秘模型建立方法的比较[J].现代生物医学进展, 2013, 13(28):5 456-5 459.
ZHENG H L, LI Y X, ZHANG C L, et al. Comparison of four methods for constructing the constipation model in mice[J].Progress in Modern Biomedicine, 2013, 13(28):5 456-5 459.
[23] LIU B, YANG L J, CUI Z F, et al.Anti-TNF-α therapy alters the gut microbiota in proteoglycan-induced ankylosing spondylitis in mice[J].MicrobiologyOpen, 2019, 8(12):e927.
[24] YU Q H, ZHAO J J, XU Z K, et al.Inulin from Jerusalem artichoke tubers alleviates hyperlipidemia and increases abundance of Bifidobacteria in the intestines of hyperlipidemic mice[J].Journal of Functional Foods, 2018, 40:187-196.