黄原胶是由野油菜黄单孢菌分泌的一种胞外杂多糖,主链由以β-1,4糖苷键相连的葡萄糖构成,甘露糖→葡萄糖→甘露糖组成其侧链,分子质量一般为2×106~5×107 Da[1]。研究发现,由黄原胶降解而来的低分子质量黄原胶可以抑制软骨细胞凋亡[2]、治疗骨关节炎[3],还具有抗氧化活性[4]、抑菌[5]、清除自由基[6]等功效,具有较高的市场价值。因此,通过降解黄原胶生产低分子质量黄原胶具有重要的意义。
常见的多糖降解方法有物理法,化学法和生物酶法[7]。相对于物理法和化学法,生物酶法反应条件温和、过程可控,因而被广泛应用[8]。研究发现,与黄原胶降解直接相关的酶有黄原胶内切酶、β-D-葡萄糖苷酶,黄原胶裂解酶、α-D-甘露糖苷酶、不饱和葡萄糖醛酸酶,其中黄原胶内切酶是一种能随机切割黄原胶主链的β-1,4-葡萄糖苷键的内切葡聚糖酶,对黄原胶的降解起关键性作用[9]。LI等[10]对来自Microbacterium sp.XT11的黄原胶内切酶进行了研究,发现其能直接作用于黄原胶主链使其降解。YANG等[11]将此黄原胶内切酶在大肠杆菌中胞内表达,对其结构进一步研究,发现它具有一般的内切葡聚糖酶具有的2个典型的结构域:具有催化活性的催化结构域和只具有结合功能但无催化活性的碳水化合物结合模块,推测其可能是来自GH9 家族的新分支。但是大肠杆菌的胞内表达和较低的酶活力限制了大规模应用。
毕赤酵母(Pichia pastoris)是一种成熟的蛋白表达宿主,在毕赤酵母中胞外表达的酶具有更高的生产率和纯度,操作相对比较简单且成本较低,主要用于生物制药和工业酶的生产[12-13]。合适的启动子能使外源蛋白高效表达,毕赤酵母的启动子分为诱导型启动子和组成型启动子,其中AOX1和GAP最为常用[14]。
本研究首次将来自Microbacterium sp.XT11的黄原胶内切酶,以毕赤酵母GS115为表达宿主进行异源表达。并对其启动子及发酵条件进行了优化,对重组黄原胶内切酶的酶学性质做了初步探索,并利用其对黄原胶进行水解,为低分子质量黄原胶的制备提供了一个可行的途径。
1 材料与方法
1.1 实验材料
1.1.1 菌株和质粒
大肠杆菌JM109和毕赤酵母GS115均为本实验室保藏;载体pPIC9K购自美国Invitrogen公司。
1.1.2 培养基
LB培养基(g/L):5酵母膏,10胰蛋白胨,5 NaCl,20琼脂粉(固体培养基),高压蒸汽灭菌(121 ℃,15 min)。
YPD培养基(g/L):10酵母膏,20蛋白胨,20葡萄糖,20琼脂粉(固体培养基),高压蒸汽灭菌(115 ℃,20 min)。
BMGY培养基(g/L):10酵母膏,20蛋白胨,13.4YNB,4×10-4生物素,10甘油,100 mmol/L磷酸钾缓冲液(pH 6.0),高压蒸汽灭菌(115 ℃,20 min)。
BMMY培养基(g/L):10酵母膏,20蛋白胨,13.4 YNB,4×10-4生物素,5甲醇,100 mmol/L 磷酸钾缓冲液(pH 6.0),高压蒸汽灭菌(115 ℃,20 min)。
BSM培养基:26.7 mL/L 85% H3PO4,0.93 g/L CaSO4,18.2 g/L K2SO4,14.9 g/L MgSO4·7H2O,4.13 g/L KOH,40 g/L甘油,4.35 mL/L PMT1。
1.1.3 主要试剂
限制性内切酶(EcoR I、Not I、Sac I、Sal I、BamH I)、DNA胶回收试剂盒,美国Thermo公司;Taq Premix、DNA Maker、DNA连接酶(Solution I),TaKaRa公司(大连);Ezup柱式酵母基因组DNA抽提试剂盒、质粒小量抽提试剂盒、氨苄青霉素、遗传霉素(G418)、琼脂糖,生工生物工程(上海)股份有限公司。
1.1.4 仪器与设备
C1000 TouchTM型 PCR仪、Micro PulserTM型电转仪,美国Bio-Rad公司; KTA蛋白纯化系统,美国GE Healthcare公司;TU-1810分光光度计,北京普析通用仪器有限公司。
KTA蛋白纯化系统,美国GE Healthcare公司;TU-1810分光光度计,北京普析通用仪器有限公司。
1.2 实验方法
1.2.1 重组质粒的构建
黄原胶内切酶基因经密码子优化后由生工生物工程(上海)股份有限公司合成,以CGGAATTCATGTCTAGACGTAGAGCCTCTTC(EcoR I)为上游引物,TAAAGCGGCCGCTTAACCAACGGCCACACCAGTAAC(Not I)为下游引物,经PCR扩增后通过双酶切法插入到毕赤酵母表达质粒pPIC9K中组成重组质粒pPIC9K-EX。将重组质粒pPIC9K-EX转入大肠杆菌感受态细胞后涂布于带有Amp抗性的LB平板上,挑取阳性转化子进行菌落PCR, 质粒酶切,测序验证。
在此基础上,以毕赤酵母GS115基因组为模板,GCAGCGAGCTCAATGTCTTGGTGTCCTCGTC(Sac I)为上游引物,GGCCGGATCCATTTAAAGTCTTTGGGTCAGG(BamH I)为下游引物,经PCR扩增后得到GAP基因片段,再通过双酶切法替换重组质粒pPIC9K-EX的启动子AOX1片段组成重组质粒pGAP9K-EX(图1)。
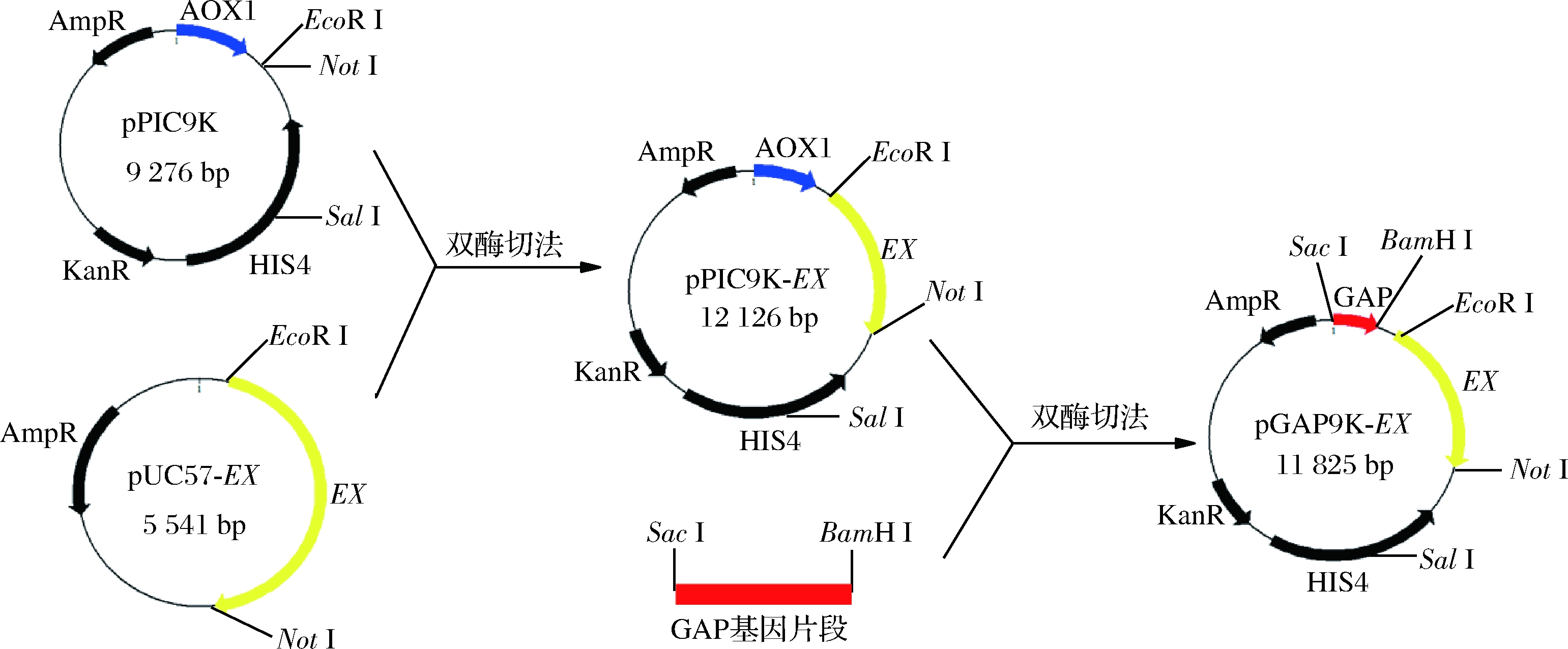
图1 重组质粒构建示意图
Fig.1 Construction of plasmids pPIC9K-EX and pGAP9K-EX
1.2.2 黄原胶内切酶的表达与筛选
将验证成功的质粒pPIC9K-EX,pGAP9K-EX分别线性化(Sal I)后电转入毕赤酵母GS115感受态细胞,经过MD,G418板筛选后[15],分别挑取20株阳性转化子提取基因组进行PCR验证。将验证成功的阳性转化子分别进行摇瓶发酵,测定其酶活力,以筛选高酶活力菌株。
1.2.3 重组酵母的发酵条件优化
将重组毕赤酵母在YPD平板上30 ℃下活化60~72 h,挑取单菌落接种至25 mL YPD培养基中,以200 r/min、30 ℃下培养16~18 h获得种子液(OD600=2~6)。设置初始发酵条件:pH 6.0;接种量5%(相对于培养基);温度30 ℃;转速:200 r/min。对培养温度、pH、转速和接种量进行优化,发酵结束后测定其细胞干重、酶活力。
1.2.4 7-L发酵罐放大生产黄原胶内切酶
将重组毕赤酵母7-L发酵罐中放大培养。选用BMS培养基作为发酵培养基,初始装液量3.0 L,接种量为5%,待出现溶氧反弹之后补加甘油,同时调节通气量和转速,使溶氧保持在20%左右。每隔4~6 h取1次样,测定其细胞干重、蛋白浓度及黄原胶内切酶酶活力。
1.2.5 黄原胶内切酶的分离纯化
采用离心、硫酸铵沉淀等步骤对发酵液进行初步纯化。发酵液8 000 r/min离心 5 min,得到上清液;加入硫酸铵,搅拌溶解后使硫酸铵终质量浓度为400 g/mL,在4 ℃下放置过夜,并于12 000 r/min、4 ℃ 条件下离心15 min 收集蛋白沉淀。最后,采用 KTA Avant蛋白纯化系统,将粗酶液进行体积排阻层析(Superdex G100)进行分离,用SDS-PAGE分析纯化后的酶。
KTA Avant蛋白纯化系统,将粗酶液进行体积排阻层析(Superdex G100)进行分离,用SDS-PAGE分析纯化后的酶。
1.2.6 黄原胶内切酶活力和蛋白浓度的测定
酶反应体系(5 mL)为2 g/L 黄原胶,10 mmol/L 磷酸钠缓冲液(pH 6.0),适量酶液。于40 ℃下反,10 min,沸水浴10 min 终止反应,DNS法测定反应体系中还原糖浓度[16],空白为灭活的酶液。酶活定义:每分钟释放1 μmol/L 还原糖所需的黄原胶内切酶酶量为1 U。利用考马斯亮蓝法测定蛋白浓度[16]。
1.2.7 黄原胶内切酶酶学性质研究
为测定黄原胶内切酶的最适pH,用10 mmol/L 不同pH(3.0~9.0)的磷酸钠缓冲液测定酶活力,以最高酶活力为100%,计算各pH下的相对酶活力。测定pH稳定性时,用上述缓冲液稀释酶液,并在4 ℃ 下放置3 h,按标准方法测定酶活力,以未经处理的黄原胶内切酶酶液为100%,计算各pH下的残余酶活力。为测定重组黄原胶内切酶最适温度,在20~70 ℃ 测定黄原胶内切酶酶活力,以最高酶活力为100%,计算各温度下的相对酶活力。测定温度稳定性时,将适当稀释后的酶液于20~70 ℃ 保温3 h后测定酶活力,以未经处理的黄原胶内切酶酶液为100%,计算各温度下的残余酶活力。
1.2.8 低分子质量黄原胶的制备
将2 g/L 原胶溶解于10 mmol/L 磷酸钠缓冲液(pH 6.0)中,加入足量的黄原胶内切酶,40 ℃ 反应5 h,水解产物经Sevage法[17]除蛋白,加入一定体积的无水乙醇醇沉,得到水解产物。采用高效体积排阻色谱(high-performance size exclusion chromatograph,HPSEC)测定其分子质量。
2 结果与分析
2.1 黄原胶内切酶的表达与纯化
Microbacterium sp.XT11来源的黄原胶内切酶基因(EX, GenBank:ALX66163.1)全长2 856 bp,编码951个氨基酸,针对毕赤酵母偏好性,对黄原胶内切酶基因进行密码子优化,优化后密码子的适应指数从0.49升到0.88,平均GC含量(DNA 4种碱基中,鸟嘌呤和胞嘧啶所占的比率)从67.3%调整至44.3%,并避免了EcoR I、Not I、Sac I、Sal I、BamH I等常用酶切位点。
重组质粒pPIC9K-EX的验证结果如图2-a所示,其单酶切结果与重组质粒pPIC9K-EX的大小相符,双酶切及PCR结果均在2 800 bp左右出现明显条带,与黄原胶内切酶基因大小一致,随后的测序验证表明重组质粒pPIC9K-EX构建成功。以同样的方法验证重组质粒pGAP9K-EX(图2-b),最后的测序验证表明重组质粒pGAP9K-EX构建成功。将验证成功的重组质粒pPIC9K-EX、pGAP9K-EX分别线性化后导入毕赤酵母感受态细胞,经筛选最终得到16株重组毕赤酵母-pPIC9K-EX和15株重组毕赤酵母pGAP9K-EX。将重组毕赤酵母摇瓶发酵后测定其酶活力,由图2-c可以看出,以AOX1为启动子的重组毕赤酵母酶活力最高为240.12 U/L(A8),以GAP为启动子的重组毕赤酵母(图2-d)酶活力最高为300.23 U/L(G12)。
ExPASy预测黄原胶内切酶分子质量约为101 kDa。发酵上清液的SDS-PAGE分析结果(图3-a)显示,泳道2(A8)和泳道4(G12)均在95~130 kDa有明显的条带,表明重组毕赤酵母-pPIC9K-EX、重组毕赤酵母-pGAP9K-EX均可成功的表达黄原胶内切酶。图3-b中无明显杂带,表明杂蛋白已被去除。对于毕赤酵母表达系统而言,不同启动子的表达速率和表达条件均有很大差异,当启动子为AOX1时,需要甲醇诱导才能表达外源蛋白;当启动子为GAP时,表达外源蛋白无需诱导[14]。高酶活力菌株重组毕赤酵母-pGAP9K-EX-12表达黄原胶内切酶的水平(300.23 U/L)高于重组毕赤酵母-pPIC9K-EX-8(240.12 U/L),且培养条件、发酵调控相对比较简单,所以选用重组毕赤酵母-pGAP9K-EX-12做后续研究。

M-DNA Marker;1、2-EcoR I、Not I单酶切结果;3-双酶切结果;4-EX基因PCR结果;5、6-Sac I、BamH I单酶切结果;7-双酶切结果;
8-GAP基因PCR结果;9-四酶切结果
a-重组质粒pPIC9K-EX的验证;b-重组质粒pGAP9K-EX的验证;c-重组毕赤酵母-pPIC9K-EX高酶活力筛选;
d-重组毕赤酵母酵母-pGAP9K-EX高酶活力筛选
图2 重组酵母的构建与筛选
Fig.2 Construction and screening of recombinant Pichia pastoris
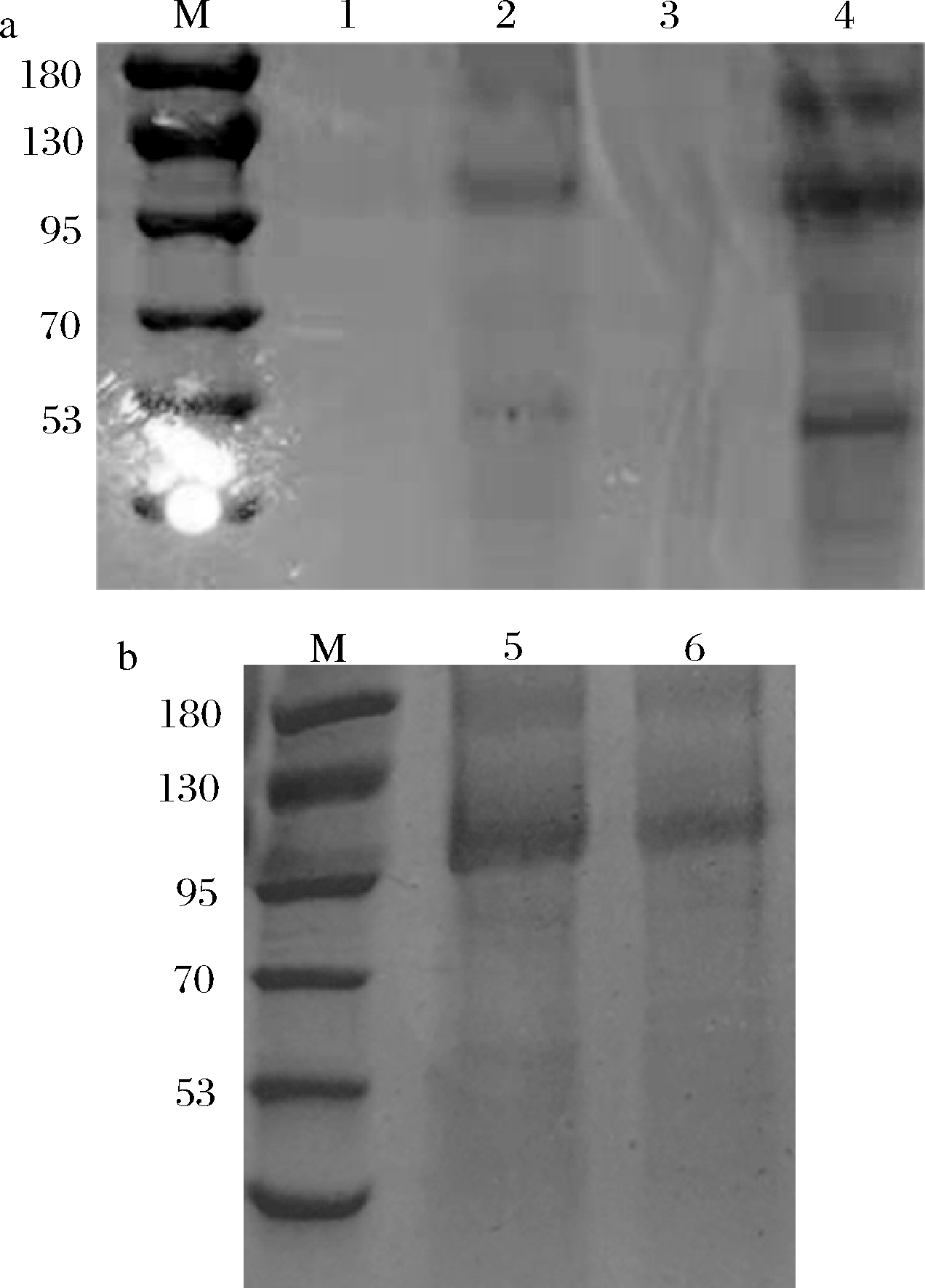
M-蛋白质Marker;1、3-原始毕赤酵母;
2-重组毕赤酵母-pPIC9K-EX-8;4-重组毕赤酵母-pGAP9K-EX-12;
5-重组毕赤酵母-pPIC9K-EX-8;
6-重组毕赤酵母-pGAP9K-EX-12
a-重组毕赤酵母发酵上清液;b-纯化后
图3 SDS-PAGE检测重组黄原胶内切酶的表达和纯化
Fig.3 SDS-PAGE analysis of endoxanthanase expression and purification
2.2 重组毕赤酵母的发酵条件优化
毕赤酵母对不同外源蛋白的表达水平有很大差异,除外源蛋白本身的性质、毕赤酵母的启动子等影响外,毕赤酵母的发酵条件也影响着外源蛋白的表达水平。毕赤酵母的最适生长温度为28~30 ℃,温度影响毕赤酵母的菌体生长速率、产物的合成方向及速率等[18],考察了不同发酵温度对重组毕赤酵母表达黄原胶内切酶的影响(图4-a)。毕赤酵母在pH为3~7的条件下都能正常生长,但各工程菌本身的发酵特性和产物的理化性质各有差别[12],导致所需的最适pH各不相同,分别在不同pH下对重组毕赤酵母进行发酵(图4-b),以寻求重组毕赤酵母表达黄原胶内切酶所需的最适pH值。发酵液中的溶氧量直接影响毕赤酵母的生长和代谢,一般通过调节转速等控制溶氧量;合适的接种比能保证在毕赤酵母快速生长的同时大量产生代谢产物[15]。所以对发酵转速(图4-c)和接种比(图4-d)进行了优化。在摇瓶水平,重组毕赤酵母-pGAP9K-EX-12表达黄原胶内切酶的最佳发酵条件为30 ℃、pH 6.0、220 r/min、接种量5%。
参照摇瓶水平的优化条件,对重组毕赤酵母-pGAP9K-EX-12进行7-L发酵罐放大培养,结果如图5所示,随着发酵的进行,重组毕赤酵母菌体干重最终达到80.53 g/L,蛋白含量与黄原胶内切酶酶活力分别达到501.12 mg/L和1 230.25 U/L,而摇瓶发酵只有185.64 mg/L和407.13 U/L,分别提高了2.7和3.0倍。

a-温度;b- pH;c-转速;d-接种量
图4 重组毕赤酵母-pGAP9K-EX-12的摇瓶发酵条件优化
Fig.4 Optimization of fermentation conditions for recombinant Pichia pastoris-pGAP9K-EX-12 in the shake flasks
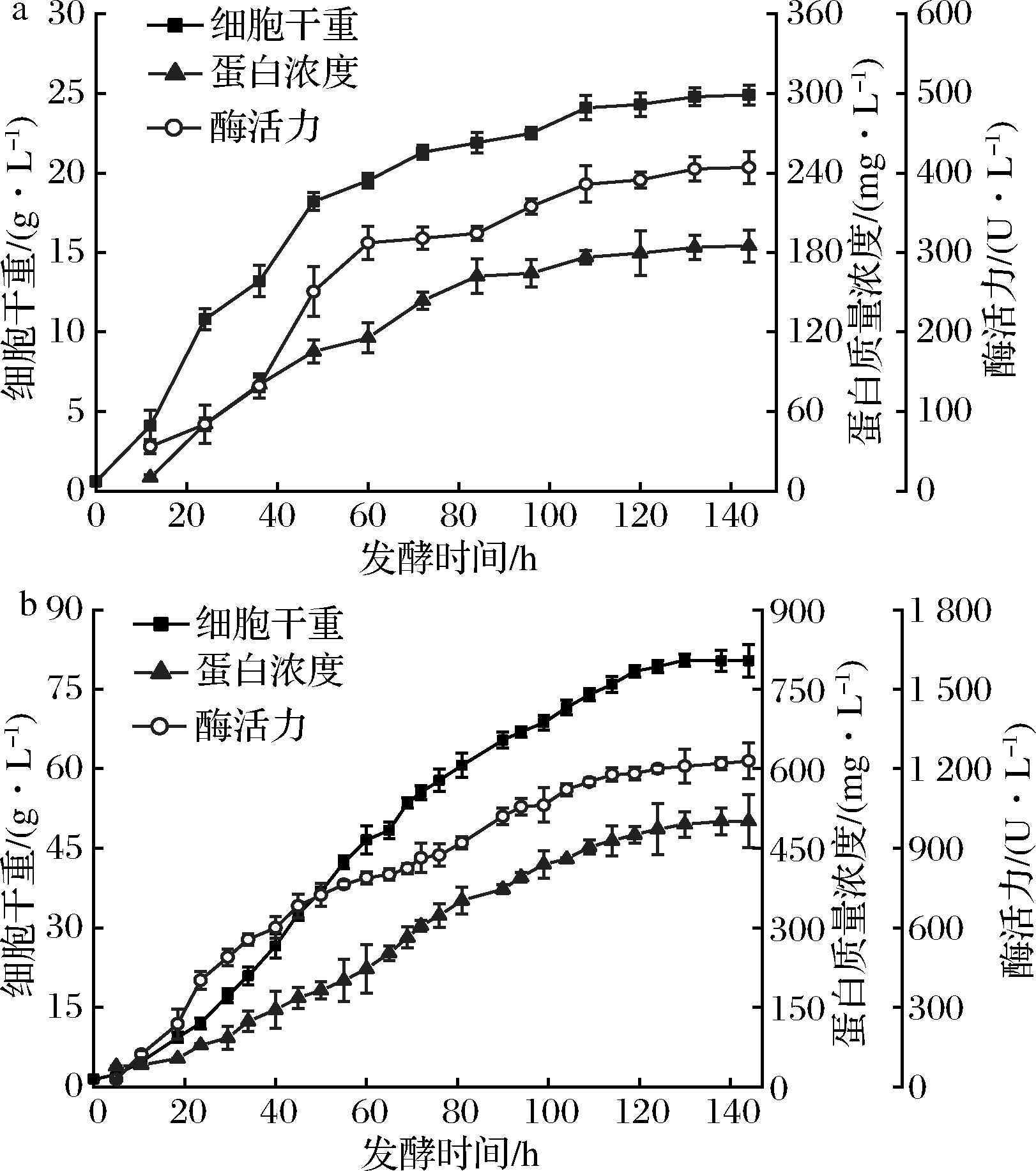
a-摇瓶;b-7-L发酵罐放大培养
图5 重组毕赤酵母-pGAP9K-EX-12的发酵曲线
Fig.5 Fermentation curve of recombinant Pichia pastoris-pGAP9K-EX-12
2.3 黄原胶内切酶酶学性质
重组黄原胶内切酶的酶学性质如图6所示。黄原胶内切酶的最适作用pH为6.0,在pH为5.5~7.5、4 ℃ 放置3 h 后,其酶活力仍可达90%以上,说明重组黄原胶内切酶具有较宽的pH耐受性。重组黄原胶内切酶的酶活力随着温度的上升先提高再下降,在40 ℃达到最大,高于45 ℃时,酶活力急速下降,可能是温度过高导致酶的结构发生了改变。在20~45 ℃ 放置 3 h 后,残留酶活力仍可达70%以上,在很宽的温度范围内表现出相对较高的活性。在最佳条件(40 ℃,pH 6.0)下测定黄原胶内切酶的比活力为2 700 U/g。
黄原胶主链的结构与纤维素类似,姜海珠等[19]将来自Clostridium thermocellum的纤维素酶在大肠杆菌中进行表达,发现其能一定程度上降解黄原胶,比酶活力为98.3 U/g。NANKAI等[20]发现来自Bacillus sp.GL-1的黄原胶内切酶对天然的黄原胶作用效果不明显,比酶活力为9.2 U/g。MOROZ等[21]将来自Paenibacillus nanensis黄原胶内切酶在枯草芽孢杆菌中表达的比酶活力为285 U/g。本研究在毕赤酵母中表达的重组黄原胶内切酶具有相对较高的酶活力和稳定性,使其成为工业生产低分子质量黄原胶的理想候选酶。
2.4 低分子质量黄原胶的制备
研究发现,分子质量在300~1 500 Da的黄原胶可以促进对人体有益的肠道微生物的生长和短链脂肪酸的产生,具有益生活性,可以作为益生元而被广泛应用[22-23]。在大肠杆菌中进行表达来自Clostridium thermocellum的纤维素酶可将黄原胶部分降解为分子质量为4.5×104 Da的低分子质量黄原胶[19];在枯草芽孢杆菌表达来自Paenibacillus nanensis黄原胶内切酶的水解产物的分子质量主要在1 500 Da左右[21]。
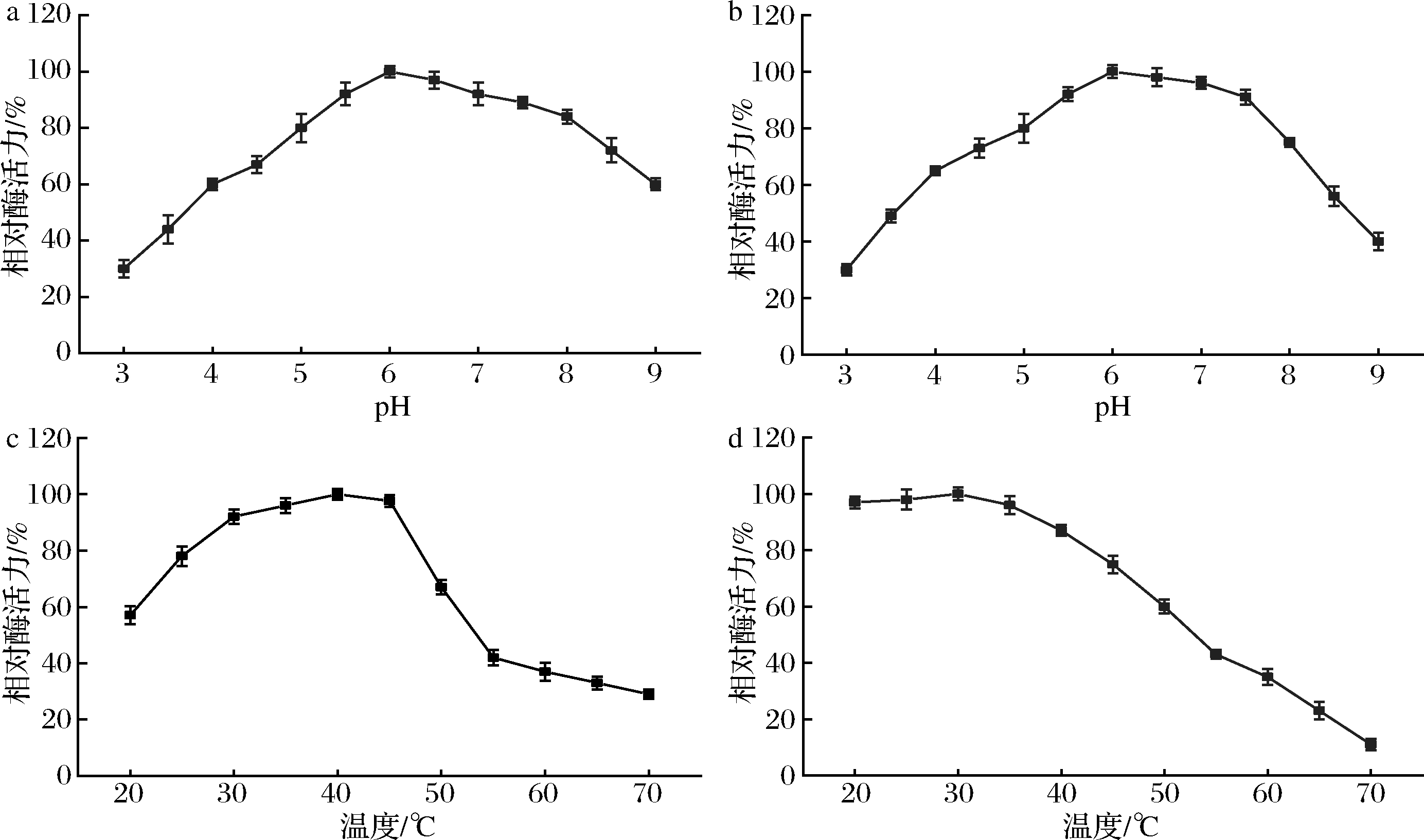
a-最适pH;b-pH稳定性;c-最适温度;d-温度稳定性
图6 黄原胶内切酶酶学性质
Fig.6 Enzymatic properties of endoxanthanase
利用HPSEC法测定了纯化后水解产物的分子质量(Mw)与保留时间(t)的关系, 以lgMw为纵坐标, 保留时间为横坐标, 绘制标准曲线如图7-a所示, 为lg(Mw)=13.1-0.515t,R2=0.996。待黄原胶内切酶水解黄原胶(2.8×107 Da)5 h 后,将得到的水解产物提纯并测定其分子质量(图7-b)。
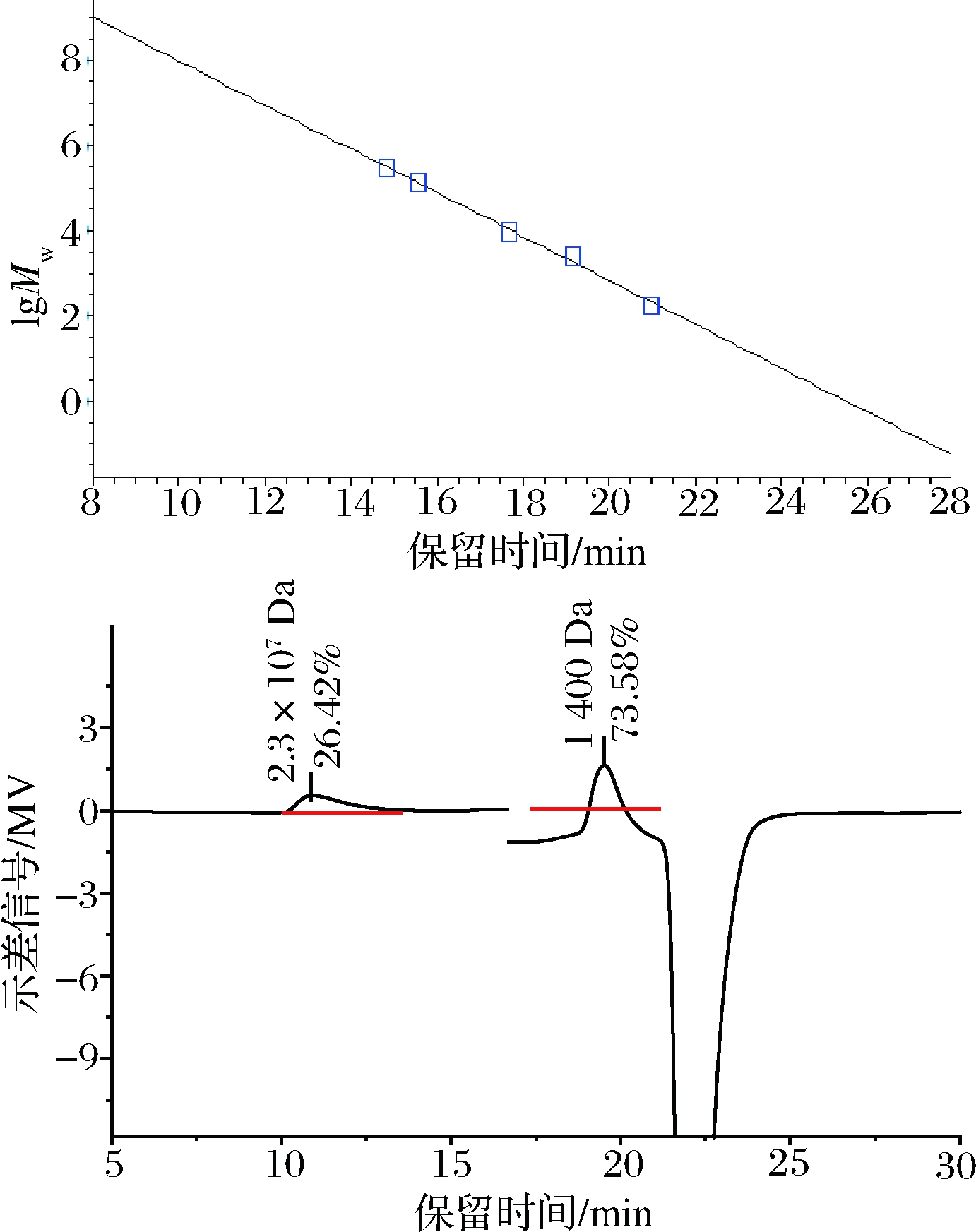
a-标准曲线;b-水解产物分子质量分布
图7 水解产物分子质量分布
Fig.7 Molecular weight distribution of hydrolysate
分别由标准曲线、峰面积计算其分子质量及比例,发现分子质量为2.3×107Da 左右的占26.42%,分子质量为1 400 Da左右的占73.58%,说明重组黄原胶内切酶可以有效水解黄原胶,但水解产物中仍存在分子质量较大的黄原胶,推测是一些结构复杂的区域没有被完全水解。因此,利用毕赤酵母异源表达的黄原胶内切酶可以有效制备低分子质量黄原胶。
3 结论
本研究成功将来自Microbacterium sp.XT11的黄原胶内切酶在毕赤酵母GS115表达,以GAP为启动子的重组毕赤酵母的最优发酵条件为30 ℃、pH 6.0、220 r/min、接种量5%,经7-L发酵罐放大培养后酶活力可达1 230.25 U/L,最适作用条件为pH 6.0,40 ℃。将黄原胶内切酶作用于黄原胶,水解产物大部分为分子质量在1 400 Da 左右的低分子质量黄原胶。为低分子质量黄原胶的工业制备提供了一种可行的途径。
[1] WANG Z C, YANG L B, WU J R, et al.Potential application of a low-viscosity and high-transparency xanthan gum produced from Xanthomonas campestris CCTCC M2015714 in foods[J].Preparative Biochemistry & Biotechnology, 2018, 48(5):402-407.
[2] ZHANG W, WU J X, ZHANG F F, et al.Lower range of molecular weight of xanthan gum inhibits apoptosis of chondrocytes through MAPK signaling pathways[J].International Journal of Biological Macromolecules, 2019, 130:79-87.
[3] HAN G Y, CHEN Q X, LIU F, et al.Low molecular weight xanthan gum for treating osteoarthritis[J].Carbohydrate Polymers, 2017,164:386-395.
[4] XIONG X Y, LI M, XIE J, et al.Antioxidant activity of xanthan oligosaccharides prepared by different degradation methods[J].Carbohydrate Polymers, 2013, 92(2):1 166-1 171.
[5] 黄成栋. 黄原胶的降解、产物寡糖结构的初步分析及生物活性探寻[D].大连:中国科学院研究生院(大连化学物理研究所), 2004.
HUANG C D.Studies on the xanthan′s degradation, it′s degradation products′ structural analysis and biological activities[D].Dalian:Dalian Institute of Chemical Physics, Chinese Academy of Sciences, 2004.
[6] WU S J, WU J H, XIA L Z, et al.Preparation of xanthan-derived oligosaccharides and their hydroxyl radical scavenging activity[J].Carbohydrate Polymers, 2013, 92(2):1 612-1 614.
[7] ZHENG Z M, HUANG Q L, LUO X G, et al.Effects and mechanisms of ultrasound- and alkali-assisted enzymolysis on production of water-soluble yeast β-glucan[J].Bioresource Technology, 2019, 273:394-403.
[8] GAO M J, XU Y, YANG G S, et al.One-step production of functional branched oligoglucosides with coupled fermentation of Pichia pastoris GS115 and Sclerotium rolfsii WSH-G01[J].Bioresource Technology, 2021, 335:125286.
[9] SUN Z, LIU H X, WANG X Y, et al.Proteomic analysis of the xanthan-degrading pathway of Microbacterium sp.XT11[J].ACS Omega, 2019, 4(21):19 096-19 105.
[10] LI B, GUO J Q, CHEN W F, et al.Endoxanthanase, a novel β-D-glucanase hydrolyzing backbone linkage of intact xanthan from newly isolated Microbacterium sp.XT11[J].Applied Biochemistry and Biotechnology, 2009, 159(1):24-32.
[11] YANG F, LI H, SUN J, et al.Novel endotype xanthanase from xanthan-degrading Microbacterium sp.strain XT11[J].Applied and Environmental Microbiology, 2019, 85(2):1 800-1 818.
[12] ZHANG S B, ZHANG W J, LI N, et al.Functional expression and characterization of an endo-1,4-β-mannosidase from Triticum aestivum in Pichia pastoris[J].Biologia, 2020, 75(11):2 073-2 081.
[13] YU J, LIU X Q, GUAN L Y, et al.High-level expression and enzymatic properties of a novel thermostable xylanase with high arabinoxylan degradation ability from Chaetomium sp.suitable for beer mashing[J].International Journal of Biological Macromolecules, 2021, 168:223-232.
[14] GAO M J, YANG G S, LI F F, et al.Efficient endo-β-1,3-glucanase expression in Pichia pastoris for co-culture with Agrobacterium sp.for direct curdlan oligosaccharide production[J].International Journal of Biological Macromolecules, 2021, 182:1 611-1 617.
[15] GAO M J, YAN J J, ZHAO Y, et al.Expression of a thermostable β-1,3-glucanase from Trichoderma harzianum in Pichia pastoris and use in oligoglucosides hydrolysis[J].Process Biochemistry, 2021, 107:74-82.
[16] 李雪雁, 武晓尧, 孙春丽, 等.菊芋菊糖粗提液的微生物除杂[J].食品与发酵工业, 2019,45(5):127-132.
LI X Y, WU X Y, SUN C L, et al.Microbial removal of impurities from Jerusalem artichoke and inulin crude extracts[J].Food and Fermentation Industries, 2019,45(5):127-132.
[17] 刘卫宝,余讯,徐静静,等.黄芪多糖的分离、结构表征及益生活性研究[J].食品与发酵工业, 2020, 46(7):50-56.
LIU W B, YU X, XU J J, et al.Isolation, structure characterization and prebiotic activity of polysaccharides from Astragalus membranaceus[J].Food and Fermentation Industries, 2020, 46(7):50-56.
[18] LOOSER V, BRUHLMANN B, BUMBAK F, et al.Cultivation strategies to enhance productivity of Pichia pastoris:A review[J].Biotechnology Advances, 2015, 33(6):1 177-1 193.
[19] 姜海珠,周海龙,谷金芸,等.纤维素酶CtCel8A的异源表达及其降解黄原胶性能[J].大连工业大学学报, 2021, 40(2):79-84.
JIANG H Z, ZHOU H L, GU J Y, et al.Heterologous expression and xanthan-degradation properties of a cellulose CtCel8A[J].Journal of Dalian Polytechnic University, 2021, 40(2):79-84.
[20] NANKAI H, HASHIMOTO W, MIKI H, et al.Microbial system for polysaccharide depolymerization:Enzymatic route for xanthan depolymerization by Bacillus sp strain GL1[J].Applied and Environmental Microbiology, 1999, 65(6):2 520-2 526.
[21] MOROZ O V, JENSEN P F, MCDONALD S P, et al.Structural dynamics and catalytic properties of a multimodular xanthanase[J].ACS Catalysis, 2018, 8(7):6 021-6 034.
[22] XU J J, LIU W B, WU J R, et al.Metabolic profiles of oligosaccharides derived from four microbial polysaccharides by faecal inocula from type 2 diabetes patients[J].International Journal of Food Sciences and Nutrition, 2021,72(8):1 083-1 094.
[23] XU J J, WANG R Y, ZHANG H T, et al.In vitro assessment of prebiotic properties of oligosaccharides derived from four microbial polysaccharides [J].LWT-Food Science and Technology, 2021, 147:111544.