牦牛是生长在青海、西藏等3 000 m以上高寒地区的特有珍稀牛种之一,独特的环境优势使牦牛肉具有优于普通黄牛肉的营养品质和加工特性,如高蛋白、低脂肪、多氨基酸且不饱和脂肪酸含量丰富等。肉糜制品具有美味、方便与时尚的优点,逐渐成为中国市场的新宠[1]。但肉糜在加工、运输和贮藏过程中,不可避免地受光、氧、温度和催化剂等外界环境的影响,产生多种自由基并发生氧化,导致产品风味、颜色、功能性质发生改变,这是造成肉糜原料及其制品发生不可逆劣变的重要原因[2]。另外,肉糜在绞碎过程中对氧化十分敏感,极易受微生物污染,进而导致肉糜品质下降,因此,必须采用适当的保鲜技术如保鲜剂来保证其品质。
保鲜剂按照来源可分为化学保鲜剂和天然保鲜剂,与化学保鲜剂相比,天然保鲜剂的安全性更高,其中的植物提取物具有很好的应用前景。我国石榴年产量高,石榴皮作为副产物,约占鲜果重的20%,研究发现有很大的利用价值,如石榴皮提取物(pomegranate peel extract,PPE)富含酚类化合物,具有较强的抗氧化性、自由基清除能力[3]和一定的抗菌作用,其含有的单宁类物质以鞣花单宁为主,经酸水解后可得大量鞣花酸。研究表明,鞣花酸具有抗氧化、抗癌变、抗诱变、抗突变、抗菌和抗病毒的作用[4],PPE及鞣花酸还可有效抑制人脂肪干细胞增殖和分化为成熟脂肪,具有潜在的抑制肥胖作用[5]。
目前,有关石榴皮中生物活性成分提取和含量测定的研究较多,在猪肉饼中添加量为0.10%时有较好的抗氧化性[6],但提取物中酚类物质的不同会影响其生物活性,富含鞣花酸的PPE在食品中的应用少有研究,其对贮藏期间牦牛肉糜理化特性及流变特性的影响尚鲜见相关报道。本试验选用富含鞣花酸的PPE,研究PPE对牦牛肉糜制品贮藏期间理化特性及流变特性的改善效果,以确定其保鲜效果和最适添加量,以期为石榴产业副产物利用、牦牛肉糜制品的冷链物流及延长其货架期提供依据。
1 材料与方法
1.1 材料与试剂
牦牛肉,红原县国中食品有限责任公司;PPE(HPLC:40%鞣花酸;SLP-C-A001940),陕西嘉禾生物科技有限公司。
三氯乙酸、乙二胺四乙酸、乙酸乙酯、盐酸胍、三氯甲烷、三羟甲基氨基甲烷、甘氨酸、2,4-二硝基苯肼,成都市科隆化学品有限公司;5,5′-二硫代双(2-硝基苯甲酸)、二丁基羟基甲苯(butylated hydroxy toluene,BHT)、硫代巴比妥酸(thiobarbituric acid,TBA),均为分析纯,上海源叶生物科技有限公司。
1.2 仪器与设备
CR-400 色彩色差仪,日本 Konica Minolta公司;5804R 冷冻离心机,德国Eppendorf公司;MP511实验室pH计,上海三信仪表厂;UV-1200紫外可见分光光度计,上海翱艺公司;SW-CJ-1F型超净工作台,苏净集团安泰公司;DHR-3流变仪,美国TA公司。
1.3 实验方法
1.3.1 牦牛肉糜制作
将解冻好的牦牛肉称重后洗净,除去可见脂肪与结缔组织,切成小块,然后用绞肉机(6 mm孔板)绞碎,将肉糜分成6个处理组:第1组为空白对照组(不添加任何抗氧化剂);第2组添加0.01%(质量分数)BHT;第3、4、5、6组分别添加0.01%、0.05%、0.10%、0.20%(质量分数)PPE;定义2%(以肉饼质量为基准)NaCl为基础物质添加到各处理组中。充分混合均匀后,将肉糜制成50 g的肉饼,直径约7 cm,厚度约1 cm,每3个肉饼放入一个聚丙烯包装盒中,用保鲜膜封好,置于4 ℃冰箱冷藏,分别在第1、3、6、9 天测定各项指标,每次测定重复3次。
1.3.2 色泽的测定
参照ÖZTÜRK等[7]的方法用色差仪测定牦牛肉糜的L*、a*、b*值。
1.3.3 pH值的测定
参照VILLALOBOS-DELGADO等[8]的方法加以修改。准确称取1 g牦牛肉糜,加入9 mL煮沸后冷却的蒸馏水,匀浆1 min,静置0.5 h后取上清液,测定其pH值。
1.3.4 持水力的测定
参照LI等[9]的方法并进行少量修改。称取肉糜的质量记为m1并用3层皎洁牌定性滤纸包裹,放入离心管中,5 000 r/min、4 ℃离心10 min,擦干表面水分后,称取质量记为m2。按公式(1)计算持水力:
持水力![]()
(1)
1.3.5 菌落总数的测定
菌落总数测定参照GB/T 4789.2—2016《食品安全国家标准 食品微生物学检验菌落总数测定》。
1.3.6 羰基含量的测定
参考OLIVER等[10]的方法测定牦牛肉糜中的羰基含量。结果以每毫克蛋白所含羰基物质的量表示,单位为nmol/mg。
1.3.7 总巯基含量的测定
根据ZHANG等[11]的Ellman试剂法做测定牦牛肉糜中的总疏基含量。结果以蛋白质量计,单位为nmol/mg。
1.3.8 硫代巴比妥酸反应物(thiobarbituric acid reactive substances,TBARS)的测定
参照高爱武等[12]的方法并加以修改。称取5 g绞碎的肉样,加入25 mL质量分数为7.5%的三氯乙酸(含0.01% EDTA),振摇30 min后,6 000 r/min离心5 min,滤纸过滤2次;取5 mL上清液,加入5 mL 0.02 mol/L TBA溶液,在沸水浴中保温40 min;取出冷却1 h,上清液中加入5 mL三氯甲烷,摇匀,静置分层后吸取上清液,测定532 nm和600 nm波长处的吸光度。以每千克肉糜样品中丙二醛的含量表示TBARS值,按照公式(2)计算:
TBARS值![]()
(2)
式中:A532、A600分别为溶液在532 和600 mm波长处的吸光度;ε为摩尔吸光系数,156 000 L/(mol·cm);V为样品体积,mL;I为光程,cm;M为丙二醛的分子质量,72.063 g/mol;m3为肉糜质量,kg。
1.3.9 动态流变学测定
参照彭新颜等[13]的方法并加以修改。采用40 mm的铝平板探头,狭缝距离为1 mm,将牦牛肉糜均匀涂抹在测试平台上并确保无气泡。升温区间设定为20~80 ℃,加热速率2 ℃/min,应变力1%,测试频率1 Hz。为防止升温过程中水分的蒸发,用硅油封住平行板与空气接触的外沿,记录储能模量(G′)的变化。
1.4 数据统计与处理
采用SPSS 18.0软件进行数据统计处理,用ANOVA进行方差分析和显著性分析,处理组之间的差异显著性采用Duncan′s法进行多重比较,P<0.05表示差异显著。数据表达为平均值±标准差形式,用Origin 2017软件作图。
2 结果与分析
2.1 PPE对牦牛肉糜色泽的影响
不同处理对贮藏期间牦牛肉糜色泽的影响如表1所示。贮藏第1天,各PPE处理组的L*值均低于空白对照组,且PPE添加量越大,L*值越低,这主要是由于PPE本身呈棕黄色所造成的。ELHADEF等[14]观察到了类似的下降趋势。随着贮藏时间的延长,空白对照组肉糜表面水分持续蒸发,其表面亮度变暗,引起L*值不断下降。0.10%、0.20% PPE处理组在贮藏结束后相比第1天 L*值分别增加0.52、2.03,前者在贮藏9 d 内L*值无显著变化(P>0.05),说明在牦牛肉糜中加入PPE可以有效控制L*值的降低。
贮藏过程中所有试验组的a*值均出现显著下降(P<0.05),这是因为在肉糜氧化过程中,产生的大量高铁肌红蛋白会使肉糜红褐色增加,导致肉色变暗。PPE自身呈棕黄色,因此贮藏第1天,PPE处理组a*值显著低于空白对照组(P<0.05)。空白对照组a*值从第6天起显著低于BHT与各PPE处理组(P<0.05)。贮藏第9天,所有处理中,0.20%PPE处理组a*值下降最低,约为23.30%。结果表明加入PPE可以抑制牦牛肉糜中Fe2+的氧化,从而减少高铁肌红蛋白的形成,延缓a*值的降低。
整个贮藏期内,各PPE处理组b*值低于空白对照组,所有试验组随时间推移b*值呈下降趋势,这与ELHADEF等[14]的研究结果类似。牦牛肉糜b*值的变化可能是由脂质氧化产物与蛋白质氨基反应产生的席夫色素(脂褐素)引起。综上,添加0.20%PPE对贮藏期间牦牛肉糜色泽的改善效果最好。
表1 PPE对牦牛肉糜色泽的影响
Table 1 Effect of PPE on the color of yak minced meat

贮藏时间/d组别L*a*b*空白对照30.19±0.65Ab19.66±0.98Aa14.01±0.24AaBHT(0.01%)30.47±0.18Aa20.52±0.60Aa12.24±0.34Abc1PPE(0.01%)29.60±0.56Aab20.15±0.52Aa12.69±0.50AbPPE(0.05%)29.40±0.97Aab15.77±1.09Ab11.59±0.35AcPPE(0.10%)28.77±0.68Abc13.94±0.18Ac9.76±0.35ABePPE(0.20%)28.19±0.34Bc13.26±0.49Ac10.79±0.51Ad空白对照28.09±0.30Bb10.42±1.40Bb12.97±0.90AaBHT(0.01%)29.89±0.25Aa14.80±0.35Ba12.28±0.67Aa3PPE(0.01%)28.48±0.60Bb11.45±0.67Bb11.80±1.12AaPPE(0.05%)28.48±0.40ABb12.43±0.53Bb10.49±0.51BbPPE(0.10%)29.55±0.30Aa11.40±0.84Bb10.24±0.32AbPPE(0.20%)30.24±0.54Aa12.16±1.89ABb9.59±0.21Bb空白对照27.65±0.10Bc7.46±0.10Cd10.38±0.80BaBHT(0.01%)28.17±0.15Bbc10.42±0.48Cb9.85±1.08Ba6PPE(0.01%)27.49±0.32Cc7.87±0.19Cd9.42±0.27BaPPE(0.05%)27.43±0.90Bc9.25±0.49Cc8.89±0.35CabPPE(0.10%)28.97±0.55Aab10.18±0.55Cb9.28±0.36BabPPE(0.20%)29.74±0.30Aa11.39±0.40ABa8.25±0.33Cb空白对照26.82±1.34Bd7.33±0.59Cc10.60±0.83BaBHT(0.01%)27.80±0.87Bcd10.73±0.18Ca9.48±0.30Bab9PPE(0.01%)28.34±0.46BCbc8.18±0.20Cb9.04±0.13BbcPPE(0.05%)28.79±0.33ABbc8.24±0.44Cb8.27±0.71CcdPPE(0.10%)29.29±0.42Aab10.35±0.35Ca7.87±0.23CcdPPE(0.20%)30.22±0.36Aa10.17±0.59Ba7.73±1.08Cd
注:同列不同小写字母表示同一贮藏时间、不同处理组差异显著(P<0.05);同列不同大写字母表示同一处理组、不同贮藏时间差异显著(P<0.05)
2.2 PPE对牦牛肉糜pH值的影响
肉样的pH值有助于消费者判断肉质的变化程度,是反映肉样新鲜度和微生物污染程度的重要指标。如图1所示,贮藏第1天,各PPE处理组的pH值均低于空白对照组,这可能与PPE中含有的酸性成分如没食子酸、绿原酸和咖啡酸有关[15]。随着贮藏时间的延长,所有试验组的pH值逐渐增加且差异显著(P<0.05),这可能与微生物产生的次级代谢产物和蛋白质脱氨增多,氨基酸分解后产生的氨在肉糜中积累有关。贮藏第6天,各PPE处理组之间无显著差异(P>0.05)。贮藏第9天,空白对照组的pH值达6.07,显著高于其他处理组(P<0.05)。贮藏9 d内,各PPE处理组的pH值均低于空白对照组,且0.20% PPE处理组与空白对照组差异显著(P<0.05),这可能是因为PPE降低了贮藏过程中蛋白质分解成氨类和碱性物质的速度,表明PPE可有效抑制贮藏过程中牦牛肉糜pH值的增加。李伟等[16]在冷却猪肉中加入桉叶多酚后,pH值均低于空白对照组,与本文的结果相似。综上,添加PPE可显著抑制肉糜pH值的升高(P<0.05),0.20% PPE处理组的效果最好。
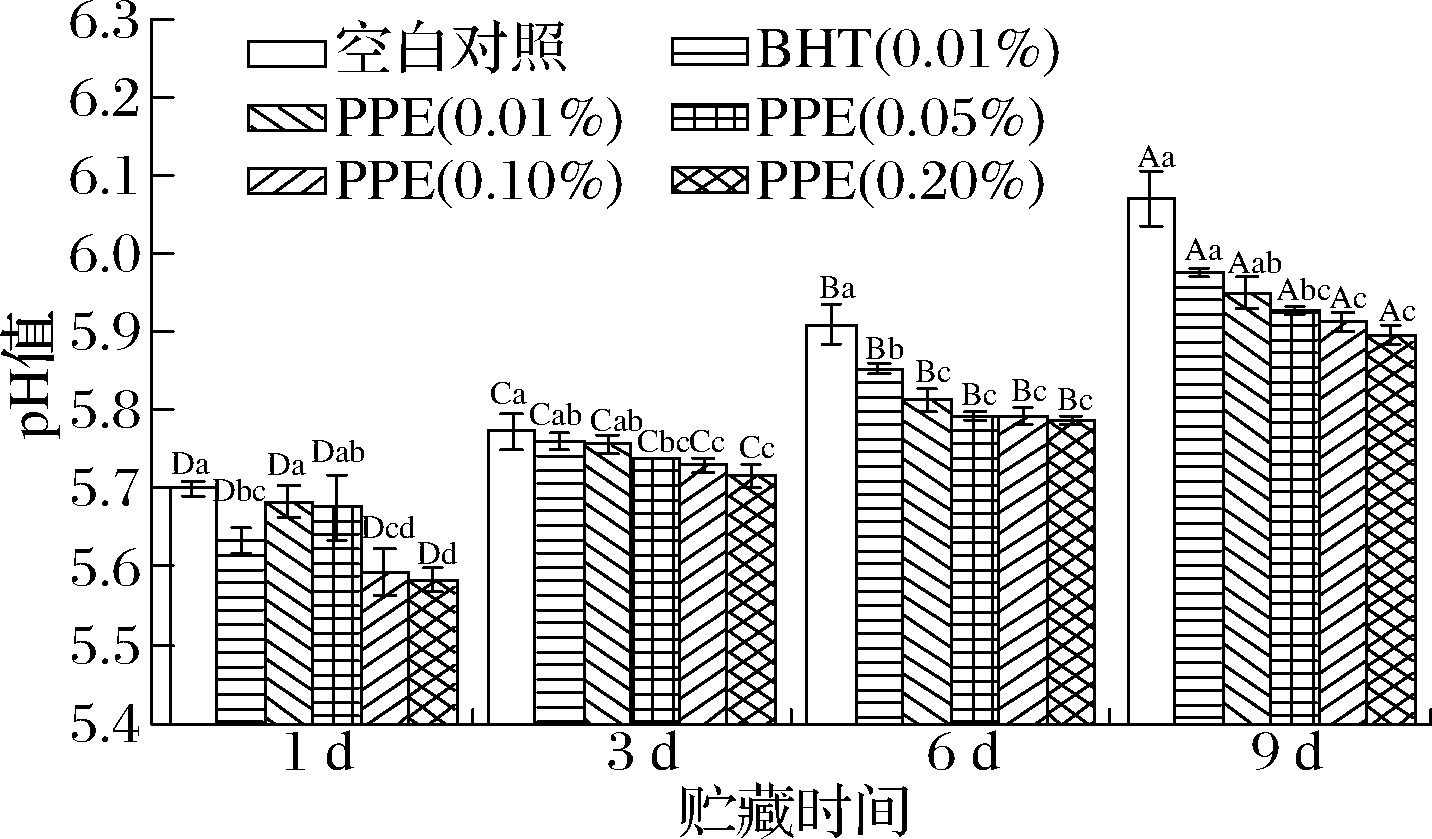
图1 PPE对牦牛肉糜pH值的影响
Fig.1 Effect of PPE on pH of yak minced meat
注:相同贮藏时间、不同处理组之间小写字母不同表示
差异显著(P<0.05);不同贮藏时间、同一处理组大写字母
不同表示差异显著(P<0.05)(图2~图6同)
2.3 PPE对牦牛肉糜持水力的影响
由图2可知,贮藏1~9 d过程中,所有试验组的持水力不断下降且差异显著(P<0.05),这可能是因为贮藏导致了蛋白的变性和氧化,进而引起肌肉保水能力的降低。空白对照组的持水力从第1天的90.24%下降到第9天的85.23%。贮藏第3、6天,0.01% PPE处理组的持水力显著高于空白对照组(P<0.05),增大PPE的添加量,牦牛肉糜的持水力增加。贮藏第9天,各PPE处理组(0.01%~0.20%)的持水力分别为87.24%、87.92%、88.65%、89.22%,均显著高于空白对照组(P<0.05),这可能是由于PPE中的鞣花酸含有的丰富羟基可与肉糜蛋白较好结合,截留更多水分[17]。结果表明,添加PPE可有效抑制牦牛肉糜持水力的降低,其抑制效果随添加量的增加而递增,添加0.20%PPE的效果最好。

图2 PPE对牦牛肉糜持水力的影响
Fig.2 Effect of PPE on water-holding capacity of yak minced meat
2.4 PPE对牦牛肉糜菌落总数的影响
生肉的保质期通常受到腐败微生物的限制,当生肉菌落总数超过6.00 lgCFU/g时,即可判定为变质肉。如图3所示,贮藏时间延长,菌落总数逐渐上升,添加PPE的各组菌落总数均显著低于空白对照组(P<0.05)。贮藏第3天,空白对照组已超过次级鲜肉规定的菌落总数标准(6 lgCFU/g),各PPE处理组的菌落总数均显著低于空白对照组(P<0.05)。贮藏第9天,0.20%PPE处理组的菌落总数为6.27 lgCFU/g,显著低于其他处理组(P<0.05)。贮藏9 d后,空白对照组牦牛肉糜所包含的菌落总数从5.04 lgCFU/g增加到8.45 lgCFU/g,增加67.66%。结果表明,PPE能够抑制牦牛肉糜中微生物的生长,延长其货架期,添加0.20%PPE的效果最好。石榴皮中富含多酚类物质,可抑制微生物的生长,其作用机制可能与它们的化学结构有关,如引起微生物的形态变化,破坏细菌细胞壁,导致细胞内成分泄露。此外,多酚还会抑制细菌生物膜的形成,影响蛋白质的生物合成并改变细菌细胞的代谢过程,抑制ATP和DNA合成[18]。研究表明,不同品种的PPE会影响其抑菌活性,例如,与酸、甜型石榴品种相比,酸甜型中鞣花酸浓度最高的PPE,其抑菌活性也最强[19],而植物提取物作为多酚混合物,对微生物生长的影响比单一化合物更大。例如,含槲皮素的葡萄提取物比相同浓度的合成纯槲皮素对蜡样芽孢杆菌的抑菌效果更好[20]。因此,PPE的成分之间可能会产生积极的协同作用,从而产生较强的抗菌活性。
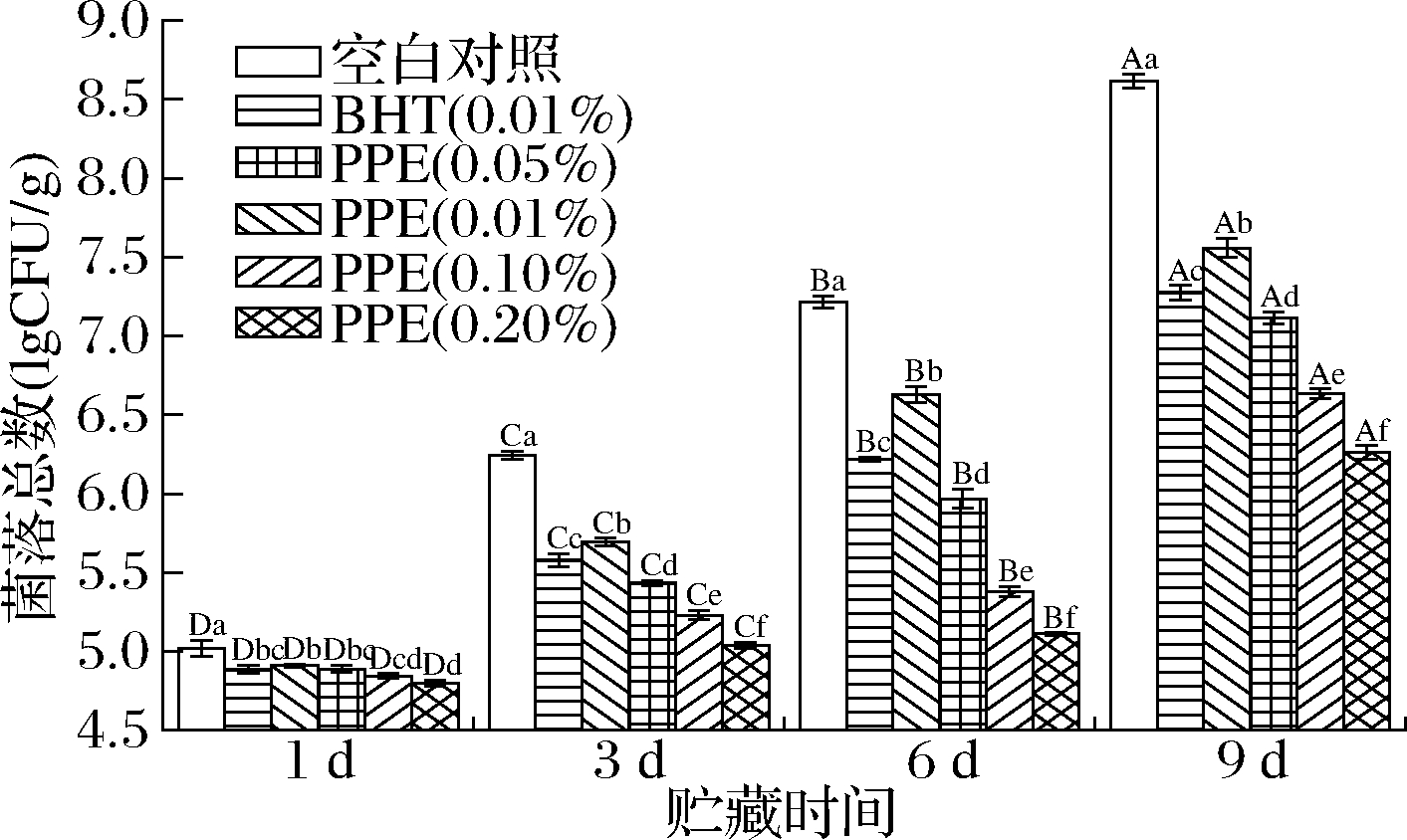
图3 PPE对牦牛肉糜菌落总数的影响
Fig.3 Effect of PPE on the total bacterial count of yak minced meat colonies
2.5 PPE对牦牛肉糜羰基含量的影响
羰基含量可作为判断肉及肉制品中蛋白质氧化氧化程度的重要指标,氨基酸侧链的直接氧化、肽骨架的断裂、与还原糖发生反应以及结合非蛋白羰基化合物均可产生羰基物质[21]。如图4所示,贮藏前6 d,0.01%、0.05%PPE处理组羰基含量显著低于空白对照组(P<0.05),说明PPE可以有效减少牦牛肉糜中蛋白质的氧化损伤。所有试验组羰基含量在贮藏第6天出现显著下降(P<0.05),这可能与蛋白质氨基酸残基中的部分醛基被进一步氧化为羧基、醛基与相邻氨基酸的氨基作用形成共价键等原因有关。整个贮藏期内,0.20% PPE处理组羰基含量始终高于空白对照组。贮藏前6 d,羰基含量随PPE添加量的增加而递增,与李颖等[6]的研究结果不一致,这可能与PPE中较高的鞣花酸含量(40%)有关,即较高浓度的鞣花酸会促进肌原纤维蛋白羰基含量的增加[22]。CANDO等[23]观察到柳叶菜提取物中较多的鞣花酸也会促进冷鲜牛肉饼中羰基含量的增加,这可能是因为某些酚类化合物可转化为相应的醌类衍生物,作为促氧化剂加速蛋白质羰基化,其抗氧化活性取决于本身特定的结构、浓度和氧化条件。
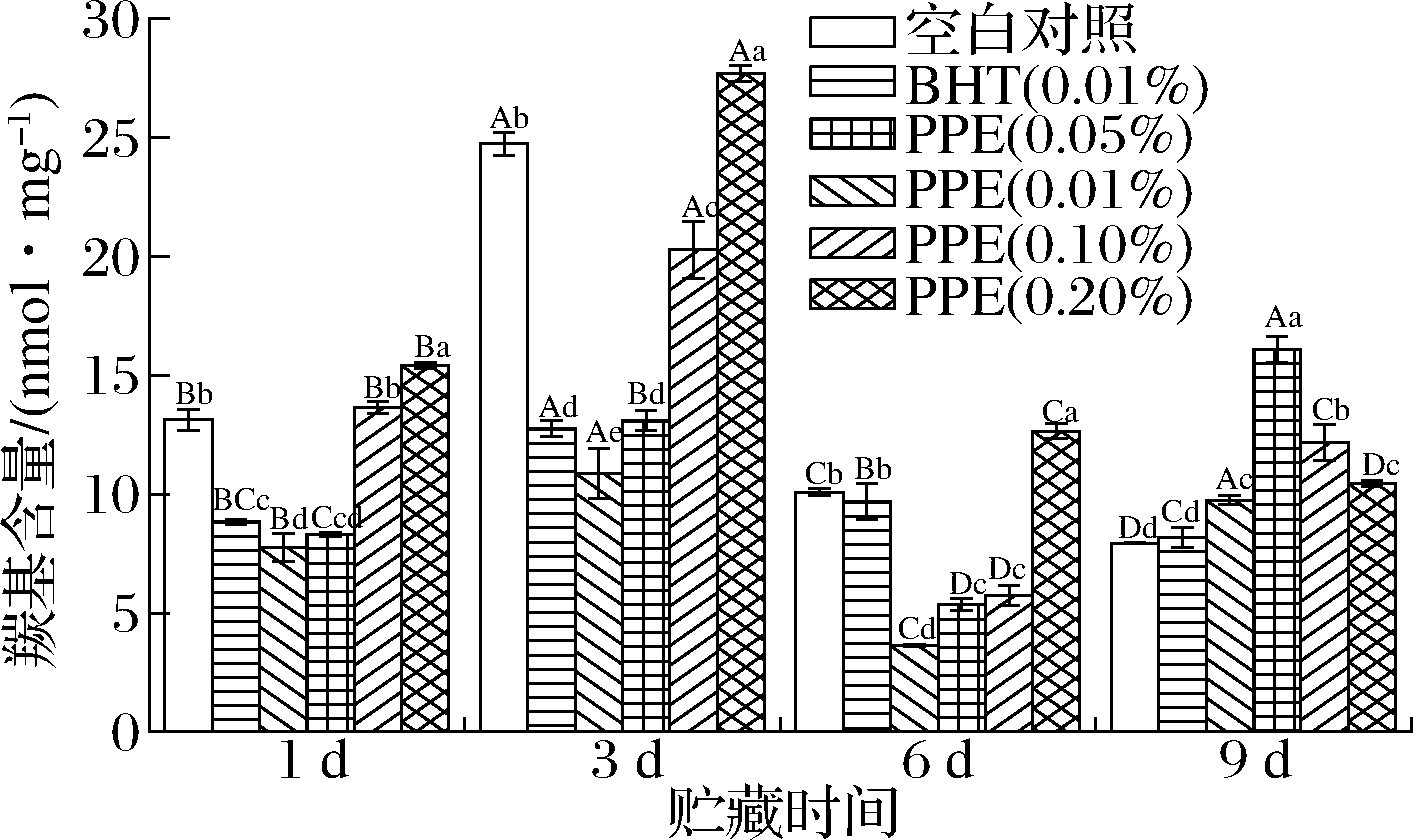
图4 PPE对牦牛肉糜羰基含量的影响
Fig.4 Effect of PPE on the carbonyl content of yak minced meat
2.6 PPE对牦牛肉糜总巯基含量的影响
总巯基含量是评定蛋白质氧化程度的一个重要指标。如图5所示,随着贮藏时间的延长,总巯基基含量逐渐下降,贮藏前3 d下降缓慢,之后迅速下降。贮藏结束时,空白对照组与0.10%PPE处理组的总巯基含量差异显著(P<0.05),分别由最初的20.92、23.06 nmol/mg下降到6.17、10.15 nmol/mg,分别下降70.51%、55.98%,说明PPE表现出抑制蛋白质巯基损失的能力。贮藏第9天,0.05%PPE处理组与0.01%BHT处理组、0.10%PPE处理组与0.20%PPE处理组间的总巯基含量无显著差异(P>0.05),各PPE处理组的总巯基含量均显著高于空白对照组(P<0.05)。以上结果表明,添加PPE对蛋白总巯基含量下降有很好的抑制效果,可减少巯基损失,其中添加0.20%PPE效果最好。
蛋白质的氨基酸侧链易受自由基攻击而氧化,导致蛋白质分子结构展开,构象发生变化,包埋在内部的疏水基团和巯基暴露。巯基受到氧化攻击后会形成分子内及分子间二硫键或磺酸等化合物,导致肌原纤维蛋白中的巯基含量下降[24]。研究表明,许多天然提取物均可有效抑制蛋白巯基损失,但在肉品中加入藤茶提取物后,反而使巯基损失加速[25],这可能是因为提取物中的酚类物质被氧化形成醌,与巯基发生迈克尔加成反应生成巯基-醌加成产物,导致巯基含量降低[26]。

图5 PPE对牦牛肉糜总巯基含量的影响
Fig.5 Effect of PPE on the total sulfhydryl content of yak minced meat
2.7 PPE对牦牛肉糜TBARS值影响
PPE对牦牛肉糜TBARS值的影响如图6所示,随着贮藏时间延长,TBARS值逐渐上升。与贮藏第1天相比,空白对照组的TBARS值在第9天显著上升(P<0.05),高达0.16 mg MDA/kg,升高89.48%。贮藏第9天,各PPE处理组样品的TBARS值无显著差异(P>0.05)。添加PPE的各组TBARS值在贮藏期内显著低于空白对照组(P<0.05),说明PPE具有很好的延缓牦牛肉糜脂质氧化的能力,对TBARS的形成有显著的抑制作用(P<0.05),添加0.20%PPE的效果最好。脂质氧化过程中经自由基链式反应产生的氢过氧化物可分解产生如醛、酮、醇和短链羧酸等物质并导致肉样异味的产生。石榴皮中的酚类物质具有较强的自由基清除能力,可作为还原剂、氢供体、单线态氧淬灭剂、超氧阴离子自由基清除剂,甚至还可以作为金属螯合剂[8],抑制脂质氧化。其他植物如柳叶菜[23]、藤茶[25]的提取物也能有效抑制肉品中TBARS值的上升。
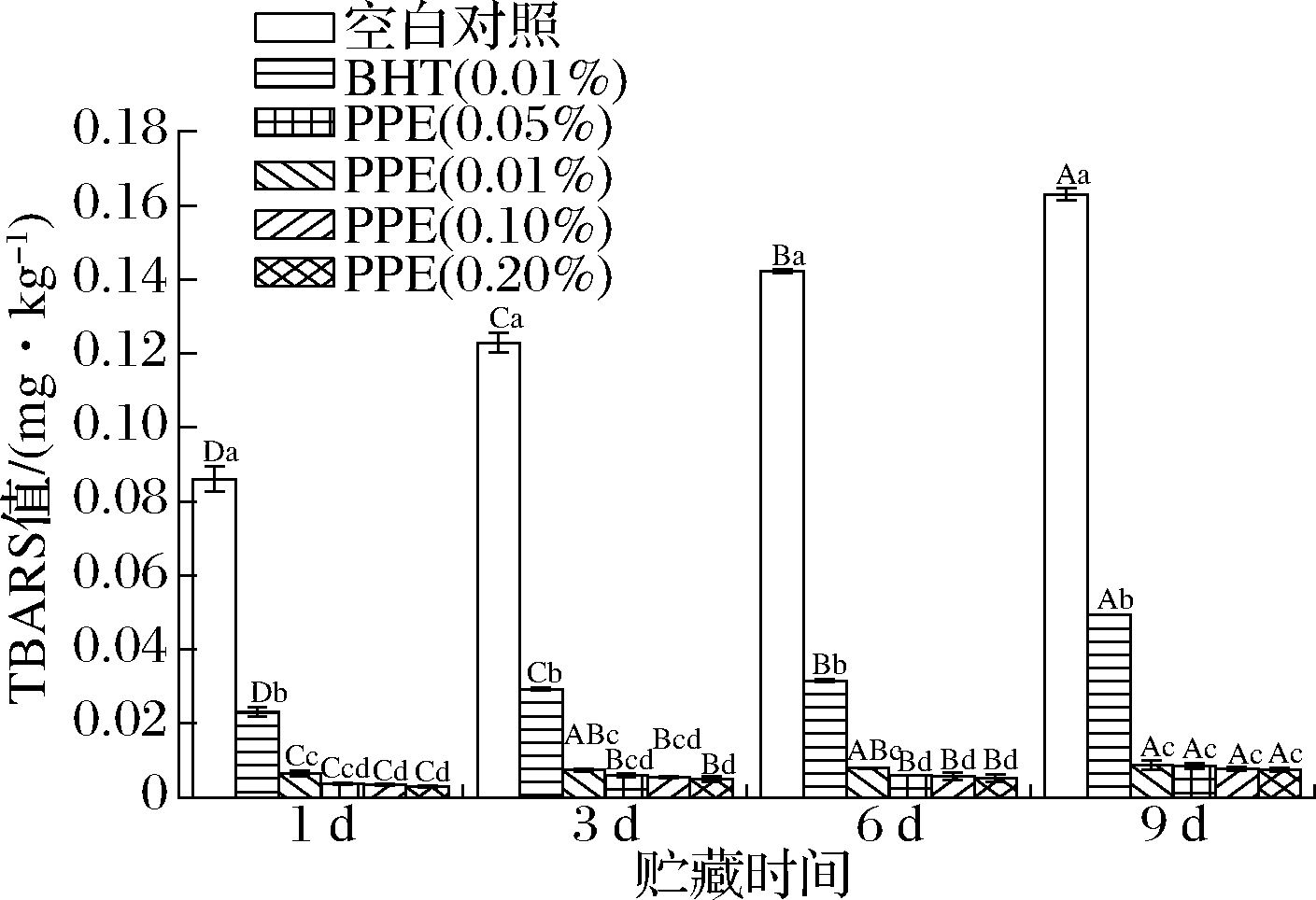
图6 PPE对牦牛肉糜TBARS值的影响
Fig.6 Effect of PPE on the TBARS value of yak minced meat
2.8 PPE对牦牛肉糜流变学性质的影响
动态流变学特性与蛋白质分子、化合物、分子内和分子间的键合、结构组织和分散状态密切相关,它能反映肌原纤维蛋白的变化以及蛋白特别是肌球蛋白间的相互作用。G′可衡量蛋白质的凝胶能力,G′值越高意味着凝胶能力越强。如图7所示,与空白对照相比,PPE的添加会影响牦牛肉糜在加热过程中G′值的变化。各试验组有着相似的加热曲线,在加热过程中肉糜蛋白质变性,涉及3个阶段:首先,20~41 ℃,G′缓慢下降,主要是因为肌原纤维蛋白发生溶解和溶胀,受热过程中发生折叠,导致G′下降[27];42~57 ℃,G′有轻微增加,这是由于蛋白质之间发生相互作用导致凝胶化[28];最后,58~80 ℃,G′快速上升,其原因是温度升高导致肌球蛋白分子的构象松散展开,活性基团暴露,实现交联,形成牢固、不可逆、具有弹性的三维凝胶结构[29]。
空白对照组牦牛肉糜凝胶加热结束时,G′值在第0天为63 945.2 Pa,在第3、6、9天分别下降为63 515.1、54 987.4、47 088.4 Pa。另外,贮藏时间延长,添加PPE和BHT的肉糜样品的G′值也逐渐降低,这主要是因为贮藏过程中蛋白质结构发生变化,凝胶形成能力降低。当达到50 ℃以后,各PPE处理组的G′值高于对照组,说明在凝胶加强阶段,PPE可促进肉糜形成凝胶的能力。0.10%、0.20%PPE处理组的G′值在整个贮藏期内始终高于其他处理组且添加0.20%PPE处理组的效果最好。
由于氧化作用,牦牛肉糜中肌原纤维蛋白的构象发生很大的变化,导致其成胶能力和凝胶强度的降低,PPE中富含的鞣花酸等多酚类物质,可有效减少此类情况的发生。JIA等[30]报道,酚类化合物如儿茶素会引起肌原纤维蛋白凝胶特性的严重恶化,这与本研究结果不一致,可能是因为儿茶素可以通过改变蛋白质的引力、排斥力、疏水性、氢键或其他相互作用力来干扰蛋白质凝胶的形成。
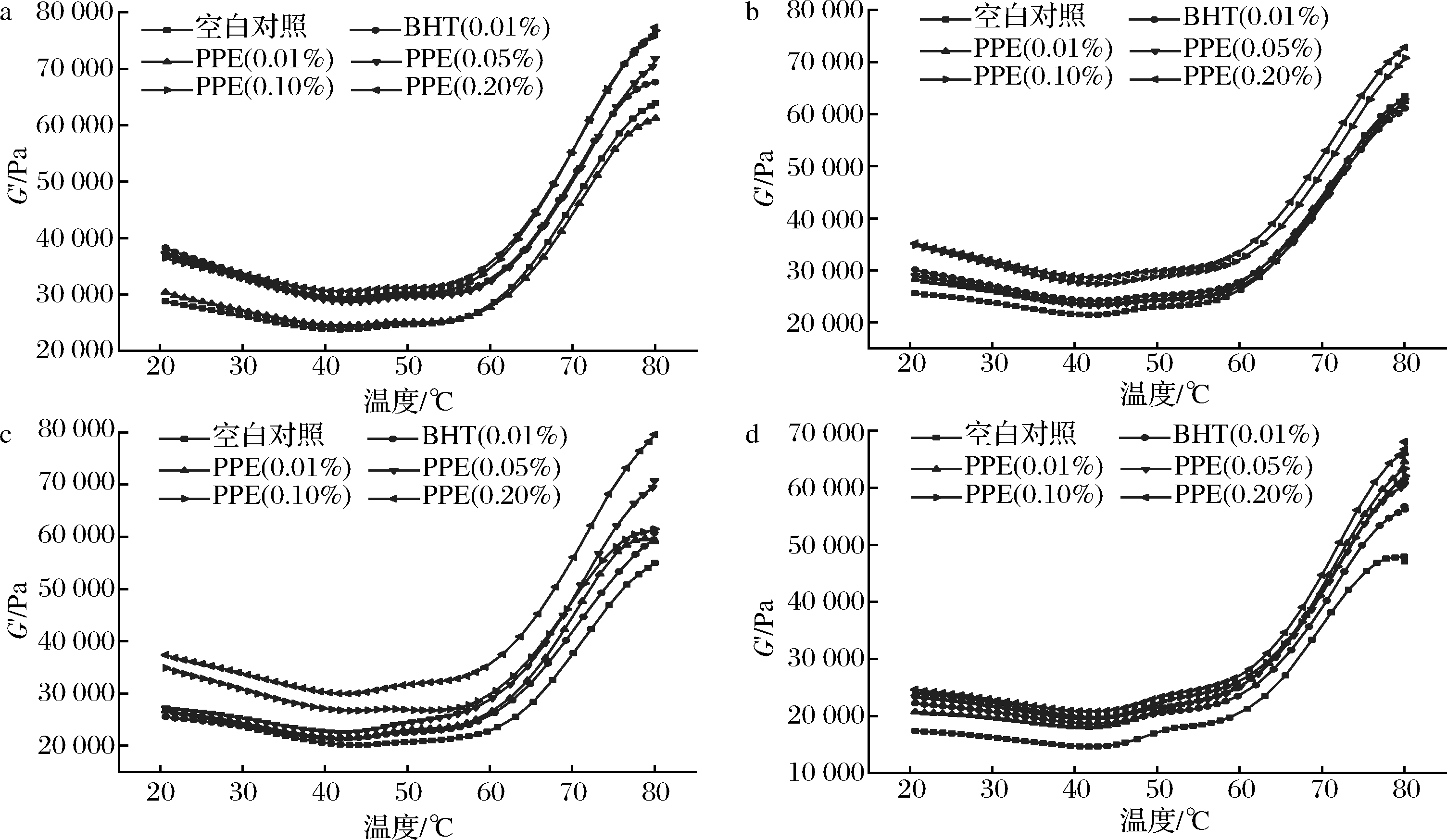
a-贮藏第1天;b-贮藏第3天;c-贮藏第6天;d-贮藏第9天
图7 PPE对牦牛肉糜流变学性质的影响
Fig.7 Effect of PPE on the rheological properties of yak minced meat
3 结论
PPE中富含鞣花酸等酚类物质,具有很强的抗氧化作用,对牦牛肉糜的pH值和持水力有积极影响,可抑制贮藏过程中牦牛肉糜pH值的增加和持水力的降低,并显著改善b*值(P<0.05),但在贮藏初期对L*值、a*值有一定的负面作用;PPE具有显著的抗菌作用(P<0.05),可抑制牦牛肉糜中微生物的生长,提高其新鲜度,延长肉糜货架期3~6 d;当PPE添加量为0.01%、0.05%时,可降低牦牛肉糜羰基含量,但PPE添加量为0.20%时,PPE可能转化为醌类衍生物,促进羰基的形成;PPE可显著抑制牦牛肉糜总巯基含量降低(P<0.05),其抑制效果随添加量的增加而递增;在抑制脂肪氧化方面, 0.01%的PPE添加量即可显著抑制TBARS值增加(P<0.05),但提高PPE的添加量对TBARS值的影响无显著差异(P>0.05);动态流变特性测定结果表明,添加PPE可增加50 ℃和80 ℃的G′值,改善牦牛肉糜的流变特性。综合来看,PPE的保鲜效果随添加量的增加而递增,当添加量为0.20%时效果最好,继续增大PPE的添加量可能会引起牦牛肉糜色泽的劣变并加速羰基含量的积累。本试验对富含鞣花酸的PPE改善牦牛肉糜制品贮藏期间理化特性和流变特性进行验证,为富含鞣花酸PPE的开发利用、提高牦牛肉糜制品品质及延长货架期提供了一定的理论依据。
[1] 彭新颜, 许晶, 杨阳, 等.乳清多肽对猪肉糜氧化和凝胶特性的影响[J].食品科学, 2016, 37(21):31-37.
PENG X Y, XU J, YANG Y, et al.Effect of whey protein peptides on lipid oxidation and gel properties of pork patties [J].Food Science, 2016, 37(21):31-37.
[2] UTRERA M, PARRA V, ESTÉVEZ M.Protein oxidation during frozen storage and subsequent processing of different beef muscles[J].Meat Science, 2014, 96(2):812-820.
[3] TURGUT S S, I IKÇI F, SOYER A.Antioxidant activity of pomegranate peel extract on lipid and protein oxidation in beef meatballs during frozen storage[J].Meat Science, 2017, 129:111-119.
IKÇI F, SOYER A.Antioxidant activity of pomegranate peel extract on lipid and protein oxidation in beef meatballs during frozen storage[J].Meat Science, 2017, 129:111-119.
[4] 丁楠, 高晓黎.HPLC法测定石榴皮提取物中鞣花酸的含量[J].新疆医科大学学报, 2012, 35(6):770-772.
DING N, GAO X L.Determination of ellagic acid in the extract of pomegranate peel by HPLC[J].Journal of Xinjiang Medical University, 2012, 35(6):770-772.
[5] 焦士蓉, 唐子尧, 孙博瑞, 等.石榴皮提取物和鞣花酸对人脂肪干细胞增殖和分化的影响[J].西华大学学报(自然科学版), 2019, 38(2):48-51.
JIAO S R, TANG Z Y, SUN B R, et al.Effect of pomegranate peel extract and ellagic acid on human adipose-derived cells proliferation and differentiation [J].Journal of Xihua University (Natural Science Edition), 2019, 38(2):48-51.
[6] 李颖, 李保玲, 董新玲, 等.石榴皮提取物对生猪肉饼品质的影响[J].肉类研究, 2020, 34(1):45-50.
LI Y, LI B L, DONG X L, et al.Effect of pomegranate peel extract on quality and storage stability of raw pork patties[J].Meat Research, 2020, 34(1):45-50.
[7] ÖZTÜRK T, TURHAN S.Physicochemical properties of pumpkin (Cucurbita pepo L.) seed kernel flour and its utilization in beef meatballs as a fat replacer and functional ingredient[J].Journal of Food Processing & Preservation, 2020, 44(9):e14695.
[8] VILLALOBOS-DELGADO L H, GONZ LEZ-MONDRAG
LEZ-MONDRAG N E G, RAM
N E G, RAM REZ-ANDRADE J, et al.Oxidative stability in raw, cooked, and frozen ground beef using Epazote (Chenopodium ambrosioides L.)[J].Meat Science, 2020, 168:108187.
REZ-ANDRADE J, et al.Oxidative stability in raw, cooked, and frozen ground beef using Epazote (Chenopodium ambrosioides L.)[J].Meat Science, 2020, 168:108187.
[9] LI X X, SUN P, JIA J Z, et al.Effect of low frequency ultrasound thawing method on the quality characteristics of Peru squid(Dosidicus gigas)[J].Ciencia y Tecnologia De Los Alimentos Internacional, 2019,25(2):171-181.
[10] OLIVER C N, AHN B W, MOERMAN E J, et al.Age-related changes in oxidized proteins[J].Journal of Biological Chemistry, 1987, 262(12):5 488-5 491.
[11] ZHANG Z Y, REGENSTEIN J M, ZHOU P, et al.Effects of high intensity ultrasound modification on physicochemical property and water in myofibrillar protein gel[J].Ultrasonics Sonochemistry, 2017, 34:960-967.
[12] 高爱武, 赵娇, 李立敏, 等.抗氧化处理对风干肉贮藏期间质构特性的影响[J].肉类研究, 2018, 32(11):30-35.
GAO A W, ZHAO J, LI L M, et al.Effect of antioxidant treatment on texture characteristics of air-dried meat during storage [J].Meat Research, 2018, 32(11):30-35.
[13] 彭新颜, 刘媛, 贺红军, 等.乳清多肽对抑制反复冻融猪肉糜氧化和改善品质的影响[J].食品科学, 2020, 41(4):7-14.
PENG X Y, LIU Y, HE H J, et al.Effects of whey protein peptides on oxidation inhibition and quality improvement of chopped pork during repeated freezing-thawing [J].Food Science, 2020, 41(4):7-14.
[14] ELHADEF K, SMAOUI S, HLIMA H B, et al.Effects of Ephedra alata extract on the quality of minced beef meat during refrigerated storage:A chemometric approach[J].Meat Science, 2020, 170:108246.
[15] 李建科, 李国秀, 赵艳红, 等.石榴皮多酚组成分析及其抗氧化活性[J].中国农业科学, 2009, 42(11):4 035-4 041.
LI J K, LI G X, ZHAO Y H, et al.Composition of pomegranate peel polyphenols and its antioxidant activities[J].Agricultural Sciences in China, 2009, 42(11):4 035-4 041.
[16] 李伟, 张小英, 陈熔, 等.桉叶多酚对冷却猪肉的保鲜效果[J].食品与发酵工业, 2020, 46(11):252-257.
LI W, ZHANG X Y, CHEN R, et al.Preservative effects of Eucalyptus robusta leaves polyphenols extact on chilled pork[J].Food and Fermentation Industries, 2020, 46(11):252-257.
[17] 宁云霞, 杨淇越, 鲍佳彤, 等.抗氧化剂对未漂洗革胡子鲶鱼鱼糜品质的影响[J].肉类研究, 2020, 34(7):84-90.
NING Y X, YANG Q Y, BAO J T, et al.Effect of antioxidants on the quality of unrinsed Clarias gariepinus surimi[J].Meat Research, 2020, 34(7):84-90.
[18] EFENBERGER-SZMECHTYK M, NOWAK A, CZYZOWSKA A.Plant extracts rich in polyphenols:Antibacterial agents and natural preservatives for meat and meat products[J].Critical Reviews in Food Science and Nutrition, 2021, 61(1):149-178.
[19] ROSAS-BURGOS E C, BURGOS-HERN NDEZ A, NOGUERA-ARTIAGA L, et al.Antimicrobial activity of pomegranate peel extracts as affected by cultivar[J].Journal of the Science of Food and Agriculture, 2017, 97(3):802-810.
NDEZ A, NOGUERA-ARTIAGA L, et al.Antimicrobial activity of pomegranate peel extracts as affected by cultivar[J].Journal of the Science of Food and Agriculture, 2017, 97(3):802-810.
[20] SERRA A T, MATIAS A A, NUNES A V M, et al.In vitro evaluation of olive- and grape-based natural extracts as potential preservatives for food[J].Innovative Food Science and Emerging Technologies, 2008, 9(3):311-319.
[21] 崔旭海, 孔保华.蛋白质氧化及其对乳蛋白结构与功能性的影响[J].中国乳品工业, 2008, 36(1):44-47.
CUI X H, KONG B H.Protein oxidation and its effects on the structure and functional properties of milk proteins[J].China Dairy Industry, 2008, 36(1):44-47.
[22] 张慧芸, 吴静娟, 郭新宇.多酚对猪肉肌原纤维蛋白氧化和凝胶特性的影响[J].食品科学, 2016, 37(21):43-47.
ZHANG H Y, WU J J, GUO X Y.Effect of polyphenols on the oxidation and gel properties of pork myofibrillar protein [J].Food Science, 2016, 37(21):43-47.
[23] CANDO D, MORCUENDE D, UTRERA M, et al.Phenolic-rich extracts from Willowherb (Epilobium hirsutum L.) inhibit lipid oxidation but accelerate protein carbonylation and discoloration of beef patties[J].European Food Research and Technology, 2014, 238(5):741-751.
[24] 蒋祎人, 李涛, 刘友明, 等.丙二醛氧化修饰对白鲢肌原纤维蛋白结构性质的影响[J].食品科学, 2020, 41(6):1-7.
JIANG Y R, LI T, LIU Y M, et al.Effect ofmalondialdehyde-induced protein oxidation on structural properties of myofibrillar protein from silver carp(Hypophthalmichthys molitrix)[J].Food Science, 2020, 41(6):1-7.
[25] 张煊, 徐玉, 薛海, 等.藤茶提取物对素肉丸冷藏期间脂质和蛋白质氧化的抗氧化活性影响[J].食品科学, 2020, 41(3):212-217.
ZHANG X, XU Y, XUE H, et al.Antioxidant activity of vine tea(Ampelopsis grossedentata) extract on lipid and protein oxidation in vegetarian meatballs during refrigerated storage[J].Food Science, 2020, 41(3):212-217.
[26] 贾娜, 林世文, 刘丹, 等.芦丁诱导猪肉肌原纤维蛋白结构变化对蛋白凝胶特性的改善作用[J].食品科学, 2021, 42(8):67-73.
JIA N, LIN S W, LIU D, et al.Improvement effects of structural changes of pork myofibrillar protein induced by rutin onits gel properties[J].Food Science, 2021, 42(8):67-73.
[27] 王希希, 李康, 黄群, 等.刺麒麟菜对鸡胸肉糜凝胶特性和流变特性的影响[J].食品科学, 2018, 39(5):76-80.
WANG X X, LI K, HUANG Q, et al.Effect of Eucheuma spinosum on gelation and rheological properties of chicken breast batters[J].Food Science, 2018, 39(5):76-80.
[28] KANG Z L, HU S J, ZHU D Y, et al.Effect of sodium chloride and processing methods on protein aggregation, physical-chemical and rheological properties of pork batters[J].International Journal of Food Engineering, 2018, 14(5-6):20170319.
[29] HUANG L, DING B, ZHANG H, et al.Textural and sensorial quality protection in frozen dumplings through the inhibition of lipid and protein oxidation with clove and rosemary extracts[J].Journal of the Science of Food and Agriculture, 2019, 99(10):4 739-4 747.
[30] JIA N, WANG L T, SHAO J H, et al.Changes in the structural and gel properties of pork myofibrillar protein induced by catechin modification[J].Meat Science, 2017, 127:45-50.