鲜切蔬菜加工和货架销售过程中会产生色变、质变、腐败等多种品质劣变现象,降低产品商品价值,缩短货架期,产品的品质保持技术成为了研究热点[1-2]。相关研究表明,温度是影响生鲜产品货架期品质变化的主要因素,通常低温有利于产品品质保持[3-4],但低温也会造成部分果蔬产品发生冷害、风味流失等不利症状[5],鲜切蔬菜产品货架温度并非越低越好。同时,在生产中维持低温环境会造成经营成本升高等负担,且鲜切蔬菜产品在加工和物流销售环节常出现冷链断链和温度大幅度波动等现象[6]。因此,明确鲜切蔬菜产品在不同货架条件下品质的变化规律,有利于为生产经营提供更经济有效的产品流通方案。山药是一种重要的根茎类蔬菜,切分加工后极易发生色泽质地改变和腐烂等现象[7-8]。本实验以山药为研究对象,测试了1、4、8、12、20 ℃这5种生产中常见货架温度下鲜切山药产品14 d内的品质变化情况,以期进一步明确鲜切山药产品在不同货架温度下的品质动态变化规律,为生产经营中确定适宜的鲜切山药产品货架温度条件和销售期提供理论依据。
1 材料与方法
1.1 材料与试剂
山药品种为‘麻山药’,原产地河北蠡县,购于四川国际农产品交易中心,外观完整,粗细均匀,无明显病虫危害。原料采购后置于4 ℃冷库避光贮藏备用。
聚乙烯包装膜,购于四川兴达塑料有限公司,包装膜O2和CO2透过量分别为16 398.3 cm3/(m2·24 h·0.1 MPa)和68 644.9 cm3/(m2·24 h·0.1 MPa)。
多酚氧化酶(polyphenol oxidase,PPO)、过氧化物酶(peroxidase,POD)和苯丙氨酸解氨酶(L-phenylalanine ammonia-lyase,PAL)试剂盒,购于上海酶联生物科技有限公司。
1.2 仪器与设备
TW-980S蔬菜切片机和蔬菜表面脱水机,广州市天烨食品机械有限公司;CheckMate ⅡO2/CO2气体分析仪,丹麦Dansensor公司;CR-400色差仪,日本Konica Minolta公司;TA.XT Plus质构仪,英国SMS公司;Synergy HTX酶标仪,英国Bio Tek公司;5810R冷冻离心机,德国Epphendorf公司;Class Ⅱ BSC AC 2-6S1生物安全柜,新加坡ESCD公司;Scan 1200全自动螺旋接种仪和自动菌落计数器,法国Interscience公司。
1.3 实验方法
1.3.1 实验处理
鲜切山药加工工艺流程如下:
山药原料→表面清洗→次氯酸钠溶液(质量浓度100 mg/L,pH 6.5)浸泡2 min→手工削皮→清水浸泡→机械切片→清水漂洗→表面脱水→密封包装→货架贮藏
同一批山药原料统一加工后混匀随机分装到聚乙烯包装袋中密封包装,再分别放入1, 4, 8, 12, 20 ℃冷库中模拟货架贮藏并定期取样测试。山药横切圆片厚度为5 mm,包装袋尺寸为24 cm × 16 cm,每袋重量(200±5) g。
1.3.2 指标测定
1.3.2.1 包装袋内O2和CO2浓度
采用O2/CO2气体分析仪测定,结果以体积百分比表示。每种处理重复4袋。
1.3.2.2 褐变度
采用色差仪测定山药片表面色差L*,a*,b*值,并参照TEOH等[8]的方法计算山药表面褐变度(browning index,BI)。每种处理重复4袋,每袋测定10片。
1.3.2.3 硬度
采用质构仪穿刺测定山药片中心位置的硬度。测试探头为A/MORS,测试速度2 mm/s,果肉硬度定义为探头穿刺深度1.2~1.8 mm所得硬度的平均值(g)。每种处理重复4袋,每袋测定10片。
1.3.2.4 感官品质
总体感官质量参考BAI等[9]的方法进行人工打分评价,参评人员5人,每种处理重复评价4袋。
1.3.2.5 菌落总数
菌落总数参照GB/T 4789.2—2010[10]方法测定,每个样品重复2个平板,每种处理重复测定4袋。
1.3.2.6 酶活性变化
PPO、POD和PAL活性使用试剂盒按照双抗体夹心法测定。所有测试样品在不同贮藏期取样后液氮粉碎保存于-80 ℃条件下,贮藏期结束后统一测定,每种处理重复4袋。
1.3.3 数据处理
采用SigmaPlot 12.3软件作图,数据结果取平均值±标准误差(SE);使用IBM SPSS Statistics 22软件对数据进行统计分析,利用邓肯氏新复极差法比较因素水平间的显著型方差分析。
2 结果与分析
2.1 包装袋内O2和CO2浓度变化
由图1-a和图1-b可知,不同货架温度下各处理鲜切山药在14 d贮藏过程中O2和CO2浓度变化差异明显,多数处理(4、8和12 ℃处理)随着贮藏时间延长包装袋内O2浓度呈缓慢降低趋势(降低3.25%~5.58%),CO2浓度则缓慢升高(升高1.85%~2.53%);1 ℃处理贮藏期内O2浓度无显著性变化(P>0.05),CO2浓度至第14天时显著升高(P<0.05);20 ℃处理O2浓度始终处于较低水平(12.17%~12.71%),而CO2浓度处于最高水平(4.2%~5.95%)。由于20 ℃处理贮藏至第7天时产品已失去食用价值,因此,终止了后续实验。

a-O2;b-CO2
图1 各处理鲜切山药包装袋内O2和CO2浓度
Fig.1 Concentration of O2 and CO2 in packaged fresh-cut yams of each treatment
2.2 切片表面BI变化
采用BI表示鲜切山药片表面褐变程度的变化水平(图2),可以清晰看出各处理鲜切山药片BI值呈规律性的增长变化,且BI值与货架温度呈正相关。1 ℃处理BI值最低,在14 d增长幅度最小,20 ℃处理最高。从各处理贮藏期间的照片(图3)也可以看出,1 ℃处理在贮藏期内表面颜色变化较小,第14天时仅有少量山药片边缘呈现出轻微颜色变化;而其余4个处理第7天时山药片均已产生可见色变,其中20 ℃ 处理所有山药片呈现黄褐色。

图2 各处理鲜切山药片表面褐变度变化
Fig.2 Changes of surface browning degree of fresh-cut yams of each treatment

图3 各处理鲜切山药贮藏照片
Fig.3 Storage photos of fresh-cut yams of each treatment
2.3 果肉硬度变化
各处理随着贮藏期延长,鲜切山药片果肉硬度均呈现不同程度的增高趋势(图4)。其中20 ℃处理增长速度最快,第7天时较初始第1天硬度增加83.27%;而1、4和8 ℃处理增长速度相对较小(第14 天较第1天硬度增长值16.81%~18.07%);12 ℃处理前期变化较缓慢,第14天时显著快速增高(P<0.05)。
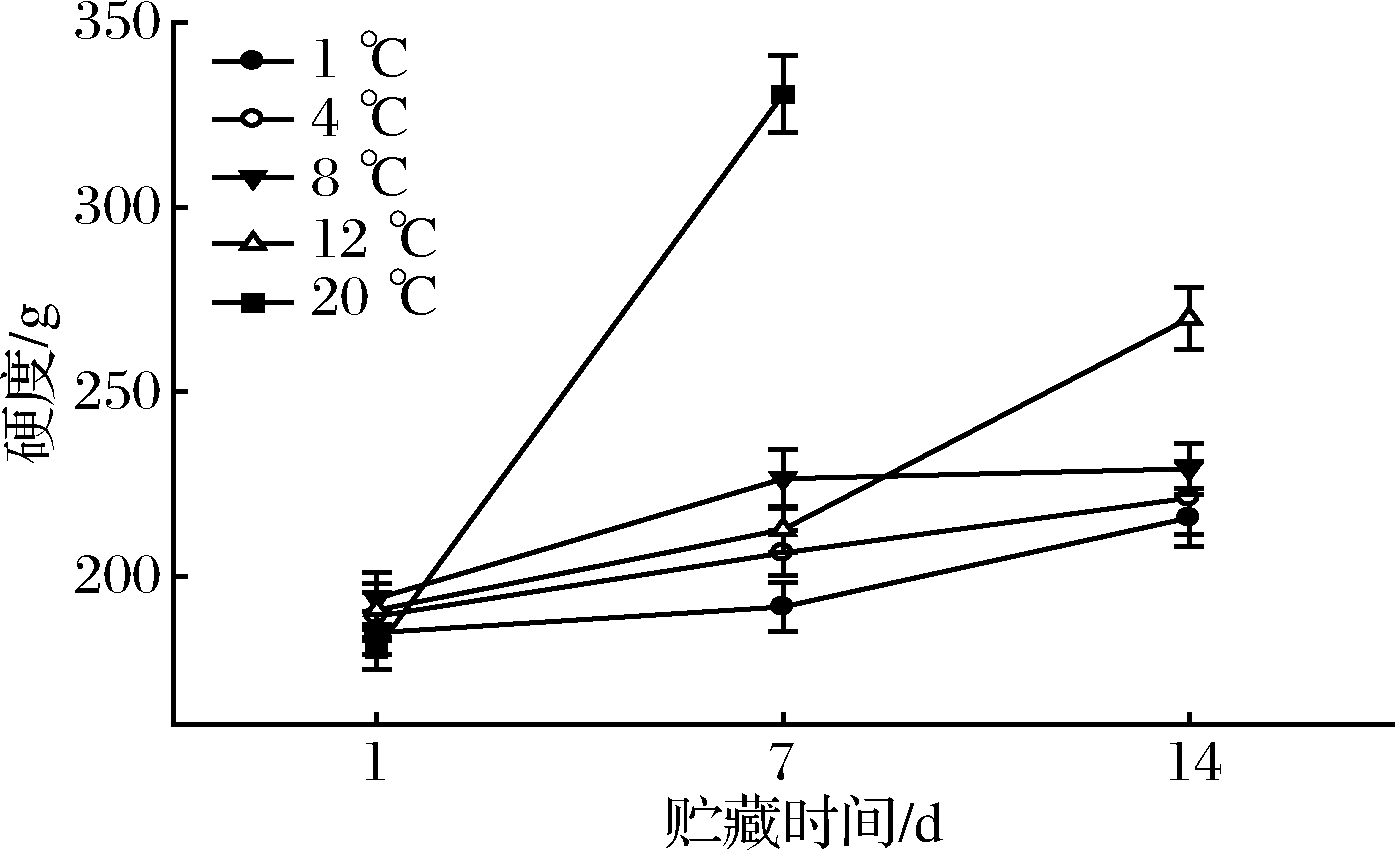
图4 各处理鲜切山药果肉硬度变化
Fig.4 Changes of firmness of fresh-cut yams of each treatment
2.4 总体感官质量变化
各处理鲜切山药总体感官质量均伴随着贮藏期的延长而逐渐降低,其中20 ℃处理降幅最快,至第7天已低于产品食用标准(3分);4、8和12 ℃处理贮藏至第7天时总体感官值低于商品临界标准(5分),至第14天时均已低于食用标准;1 ℃处理贮藏至第14天总体感官质量达到(4.85±0.42)分。
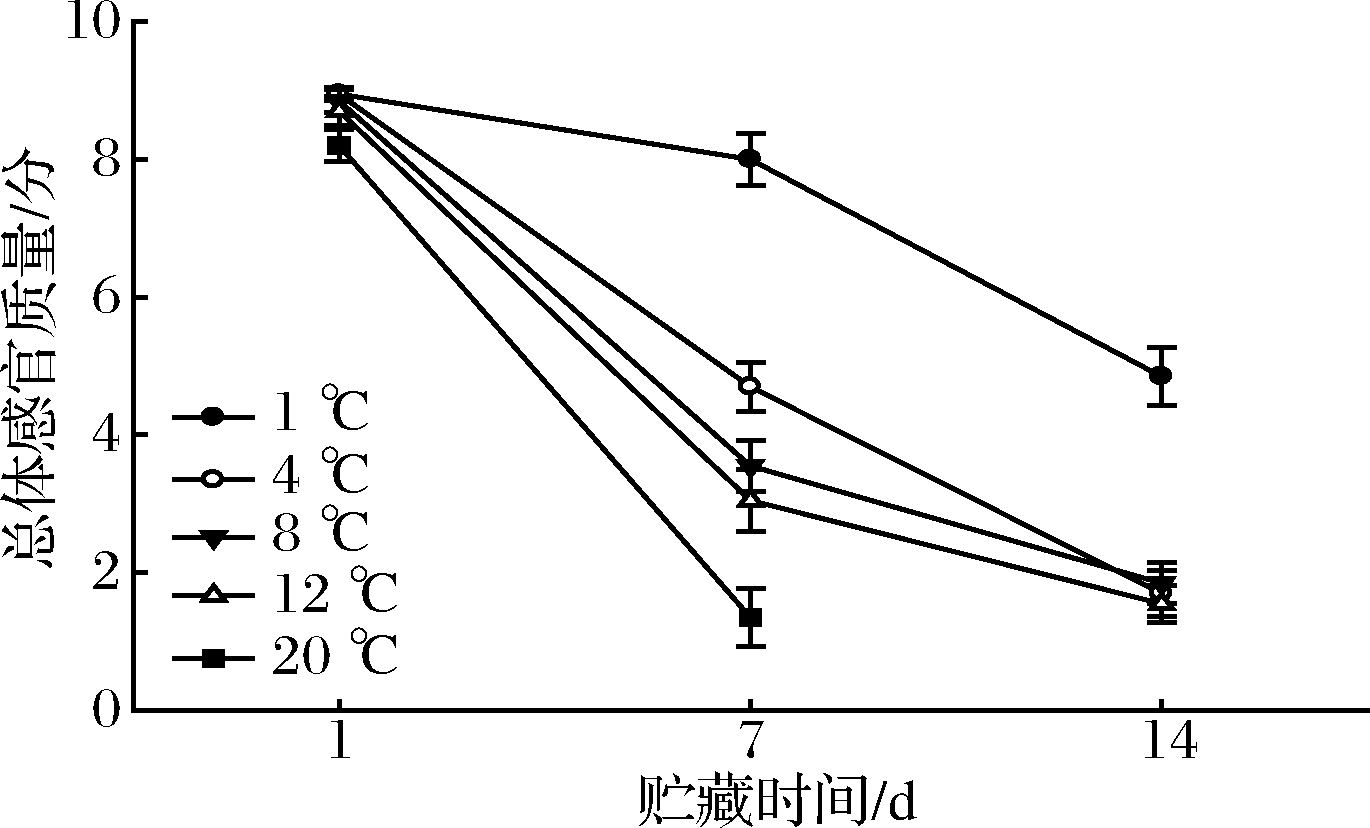
图5 各处理鲜切山药总体感官质量变化
Fig.5 Changes of over visual quality of fresh-cut yams of each treatment
2.5 菌落总数变化
各处理菌落总数随着贮藏时间延长均呈现快速增长趋势(图6),第7天增长幅度达(2.33~3.77) lgCFU/g,第7~14天增幅放缓至(0.36~1.29) lgCFU/g;其中20 ℃处理在初始第1天时菌落总数5.48 lgCFU/g显著高于其他处理,比1 ℃处理高56.73%;8 ℃和12 ℃处理相对次之,1和4 ℃处理显著较低(P<0.05)。
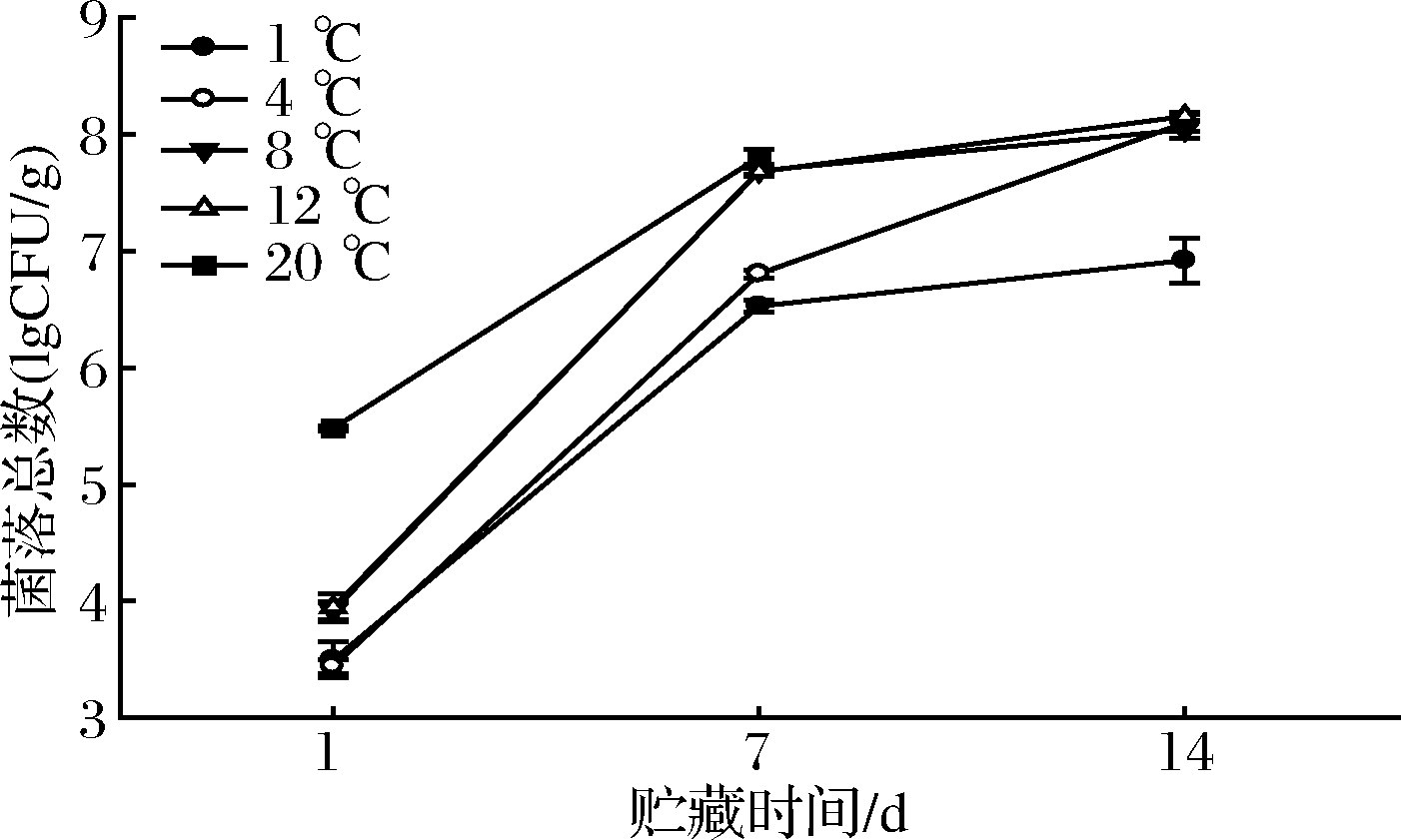
图6 各处理鲜切山药菌落总数变化
Fig.6 Changes of total plate count of fresh-cut yams of each treatment
2.6 酶活性变化
分析各处理鲜切山药片贮藏过程中酶活性变化情况可知(表1),随着贮藏期的延长,5个处理PPO活性均呈现增长趋势;其中1 ℃处理增幅最低,第14天较第1天增长了49.96%;20 ℃处理相对增幅最快,第7天较第1天增长了157.95%。各处理POD活性则随着贮藏期延长表现出不规律变化,其中1 ℃和8 ℃处理POD活性变化差异不显著,4 ℃和12 ℃处理整体呈小幅下降趋势(降低幅度为17.76%~69.33%);而20 ℃处理第1天和第7天测试数据差异较小。各处理PAL活性随贮藏期延长呈缓慢上升趋势;其中1 ℃ 处理14 d内变化差异不显著;12 ℃处理第14天较第1天增幅相对较高,达87.91%;20 ℃处理第7天较第1天增长48.95%。各处理间3个贮藏期内PPO、POD和PAL活性变化均无明显规律,但PAL活性在整个贮藏期内的测定值大幅低于PPO和POD活性。以1 ℃处理为例,第1天时PPO活性是PAL活性的13.33倍,POD活性是PAL活性的16.35倍;而20 ℃处理第1天的PPO活性是PAL活性的22.38倍,PPO活性是PAL活性的27.13倍。从酶活性的增长速率来看,1 ℃处理第14天的PPO活性比第1天增长了49.96%,POD活性降低28.82%,PAL活性增长54.81%;12 ℃处理PPO活性增长97.28%,POD活性降低59.61%,PAL活性增长87.91%。可见不同温度下3种酶活性在14 d内的变化幅度存在差异,PPO和PAL活性的增幅大于POD活性降幅。
表1 各处理鲜切山药贮藏过程中酶活性变化
Table 1 Changes of enzyme activities in fresh-cut yams during storage
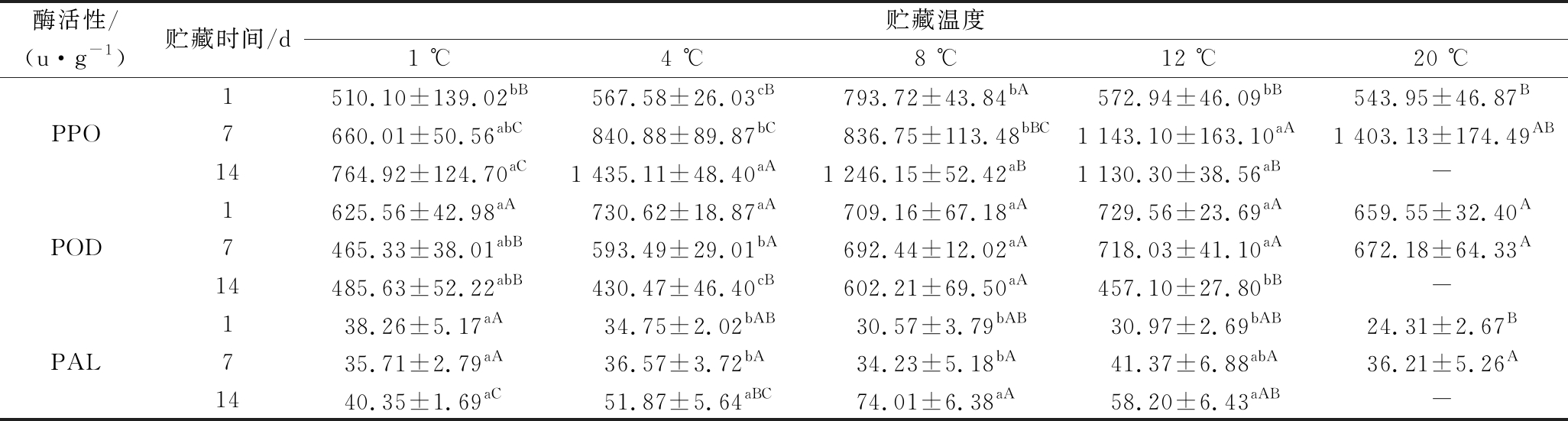
酶活性/(u·g-1)贮藏时间/d贮藏温度1 ℃4 ℃8 ℃12 ℃20 ℃1510.10±139.02bB567.58±26.03cB793.72±43.84bA572.94±46.09bB543.95±46.87BPPO7660.01±50.56abC840.88±89.87bC836.75±113.48bBC1 143.10±163.10aA1 403.13±174.49AB14764.92±124.70aC1 435.11±48.40aA1 246.15±52.42aB1 130.30±38.56aB-1625.56±42.98aA730.62±18.87aA709.16±67.18aA729.56±23.69aA659.55±32.40APOD7465.33±38.01abB593.49±29.01bA692.44±12.02aA718.03±41.10aA672.18±64.33A14485.63±52.22abB430.47±46.40cB602.21±69.50aA457.10±27.80bB-138.26±5.17aA34.75±2.02bAB30.57±3.79bAB30.97±2.69bAB24.31±2.67BPAL735.71±2.79aA36.57±3.72bA34.23±5.18bA41.37±6.88abA36.21±5.26A1440.35±1.69aC51.87±5.64aBC74.01±6.38aA58.20±6.43aAB-
注:-表示无数据;同一测试指标同列数据不同小写字母表示贮藏时间之间的显著性差异(P<0.05),同行数据不同大写字母表示贮藏温度间的显著性差异(P<0.05)
3 结论与讨论
蔬菜经过切分等加工处理后会产生一系列的生理代谢变化,通常表现为呼吸速率加快、质地变软、外观色泽改变、营养物质流失、发生腐败现象等[11]。本实验模拟测试了5种常见货架温度下鲜切山药在14 d贮藏过程中产品品质的变化情况,实验结果表明货架贮藏温度对包装袋内O2和CO2浓度、外观色泽和BI、果肉硬度、总体感官质量、菌落总数、酶活性变化均具有明显影响。实验中采用同一批山药原料,所有切分、清洗、包装等加工过程均统一完成,因此后续测试结果间产生的差异主要由贮藏温度单一因素引起。可见,货架贮藏温度对于调控产品货架品质具有重要影响。本实验中,1 ℃条件下鲜切山药包装袋内气体成分变化相对稳定,外观色泽和硬度保持较好,总体感官质量相对更好,可见低温有利于鲜切山药产品货架品质的保持;而相对的20 ℃常温条件下鲜切山药外观品质劣变迅速。低温对于鲜切山药品质保持作用主要通过抑制呼吸,延缓组织衰老,抑制酶活性减少色变产生和抑制微生物繁殖等方面来实现。所有样品果肉硬度增高可能与贮藏过程中呼吸代谢消耗和水分散失导致果肉变硬有关,贮藏温度越高表现出果肉变硬越严重。本实验中由于清洗等加工环节未采用外源化学或物理杀菌方式进行抑菌处理,导致加工产品初始菌落总数偏高,且在后续贮藏过程中快速增加,影响了产品的安全性。可见,在鲜切蔬菜生产过程中采取相应的抑菌措施非常必要[12]。
切分造成的细胞膜结构破坏和货架过程中产品膜脂结构降解会加速各种酶反应的发生,其中酶促褐变和非酶褐变是造成鲜切蔬菜产品色变的主要问题[13]。现有研究表明,鲜切山药的色变主要表现为褐变[14]和黄变[15]2种,本实验中各处理鲜切山药片贮藏后期也表现出切片表面和边缘黄褐色变化(图3),生产中可通过多种保鲜技术联合应用的方式延缓鲜切山药色变的产生[16]。实验中测试了3种与果蔬褐变密切相关的酶(PPO、POD和PAL)在鲜切山药货架贮藏过程中的变化情况,结果显示PPO和PAL活性随着贮藏期延长有缓慢升高趋势,而POD活性有降低趋势;同一条件下货架温度越低,贮藏后期酶活性相对更低,可见低温对3种酶活性具有抑制作用。鲜切山药PPO和POD活性在贮藏过程中比PAL活性高出10倍以上,但PPO和PAL活性的变化幅度明显大于POD活性,可见PPO和PAL 2种酶在鲜切山药贮藏后期表现活跃,这可能与PPO和PAL参与酶促褐变反应和苯丙烷类代谢物的生物合成反应有关[7, 17-18]。
综上所述,相对较低的货架贮藏温度有利于延长鲜切山药货架期,在生产中鲜切山药的加工销售应尽量维持低温环境,且需要增加必要的抑菌措施。
[1] RICO D, MART N-DIANA A B, BARAT J M, et al.Extending and measuring the quality of fresh-cut fruit and vegetables:A review[J].Trends in Food Science & Technology, 2007, 18(7):373-386.
N-DIANA A B, BARAT J M, et al.Extending and measuring the quality of fresh-cut fruit and vegetables:A review[J].Trends in Food Science & Technology, 2007, 18(7):373-386.
[2] 王艳颖, 胡文忠, 庞坤, 等.机械伤害引起果蔬褐变机理的研究进展[J].食品工业科技, 2007, 28(11):230-233.
WANG Y Y, HU W Z, PANG K, et al.Research progress on browning mechanism of fruits and vegetables caused by mechanical injury[J].Science and Technology of Food Industry, 2007, 28(11):230-233.
[3] MANZOCCO L, ALONGI M, LAGAZIO C, et al.Effect of temperature in domestic refrigerators on fresh-cut Iceberg salad quality and waste[J].Food Research International, 2017, 102:129-135.
[4] KOU L, LUO Y, PARK E, et al.Temperature abuse timing affects the rate of quality deterioration of commercially packaged ready-to-eat baby spinach.Part I:Sensory analysis and selected quality attributes[J].Postharvest Biology and Technology, 2014, 91:96-103.
[5] AMARO A L, SPADAFORA N D, PEREIRA M J, et al.Multitrait analysis of fresh-cut cantaloupe melon enables iscrimination between storage times and temperatures and identifies potential markers for quality assessments[J].Food Chemistry, 2018, 241:22-231.
[6] 郭光辉, 谭锋, MONAGHAN J M, 等.鲜切生菜供应链温度波动与微生物含量变化[J].北京农学院学报, 2014, 29(4):45-48.
GUO G H, TAN F, MONAGHAN J M, et al.Correlation analysis of temperature fluctuation and microbial content changing in the fresh-cut lettuce supply chain[J].Journal of Beijing Univeristy of Agriculture, 2014, 29(4):45-48.
[7] LUO Z, WANG Y, JIANG L, et al.Effect of nano-CaCO3-LDPE packaging on quality and browning of fresh-cut yam[J].LWT - Food Science and Technology, 2015, 60(2):1 155-1 161.
[8] TEOH L S, LASEKAN O, ADZAHAN N M, et al.The effect of combinations of UV-C exposure with ascorbate and calcium chloride dips on the enzymatic activities and total phenolic content of minimally processed yam slices[J].Postharvest Biology and Technology, 2016, 120:138-144.
[9] BAI J, BALDWIN E A, FORTUNY R C S, et al.Effect of pretreatment of intact ‘Gala’ apple with ethanol vapor, heat, or 1-methylcyclopropene on quality and shelf life of fresh-cut slices[J].Journal of the American Society for Horticultural Science, 2004, 129(4):583-593.
[10] 国家食品药品监督管理总局, 国家卫生和计划生育委员会.GB/T 4789.2—2010食品安全国家标准 食品微生物学检验 菌落总数测定[S].北京:中国标准出版社, 2010.
State Food and Drug Administration, National Health and Family Planning Commission.GB/T 4789.2—2010 Determination of total number of bacterial colonies in food microbiological inspection of national standard for food safety[S].Beijing:Standards Press of China, 2010.
[11] 田密霞, 胡文忠, 王艳颖, 等.鲜切果蔬的生理生化变化及其保鲜技术的研究进展[J].食品与发酵工业, 2009, 35(5):132-135.
TIAN M X, HU W Z, WANG Y Y, et al.The research process of physiological and biochemical changes and preservation methods of fresh-cut fruits and vegetables[J].Food and Fermentation Industries, 2009, 35(5):132-135.
[12] 陈晨, 胡文忠, 姜爱丽, 等.栅栏技术在鲜切果蔬中的应用研究进展[J].食品科学, 2013, 34(11):338-343.
CHEN C, HU W Z, JIANG A L, et al.Application of hurdle technology in fresh-cut fruits and vegetables[J].Food Science, 2013, 34(11):338-343.
[13] 宋晓雪, 胡文忠, 毕阳, 等.鲜切果蔬酶促褐变关键酶的研究进展[J].食品工业科技, 2013, 34(4):390-393.
SONG X X, HU W Z, BI Y, et al.Research progress in softening mechanism and regulation of fresh-cut fruits and vegetables[J].Science and Technology of Food Industry, 2013, 34(4):390-393.
[14] MARTIN F W, RUBERTE R.The polyphenol of Dioscorea alata (yam) tubers associated with oxidative browning[J].Journal of Agricultural and Food Chemistry, 1976, 24(1):67-70.
[15] ZHAO L, WANG D, MA Y, et al.Yellow pigment formation, pigment composition, and quality of fresh-cut yam (Dioscorea opposita) slices[J].Royal Society of Chemistry, 2020, 10:1 104-1 113.
[16] 陈凤真. 鲜切山药酶促褐变及其抑制方法研究进展[J].生物学教学, 2013, 38(8):7-9.
CHENG F Z.Research progress on enzymatic browning and inhibition methods of fresh-cut yam[J].Biology Teaching, 2013, 38(8):7-9.
[17] 刘洪丽, 李洁, 王清章, 等.高浓度乙醇溶液保鲜鲜切山药研究[J].食品安全质量检测学报, 2015, 6(7):2 509-2 515.
LIU H L, LI J, WANG Q Z, et al.Study on the Chinese fresh-cut yam preserved by high concentration of ethanol solution[J].Journal of Food Safety and Quality, 2015, 6(7):2 509-2 515.
[18] 江力, 袁怀波, 周强, 等.底物和产物对鲜切山药苯丙氨酸解氨酶活性的影响[J].食品科学, 2007, 28(10):35-38.
JIANG L, YUAN H B, ZHOU Q, et al.Effects of substrate and products on activity of phenylalanine ammonia-lyase (PAL) in fresh-cut yam[J].Food Science, 2007, 28(10):35-38.