镇远道菜作为黔菜中一种色香味俱全的腌菜制品,以当地青菜为原料,经茎皮剥离、盐渍、日晒、搓揉、发酵等14道工艺加工而成,发酵后的道菜被赋予更丰富的味觉层次和更高的营养价值[1]。传统道菜的生产以自然发酵为主,该过程中蔬菜受微生物生长、酸化、蛋白质水解和低分子质量化合物分解作用的影响,在发酵及储存过程均存在亚硝酸盐和生物胺积累现象[2-3]。
生物胺是一类含氮有机化合物,适量的生物胺可提高人体免疫力,但过量外源生物胺的摄入和累积将对机体产生诸多不利影响[4]。过去对生物胺研究的热点主要集中于肉制品和水产品,除四川豆瓣酱、四川泡菜外,蔬菜中有关生物胺的研究相对较少。ANAL等[5]研究证实发酵蔬菜中生物胺主要有组胺、酪胺和丁二胺;DOEUN等[6]研究发现发酵卷心菜中丁二胺、酪胺、组胺的含量分别高达108.90、60.66、37.01 mg/kg,而唐垚等[7]发现四川工业泡菜中尸胺的含量可高达(349.43±13.23) mg/kg。因此,抑制生物胺的产生对传统发酵蔬菜的安全具有重要意义。
发酵蔬菜中生物胺的产生与原材料的卫生质量、发酵工艺和储存条件息息相关[8],虽有研究表明添加防腐剂[9],以及高压、冷冻等物理手段[10-11]或真空包装等技术可控制食品中生物胺的浓度,但这些技术同时也会对产品的风味及品质产生不可逆转的影响[12]。有研究指出,可通过抑制脱羧酶活性产胺菌的生长控制食品中生物胺的浓度,但诸如植物乳杆菌(Lactobacillus plantarum)、解淀粉芽胞杆菌(Bacillus amyloliquefaciens)、枯草芽胞杆菌(Bacillus subtilis)等[13-14]产胺菌却也是传统发酵蔬菜中的主导优势菌株,对γ-氨基丁酸[15]、抗氧化物[16]、有机酸[17]等物质的形成以及产品的色泽和风味起着重要作用,此外产胺菌的去除无法降低原料中已生成的生物胺[18]。近期研究发现生物胺含量的动态变化取自于发酵过程中产胺菌和生物胺降解菌的动态平衡,因此也可利用生物胺降解菌来控制食品中生物胺的含量[19],目前已报道的生物胺降解菌包括解淀粉芽胞杆菌(B.amyloliquefaciens)、肉葡萄球菌(Staphylococcus carnosus)[20]、植物乳杆菌(L.plantarum)、清酒乳杆菌(Lactobacillus sakei)[21]、黑曲霉(Aspergillius niger)等[22]。
本文以不同发酵阶段道菜为研究对象,创新性地利用双层显色培养技术和高效液相色谱技术,从可培养主导菌中筛选出生物胺降解性能优于生物胺产生性能的菌株,避免高浓度生物胺累积对人体造成的危害。利用形态学、生理生化、16S rDNA 分子生物学技术对所筛菌株进行鉴定,为镇远道菜及传统发酵蔬菜中生物胺含量的调控提供支撑。
1 材料与方法
1.1 主要仪器与试剂
101-1AB电热恒温干燥箱,天津泰斯特仪器有限公司;YXQ-LS-75G立式压力蒸汽灭菌锅、BMJ-250C培养箱,上海博讯实业有限公司医疗设备厂;JJJ-CJ-IFD型超净工作台,苏州市金净净化设备科技有限公司;正置荧光显微镜,奥林巴斯Olympus;FA-2004 N电子分析天平,上海菁海仪器有限公司;Heraeus Multifuge X3R冷冻离心机,美国Thermo Fisher公司;721可见分光光度计,上海菁华科技仪器有限公司;PCR 扩增仪,德国 Jena;1260Infinity高效液相色谱仪,美国安捷伦有限公司。
试剂盒:细菌基因组DNA 提取试剂盒,天根生化科技(北京)有限公司。
精氨酸、赖氨酸、组氨酸、酪氨酸、色氨酸、苯丙氨酸、亚精胺、色胺、D-果糖、D-半乳糖、葡萄糖等均为国产分析纯。
1.2 样品来源与培养基
样品及编号:道菜样品取自贵州省黔东南自治州镇远县某食品加工企业道菜发酵车间,发酵前道菜记为JY0、发酵1 d后道菜记为FJ1、发酵5 d后道菜记为FJ5。
LB琼脂培养基(g/L):蛋白胨10.0、酵母粉5.0、NaCl 10.0、琼脂15.0,pH 6.8~7.2;121 ℃灭菌15 min。上述培养基去掉琼脂即为LB肉汤培养基。
营养琼脂培养基(g/L):蛋白胨10.0、牛肉膏3.0、氯化钠5.0、琼脂20.0,pH 7.0 ~7.4。
生物胺检测双层培养基[23]:(1)底层培养基(g/L):蛋白胨5.0、牛肉膏5.0、酵母膏5.0、葡萄糖0.5、NaCl 2.5、MgSO4·7H2O 0.4、MnSO4 0.03、K2HPO4 2.0、柠檬酸三铵2.0、CaCO3 0.1、FeSO4 0.04、维生素B1 0.01、磷酸吡哆醛0.05、琼脂18.0、吐温80 mL、氨基酸底物(色氨酸、精氨酸、赖氨酸、酪氨酸、苯丙氨酸、组氨酸)各5.0,pH 5.2;115 ℃灭菌15 min。(2)上层培养基(g/L):溴甲酚紫0.06、琼脂20.0,pH 5.2;121 ℃灭菌10 min。
生物胺降解培养基(MLB)(g/L):蛋白胨10.0、NaCl 10.0、生物胺(尸胺、酪胺、组胺、亚精胺、β-苯乙胺、色胺、丁二胺)各0.1,pH 6.8~7.2;121 ℃灭菌15 min。
液体糖发酵培养基、淀粉牛肉膏蛋白胨固体培养基、西蒙斯(Simons)氏柠檬酸盐培养液、葡萄糖蛋白胨液体培养基、牛肉膏蛋白胨液体培养基、柠檬酸铁铵培养基、以上培养基参考《伯杰细菌鉴定手册》。
1.3 菌株的分离筛选及纯化
1.3.1 生物胺产生菌的筛选及纯化
分别称取10 g不同发酵阶段的道菜,加入盛有90 mL无菌生理盐水的锥形瓶中,制成稀释度为10-1的道菜悬液,将其置于37 ℃摇床中振荡培养30 min。取1 mL道菜悬液以10倍梯度制成10-2~10-6梯度浓度,取上述梯度道菜悬液以4分法接种至LB琼脂培养基中,每个梯度重复3次。将平板置于37 ℃恒温培养箱中培养1 d后,挑取形态特征各异的菌株进行划线纯化,直至得到纯的单菌株后转接至营养琼脂培养基斜面,于4 ℃冰箱保藏。
将纯化的单菌株接种至LB肉汤培养基中活化3次后制成浓度约为1×108 CFU/mL的菌悬液,取100 μL涂布至生物胺检测底层培养基中,于37 ℃培养48 h后在无菌条件下向底层培养基倒入上层培养基进行显色反应,在5 min内记录实验结果,显紫色的为阳性菌(产胺菌),不变色即黄色为阴性菌(不产胺菌),以不接种菌株的培养基作为空白对照。选取阳性菌株作为实验菌株,将显色培养基中挑选出的生物胺产生菌转接至营养琼脂培养基斜面,置于4 ℃冰箱保藏。
1.3.2 生物胺降解菌的筛选
将1.3.1中筛选得到的生物胺产生菌接种至LB肉汤培养基中活化3次后制成浓度约为1×108 CFU/mL的菌悬液,再以1%的接种量接种至MLB培养基中,以未接菌的MLB培养基为对照。置于37 ℃,120 r/min条件下培养6 d后取2 mL菌液,12 000 r/min离心10 min,取1 mL上清液与1 mL 0.4 mol/L的HClO4混匀制备成菌液样品,样品经衍生后利用高效液相色谱测定生物胺含量,选择生物胺降解率高以及生物胺降解种类多的菌株作为后续研究菌株,生物胺降解率按公式(1)计算:
(1)
式中:X,生物胺降解率,%;ρ,对照组生物胺含量,mg/L;ρ1,实验组生物胺含量,mg/L。
1.4 生物胺的测定
本实验中生物胺的测定采用外标法,相关试剂配制及方法参考文献[24]。
1.4.1 生物胺混合标准曲线的制作
准确称取色胺、β-苯乙胺、丁二胺、尸胺、组胺、亚精胺、酪胺各10 mg溶于0.1 mol/L的盐酸中并定容至10 mL,配制成1 000 mg/L的各类生物胺标准储备液,置于-20 ℃保存。取1 mL各类生物胺标准储备液混合至10 mL容量瓶中,用0.1 mol/L盐酸稀释成100 mg/L的混合标准液,将上述混合标准液稀释成50、25、15、10、5、2.5 mg/L,于4 ℃保存备用。
取1 mL混合标准液经柱前衍生后利用HPLC进行测定,以峰面积(y)为纵坐标,生物胺质量浓度(x)为横坐标,绘制7种生物胺的标准曲线。
1.4.2 生物胺柱前衍生
取1 mL混合标准液/待测样品加入200 μL浓度为2 mol/L的NaOH溶液调节pH至碱性,依次加入300 μL饱和NaHCO3缓冲液,2 mL 10 mg/mL的DNS-CL(丙酮配制),置于40 ℃下暗反应45 min后加入100 μL氨水终止反应,最后以乙腈定容至5 mL,过0.22 μm滤膜,上机分析。
1.4.3 高效液相色谱条件
色谱分离条件:色谱柱为SHIMADZU C18-AQ(5 μm,250 mm×4.6 mm);流动相A为水;流动相B为乙腈;进样量20 μL;柱温35 ℃;紫外检测波长254 nm,梯度洗脱程序见表1。
表1 RP-HPLC测定生物胺的洗脱程序
Table 1 RP-HPLC elution procedure to determine
biogenic amines
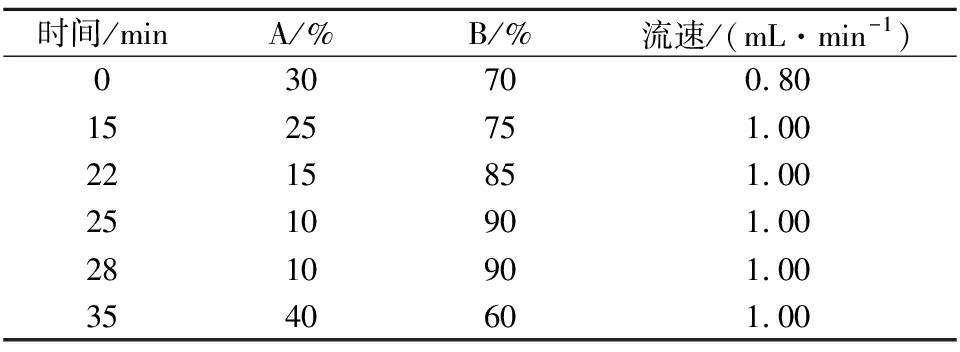
时间/minA/%B/%流速/(mL·min-1)030700.801525751.002215851.002510901.002810901.003540601.00
1.5 生物胺降解菌鉴定
1.5.1 形态学鉴定
将筛选得到的生物胺降解菌分别点接于LB琼脂培养基中,37 ℃培养48 h后观察并记录菌株的形态特征,经革兰氏染色后置于显微镜下观察细胞的形状。
1.5.2 生理生化测定
参考第8版《伯杰氏细菌鉴定手册》完成糖发酵、淀粉水解、柠檬酸盐利用试验、甲基红试验(M.R试验)、Voges-Proskauer试验(V.P试验)、吲哚试验、明胶液化试验、硫化氢试验、丙二酸盐利用试验等生理生化试验。
1.5.3 分子生物学鉴定
将活化后的菌株接入30 mL LB肉汤培养基中,于37 ℃、180 r/min 条件下培养24 h。以细菌基因组提取试剂盒(上海生工生物工程有限公司)提取DNA。采用细菌16S rDNA 通用上游引物27 F(5′-AGAGTTTGATCCTGGCTCAG-3′)和下游引物1492 R(5′-GGTTACCTTGTTACGACTT-3′)对生物胺降解菌进行PCR 扩增。细菌 PCR 扩增总体系为25 μL,其中细菌 DNA模板2 μL、2×Taq PCR Master Mix 12.5 μL、上下游引物各1 μL、ddH2O 8.5 μL。细菌 PCR 扩增程序:94 ℃预变性5 min,94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸2 min,35个循环,然后72 ℃延伸10 min。
DNA产物送上海生工生物工程有限公司测序,为提高序列的准确度,测序采用双向测序。测序结果序列在 NCBI 数据库中进行 BLASTn 分析比对,选取同源性较高的菌株序列作为参照,用MEGA 5.0软件进行菌株系统发育树的构建,完成菌种的鉴定。
1.6 数据处理
试验数据采用SPSS 22.0和Excel 2010进行相关统计和分析,用Origin 9.0 Pro软件作图,表中数据均为3次重复的平均值。
2 结果与分析
2.1 生物胺标品图谱及标准曲线的绘制
由图1可知,7种生物胺在35 min内都能很好地得到分离,并依此确定了各生物胺标准品的保留时间,说明此方法具有良好的分离检测生物胺的效果。
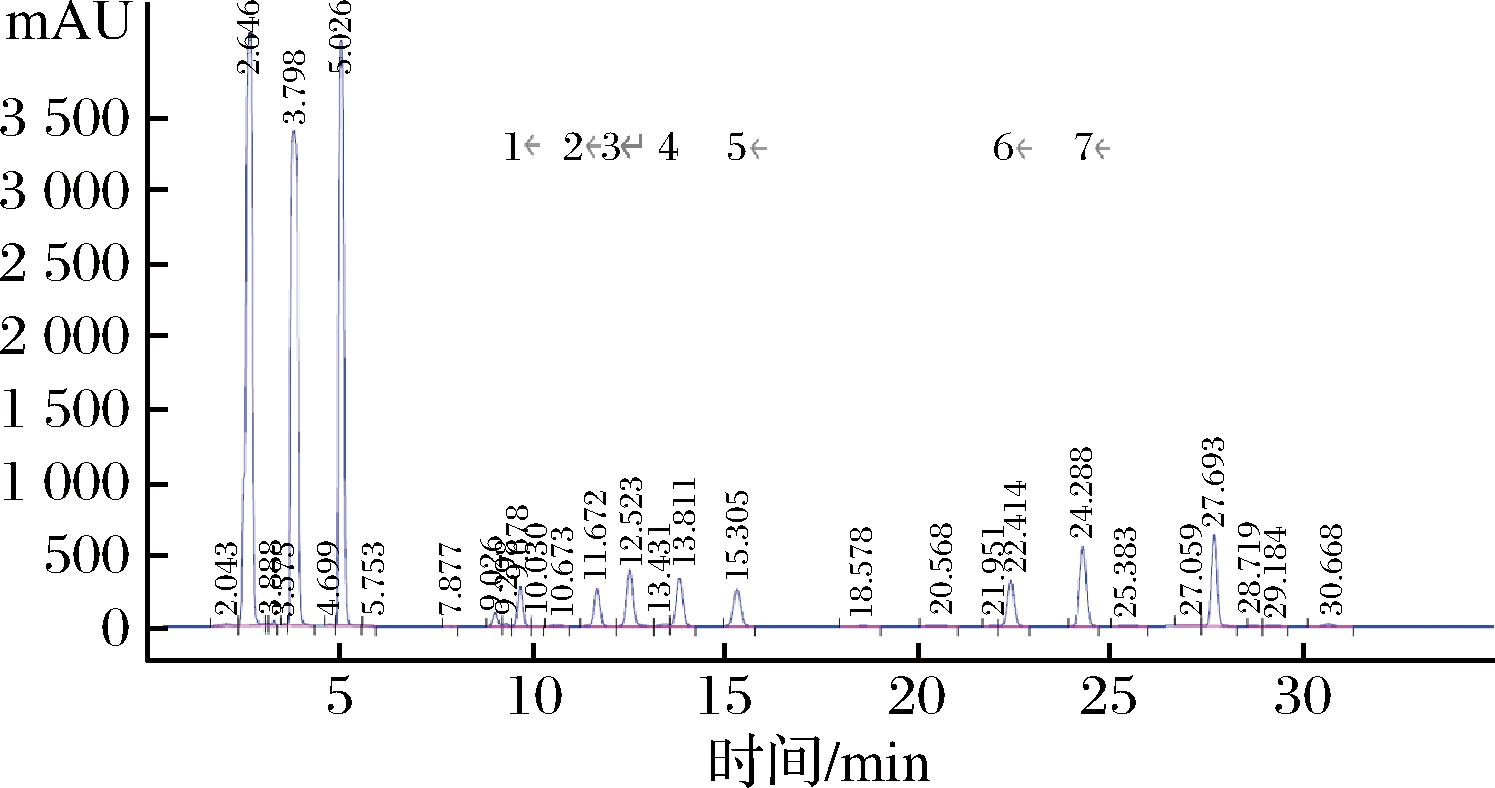
1-色胺;2-β-苯乙胺;3-丁二胺;4-尸胺;5-组胺;6-酪胺;7-亚精胺
图1 生物胺混合标品HPLC图
Fig.1 HPLC chromatogram of bio-amine mixed standards
7种不同浓度生物胺混合标品经高效液相测定后,以峰面积(y)为纵坐标,生物胺质量浓度(x)为横坐标,绘制标准曲线,回归方程及相关系数如表2所示,7种生物胺在2.5~100 mg/L质量浓度范围内线性关系较好,R2>0.997,说明采用HPLC法定量测定样品中的生物胺具有良好的可靠性。
表2 七种生物胺的回归方程和相关系数
Table 2 Regression equations and correlation coefficients
of the seven biogenic amines

生物胺回归方程相关系数(R2)色胺y=25.438x+24.9440.997尸胺y=40.98x+32.1380.999苯胺y=27.39x+40.7440.999丁二胺y=45.761x+10.5740.998亚精胺y=66.47x+129.640.999组胺y=34.62x+17.8660.999酪胺y=39.703x+59.1310.999
2.2 镇远道菜中生物胺产生菌的筛选
利用LB琼脂培养基从不同发酵阶段的镇远道菜样品中分离出42株细菌,将其分别接种至生物胺检测双层培养基培养48 h后,经显色反应筛选出32株生物胺产生菌。显色结果见图2。
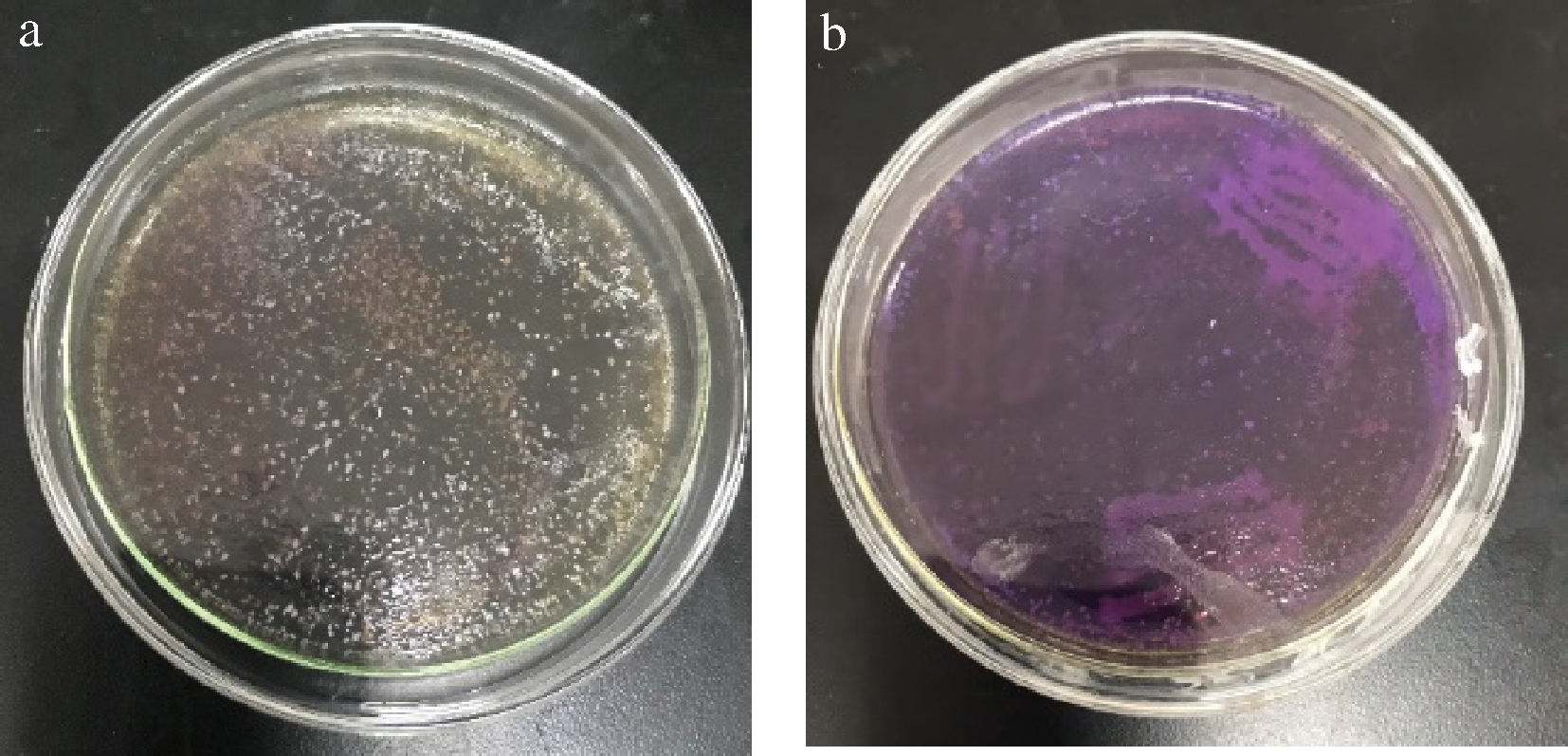
a-颜色反应阴性;b-颜色反应阳性
图2 生物胺显色反应
Fig.2 Biogenic amine color reaction
2.3 镇远道菜中生物胺降解菌的筛选
将道菜中筛选出的32株生物胺产生菌接种至以外源生物胺为氮源的MLB培养基中培养6 d,利用HPLC法测定其生物胺降解率。由表3、图3可知,FJ5-002-003、FJ5-002-005、FJ5-002-007、LS1-002-011、LS1-003-002共5株菌对酪胺的降解率较高,均在50%以上,最高可达61.87%;菌株LS1-002-014对组胺降解能力较强,达到19.42%;菌株LS1-002-014和LS1-003-016对亚精胺降解效果较好,最高为43.95%。根据图3可知,LS1-002-014、LS1-003-016两株菌对7种生物胺都具有一定的降解能力,最终根据生物胺降解率的高低和降解种类的多少选定菌株FJ5-002-005、LS1-002-014和LS1-003-006为后续研究菌株。
表3 不同菌株对7种生物胺降解率比较
Table 3 Degradation rate of the seven biogenic amines by the different strains
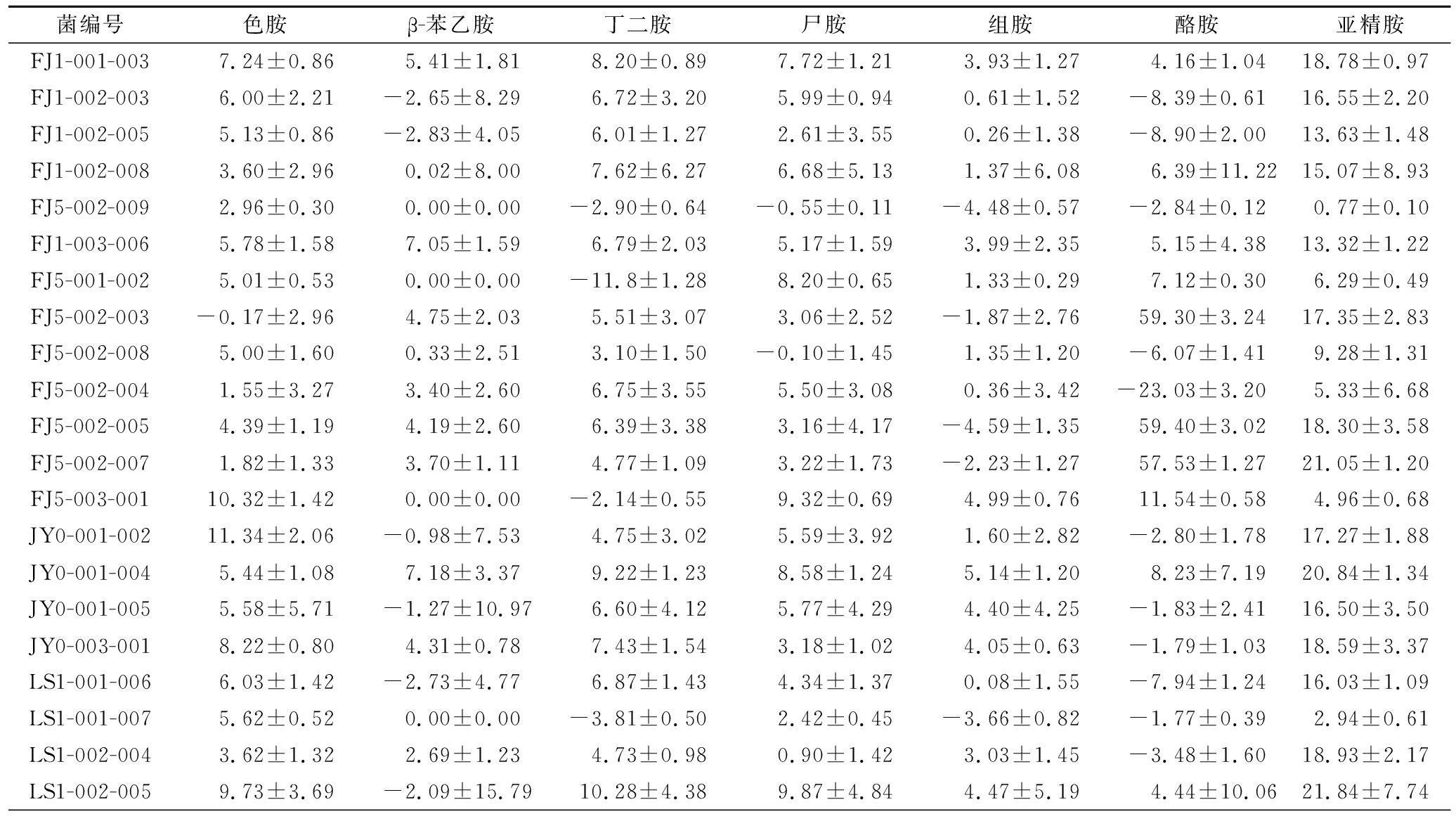
菌编号色胺β-苯乙胺丁二胺尸胺组胺酪胺亚精胺FJ1-001-0037.24±0.865.41±1.818.20±0.897.72±1.213.93±1.274.16±1.0418.78±0.97FJ1-002-0036.00±2.21-2.65±8.296.72±3.205.99±0.940.61±1.52-8.39±0.6116.55±2.20FJ1-002-0055.13±0.86-2.83±4.056.01±1.272.61±3.550.26±1.38-8.90±2.0013.63±1.48FJ1-002-0083.60±2.960.02±8.007.62±6.276.68±5.131.37±6.086.39±11.2215.07±8.93FJ5-002-0092.96±0.300.00±0.00-2.90±0.64-0.55±0.11-4.48±0.57-2.84±0.120.77±0.10FJ1-003-0065.78±1.587.05±1.596.79±2.035.17±1.593.99±2.355.15±4.3813.32±1.22FJ5-001-0025.01±0.530.00±0.00-11.8±1.288.20±0.651.33±0.297.12±0.306.29±0.49FJ5-002-003-0.17±2.964.75±2.035.51±3.073.06±2.52-1.87±2.7659.30±3.2417.35±2.83FJ5-002-0085.00±1.600.33±2.513.10±1.50-0.10±1.451.35±1.20-6.07±1.419.28±1.31FJ5-002-0041.55±3.273.40±2.606.75±3.555.50±3.080.36±3.42-23.03±3.205.33±6.68FJ5-002-0054.39±1.194.19±2.606.39±3.383.16±4.17-4.59±1.3559.40±3.0218.30±3.58FJ5-002-0071.82±1.333.70±1.114.77±1.093.22±1.73-2.23±1.2757.53±1.2721.05±1.20FJ5-003-00110.32±1.420.00±0.00-2.14±0.559.32±0.694.99±0.7611.54±0.584.96±0.68JY0-001-00211.34±2.06-0.98±7.534.75±3.025.59±3.921.60±2.82-2.80±1.7817.27±1.88JY0-001-0045.44±1.087.18±3.379.22±1.238.58±1.245.14±1.208.23±7.1920.84±1.34JY0-001-0055.58±5.71-1.27±10.976.60±4.125.77±4.294.40±4.25-1.83±2.4116.50±3.50JY0-003-0018.22±0.804.31±0.787.43±1.543.18±1.024.05±0.63-1.79±1.0318.59±3.37LS1-001-0066.03±1.42-2.73±4.776.87±1.434.34±1.370.08±1.55-7.94±1.2416.03±1.09LS1-001-0075.62±0.520.00±0.00-3.81±0.502.42±0.45-3.66±0.82-1.77±0.392.94±0.61LS1-002-0043.62±1.322.69±1.234.73±0.980.90±1.423.03±1.45-3.48±1.6018.93±2.17LS1-002-0059.73±3.69-2.09±15.7910.28±4.389.87±4.844.47±5.194.44±10.0621.84±7.74
续表3
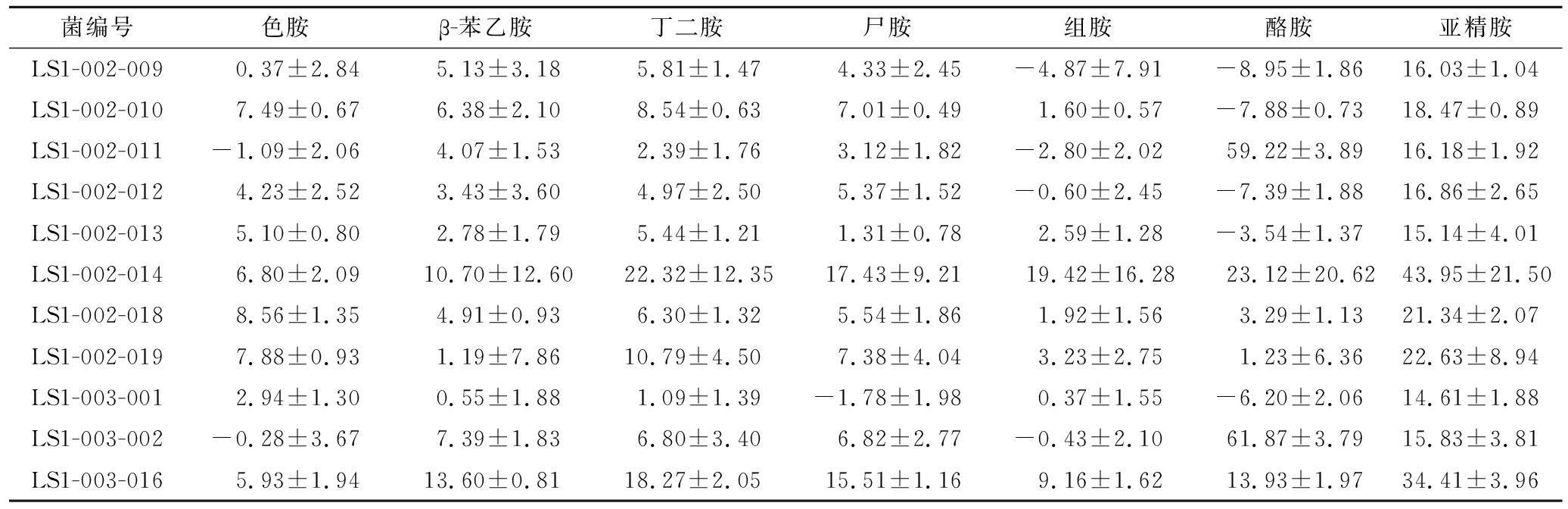
菌编号色胺β-苯乙胺丁二胺尸胺组胺酪胺亚精胺LS1-002-0090.37±2.845.13±3.185.81±1.474.33±2.45-4.87±7.91-8.95±1.8616.03±1.04LS1-002-0107.49±0.676.38±2.108.54±0.637.01±0.491.60±0.57-7.88±0.7318.47±0.89LS1-002-011-1.09±2.064.07±1.532.39±1.763.12±1.82-2.80±2.0259.22±3.8916.18±1.92LS1-002-0124.23±2.523.43±3.604.97±2.505.37±1.52-0.60±2.45-7.39±1.8816.86±2.65LS1-002-0135.10±0.802.78±1.795.44±1.211.31±0.782.59±1.28-3.54±1.3715.14±4.01LS1-002-0146.80±2.0910.70±12.6022.32±12.3517.43±9.2119.42±16.2823.12±20.6243.95±21.50LS1-002-0188.56±1.354.91±0.936.30±1.325.54±1.861.92±1.563.29±1.1321.34±2.07LS1-002-0197.88±0.931.19±7.8610.79±4.507.38±4.043.23±2.751.23±6.3622.63±8.94LS1-003-0012.94±1.300.55±1.881.09±1.39-1.78±1.980.37±1.55-6.20±2.0614.61±1.88LS1-003-002-0.28±3.677.39±1.836.80±3.406.82±2.77-0.43±2.1061.87±3.7915.83±3.81LS1-003-0165.93±1.9413.60±0.8118.27±2.0515.51±1.169.16±1.6213.93±1.9734.41±3.96
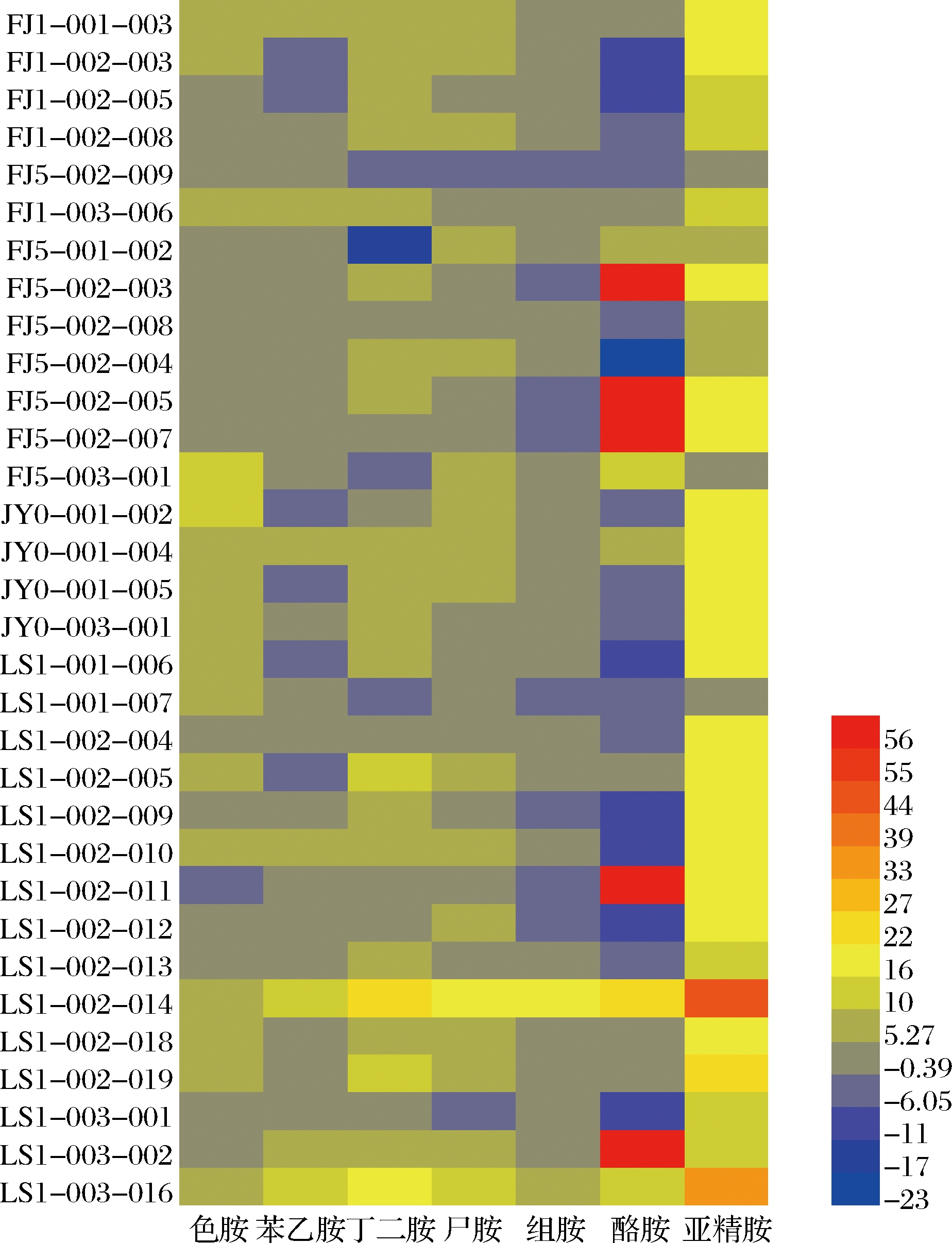
图3 不同生物胺降解菌降胺能力比较
Fig.3 Degrading ability of different biogenic amine
degrading bacteria
2.4 生物胺降解菌的鉴定
2.4.1 形态学鉴定
将生物胺降解菌FJ5-002-005、LS1-002-014、LS1-003-016分别接种至营养琼脂培养基上,培养48 h后均出现直径为2~5 mm的单菌落,各菌株的菌落形态如图4所示,形态学描述如表4所示。各菌株的革兰氏染色镜检图如图5所示,革兰氏染色结果显示,3株菌均为杆状革兰氏阳性菌。

a-LS1-003-016;b-LS1-002-014;c-FJ5-002-005
图4 生物胺降解菌的菌落形态
Fig.4 Colony morphology of biogenic amine-degrading bacteria
表4 生物胺降解菌形态描述
Table 4 Microscopic examination of biogenic
amine-degrading bacteria

菌株编号形态光泽度边缘隆起表面干湿度透明度颜色FJ5-002-005圆形无波形凸起不光滑干不透明浅黄LS1-002-014不规则有光滑脐凸光滑湿不透明奶白LS1-003-016圆形无波形脐凸不光滑干不透明白色
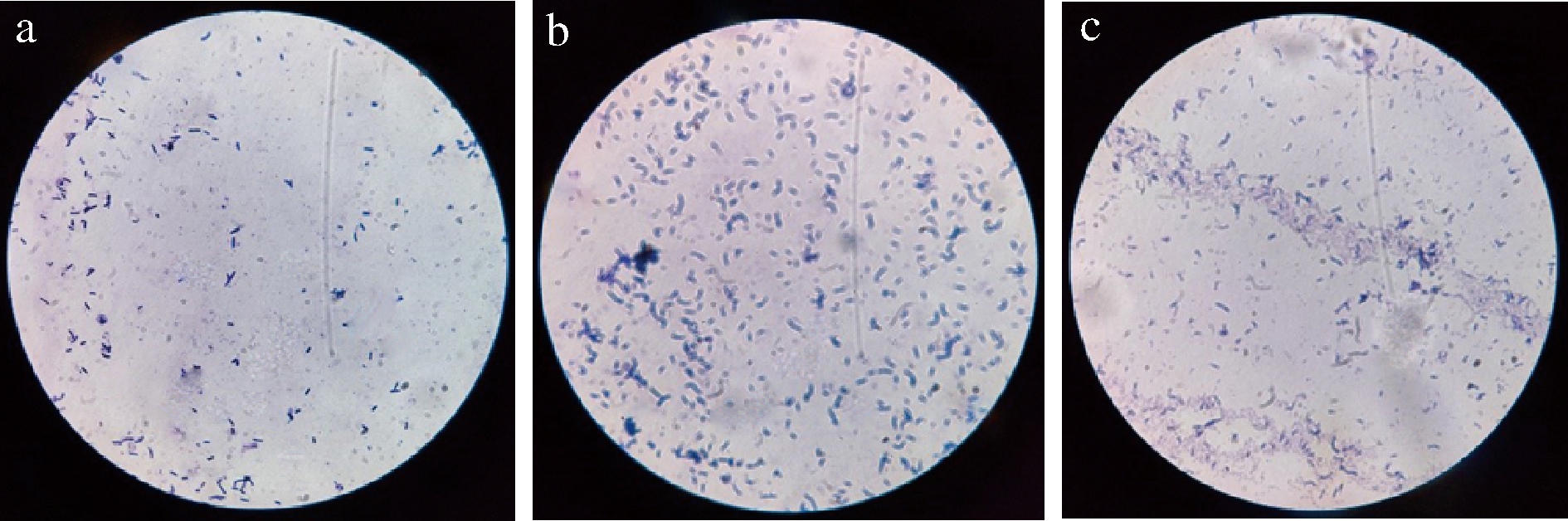
a-LS1-003-016;b-LS1-002-014;c-FJ5-002-005
图5 生物胺降解菌的微生物镜检图
Fig.5 Microscopic examination of biogenic
amine-degrading bacteria
2.4.2 生理生化测定
依据《伯杰氏细菌鉴定手册》对筛选出的3株生物胺降解菌进行相应的生理生化实验,结果见表5。研究表明3株菌的淀粉水解、明胶液化、V-P试验、产硫化氢、过氧化氢酶、精氨酸产氨反应均为阳性,3株菌均能利用大部分常见碳源,其中仅有菌株LS1-003-016能利用L-阿拉伯糖,菌株LS1-002-014能利用纤维二糖,FJ5-002-004能利用D-半乳糖。
表5 三株生物胺降解菌生理生化特性
Table 5 Physiological and biochemical characteristics of the
three strains of biogenic amine-degrading bacteria

特征供试菌株FJ5-002-004LS1-002-014LS1-003-016L-阿拉伯糖--+纤维二糖-+-D-果糖+++D-半乳糖(+)--葡萄糖(+)(+)+乳糖(+)(+)(+)D(+)麦芽糖+++D-甘露醇(+)(+)+蜜二糖-(+)+D-棉子糖+(+)-D-山梨醇(+)(+)(+)L-山梨糖(+)+(+)可溶性淀粉(+)(+)-蔗糖-(+)+木糖+++葡萄糖酸钠(+)(+)(+)淀粉水解+++明胶液化+++V-P试验+++MR试验+--产硫化氢+++过氧化氢酶+++精氨酸产氨+++
注:菌体生长温度为37 ℃,“+”为阳性、“(+)”为弱阳性、“-”为阴性、“(-)”为弱阴性
2.4.3 分子学鉴定
将生物胺降解菌FJ5-002-005、LS1-002-014、LS1-003-016的测序序列输入NCBI 数据库中与较为相似且已发表的菌株进行BLASTn比对,再通过MEGA 5.0软件将菌株FJ5-002-005、LS1-002-014、LS1-003-016与其同属亲缘关系较近的模式菌株进行同源性分析并构建系统发育树,结果如图6所示。由图6可知,LS1-002-014与B.amyloliquefaciens亲源关系最近,LS1-003-016与B.subtilis亲源关系最近,FJ5-002-005与B.subtilis亲源关系最近。
结合菌落和菌株的形态特征,以及16S rDNA测序分析结果,分别将菌株LS1-002-014、LS1-003-016、FJ5-002-005鉴定为B.amyloliquefaciens、B.subtilis、B.subtilis。
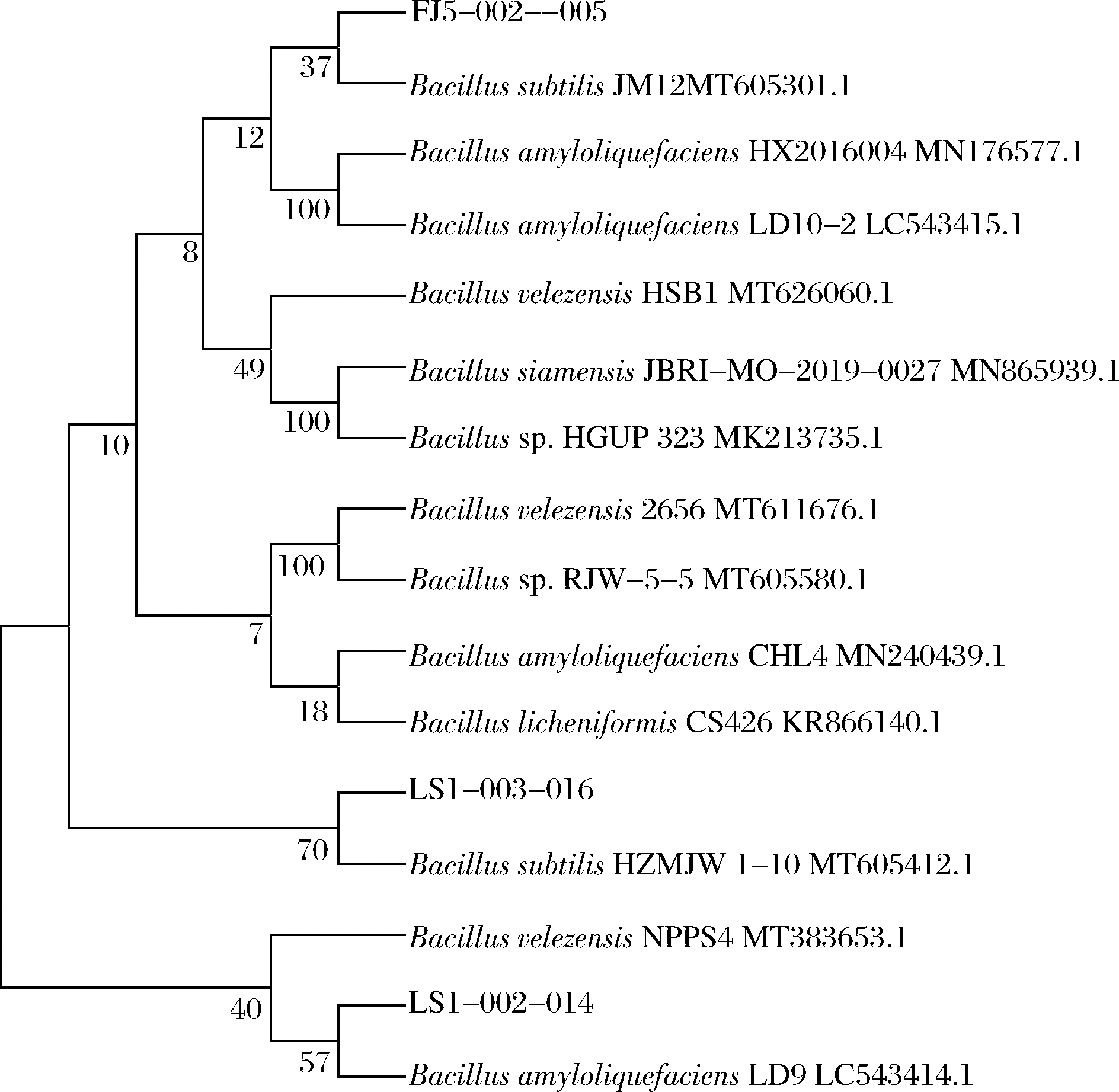
图6 基于16SrDNA序列的菌株FJ5-002-005、LS1-002-014、
LS1-003-016系统发育树
Fig.6 Phylogenetic tree of strains FJ5-002-005,LS1-002-014,
and LS1-003-016 based on 16S rDNA sequences
3 讨论与结论
本研究采用双层显色平板培养技术从已分离纯化出的42株细菌中筛选出32株生物胺产生菌,说明道菜发酵过程中可培养细菌多数都具有产胺性能,因此若是采用前人的研究方法则缩小了降胺菌筛选的样本范围,不利于高效生物胺降解菌的筛选。继而利用HPLC技术从32株产生物胺菌株中筛选出3株具有较好生物胺降解性能的菌株,B.amyloliquefaciens(LS1-002-014)、B.subtilis(LS1-003-016)、B.subtilis(FJ5-002-005)。
菌株LS1-002-014与李东蕊[25]利用高通量技术从豆瓣酱中筛选出的B.amyloliquefaciens 1-G6相比,降解亚精胺的能力较为相近,而组胺降解能力则强于后者,可高达19.42%。菌株LS1-003-016与张惠超等[26]报道的生物胺降解菌B.subtilis相比,酪胺降解率低了50.40%,但本研究筛选的菌株LS1-003-016所能降解的生物胺种类更多,如色胺、β-苯乙胺、丁二胺、尸胺、组胺、亚精胺,降解率依次为5.93%、13.60%、18.27%、15.51%、9.16%、34.41%。菌株FJ5-002-005对酪胺的降解率与EOM等[27]报道的B.subtilis HJ0-6相比,降解率高出25.9%,且枯草芽胞杆菌在过去的报道中多作为生物胺产生菌[28],有关其生物胺降解能力的报道较少。
研究发现发酵食品生产过程中生物胺的含量并不是稳定不变的,而是在产胺微生物与降胺微生物的作用下不断变化。当环境中生物胺含量增大时,微生物为抵御环境中的有害物质与酸碱度的变化而合成胺氧化酶,该酶可将生物胺分解为相应的醛、氨气和![]() 然而胺氧化酶并不是单一的酶,目前研究发现的胺氧化酶有含核黄素的单胺氧化酶(monoamine oxidase,MAO)(EC.1.4.3.4)、腐胺氧化酶(EC.1.4.3.10)、含铜的初级胺氧化酶(EC.1.4.3.21)和含铜的二胺氧化酶(EC.1.4.3.10)等[30],由于微生物合成胺氧化酶的差异性,导致氧化酶催化生物胺的能力并不相同[22],由此出现不同菌株对同一生物胺降解率的差异,以及同一菌株降解不同生物胺能力的不同。
然而胺氧化酶并不是单一的酶,目前研究发现的胺氧化酶有含核黄素的单胺氧化酶(monoamine oxidase,MAO)(EC.1.4.3.4)、腐胺氧化酶(EC.1.4.3.10)、含铜的初级胺氧化酶(EC.1.4.3.21)和含铜的二胺氧化酶(EC.1.4.3.10)等[30],由于微生物合成胺氧化酶的差异性,导致氧化酶催化生物胺的能力并不相同[22],由此出现不同菌株对同一生物胺降解率的差异,以及同一菌株降解不同生物胺能力的不同。
本研究采用双层显色平板培养技术从不同发酵阶段的镇远道菜中筛选出32株产生物胺菌,以色胺、β-苯乙胺、丁二胺、尸胺、组胺、酪胺和亚精胺为氮源,考察各菌株对不同生物胺的降解能力,根据生物胺降解率的高低和降解种类的多少筛选出LS1-002-014、LS1-003-016、FJ5-002-005共3株生物胺降解菌,经形态学、生物生化和分子生物学鉴定上述菌株分别为B.amyloliquefaciens、B.subtilis和B.subtilis。其中菌株LS1-002-014和LS1-003-016对7种生物胺均具有降解作用,2株菌降解率最高的生物胺均为亚精胺,分别为43.95%、34.41%;而菌株FJ5-002-005则缺乏对组胺的降解能力,相较于空白组产生了4.59%的组胺,但对酪胺降解效果明显,最高达59.40%。此外本研究结果还证明了生物胺的降解与菌株本身有关,与其属无关,同一菌株对不同生物胺的降解具有特异性。
[1] 何丝汀,王力,任艳玲.镇远陈年道菜的制作工艺及乳酸菌的分离与鉴定[J].现代食品,2020(11):164-166.
HE S T,WANG L,REN Y L.Study on producing process,isolation and identification of lactic acid bacteria in Zhenyuan Daocai[J].Modern Food,2020(11):164-166.
[2] PAPAGEORGIOU M,LAMBROPOULOU D,MORRISON C,et al.Literature update of analytical methods for biogenic amines determination in food and beverages[J].TrAC Trends in Analytical Chemistry,2018,98:128-142.
[3] LIU W L,ZHANG L W,SHI J,et al.Assessment of the safety and applications of bacteriocinogenic Enterococcus faecium Y31 as an adjunct culture in North-eastern Chinese traditional fermentation Paocai[J].Food Control,2015,50:637-644.
[4] 姜维.一株耐盐性高效生物胺降解新菌的筛选、分类鉴定及应用研究[D].青岛:中国海洋大学,2014.
JIANG W.Study on the screening,taxonomic analysis and application of one novel,salt-tolerant and high efficient biogenic amines degrading bacterium[D].Qingdao:Ocean University of China,2014.
[5] ANAL A K,PERPETUINI G,PETCHKONGKAEW A,et al.Food safety risks in traditional fermented food from South-East Asia[J].Food Control,2020,109:106922.
[6] DOEUN D,DAVAATSEREN M,CHUNG M.Biogenic amines in foods[J].Food Science and Biotechnology,2017,26(6):1 463-1 474.
[7] 唐垚,唐小曼,明建英,等.四川泡菜产生物胺细菌的筛选及产胺能力验证[J].中国调味品,2019,44(7):81-84.
TANG Y,TANG X M,MING J Y,et al.Screening of amine-producing bacteria from Sichuan pickles and verification of amine-producing ability[J].China Condiment,2019,44(7):81-84.
[8] ![]() Z,ERIM F B.Nitrate and nitrites in foods:Worldwide regional distribution in view of their risks and benefits[J].Journal of Agricultural and Food Chemistry,2019,67(26):7 205-7 222.
Z,ERIM F B.Nitrate and nitrites in foods:Worldwide regional distribution in view of their risks and benefits[J].Journal of Agricultural and Food Chemistry,2019,67(26):7 205-7 222.
[9] BOZKURT H,ERKMEN O.Effects of temperature,humidity and additives on the formation of biogenic amines in sucuk during ripening and storage periods[J].Food Science and Technology International,2004,10(1):21-28.
[10] CLAUDIA R C,FRANCISCO J C.Effect of an argon-containing packaging atmosphere on the quality of fresh pork sausages during refrigerated storage[J].Food Control,2010,21(10):1 331-1 337.
[11] ZHAO N,LAI H M,HE W,et al.Reduction of biogenic amine and nitrite production in low-salt Paocai by controlled package during storage:A study comparing vacuum and aerobic package with conventional salt solution package[J].Food Control,2021,123:107858.
[12] TUBOLY E,LEBOVICS V K,GAAL O,et al.Microbiological and lipid oxidation studies on mechanically deboned turkey meat treated by high hydrostatic pressure[J].Journal of Food Engineering,2003,56(2/3):241-244.
[13] KUNG H F,TSAI Y H,WEI C I.Histamine and other biogenic amines and histamine-forming bacteria in miso products[J].Food Chemistry,2007,101(1):351-356.
[14] GARDINI F,TOFALO R,BELLETTI N,et al.Characterization of yeasts involved in the ripening of Pecorino Crotonese cheese[J].Food Microbiology,2006,23(7):641-648.
[15] CHO Y R,CHANG J Y,CHANG H C.Production of gamma-aminobutyric acid(GABA) by Lactobacillus buchneri isolated from kimchi and its neuroprotective effect on neuronal cells[J].Journal of Microbiology and Biotechnology,2007,17(1):104-109.
[16] DE LA FUENTE B,LUZ C,PUCHOL C,et al.Evaluation of fermentation assisted by Lactobacillus brevis POM,and Lactobacillus plantarum(TR-7,TR-71,TR-14) on antioxidant compounds and organic acids of an orange juice-milk based beverage[J].Food Chemistry,2021,343:128414.
[17] WU Y,LI S J,TAO Y,et al.Fermentation of blueberry and blackberry juices using Lactobacillus plantarum,Streptococcus thermophilus and Bifidobacterium bifidum:Growth of probiotics,metabolism of phenolics,antioxidant capacity in vitro and sensory evaluation[J].Food Chemistry,2021,348:129083.
[18] 吴燕燕,钱茜茜,陈玉峰,等.咸鱼中生物胺降解菌的筛选与降解特性研究[J].食品工业科技,2016,37(18):173-179.
WU Y Y,QIAN X X,CHEN Y F,et al.Screening and degradation properties of biogenic amines degrading strains in salted fish[J].Science and Technology of Food Industry,2016,37(18):173-179.
[19] PAPAVERGOU E J,SAVVAIDIS I N,AMBROSIADIS I A.Levels of biogenic amines in retail market fermented meat products[J].Food Chemistry,2012,135(4):2 750-2 755.
[20] ZAMAN M Z,ABU BAKAR F,JINAP S,et al.Novel starter cultures to inhibit biogenic amines accumulation during fish sauce fermentation[J].International Journal of Food Microbiology,2011,145(1):84-91.
[21] ALVAREZ M A,MORENO-ARRIBAS M V.The problem of biogenic amines in fermented foods and the use of potential biogenic amine-degrading microorganisms as a solution[J].Trends in Food Science & Technology,2014,39(2):146-155.
[22] LI B B,LU S L.The importance of amine-degrading enzymes on the biogenic amine degradation in fermented foods:A review[J].Process Biochemistry,2020,99:331-339.
[23] 马宇霞,卢士玲,李开雄,等.熏马肠中生物胺氧化酶菌株的筛选与鉴定[J].现代食品科技,2014,30(5):49-55.
MA Y X,LU S L,LI K X,et al.Screening and identification of amine oxidase productive strains from smoked horse intestine[J].Modern Food Science and Technology,2014,30(5):49-55.
[24] 杨琴.酸鱼中产胺菌的氨基酸脱羧酶基因及功能特性研究[D].贵阳:贵州大学,2020.
YANG Q.Study on the amino acid decarboxylase gene and functional characteristics of amine producing bacteria from Suan yu[D].Guiyang:Guizhou University,2020.
[25] 李东蕊.豆瓣酱工业发酵过程中生物胺的生成规律及微生物多样性的研究[D].无锡:江南大学,2020.
LI D R.Study on the formation regularity of biogenic amines and microbial diversity during the industrial fermentation of broad bean paste[D].Wuxi:Jiangnan University,2020.
[26] 张惠超,卢士玲,马宇霞,等.熏马肠成熟过程中产生物胺氧化酶菌对生物胺作用的研究[J].现代食品科技,2015,31(6):122-128.
ZHANG H C,LU S L,MA Y X,et al.Effects of biogenic amine oxidase producing strains during the maturation of smoked horsemeat sausages[J].Modern Food Science and Technology,2015,31(6):122-128.
[27] EOM J S,SEO B Y,CHOI H S.Biogenic amine degradation by Bacillus sp. isolated from traditional fermented soybean food and detection of decarboxylase-related genes[J].Journal of Microbiology and Biotechnology,2015,25(9):1 519-1 527.
[28] MAH J H,PARK Y K,JIN Y H,et al.Bacterial production and control of biogenic amines in Asian fermented soybean foods[J].Foods,2019,8(2):85.
[29] LEE H I,KIM Y M,RO Y T.Purification and characterization of a copper-containing amine oxidase from Mycobacterium sp.strain JC1 DSM 3803 grown on benzylamine[J].The Journal of Biochemistry,2008,144(1):107-114.
[30] 李彬彬,徐晔,牛淑慧,等.食品中生物胺含量及生物胺氧化酶的研究进展[J].食品科学,2019,40(1):341-347.
LI B B,XU Y,NIU S H,et al.Recent progress in biogenic amines and bioamine oxidases in foods[J].Food Science,2019,40(1):341-347.