细菌素是一种由细菌核糖体分泌的对近源微生物具有抑制作用的蛋白质或多肽类物质,具有安全性高,易被人体消化吸收等优点,可作为天然食品防腐剂用于食品生产中[1]。乳酸菌细菌素由于具有良好的耐热性、广谱抑菌活性等优点而成为研究热点[2]。实验室前期从白酒酒醅中分离出1株高产细菌素的粪肠球菌Gr17(Enterococcus faecalis Gr17),其所产细菌素属于Ⅱa类乳酸菌细菌素,能够抑制多种食品腐败菌和食源性致病菌[3]。但菌株在自然环境和食品生产中常常会面临多种环境胁迫,如酸胁迫[4]、渗透压胁迫[5]、高压胁迫[6]、冷胁迫[7]等。细菌的生长繁殖和代谢活动均依赖于营养物质,营养胁迫下细菌代谢活动产生变化,影响菌体生长及细菌素合成。马佳歌等[8]研究表明在缺乏葡萄糖的条件下Lactiplantibacillus plantarum KLDS 1.0328的生长和细菌素抑菌活性均受到抑制。KUMAR等[9]发现碳源胁迫(1/2葡萄糖)和氮源胁迫(1/2蛋白胨、牛肉膏、酵母浸粉)对Pediococcus pentosaceus NKSM1的生长与细菌素合成均有不利影响。VERLUYTEN等[10]研究表明复合营养胁迫(1/2 MRS)抑制Lactobacillus curvatus LTH 1174生长,但可促进细菌素合成。由于菌株本身的特异性,不同胁迫条件对菌体生长及细菌素合成调控作用不同。
群体感应(quorum sensing,QS)是细菌的一种调节机制,细胞通过随菌体密度波动的特定信号分子诱导特定基因表达,从而实现对生物膜形成、胞外多糖形成、细菌素合成等一系列微生物行为的调控[11-13]。QS是乳酸菌细菌素合成的关键调控机制,目前普遍认为与乳酸菌细菌素合成相关的QS调控系统由自诱导肽(autoinducing peptides,AIPs)和双组份信号转导系统(two component system,TCS)组成[14]。TCS包括组氨酸蛋白激酶(histidine protein kinase,HPK)和感应调节蛋白(response regulator protein,RR)。AIPs随菌体密度增大而增加,当达到一定阈值后,激活细胞膜上的HPK,使其发生自我磷酸化。磷酸基团转移至RR信号输出区域的保守天冬氨酸残基位点,使其发生磷酸化。磷酸化的RR与目的基因特定位点结合,激活细菌素基因表达。已有研究表明营养胁迫可以对乳酸菌QS系统产生影响[15-16]。由此QS系统可能在营养胁迫调控细菌素的合成中起重要作用。但目前关于营养胁迫如何通过QS系统调控细菌素合成少有研究报道。
基于上述原因,本研究以粪肠球菌Gr17为研究对象,测定了营养胁迫对其生长及细菌素活性的影响,筛选可正向调控细菌素合成的营养胁迫条件,并初步探究这一正向调控的具体机制,以期为营养胁迫对细菌素合成的调控相关研究提供参考。
1 材料与方法
1.1 材料与试剂
肠球菌Gr17,由本实验室保存于-80 ℃;大肠杆菌(Escherichia coli)1.90,中国普通微生物菌种保藏管理中心;NaOH、NaCl,天津大茂化学试剂厂;TSB培养基、TSA培养基、MRS肉汤培养基,杭州百思生物;细菌总RNA提取试剂盒、FastKing一步法反转录-荧光定量试剂盒(FP314)、SuperReal彩色荧光定量预混试剂(SYBR Green),天根生化科技有限公司。
1.2 仪器与设备
TG-16G离心机,常州隆和仪器制造有限公司;TG600酶标仪,云铂仪器有限公司;FastDry-1真空离心浓缩仪,北京博医康实验仪器有限公司;HJ-6AB多头磁力搅拌器,金坛市华城润华实验仪器厂;HZQ-F400全温振荡培养箱,常州普天仪器制造有限公司;CFX96 Real-Time System、C1000 Touch PCR仪,美国Bio-Rad公司。
1.3 实验方法
1.3.1 菌种的活化
将甘油管中的粪肠球菌Gr17以1%接种量接种于已灭菌的MRS液体培养基中,37 ℃培养18 h,连续活化2代后用于实验。
1.3.2 营养胁迫处理菌株
用9 g/L的生理盐水稀释MRS培养基(营养物质浓度48.3 g/L),得1/4 MRS、1/2 MRS和3/4 MRS,质量浓度分别为12.075、24.15、36.225 g/L。将活化后的Gr17以1%的接种量接种于不同浓度的培养基中,37 ℃静置培养28 h。
1.3.3 菌体生长测定
取1.3.2所得发酵液200 μL加入96孔板中,用酶标仪测定其OD600 nm。
1.3.4 抑菌活性的测定
取1.3.2所得发酵液,8 000 r/min离心10 min,用0.1 mol/L的NaOH溶液将上清液pH调至7.0,采用真空离心浓缩仪浓缩25倍,得细菌素粗提液。按参考文献[17-18]采用琼脂扩散法测定粗提液抑菌活性,以大肠杆菌1.90为指示菌。
1.3.5 正常条件与最佳胁迫条件下细菌生长性能比较
按1%接种量将Gr17分别接种于MRS和1/4 MRS液体培养基中,37 ℃培养40 h,每隔4 h取样,按1.3.3与1.3.4中方法测定样品菌体生长情况及抑菌活性。
1.3.6 正常条件与最佳胁迫条件下部分基因表达的比较
由实验室对Gr17进行的全基因组测序结果,该菌具有10个与细菌素合成有关的基因,ent I、ent J和ent Gr17编码细菌素结构蛋白,分别编码细菌素enterocin L50A、enterocin L50B,enterocin Gr17;AS-48E、AS-48F、AS-48G、AS-48H共同编码ABC(ATP-Binding Cassette)转运系统的ABC转运蛋白及其辅助蛋白;hpk和rr分别编码TCS中的HPK和RR;AIP编码自诱导肽。在此基础上进一步研究这10个基因在最佳营养胁迫条件下表达量的变化。
1.3.6.1 总RNA提取及逆转录
按1%接种量将Gr17分别接种于MRS和1/4 MRS液体培养基中,37 ℃培养48 h,每隔6 h取样,按天根细菌总RNA提取试剂盒(DP430)说明书提取总RNA,将提取的RNA在冰浴上按FastKing一步法反转录-荧光定量试剂盒(FP314)说明书混合体系并合成cDNA。
1.3.6.2 RT-qPCR引物设计
采用Primer Premier 5.0软件设计RT-qPCR引物,设计结果如表1。
表1 RT-qPCR引物
Table 1 RT-qPCR primers
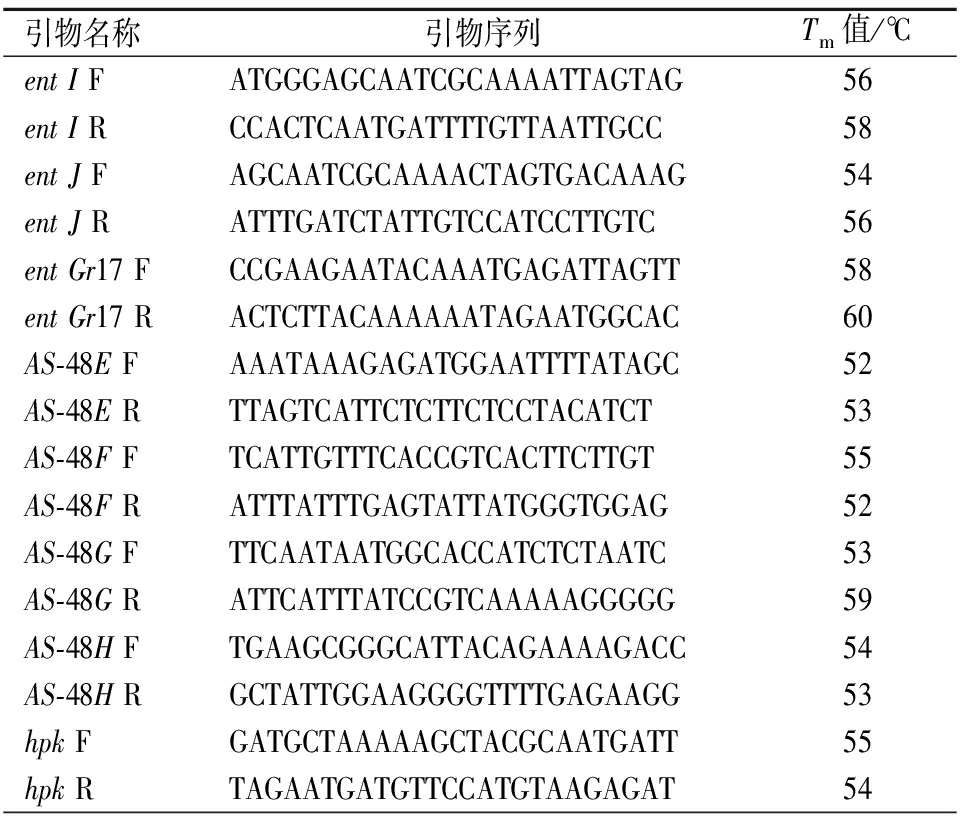
引物名称引物序列Tm值/℃ent I FATGGGAGCAATCGCAAAATTAGTAG56ent I RCCACTCAATGATTTTGTTAATTGCC58ent J FAGCAATCGCAAAACTAGTGACAAAG54ent J RATTTGATCTATTGTCCATCCTTGTC56ent Gr17 FCCGAAGAATACAAATGAGATTAGTT58ent Gr17 RACTCTTACAAAAAATAGAATGGCAC60AS-48E FAAATAAAGAGATGGAATTTTATAGC52AS-48E RTTAGTCATTCTCTTCTCCTACATCT53AS-48F FTCATTGTTTCACCGTCACTTCTTGT55AS-48F RATTTATTTGAGTATTATGGGTGGAG52AS-48G FTTCAATAATGGCACCATCTCTAATC53AS-48G RATTCATTTATCCGTCAAAAAGGGGG59AS-48H FTGAAGCGGGCATTACAGAAAAGACC54AS-48H RGCTATTGGAAGGGGTTTTGAGAAGG53hpk FGATGCTAAAAAGCTACGCAATGATT55hpk RTAGAATGATGTTCCATGTAAGAGAT 54
续表1

引物名称引物序列Tm值/℃rr FCATTCTAATGTTATCCCATGGCAGC58rr RTGGATACATGAGCAATGGAGACGAT59AIP FAGATTAAAACATTTTTTGATTACCG 57AIP RTCAATCGAGGGCCATTATCCCAAGT 53
1.3.6.3 RT-qPCR扩增实验
以16S rRNA为内参基因[19],按SuperReal彩色荧光定量预混试剂试剂盒说明书配制反应体系,具体见表2,RT-qPCR参数如表3。记录数据并分析得到的Ct值,以2-ΔΔCt相对定量法分析目的基因表达量的变化。按公式(1)计算:
F=2-ΔΔCt=
2-(Ct目的基因-Ct内参基因)实验组-(Ct目的基因-Ct内参基因)对照组
(1)
表2 RT-qPCR反应体系
Table 2 RT-qPCR reaction system

组成成分添加量/μL2×SuperReal PreMix Plus10 正向引物(10 μmol/L)0.6 反向引物(10 μmol/L)0.6 cDNA模板1 RNase-free ddH2O7.8
表3 RT-qPCR参数
Table 3 RT-qPCR parameters

温度/℃时间/s9512094 20 63 45 60 300GOTO:40Melt Curve 65.0 ℃ to 95.0 ℃
1.4 数据分析
结果均为3 次独立重复实验数据的平均值,采用Origin 8.5进行数据分析和作图,并利用SPSS 17.0进行方差分析。P<0.05表示差异显著。
2 结果与分析
2.1 营养胁迫对Gr17的生长及细菌素合成的影响
由图1可知,相同条件下培养28 h后,对照组Gr17的菌体密度最大,处理组菌体密度随培养基初始营养物质浓度降低逐渐减小,表明营养胁迫条件抑制菌体生长。1/2 MRS和3/4 MRS的胁迫条件下细菌素抑菌活性均低于对照组且变化趋势与菌体密度一致。但菌株在1/4 MRS中所产细菌素抑菌活性最大(效价704 AU/mL),较对照组增加80 AU/mL。基于上述结果,选择1/4 MRS作为最佳胁迫条件进行后续研究。
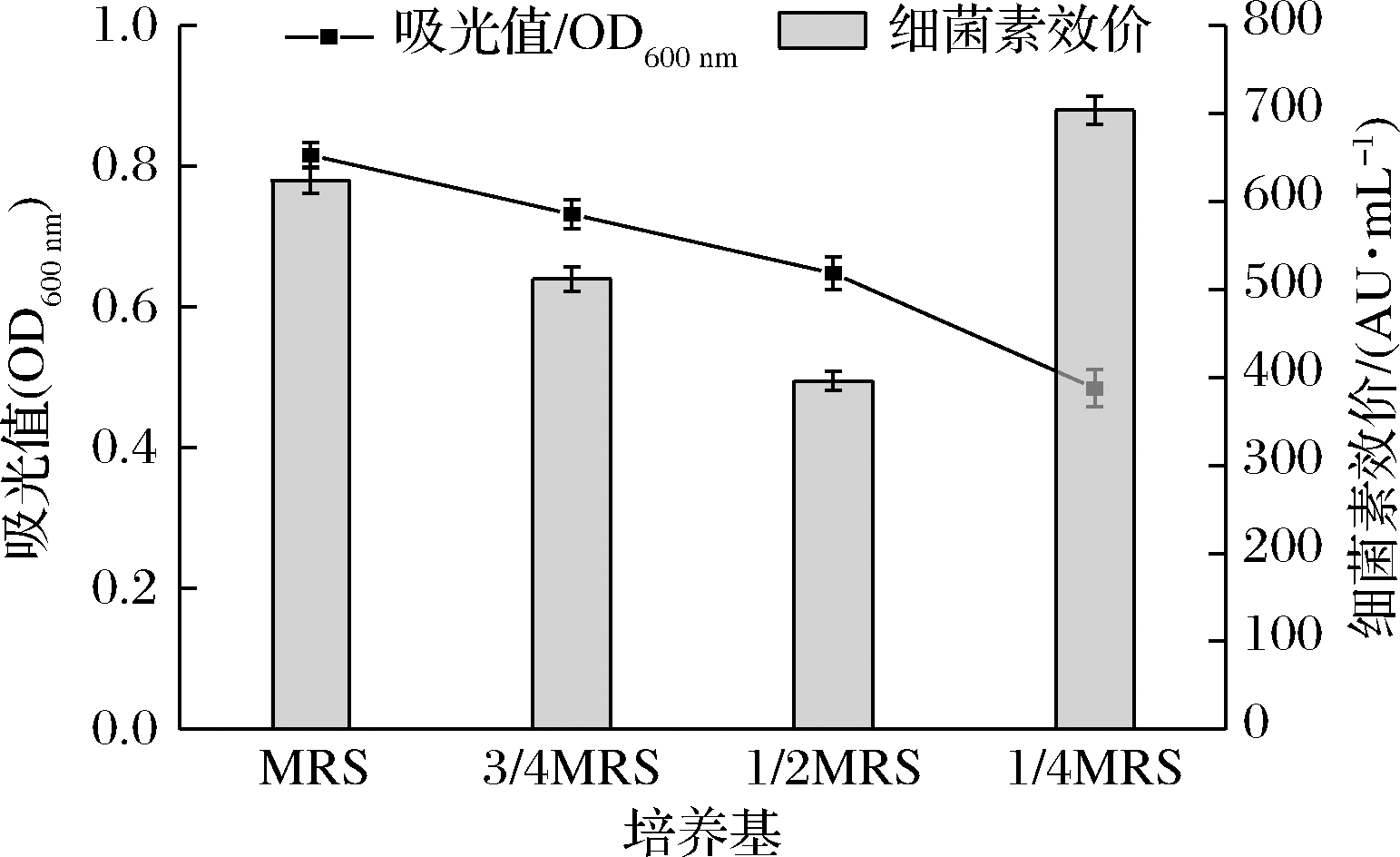
图1 营养物质浓度对肠球菌Gr17生长和细菌素合成的影响
Fig.1 Effects of nutrient concentrations on the growth
and bacteriocin synthesis of E.faecalis Gr17
2.2 可正向调控细菌素合成的最佳胁迫条件对Gr17的生长及细菌素合成的影响
测定不同时间下MRS和1/4 MRS中的菌体密度和细菌素抑菌活性(图2),结果表明胁迫处理的菌株生长至24 h开始进入稳定期,较对照组延迟4 h,OD600 nm值也显著降低(P<0.05),最大OD600 nm仅为0.725,较对照组最大OD600 nm(0.883)显著降低(P<0.05)(图2-a)。表明1/4 MRS的胁迫条件会抑制Gr17生长。
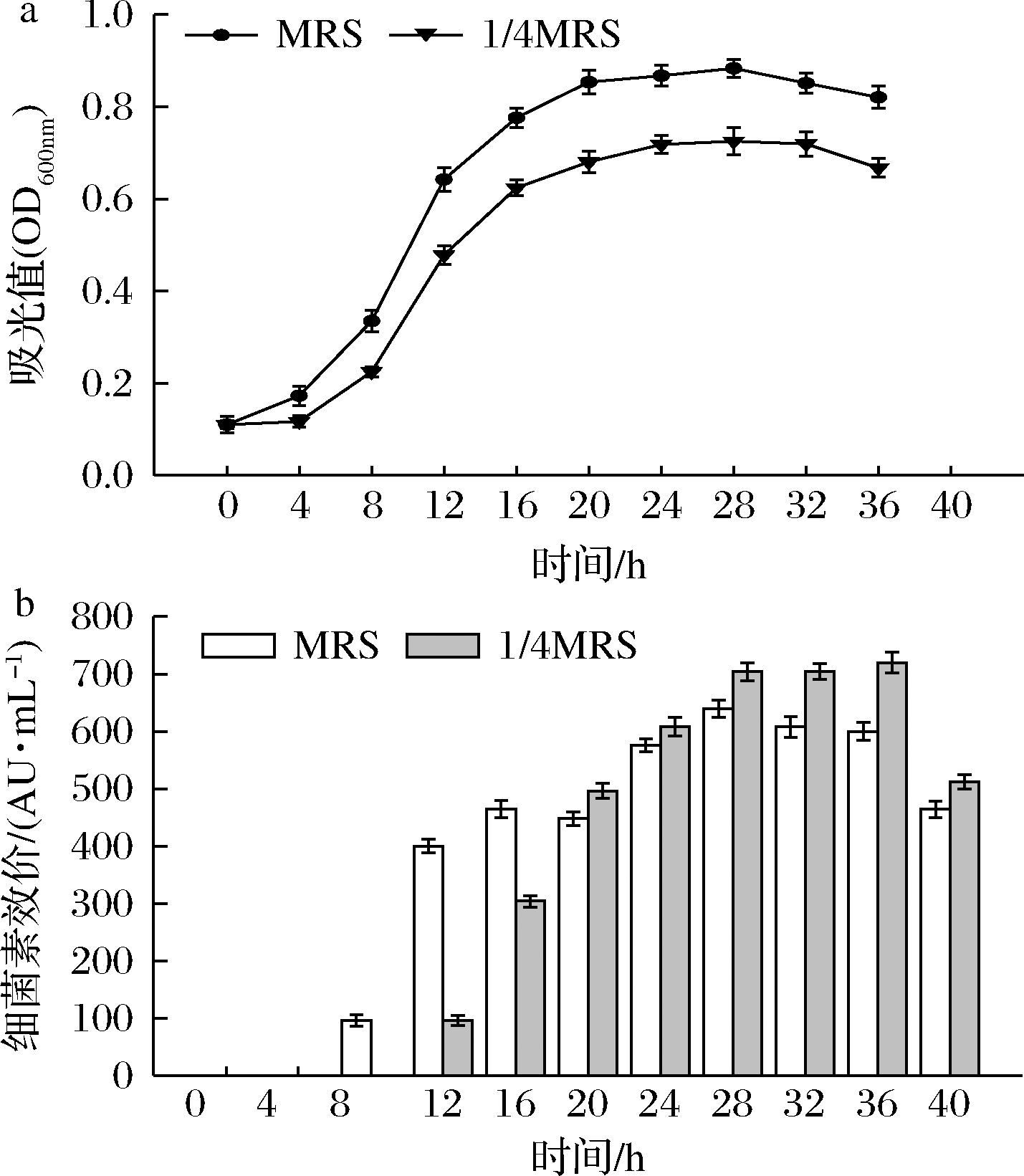
a-生长情况;b-细菌素抑菌活性
图2 正常条件与营养胁迫下肠球菌Gr17生长情况
与细菌素抑菌活性
Fig.2 Growth and bacteriocin activity of E.faecalis Gr17
under normal and nutritional stress condition
由图2-b可知,在MRS中,菌株自8 h开始合成细菌素,28 h细菌素抑菌活性达到最高(640 AU/mL),此后细菌素产量随菌体密度减小逐渐下降。1/4 MRS中,菌株自12 h开始合成细菌素,较对照组延后4 h,原因为当菌体细胞达到一定密度,AIPs积累至一定阈值激活QS,细菌素才开始合成,营养胁迫下菌株生长状况差,从而菌体密度达到细菌素开始合成的阈值的时间延长(图2-b)。自20 h,同一时间胁迫条件下的细菌素抑菌活性更强,且其在36 h时达到的最大抑菌活性(720 AU/mL)显著高于对照组的最大抑菌活性(640 AU/mL)(P<0.05),表明1/4 MRS这一胁迫条件可促进细菌素的合成分泌(图2-b)。
2.3 可正向调控细菌素合成的最佳胁迫条件对Gr17细菌素合成相关基因表达的影响
2.3.1 编码自诱导肽相关基因的表达
基因AIP在MRS和1/4 MRS下的表达量如图3所示,两种条件下AIP的表达趋势均与菌体密度的变化趋势基本一致。12 h前,营养胁迫下菌体密度较对照组减小(图2-a),AIPs积累量较低,这与图3营养胁迫条件下AIP的表达量低于对照组结果一致。自18 h,1/4 MRS中AIP的表达量却较对照组显著上调(P<0.05),表明1/4 MRS下AIP的表达受到正向调控。

a-6 h;b-12 h;c-18 h;d-24 h;e-36 h;f-48 h
图3 正常条件与营养胁迫下基因hpk、rr、AIP表达量变化
Fig.3 Changes in the expression of genes hpk,rr and AIP under normal and nutritional stress conditions
2.3.2 编码双组分系统中组氨酸蛋白激酶和感应调节蛋白基因的表达
如图3所示,hpk与rr的表达量变化趋势与AIP的趋势基本一致。6~12 h,与对照组相比,营养胁迫条件下hpk和rr表达量较低,这可能是因为营养胁迫影响菌体生长,导致AIPs积累量低,hpk和rr未被大量激活。18 h起,AIP表达量上调,AIPs合成量增加,hpk与rr被大量激活,表达量显著上调(P<0.05)。表明1/4 MRS这一胁迫条件可能通过影响AIP正向调控hpk与rr的表达。
2.3.3 编码细菌素相关基因的表达
ent I、ent J和ent Gr17在MRS和1/4 MRS中的表达量如图4,两种条件下ent I、ent J和ent Gr17的表达趋势与细菌素产量的趋势基本一致。6~12 h,营养胁迫条件下ent I、ent J和ent Gr17的表达量低于正常培养条件;但自18 h,营养胁迫条件下ent I、ent J和ent Gr17的表达量较对照组均出现显著上调(P<0.05)。这一结果与2.3.1和2.3.2中结论相符,推测1/4 MRS这一营养胁迫条件通过上调AIP的表达,进而上调hpk、rr的表达,最终实现对细菌素结构基因的调控。
2.3.4 编码ABC转运系统的ABC转运蛋白及其辅助蛋白相关基因的表达
AS-48E、AS-48F、AS-48G、AS-48H在MRS和1/4 MRS下的表达量如图5所示,两种条件下这4个基因的表达均与细菌素产量的趋势基本一致。6 h之前,QS系统尚未启动,细菌素未开始合成,仅有少量AIPs需借助ABC转运系统运送至胞外,而胁迫条件下AIPs积累量较低,故AS-48E、AS-48F、AS-48G、AS-48H的表达量低于对照组。12~18 h,菌体密度已达到启动QS系统的阈值,这4个基因的表达量上调,以合成足量ABC转运蛋白参与AIPs及细菌素的转运,但此时仅有少量AIPs及细菌素需要运输,故上调不明显。18 h后,大量AIPs及细菌素被生产出来,对ABC转运蛋白需求量增大,这4个基因的表达量较对照组显著上调(P<0.05)。36 h左右,菌体生长到达后期,AIPs减少,细菌素合成量降低,对ABC转运蛋白需求量减小,AS-48E、AS-48F、AS-48G、AS-48H的表达量相应下调。但营养胁迫条件下AS-48E、AS-48F、AS-48G和AS-48H的表达量仍高于对照组。表明1/4 MRS可间接上调ABC转运系统相关基因表达量(P<0.05)。

a-6 h;b-12 h;c-18 h;d-24 h;e-36 h;f-48 h
图4 正常条件与营养胁迫下基因ent I、ent J和ent Gr17表达量变化
Fig.4 Changes in the expression of genes ent I,ent J and ent Gr17 under normal and nutritional stress conditions

a-6 h;b-12 h;c-18 h;d-24 h;e-36 h;f-48 h
图5 正常条件与营养胁迫下ABC转运系统相关基因表达量变化
Fig.5 Changes in the expression of genes related to ABC transport system under normal and nutritional stress conditions
3 结论与讨论
本研究表明,营养胁迫抑制粪肠球菌Gr17的生长,MATARAGAS等[20]研究表明氮源胁迫可对L.curvatus L442产生生长抑制;PARLINDUNGAN等[21]发现L.plantarum B21受到葡萄糖胁迫时,细胞活力和生长速度明显降低;LEROY等[22]也发现糖和复合营养素(蛋白胨、肉膏、酵母提取物)胁迫下,E.faecium RZS C5细胞生长下降,最大生物量减小,与本文研究结果相似。
关于营养胁迫对乳酸菌细菌素合成的影响,有研究表明[21]葡萄糖胁迫对L.plantarum B21细菌素的合成无明显影响;LEROY等[22]也发现在培养基葡萄糖质量浓度为2.5、5.0、10.0、20.0、30.0、40.0、80.0 g/L以及1/4、1/2复合氮源(蛋白胨、肉膏、酵母提取物)胁迫条件下,屎肠球菌RZS C5的细菌素产量无明显变化。但葡萄糖及蛋白胨、酵母抽提物等氮源胁迫条件抑制细菌素的合成[8-9]。然而,KIM等[23]发现与总营养物质浓度较高时相比,营养浓度较低时Lactococcus lactis subsp. lactis C2SmPrt-细菌素产量较高;LEROY等[24]测定了不同复合氮源(牛肉粉、蛋白胨、酵母提取物)浓度下Lactobacillus sakei CTC 494的细菌素活性,结果表明低氮源浓度下细菌素活性更高。CALLEWAERT等[25]发现MRS中复合氮源(牛肉浸粉、蛋白胨、酵母提取物)增加,Lactobacillus amylovorus DCE 471的特异性细菌素产量降低;VERLUYTEN等[10]发现L.curvatus LTH 1174在1/2 MRS中的细菌素产量较MRS中增加。不同研究中所得结论的差异可能与菌株本身特性和具体胁迫条件有关。目前很多研究通过富营养条件或调整培养基营养物质成分及配比提高细菌素产量[26-28],但成本高且增产效果有限。本研究发现1/4 MRS下Gr17的细菌素活性显著提高,表明适当的营养胁迫条件可以正向调控细菌素合成。这是因为细菌在自然环境下面临多种竞争,细菌通过合成细菌素抑制其他细菌的生长以达到自我保护的目的。营养丰富时,细菌缺少竞争压力,细菌素的合成分泌下降。但胁迫条件使细菌素生产机制处于活跃状态,细菌素产量由此增大。
对于营养胁迫调控细菌素合成的机制目前无明确定论,基于本文研究结果,推测1/4 MRS营养胁迫条件正向调控细菌素合成的机制为:营养胁迫促使编码AIPs的基因AIP上调,AIPs合成量增大。AIPs积累达阈值后,激活HPK,HPK发生自磷酸化,接着激活RR,RR靶向激活细菌素结构基因ent I、ent J和ent Gr17,细菌素合成量增大。因为AIPs和已合成的细菌素需借助ABC转运系统运送至胞外,故编码ABC转运系统的基因表达量也发生上调,具体见图6。

图6 营养胁迫正向调控细菌素合成机制预测图
Fig.6 Prediction of the mechanism of nutrient stress positively
regulating bacteriocin synthesis
本研究结果表明营养胁迫可以通过种内QS系统调控细菌素合成。目前有研究表明fsr QS系统在粪肠球菌合成抗菌肽的过程中具有调控作用,该系统通过fsrABCD 4个基因调控编码重要蛋白酶和抗菌蛋白的靶位点fsrBCD,gelE-sprE operons,ef1097,进而影响抗菌肽的合成[29-30]。还有研究表明由信号分子AI-2介导的LuxS种间QS系统可能参与饥饿环境下乳酸菌的应激反应,YEO等[16]发现乳杆菌在饥饿胁迫下,QS系统中的AI-2活性升高。GU等[15]研究稀释的MRS中AI-2活性显著高于对照组,且QS相关基因LuxS过表达。营养胁迫下还可能存在其他细菌素合成调控机制,随着相关研究的深入,营养胁迫有望成为一种有效提高细菌素产量的方法。
[1] SILVA C C G,SILVA S P M,RIBEIRO S C.Application of bacteriocins and protective cultures in dairy food preservation[J].Frontiers in Microbiology,2018,9:594.
[2] JAWAN R,ABBASILIASI S,TAN J S,et al.Influence of culture conditions and medium compositions on the production of bacteriocin-like inhibitory substances by Lactococcus lactis Gh1[J].Microorganisms,2020,8(10):1454.
[3] LIU G R,WANG Y,LI X,et al.Genetic and biochemical evidence that Enterococcus faecalis Gr17 produces a novel and sec-dependent bacteriocin,enterocin Gr17[J].Frontiers in Microbiology,2019,10:1806.
[4] FIOCCO D,LONGO A,ARENA M P,et al.How probiotics face food stress:they get by with a little help[J].Critical Reviews in Food Science and Nutrition,2020,60(9):1 552-1 580.
[5] ENGELHARDT T,ALBANO H,KISK G,et al.Antilisterial activity of bacteriocinogenic Pediococcus acidilactici HA6 111-2 and Lactobacillus plantarum ESB 202 grown under pH and osmotic stress conditions[J].Food Microbiology,2015,48:109-115.
G,et al.Antilisterial activity of bacteriocinogenic Pediococcus acidilactici HA6 111-2 and Lactobacillus plantarum ESB 202 grown under pH and osmotic stress conditions[J].Food Microbiology,2015,48:109-115.
[6] SCHOTT A S,BEHR J,GEIßLER A J,et al.Quantitative proteomics for the comprehensive analysis of stress responses of Lactobacillus paracasei subsp.paracasei F19[J].Journal of Proteome Research,2017,16(10):3 816-3 829.
[7] LIU S L,MA Y M,ZHENG Y,et al.Cold-stress response of probiotic Lactobacillus plantarum K25 by iTRAQ proteomic analysis[J].Journal of Microbiology and Biotechnology,2020,30(2):187-195.
[8] 马佳歌,姜瞻梅,姜瑞,等.营养胁迫植物乳杆菌KLDS 1.0328的生理特性及其冷冻干燥菌粉贮存稳定性分析[J].食品科学,2021,42(22):155-161.
MA J G,JIANG Z M,JIANG R,et al.Physiological characteristics of nutrient stressed Lactobacillus plantarum KLDS 1.0328 and storage stability of its freeze-dried cells[J].Food Science,2021,42(22):155-161.
[9] KUMAR K N,DEVADAS S M,MURUGAN S,et al.Production and characterization of bacteriocin by lactic acid bacterium-Pediococcus pentosaceus NKSM1 isolated from fermented ‘appam’ batter[J].Journal of Pure and Applied Microbiology,2018,12(3):1 315-1 330.
[10] VERLUYTEN J,LEROY F,DE VUYST L.Influence of complex nutrient source on growth of and curvacin A production by sausage isolate Lactobacillus curvatus LTH 1174[J].Applied and Environmental Microbiology,2004,70(9):5 081-5 088.
[11] ZHANG D L,WANG F J,YU Y,et al.Effect of quorum-sensing molecule 2-phenylethanol and ARO genes on Saccharomyces cerevisiae biofilm[J].Applied Microbiology and Biotechnology,2021,105(9):3 635-3 648.
[12] BISWAS S,MUKHERJEE P,MANNA T,et al.Quorum sensing autoinducer(s) and flagellum independently mediate EPS signaling in Vibrio cholerae through LuxO-independent mechanism[J].Microbial Ecology,2019,77(3):616-630.
[13] MALDONADO-BARRAG N A,WEST S A.The cost and benefit of quorum sensing-controlled bacteriocin production in Lactobacillus plantarum[J].Journal of Evolutionary Biology,2020,33(1):101-111.
N A,WEST S A.The cost and benefit of quorum sensing-controlled bacteriocin production in Lactobacillus plantarum[J].Journal of Evolutionary Biology,2020,33(1):101-111.
[14] KAREB O,AÏDER M.Quorum sensing circuits in the communicating mechanisms of bacteria and its implication in the biosynthesis of bacteriocins by lactic acid bacteria:A review[J].Probiotics and Antimicrobial Proteins,2020,12(1):5-17.
[15] GU Y,LI B,TIAN J J,et al.The response of LuxS/AI-2 quorum sensing in Lactobacillus fermentum 2-1 to changes in environmental growth conditions[J].Annals of Microbiology,2018,68(5):287-294.
[16] YEO S,PARK H,JI Y,et al.Influence of gastrointestinal stress on autoinducer-2 activity of two Lactobacillus species[J].FEMS Microbiology Ecology,2015,91(7):fiv065.
[17] YADAV M K,SINGH B,TIWARI S K.Comparative analysis of inhibition-based and indicator-independent colorimetric assay for screening of bacteriocin-producing lactic acid bacteria[J].Probiotics and Antimicrobial Proteins,2019,11(2):687-695.
[18] LIU G R,REN L,SONG Z Q,et al.Purification and characteristics of bifidocin A,a novel bacteriocin produced by Bifidobacterium animalis BB04 from centenarians’intestine[J].Food Control,2015,50:889-895.
[19] KUBOTA H,TSUJI H,MATSUDA K,et al.Detection of human intestinal catalase-negative,Gram-positive cocci by rRNA-targeted reverse transcription-PCR[J].Applied and Environmental Microbiology,2010,76(16):5 440-5 451.
[20] MATARAGAS M,DROSINOS E H,TSAKALIDOU E,et al.Influence of nutrients on growth and bacteriocin production by Leuconostoc mesenteroides L124 and Lactobacillus curvatus L442[J].Antonie Van Leeuwenhoek,2004,85(3):191-198.
[21] PARLINDUNGAN E,DEKIWADIA C,TRAN K T M,et al.Morphological and ultrastructural changes in Lactobacillus plantarum B21 as an indicator of nutrient stress[J].LWT,2018,92:556-563.
[22] LEROY F,VANKRUNKELSVEN S,DE GREEF J,et al.The stimulating effect of a harsh environment on the bacteriocin activity by Enterococcus faecium RZS C5 and dependency on the environmental stress factor used[J].International Journal of Food Microbiology,2003,83(1):27-38.
[23] KIM W S,HALL R J,DUNN N W.The effect of nisin concentration and nutrient depletion on nisin production of Lactococcus lactis[J].Applied Microbiology and Biotechnology,1997,48(4):449-453.
[24] LEROY F,DE VUYST L.Growth of the bacteriocin-producing Lactobacillus sakei strain CTC 494 in MRS broth is strongly reduced due to nutrient exhaustion:A nutrient depletion model for the growth of lactic acid bacteria[J].Applied and Environmental Microbiology,2001,67(10):4 407-4 413.
[25] CALLEWAERT R,DE VUYST L.Bacteriocin production with Lactobacillus amylovorus DCE 471 is improved and stabilized by fed-batch fermentation[J].Applied and Environmental Microbiology,2000,66(2):606-613.
[26] SABO S S,CONVERTI A,ICHIWAKI S,et al.Bacteriocin production by Lactobacillus plantarum ST16 Pa in supplemented whey powder formulations[J].Journal of Dairy Science,2019,102(1):87-99.
[27] FAHIM H A,ROUBY W M A E,EL-GENDY A O,et al.Enhancement of the productivity of the potent bacteriocin avicin A and improvement of its stability using nanotechnology approaches[J].Scientific Reports,2017,7:10604.
[28] SIDOOSKI T,BRANDELLI A,BERTOLI S L,et al.Physical and nutritional conditions for optimized production of bacteriocins by lactic acid bacteria-A review[J].Critical Reviews in Food Science and Nutrition,2019,59(17):2 839-2 849.
[29] DUNDAR H,BREDE D A,LA ROSA S L,et al.The fsr quorum-sensing system and cognate gelatinase orchestrate the expression and processing of proprotein EF1097 into the mature antimicrobial peptide enterocin O16[J].Journal of Bacteriology,2015,197(13):2 112-2 121.
[30] ALI L,GORAYA M U,ARAFAT Y,et al.Molecular mechanism of quorum-sensing in Enterococcus faecalis:Its role in virulence and therapeutic approaches[J].International Journal of Molecular Sciences,2017,18(5):960.