蛋白质在食品领域应用广泛,其可作为乳液体系的乳化剂吸附在油水界面,降低界面张力,提高乳液的热力学稳定性[1]。添加表面活性剂和多糖等均可增加蛋白质乳化性,但表面活性剂的潜在毒性及对环境的危害限制了其在食品领域中的应用,多糖的原料易获取、安全无毒、操作简单,更适宜应用在食品体系中。蛋白质和多糖分子间的相互作用可分为共价(即形成美拉德反应产物)和非共价相互作用(如氢键、空间排阻、静电和疏水)。二者间的作用力主要取决于环境条件,如pH、温度和浓度等[2]。利用两者间的相互作用,可以改变蛋白质的结构特性与功能特性,如流变学特性、界面特性等,制备不同结构和功能特性的复合微纳米胶体粒子。
鱼皮明胶(fish skin gelatin, FSG) 通过水解水产鱼皮的胶原蛋白而获得,是相对分子质量较高的优质海洋源蛋白质[3],其来源广泛、价格低廉,且可有效解决哺乳动物源明胶涉及的传染病(疯牛病)与宗教信仰等问题。FSG具有很高的表面活性,可以起到乳化剂的作用,并形成带正电荷的液滴,在食品工业中被广泛用作稳定剂。海藻酸钠(sodium alginate, Alg)是从褐藻或马尾藻中提取的天然阴离子线性多糖,具有无毒、亲水性、生物相容性、较强粘稠性等特点[4],是复合体系中理想的多糖稳定剂。SILVA等[5]将质量分数为0.5%的Alg与1.5%的明胶混合,二者通过静电作用形成复合体系,275 W超声处理后可得到稳定的乳液体系,提高了乳液的贮藏稳定性。SILVANA等[6]研究了乳清分离蛋白与Alg复合制备的多层乳液,发现Alg的添加使得乳清蛋白通过静电作用与Alg在油水界面结合,增加了乳液的稳定性。虽然Alg与动物源蛋白的相互作用研究比较广泛,但其与海洋蛋白(如FSG)的相互作用关系还不明确。
本实验研究了pH、Alg浓度对FSG-Alg间相互作用的影响,通过浊度、电位、荧光光谱、冷场扫描电镜、等温滴定量热分析了复合体系中FSG与Alg的相互作用力的类型及规律。为海洋源蛋白FSG在食品领域的应用例如复合凝胶、多层乳液输送体系等提供了理论依据。
本实验研究了pH、Alg浓度对FSG-Alg间相互作用的影响,通过浊度、电位、荧光光谱、冷场扫描电镜、等温滴定量热分析了复合体系中FSG与Alg的相互作用力的类型及规律。为海洋源蛋白FSG在食品领域的应用例如复合凝胶、多层乳液输送体系等提供了理论依据。
1 材料与方法
1.1 材料与试剂
鱼皮明胶,美国Sigma-Aldrich公司;玉米油,山东西王食品有限公司;海藻酸钠、异硫氰酸荧光素,上海阿拉丁生化科技股份有限公司;尼罗红,上海生工生物工程有限公司;其他试剂均为分析纯,天津市大茂化学试剂厂。
1.2 仪器与设备
Zetasizer 3000HSA激光粒度仪,英国马尔文仪器公司;Affinity等温滴定量热仪,美国TA仪器有限公司;F—2700荧光光谱仪,日立仪器(上海)有限公司;SU8010冷场扫描电镜,日本HITACHI公司;UV2100紫外可见分光光度计,上海尤尼柯仪器有限公司。
1.3 实验方法
1.3.1 FSG-Alg复合体系的制备
分别取一定量的FSG和Alg于去离子水中,在室温下用磁力搅拌器搅拌过夜,使二者可以完全水化溶解。将溶解好的溶液按一定比例混合,制备总浓度为1%,FSG及Alg的质量比分别为8∶1、4∶1、2∶1、1∶1、1∶2、1∶4的混合物。用1 mol/L NaOH溶液和HCl溶液调节混合物的pH,使其pH变化区间为2~8。取一定量的上述混合物溶液于螺口玻璃瓶中,静置12 h后进行拍照观察。
1.3.2 FSG-Alg复合体系的浊度测定
参照MARTINIS等[7]的方法略加修改。将样品放置于1 cm光程的样品池中,使用紫外分光光度计在600 nm处测量样品的浊度,每个样品平行测定3次,取平均值。浊度(T)定义按公式(1)计算:
T=-ln(I/I0)
(1)
式中:I,透射光强度;I0,入射光强度。
1.3.3 FSG-Alg复合体系的电位测定
Zeta电位的测定参照GUMUS等[8]的方法稍加修改。采用激光粒度仪对其Zeta电位进行测定。实验具体参数为:25 ℃;平衡时间10 s;运行次数:10次。
1.3.4 FSG-Alg复合体系的荧光光谱分析
采用荧光光谱仪对FSG-Alg复合体系进行内源荧光分析。实验具体参数为:激发波长295 nm;采集范围250~450 nm;扫描速率50 nm/min。
1.3.5 FSG-Alg复合体系的等温滴定量热(isothermal titration calorimetry,ITC)分析
复合体系的ITC分析是根据LI等[9]的方法并稍加改动。首先,将浓度分别为0.1 mmol/L的FSG溶液与0.005 mmol/L的Alg溶液进行脱气处理。向样品池中添加250 μL的Alg溶液,进样针吸取200 μL的FSG溶液后,对样品进行热力学分析,pH 7的磷酸盐缓冲液为对照组。实验具体参数为:实验温度25 ℃;每次进样量5 μL;滴定次数30次;滴定间隔240 s;搅拌速率100 r/min。
1.3.6 FSG-Alg复合体系的微观结构观察
使用冷场扫描电子显微镜(cryo-scanning electron microscope,cryo-SEM)表征各消化阶段样品的微观结构。将载有样品的样品台在液氮中快速冷冻至-180 ℃,将冷冻的样品在真空条件下转移至制备室。样品于-90 ℃下升华20 min以去除水分。对样品喷金处理后,在2 kV的加速电压下操作以获得FSG-Alg复合体系的cryo-SEM图像。
1.4 数据处理
每组实验均至少做3次平行并取平均值,数据以平均值±标准差表示。利用SPSS 18.0软件对数据进行ANOVA差异显著性分析,P<0.05为显著性差异。
2 结果与分析
2.1 FSG-Alg复合体系的浊度变化及相行为研究
各个FSG-Alg复配比的复合体系的浊度随pH变化的曲线如图1-a所示。
复合体系有4个关键pH拐点:pHc为可溶性复合物形成,pHφ1为不溶性复合物形成,pHopt为达到最大浊度,pHφ2为不溶性复合物解离[10]。FSG-Alg复合体系的初始pH值在5附近,此时复合体系形成不可溶性复合物,即pHφ1。继续增加pH,体系浊度减小,在pH 6~7时达到最小值,形成可溶性复合物,即pHc。由于Alg遇酸会形成沉淀,所以除FSG∶Alg为8∶1外,在加入酸后均在pH 4时达到最大浊度,形成不可溶性复合物,即pHopt。FSG∶Alg为8∶1时未达到最大浊度的原因可能是Alg在体系中占比较小,FSG占据主导作用。继续减小pH,样品浊度开始减小,FSG-Alg复合体系浊度的结果与其相行为宏观图像(图1-b)相对应。散射理论表明,复合体系浊度减少则体系内颗粒减少[11]。当FSG-Alg比例在8∶1~1∶1,不可溶性复合物在pH 2时解离,即pHφ2,体系内颗粒减少,FSG-Alg的复合体系澄清透明。当FSG-Alg比例为1∶2和1∶4时,复合体系的浊度随着pH的降低而升高,说明在这2种浓度下复合体系结合的更为牢固,并未出现复合物解离的现象,pH的下降使得复合体系稳定性更好。FSG-Alg复配比例为1∶4时,其浊度在pH下降过程中明显小于FSG-Alg复配比为1∶2的浊度,这可能是因为Alg的浓度过高超过了蛋白能够结合的多糖临界浓度[12],过量的Alg降低了体系的pH稳定性,使浊度降低。结合上述理论分析,FSG-Alg复合体系在pH 7时出现可溶性复合物并呈共溶趋势,并且在 FSG与Alg的配比为1∶2时,体系的稳定性受pH变化影响较小。

a-FSG-Alg复合体系的浊度曲线与pH关系;b-宏观相行为变化
图1 FSG-Alg复合体系的浊度曲线与pH关系
及宏观相行为变化
Fig.1 Turbidity curve and pH relationship,and macroscopic
phase behavior change of FSG-Alg composite system
2.2 FSG-Alg复合体系的电位变化
如图2-a所示,当pH 7时FSG带温和的正电荷,Alg带强的负电荷,复合体系带负电,随着复合体系中Alg比例的加大,其Zeta电位的绝对值发生显著性升高(P<0.05),FSG-Alg的复配比从8∶1变化到1∶2的过程中,体系的电位从(-16.77±0.76)mV降低到(-60.70±2.52)mV。这与牛付阁[13]研究的卵白蛋白-阿拉伯胶复合体系的电位变化趋势相同,随着阳离子蛋白浓度增加,电位趋于正值,Alg和FSG所带的相反的电荷相互中和导致电位下降。由于Alg本身是一种阴离子多糖,当Alg浓度增大时,体系所带的负电荷逐渐增加,这说明二者之间存在一种交互作用使其形成一种新的FSG-Alg复合物。当FSG∶Alg的复配比由1∶2增加到1∶4,电位没有明显的变化,这说明Alg与FSG的结合已经达到饱和,继续添加Alg并不会对复合体系产生影响。
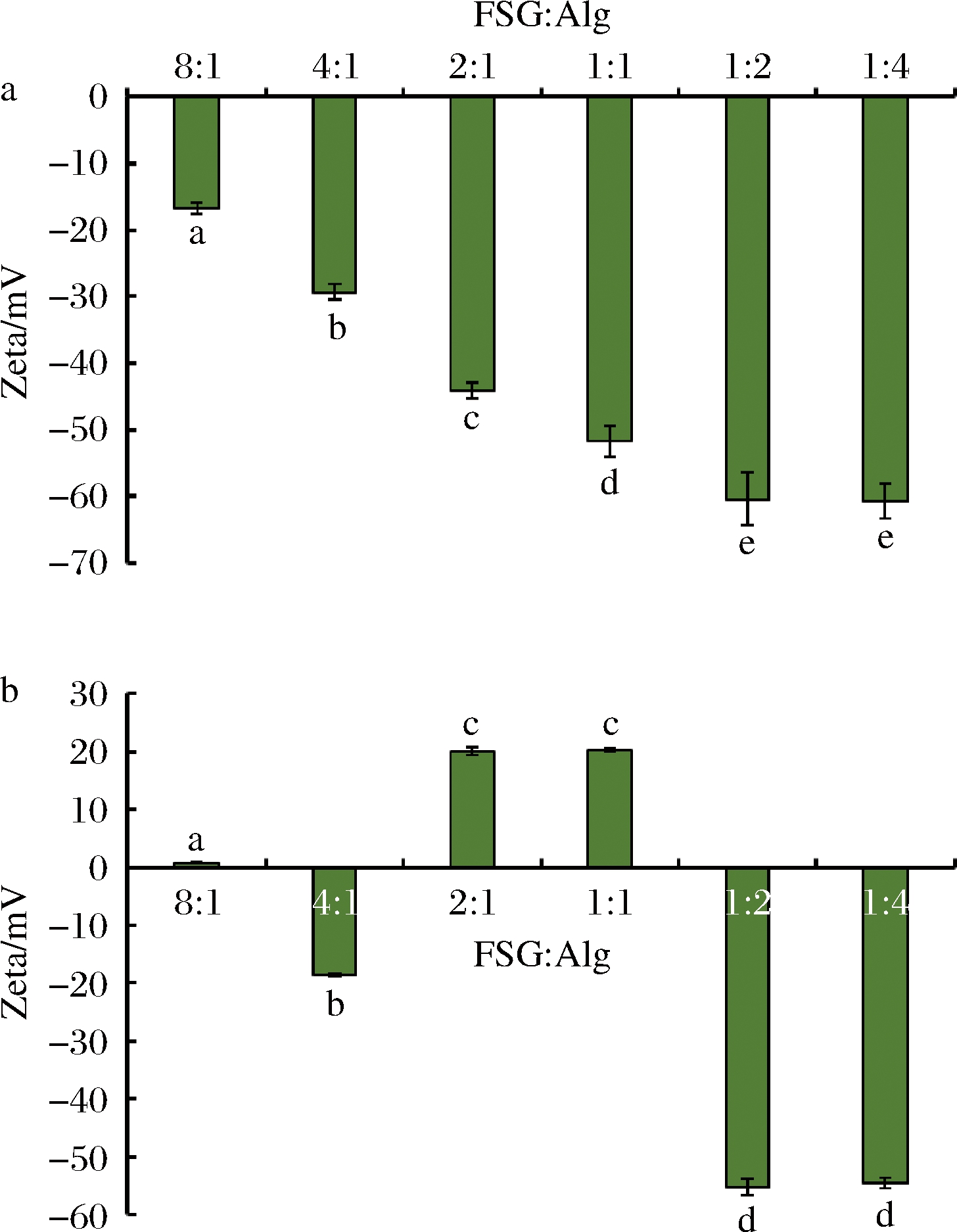
a-pH 7;b-pH 4
图2 FSG和Alg的配比对复合体系Zeta电位的影响
Fig.2 Influence of the ratio of FSG and Alg on Zeta potential
其次,由于多糖含量过高,架桥絮凝和损耗絮凝的作用会导致体系中分子间的复合受到抑制。
如图2-b所示,pH为4时,FSG-Alg的复配比从8∶1变化到4∶1后电势绝对值从(1.14±0.04)mV增大到(18.84±0.12) mV,说明体系在加入Alg后趋于稳定。值得一提的是FSG-Alg的复配比从2∶1增加到1∶2时,电位由正转为负,这可能是由于Alg的酸敏感性,在pH 4时部分的Alg会形成沉淀。浊度的结果也表明,在pH 4时,由于Alg沉淀的颗粒更大,FSG-Alg的复配比在2∶1~1∶1的样品浊度显著高于其余样品。当FSG-Alg的复配比例在2∶1~1∶1时,Alg并未与FSG结合形成复合物,未结合的FSG导致了体系整体电位为正。继续增加Alg,当FSG-Alg的复配比达到1∶2和1∶4时溶液体系电位的绝对值最高(>50 mV),这可能是因为FSG分子上的正电荷与Alg分子上的负电集团发生静电吸引[14],使得复合体系的电势增加。
2.3 FSG-Alg复合体系的荧光光谱变化
蛋白质的某些氨基酸,如色氨酸、苯丙氨酸等芳香族氨基酸残基会由于复合体系中蛋白质与多糖之间的相互作用而发生改变。通常根据内源性荧光强度来分析其周围环境的极性状况以及相互作用的类型[15]。由图3可知,随着Alg的加入,荧光光谱的峰值未发生较大的偏移,说明Alg没有使FSG的酪氨酸和色氨酸残基的微环境发生太大的变化[16]。
pH为4时,FSG-Alg的复配比为8∶1时体系的荧光强度最低,体系中的多糖浓度增加后,其荧光强度有所增加,可能是蛋白质发生了自聚集与Alg相互作用后使发色基团被包裹在其他大分子侧链内,使荧光强度增加[17]。说明体系中的FSG-Alg复合物并非稳定,而是以团聚体的形式存在,并且随着Alg浓度上升,团聚更加明显,当FSG-Alg的复配比为2∶1时,体系中的荧光强度达到最大值,表明此时体系的浊度最大,与浊度曲线(图1-a)吻合。
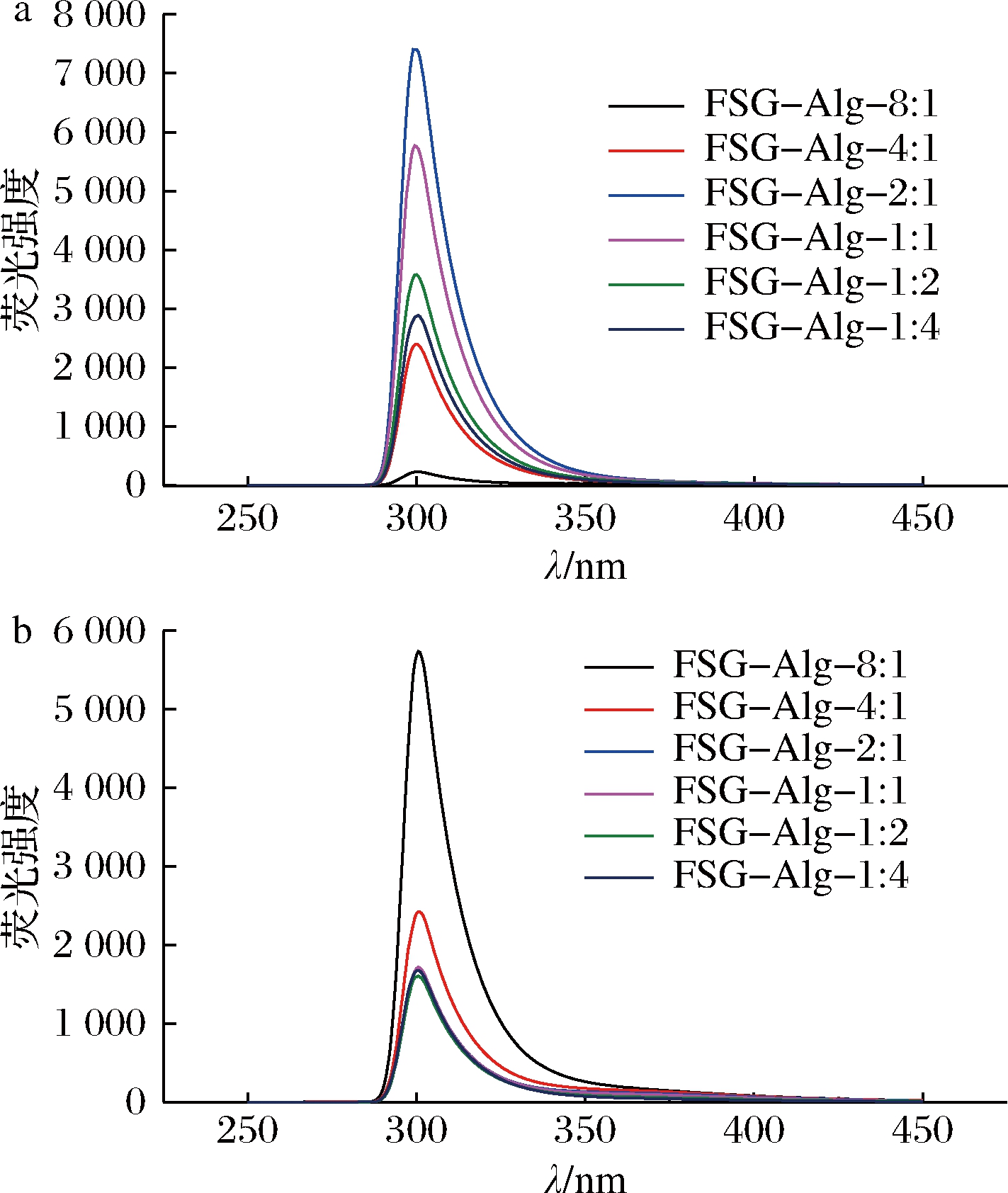
a-pH 4;b-pH 7
图3 FSG和Alg的配比对复合体系荧光光谱的变化
Fig.3 Effect of the ratio of FSG to Alg on the fluorescence
spectrum of FSG-Alg composite system
pH为7时,FSG-Alg的复配比为8∶1时体系的荧光强度最高,并且随着Alg比例的增加,体系的荧光强度逐渐减弱。这说明Alg的增加对荧光有猝灭效果[18],Alg与FSG发生了相互作用,Alg改变了FSG的空间构象。当FSG与Alg配比达到1∶2后,增加Alg浓度,体系的荧光强度没有发生大的转变,结合之前的浊度与电位结果可知,多余的Alg游离在体系中,并未与FSG结合。薛瑾等[19]在研究茶多酚与酪蛋白的相互作用时也出现了类似的情况。蛋白与多糖间的相互作用会导致荧光猝灭致使荧光强度下降。在荧光猝灭机理的研究过程中,蛋白质通常是作为荧光能量的供体,这些荧光供体与其他物质(荧光猝灭剂即荧光能量受体)存在分子间的弱相互作用力,主要包括静电作用力、范德华力、疏水作用力和氢键等[20]。
2.4 FSG-Alg复合体系的ITC分析
浊度结果表明,pH 4时所有比例的FSG-Alg溶液均形成不可溶沉淀,故仅对pH 7条件下FSG-Alg体系进行等温滴定量热测定。根据OVERBEEK等[21]的理论,蛋白质和多糖的复合受静电作用和热力学作用的影响,与溶剂分子电荷相反的粒子结合成凝聚相,包埋了溶剂分子。由于分子重排的影响,凝聚相中溶剂分子的存在增加了体系的熵值。为了进一步了解FSG与Alg的热力学相互作用,等温滴定量热法的结果如图4所示。
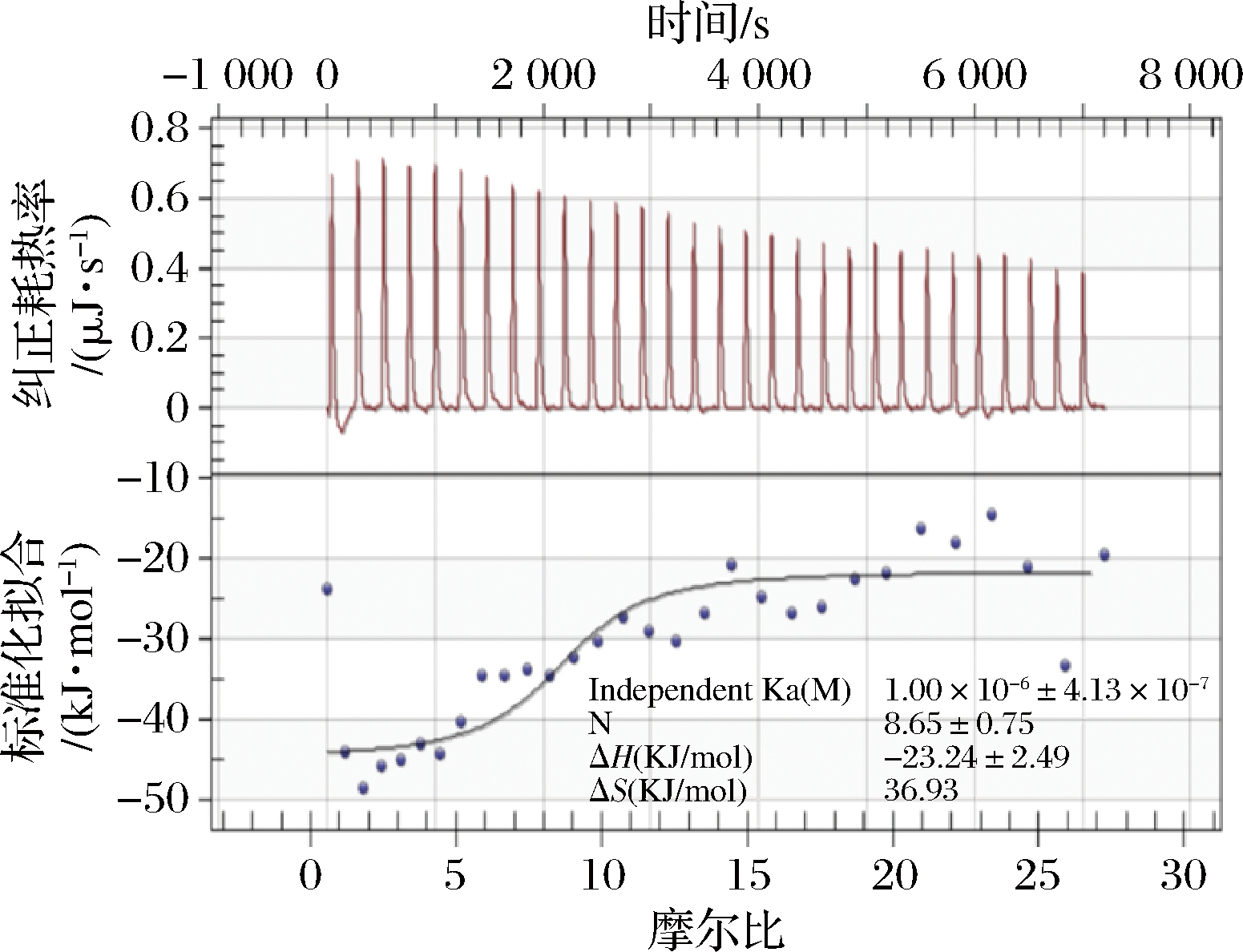
图4 FSG与Alg的等温滴定曲线
Fig.4 Isothermal titration curves of FSG and Alg
在pH 7时,在Alg滴定FSG过程中的焓变值始终为负(ΔH<0),说明FSG与Alg间的复合反应是放热反应,并且是自发的(ΔG<0)。这个结果与已报道的复合物形成主要是由静电相互作用引起的观点相吻合[22]。在pH 7下FSG与Alg所带电荷相反,两者之间由静电吸引产生的静电作用力,释放出了较多热量。随着Alg的滴定量增加,体系的焓变值不断减小趋于稳定。在FSG∶Alg=1∶2时出现滴定终点,继续滴加Alg并不会引起热量的变化,说明体系中FSG与Alg完全结合,没有更多的结合位点产生静电作用而放热,因此体系的滴定热会逐渐降低。整个热力学相互作用过程中,体系的焓变值为(-23.24±2.49)kJ/mol,熵变值为(36.93±0.08)kJ/mol。孙亚天等[23]研究了pH 6时大豆蛋白与壳聚糖滴定的热量变化。在焓变过程中随着壳聚糖浓度的增加,放热量逐渐降低直至最终体系稳定。表明FSG和Alg的热力学作用为静电作用和负焓驱动的放热反应,且在当FSG∶Alg=1∶2时达到焓变最大值。
2.5 FSG-Alg复合体系的空间结构观察
如图5所示,pH 4和pH 7条件下的FSG-Alg复合体系的微观结构有明显的区别:pH 4时复合体系呈细丝状堆叠的结构,并没有稳定完整的空间构象,结合浊度的结果可知,由于Alg在酸性条件下产生沉淀,体系中蛋白与多糖间的静电作用也相对较小,并且随着Alg浓度增加,最终形成与pH 4时单纯Alg溶液相似的片层状的结构,表明此时Alg并没有充分与FSG复合,复合体系相对不稳定。

图5 FSG和Alg的配比对复合体系空间结构的影响
Fig.5 Influence of the ratio of FSG to Alg on the spatial
structure of the composite system
在pH 7时Alg的片层结构较为平滑,有形成蜂窝状的趋势,而FSG的微观结构呈现细碎枝杈状的结构。如图5所示,当FSG∶Alg>1∶1时,并没有呈片层状结构,当FSG∶Alg=1∶1和1∶2时,复合体系微观结构呈片层状结构。当FSG∶Alg=1∶4时,又呈与单纯Alg相似的蜂窝状结构。这说明当FSG和Alg混合后,随着Alg浓度增加,FSG特有的枝杈状结构出现在Alg的片层上,表明FSG-Alg结合形成了稳定的空间结构。当FSG∶Alg=1∶1和1∶2时,复合物中亲水基团和疏水基团的比例接近0.5。MAI等[24]和BATES等[25]的研究结果同样表明,当复合物中单体分子数量/整体聚合度为0.4~0.6时,两亲性小分子物质在水中会自组装呈片层状。所以当FSG∶Alg=1∶1和1∶2时,复合体系呈稳定的片层状,继续增加Alg的浓度,过量的Alg堆积形成蜂窝状结构,影响复合体系的稳定以及FSG与Alg间的相互作用。
3 结论
本研究在不同pH条件下制备了不同FSG、Alg配比的蛋白质-多糖复合体系。对复合体系进行浊度、Zeta电位、荧光光谱和ITC测定发现:FSG-Alg复合体系在pH 7时共溶,在此pH下FSG-Alg的结合是最稳定的;FSG-Alg复合体系中静电作用占据主导,静电作用随着Alg浓度的增加而更加强烈,在FSG∶Alg为1∶2时复合体系的电荷量最高,FSG与Alg间的静电作用最强,pH是影响静电作用的主要因素。冷场扫描电镜观察到FSG与Alg在静电力的作用下紧密结合,随着Alg浓度的升高,Alg细丝更多的附着在FSG的枝杈网络结构中。不同的是pH 7时FSG与Alg复合体系形成了更为稳定的蜂窝状结构,而pH 4时则呈片层状结构,表明pH 7时FSG与Alg间的静电作用更强。本研究对FSG和Alg相互结合的规律进行了初步探索,为今后的复合纳米粒子或多层乳液制备提供了理论研究基础。
[1] XU G R X,WANG C N,YAO P.Stable emulsion produced from casein and soy polysaccharide compacted complex for protection and oral delivery of curcumin[J].Food Hydrocolloids,2017,71:108-117.
[2] PATINO J M R,PILOSOF A M.Protein-polysaccharide interactions at fluid interfaces[J].Food Hydrocolloids,2011,25(8):1 925-1 937.
[3] AKAGüNDüZ Y,MOSQUERA M,GIMÉNEZ B,et al.Sea bream bones and scales as a source of gelatin and ace inhibitory peptides[J].LWT-Food Science and Technology,2014,55(2):579-585.
[4] 冯稳稳. 基于乳清分离蛋白-海藻酸钠复合载体的活性物质的包埋研究[D].无锡:江南大学,2018.
FENG W W.Study on the encapsulation of bioactive materials baesd on whey protein isolate-sodium alginate complex carriers[D].Wuxi:Jiangnan University,2018.
[5] SILVA K C G,SATO A C K.Sonication technique to produce emulsions:The impact of ultrasonic power and gelatin concentration[J].Ultrasonics Sonochemistry,2019,52:286-293.
[6] SILVANA A,FIORAMONTI,MARTINEZ M J,et al.Multilayer emulsions as a strategy for linseed oil microencapsulation:Effect of pH and alginate concentration[J].Food Hydrocolloids,2015,43:8-17.
[7] MARTINIS,POTERR,WALSHMK.Optimizing the use of power ultrasound to decrease turbidity in whey protein suspensions[J].Food Research International,2010,43(10):2 444-2 451.
[8] GUMUS C E,DECKER E A,MCCLEMENTS D J.Gastrointestinal fate of emulsion-based ω-3 oil delivery systems stabilized by plant proteins:Lentil,pea,and faba bean proteins[J].Journal of Food Engineering,2017,207:90-98.
[9] LI Y,ZHANG X,ZHAO Y,et al.Investigation on complex coacervation between fish skin gelatin from cold-water fish and gum Arabic:Phase behavior,thermodynamic,and structural properties[J].Food Research International(Ottawa,Ont.),2018,107:596-604.
[10] 李兴飞. 大豆乳清蛋白与多糖的复合作用以及蛋白质组分的选择性提取[D].无锡:江南大学,2017.
LI X F.Soybean whey proteins-polysaccharide complexation and the selective extraction of proteins[D].Wuxi:Jiangnan University,2017.
[11] 邱蓉. CMC和大豆多糖对酸性乳饮料中酪蛋白稳定机理的研究[D].杭州:浙江工商大学,2010.
QIU R.Studies on the stabilization mechanism of casein in the acidified milk drinks induced by CMC and soybean polysaccharide[D].Hangzhou:Zhejiang Gongshang University,2010.
[12] JIAN Z,TERRY L,PEPPARD.Double-layered emulsions as beverage clouding agents[J].Flavour and Fragrance Journal,2015,30(3):218-223.
[13] 牛付阁. 卵白蛋白—阿拉伯胶相互作用及其在油水界面的吸附特性[D].无锡:江南大学,2015.
NIU F G.Ovalbumin-gum arabic interaction and the adsorption properties at the oil-water interface[D].Wuxi:Jiangnan University,2015.
[14] 王莉红. 禽类蛋白质与κ-卡拉胶相互作用及其复合物对姜黄素包载作用研究[D].杭州:浙江工商大学,2018.
WANG L H.Study on the interactions between pourtry proteins and κ-carrageenan and entrapment of curcumin to their complexes[D].Hangzhou:Zhejiang Gongshang University,2018.
[15] WANG L J,YIN Y C,YIN S W,et al.Development of novel zein-sodium caseinate nanoparticle(ZP)-stabilized emulsion films for improved water barrier properties via emulsion/solvent evaporation[J].Journal of Agricultural and Food Chemistry,2013,61(46):11 089-11 097.
[16] HUSSEIN B H M.Spectroscopic studies of 7,8-dihydroxy-4-methylcoumarin and its interaction with bovine serum albumin[J].Journal of Luminescence,2011,131(5):900-908.
[17] 丁俭, 齐宝坤,姜楠,等.超声处理大豆分离蛋白-壳聚糖复合物结构性质研究[J].农业机械学报,2017,48(9):352-358.
DING L,QI B K,JIANG N,et al.Structural properties of soybean protein isolate-chitosan complex treated by ultrasonic[J].Transactions of the Chinese Society for Agricultural,2017,48(9):352-358.
[18] LECKBAND D.Measuring the forces that control protein interactions[J].Annual Review of Biophysics and Biomolecular Structure,2000,29:1-26.
[19] 薛瑾. 茶多酚—蛋白纳米复合物的研究[D].无锡:江南大学,2014.
XUE J.Study on tea polyphenol-protein nano-complexes[D].Wuxi:Jiangnan University,2014.
[20] BOURASSA P,HASNI I,TAJMIR-RIAHI H A.Folic acid complexes with human and bovine serum albumins[J].Food Chemistry,2011,129(3):1 148-1 155.
[21] OVERBEEK J T G,VOORN M J.Phase separation in polyelectrolyte solutions.Theory of complex coacervation[J].Journal of Cellular and Comparative Physiology,1957,49(1):7-22.
[22] GIRARD M,TURGEON S L,GAUTHIER S F.Thermodynamic parameters of β-Lactoglobulin-pectin complexes assessed by isothermal titration calorimetry[J].Journal of Agricultural and Food Chemistry,2003,51(15):4 450-4 455.
[23] 孙亚天, 程志先,李果,等.大豆分离蛋白与壳聚糖相互作用的光谱法研究[J].核农学报,2018(4):723-731.
SUN Y T,CHENG Z X,LI G,et al.Study on the interaction between soybean protein isolate and chitosan by spectroscopic methods[J].Journal of Nuclear Agricultural Sciences,2018(4):723-731.
[24] MAI Y,EISENBERG A.Self-assembly of block copolymers[J].Chemical Society Reviews,2012,41(18):5 969-5 985.
[25] BATES F S,FREDRICKSON G H.Block copolymers-designer soft materials[J].Physics Today,1999,52:32-38.