苹果是世界四大水果之一,在全球的种植面积约500万hm2,规模稳居世界首位,我国苹果果汁作为苹果加工制品的主导部分,年生产总量约占世界的60%,是支持进出口贸易及地域性经济发展的重要产业之一[1]。在苹果果汁加工中产生大量果渣副产物,其含有丰富的碳水化合物、果胶、多酚、粗纤维等营养物质,其中苹果多酚主要包括绿原酸、根皮苷、表儿茶素及其低聚体和槲皮酮糖苷等,表现出良好的抗氧化、抗衰老和抗癌等生理功能[2]。但是由于多酚类物质常通过糖苷键形式与碳水化合物结合,以及皮渣细胞壁结构的阻隔作用,使得多酚的提取和利用受到一定限制,造成多酚资源浪费。因此,采取适当的破壁预处理方法从苹果皮渣中充分提取和利用多酚类物质是充分发挥苹果营养保健作用、提高其附加值的有效途径。目前,有研究利用微波、超声波或超高压技术来辅助提取苹果多酚,如高义霞等[3]利用果胶酶结合微波法提取苹果多酚,在最优工艺条件下(果胶酶用量1.7 mg在50 ℃酶解2 h,微波功率380 W提取2 min,重复提取2次)多酚得率为(12.26±0.213)mg/g;贺金娜[4]利用超声辅助乙醇提取苹果多酚,在最优处理条件下多酚的提取率为11.5 mg/g。虽然以上方法可以在一定程度提高苹果皮渣多酚的提取效率,但破壁作用有限,且已有研究表明,当微波处理10 min后会导致部分热敏性多酚的降解和多酚抗氧化活性的降低[5],此外,也可能导致多酚降解产物复杂难以分离鉴定,从而低估其功能活性及价值。蒸汽爆破技术是近年来新兴的一种绿色预处理技术,能在短时间(3~5 min)的高温(160~260 ℃)高压(0.69~4.83 MPa)条件下利用蒸汽充分渗透润胀物料,并通过瞬间释压将物料破碎,以促进生物活性成分的释放溶出[6],具有操作简便,高效环保,对热敏性营养成分的保留率高的优点[7]。SECMELER等[8]在200 ℃下蒸汽爆破处理橄榄果渣5 min,所得的总酚含量比未处理样品增加了12%。LIU等[9]在215 ℃蒸汽爆破处理麦麸120 s,提取所得的多酚含量为处理前的39倍;LI等[10]的研究也证实蒸汽爆破处理对苦荞麸皮酚类物质的溶出及体外细胞抗氧化活性具有明显的促进作用,显著提高了其结合没食子酸,原儿茶素及咖啡酸的含量。苹果皮渣作为一种潜在的多酚资源原料,已得到广泛的提取及利用,而许多研究已经证实蒸汽爆破是一种高效预处理纤维原料[11],促进多酚释放及改善抗氧化能力的潜在新方法,但目前蒸汽爆破处理苹果皮渣鲜见报道,也缺乏蒸汽爆破处理对多酚组分及抗氧化活性具体影响的研究。利用蒸汽爆破处理苹果皮渣,探究不同爆破条件对苹果皮渣中多酚类物质的含量、组成的影响,以及爆破处理后的苹果皮渣在消化前后的抗氧化活性、表面结构的变化。以期为苹果皮渣多酚的综合开发利用提供参考。
1 材料与方法
1.1 材料与试剂
苹果皮渣,四川省凉山州盐源县美青源食品有限公司,为去皮整苹果的加工副产物。没食子酸标准品、福林酚、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH) 、2,2’-联氨双(3-乙基苯并噻唑啉-6-磺酸)[2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS]、绿原酸、金丝桃苷、异槲皮苷、鞣花酸、根皮苷、槲皮苷、槲皮素,色谱纯,美国sigma公司;2,3,5-三苯基氯化四氮唑(2,3,5-triphenyltetrazolium chloride,TPTZ),分析纯,梯希爱(上海)化成工业发展有限公司;乙腈、甲酸、磷酸、甲醇,色谱纯,重庆市钛新化工有限公司;丙酮、浓盐酸、氢氧化钠、乙酸乙酯等其他试剂均为分析纯,成都科龙化工试剂有限公司。
1.2 仪器与设备
QBS-8GB汽爆工艺试验台,鹤壁正道生物能源有限公司;UltraScan PRO测色仪,美国HunterLab公司;Phenom Pro扫描电子显微镜,荷兰Phenom World公司;L6紫外/可见分光光度计,上海仪电分析仪器有限公司;LC-20A高效液相色谱,岛津企业管理(中国)有限公司;TGL-16G离心机,上海安亭科学仪器厂。
1.3 试验方法
1.3.1 蒸汽爆破处理苹果皮渣
将苹果皮渣粉碎过60目筛,收集样品(含水量约5%)。将样品进行蒸汽爆破处理,每次爆破样品进样量不超过400 g,设备经点火操作后,待压力分别升至1.0、1.5和2.0 MPa后,接通蒸汽加热60 s,收集样品,60 ℃烘干过60目筛,置于干燥器保存备用,未经爆破处理的样品为对照组。
1.3.2 苹果皮渣多酚提取及测定
游离态多酚提取参考文献[11]:1.00 g样品加入50 mL 80%冷冻丙酮水溶液,避光剧烈搅拌提取10 min,3 558×g离心10 min,收集上清液,残渣再重复提取1次,合并上清液,45 ℃旋转蒸发至干,用甲醇定容于25 mL棕色容量瓶,保存在-20 ℃下备用。
结合态多酚提取参考文献[12]:上述提取游离态多酚后的残渣加入20 mL 2 mol/L NaOH溶液,并转移至50 mL离心管中,室温下磁力搅拌1 h,取出后放入冰水浴中,浓盐酸调整混合物pH至7,接着加入20 mL正己烷剧烈振荡5 min,去除脂肪,3 558×g离心10 min,去掉上清液。向残渣中加入20 mL乙酸乙酯提取,振荡10 min,离心,收集上清液,之后操作如上,45 ℃旋转蒸发至干,用甲醇定容于5 mL棕色容量瓶,保存在-20 ℃下备用。
游离酚和结合酚的测定采用福林酚比色法[13],以没食子酸为标准物质,得到线性回归方程:y =0.006 2x+0.017 6,R2=0.996 3,没食子酸浓度的线性范围是0~100 μg/mL。
1.3.3 游离态多酚定量和定性测定
采用HPLC对苹果皮渣的游离态多酚进行定性定量分析[10]。色谱柱:Thermo BDS-C18反相色谱柱(250 mm×4.6 mm×5 μm),柱温40 ℃,进样量5 μL,检测波长320、280 nm;流动相:A相:甲醇,B相:0.1%磷酸,流速0.4 mL/min。梯度洗脱方法:0 min,A相85%,B相15%;30 min,A相40%,B相60%;35 min,A相20%,B相80%;40 min,A相10%,B相90%;50 min,A相85%,B相15%;60 min,A相85%,B相15%。
1.3.4 苹果皮渣粉末及体外模拟消化液抗氧化活性测定
模拟肠胃液的配制及样品的消化参照![]() 等[14]的方法,取1.00 g样品加15 mL模拟唾液,均质1 min后在37 ℃振荡10 min,5 mol/L HCl溶液调pH至1.2(胃液pH),然后加入15 mL模拟胃液,在37 ℃振荡120 min后用0.1 mol/L NaHCO3溶液调pH至6(肠液pH),再加入15 mL模拟肠液,1 mol/L NaOH溶液调整pH为7,37 ℃避光搅拌反应120 min,4 393×g离心10 min,收集上清液得到消化液。皮渣粉末和消化液抗氧化活性的测定采用DPPH阳离子自由基清除活性[15]和ABTS阳离子自由基清除活性[16]测定方法。
等[14]的方法,取1.00 g样品加15 mL模拟唾液,均质1 min后在37 ℃振荡10 min,5 mol/L HCl溶液调pH至1.2(胃液pH),然后加入15 mL模拟胃液,在37 ℃振荡120 min后用0.1 mol/L NaHCO3溶液调pH至6(肠液pH),再加入15 mL模拟肠液,1 mol/L NaOH溶液调整pH为7,37 ℃避光搅拌反应120 min,4 393×g离心10 min,收集上清液得到消化液。皮渣粉末和消化液抗氧化活性的测定采用DPPH阳离子自由基清除活性[15]和ABTS阳离子自由基清除活性[16]测定方法。
1.3.5 苹果皮渣表面结构特征表征
1.3.5.1 色差测定
利用测色仪对苹果皮渣蒸汽爆破前后颜色进行测定,亮度为L*、红度为a*、黄度为b*。
ΔE=[(ΔL*)2+(Δa*)2+(Δb*)2]1/2
式中:ΔL*=L-L0,Δa*=a-a0,Δb*=b-b0,L0、a0、b0分别是原样的亮度、红度和黄度,L、a、b是处理后样品的亮度、红度和黄度。
1.3.5.2 微观结构表征
利用扫描电镜(scanning electron microscope,SEM)对皮渣微观结构进行表征,导电胶将少量提前干燥好的苹果皮渣粉末固定在样品座上,再将样品座置于离子溅射仪中镀铂金膜约30 s后,利用SEM在10 kV的加速电压条件下放大3 000倍观察样品的形态特征并拍照。
1.4 数据处理
实验结果以平均值±标准误差(means±SE)表示,并采用Excel软件和SPSS 19.0软件进行分析,显著性分析采用单因素方差分析的Duncan’s检验,P<0.05判定为具有显著差异。
2 结果与分析
2.1 蒸汽爆破前后苹果皮渣多酚含量变化
蒸汽爆破处理前后苹果皮渣的多酚含量如表1所示,蒸汽爆破处理后游离态多酚和总酚含量均有所提高,在1.5和2.0 MPa条件下,游离态多酚含量分别较原样显著提高了15.11%和19.85%,总酚含量分别较原样显著提高了16.28%和18.51%,这与LI等[10]蒸汽爆破处理苦荞麸皮的研究结果一致,其中,含量的增加可能与物料结构和化学成分的变化有关。许多研究表明蒸汽爆破处理可以有效破坏植物细胞壁结构,增大组织孔隙与比表面积,有助于改善多酚提取过程中溶质的传质速率,从而提高多酚的溶出率和提取率[6]。
表1 蒸汽爆破处理60 s对苹果皮渣的多酚含量的影响 单位:mg/100 g
Table 1 Effect of steam explosion on polyphenol
contents in apple pomace

成分原样1.0 MPa1.5 MPa2.0 MPa游离态多酚675.25±18.23a688.25±15.56a792.22±30.08b809.31±28.84b结合态多酚14.96±0.034c14.26±0.68c12.90±0.55b11.56±0.60a总酚684.21±17.70a696.05±15.78a795.62±29.59b810.84±28.26b
注:a~d同行数据带有不同小写字母表示有显著性差异(P<0.05)(下同)
此外,蒸汽爆破处理过程中高温水蒸汽也可以占据与纤维素结合的多酚羟基位点,有利于多酚的溶出[9]。而蒸汽爆破处理后结合态多酚含量有所降低,在1.5和2.0 MPa条件下分别较原样显著降低了13.77%和22.73%,这可能是由于高强度蒸汽爆破的热作用使生物质降解形成了有机酸,导致部分与之结合的结合酚类物质发生降解或聚合反应[17]。蒸汽爆破处理后皮渣中结合态多酚含量的减少还可能导致物料的颜色加深,从侧面反映了蒸汽爆破的热作用可能消耗了部分多酚[18]。
2.2 蒸汽爆破对苹果皮渣游离态多酚组分及含量的影响
通过HPLC对苹果皮渣样品的游离态多酚进行定性定量分析,共鉴定出9种主要物质(图1),蒸汽爆破预处理前后苹果皮渣游离态多酚种类未发生改变,主要是黄酮和酚酸类,包括绿原酸、金丝桃苷、异槲皮苷、鞣花酸、根皮苷、槲皮苷、槲皮素、槲皮素-3-D-木糖苷和槲皮素-3-O-α-L-阿拉伯糖苷,这与![]() 等[19]对苹果皮的多酚提取物的定性分析结果类似。
等[19]对苹果皮的多酚提取物的定性分析结果类似。
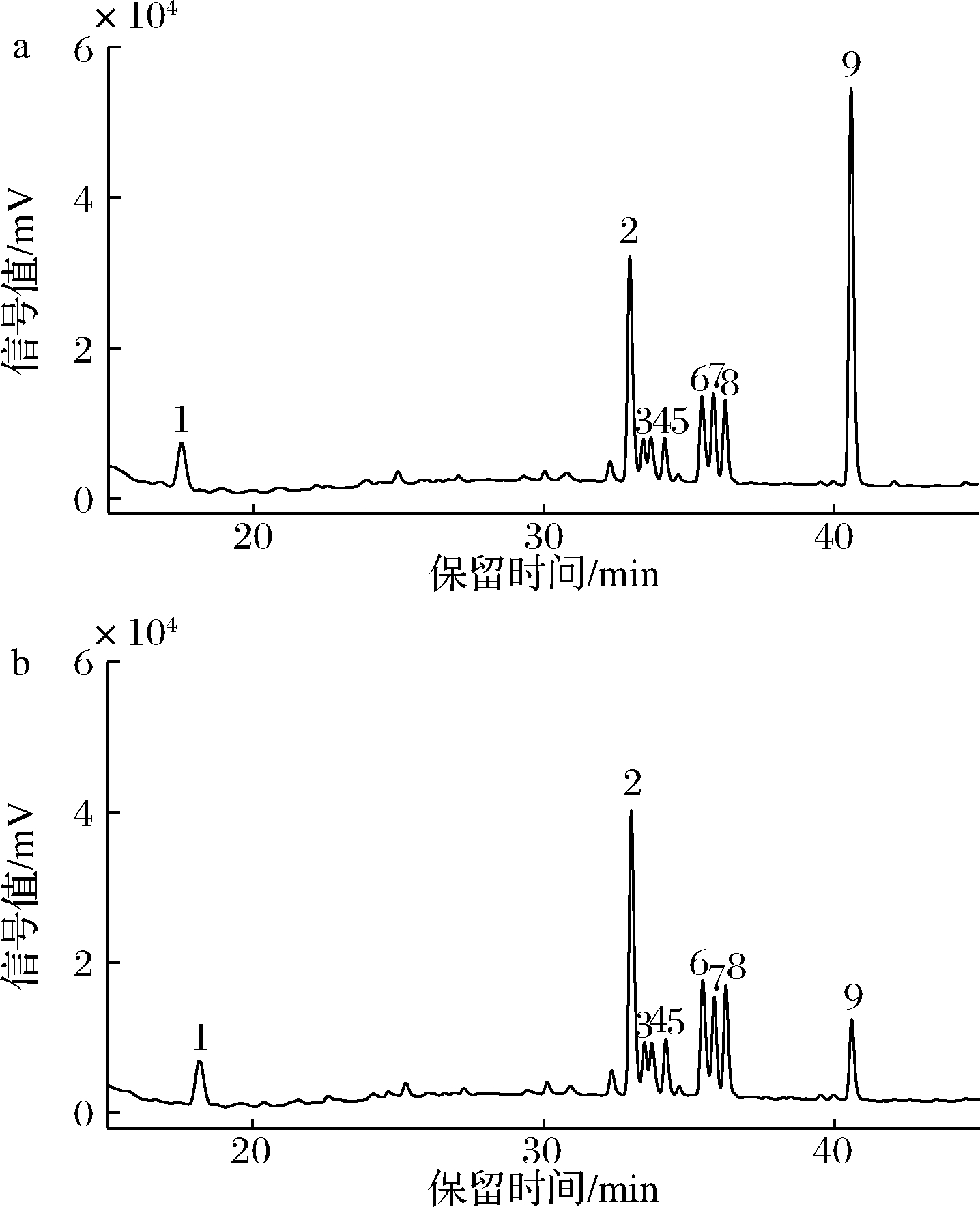
a-标品图;b-苹果皮渣游离态多酚HPLC图
图1 苹果皮渣游离态多酚的HPLC图谱
Fig.1 HPLC profile of free polyphenols in apple pomace
注:1-绿原酸;2-金丝桃苷;3-异槲皮苷;4-鞣花酸;5-槲皮素-3-D-木糖苷;
6-槲皮素-3-O-α-L-阿拉伯糖苷;7-根皮苷;8-槲皮苷;9-槲皮素
采用外标法利用多酚标品校准曲线对苹果皮渣游离态多酚进行定量分析,结果如表2所示,蒸汽爆破前后皮渣游离态多酚含量均以金丝桃苷为最高(41.29~45.01 mg/100 g),其次是槲皮素-3-O-α-L-阿拉伯糖苷(29.01~32.30 mg/100 g)、根皮苷(26.09~26.80 mg/100 g)及绿原酸(17.11~26.54 mg/100 g),表明苹果皮渣游离态多酚主要以糖苷类多酚为主,酚酸类占比较小。
与未蒸汽爆破处理相比,在1.0和1.5 MPa蒸汽爆破条件下的苹果皮渣游离态多酚含量及单体多酚含量均无显著性变化,但在2.0 MPa蒸汽爆破条件下,游离态多酚含量从185.28 mg/100 g增加到216.07 mg/100 g,显著提高了16.62%,此外单体多酚中绿原酸、异槲皮苷、鞣花酸、槲皮素-3-D-木糖苷、槲皮素-3-O-α-L-阿拉伯糖苷、根皮苷及槲皮素的含量均显著升高。蒸汽爆破处理可以增加游离态多酚及部分单体酚含量,这在许多麸皮纤维原料中得到证实,但由于不同原料的组成及结构差异,其单体多酚变化情况也有所不同。GONG等[20]研究发现,蒸汽爆破处理可以导致青稞麸皮纤维素及半纤维素的葡萄糖苷键水解,有利于结合态酚酸转变和释放,尤其是游离态阿魏酸和对香豆酸含量显著增加。CHENG等[21]蒸汽爆破处理红豆发现游离酚中原儿茶素、儿茶素、表儿茶素、香豆酸含量升高,而结合酚中儿茶素和对香豆酸含量显著降低,推测结合态的儿茶素和对香豆酸在蒸汽爆破作用下转变为游离态溶出。此外,通过福林酚法所测得游离态多酚含量明显高于通过HPLC所测单体多酚总和,可能是由于某些单体多酚含量太低,HPLC未检测到,还有可能是由于复合酚的形成,如可溶性木质素化合物[22-23],从而导致测定所得的总酚含量明显高于单个多酚的总和。
表2 苹果皮渣游离态多酚的组成及含量 单位:mg/100 g
Table 2 Qualitative and quantitative of free polyphenols of apple pomace
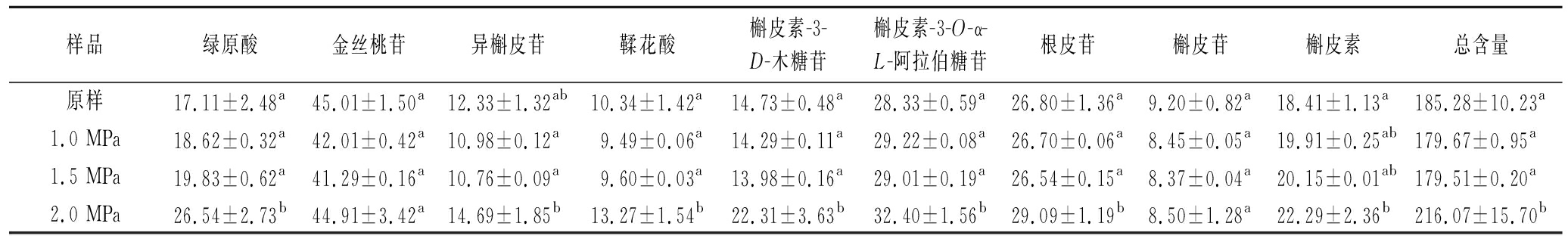
样品绿原酸金丝桃苷异槲皮苷鞣花酸槲皮素-3-D-木糖苷槲皮素-3-O-α-L-阿拉伯糖苷根皮苷槲皮苷槲皮素总含量原样17.11±2.48a45.01±1.50a12.33±1.32ab10.34±1.42a14.73±0.48a28.33±0.59a26.80±1.36a9.20±0.82a18.41±1.13a185.28±10.23a1.0 MPa18.62±0.32a42.01±0.42a10.98±0.12a9.49±0.06a14.29±0.11a29.22±0.08a26.70±0.06a8.45±0.05a19.91±0.25ab179.67±0.95a1.5 MPa19.83±0.62a41.29±0.16a10.76±0.09a9.60±0.03a13.98±0.16a29.01±0.19a26.54±0.15a8.37±0.04a20.15±0.01ab179.51±0.20a2.0 MPa26.54±2.73b44.91±3.42a14.69±1.85b13.27±1.54b22.31±3.63b32.40±1.56b29.09±1.19b8.50±1.28a22.29±2.36b216.07±15.70b
注:同列带有不同上标小写字母表示显著性差异(P<0.05)(下同)
2.3 蒸汽爆破对苹果皮渣粉末及体外消化液抗氧化活性的影响
研究表明,食物经过胃肠道消化过程可以改变活性成分的释放及抗氧化能力的大小[24],因此对蒸汽爆破前后皮渣粉末及体外模拟消化液的抗氧化活性进行测定,结果如图2所示。由DPPH自由基清除能力结果(图2-a)可知,与原样相比,蒸汽爆破预处理60 s后,样品粉末在1.0 MPa条件下的DPPH自由基清除能力显著增加了44.19%[3 551.62~5 121.20 μmol TE/(100 g DW)],其余2组无显著性差异。样品经过体外消化后,仅2.0 MPa蒸汽爆破条件下的消化液DPPH自由基清除能力显著增加20.43%[871.33~1 095.09 μmol TE/(100 g DW)],其他条件下没有显著性差异。由ABTS阳离子自由基清除能力结果(图2-b)可知,与原样相比,2.0 MPa蒸汽爆破条件下的苹果皮渣粉末的ABTS阳离子自由基清除能力显著增加了40.42%[17 148.22~24 079.72 μmol TE/(100 g DW)],推测蒸汽爆破对皮渣结构的破坏可能促进了消化过程中多酚的释放。唐宇等[25]研究表明,蒸汽爆破处理的苦荞麸皮在体外模拟消化过程中多酚释放量显著高于未蒸汽爆破处理的麸皮,且体外抗氧化能力和细胞抗氧化活性均得到明显改善。蒸汽爆破前后样品的体外消化液的ABTS阳离子自由基清除能力没有显著性变化。

a-DPPH自由基清除能力;b-ABTS阳离子自由基清除能力
图2 苹果皮渣粉末及消化液的体外抗氧化能力
Fig.2 Antioxidant activity in vitro of apple pomace
powder and supernatant
注:同样柱子带有不同上标小写字母表示有
显著性差异(P<0.05)(下同)
总的来说,苹果皮渣粉末的抗氧化能力高于上清液的抗氧化能力,多酚在体外消化过程中类黄酮含量及根皮苷易发生降解(主要发生肠消化阶段),槲皮素和金丝桃苷中的糖苷键在酸性或酶反应中也容易发生断裂,此外,在小肠碱性条件下,一些多酚的糖苷配体骨架也可能被降解成不同的结构和化学形式[26],故而消化液抗氧化能力低于样品粉末。BOUAYED等[27]研究了4种苹果样品经过模拟胃肠道消化后消化液的FRAP和ABTS抗氧化能力显著降低,与本研究结果一致。
2.4 蒸汽爆破对苹果皮渣显微结构特征的影响
颜色改变是蒸汽爆破的特征变化之一,爆破前后样品色差结果如表3所示。与原样相比,随着蒸汽爆破处理压力的增加,亮度L*值显著降低,分别较原样减少了4.05%,8.38%和11.02%;红度a*值仅在压力2.0 MPa处理后减少了8.06%,其余条件下没有显著性差异;黄度b*值显著降低,分别较原样降低了13.98%,23.29%和33.12%;色差ΔE分别为7.14、30.71、40.11,表明色差随着蒸汽爆破处理压力的增加而增加,由蒸汽爆破前后样品照片(图3)也可以明显看出颜色由淡黄变为棕褐色,颜色加深,这可能是由于苹果皮渣本身含糖量高,在此过程中发生美拉德反应导致色变[6],此外,多酚类物质自氧化、苯酚氧化和酚聚合会形成棕色成分,可以加深物料的颜色[28]。
表3 蒸汽爆破处理60 s后苹果皮渣的颜色特性
Table 3 Color properties of apple pomace after SE treatment

测定参数原样1.0 MPa1.5 MPa2.0 MPaL∗55.61±0.47d52.80±0.78c50.95±1.48b49.48±0.59aa∗10.17±0.19b10.15±0.40b9.93±0.35b9.35±0.27ab∗18.81±0.15d16.18±0.66c14.43±1.48b12.58±0.48aΔE-7.14±0.85a30.71±4.03b40.11±4.11c
苹果皮渣SEM结果(图3)所示,蒸汽爆破前苹果皮渣结构呈层状,无褶皱无孔状结构。蒸汽爆破处理后,在1.0 MPa压力出现明显的褶皱,规则的层状结构被破坏。在1.5和2.0 MPa不仅有褶皱,而且出现了孔隙结构,并且2.0 MPa的孔隙结构及孔隙大小均明显多于1.5 MPa,表明蒸汽爆破处理使得物料表面结构发生改变。许多研究证实蒸汽爆破过程的瞬时破壁作用是促进活性成分释放的重要因素,多孔结构的增加有助于改善提取过程中溶剂的可及性及溶质的传质途径,提高有效成分的提取率[29],在本研究中,也明显发现了苹果皮渣汽爆处理后表皮结构的破裂及多孔结构的增加,这与LORENZO-HERNANDO等[30]蒸汽爆破处理纤维素的研究结果类似,推测皮渣结构的变化促进了游离态多酚的溶出。

a-原样;b-1.0 MPa;c-1.5 MPa;d-2.0 MPa
图3 蒸汽爆破处理前后苹果皮渣的照片(a1~d1)及SEM图(a2~d2)
Fig.3 The photo and SEM pictures of apple peel residue before and after SE treatment
3 结论
蒸汽爆破预处理后苹果皮渣结合态多酚含量降低,而游离态多酚含量显著提高(1.5 MPa,60 s和2.0 MPa,60 s),对游离态多酚进行定性定量分析发现,蒸汽爆破预处理后游离态多酚种类没有发生改变,主要是酚酸类和黄酮类,分别有绿原酸、金丝桃苷、异槲皮苷、鞣花酸、根皮苷、槲皮苷、槲皮素、槲皮素-3-D-木糖苷、槲皮素-3-O-α-L-阿拉伯糖苷(主要是糖苷类),蒸汽爆破预处理后(2.0 MPa,60 s),除了金丝桃苷和槲皮苷外,其余多酚单体含量均显著增加;此外,蒸汽爆破预处理后苹果皮渣的DPPH和ABTS阳离子自由基的清除能力分别在1.0和2.0 MPa时表现出较高的活性,模拟体外消化后上清液的DPPH自由基清除能力在2.0 MPa时表现出较高的活性,而其ABTS阳离子自由基的清除能力不随爆破压力的增加而发生变化。色差分析表明,蒸汽爆破预处理后苹果皮渣颜色加深,SEM表明蒸汽爆破预处理破坏了苹果皮渣的微观结构,增大了比表面积及孔隙率。综上所述,蒸汽爆破对苹果皮渣多酚释放及抗氧化活性改善具有较好的效果,为促进苹果皮渣综合利用提供一定参考。
[1] 李珍.苹果皮渣多酚提取、纯化及抗氧化活性研究[D].北京:中国农业科学院,2014.
LI Z.Research on extraction,purification and antioxidant effects of polyphenols in apple pomance[D].Beijing:Chinese Academy of Agricultural Sciences,2014.
[2] WANG F,LI J H,LI L X,et al.Protective effect of apple polyphenols on chronic ethanol exposure-induced neural injury in rats[J].Chemico-Biological Interactions,2020,326:109113.
[3] 高义霞,陶超楠,周向军,等.微波辅助提取花牛苹果幼果多酚的工艺优化[J].食品工业科技,2017,38(14):209-215;222.
GAO Y X,TAO C N,ZHOU X J,et al.Process optimization of microwave-assisted extraction of polyphenols from young fruits of Huaniu apple[J].Science and Technology of Food Industry,2017,38(14):209-215;222.
[4] 贺金娜.苹果多酚的制备、成分鉴定及其抗氧化性研究[D].无锡:江南大学,2014.
HE J N.Research on polyphenols from apple:Preparation,identification and antioxidant activity[D].Wuxi:Jiangnan University,2014.
[5] ZHANG M,CHEN H X,LI J L,et al.Antioxidant properties of Tartary buckwheat extracts as affected by different thermal processing methods[J].LWT-Food Science and Technology,2010,43(1):181-185.
[6] SUI W J,XIE X,LIU R,et al.Effect of wheat bran modification by steam explosion on structural characteristics and rheological properties of wheat flour dough[J].Food Hydrocolloids,2018,84:571-580.
[7] YU Z D,ZHANG B L,YU F Q,et al.A real explosion:The requirement of steam explosion pretreatment[J].Bioresource Technology,2012,121:335-341.
[8] SEÇMELER Ö,GÜÇLÜ ![]() Ö,FERN
Ö,FERN NDEZ-BOLA
NDEZ-BOLA OS J,et al.Effect of subcritical water and steam explosion pretreatments on the recovery of sterols,phenols and oil from olive pomace[J].Food Chemistry,2018,265:298-307.
OS J,et al.Effect of subcritical water and steam explosion pretreatments on the recovery of sterols,phenols and oil from olive pomace[J].Food Chemistry,2018,265:298-307.
[9] LIU L Y,ZHAO M L,LIU XX,et al.Effect of steam explosion-assisted extraction on phenolic acid profiles and antioxidant properties of wheat bran[J].Journal of the Science of Food and Agriculture,2016,96(10):3 484-3 491.
[10] LI W Z,ZHANG X L,HE X Q,et al.Effects of steam explosion pretreatment on the composition and biological activities of Tartary buckwheat bran phenolics[J].Food & Function,2020,11(5):4 648-4 658.
[11] SINGH J,SUHAG M,DHAKA A.Augmented digestion of lignocellulose by steam explosion,acid and alkaline pretreatment methods:A review[J].Carbohydrate Polymers,2015,117:624-631.
[12] NUUTILA A M,KAMMIOVIRTA K,OKSMAN-CALDENTEY K M.Comparison of methods for the hydrolysis of flavonoids and phenolic acids from onion and spinach for HPLC analysis[J].Food Chemistry,2002,76(4):519-525.
[13] LE BOURVELLEC C,BOUZERZOUR K,GINIES C,et al.Phenolic and polysaccharidic composition of applesauce is close to that of apple flesh[J].Journal of Food Composition and Analysis,2011,24(4-5):537-547.
![]() M,BARANIAK B,GAWLIK-DZIKI U.In vitro digestibility and starch content,predicted glycemic index and potential in vitro antidiabetic effect of lentil sprouts obtained by different germination techniques[J].Food Chemistry,2013,138(2-3):1 414-1 420.
M,BARANIAK B,GAWLIK-DZIKI U.In vitro digestibility and starch content,predicted glycemic index and potential in vitro antidiabetic effect of lentil sprouts obtained by different germination techniques[J].Food Chemistry,2013,138(2-3):1 414-1 420.
[15] VON GADOW A,JOUBERT E,HANSMANN C F.Comparison of the antioxidant activity ofaspalathin with that of other plant phenols of rooibos tea (Aspalathus linearis),α-tocopherol,BHT,and BHA[J].Journal of Agricultural and Food Chemistry,1997,45(3):632-638.
[16] NENADIS N,WANG L F,TSIMIDOU M,et al.Estimation of scavenging activity of phenolic compounds using the ABTS·+assay[J].Journal of Agricultural and Food Chemistry,2004,52(15):4 669-4 674.
[17] DEL PINO-GARC A R,GONZ
A R,GONZ LEZ-SANJOSÉ M L,RIVERO-PÉREZ M D,et al.The effects of heat treatment on the phenolic composition and antioxidant capacity of red wine pomace seasonings[J].Food Chemistry,2017,221:1 723-1 732.
LEZ-SANJOSÉ M L,RIVERO-PÉREZ M D,et al.The effects of heat treatment on the phenolic composition and antioxidant capacity of red wine pomace seasonings[J].Food Chemistry,2017,221:1 723-1 732.
[18] LIU C,ZHANG R T,LIU B G,et al.Effect of steam explosion treatment on phenolic acid composition of wheat bran and its antioxidant capacity[J].Transactions of the Chinese Society of Agricultural Engineering,2016,32(6):308-314.
![]() V B,KREFT S,et al.Analysis of phenolics in the peel and pulp of wild apples (Malus sylvestris (L.) Mill.)[J].Journal of Food Composition and Analysis,2018,67:1-9.
V B,KREFT S,et al.Analysis of phenolics in the peel and pulp of wild apples (Malus sylvestris (L.) Mill.)[J].Journal of Food Composition and Analysis,2018,67:1-9.
[20] GONG L X,HUANG LL,ZHANG Y.Effect of steam explosion treatment on barley bran phenolic compounds and antioxidant capacity[J].Journal of Agricultural and Food Chemistry,2012,60(29):7 177-7 184.
[21] CHENG A W,HOU C Y,SUN J Y,et al.Effect of steam explosion on phenolic compounds and antioxidant capacity in adzuki beans[J].Journal of the Science of Food and Agriculture,2020,100(12):4 495-4 503.
[22] HENDRIKS A T W M,ZEEMAN G.Pretreatments to enhance the digestibility of lignocellulosic biomass[J].Bioresource Technology,2009,100(1):10-18.
[23] RUBIO-SENENT F,LAMA-MU OZ A,RODR
OZ A,RODR GUEZ-GUTIÉRREZ G,et al.Isolation and identification of phenolic glucosides from thermally treated olive oil byproducts[J].Journal of Agricultural and Food Chemistry,2013,61(6):1 235-1 248.
GUEZ-GUTIÉRREZ G,et al.Isolation and identification of phenolic glucosides from thermally treated olive oil byproducts[J].Journal of Agricultural and Food Chemistry,2013,61(6):1 235-1 248.
[24] SENSOY I.A review on the relationship between food structure,processing,and bioavailability[J].Critical Reviews in Food Science and Nutrition,2014,54(7):902-909.
[25] 唐宇,张小利,何晓琴,等.体外模拟胃肠消化过程中蒸汽爆破处理的苦荞麸皮的抗氧化及抗增殖活性[J].食品与发酵工业,2019,45(3):103-111.
TANG Y,ZHANG X L,HE X Q,et al.Antioxidantive and anti-proliferative activities of steam exploded Tartary buckwheat bran during simulated gastrointestinal digestion in vitro[J].Food and Fermentation Industries,2019,45(3):103-111.
[26] CELEP E,CHAREHSAZ M,AKYÜZ S,et al.Effect of in vitro gastrointestinal digestion on the bioavailability of phenolic components and the antioxidant potentials of some Turkish fruit wines[J].Food Research International,2015,78:209-215.
[27] BOUAYED J,HOFFMANN L,BOHN T.Total phenolics,flavonoids,anthocyanins and antioxidant activity following simulated gastro-intestinal digestion and dialysis of apple varieties:Bioaccessibility and potential uptake[J].Food Chemistry,2011,128(1):14-21.
[28] CHEN G Z,CHENG H Z.Extraction anddeglycosylation of flavonoids from sumac fruits using steam explosion[J].Food Chemistry,2010,126(4):1 934-1 938.
[29] CHEN G Z,CHEN H Z.Extraction anddeglycosylation of flavonoids from sumac fruits using steam explosion[J].Food Chemistry,2011,126(4):1 934-1 938.
[30] LORENZO-HERNANDO A,MART N-JU
N-JU REZ J,BOLADO-RODR
REZ J,BOLADO-RODR GUEZ S.Study of steam explosion pretreatment and preservation methods of commercial cellulose[J].Carbohydrate Polymers,2018,191:234-241.
GUEZ S.Study of steam explosion pretreatment and preservation methods of commercial cellulose[J].Carbohydrate Polymers,2018,191:234-241.