新鲜果蔬加工成鲜切果蔬,能够最大限度地保留果蔬的原汁原味,具有自然、新鲜、卫生、方便等特点,深受消费者喜爱。近几年来,国内外的鲜切果蔬销售加工市场迅猛发展[1]。在鲜切果蔬加工过程中会引入非生物(如低温、物理剪切磨损、不恰当的气调比等)与生物因素胁迫,非生物因素胁迫将促使果蔬组织中的生理代谢引起改变,例如,呼吸作用增强及其途径的改变、次生代谢物累积、水分流失、乙烯合成增加等,最终导致果蔬组织的衰老[2],而生物因素胁迫则主要引起组织腐烂。此外,病原菌还能在果蔬受损时定植于其表面进行繁殖,在人类食用后引起食源性疾病,对人类健康造成威胁。这些因素使得鲜切果蔬的货架期往往较短[3-4]。
鲜切生菜是最常见的鲜切果蔬之一,富含维生素、纤维素、矿物质等多种营养物质。其在储藏期间容易发生叶片周边变黄、叶片发臭腐烂、组织软化、褐变等现象,造成感官品质下降[5]。近几年来,鲜切生菜保鲜剂的研究主要集中在物理保鲜(如低温、气调包装、臭氧、电解水等)和化学保鲜剂(如有机酸、赤霉素等),而生物保鲜剂(如天然植物提取物、可食性涂膜等)的应用研究仍然较少[6]。生物保鲜剂拥有天然、安全、无毒害等优点,既不会对果蔬造成明显的组织损伤也不存在潜在的安全隐患,应用前景十分广阔。
植物多酚是从植物体内提取出的具有生理活性的次生代谢物,能够减少心血管疾病的发病率[7],预防结肠癌[8]、肥胖症[9]、糖尿病[10]等。除此之外,从植物体内提取出的多酚复合物被证明具有一定的抗氧化[11]、抗褐变[12]、抗菌[13]等作用,据此可以作为一种天然的生物保鲜剂。罗立娜等[14]用茶多酚处理油梨果实,结果表明茶多酚能够很好地保持果实硬度与质量,同时也降低了果实中褐变相关酶,如超氧化物歧化酶(superoxide dismutase,SOD)、过氧化物酶(peroxidase,PPO)的活性,降低了果实的腐烂率。
桑叶中含有丰富的多酚、多糖、精油等生物学活性物质,具有抗糖尿病[15]、降低心血管疾病风险[16]、抗氧化[17]等作用。目前桑叶较多的用作养蚕,还未被完全充分地开发利用和加工,出现了大量桑叶资源过剩的现象,浪费了宝贵资源。与其他植物多酚类似,桑叶多酚也具有抗氧化[18]、抑菌[19]等生物学活性。冯淦熠等[20]对桑叶多酚的提取工艺进行了优化并测定了其在体外的抗氧化能力,结果表明DPPH自由基清除率随着桑叶多酚的浓度增高而增大。
目前,对于桑叶多酚或桑叶提取物的研究较多地专注于其抗氧化与抗菌活性等研究层面,但其作为生物保鲜剂应用于鲜切果蔬的报道仍然较少。因此,本研究旨在研究桑叶多酚对鲜切生菜室温储藏期间保鲜效果的影响。测定了5种桑叶多酚对常见的食源性致病菌大肠杆菌O157:H7与单增李斯特菌的最小抑菌浓度(minimal inhibit concentration,MIC),从中选择效果最好的2种桑叶多酚进行后续实验。测定了MIC(5 mg/mL)的2种桑叶多酚对鲜切生菜重量损失率、褐变度、叶绿素含量、总酚含量、菌落总数的影响,从抑菌、抗褐变的角度对其保鲜效果进行综合评价。从而对桑叶多酚作为天然鲜切果蔬生物保鲜剂的开发提供理论依据。
1 材料与方法
1.1 材料与试剂
蔬菜:生菜购自重庆市北碚区永辉超市;本研究中所用的菌株为大肠杆菌O157∶H7 NCTC12900,英国国立标准菌种收藏所;单增李斯特菌 ATCC 19115,美国典型培养物保藏中心。大肠杆菌 O157∶H7 NCTC12900菌株不能产生志贺毒素Stxl和Stx2,因此属于脱毒型菌株。胰酪胨大豆琼脂培养基(tryptose soya agar,TSA)、Luria-Bertani肉汤培养基(luria-bertani,LB)、胰蛋白胨大豆肉汤培养基(tryptone soy broth,TSB),青岛海博生物技术有限公司;福林酚,上海生工生物科技有限公司;丙酮、碳酸钠、氯化钠、无水乙醇,所有试剂均为分析纯,重庆市钛兴化工试剂厂;大孔树脂,范德(北京)生物科技有限公司。
1.2 仪器与设备
YX280A 高压灭菌锅,上海三申医疗器械有限公司;SW-CJ-FD 超净工作台,苏州安泰空气技术有限公司;Mill-Q 纯水系统,Merck Millipore;BCD-549 W 普通冰箱,青岛海尔股份有限公司;DHP—9272电热恒温培养箱,上海齐欣科学仪器有限公司;721 N型可见分光光度计,上海生工生物科技有限公司;1510型酶标仪,赛默飞世尔仪器有限公司;TCP2-B 全自动色差仪、5810R 冷冻高速离心机,Eppendorf;SQP 电子天平、PB-10 pH计,Sartorius;研钵,范德(重庆)生物科技有限公司。
1.3 实验方法
1.3.1 桑叶与鲜切生菜的制备
从西南大学桑叶园采摘嘉陵20、嘉陵40、红果、纳溪和湖桑桑叶。将新鲜的桑叶置于50 ℃的烘箱中,干燥12 h,并用粉碎机将其粉碎成粉末,最后将桑叶粉末置于-80 ℃冰箱中储存直至使用。
从重庆市北碚区永辉超市购得无物理损伤的生菜。将生菜最外层枯黄的叶片丢弃掉,然后摘除剩余叶片备用。将生菜浸泡在次氯酸钠溶液(体积分数0.02%)中3 min,然后用蒸馏水反复冲洗叶片3次,然后用剪刀将叶片剪切成2 cm×2 cm菜叶碎片。将得到的菜叶碎片浸泡于MIC的桑叶多酚溶液中5 min,然后置于生物安全柜中风干。取样品10 g置于食品自封袋中,于常温下进行贮藏。分别在0、1、2、3、4 d测定鲜切生菜的各项贮藏品质指标。
1.3.2 桑叶多酚的提取
取6 g桑叶粉末,加入体积分数70%乙醇,混合均匀后置于超声环境下提取,超声时间60 min,超声功率400 W,超声温度50 ℃,提取液经过滤,立即置于旋转蒸发仪中减压浓缩,用容量瓶定容到一定体积后得桑叶总多酚粗提液,离心20 min(4 000×g),取上清液,获得桑叶多酚粗提液[21]。将40 g预先处理好的大孔吸附树脂装入3 cm×30 cm 的层析柱中,缓缓加入先前获得的桑叶多酚粗提液,静置过夜,然后用蒸馏水冲洗柱子,洗脱一些不要的水溶性化合物,直至洗涤水澄清;用酸化的60%乙醇[pH=(4±0.1)]洗脱大孔树脂吸附的多酚类物质,直至洗脱液没有颜色,将收集的洗脱液置于旋转蒸发仪中减压浓缩,收集浓缩液,立即置于真空冷冻干燥机中干燥,最后用真空包装袋包装桑叶多酚粉末并储存于-80 ℃冰箱。
1.3.3 MIC的测定
取出在-80 ℃冰箱保存的菌种,用接种环取少量划线于TSA板上,37 ℃培养16 h后取出,于4 ℃保存备用。在超净工作台内,用接种环分别挑取1环大肠杆菌O157∶H7和单增李斯特菌单菌落接种于20 mL已灭菌的LB培养基和TSB培养基中,于摇床中孵育16 h(37 ℃,120 r/min),得到菌浓度约为109 CFU/mL大肠杆菌O157∶H7和单增李斯特菌菌悬液,再将菌液进行10倍梯度稀释到105 CFU/mL,备用。
MIC是指能够抑制细菌生长、繁殖的最低药物浓度[22]。通过二倍肉汤稀释法,将桑叶多酚提取物溶于无菌水,倍比稀释,得到样品质量浓度分别为10、5、2.5、1.25、0.625和0.312 5 mg/mL。分别加入105 CFU/mL的大肠杆菌O157∶H7和单增李斯特菌的菌悬液,37 ℃过夜培养 12 h,观察菌液生长情况,菌液透明澄清时所对应的样品浓度即为MIC。
1.3.4 重量损失率的测定
使用分析天平进行精确称量并计算,通过将生菜样品储存一定时间后的质量除以样品原始质量并乘以100%来计算重量损失率的百分比。
1.3.5 褐变度的测定
取生菜样品2 g,加入95%乙醇6 mL,研磨均匀,8 000 r/min 离心10 min,取上清液于420 nm处测定吸光度,即为样品褐变度。
1.3.6 叶绿素含量的测定
称取0.5 g生菜样品,加入2.0 mL丙酮研磨,收集研磨液后再加入2.0 mL丙酮反复冲洗研钵并收集冲洗液,汇总后再加入离心管中,8 000 r/min离心10 min。取上清液,以丙酮作为空白对照,分别在645、663 nm 测定吸光度值,按公式(1)(2)(3)计算叶绿素含量。
ρa=12.72A663-2.59A645
(1)
ρb=22.88A645-4.67A663
(2)
叶绿素含量![]()
(3)
式中:ρa,叶绿素a质量浓度,mg/L;ρb,叶绿素b质量浓度,mg/L;V,提取液总体积,mL;m,取样质量,g。
1.3.7 总酚含量的测定
取5 g生菜样品于研钵中,加入45 mL 50%乙醇,研磨,然后在4 ℃下以5 000 r/min离心10 min,取上清液。将0.5 mL上清液、1 mL福林酚试剂和2 mL质量分数10%碳酸钠溶液混合,在室温下避光静置1 h,并在760 nm处使用分光光度计测量吸光度。用没食子酸标准曲线计算总酚含量。总酚含量(没食子酸当量)单位表示为g/kg。
1.3.8 菌落总数的测定
将5 g生菜样品与45 mL 0.85%无菌生理盐水混合摇匀,然后用0.85%无菌生理盐水进行梯度稀释,分别稀释至10-1、10-2、10-3、10-4、10-5和10-6。在无菌条件下,将样品稀释液滴到营养琼脂平板上以进行菌落计数,并在37 ℃下培养24 h。
1.3.9 数据统计与分析
利用Excel 2010对试验数据进行统计与整理。采用Origin 9.0做误差图并分析结果。采用SPSS 20对数据进行单因素方差分析(One-way ANOVA),用Duncan氏法进行多重差异显著性比较。所有试验均重复3次。
2 结果与分析
2.1 不同品种桑叶多酚的MIC值
将所选菌种在试管中培养后,通过试管中菌液的澄清度来判定5种桑叶多酚的MIC,结果见表1。
表1 不同品种桑叶多酚的MIC值 单位:g/L
Table 1 MIC values of polyphenols in mulberry leaves
of different cultivars
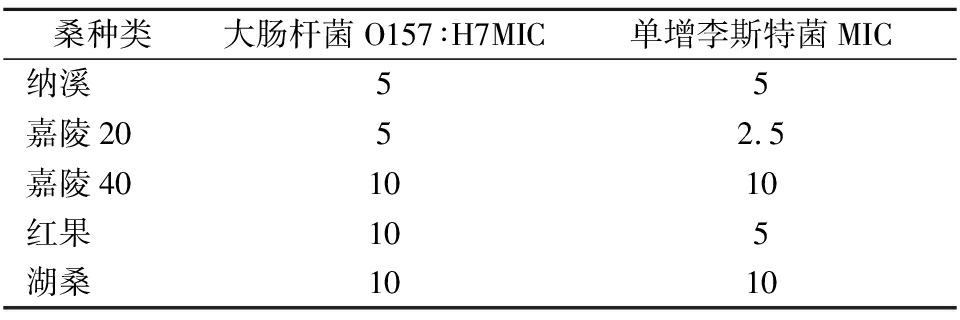
桑种类大肠杆菌O157∶H7MIC单增李斯特菌MIC纳溪55嘉陵2052.5嘉陵401010红果105湖桑1010
5种桑叶多酚对2种菌的抑制作用不同。纳溪桑叶多酚、嘉陵40桑叶多酚、湖桑桑叶多酚:大肠杆菌O157∶H7=单增李斯特菌;嘉陵20桑叶多酚、红果桑叶多酚:大肠杆菌O157∶H7<单增李斯特菌。上述结果表明,纳溪和嘉陵20 桑叶多酚相比嘉陵40、红果和湖桑对2种菌种的抑制作用更强,且嘉陵20对单增李斯特菌的MIC为2.5 g/L,抑菌效果最好。FEI等[23]研究报道橄榄叶多酚提取物对阪崎肠杆菌(Cronobacter sakazakii ATCC29544,C.sakazakii ATCCBAA-894)MIC为0.625~1.25 g/L,认为橄榄叶多酚具有较强抗菌活性是与其含有的羟基基团有关。在之前的研究中,对2个品种(人工培育品种嘉陵20、野生品种纳溪)的桑叶多酚的各类多酚单体进行了分析,结果表明不同品种的多酚单体组成不一且含量各异,嘉陵20比纳溪含有更高的抑菌活性多酚单体物质,如绿原酸、咖啡酸、香豆酸、芦丁、异槲皮素等[24]。由此推测,5种桑叶多酚对不同的病原菌具有不同的MIC值,原因是它们的多酚单体组成与含量不同。因此,该研究结果提供了一种理论上的可能性,即桑叶多酚可以作为一种天然食品杀菌剂,以减少食品中大肠杆菌O157∶H7和单增李斯特菌引起的食品安全问题以及食品加工环境中的污染。从中选出效果较好的纳溪和嘉陵20进行后续的保鲜效果测定实验。
2.2 两种桑叶多酚对鲜切生菜保鲜效果的评价
2.2.1 桑叶多酚处理对鲜切生菜重量损失率的影响
重量损失率是评价生菜外观品质的重要指标之一。新鲜生菜的含水量高达97% ~ 98%,鲜切处理后加速了它们的蒸腾作用和呼吸作用,因此在储藏过程中容易损失水分,导致菜叶失水萎蔫,质量下降。由图1可知,无菌水、纳溪和嘉陵20桑叶多酚处理的生菜质量变化的趋势基本一致,重量损失率随着贮藏时间的增加逐渐变大。贮藏期间,经过纳溪和嘉陵20桑叶多酚处理的生菜的重量损失率减少,显著低于对照组(P<0.05)。在储藏最后1 d,对照组的重量损失率增加到5.82%。这说明,桑叶多酚处理可以有效保持鲜切生菜的水分和营养成分,减少储藏期间质量损失。

图1 桑叶多酚处理对鲜切生菜重量损失率的影响
Fig.1 Effect of mulberry leaf polyphenols treatments on
weight loss rate of fresh-cut lettuce
2.2.2 桑叶多酚处理对鲜切生菜叶绿素含量的影响
叶绿素是植物进行光合作用的重要色素物质。在储藏期间,鲜切生菜的叶绿素无法进行光合作用,随着储藏时间的延长,叶绿素酶会逐渐分解叶绿素而使绿色消退,叶绿素含量逐渐下降,从而导致生菜叶子的黄化。因此叶绿素含量是维持鲜切生菜储藏品质的重要指标。如图2所示,在储藏期间各处理组生菜叶的叶绿素都有不同程度地下降,其中无菌水处理组的下降速率大于纳溪和嘉陵20桑叶多酚处理组。其中,在储藏第1天,纳溪桑叶多酚处理组和嘉陵20桑叶多酚处理组之间差异性不显著(P>0.05),第2天开始,纳溪桑叶多酚处理组和嘉陵20桑叶多酚处理组之间存在显著性差异(P<0.05),说明2种桑叶多酚都可有效地减少叶绿素的分解,且经纳溪桑叶多酚处理后效果最明显。

图2 桑叶多酚处理对鲜切生菜叶绿素含量的影响
Fig.2 Effect of mulberry leaf polyphenols treatment on
chlorophyll content of fresh-cut lettuce
2.2.3 桑叶多酚处理对鲜切生菜褐变度的影响
褐变度通常被认为是一种间接的度量指标,用来反映由褐变反应生成的可溶性色素化合物含量,从而反映果蔬褐变程度。储藏期间鲜切生菜褐变度的变化情况如图3所示,各处理鲜切生菜的褐变度随储藏时间的延长而增大,其中对照组中无菌水的褐变度急剧上升,处理组纳溪和嘉陵20桑叶多酚之间不存在显著性差异(P >0.05)。在储藏第1天,无菌水、纳溪和嘉陵20桑叶多酚处理的鲜切生菜的褐变度分别是2.75、2.69和2.69。在储藏末期,无菌水、纳溪和嘉陵20桑叶多酚处理的鲜切生菜的褐变度分别是2.81、2.78和2.79。结果表明,桑叶多酚可以附着在切口表面,在一定程度上隔绝了环境中的氧气,从而抑制了褐变的产生,因此MIC的桑叶多酚溶液可以抑制鲜切生菜切口褐变,维持鲜切生菜鲜亮的外观。同时,随着储藏时间的延长,虽然桑叶多酚处理组低于对照组,但是桑叶多酚抑制褐变的强度减弱。由于多酚类物质是褐变相关酶的底物,因此很有可能会促进鲜切生菜的褐变。MART N-DIANA等[25]研究报道0.5 g/100 mL茶多酚有效地防止抗坏血酸和类胡萝卜素的流失,过量的茶多酚(1 g/100 mL)促进了生菜的褐变。
N-DIANA等[25]研究报道0.5 g/100 mL茶多酚有效地防止抗坏血酸和类胡萝卜素的流失,过量的茶多酚(1 g/100 mL)促进了生菜的褐变。

图3 桑叶多酚处理对鲜切生菜褐变度的影响
Fig.3 Effect of mulberry leaf phenols treatment on
browning degree of fresh-cut lettuce
2.2.4 桑叶多酚处理对鲜切生菜总酚含量的影响
由苯丙烷途径合成的酚类化合物可以被PPO氧化成醌类,醌类会自发聚合成褐色色素,导致组织褐变。如图4所示,不同桑叶多酚处理后,总酚含量在储藏4 d内呈先增加后下降的趋势,在第2天达到峰值。纳溪和嘉陵20桑叶多酚处理的鲜切生菜的总酚含量在储藏过程中增加的量低于对照组。这些结果表明,桑叶多酚处理可以减少总酚类物质的积累,从而延缓褐变。纳溪和嘉陵20桑叶多酚抑制褐变的原因是由于它能抑制活性氧的形成和各种氧化酶的活性。这可能是由于外源酚物质处理抑制了生菜中束缚态酚物质的释放。
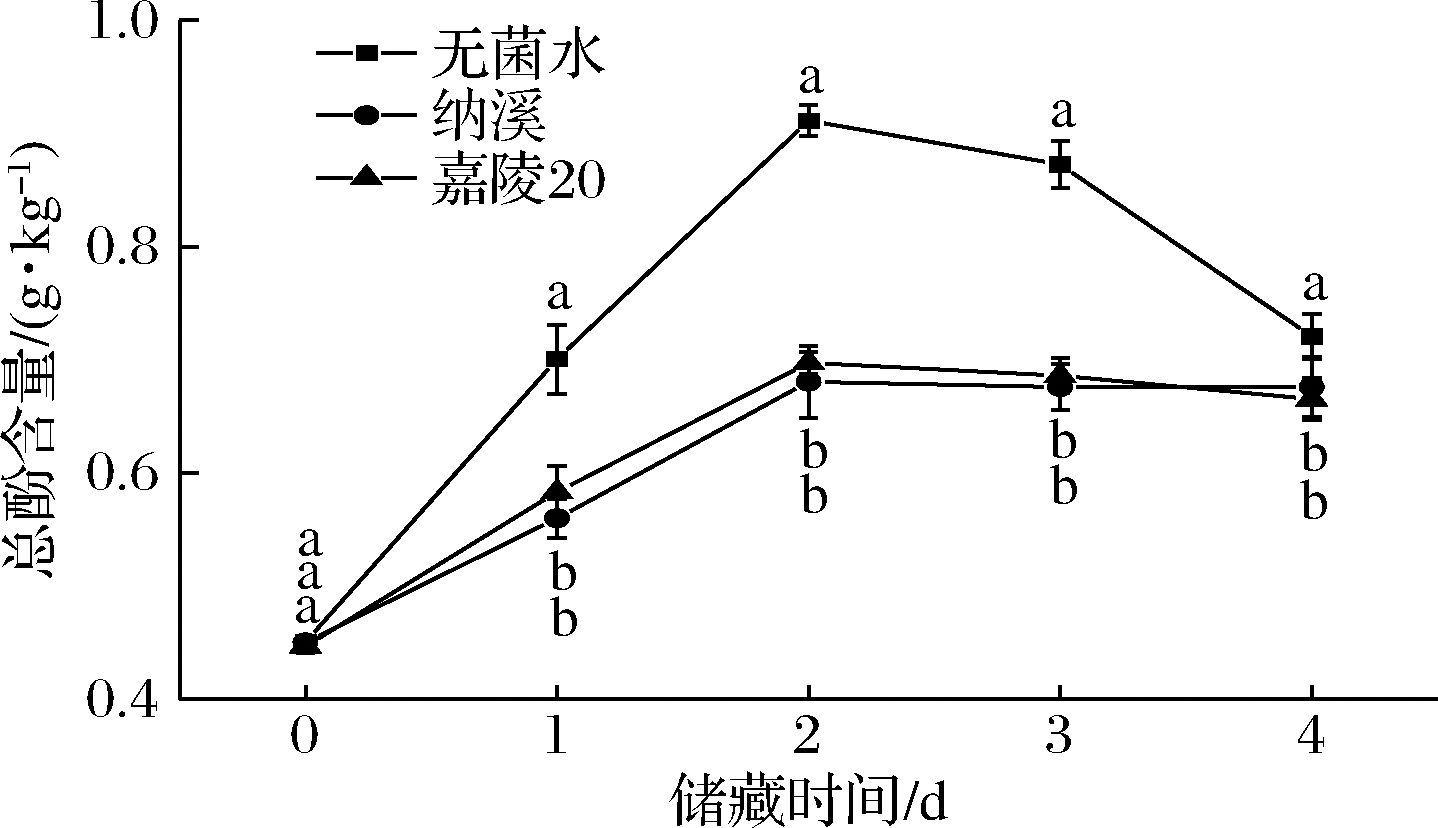
图4 桑叶多酚处理对鲜切生菜总酚含量的影响
Fig.4 Effect of mulberry leaf polyphenols treatment on total
phenols content of fresh-cut lettuce
2.2.5 桑叶多酚处理对鲜切生菜菌落总数的影响
菌落总数是用来判定食品被微生物污染的程度及卫生质量,菌落总数在一定程度上标志着食品卫生质量的优劣。在室温(25 ℃)条件下,纳溪和嘉陵20桑叶多酚均对鲜切生菜有一定的抑菌保鲜效果。如图5所示,从菌落总数变化情况来看,经桑叶多酚处理的鲜切生菜的总细菌数显著低于对照组(P<0.05),储藏第2天,只有无菌水处理的鲜切生菜的菌落数为4.98 lg CFU/g,高于4 lg CFU/g。纳溪和嘉陵20桑叶多酚处理的鲜切生菜菌落数均低于4 lg CFU/g,分别是3.86和3.11 lg CFU/g。在储藏第4天,经过无菌水、纳溪和嘉陵20桑叶多酚处理的鲜切生菜的菌落总数分别增加到6.83、5.74和5.27 lg CFU/g。这些结果表明,2种桑叶多酚都可有效抑制鲜切生菜上细菌的生长,而且嘉陵20桑叶多酚的抗菌活性显著高于纳溪桑叶多酚(P<0.05)。这可能是由于酚类物质可以抑制蛋白质合成,与磷脂分子相互作用来改变细胞膜的结构,增强通透性,使细菌细胞遭受不可逆损伤,造成细胞死亡[26]。嘉陵20桑叶多酚的抗菌活性较好,桑叶多酚中不同含量的单体具有不同的抗菌活性,这可以解释纳溪和嘉陵20桑叶多酚之间的抗菌活性差异。

图5 桑叶多酚处理对鲜切生菜菌落总数的影响
Fig.5 Effect of mulberry leaf polyphenols treatment on
bacterial counts of fresh-cut lettuce
因此,在后续研究中可以利用嘉陵20桑叶多酚良好的抗菌性将其作为天然抗菌剂应用于食品安全不同领域的研究。
3 结论
5个品种提取的桑叶多酚均对大肠杆菌O157∶H7与单增李斯特菌具有抑菌效果,其中纳溪、嘉陵20效果最好,纳溪对大肠杆菌O157∶H7与单增李斯特菌的MIC均为5 mg/mL,嘉陵20分别为5、2.5 mg/mL。在保鲜效果测定实验中,相比于对照组,鲜切生菜经过MIC(5 mg/mL)的纳溪、嘉陵20处理后,均显著延缓了品质劣变。2种桑叶多酚均能够有效维持水分、保留营养成分、抑制叶绿素的降解、延缓褐变、抑制总酚的合成、降低菌落总数。其中,纳溪的保鲜能力更好,而嘉陵20抗菌性能更好。因此,桑叶多酚有望成为一种新型的天然生物保鲜剂。
[1] 胡叶静,李保国,张敏,等.鲜切果蔬保鲜技术及方法研究进展[J].食品与发酵工业,2020,46(22):276-281.
HU Y J,LI B G,ZHANG M,et al.Progresses on fresh-keeping techniques and methods of fresh-cut fruits and vegetables[J].Food and Fermentation Industries,2020,46(22):276-281.
[2] HODGES D M,TOIVONEN P M A.Quality of fresh-cut fruits and vegetables as affected by exposure to abiotic stress[J].Postharvest Biology and Technology,2008,48(2):155-162.
[3] 刘伟,王洪江,孟令伟.保鲜技术在果蔬仓储过程中的应用研究进展[J].包装工程,2017,38(17):58-63.
LIU W,WANG H J,MENG L W.Research progress of fresh-keeping technology in fruits and vegetables storage[J].Packaging Engineering,2017,38(17):58-63.
[4] 田密霞,胡文忠,王艳颖,等.鲜切果蔬的生理生化变化及其保鲜技术的研究进展[J].食品与发酵工业,2009,35(5):132-135.
TIAN M X,HU W Z,WANG Y Y,et al.The research process of physiological and biochemical changes and preservation methods of fresh-cut fruits and vegetables[J].Food and Fermentation Industries,2009,35(5):132-135.
[5] TUDELA J A,GIL M I.Leafy Vegetables:Fresh-Cut Lettuce[M].Elsevier:Academic Press,2020:545-550.
[6] 杨晓哲,胡文忠,姜爱丽,等.鲜切莴苣生理生化变化及其保鲜技术的研究进展[J].食品与发酵工业,2018,44(2):278-283.
YANG X Z,HU W Z,JIANG A L,et al.Progress in physiological and biochemical change and fresh-keeping technique of fresh-cut lettuce[J].Food and Fermentation Industries,2018,44(2):278-283.
[7] MCSWEENEY M,SEETHARAMAN K.State of polyphenols in the drying process of fruits and vegetables[J].Critical Reviews in Food Science and Nutrition,2015,55(5):660-669.
[8] ZHOU Y,ZHENG J,LI Y,et al.Natural polyphenols for prevention and treatment of cancer[J].Nutrients,2016,8(8):515.
[9] PENG C H,CHENG J J,YU M H,et al.Solanum nigrum polyphenols reduce body weight and body fat by affecting adipocyte and lipid metabolism[J].Food & Function,2020,11(1):483-492.
[10] CAO H,OU J Y,CHEN LEI,et al.Dietary polyphenols and type 2 diabetes:Human study and clinical trial[J].Critical Reviews in Food Science and Nutrition,2019,59(20):3 371-3 379.
[11] YÜCETEPE A,ALTIN G,ÖZÇELIK B.A novel antioxidant source:Evaluation of in vitro bioaccessibility,antioxidant activity and polyphenol profile of phenolic extract from black radish peel wastes(Raphanus sativus L.var.Niger) during simulated gastrointestinal digestion[J].International Journal of Food Science & Technology,2021,56(3):1 376-1 384.
[12] ALI W,AL-ABBASY O,YOUNIS S.Vanillic acid:An antioxidant used in preventing browning process in pear(Pyrus communis L.) juice[J].Annals of the Romanian Society for Cell Biology,2021,25(3):5 272-5 285.
[13] EFENBERGER-SZMECHTYK M,NOWAK A,CZYZOWSKA A.Plant extracts rich in polyphenols:Antibacterial agents and natural preservatives for meat and meat products[J].Critical Reviews in Food Science and Nutrition,2021,61(1):149-178.
[14] 罗立娜,韩树全,范建新,等.茶多酚对油梨果实保鲜效果的评价[J].食品工业科技,2021,42(2):284-289.
LUO L N,HAN S Q,FAN J X,et al.Evaluation of the preservation effect of tea polyphenol treatment on avocado fruit[J].Science and Technology of Food Industry,2021,42(2):284-289.
[15] GE Q,CHEN L,TANG M,et al.Analysis of mulberry leaf components in the treatment of diabetes using network pharmacology[J].European Journal of Pharmacology,2018,833:50-62.
[16] 曹宇,许璐,李凯峰,等.桑叶提取物对糖尿病小鼠心肌保护作用的研究[J].心脏杂志.2021,33(1):17-23.
CAO Y,XU L,LI K F,et al.Study on myocardial protective effect of mulberry leaves extraction in diabetic mice[J].Chinese Heart Journal,2021,2021,33(1):17-23.
[17] JIN Q,YANG J F,MA L Y,et al.Comparison of polyphenol profile and inhibitory activities against oxidation and α-glucosidase in mulberry(genus Morus) cultivars from China[J].Journal of Food Science,2015,80(11):C2440-C2451.
[18] HAO J Y,WAN Y,YAO X H,et al.Effect of different planting areas on the chemical compositions and hypoglycemic and antioxidant activities of mulberry leaf extracts in Southern China[J].PLoS one,2018,13(6):e0198072.
[19] BUDIMAN A,AULIFA D L,KUSUMA A S W,et al.Antibacterial and antioxidant activity of black mulberry(Morus nigra L.) extract for acne treatment[J].Pharmacognosy Journal,2017,9(5):611-614.
[20] 冯淦熠,杨浩然,项轩,等.桑叶多酚的提取及其体外抗氧化能力测定[J].动物营养学报,2021,33(6):3 573-3 580.
FENG G Y,YANG H R,XIANG X,et al.Extraction of polyphenols from mulberry leaves and its determination of antioxidant capacity in vitro[J].Chinese Journal of Animal Nutrition,2021,33(6):3 573-3 580.
[21] JIN Q,YANG J F,MA L Y,et al.Identification of polyphenols in mulberry(genus Morus) cultivars by liquid chromatography with time-of-flight mass spectrometer[J].Journal of Food Composition and Analysis,2017,63:55-64.
[22] ZHANG Y B,LIU X Y,WANG Y F,et al.Antibacterial activity and mechanism of cinnamon essential oil against Escherichia coli and Staphylococcus aureus[J].Food Control,2016,59:282-289.
[23] FEI P,ALI M A,GONG S Y,et al.Antimicrobial activity and mechanism of action of olive oil polyphenols extract against Cronobacter sakazakii[J].Food Control,2018,94:289-294.
[24] YU L,SHI H.Effect of two mulberry(Morus alba L.) leaf polyphenols on improving the quality of fresh-cut cantaloupe during storage[J].Food Control,2021,121:107624.
[25] MART N-DIANA A B,RICO D,BARRY-RYAN C.Green tea extract as a natural antioxidant to extend the shelf-life of fresh-cut lettuce[J].Innovative Food Science & Emerging Technologies,2008,9(4):593-603.
N-DIANA A B,RICO D,BARRY-RYAN C.Green tea extract as a natural antioxidant to extend the shelf-life of fresh-cut lettuce[J].Innovative Food Science & Emerging Technologies,2008,9(4):593-603.
[26] 老莹,胡文忠,冯可,等.天然抑菌剂的抑菌机理及其在果蔬保鲜中的应用[J].食品与发酵工业,2018,44(9):288-293.
LAO Y,HU W Z,FENG K,et al.Application of natural antimicrobial agents on fruits and vegetables preservation and its mechanism[J].Food and Fermentation Industries,2018,44(9):288-293.