西兰花(Brassica oleracea L.var.Italica Planch.),属十字花科,甘蓝变种之一,富含维生素C、类胡萝卜素、花色苷和多种微量元素等营养及活性成分[1],除此之外,西兰花因含有丰富的硫代葡萄糖苷(简称硫苷)而备受青睐,其水解产物异硫氰酸酯(isothiocyanate,ITC)具有抗氧化、调节机体免疫及抗癌等功效。西兰花中主要的ITC为萝卜硫素[2]。西兰花采后如不采取任何措施或在不适宜的环境下贮藏及销售,极易发生黄化和腐烂,这造成其保鲜期极短,超市低温货架下3~4 d即失去商品价值,营养及活性成分也随之被降解[3]。因此,筛选适宜的西兰花贮藏及销售条件具有重要意义。
光照作为贮藏环境的重要因素之一,已被证实是调控细胞功能及代谢的重要因子之一,如植物的发芽、开花和果实生长等[4]。在采后,光照处理可通过将适宜波长、光强和光照周期的光源引入贮藏环境,使蔬菜进行光合作用,促进营养成分合成,或降低呼吸作用,利用电离辐射产生的高能射线杀灭病原微生物,达到提升蔬菜品质的效果[5-6]。已有研究发现光密度为12~13 μmol/(m2·s)的绿色LED光照可有效提高西兰花采后品质[7];而JIANG等[8]得出50 μmol/(m2·s)的红色LED光照可有效延缓其花球黄化,并抑制其营养物质的降解;詹丽娟等[5]采用连续白光对鲜切西兰花进行处理,同样发现2 000 Lux的光强对保持其叶绿素、类胡萝卜素和可溶性固形物等的含量具有较好的效果。
此外,湿度也是贮藏销售环境的重要因素,研究发现,过低湿度易造成果蔬严重失水,而高湿环境会导致其腐烂[9-10]。CALEB等[11]和徐长妍等[12]分别采用不同孔径和厚度的保鲜膜对鲜切西兰花进行包装,发现膜孔径越小,厚度越大,西兰花失水率越低,保鲜效果越佳。彭光华等[13]同时对西兰花贮藏环境的湿度及温度因子进行控制,得出西兰花贮藏期间要保持低温并采取保湿措施。但目前尚未见有关贮藏环境光照及湿度因子协同处理对西兰花保鲜效果的报道,且重点关注其采后生物活性成分提升的相关研究也较少。
本研究拟在超市货架温度[(13±1) ℃]下,研究不同光照[光密度5~8、25~35、75~85 μmol/(m2·s)]联合不同湿度(50%~60%、70%~80%、90%~100%)处理对鲜切西兰花品质、硫苷代谢及生物活性物质含量的影响,由此为鲜切西兰花的贮藏及销售提供理论及技术支持。
1 材料与方法
1.1 试验材料
本试验所采用西兰花品种为“优秀”,采收于盐城响水西兰花基地,并于采摘当日运至实验室。参考朱玲玲等[14]的方法,挑选颜色翠绿,大小、成熟度均匀,无明显病虫害和机械损伤的西兰花为试验材料,用消毒过的不锈钢刀将西兰花切成大小均一的花球。
1.2 试剂与仪器
1.2.1 主要试剂
无水乙醇、盐酸、硫酸、磷酸二氢钾、氢氧化钾、乙酸锌、苯酚,国药集团化学试剂有限公司;葡萄糖、甲酸铵、邻苯二硫醇,上海阿拉丁生化科技股份有限公司;福林酚、焦性没食子酸、亚铁氰化钾、二氯甲烷,上海麦克林生化科技有限公司,以上均为分析纯;苯甲腈、4-异硫氰基-1-丁烯、1-丁基异硫氰酸酯,上海源叶生物科技有限公司;萝卜硫素、黑芥子苷,美国Sigma-Aldrich。以上均为分析标准品。
1.2.2 主要仪器
ZQXP-R1350培养箱,上海智诚分析仪器制造有限公司;CR-400全自动测色色差仪,日本KONICA MINOLTA公司;A11 Basic型液氮研磨器,艾卡(广州)仪器设备有限公司;3K15高速冷冻离心机,德国Sigma公司;UV—1102型紫外可见分光光度计,上海天美科学仪器有限公司;Seven Multi pH计,梅特勒-托利多仪器(上海)有限公司;Q-Orbitrap 6500高效液相色谱串联质谱分析仪、TSQ 8000 EVO气相色谱串联质谱分析仪,安捷伦科技(中国)有限公司。
1.3 试验方法
在超市低温货架[(13±1) ℃]条件下,将鲜切好的西兰花花球置于可控温控湿的光照培养箱中贮藏,箱内温湿度及光照采用温湿度记录仪及照度仪进行校正,每个培养箱容量350 L,均匀分成3层,每层处理500 g样品,花球朝上,平铺于货架表面,样品距LED灯带(白光)20 cm,光照周期为12 h明期+12 h暗期。贮藏期为10 d,每2 d观察表型,进行感官评价,并拍照、取样(每个平行取约50 g)。取样方式为用干净的刀具切取西兰花小花蕾于液氮中速冻,并置于-20 ℃用于相关指标的测定。不同试验组设置如表1所示:
表1 不同试验组光照及湿度条件
Table 1 The condition of fluorescence irradiation and
relative humidity(RH) of different experimental groups
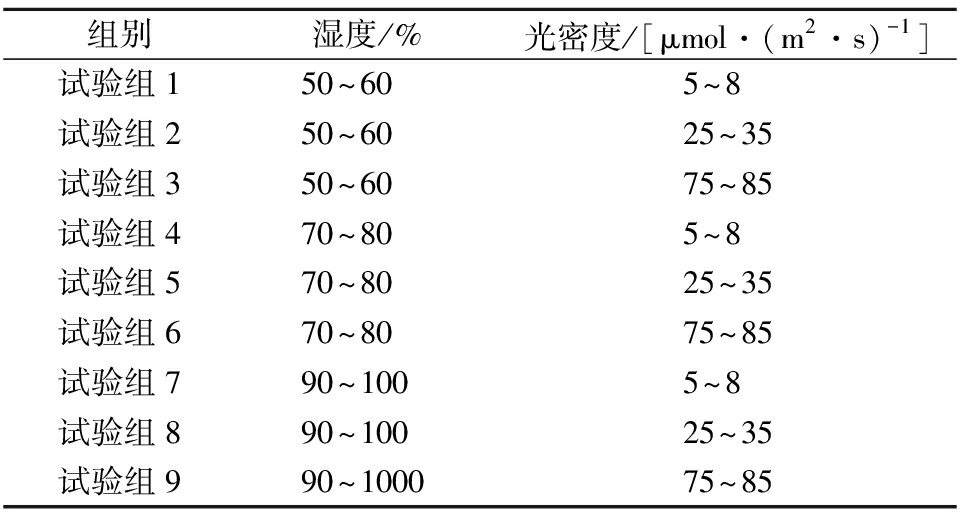
组别湿度/%光密度/[μmol·(m2·s)-1]试验组150~605~8试验组250~6025~35试验组350~6075~85试验组470~805~8试验组570~8025~35试验组670~8075~85试验组790~1005~8试验组890~10025~35试验组990~100075~85
通过上述9组试验,以鲜切西兰花表型、感官评分、色差及总硫苷和ITC含量为评价指标,筛选出适宜的光照及湿度条件。在此基础上,以上述筛选出的条件为处理组,以超市实际销售环境[光密度:5~8 μmol/(m2·s);湿度:50%~60%]为对照组(CK),研究适宜光照及湿度条件对鲜切西兰花硫苷代谢及生物活性物质的影响。
1.4 指标的测定方法
1.4.1 感官评分标准
参照朱玲玲等[14]的方法,并略作修改。评分小组按照表2分别从花球色泽、霉变程度、花球组织状态、茎部脆度和气味等5个方面进行评价,每项分值2分,且分4个等级进行评价,最终得分为5项的总和,得分越高,评价越好。
表2 鲜切西兰花感官评分标准
Table 2 Criteria for sensory evaluation of fresh-cut broccoli
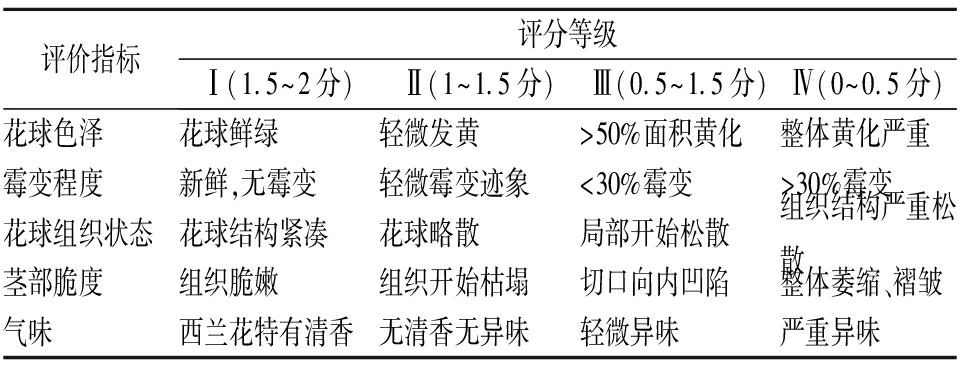
评价指标评分等级Ⅰ(1.5~2分)Ⅱ(1~1.5分)Ⅲ(0.5~1.5分)Ⅳ(0~0.5分)花球色泽花球鲜绿轻微发黄>50%面积黄化整体黄化严重霉变程度新鲜,无霉变轻微霉变迹象<30%霉变>30%霉变花球组织状态花球结构紧凑花球略散局部开始松散组织结构严重松散茎部脆度组织脆嫩组织开始枯塌切口向内凹陷整体萎缩、褶皱气味西兰花特有清香无清香无异味轻微异味严重异味
1.4.2 色差测定
参考纪淑娟等[15]的方法,测定花球h。,a*和b*值,每个平行测定20次,取平均值。
1.4.3 总硫苷含量的测定
参照HEANEY等[16]的方法。采用液氮研磨器将样品研磨成粉,称取2份西兰花粉末样品各1 g,1份加2 mL水,另1份加2 mL体积分数40%酸化甲醇(pH 4.0,HCl溶液调制),浸提20 min后,均用8 mL 40%酸化甲醇振荡摇匀以终止反应。于4 ℃、10 000 r/min离心20 min,上清液置于50 mL容量瓶中,加蒸馏水5 mL,混匀后依次加5 mL质量分数21.90%乙酸锌溶液、5 mL质量分数10.60%的亚铁氰化钾溶液,加水定容至刻度,混匀后,室温条件下静置30 min,用滤纸过滤。取1 mL滤液,依次加入1 mL蒸馏水和2 mL体积分数6%苯酚溶液,摇匀后,立即加入5 mL浓硫酸,摇匀,室温下静置5 min后于沸水浴15 min,取出后冷却至室温,用2 mL蒸馏水做空白对照,在490 nm处测吸光度。以葡萄糖为标准品进行外标法定量。
1.4.4 总ITC的测定
参考KIM等[17]的方法。准确称取1 g西兰花粉末样品,加入4 mL蒸馏水于40 ℃水浴3 h,再加入5 mL二氯甲烷振荡萃取30 min,于4 ℃、10 000 r/min离心15 min,取500 μL下层溶液,依次加入2 mL甲醇、1.8 mL 50 mmol/L的硼酸缓冲液和0.2 mL 70 mmol/L的邻苯二硫醇溶液,65 ℃水浴1 h后于365 nm处测定吸光值。用萝卜硫素为标准品计算ITC含量。
1.4.5 硫苷单体的测定
样品制备:参照YI等[18]的方法,称取1 g粉末样品,加入体积分数75%甲醇4 mL和内标物黑芥子苷(50 μg/L),于80 ℃水浴15 min,冷却至4 ℃后于10 000 r/min离心15 min,上清液浓缩后复溶于3 mL 75%甲醇。然后注入DEAE Sephadex-A25小柱,用1 mL 20 mmol/L醋酸钠冲洗2次,随后注入150 U/mL硫酸酯酶75 μL,于35 ℃下温育16 h。脱硫后采用0.5 mL纯水冲洗3次。合并洗脱液后浓缩至0.5 mL,根据在全扫描模式下确定的m/z值和在MS2模式下观察到的碎片信息,对硫苷进行鉴定。鉴定后采用Q-Orbitrap液质联用仪并采用内标法进行定量。
液相条件:色谱柱:waters BEH Xbridge 3.5 μm,2.1 mm×150 mm;流动相:A相和B相分别为5 mmol/L甲酸铵和甲醇;梯度洗脱:0~10 min:A相由95%降至70%,10~20 min:A相保持70%,20~35 min:A相由70%降至0%,35~40 min:A相由0%升至95%,40~45 min:A相保持95%;流速0.3 mL/min;柱温35 ℃;进样量5 μL。
质谱条件:保护层气流速率为30 L/min;辅助气流速率为10 L/min;尾气流速为1 L/min;喷雾电压为4.3 kV;毛细管温度为320 ℃;S-镜头RF电平为50;加热器温度为200 ℃。全扫描模式,分辨率为70 000;最大注入时间为100 ms;负离子模式;扫描范围为200~800 m/z。在MS2模式下分辨率:17 500 FWHM(m/z 200)。
1.4.6 硫苷水解产物的测定
样品提取:参照YANG等[19]的方法,略作修改。取2 g样品加入4 mL去离子水,37 ℃水解3 h,加入10 mL二氯甲烷萃取3次(剧烈振荡),离心后取下层溶液浓缩后用1 mL正己烷复溶,过膜后,采用GC-MS定性及定量。
分析条件:色谱柱:Hp-5 ms毛细管柱,载气流速1 mL/min,进样口260 ℃,检测器280 ℃,程序升温:40 ℃保持2 min,然后以10 ℃/min的速度升至260 ℃保持10 min,再以15 ℃/min的速度降至40 ℃,EI离子源温度250 ℃,EI能量:70 eV,接口温度260 ℃,四级杆温度150 ℃,负离子模式,扫描范围50~550 amu。以标准品离子的m/z信息为依据进行定性,采用外标法定量。
1.4.7 黑芥子酶活性的测定
参照KIM等[17]的方法,并略作修改。取1 g样品加入2 mL 0.1 mol/L磷酸盐缓冲液(pH 6.5),于4 ℃、10 000 r/min下离心15 min,取300 μL上清液,加入200 μL 2 mmol/L的黑芥子苷溶液,混匀,37 ℃水浴15 min,置于沸水浴中5 min以停止反应。测定葡萄糖含量,以1 min生成1 nmol葡萄糖为1个酶活力,结果以U/g表示。
1.4.8 总酚含量的测定
参照FERN NDEZ-LE
NDEZ-LE N等[20]的方法。称取0.5 g样品,加入5 mL 80%的乙醇溶液,然后于4 ℃、10 000 r/min离心20 min,取上清液0.1 mL,冰浴条件下加入0.9 mL蒸馏水和0.5 mL福林酚试剂,于25 ℃水浴3 min,再加入1 mL饱和碳酸钠于25 ℃下反应1 h,然后于760 nm处测定吸光值,以没食子酸标品制作标曲,计算总酚含量。
N等[20]的方法。称取0.5 g样品,加入5 mL 80%的乙醇溶液,然后于4 ℃、10 000 r/min离心20 min,取上清液0.1 mL,冰浴条件下加入0.9 mL蒸馏水和0.5 mL福林酚试剂,于25 ℃水浴3 min,再加入1 mL饱和碳酸钠于25 ℃下反应1 h,然后于760 nm处测定吸光值,以没食子酸标品制作标曲,计算总酚含量。
1.4.9 总花色苷含量的测定
参考WANG等[21]的方法。取1 g西兰花样品,加入6 mL 95%的酸化甲醇(0.1 mol/L HCl),于黑暗条件下振荡提取4 h,离心(10 000×g,20 min,4 ℃)提取上清液。提取液分别用0.025 mol/L KCl缓冲液(pH 1.0)和0.4 mol/L醋酸钠缓冲液(pH 4.5)稀释,室温下放置15 min后测定溶液在520和700 nm处的吸光值。计算如公式(1)所示:
总花色甘含量![]()
(1)
式中:A,吸光度,A=(A520 nm-A700 nm)pH 1.0-(A520 nm-A700 nm)pH 4.5;MW,氰化-3-葡萄糖苷的分子质量(C15H11O6,449.2);DF,稀释因子;δ,摩尔吸收率(26 900);m,鲜样质量,g。
1.4.10 叶绿素和类胡萝卜素含量的测定
参照李合生[22]的方法,略有改动。称取0.2 g粉末样品,加入95%乙醇10 mL,避光浸提6 h,取上清液,测定上清液在470、474、485、642和665 nm处的吸光值,计算如公式(2)~公式(5)所示:
ρa=13.95×A665 nm-6.88×A649 nm
(2)
ρb=24.96×A649 nm-7.32×A665 nm
(3)
总叶绿素含量/(mg·mL-1)=(ρa×ρb)×V×1 000/m
(4)
类胡萝卜素含量/(mg·mL-1)=4.92×A470 nm-
0.025 5×ρa-0.25×ρb
(5)
式中:ρa,叶绿素a的质量浓度,mg/mL;ρb,叶绿素b的质量浓度,mg/mL;m,鲜样质量,g;V,样品体积,L。
1.4.11 叶黄素含量的测定
叶黄素的提取:参考MARISIDDAIAH等[23]的方法,略有修改。避光条件下,称取0.2 g粉末样品,加入5 mL V(三氯甲烷)∶V(甲醇)=2∶1混合液,旋涡混匀1 min后浸提1 h,加入10 mL正己烷,离心(10 000×g,20 min,4 ℃)取上清液,重复2次,合并上清液,N2气氛下吹干,以1 mL甲醇复溶,用于HPLC分析。
HPLC检测条件:参考李大婧等[24]的方法,色谱柱为YMC-C30(4.6 mm×250 mm,5 μm);流动相A为V(纯净水)∶V(MTBE)∶V(甲醇)=5∶25∶70;流动相B为V(纯净水)∶V(MTBE)∶V(甲醇)=5∶85∶10;梯度洗脱程序:0~4.5 min(95%~80% A);4.5~12.5 min(80%~50%A);12.5~18 min(50%~25% A);18~24 min(25%~5% A);24~30 min(5% A);流速0.6 mL/min;进样量20 μL;柱温25 ℃;检测器:DAD检测器,检测波长450 nm。
1.5 数据统计
数据采用Origin 8.5软件绘制图表,所有数据为3个重复的(平均值±标准误),采用SPSS 17.0软件进行邓肯氏多重显著性差异分析(P<0.05)。
2 结果与分析
2.1 光照及湿度条件的筛选
2.1.1 不同光照和湿度条件对鲜切西兰花的保鲜效果
如表3所示,不同光照及湿度条件下鲜切西兰花的品质劣变速度不同。弱光条件[5~8 μmol/(m2·s)]下贮藏的鲜切西兰花保鲜期最短,其中低湿(50%~60%)、中等湿度(70%~80%)和高湿(90%~100%)环境保鲜期分别为4、6和4 d;其次为75~85 μmol/(m2·s)光照条件,低湿、中湿、高湿条件下西兰花保鲜期分别为6、8和6 d;光密度为25~35 μmol/(m2·s)条件下贮藏的鲜切西兰花保鲜期最长,低湿和高湿条件下西兰花保鲜期都为8 d,中湿条件(试验组5)保鲜期最长,达到10 d。总体而言,低湿(50%~60%)或高湿(90%~100%)条件均不利于其贮藏。
表3 不同光照和湿度条件对鲜切西兰花的保鲜效果
Table 3 Effect of different fluorescence irradiation and RH on the quality of fresh-cut broccoli

试验组号湿度/%光照/[μmol·(m2·s)-1]0 d2 d4 d6 d8 d10 d试验组150~605~8试验组250~6025~35试验组350~6075~85试验组470~805~8试验组570~8025~35
续表3

试验组号湿度/%光照/[μmol·(m2·s)-1]0 d2 d4 d6 d8 d10 d试验组670~8075~85试验组790~1005~8试验组890~10025~35试验组990~10075~85
2.1.2 不同光照强度及湿度条件对鲜切西兰花感官得分及色差的影响
如图1-a所示,随着贮藏时间的延长,鲜切西兰花的感官得分逐渐降低。其中,试验组1和试验组7下降速度最快,到第10天时,感官评分别仅为3.5和4分;而试验组5和6感官得分最高,在6 d后显著高于其他试验组(P<0.05),其中试验组5显著高于试验组6(P<0.05),第10天时鲜切西兰花感官得分仍保持为7.5分。
a*值和b*值增大,表示西兰花花球变黄,色调角h°为0°代表紫红色,90°代表黄色,180°代表绿色,270°代表蓝色。由图1-b~图1-d得出,随着贮藏时间延长,不同试验组的西兰花花球a*、b*和h°值都出现了不同程度的变化。总体而言,试验组4、5和6的a*值无明显下降,但试验组4和6的贮藏环境对鲜切西兰花b*和h°值保持效果不佳。综上,试验组5的光照及湿度条件最有利于保持鲜切西兰花色泽。

a-感官评分;b-a*值;c-b*值;d-h°值
图1 不同光照及湿度条件对鲜切西兰花感官评分及a*和b*、h°值的影响
Fig.1 Effect of different fluorescence irradiation and RH con the sensory score and a*,b*and h° of fresh-cut broccoli
2.1.3 不同光照及湿度条件对鲜切西兰花总硫苷及总ITC含量的影响
如图2-a所示,随着贮藏时间的延长,试验组1~3和试验组7、试验组9鲜切西兰花的硫苷含量逐渐降低;而试验组4、5、6和8呈先上升再下降趋势,其中试验组5[光密度25~35 μmol/(m2·s);湿度70%~80%]含量显著高于其他组(P<0.05)。与硫苷类物质结果类似,试验组5中ITC含量高于其他试验组,其次为试验组6;试验组1~3和试验组7~9同样不利于ITC含量的保持(图2-b)。
综上,试验组5[光密度25~35 μmol/(m2·s);湿度70%~80%]的条件更适宜鲜切西兰花贮藏,因此,采用该条件进行处理,以超市货架实际条件[光密度5~8 μmol/(m2·s);湿度50%~60%]为对照组(CK),研究光照和湿度条件对西兰花硫苷代谢及生物活性物质的影响。

a-总硫苷;b-ITC含量
图2 不同光照及湿度条件对鲜切西兰花总硫苷
及ITC含量的影响
Fig.2 Effect of different fluorescence irradiation and RH on
the contents of glucosinolates and ITC of fresh-cut broccoli
2.2 适宜光照及湿度条件对鲜切西兰花硫苷代谢及生物活性物质的影响
2.2.1 适宜光照及湿度条件对鲜切西兰花硫苷单体含量的影响
西兰花中主要的硫苷物质有萝卜硫苷(glucoraphanin, GRA),3-甲基亚磺酰丙基(glucoiberin, GIB),2-羟基-3-丁烯基硫苷(2-hydroxy-3-butenyl, PRO),3-丁烯基硫苷(gluconapin, GNA),4-甲硫基-丁基硫苷(glucoerucin, GER),吲哚甲基硫苷(glucobrassicin, GBR)和4-甲氧基吲哚甲基硫苷(4-methoxyglucobrassicin, 4MGBS)等,其中含量最高的硫苷物质为GRA。表4显示,光密度为25~35 μmol/(m2·s)及湿度为70%~80%的处理组中西兰花的GRA含量在整个贮藏期间显著高于CK(P<0.05)。同样,该处理组也有效保持了其GER,GIB,PRO,GBR和4MGBS的含量。可见,适宜光照及湿度条件可有效提升西兰花中硫苷单体物质的含量,由此提升了其总硫苷含量。
表4 适宜光照和湿度条件对鲜切西兰花硫苷物质含量的影响
Table 4 Effect of suitable fluorescence irradiation and RH on content of glucosinolates in fresh-cut broccoli
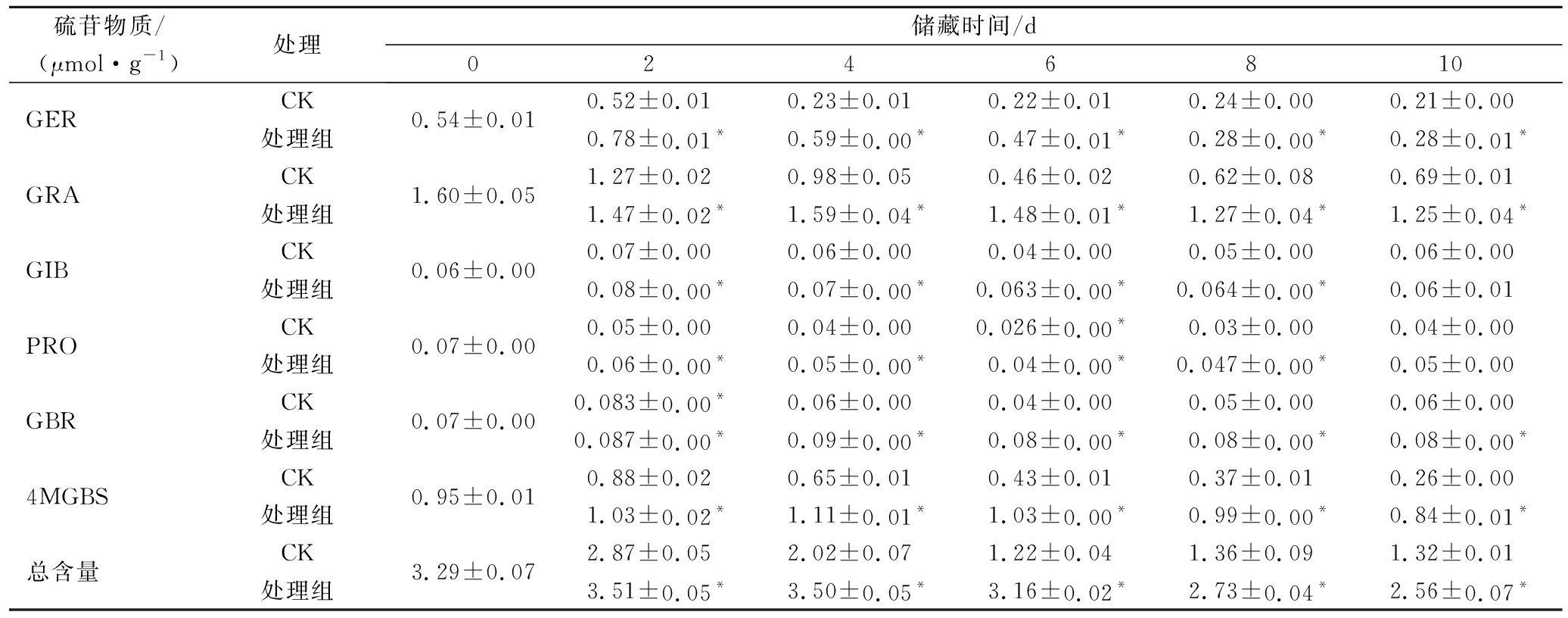
硫苷物质/(μmol·g-1)处理储藏时间/d02 4 6 8 10 GERCK0.54±0.010.52±0.010.23±0.010.22±0.010.24±0.000.21±0.00处理组0.78±0.01*0.59±0.00*0.47±0.01*0.28±0.00*0.28±0.01*GRACK1.60±0.051.27±0.020.98±0.050.46±0.020.62±0.080.69±0.01处理组1.47±0.02*1.59±0.04*1.48±0.01*1.27±0.04*1.25±0.04*GIBCK0.06±0.000.07±0.000.06±0.000.04±0.000.05±0.000.06±0.00处理组0.08±0.00*0.07±0.00*0.063±0.00*0.064±0.00*0.06±0.01PROCK0.07±0.000.05±0.000.04±0.000.026±0.00*0.03±0.000.04±0.00处理组0.06±0.00*0.05±0.00*0.04±0.00*0.047±0.00*0.05±0.00GBRCK0.07±0.000.083±0.00*0.06±0.000.04±0.000.05±0.000.06±0.00处理组0.087±0.00*0.09±0.00*0.08±0.00*0.08±0.00*0.08±0.00*4MGBSCK0.95±0.010.88±0.020.65±0.010.43±0.010.37±0.010.26±0.00处理组1.03±0.02*1.11±0.01*1.03±0.00*0.99±0.00*0.84±0.01*总含量CK3.29±0.072.87±0.052.02±0.071.22±0.041.36±0.091.32±0.01处理组3.51±0.05*3.50±0.05*3.16±0.02*2.73±0.04*2.56±0.07*
注:*表示同一指标在同一贮藏时间,处理组与对照组之间存在显著差异(P<0.05)(下同)
2.2.2 适宜光照及湿度条件对鲜切西兰花黑芥子酶活性的影响
黑芥子酶催化硫苷物质水解。图3显示,在贮藏期间,鲜切西兰花中黑芥子酶活性呈逐渐上升趋势,但处理组上升速度大于CK组,且在整个贮藏期间显著高于CK组(P<0.05),尤其在6 d后高于CK组33%以上。可见,适宜的光照及湿度条件可促进硫苷物质水解。
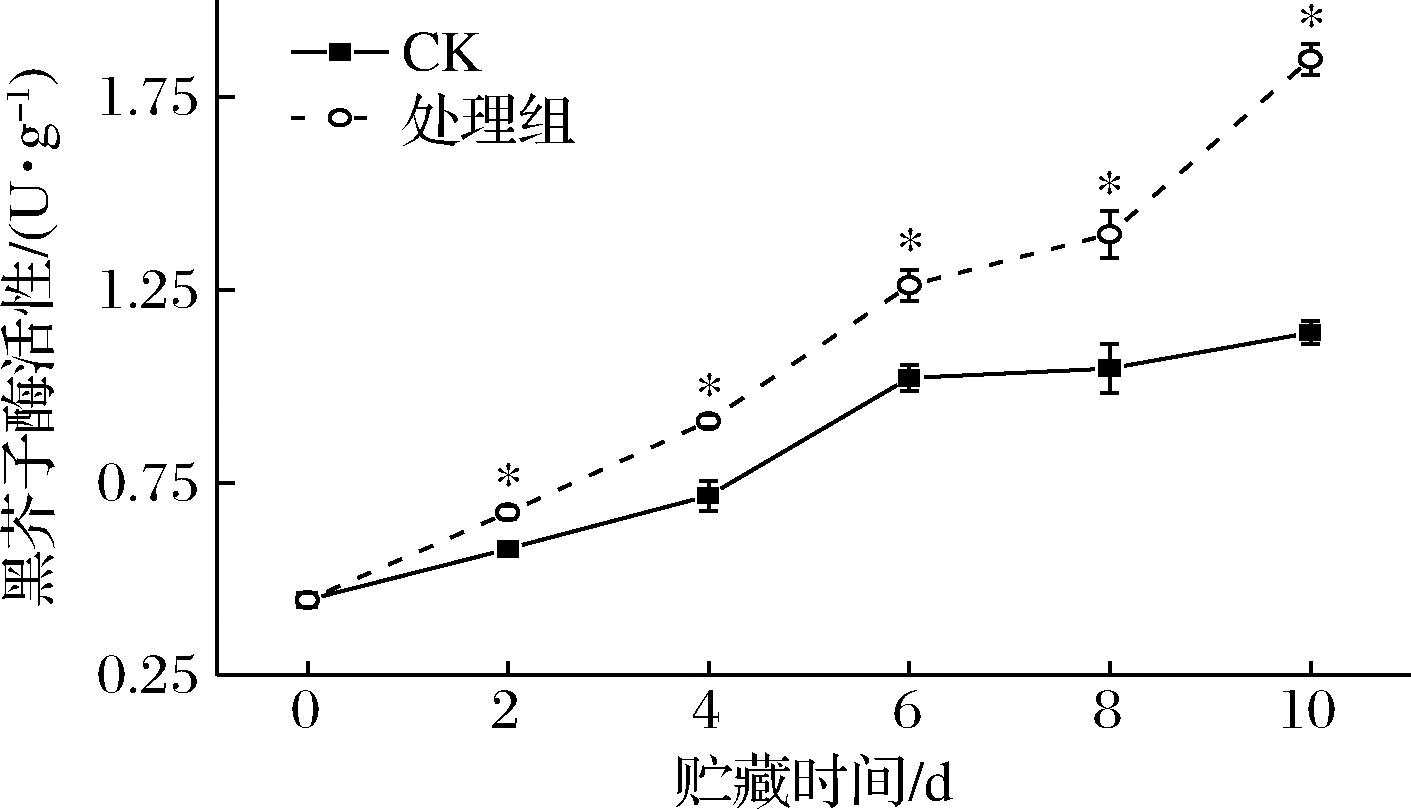
图3 适宜光照及湿度条件对鲜切西兰花黑芥子酶活性的影响
Fig.3 Effect of suitable fluorescence irradiation and RH
condition on myrosinase activity of fresh-cut broccoli
2.2.3 适宜光照及湿度条件对鲜切西兰花硫苷水解产物含量的影响
西兰花硫苷水解产物主要成分有4-戊烯基异硫氰酸酯、4-异硫氰基-1-丁烯和萝卜硫素3种ITC,一种睛类:苯甲腈(表5),其中萝卜硫素含量最高,其次为4-异硫氰基-1-丁烯。结果显示,这2种水解产物含量在第2天迅速上升,后呈整体下降的趋势,但在整个贮藏期间,处理组的萝卜硫素和4-异硫氰基-1-丁烯含量显著高于CK组。由此可见,光密度25~35 μmol/(m2·s)协同湿度70%~80%的贮藏条件有利于保持鲜切西兰花ITC含量。
表5 适宜光照和湿度条件对鲜切西兰花硫苷水解产物含量的影响
Table 5 Effect of suitable fluorescence irradiation and RH on glucosinolate hydrolyzates contents in fresh-cut broccoli
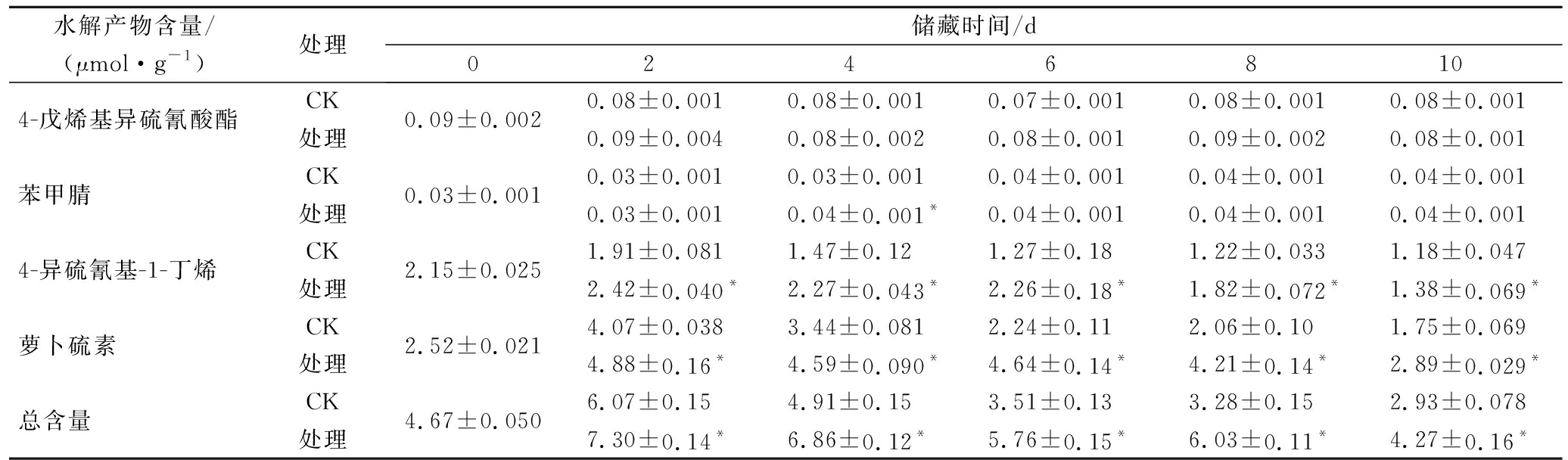
水解产物含量/(μmol·g-1)处理储藏时间/d02 4 6 8 10 4-戊烯基异硫氰酸酯CK0.09±0.0020.08±0.0010.08±0.0010.07±0.0010.08±0.0010.08±0.001处理0.09±0.0040.08±0.0020.08±0.0010.09±0.0020.08±0.001苯甲腈CK0.03±0.0010.03±0.0010.03±0.0010.04±0.0010.04±0.0010.04±0.001处理0.03±0.0010.04±0.001*0.04±0.0010.04±0.0010.04±0.0014-异硫氰基-1-丁烯CK2.15±0.0251.91±0.0811.47±0.121.27±0.181.22±0.0331.18±0.047处理2.42±0.040*2.27±0.043*2.26±0.18*1.82±0.072*1.38±0.069*萝卜硫素CK2.52±0.0214.07±0.0383.44±0.0812.24±0.112.06±0.101.75±0.069处理4.88±0.16*4.59±0.090*4.64±0.14*4.21±0.14*2.89±0.029*总含量CK4.67±0.0506.07±0.154.91±0.153.51±0.133.28±0.152.93±0.078处理7.30±0.14*6.86±0.12*5.76±0.15*6.03±0.11*4.27±0.16*
2.2.4 适宜光照及湿度条件对鲜切西兰花总酚及花色苷含量的影响
由图4-a得出,在贮藏期间,西兰花总酚含量呈先上升后下降的趋势,且处理组始终高于CK组,在6 d后,高于CK组40%以上。与总酚含量不同,西兰花中花色苷含量在贮藏期间呈现逐渐上升的趋势(图4-b),但处理组上升速度较快,且在整个贮藏期间显著高于CK组(P<0.05)。可见,光密度25~35 μmol/(m2·s)协同湿度70%~80%的贮藏环境可有效提高鲜切西兰花中总酚和花色苷含量。

a-总酚;b-花色苷
图4 适宜光照及湿度条件对鲜切西兰花总酚及
花色苷含量的影响
Fig.4 Effect of suitable fluorescence irradiation and RH
on total phenol and anthocyanin contents in fresh-cut broccoli
2.2.5 适宜光照及湿度条件对鲜切西兰花叶绿素、叶黄素及类胡萝卜素含量的影响
在贮藏期间,CK组鲜切西兰花中的叶绿素含量总体呈直线下降趋势(图5-a),而处理组在贮藏前4 d前趋于稳定,到4 d后缓慢下降,在4~10 d显著高于CK组(P<0.05)。西兰花中类胡萝卜素含量在贮藏期间的变化与叶绿素结果类似(图5-b),但CK组下降速度较处理组快,且在整个贮藏期间显著低于处理组15%以上。叶黄素是类胡萝卜素的一种,其结果(图5-c)与类胡萝卜素相似,在贮藏前8 d,CK组西兰花叶黄素含量迅速下降,而处理组在前4 d变化幅度不大,随后呈现迅速下降趋势,由此,在整个贮藏期间,处理组叶黄素含量显著高于CK组(P<0.05)。综上,光密度25~35 μmol/(m2·s)协同湿度70%~80%的贮藏环境对提升鲜切西兰花中叶绿素和类胡萝卜素含量效果较好。

a-叶绿素;b-类胡萝卜素;c-叶黄素
图5 适宜光照及湿度条件对鲜切西兰花叶绿素、类胡萝卜素及叶黄素含量的影响
Fig.5 Effect of suitable fluorescence irradiation and RH on contents of chlorophyll,carotenoid and lutein in fresh-cut broccoli
3 结论与讨论
当前,我国西兰花在贮藏及销售期间,光照仅以可视为原则,保湿处理也并没有进行精准控制,这导致其采后迅速发生黄化、组织松散和腐烂,同时伴随着营养及活性成分的快速消耗,由此失去商品价值。因此,对鲜切西兰花贮藏及销售环境进行有效的管控至关重要。光照和湿度是环境的重要影响因子,对其进行合理、科学的调节可有效延长果蔬保鲜期。张翠翠等[25]发现适宜强度荧光照射[24 μmol/(m2·s)]可有效提升低温贮藏期鲜切西兰花的品质;而PINTOSA等[26]以不同光照强度和光周期对西兰花进行处理,得出光密度为9.5~19.0 μmol/(m2·s)并每天照射3~12 h的光照有利于西兰花贮藏。CALEB等[11]采用不同孔径的薄膜对鲜切西兰花进行包装,发现孔径过大,膜透湿率上升,将导致西兰花失水严重,由此加速其品质劣变速度。本研究对鲜切西兰花贮藏环境的光照及湿度因子同时进行管控,发现适宜光照及湿度环境可有效保持西兰花品质,延长其保鲜期。
西兰花因其富含硫苷和萝卜硫素等生物活性物质而得到广泛关注,萝卜硫素是GRA的水解产物,是蔬菜中所发现的抗癌效果最好的生物活性物质。本研究经鉴定和分析得出西兰花中主要的硫苷单体为GRA,主要的ITC为萝卜硫素,但其性质极其不稳定。适宜的环境可有效保持萝卜硫素的含量,例如,RYBARCZYK-PLONSKA等[27]发现在低温条件(0~4 ℃)下,光照处理对西兰花硫苷物质影响不显著,而在18 ℃下,光照处理可有效提升其主要硫苷物质和萝卜硫素的含量,这说明光照处理在不同的环境下效果不一。本研究得出光密度25~35 μmol/(m2·s)协同湿度70%~80%的贮藏环境可有效提升鲜切西兰花中主要硫苷物质的含量,并增强其黑芥子酶活性,由此加速了ITC的累积。与本试验结果类似,JIN等[7]也发现适宜光照条件可有效保持西兰花品质并提升其硫苷和萝卜硫素的含量;而薛冲等[28]得出红光和蓝光对西兰花组织中萝卜硫素的积累效果优于白光、绿光和黄光。
除硫苷类物质外,西兰花同样富含总酚、类胡萝卜素和花色苷等生物活性物质[29]。适宜光照和湿度条件可有效维持其组织较高的总酚、花色苷、叶绿素和类胡萝卜素等生物活性物质的含量。HASPERUE等[30]采用白光和蓝光[20 μmol/(m2·s)]混合处理西兰花,发现在22 ℃下可有效促进其光合作用,延长其保鲜期,并提升其组织叶绿素、类胡萝卜素和总酚含量。而LOI等[31]发现低密度绿光可有效延缓西兰花黄化,并保持其较高的酚类物质和类胡萝卜素含量,由此说明,在不同的环境下,可有效提升西兰花品质及生物活性物质的光照条件不一。
因此,在(13±1) ℃下,光密度25~35 μmol/(m2·s)协同湿度70%~80%的贮藏环境可有效保持西兰花外观品质,延缓其黄化,并保持主要硫苷物质GRA和黑芥子酶活性,由此促进萝卜硫素的生成,同时保持其组织较高的总酚、类胡萝卜素等生物活性物质含量,由此提升其营养品质,延长其保鲜期。
[1] 蒋金勇,唐海兵,栾东磊,等.聚乳酸/聚丁二酸-己二酸丁二酯可降解抗氧化薄膜对鲜切西兰花的保鲜效果[J].食品科学,2019,40(13):274-280.
JIANG J Y,TANG H B,LUAN D L,et al.Effect of polylactic acid/poly(butylene succinate-co-adipate) biodegradable film containing different essential oils in preserving quality and extending shelf-life of fresh-cut broccoli[J].Food Science,2019,40(13):274-280.
[2] 刘泽松,史君彦,左进华,等.UV-C和LED红光复合处理对西兰花贮藏品质的影响[J].食品科学,2020,41(17):238-245.
LIU Z S,SHI J Y,ZUO J H,et al.Effect of combined UV-C and red light emitting diode irradiation on storage quality of broccoli[J].Food Science,2020,41(17):238-245.
[3] B RCENA A,BAHIMA J
RCENA A,BAHIMA J ![]() V,et al.The degradation of chloroplast components during postharvest senescence of broccoli florets is delayed by low-intensity visible light pulses[J].Postharvest Biology and Technology,2020,168:111249.
V,et al.The degradation of chloroplast components during postharvest senescence of broccoli florets is delayed by low-intensity visible light pulses[J].Postharvest Biology and Technology,2020,168:111249.
[4] ![]() Z S,FALLIK E.Light quality manipulation improves vegetable quality at harvest and postharvest:A review[J].Environmental and Experimental Botany,2017,139:79-90.
Z S,FALLIK E.Light quality manipulation improves vegetable quality at harvest and postharvest:A review[J].Environmental and Experimental Botany,2017,139:79-90.
[5] 詹丽娟,魏国强,乔明武,等.光照处理提高鲜切西兰花贮藏品质[J].食品科学,2012,33(14):296-300.
ZHAN L J,WEI G Q,QIAO M W,et al.Quality improvement of fresh-cut broccoli(Brassica Oleracea L.) during storage by light illumination[J].Food Science,2012,33(14):296-300.
[6] ZHANG X Y,BIAN Z H,YUAN X X,et al.A review on the effects of light-emitting diode(LED) light on the nutrients of sprouts and microgreens[J].Trends in Food Science & Technology,2020,99:203-216.
[7] JIN P,YAO D,XU F,et al.Effect of light on quality and bioactive compounds in postharvest broccoli florets[J].Food Chemistry,2015,172:705-709.
[8] JIANG A L,ZUO J H,ZHENG Q L,et al.Red LED irradiation maintains the postharvest quality of broccoli by elevating antioxidant enzyme activity and reducing the expression of senescence-related genes[J].Scientia Horticulturae,2019,251:73-79.
[9] 张国强,乔勇进,王晓,等.相对湿度对双孢蘑菇贮藏品质的影响[J].食品工业科技,2019,40(13):226-230.
ZHANG G Q,QIAO Y J,WANG X,et al.Effect of relative humidity on storage quality of Agaricus bisporus[J].Science and Technology of Food Industry,2019,40(13):226-230.
[10] KTENIOUDAKI A,O’DONNELL C P,DO NASCIMENTO NUNES M C.Modelling the biochemical and sensory changes of strawberries during storage under diverse relative humidity conditions[J].Postharvest Biology and Technology,2019,154:148-158.
[11] CALEB O J,ILTE K,FRÖHLING A,et al.Integrated modified atmosphere and humidity package design for minimally processed Broccoli(Brassica oleracea L.var.italica)[J].Postharvest Biology and Technology,2016,121:87-100.
[12] 徐长妍,刘杰,陈焕霓.鲜切西兰花的PE薄膜保鲜包装技术研究[J].食品科技,2011,36(7):40-44.
XU C Y,LIU J,CHEN H N.PE film fresh-keeping package for fresh-cut broccoli[J].Food Science and Technology,2011,36(7):40-44.
[13] 彭光华,赵安娜,涂贻轩,等.不同温度、保湿时间对西兰花主要采后病害发生的影响[J].长江蔬菜,2019(14):72-76.
PENG G H,ZHAO A N,TU Y X,et al.Effects of temperature and moisturizing time on occurrence of main post-harvest diseases of Broccoli[J].Journal of Changjiang Vegetables,2019(14):72-76.
[14] 朱玲玲,胡花丽,罗淑芬,等.褪黑素调控呼吸代谢及抗氧化活性延缓采后青花菜衰老[J].农业工程学报,2018,34(3):300-308.
ZHU L L,HU H L,LUO S F,et al.Melatonin delaying senescence of postharvest broccoli by regulating respiratory metabolism and antioxidant activity[J].Transactions of the Chinese Society of Agricultural Engineering,2018,34(3):300-308.
[15] 纪淑娟,熊振华,程顺昌,等.1-MCP和CO2自发释放处理对西兰花常温货架期的保鲜作用[J].食品与发酵工业,2014,40(2):202-206.
JI S J,XIONG Z H,CHENG S C,et al.Effects of spontaneous release 1-MCP and CO2 on the quality of broccolis during shelf life[J].Food and Fermentation Industries,2014,40(2):202-206.
[16] HEANEY R K,SPINKS E A,FENWICK G R.Improved method for the determination of the total glucosinolate content of rapeseed by determination of enzymically released glucose[J].The Analyst,1988,113(10):1 515.
[17] KIM H J,CHEN F,WANG X,et al.Effect of methyl jasmonate on phenolics,isothiocyanate,and metabolic enzymes in radish sprout(Raphanus sativus L.)[J].Journal of Agricultural and Food Chemistry,2006,54(19):7 263-7 269.
[18] YI G,LIM S,CHAE W B,et al.Root glucosinolate profiles for screening of radish(Raphanus sativus L.) genetic resources[J].Journal of Agricultural and Food Chemistry,2016,64(1):61-70.
[19] YANG R Q,HUI Q R,GU Z X,et al.Effects of CaCl2 on the metabolism of glucosinolates and the formation of isothiocyanates as well as the antioxidant capacity of broccoli sprouts[J].Journal of Functional Foods,2016,24:156-163.
[20] FERN NDEZ-LE
NDEZ-LE N M F,FERN
N M F,FERN NDEZ-LE
NDEZ-LE N A M,LOZANO M,et al.Altered commercial controlled atmosphere storage conditions for ‘Parhenon’ broccoli plants(Brassica oleracea L.var. italica) .Influence on the outer quality parameters and on the health-promoting compounds[J].LWT-Food Science and Technology,2013,50(2):665-672.
N A M,LOZANO M,et al.Altered commercial controlled atmosphere storage conditions for ‘Parhenon’ broccoli plants(Brassica oleracea L.var. italica) .Influence on the outer quality parameters and on the health-promoting compounds[J].LWT-Food Science and Technology,2013,50(2):665-672.
[21] WANG Y C,LIU W J,JIANG H Y,et al.The R2R3-MYB transcription factor MdMYB24-like is involved in methyl jasmonate-induced anthocyanin biosynthesis in apple[J].Plant Physiology and Biochemistry,2019,139:273-282.
[22] 李合生.植物生理生化试验原理和技术[M].北京:高等教育出版社,2000.
LI H S.Principles and Techniques of Plant Physiological and Biochemical Experiments[M].Beijing:Higher Education Press,2000.
[23] MARISIDDAIAH R,BASKARAN V.Bioefficacy of β-carotene is improved in rats after solubilized as equimolar dose of β-carotene and lutein in phospholipid-mixed micelles[J].Nutrition Research,2009,29(8):588-595.
[24] 李大婧,王闯,徐爱琴,等.高效液相色谱法测定叶黄素顺、反异构体[J].食品科学,2012,33(22):186-190.
LI D J,WANG C,XU A Q,et al.Determination of lutein stereoisomers by HPLC[J].Food Science,2012,33(22):186-190.
[25] 张翠翠,马亚丹,李林杰,等.可溶性糖介导的荧光照射延缓鲜切西兰花衰老黄化[J].食品科学,2019,40(9):207-212.
ZHANG C C,MA Y D,LI L J,et al.Soluble sugar-mediated yellowing delay of fresh-cut broccoli florets(Brassica oleracea var.italica) exposed to fluorescence irradiation[J].Food science,2019,40(9):207-212.
[26] PINTOS F M,HASPERUÉ J H,VICENTE A R,et al.Role of white light intensity and photoperiod during retail in broccoli shelf life[J].Postharvest Biology and Technology,2020,163:111121.
[27] RYBARCZYK-PLONSKA A,HAGEN S F,BORGE G I A,et al.Glucosinolates in broccoli(Brassica oleracea L.var.italica) as affected by postharvest temperature and radiation treatments[J].Postharvest Biology and Technology,2016,116:16-25.
[28] 薛冲,李胜,马绍英,等.不同光质对西兰花愈伤组织及萝卜硫素含量的影响[J].甘肃农业大学学报,2010,45(4):95-99.
XUE C,LI S,MA S Y,et al.Effects of different light qualities on the callus and its sulforaphen content from broccoli[J].Journal of Gansu Agricultural University,2010,45(4):95-99.
[29] 罗枫.BoPIF4和BobHLH66转录因子对采后西兰花黄化关键基因的转录调控机理研究[D].沈阳:沈阳农业大学,2019.
LUO F.Research on the transcriptional regulation mechanism of BoPIF4 and BobHLH66 transcription factors on key genes of postharvest broccoli yellowing[D].Shenyang:Shenyang Agricultural University,2019.
[30] HASPERUÉ J H,GUARDIANELLI L,RODONI L M,et al.Continuous white-blue LED light exposition delays postharvest senescence of broccoli[J].LWT-Food Science and Technology,2016,65(1):495-502.
[31] LOI M,LIUZZI V C,FANELLI F,et al.Effect of different light-emitting diode(LED) irradiation on the shelf life and phytonutrient content of broccoli(Brassica oleracea L.var.italica)[J].Food Chemistry,2019,283:206-214.