石榴(Punica granatum L.)为乔木或灌木,是石榴科石榴属的多年生双子叶落叶果树,其原产于巴尔干半岛及其邻近区域,在我国已有2000余年的栽培历史[1]。石榴也是一种传统中药材,《图经本草》中记载:“榴叶者,治咽喉燥渴,止下痢漏精,消食祛火”。对于治疗溃疡、腹泻以及口舌生疮等具有一定的效果,同时也可以用作补血药和抗寄生虫药[2]。此外,适当食用石榴还能促进女性身体健康,有效降低人体内长期累积的氧化胆固醇,并减缓机体的衰老[3-4]。因此,石榴作为一种功能性水果越来越受到消费者青睐[5]。
石榴果酒是以石榴果汁为原料,通过果酒酵母发酵而成的一种果酒[6]。随着石榴酒产量的提高,有关石榴果酒的研究也受到广泛关注。也有人研究了石榴酒的抗氧化功能成分,检测出其中安石榴苷的含量达到(21.20±1.38)mg/100 mL,还含有没食子酸、鞣花酸和香草酸等多酚类抗氧化物质,表现出高抗氧化能力[7]。果酒中风味物质的种类及含量的多少是影响其品质的关键,对于食品中的风味物质检测一般采用电子鼻法、气相-质谱联用法[8],气相-质谱联用法需要对样品进行前处理,比较麻烦且容易失真;电子鼻法虽不需要前处理,但对风味成分不能精准定性和定量。离子迁移图谱(ion mobility spectrometry,IMS)在20世纪70年代便已经出现,以等离子色谱形式被应用[9],最早被使用在毒品、环境污染物的检测、爆炸物的分析处理等方面[10],与GC技术联用便出现了气相-离子迁移谱技术(gas chromatography-ion mobility spectrometry,GC-IMS),相比于GC-MS技术,GC-IMS具有更加高效的分离能力以及灵敏的响应速度,无需进行样品预处理,能够广泛地应用于不同样品挥发性成分差异的分析[11],且GC-IMS技术能有效区分同分异构体[12]。目前对石榴酒酿造过程中风味成分变化的研究主要集中在发酵的前8 d[7,13-14],缺少酿制前后挥发性风味成分变化的报道。
本文采用GC-IMS对石榴果酒酿制前后挥发性风味成分迁移变化规律进行研究,旨在为石榴果酒酿造工艺的改进提供科学依据。
1 材料及方法
1.1 仪器与设备
FlavourSpec®风味分析仪,德国G.A.S公司;SPL-250恒温培养箱,天津莱博瑞特仪器设备有限公司;-80 ℃超低温冰箱,美国Thermo scientific公司。
1.2 材料与试剂
优质大青皮石榴,山东省枣庄市峄城区所产;酵母菌采用安琪葡萄酒用高活性干酵母;蔗糖,市售。
1.3 实验方法
1.3.1 酒样制备
工艺流程:
石榴→筛选→清洗→去皮→榨汁→调整糖度→添加活化后的酵母菌培养液(安琪果酒用高活性干酵母)→发酵→澄清→过滤→成品。
操作要点:石榴成熟季节,挑选充分成熟无病虫害的完整果实,清洗后剥皮取籽,螺旋压榨机压榨,得石榴果汁,取其中100 mL果汁装于塑料瓶中密封并标记为样品1,于-80 ℃冰箱中保存;将剩余石榴汁的糖度调配至20°Brix,放置在5 L发酵罐中,在28 ℃下进行发酵,于20 d时取100 mL酒液装于塑料瓶中标记为样品2,同样于-80 ℃冰箱中保存;剩余酒样分离酒脚后于20~25 ℃避光陈酿,1年后取样100 mL,标记为样品3,样品1、2、3均设置3组平行实验,并标记为1-1,1-2,1-3;2-1,2-2,2-3;3-1,3-2,3-3,3组样品用于检测分析。
1.3.2 GC-IMS测定挥发性成分
样品的预处理方法:将1 mL石榴酒样置于20 mL顶空检测瓶中,以500 r/min的转速,在60 ℃的条件下孵育10 min后开始进样。
GC-IMS分析条件:分析用色谱柱型号MXT-WAX(30 m×0.53 mm,1 μm),IMS温度45 ℃,色谱柱温度60 ℃,进样针温度85 ℃,载气/漂移气N2,分析时间30 min,自动进样体积500 μL。
气相色谱条件:0~2 min:漂移气150 mL/min,载气2 mL/min;2~10 min:漂移气150 mL/min,载气2 mL/min提升到10 mL/min;10~20 min:漂移气150 mL/min,载气10 mL/min提升到100 mL/min;20~30 min:漂移气150 mL/min,载气100 mL/min。
1.3.3 数据处理
使用GC-IMS仪器配套的VOCal软件查看数据的定性和分析谱图,使用到软件内置的IMS数据库和NIST数据库进行物质的定性分析;Reporter插件用于二维和三维谱图的差异对比;Gallery Plot插件用于比较不同样品间挥发性有机物含量的差异;Dynamic PCA插件则用于主成分分析(picipal components analysis,PCA)及其图表的绘制。
2 结果分析
2.1 石榴果汁果酒挥发性成分定性分析
结合图1与表1可以看出,通过GC-IMS技术在石榴果汁和果酒样品中共检出并定性了36种挥发性成分,保留指数均在1 600以下,结合difference图进行对比分析,酯类和醇类物质占大部分,包括12种酯类物质,6种醇类物质,此外还有醛类物质4种,酮类物质2种,酸类物质1种,烷类物质1种,醚类物质1种。检出的36种成分中9对成分为其单体与二聚体或聚合物。出现此现象是由于在检测过程中,一部分挥发性组分在经过漂移管之前会因为质子化中性组分的电离而出现二聚体或聚合物[15]。在GC-IMS测得的27种物质中,有18种(67%)为醇和酯,这表明大量的醇和酯是构成石榴酒香气的主要成分。有学者采用HS-SPME-GC-MS技术测定石榴酒中易挥发物质,检测出了酯类物质23种,醇类物质16种[16],与本研究得到的结果类似。

a-未发酵石榴汁;b-发酵20 d石榴酒;c-陈酿1年石榴酒
图1 不同阶段样品GC-IMS 分析谱图
Fig.1 GC-IMS analysis spectra of samples at different stages
表1 挥发性物质定性结果
Table 1 Qualitative results of volatile substances

编号化合物名称CAS#分子式分子质量RIRt/sDt[a.u.]1二甲基硫醚C75183C2H6S62.1766.5245.8570.962 3622-甲基丙烷C78842C4H8O72.1799.2260.0991.282 293丙酮C67641C3H6O58.1806.6263.3241.120 354丙醛C123386C3H6O58.1786.2254.4561.154 915乙酸乙酯C141786C4H8O288.1895.9302.2881.340 556乙醇C64175C2H6O46.1947.7333.1911.140 172-甲基-1-丙醇单体C78831C4H10O74.11 098485.6981.170 4382-甲基-1-丙醇二聚体C78831C4H10O74.11 099.3487.9871.371 899丁酸乙酯C105544C6H12O2116.21 040.9417.8021.561 2510己醛单体C66251C6H12O100.21 087.9473.4921.259 611己醛二聚体C66251C6H12O100.21 088.8474.6371.564 5512辛酸乙酯单体C106321C10H20O2172.31 460.51 091.0261.473 8213辛酸乙酯二聚体C106321C10H20O2172.31 458.71 087.9432.037 22143-甲基-1-丁醇二聚体C123513C5H12O88.11 213.6680.6421.502 06153-甲基-1-丁醇聚合物C123513C5H12O88.11 213.6680.6421.803 1916己酸乙酯C123660C8H16O2144.21 237714.3721.803 1917乳酸乙酯C97643C5H10O3118.11 350.4896.5151.542 4318丙烷酸乙酯C105373C5H10O2102.1961.8342.6151.458 4919异丁酸乙酯C97621C6H12O2116.2973350.1771.568 1120乙酸异丁酯C110190C6H12O2116.21 020.2393.2951.619 13211-丙醇单体C71238C3H8O60.11 041.1418.0511.109 69221-丙醇聚合物C71238C3H8O60.11 040.8417.731.388 39233-甲基丁酸乙酯单体C108645C7H14O2130.21 069.1451.2051.265 61243-甲基丁酸乙酯二聚体C108645C7H14O2130.21 067.8449.6531.657 3252-甲基丁酸乙酯单体C7452791C7H14O2130.21 057.9437.9941.244262-甲基丁酸乙酯二聚体C7452791C7H14O2130.21 054.7434.2221.655 8427乙酸异戊酯单体C123922C7H14O2130.21 125.9534.3531.306 5828乙酸异戊酯二聚体C123922C7H14O2130.21 126.3535.0391.748 9829乙酸C64197C2H4O260.11 519.41 195.2711.152 9630丁醇单体C71363C4H10O74.11 147.2571.4171.183 9731丁醇二聚体C71363C4H10O74.11 148.4573.61.386 4332庚醛C111717C7H14O114.21 190.1646.2141.328 2333正戊醇C71410C5H12O88.11 253.6738.3281.255 0634壬醛C124196C9H18O142.21 398.6981.7111.473 9835乙酸丁酯C123864C6H12O2116.21 074.7457.8941.626362-羟基-2-丁酮C513860C4H8O288.11 287.3786.8781.055 52
注:RI-计算出的保留指数;Rt-保留时间;Dt-归一化后的相对迁移时间
2.2 发酵前后样品中的挥发性风味物质差异
图2为利用Reporter插件制作的不同发酵阶段石榴果汁果酒样品中挥发性风味物质差异三维谱图(保留时间,迁移时间和峰强度),从图中可以直观看出不同样品挥发性有机物差异。为了方便观察对比,图3为二维俯视图,其背景呈蓝色,横坐标1.0处红色竖线为RIP峰(反应离子峰,经归一化处理),纵坐标代表气相色谱的保留时间(s),横坐标代表离子迁移时间(归一化处理)。RIP峰的两侧有许多点,其中每一种挥发性有机物对应一个点。RIP峰两侧点的颜色深浅代表这一挥发性有机物的浓度,白色表示该物质的浓度较低,红色表示该物质的浓度较高,峰颜色越深则表明该物质浓度越大。为了使发酵前后样品间的差异更加明显,可以使用差异对比模式进行观察:选取未发酵石榴汁的谱图作为参比,其他样品的谱图扣减参比。如果二者所含挥发性有机物浓度相似,则扣减后的背景为白色,若呈现红色便代表该物质的浓度高于参比,蓝色则代表该物质的浓度低于参比,得到样品的气相离子迁移谱图Difference图(图4)。在样品2和3的Difference图中可以明显观察到较多红色斑点,表明发酵后产生了大量的挥发性风味物质。
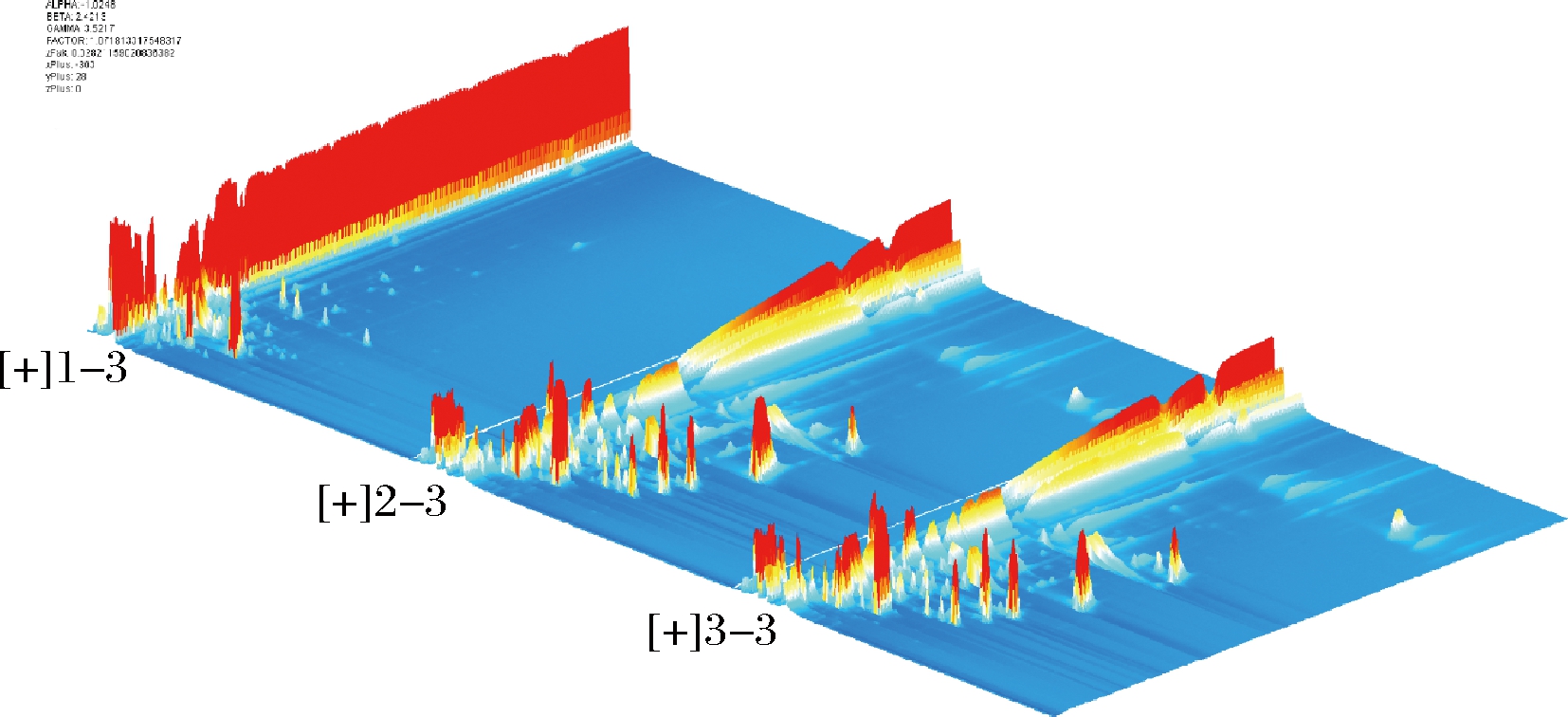
图2 GC-IMS 三维谱图
Fig.2 Three-dimensional spectrum of GC-IMS

图3 GC-IMS 二维谱图
Fig.3 Two-dimensional spectrum of GC-IMS

图4 GC-IMS 差异谱图
Fig.4 GC-IMS difference spectrum
2.3 发酵前后样品中挥发性成分指纹图谱对比
为了明确对比不同样品挥发性风味物质的变化程度与变化规律,采用了Dynamic PCA插件制作了指纹图谱(图5),使不同发酵阶段石榴酒样品之间的挥发性有机物差异更加便于观察比较。
在该指纹图谱中,每一列代表同一挥发性有机物在不同样品中的信号峰,每一行代表一个样品中选取的全部信号峰,从图中可以看出每种样品的完整挥发性有机物信息以及样品之间挥发性有机物的差异,图中数字代表迁移谱库中未定性的物质用数字代替。为了方便观察比较,将变化规律相似的物质排在一起比较,并将其分为A、B、C 3个区域。通过图5的指纹图谱可观察出3种样品的特征挥发性物质和在发酵过程中挥发性物质的变化规律。图中A区域物质显示1号样品(石榴果汁)的特征挥发性物质,在发酵过程中浓度降低或消失,主要有庚醛、壬醛和己醛等,而乙醇、乙酸乙酯、2-甲基-1-丙醇和3-甲基-1-丁醇等的浓度在发酵之后都有提升。图中B区域物质(乙酸丁酯、乙酸异丁酯、1-丙醇和乙酸异戊酯等)代表2号样品(发酵20 d石榴酒)的特征挥发性物质,其浓度远大于其他样品,主要是酯类物质。图中C区域物质(辛酸乙酯、乙酸、丁醇和乳酸乙酯等)代表3号样品(陈酿1年石榴酒)的特征挥发性物质,其在3号样品中的峰颜色明显较深,表明这些物质的含量高于其他样品。
在石榴酒中,庚醛、壬醛和己醛等醛类物质含量明显降低或消失,与此同时石榴酒中各种醇类物质含量增加。在发酵过程中有机酸被微生物大量合成,有机酸又与酒中的醇类物质发生酯化反应,生成多种酯类物质[17]。乙酸乙酯在石榴汁与石榴酒中均能被检测到,且具有明显的花果香(苹果香,菠萝香),是各种水果与花香的主要来源[18],经过发酵及陈酿后其在石榴酒中的含量也维持在较高水平。乙酸异戊酯具有香蕉香、苹果香、甜香等特征,是各种酒类中都存在的特征香气物质,其在石榴酒中也有一定含量[19]。乙酸异丁酯具有生梨、覆盆子香[19],在石榴汁中含量相对较低,其含量在发酵20 d时有明显增加,经过陈酿后含量减少约30%,其在发酵过程中增加又在陈酿过程中减少的特性与LI等[15]在白兰地的年龄与白兰地中挥发性物质的相关性研究中得到的结果相同,即随着陈酿的进行一些酯类物质的含量会随之减少,可能是由于酯交换以及乙酸异戊酯和乙酸异丁酯的易挥发特性所导致。丁酸乙酯、己酸乙酯等物质含量在陈酿后明显增加。中国黄酒与西方葡萄酒也是在陈酿中丰富其风味物质,WANG等[20]则将黄酒中风味物质的变化情况与陈酿年份结合,用以区分黄酒年龄。通过对比其他果酒风味物质研究结论发现,石榴酒中所含有的大量香气成分是在发酵过程中累积的[21]。

图5 GC-IMS 指纹图谱
Fig.5 GC-IMS fingerprint
2.4 石榴果酒主成分分析和指纹图谱相似度分析
为了更加直观地分析发酵前后石榴酒样品风味物质的差异,使用Dynamic PCA插件绘制样品的主成分分析图(图6),PC1和PC2的贡献解释了总变异的97%,1号样品在图的右侧,2号样品在图的左下方,3号样品在图的左上方,2号样品与3号样品在图中距离更近,表明其挥发性物质种类有很高的相似性,并且2、3号样品与1号样品可以明显地区分开来,证明其特征风味物质在发酵前后有明显的区别。由PCA图分析可知,石榴酒在发酵前后风味差异较大,其中发酵20 d的样品与陈酿1年的样品也有一定差别。

图6 主成分分析结果
Fig.6 Principal component analysis results
3 结论
本文采用GC-IMS技术,对比分析了3种不同发酵阶段的石榴酒中挥发性风味物质的迁移变化情况。3个样品共检测出74种挥发性成分,并定性了其36种成分,其中9对成分(2-甲基-1-丙醇、己醛、辛酸乙酯、3-甲基-1-丁醇、1-丙醇、3-甲基丁酸乙酯、2-甲基丁酸乙酯、乙酸异戊酯、丁醇)为其单体与二聚体或多聚体,构建了风味物质迁移指纹图谱。对其分析可知,石榴果汁发酵后,庚醛、壬醛和己醛等醛类物质浓度降低或消失,乙酸乙酯、乙醇、3-甲基-1-丁醇和2-甲基-1-丙醇等物质含量有明显升高。石榴酒发酵20 d和陈酿1年的挥发性物质的种类基本一致,其中乙酸异丁酯、乙酸异戊酯、乙酸丁酯等有所减少,但陈酿后丁酸乙酯、己酸乙酯等物质含量明显增加。
[1] 林雨晴,秦丹.石榴果酒营养成分及加工工艺进展[J].农产品加工,2018(13):44-46.
LIN Y Q,QIN D.Research progress in nutrient ingredients and processing technology of pomegranate wine[J].Farm Products Processing,2018(13):44-46.
[2] MENA P,GIRONÉS-VILAPLANA A,MART N,et al.Pomegranate varietal wines:Phytochemical composition and quality parameters[J].Food Chemistry,2012,133(1):108-115.
N,et al.Pomegranate varietal wines:Phytochemical composition and quality parameters[J].Food Chemistry,2012,133(1):108-115.
[3] 杨彬彬.我国石榴浓缩汁的产业现状及发展趋势[J].陕西农业科学,2009,55(1):94-96.
YANG B B.The current situation and development trend of our country’s pomegranate juice concentrate[J].Shaanxi Journal of Agricultural Sciences,2009,55(1):94-96.
[4] FERRARA G,CAVOSKI I,PACIFICO A,et al.Morpho-pomological and chemical characterization of pomegranate(Punica granatum L.) genotypes in Apulia region,Southeastern Italy[J].Scientia Horticulturae,2011,130(3):599-606.
[5] MENA P,GIRONES-VILAPLANA A,MORENO D A,et al.Phenolic composition of pomegranate wines.Influence of variety and winemaking stage[C]//5th International Conference on Polyphenols and Health(ICPH).Sitges(Spain).2011.
[6] ANDREU-SEVILLA A J,MENA P,MARTI N,et al.Volatile composition and descriptive sensory analysis of pomegranate juice and wine[J].Food Research International,2013,54(1):246-254.
[7] 兰永丽.石榴酒及石榴乳酸饮料发酵工艺优化及其风味和抗氧化性研究[D].杨凌:西北农林科技大学,2017.
LAN Y L.Study on fermentation process and flavor and antioxidant quality of pomegranate wine and pomegranate lactic acid drink[D].Yangling,China:Northwest A & F University,2017.
[8] 姚文生,蔡莹暄,刘登勇,等.不同材料熏制鸡腿肉挥发性物质GC-IMS指纹图谱分析[J].北京工商大学学报(自然科学版),2019,37(6):37-45.
YAO W S,CAI Y X,LIU D Y,et al.GC-IMS fingerprint analysis of volatile substances in chicken thighs smoked from different materials[J].Journal of Food Science and Technology,2019,37(6):37-45.
[9] COHEN M J,KARASEK F W.Plasma chromatographyTM—A new dimension for gas chromatography and mass spectrometry[J].Journal of Chromatographic Science,1970,8(6):330-337.
[10] 周晨曦,郑福平,孙宝国.离子迁移谱技术在食品风味分析中的应用研究进展[J].食品工业科技,2019,40(18):309-318.
ZHOU C X,ZHENG F P,SUN B G.Research progress on the application of ion mobility spectrometry(IMS) in food flavor analysis[J].Science and Technology of Food Industry,2019,40(18):309-318.
[11] 陈东杰,张明岗,聂小宝,等.基于气相离子迁移谱检测静电场处理的大菱鲆品质[J].食品科学,2019,40(24):313-319.
CHEN D J,ZHANG M G,NIE X B,et al.Quality detection of turbot(Scophtalmus maximus) treated with electrostatic field using gas chromatography-ion mobility spectrometry[J].Food Science,2019,40(24):313-319.
[12] GARRIDO-DELGADO R,DOBAO-PRIETO M D M,ARCE L,et al.Determination of volatile compounds by GC-IMS to assign the quality of virgin olive oil[J].Food Chemistry,2015,187:572-579.
[13] 唐柯,王茜,周霞,等.石榴酒发酵过程中香气动态变化规律[J].食品与发酵工业,2019,45(6):197-202;214.
TANG K,WANG X,ZHOU X,et al.Dynamic changes in aroma during pomegranate wine fermentation[J].Food and Fermentation Industries,2019,45(6):197-202;214.
[14] 彭潇,邹文静,邵清清,等.石榴酒发酵过程中真菌种群演替及风味物质代谢规律解析[J].食品科学,2021,42(6):157-163.
PENG X,ZOU W J,SHAO Q Q,et al.Fungal community succession and flavor compounds metabolism during pomegranate wine fermentation[J].Food Science,2021,42(6):157-163.
[15] LI S Y,YANG H F,TIAN H H,et al.Correlation analysis of the age of brandy and volatiles in brandy by gas chromatography-mass spectrometry and gas chromatography-ion mobility spectrometry[J].Microchemical Journal,2020,157:104948.
[16] 李美萍,苗潇潇,张生万.HS-SPME-GC-MS分析石榴酒中易挥发性成分[J].食品科学,2014,35(8):263-268.
LI M P,MIAO X X,ZHANG S W.Analysis of volatile compounds in pomegranate wine by headspace solid phase micro-extraction and gas chromatography-mass spectrometry[J].Food Science,2014,35(8):263-268.
[17] JIN G Y,ZHU Y,XU Y.Mystery behind Chinese liquor fermentation[J].Trends in Food Science & Technology,2017,63:18-28.
[18] 王磊.GC-MS、GC-O和感官鉴定对六种白兰地挥发性成分和香气成分差异研究[D].烟台:烟台大学,2010.
WANG L.Difference of volatile compounds and aroma compounds in six brandies by GC-MS,GC-O and sensory evaluation[D].Yantai,China:Yantai University,2010.
[19] 张宝香,舒楠,金宇宁,等.不同果胶酶处理北冰红冰葡萄汁酿制北冰红冰酒香气成分分析[J].酿酒科技,2020(12):38-43.
ZHANG B X,SHU N,JIN Y N,et al.Analysis of aroma components of Beibing red ice wine brewed from Beibing red ice grape juice with different pectinase[J].Liquor-Making Science & Technology,2020(12):38-43.
[20] WANG N,CHEN S,ZHOU Z M.Characterization of volatile organic compounds as potential aging markers in Chinese rice wine using multivariable statistics[J].Journal of the Science of Food and Agriculture,2019,99(14):6 444-6 454.
[21] 杨颖迪,李闽,彭帮柱.苹果酒香气成分代谢研究进展[J].食品工业科技,2018,39(19):314-320.
YANG Y D,LI M,PENG B Z.Research on the metabolism of aroma components in apple cider[J].Science and Technology of Food Industry,2018,39(19):314-320.