多酚是广泛存在于植物中的一类具有多元酚结构的次生代谢物,具有抗氧化、调节血脂水平、预防心血管疾病、抗炎、防癌、促进肠道健康等生物活性功效[1]。随着消费者对食品健康功效的需求日益增长,植物多酚在各类健康食品中得到广泛的应用。然而,多酚易被氧化且稳定性差,导致其稳定性和利用率较低[2]。因此,提高多酚的稳定性和利用率成为食品加工领域的研究热点之一。纤维素是植物细胞壁的主要成分,是一种由葡萄糖组成的化学组分单一、结构明确的大分子多糖。纤维素是自然界中来源广泛的膳食纤维,具有不被消化酶降解、不被小肠吸收等特点[3]。研究表明,天然纤维素可吸附植物多酚,并作为其保护性载体起到提高多酚稳定性和利用率的作用[4-5]。近年来,随着肠道菌群与人体健康关系的明确,膳食纤维对多酚的吸附能力也被认为是膳食纤维的一项重要生理功能[6]。多项研究发现膳食纤维与多酚结合形成的复合物可保护多酚达到结肠,与膳食纤维一起被肠道微生物吸收与利用,进而发挥其对人体的健康功效。近年来,越来越多的研究对纤维素进行改性处理或化学修饰,以进一步提高纤维素对多酚的吸附和递送能力。本文综述了纤维素与植物多酚的相互作用机制、影响因素及对多酚功能活性影响的研究进展,并探讨分析纤维素与多酚相互作用在健康食品加工中的研究趋势和应用潜力。
1 多酚与纤维素概述
1.1 多酚
植物多酚以苯酚为基本骨架,以苯环的多羟基取代为特征,是广泛存在于茶叶、蔬菜、水果等植物中的具有多元酚结构的次生代谢物。多元酚结构使多酚类化合物具有一系列独特的化学性质,如消毒杀菌、抗氧化性、与蛋白质等物质结合、与多种金属离子及其化合物发生螯合反应等[1]。同时,植物多酚中含有丰富的酚羟基,可以通过氢键、疏水键或者共价键与高分子化合物接枝、共聚或共混。然而,多酚的稳定性相对较差,易受到温度、光照、氧、pH等环境因素影响,发生氧化、分解等反应,使其原有的结构和活性受到改变而失去生理活性。同时,多酚的生物利用度也比较低,在进入人体后只有少部分被吸收利用,其余大部分在进入肠道后发生降解,无法到达作用靶点发挥其生理作用[7]。因此如何有效提高植物多酚的稳定性和生物利用率是当前健康食品研发领域的重要方向之一。
1.2 纤维素
膳食纤维是指在人体小肠内不会被消化酶水解,在大肠内可部分或全部发酵的多糖类大分子的总和[8]。按照溶解性膳食纤维可分为水溶性膳食纤维和水不溶性膳食纤维两大类,水溶性膳食纤维主要包括果胶、葡聚糖等,水不溶性膳食纤维主要包括纤维素、半纤维素、壳聚糖等[9]。其中,纤维素作为水不溶性膳食纤维的主要组成部分,是地球上最丰富的天然可再生资源,可从笋壳、花生壳、豆渣等多种农产废弃料中提取[10]。纤维素是由D-吡喃葡萄糖环经β-1,4糖苷键,以C1椅式构象联结而成的线性高分子,其分子内部多个葡萄糖基环上均含有羟基,使得其分子之间、分子内部或纤维素与水之间都可以形成氢键,而氢键又决定了纤维素具有可及性、结晶性、化学活性等特殊性能。纤维素的结构通常分为3层,分别为:单分子层、超分子层与原纤结构层。而纤维素原纤作为细小、伸展的单元,构成了纤维素的主体[11]。
研究表明,纤维素对人体健康有重要作用。人体缺乏纤维素酶,无法对纤维素进行消化、吸收与利用,因此纤维素在肠胃道内具有一定稳定性。但由于纤维素的吸水性,其在肠道内吸水膨胀不仅可以对肠内容物进行稀释,改善肠道菌群环境,还可以促进肠道蠕动,利于粪便排泄,预防肠道肿瘤的发生,同时可以平抑血糖和血脂水平[12]。纤维素不仅是主要的膳食纤维来源,在食品加工应用中还具有生物可降解性、安全无毒、来源广泛、制备成本低等优点。
2 纤维素与多酚的互作机制
纤维素和多酚是水果、蔬菜等植物源食物中广泛存在的功能性成分,纤维素与多酚结合后所形成的复合物可保护多酚在人体消化道内不受环境的破坏,顺利达到胃肠道的下部,并在结肠中释放出来,发挥有益作用,与纤维素一起被肠道微生物吸收利用[13-14]。近年来随着肠道菌群与人体健康关系的日益明确及结肠功能性食品研发的升温,纤维素作为多酚的食品级活性成分输送系统,可实现多酚的控制释放与结肠靶向运输。
纤维素在分子间易形成氢键,这是其能与多酚发生相互作用的基础。纤维素与多酚的相互作用受非共价结合的调节,主要是物理结合,不伴随化学反应。非共价相互作用是指生物大分子与特异性生物活性小分子以氢键、离子键、范德华力及疏水相互作用等非共价作用力结合,其相互作用的键能较弱,比共价键小1~2数量级,但分子间的弱缔合驱动力在一定条件下可发生协同作用,形成具有定向性和选择性的强驱动力[15],可以通过等温模型描述其作用过程。PHAN等[16]研究发现纤维素与儿茶素、绿原酸、矢车菊素-3-O葡萄糖苷等多酚之间的相互作用均以非共价结合为主。研究表明,纤维素与多酚相互作用的本质为疏水相互作用与氢键介导的非共价作用[17-19]。纤维素与多酚表面共同存在羟基,有利于氢键的形成[20]。如图1-a所示,氢键一般形成于纤维素糖苷键的氧原子与多酚的羟基之间[21],使分子间距离缩短,有利于范德华力的产生。疏水相互作用指的是水与水不溶性分子(非极性分子)之间的相互作用,不溶于水的分子会聚集在一起产生较低的表面势能,从而尽可能地减少与水的接触。纤维素与大多数多酚都不溶于水,聚集会导致疏水相互作用。疏水相互作用是纤维素与多酚结合的主要驱动力,并且多酚具有的疏水芳香环会促进疏水相互作用的发生[19]。
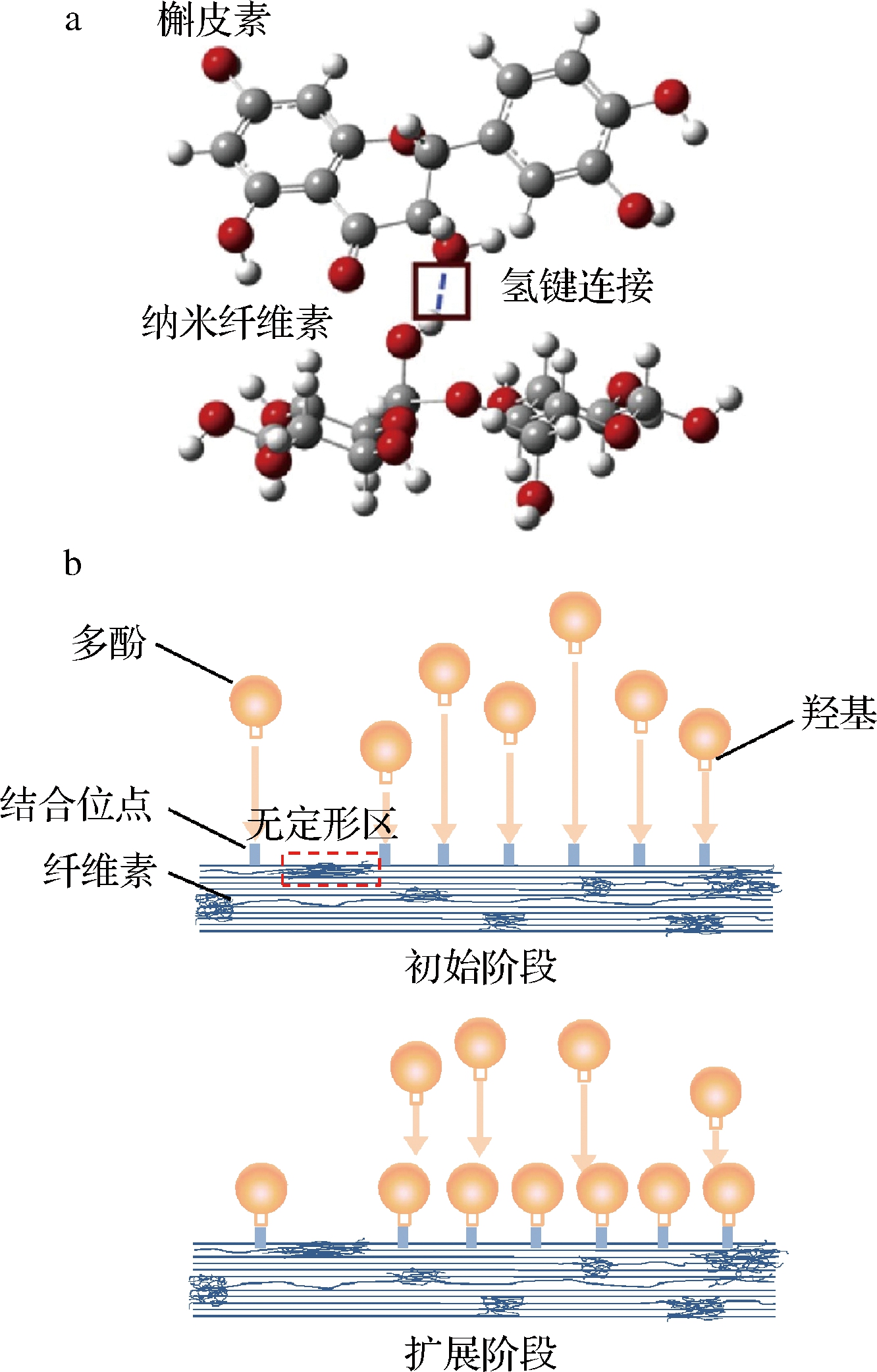
a-纳米纤维素通过氢键结合与槲皮素相互作用[22];
b-多酚在纤维素上的结合的初始和扩展阶段
图1 纤维素与多酚互作示意图
Fig.1 Schematic representation of the interaction between
cellulose and polyphenols
纤维素是一种表面多羟基极性强的聚合物,其羟基中氧原子的孤对电子可与水分子中的氢原子相互吸引形成氢键,在疏水作用的驱动下,多酚与纤维素表面结合位点进行接触,而氢键会促进其结合更加紧密[19,22]。纤维素结构包括纤维素结晶和无定形区,纤维素表面的结合位点存在于纤维素结晶上,多酚的吸附通常不发生在无定形区域。纤维素对多酚的吸附分为自发快速的初始阶段与平稳而且缓慢的扩展阶段[23]。在结合的初始阶段,由于纤维素表面的结合位点数量充足,部分酚类物质可迅速地与其结合;在结合的扩展阶段,位点的饱和导致两者结合较为缓慢,未结合的多酚会在结合物表面发生缔合堆叠导致结合能力受限[24](图1-b)。
3 纤维素与多酚互作的影响因素
3.1 纤维素结构的影响
在食品的加工过程中,由物理作用引起的纤维素结构变化会影响纤维素与多酚的结合。LIU等[25]发现对纤维素进行冷冻干燥处理会显著降低其与多酚的结合能力。这是由于微纤维内的大部分水分子被去除,其网络结构变得更加密集,同时纤维素分子的羟基可用性受到影响,导致结合位点数量的降低。此外,将冻干处理的纤维素复水后再次与多酚进行结合,发现其结合能力稍有提升,这表明纤维素网络发生溶胀,有助于纤维素与多酚的结合。
3.2 多酚物质结构与分子质量的影响
多酚物质的分子构象是影响纤维素与其结合的一个重要因素,多酚分子适当的羟基化有利于两者结合。WANG等[26]通过比较肉桂酸的羟基同分异构体对膳食纤维的结合水平,发现邻羟基肉桂酸的结合水平明显高于间羟基肉桂酸与对羟基肉桂酸。FERNANDES等[27]研究表明,分子结构中含有3个羟基基团的多酚,具有更强的分子亲和力,更易于结合的发生;而当酚类物质具有的羟基数量超过4个时,分子间的空间位阻被过多增加,不利于两者结合[26]。多酚分子的酰基化能促进纤维素对其的吸附作用,比起未酰基化的花青素,酰基化处理后的花青素在纤维素上的吸附程度更高[24]。而甲基化、甲氧基化的多酚分子则会降低其在膳食纤维中的吸附能力[26]。
多酚的分子质量与聚合度是影响两者相互作用的另一个因素。PADAYACHEE等[14]研究比较了不同分子质量多酚的吸附能力,结果表明分子质量与结合水平正相关,原因在于分子质量增加,邻位酚组和芳香环的结合位点增多,能促进氢键的形成与疏水相互作用的发生。BOURVELLEC等[28]发现除了分子质量的影响之外,多酚的聚合度也与其对膳食纤维的亲和力正相关。聚合度较低的多酚分子易发生自交联,从而限制其与膳食纤维的结合[29],但与分子质量的影响程度相比,聚合度对两者相互作用的影响相对轻微。
3.3 环境因素的影响
食物在体内的消化或食品的加工过程中,pH值、温度与离子强度的变化均会影响纤维素与多酚的非共价结合。
pH值是环境因素中影响两者结合的最主要因素。COSTA等[30]发现pH值(2.0~7.0)是影响纤维素与儿茶素、咖啡酸、阿魏酸等酚类结合的首要因素,pH 2.0时达到吸附的最大程度。有研究表明,多酚在较低pH值下更加稳定[31],pH值影响了多酚的稳定性,从而使两者结合受到影响[18]。而不同多酚在不同的pH条件下结合情况不同,例如花青素在pH 3.6时与膳食纤维的亲和力最强[32],而提高pH值又有利于阿魏酸与膳食纤维的相互作用[33],这与每种多酚个体在不同pH值下的稳定情况有关。pH值除了会影响多酚的稳定性进而影响两者作用外,还会影响纤维素中质子化与去质子化的官能团数量的比值[25]。当pH值增加时该比值也增加,导致分子间排斥力与吸引力受影响,从而影响相互作用。
温度是影响酚类物质与纤维素等多糖类物质结合的另一个关键因素。PHAN等[18]发现温度的升高会导致两者结合力下降;LIU等[34]发现反应温度从27 ℃升高至42 ℃,会明显降低儿茶素对纤维素的结合作用。因为温度升高会减弱两者的非共价相互作用,主要是影响了氢键作用,不利于结合。
离子强度也会影响纤维素与多酚物质的相互作用。BOURVELLEC等[35]研究了离子浓度对膳食纤维与花青素结合的影响,发现当离子浓度逐渐提升至1 mol/L时,多酚对膳食纤维的吸附力也随之提升,离子强度的升高可增强静电作用,使结合更加紧密。ZAINUDDIN等[36]在溶液中加入了十六烷基三甲基溴化铵等离子表面活性剂,有效提升了纳米纤维素与姜黄素的结合效率。此外,FOO等[37]使用单宁酸和癸胺等离子活性剂也得出了类似的研究结论。主要是由于活性剂的加入使得纳米纤维素表面改性,结合位点增加,有利于疏水相互作用。除此之外,在溶液中加入乙醇、二氧杂环乙烷等溶剂会降低溶液的极性而减弱二者的结合作用;加入尿素则会破坏氢键作用,抑制多酚的结合[28],不利于相互作用。
4 提高纤维素对多酚吸附作用的研究进展
近年来,利用纤维素对多酚的吸附作用形成纤维素/多酚稳定复合物,逐渐成为开发新型健康食品的研究热点。然而,天然纤维素对多酚的吸附能力和负载率有限,且在食品当中添加过量纤维素对食品品质易造成不利的影响。这些因素都在一定程度上限制了纤维素作为多酚保护性载体的应用,为进一步发挥纤维素来源广泛和生物安全性高的优势,克服其作为载体的局限性,大量研究测定了纤维素与不同多酚互作的效果并分析互作机理(表1)。纤维素(含纳米纤维素)、纤维素衍生物及植物细胞壁与多酚的互作方式均为疏水相互作用、氢键等非共价作用结合,要克服纤维素自身缺点并提高其对多酚的吸附作用,最直接的方式即为优化纤维素的粒径换和增加纤维素载体的结合位点。
前期研究表明,对以纤维素为主的植物膳食纤维进行改性处理,可显著改变膳食纤维的粒径,进而提高其吸附能力[38-39]。近年来,纳米技术在食品中的创新应用已成为现代食品科学的研究前沿,其中纳米级纤维素在食品工业中表现出巨大的应用潜力[40]。农产品加工副产物中往往含有丰富的纤维素,通过化学或物理方法破坏纤维素中的无定形区,可制备成纳米纤维素(cellulose nanofiber,CNF)以及纳米纤维素晶体(nanocrystalline cellulose,NCC)等。相对于天然纤维素,CNF具有高比表面积、丰富的表面羟基等优点,不仅可提高对多酚的结合效率和保护作用,还可进一步对其表面进行化学修饰,促进对多酚的保护和递送能力。LI等[22]以CNF作为载体与槲皮素相互作用,通过优化溶液组分配比和制备工艺,得到稳定的CNF/槲皮素复合物。研究结果表明,CNF对槲皮素的负载率和包埋率分别达到了78.91%和88.77%。与对照槲皮素相比,CNF/槲皮素复合物具有更强的抗氧化活性与持续释放能力,同时也保护了槲皮素在肠胃道中的稳定性。FOO等[37]用油棕加工废弃物为原料制备杆状NCC(直径13~30 nm,长150~360 nm),并通过单宁酸和癸胺对NCC进行表面化学修饰,使得其对脂溶性的姜黄素也有良好的吸附作用,修饰后的NCC对姜黄素的结合率最高可达99%,约为未修饰NCC的最高结合率(54%)的2倍。纤维素衍生物也可作为载体与多酚结合。LIU等[41]以纤维素、甲基纤维素、乙基纤维素为载体,通过等温模型拟合发现纤维素的吸附能力随着其侧链的增加而增大。综上所述,当纤维素的粒径降低至纳米级后,虽然其与多酚结合的互作模式未发生改变,但是CNF和NCC表面上结合位点的增加使得对多酚的负载率显著提升。同时,对CNF的化学修饰还能进一步提高其对脂溶性多酚吸附能力。
表1 纤维素与不同多酚的相互作用的研究
Table 1 Studies on the interactions between cellulose and various polyphenols
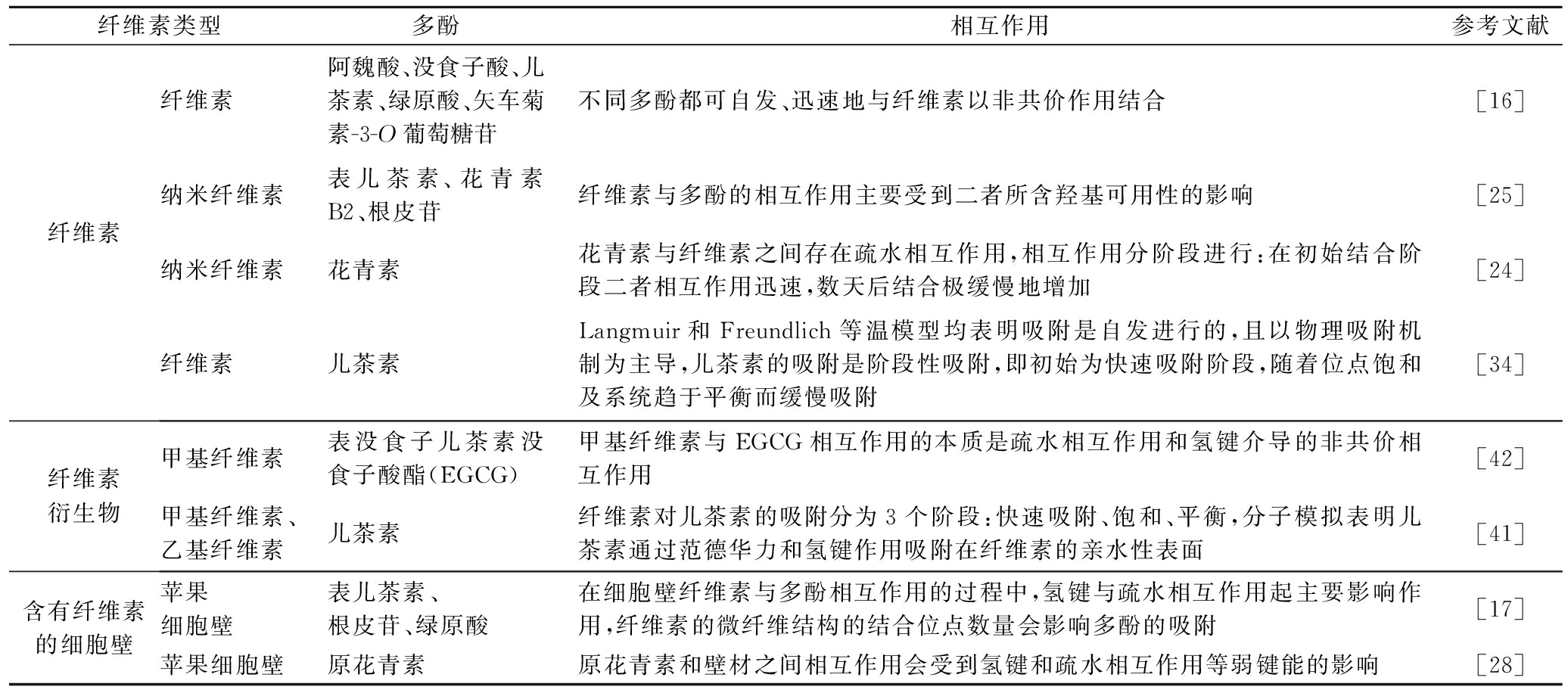
纤维素类型多酚相互作用参考文献纤维素纤维素阿魏酸、没食子酸、儿茶素、绿原酸、矢车菊素-3-O葡萄糖苷不同多酚都可自发、迅速地与纤维素以非共价作用结合[16]纳米纤维素表儿茶素、花青素B2、根皮苷纤维素与多酚的相互作用主要受到二者所含羟基可用性的影响[25]纳米纤维素花青素花青素与纤维素之间存在疏水相互作用,相互作用分阶段进行:在初始结合阶段二者相互作用迅速,数天后结合极缓慢地增加[24]纤维素儿茶素Langmuir和Freundlich等温模型均表明吸附是自发进行的,且以物理吸附机制为主导,儿茶素的吸附是阶段性吸附,即初始为快速吸附阶段,随着位点饱和及系统趋于平衡而缓慢吸附[34]纤维素衍生物甲基纤维素表没食子儿茶素没食子酸酯(EGCG)甲基纤维素与EGCG相互作用的本质是疏水相互作用和氢键介导的非共价相互作用[42]甲基纤维素、乙基纤维素儿茶素纤维素对儿茶素的吸附分为3个阶段:快速吸附、饱和、平衡,分子模拟表明儿茶素通过范德华力和氢键作用吸附在纤维素的亲水性表面[41]含有纤维素的细胞壁苹果细胞壁表儿茶素、根皮苷、绿原酸在细胞壁纤维素与多酚相互作用的过程中,氢键与疏水相互作用起主要影响作用,纤维素的微纤维结构的结合位点数量会影响多酚的吸附[17]苹果细胞壁原花青素原花青素和壁材之间相互作用会受到氢键和疏水相互作用等弱键能的影响[28]
5 纤维素与多酚相互作用对多酚特性的影响
越来越多的研究表明,当纤维素与多酚通过非共价结合形成稳定复合物后,可对多酚的稳定性、功能活性和生物利用率等可发生积极的影响(表2)。
5.1 对多酚稳定性的影响
多酚具有许多生理活性,但易受温度、光照、氧、pH 等因素影响,发生氧化、分解等反应,使其稳定性降低,而无法良好的发挥自身的功能活性。同时,由于人体内消化道环境复杂多变,多酚无法在胃肠道内保持相对的稳定性。研究表明在多酚体系中加入纤维素,可有效改善多酚的稳定性[4,22,43]。多酚稳定性的增强主要是由于纤维素本身带负电荷,在多酚中加入纤维素可提升多酚颗粒的分散性,并且纤维素作为保护性载体可使多酚有效避免温度、光照等环境因素对其稳定性的破坏。
5.2 对多酚功能活性的影响
多酚本身具有许多利于机体的功能特性,但由于其性质不稳定,纤维素在此充当一个保护性载体,有效阻止消化过程中酶对多酚的反应,使其能顺利被运送至肠道[5]。纤维素与多酚相互作用可提高多酚抗氧化、抑菌、抗肿瘤等功能活性。纤维素与槲皮素、EGCG、儿茶素等多酚结合后具有更强的协同抗氧化能力,更有效的阻断自由基反应[4,22,42]。纤维素-多酚复合物在大肠消化阶段被释放,并参与代谢,复合物可有效抑制病菌的生长,调节肠道内菌群平衡[44]。GEORGE等[45]通过体外研究证明纤维素-多酚复合物可抑制金黄色葡萄球菌的生长。GIL-S NCHEZ等[46]研究表明,在膳食纤维与多酚的共同影响下,肠道内乳酸菌群数量增加,同时也增加了结肠内产生的短链脂肪酸,其对肠道健康有重要作用。与膳食纤维结合后的多酚对动物体内黑色素瘤内肿瘤有抑制作用,同时也可抑制人类白血病和宫颈癌细胞的增殖[47]。在多酚与膳食纤维结合后,膳食纤维使其溶液分散性增强、溶解性增加,并减少了多酚的结晶,有利于多酚更有效发挥本身的功效。
NCHEZ等[46]研究表明,在膳食纤维与多酚的共同影响下,肠道内乳酸菌群数量增加,同时也增加了结肠内产生的短链脂肪酸,其对肠道健康有重要作用。与膳食纤维结合后的多酚对动物体内黑色素瘤内肿瘤有抑制作用,同时也可抑制人类白血病和宫颈癌细胞的增殖[47]。在多酚与膳食纤维结合后,膳食纤维使其溶液分散性增强、溶解性增加,并减少了多酚的结晶,有利于多酚更有效发挥本身的功效。
5.3 对多酚生物利用率的影响
体外消化研究表明,纤维素的存在会降低多酚在小肠的生物可及性并延缓了其在上消化道的释放,但是会使其更易到达消化道下部,在结肠发挥作用[43]。BOURVELLEC等[48]发现膳食纤维可充当多酚的保护性载体,限制酚类物质在消化道上部的释放,进而到达结肠,同时充当可将多酚转化为活性物质的结肠微生物的养分。多酚的生物利用度与纤维素的粒径大小与含量有重要关联,纤维素含量越高,生物利用率越小;纤维素粒径越小,生物利用率越高。
表2 纤维素与多酚相互作用对多酚的增效作用
Table 2 Synergistic effect of interaction on polyphenols
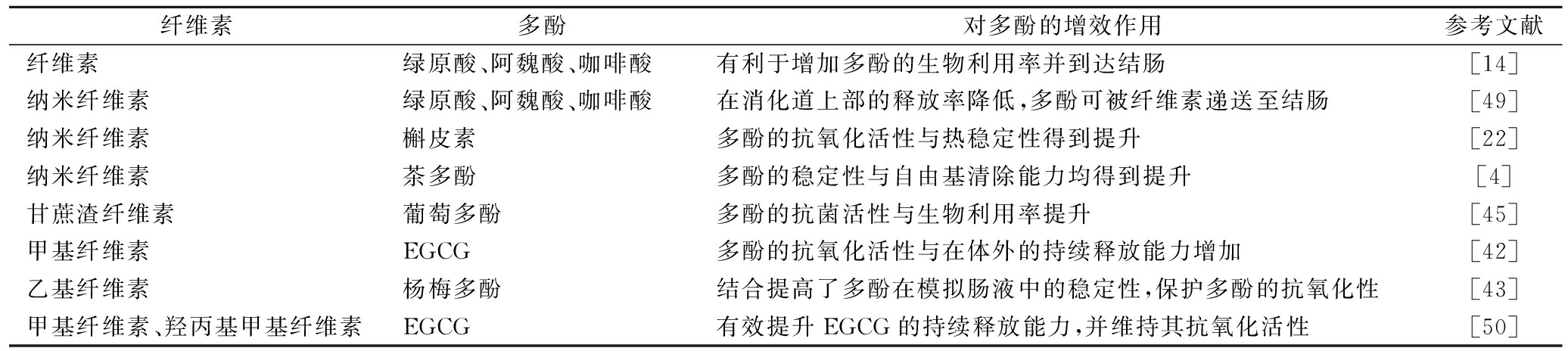
纤维素多酚对多酚的增效作用参考文献纤维素绿原酸、阿魏酸、咖啡酸有利于增加多酚的生物利用率并到达结肠[14]纳米纤维素绿原酸、阿魏酸、咖啡酸在消化道上部的释放率降低,多酚可被纤维素递送至结肠[49]纳米纤维素槲皮素多酚的抗氧化活性与热稳定性得到提升[22]纳米纤维素茶多酚多酚的稳定性与自由基清除能力均得到提升[4]甘蔗渣纤维素葡萄多酚多酚的抗菌活性与生物利用率提升[45]甲基纤维素EGCG多酚的抗氧化活性与在体外的持续释放能力增加[42]乙基纤维素杨梅多酚结合提高了多酚在模拟肠液中的稳定性,保护多酚的抗氧化性[43]甲基纤维素、羟丙基甲基纤维素EGCG有效提升EGCG的持续释放能力,并维持其抗氧化活性[50]
6 结论与展望
本文针对近年来关于纤维素与多酚互作机制的研究进展进行综述,大量研究明确了二者之间主要是通过氢键、疏水相互作用、离子键等非共价作用机制而进行的自发快速结合反应,并分析了影响其相互作用的多种因素,包括纤维素与多酚的结构、环境因素等。一些研究还通过优化纤维素的粒径、增加结合位点以及对纤维素进行化学修饰等方法,进一步提升纤维素作为多酚的天然载体和稳定剂的功效。
纤维素与多酚形成的复合物可保护多酚免受环境影响,提高其稳定性,并可靶向递送至人体结肠组织,同时纤维素具有较好的安全性和肠道稳定性,使其与多酚协同发挥对肠道菌群的有益作用,进而促进人体健康。
综合以上有益因素,可将纤维素/多酚复合物作为新型食品添加剂或复配功能因子,利用纤维素自身可作为食品稳定剂、乳化剂及脂肪替代品的特点,结合多酚物质的功能活性,在食品加工中同时做到提升口感、品质和食品的功能性、健康性,以用于在预防和治疗高血脂等有关疾病的功能性食品中发挥功效。因此,纤维素与多酚的互作对食品加工、人类健康等方面的应用具有重要意义。
然而,目前在纤维素与多酚的互作机理研究与应用领域虽然已取得了显著的成果,但仍有一些问题需要进一步研究和阐明:纤维素与多酚相互作用的分子机制,包括分子结合位点和具体的连接方式,还有待于进一步确定;探索如何更加灵活和有效地控制复合物中多酚的缓释,合理利用载体的保护并充分发挥其功能活性;由于人体消化代谢过程的复杂性,纤维素与多酚复合物的协同增效作用对人体健康,特别是肠道环境与菌群结构的影响,还需进一步的研究。
[1] 赵扬帆,郑宝东.植物多酚类物质及其功能学研究进展[J].福建轻纺,2006(11):107-110.
ZHAO Y F,ZHENG B D.Research progress on plant polyphenols and their functions[J].The Light & Textile Industries of Fujian,2006(11):107-110.
[2] 张杨波,饶甜甜,刘仲华.茶多酚的抗癌作用机制及EGCG纳米载体技术研究进展[J].食品工业科技,2019,40(16):343-348.
ZHANG Y B,RAO T T,LIU Z H.Research progress on the anticancer mechanism of tea polyphenol and EGCG nanocarrier technology.[J].Science and Technology of Food Industry,2019,40(16):343-348.
[3] 唐丽荣,黄彪,李涛,等.功能化修饰纳米纤维素的结肠靶向给药载体[J].科技导报,2014,32(4):22-28.
TANG L R,HUANG B,LI T,et al.Functionalized Cellulose Nanocrystals as a Carrier for Colon-targeted Drug Delivery System.[J].Science & Technology Review,2014,32(4):22-28.
[4] SUN B,ZHANG M,NI Y H.Use of sulfated cellulose nanocrystals towards stability enhancement of gelatin-encapsulated tea polyphenols[J].Cellulose,2018,25(9):5 157-5 173.
[5] PALAFOX-CARLOS H,AYALA-ZAVALA J F,GONZ LEZ-AGUILAR G A.The role of dietary fiber in the bioaccessibility and bioavailability of fruit and vegetable antioxidants[J].Journal of Food Science,2011,76(1):R6-R15.
LEZ-AGUILAR G A.The role of dietary fiber in the bioaccessibility and bioavailability of fruit and vegetable antioxidants[J].Journal of Food Science,2011,76(1):R6-R15.
[6] RENARD C M,WATRELOT A A,BOURVELLEC C L.Interactions between polyphenols and polysaccharides:Mechanisms and consequences in food processing and digestion[J].Trends in Food Science & Technology,2017(60):43-51.
[7] 祁洁,徐颖磊,梁文怡,等.EGCG纳米载体制备技术及其对EGCG活性影响的研究进展[J].茶叶科学,2017,37(2):119-129.
QI J,XU Y L,LIANG W Y,et al.Progress on the preparation technologies and the active improvement of EGCG nano-carriers[J].Journal of Tea Science,2017,37(2):119-129.
[8] 扈晓杰,韩冬,李铎.膳食纤维的定义、分析方法和摄入现状[J].中国食品学报,2011,11(3):133-137.
HU X J,HAN D,LI D.The definition,analytic methods and intake status of dietary fiber[J].Journal of Chinese Institute of Food Science and Technology,2011,11(3):133-137.
[9] 刘伟,刘成梅,林向阳.膳食纤维的国内外研究现状与发展趋势[J].粮食与食品工业,2003,10(4):25-27.
LIU W,LIU C M,LIN X Y.Present situation and prospect of studies on dietary fiber home and abroad[J].Cereal & Food Industry,2003,10(4):25-27.
[10] 王阳,赵国华,肖丽,等.源于食品加工副产物纳米纤维素晶体的制备及其在食品中的应用[J].食品与机械,2017,33(2):1-5;38.
WANG Y,ZHAO G H,XIAO L,et al.Preparation of nanocrystalline cellulose from food by-product and its application in food industry[J].Food & Machinery,2017,33(2):1-5;38.
[11] 叶代勇,黄洪,傅和青,等.纤维素化学研究进展[J].化工学报,2006,57(8):1 782-1 791.
YE D Y,HUANG H,FU H Q,et al.Advances in cellulose chemistry[J].Journal of Chemical Industry and Engineering(China),2006,57(8):1 782-1 791.
[12] 刘成梅,李资玲,梁瑞红,等.膳食纤维的生理功能与应用现状[J].食品研究与开发,2006,27(1):122-125.
LIU C M,LI Z L,LIANG D H,et al.The application actuality and physiological function of dietary fiber[J].Food Research and Development,2006,27(1):122-125.
[13] MAURER L H,CAZARIN C B B,QUATRIN A,et al.Grape peel powder promotes intestinal barrier homeostasis in acute TNBS-colitis:A major role for dietary fiber and fiber-bound polyphenols[J].Food Research International,2019,123:425-439.
[14] PADAYACHEE A,NETZEL G,NETZEL M,et al.Binding of polyphenols to plant cell wall analogues-Part 2:Phenolic acids[J].Food Chemistry,2012,135(4):2 287-2 292.
[15] 李锐,任海平,孙艳亭,等.小分子与生物大分子间非共价相互作用分析方法研究进展[J].分析化学,2006,34(12):1 801-1 806.
LI R,REN H P,SUN Y T,et al.Advances in non-covalent interaction analysis methods between small molecules and biomacromolecules[J].Chinese Journal of Analytical Chemistry,2006,34(12):1 801-1 806.
[16] PHAN A D T,NETZEL G,WANG D J,et al.Binding of dietary polyphenols to cellulose:Structural and nutritional aspects[J].Food Chemistry,2015,171:388-396.
[17] LIU D J,LOPEZ-SANCHEZ P,MARTINEZ-SANZ M,et al.Adsorption isotherm studies on the interaction between polyphenols and apple cell walls:Effects of variety,heating and drying[J].Food Chemistry,2019,282:58-66.
[18] PHAN A D T,D’ARCY B R,GIDLEY M J.Polyphenol-cellulose interactions:Effects of pH,temperature and salt[J].International Journal of Food Science & Technology,2016,51(1):203-211.
[19] RENARD C M G C,BARON A,GUYOT S,et al.Interactions between apple cell walls and native apple polyphenols:Quantification and some consequences[J].International Journal of Biological Macromolecules,2001,29(2):115-125.
[20] WU Z,LI H,MING J,et al.Optimization of adsorption of tea polyphenols into oat β-glucan using response surface methodology[J].Journal of Agricultural and Food Chemistry,2011,59(1):378-385.
[21] QUIR S-SAUCEDA A E,PALAFOX-CARLOS H,S
S-SAUCEDA A E,PALAFOX-CARLOS H,S YAGO-AYERDI S G,et al.Dietary fiber and phenolic compounds as functional ingredients:Interaction and possible effect after ingestion[J].Food & Function,2014,5(6):1 063-1 072.
YAGO-AYERDI S G,et al.Dietary fiber and phenolic compounds as functional ingredients:Interaction and possible effect after ingestion[J].Food & Function,2014,5(6):1 063-1 072.
[22] LI X H,LIU Y Z,YU Y Y,et al.Nanoformulations of quercetin and cellulose nanofibers as healthcare supplements with sustained antioxidant activity[J].Carbohydrate Polymers,2019,207:160-168.
[23] JAKOBEK ![]() P.Non-covalent dietary fiber-Polyphenol interactions and their influence on polyphenol bioaccessibility[J].Trends in Food Science & Technology,2019,83:235-247.
P.Non-covalent dietary fiber-Polyphenol interactions and their influence on polyphenol bioaccessibility[J].Trends in Food Science & Technology,2019,83:235-247.
[24] PADAYACHEE A,NETZEL G,NETZEL M,et al.Binding of polyphenols to plant cell wall analogues-Part 1:Anthocyanins[J].Food Chemistry,2012,135(4):155-161.
[25] LIU D J,MARTINEZ-SANZ M,LOPEZ-SANCHEZ P,et al.Adsorption behaviour of polyphenols on cellulose is affected by processing history[J].Food Hydrocolloids,2017,63:496-507.
[26] WANG Y X,LIU J,CHEN F,et al.Effects of molecular structure of polyphenols on their noncovalent interactions with oat β-glucan[J].Journal of Agricultural and Food Chemistry,2013,61(19):4 533-4 538.
[27] FERNANDES A,BR S N F,MATEUS N,et al.Understanding the molecular mechanism of anthocyanin binding to pectin[J].Langmuir,2014,30(28):8 516-8 527.
S N F,MATEUS N,et al.Understanding the molecular mechanism of anthocyanin binding to pectin[J].Langmuir,2014,30(28):8 516-8 527.
[28] BOURVELLEC C L,GUYOT S,RENARD C M G C.Non-covalent interaction between procyanidins and apple cell wall material:Part I.Effect of some environmental parameters[J].Biochimica et Biophysica Acta,2004,1672(3):192-202.
[29] WATRELOT A A,LE BOURVELLEC C,IMBERTY A,et al.Interactions between pectic compounds and procyanidins are influenced by methylation degree and chain length[J].Biomacromolecules,2013,14(3):709-718.
[30] COSTA T D S,ROGEZ H,PENA R D S.Adsorption capacity of phenolic compounds onto cellulose and xylan[J].Food Science and Technology,2015,35(2):314-320.
[31] ZENG L,MA M J,LI C,et al.Stability of tea polyphenols solution with different pH at different temperatures[J].International Journal of Food Properties,2017,20(1):1-18.
[32] LIN Z,FISCHER J,WICKER L.Intermolecular binding of blueberry pectin-rich fractions and anthocyanin[J].Food Chemistry,2016,194:986-993.
[33] GOTO T,KONDO T.Structure and molecular stacking of anthocyanins—Flower color variation[J].Angewandte Chemie International Edition,1991,30(1):17-33.
[34] LIU Y J,YING D Y,SANGUANSRI L,et al.Comparison of the adsorption behaviour of catechin onto cellulose and pectin[J].Food Chemistry,2019,271:733-738.
[35] BOURVELLEC C L,QUERE J-M L,RENARD C M G.Impact of noncovalent interactions between apple condensed tannins and cell walls on their transfer from fruit to juice:studies in model suspensions and application[J].Journal of Agricultural and Food Chemistry,2007,55(19):7 896-7 904.
[36] ZAINUDDIN N,AHMAD I,KARGARZADEH H,et al.Hydrophobic kenaf nanocrystalline cellulose for the binding of curcumin[J].Carbohydrate Polymers,2017,163:261-269.
[37] FOO M L,TAN C R,LIM P D,et al.Surface-modified nanocrystalline cellulose from oil palm empty fruit bunch for effective binding of curcumin[J].International Journal of Biological Macromolecules,2019,138:1 064-1 071.
[38] LUO X L,WANG Q,FANG D Y,et al.Modification of insoluble dietary fibers from bamboo shoot shell:Structural characterization and functional properties[J].International Journal of Biological Macromolecules,2018,120:1 461-1 467.
[39] FANG D Y,WANG Q,CHEN C H,et al.Structural characteristics,physicochemical properties and prebiotic potential of modified dietary fiber from the basal part of bamboo shoot[J].International Journal of Food Science & Technology,2020,56(2):618-628.
[40] MU R J,HONG X,NI Y S,et al.Recent trends and applications of cellulose nanocrystals in food industry[J].Trends in Food Science & Technology,2019,93:136-144.
[41] LIU Y J,YING D Y,SANGUANSRI L,et al.Adsorption of catechin onto cellulose and its mechanism study:Kinetic models,characterization and molecular simulation[J].Food Research International,2018,112:225-232.
[42] PATEL A R,SEIJEN-TEN-HOORN J,VELIKOV K P.Colloidal complexes from associated water soluble cellulose derivative(methylcellulose) and green tea polyphenol(epigallocatechin gallate)[J].Journal of Colloid and Interface Science,2011,364(2):317-323.
[43] ZHENG L Q,DING Z S,ZHANG M,et al.Microencapsulation of bayberry polyphenols by ethyl cellulose:Preparation and characterization[J].Journal of Food Engineering,2011,104(1):89-95.
[44] TUOHY K M,CONTERNO L,GASPEROTTI M,et al.Up-regulating the human intestinal microbiome using whole plant foods,polyphenols,and/or fiber[J].Journal of Agricultural and Food Chemistry,2012,60(36):8 776-8 782.
[45] GEORGE D,BEGUM K M M S,MAHESWARI P U.Sugarcane bagasse(SCB) based pristine cellulose hydrogel for delivery of grape pomace polyphenol drug[J].Waste and Biomass Valorization,2020,11(3):851-860.
[46] GIL-S NCHEZ I,CUEVA C,SANZ-BUENHOMBRE M,et al.Dynamic gastrointestinal digestion of grape pomace extracts:Bioaccessible phenolic metabolites and impact on human gut microbiota[J].Journal of Food Composition and Analysis,2018,68:41-52.
NCHEZ I,CUEVA C,SANZ-BUENHOMBRE M,et al.Dynamic gastrointestinal digestion of grape pomace extracts:Bioaccessible phenolic metabolites and impact on human gut microbiota[J].Journal of Food Composition and Analysis,2018,68:41-52.
[47] KALE R,SARAF M,JUVEKAR A,et al.Decreased B16F10 melanoma growth and impaired tumour vascularization in BDF1 mice with quercetin-cyclodextrin binary system[J].Journal of Pharmacy and Pharmacology,2010,58(10):1 351-1 358.
[48] BOURVELLEC C L,RENARD C M G C L.Interactions between polyphenols and macromolecules:Quantification methods and mechanisms[J].Critical Reviews in Food Science and Nutrition,2012,52(3):213-248.
[49] PADAYACHEE A,NETZEL G,NETZEL M,et al.Lack of release of bound anthocyanins and phenolic acids from carrot plant cell walls and model composites during simulated gastric and small intestinal digestion[J].Food & Function,2013,4(6):906-916.
[50] PATEL A R,NIJSSE J,VELIKOV K P.Novel polymer-polyphenol beads for encapsulation and microreactor applications[J].Soft Matter,2011,7(9):4 294-4 301.