脂肪酸是一类重要的化合物,被广泛应用于食品和化学工业中[1]。在食品行业中,饱和脂肪酸可作为某些发酵饮料中的主要芳香物质、表面活性剂、食品添加剂和增塑剂[2-4];奇数碳脂肪酸及其衍生物可作为合成香精和香料等前体物质[5],还可用作饮食评估中食物摄入的标准生物标志物以及冠心病风险和二型糖尿病风险的指示物[1,6]。
当前,利用动、植物油脂生产脂肪酸面临原料短缺、生产周期长、价格波动大等诸多风险和挑战,而微生物油脂因其不与民争粮争地,不受气候、环境和场地等限制,培养周期短,易规模化放大等优势受到广泛关注[7]。产油酵母是一类能积累超过自身干重30%油脂的微生物[8-9],在特定的培养条件下能够超过自身干重的60%[10-12]。此外,产油酵母具有生长速度快、底物利用谱广、耐受多种木制纤维素水解副产物等优点,被认为是生产油脂的理想细胞工厂[13]。
脂肪酸组成的差异赋予油脂不同的功能与用途,富含油酸、硬脂酸和棕榈酸等长链脂肪酸的脂质可用于可可脂的替代品,而富含单不饱和脂肪酸的脂质适合生产生物柴油[14-15]。调控培养基的成分或改变发酵条件(如碳源、温度和pH等)能够改变微生物油脂脂肪酸组成,获得富含特定脂肪酸的油脂[16-17]。本文分析了圆红冬孢酵母(Rhodosporidium toruloides)等4株产油酵母油脂的脂肪酸组成;研究了碳源、温度和pH对圆红冬孢酵母油脂脂肪酸组成的影响,以期为定向改造产油酵母合成特定脂肪酸提供参考。
1 材料与方法
1.1 材料与仪器
1.1.1 菌种
圆红冬孢酵母(Rhodosporidium toruloides)CGMCC 2.1389、皮状丝孢酵母(Trichosporon cutaneum)CGMCC 2.571、斯达式油脂酵母(Lipomyces starkeyi)CGMCC 2.1560,中国普通微生物菌种保藏管理中心(CGMCC);弯曲隐球菌(Cryptococcus curvatus)ATCC 20509,美国菌种保藏中心(ATCC)。
1.1.2 培养基与溶液
YPD种子液培养基(g/L):蛋白胨20,酵母提取物10,葡萄糖20。固体培养基为YPD液体培养基加15 g/L琼脂粉。
限氮培养基(g/L):葡萄糖70,(NH4)2SO4 0.1,酵母提取物0.75,KH2PO4 1.0,MgSO4·7H2O 1.5,痕量元素储液1%(体积分数),pH 6.0。
痕量元素储液(g/L):CaCl2·2H2O 4.0,FeSO4·7H2O 0.55,一水合柠檬酸0.52,ZnSO4·7H2O 0.1,MnSO4·H2O 0.076;另外补加浓硫酸100 μL/L。以上培养基均在121 ℃下灭菌15 min。
1.1.3 主要设备
ZQZY-CF8振荡培养箱,上海知楚仪器有限公司;7890B-7000D三重四级杆气质联用仪,安捷伦科技有限公司;V-530紫外可见分光光度计,日本分光公司。
1.2 实验方法和分析方法
1.2.1 产油酵母的培养和产油发酵
将产油酵母在YPD固体培养基上划线培养,30 ℃,48 h。挑取单菌落,接种到含有50 mL YPD液体培养基的250 mL摇瓶中,30 ℃,200 r/min发酵48 h获得种子液。以10%的体积比例将种子液接种到含45 mL限氮培养基的250 mL摇瓶中,30 ℃,200 r/min条件下发酵至培养基中碳源低于2 g/L。
1.2.2 碳源、温度和pH对圆红冬孢酵母脂肪酸组成的影响
菌株活化、培养等方法同1.2.1。除考察温度的试验组外,发酵转速和温度均为200 r/min和30 ℃。培养条件试验组分别为:(1)碳源为葡萄糖、木糖、蔗糖和甘油,C/N摩尔比(C/N=260)配置氮限制培养基;(2)初始pH分别为4、5、6、7和8,用4 mol/L NaOH溶液调控培养基初始pH;(3)温度:20、25、30、33和37 ℃。
1.2.3 生物量测定方法
取30 mL发酵液,8 000×g离心5 min;所得菌体用去离子水洗涤2次,于105 ℃烘至恒重,以g/L表示菌体生物量。
1.2.4 碳源的测定方法
利用DionexICS2500离子色谱仪(Dionex公司,CarboPac100保护柱(4 mm×50 mm)、CarboPac100分析柱(4 mm×250 mm)。洗脱条件:30 ℃,流速0.5 mL/min。NaOH浓度从0到15 min为22 mmol/L,随后1 min内增加到200 mmol/L,保持15 min[18]。甘油、木糖、葡萄糖和蔗糖的保留时间分别为1.7、12.2、13.5和16.7 min。
1.2.5 油脂含量测定方法
采用酸热法提取产油酵母油脂[10]。向装有0.5 g干菌体的50 mL圆底离心管中加入3 mL的4 mol/L HCl溶液,78 ℃水浴处理1 h,冷却后加入3 mL甲醇和3 mL氯仿,漩涡振荡1 min;8 000×g离心5 min收集氯仿层;加入3 mL氯仿重复萃取,直至氯仿层澄清透明;合并氯仿抽提液,加入等体积1 g/L NaCl溶液,振荡混匀;8 000×g离心5 min,取下层氯仿层,无水Na2SO4过滤;真空蒸发除去氯仿,105 ℃烘干至恒重。以g/L表示油脂产量,g/(g·DCW)表示油脂含量。
1.2.6 脂肪酸组成分析方法
油脂甲酯化[10]:取200 mg油脂,加入0.5 mL 50 g/L的KOH/CH3OH溶液,转入10 mL圆底烧瓶,70 ℃回流50 min;加入0.7 mL三氟化硼乙醚甲醇溶液[V(三氟化硼乙醚溶液)∶V(甲醇)=4∶10],继续回流10 min,冷却后加入1 mL去离子水并混匀;加入0.7 mL正己烷萃取,去离子水洗涤2次,用0.22 μm滤膜过滤后用GC-MS进行分析。
脂肪酸组成分析:Agilent 7890A-7000D型气质联用仪(GC-MS),色谱柱采用HP-5MS(30 m×0.25 m×0.25 μm)。升温程序:初始温度80 ℃,保持1 min,7 ℃/min升温至250 ℃,保持10 min;分流进样比10∶1;载气氦气;流速1.0 mL/min;测定方式:全扫描方式;进样量1 μL。
1.3 数据处理
试验结果均以平均值±标准差表示,每个试验平行3次。采用Origin 2021进行数据分析。
2 结果与分析
2.1 不同产油酵母的脂肪酸组成分析
营养限制是常用的促进产油微生物合成和积累油脂的策略[18]。本研究采用氮元素限制培养基实现油脂合成积累,采用C/N质量比为260,所得4株产油酵母油脂产量分别为7.5、9.41、8.75和10.6 g/L,含量分别为52.74%、43.8%、42.19%和53.56%(图1)。
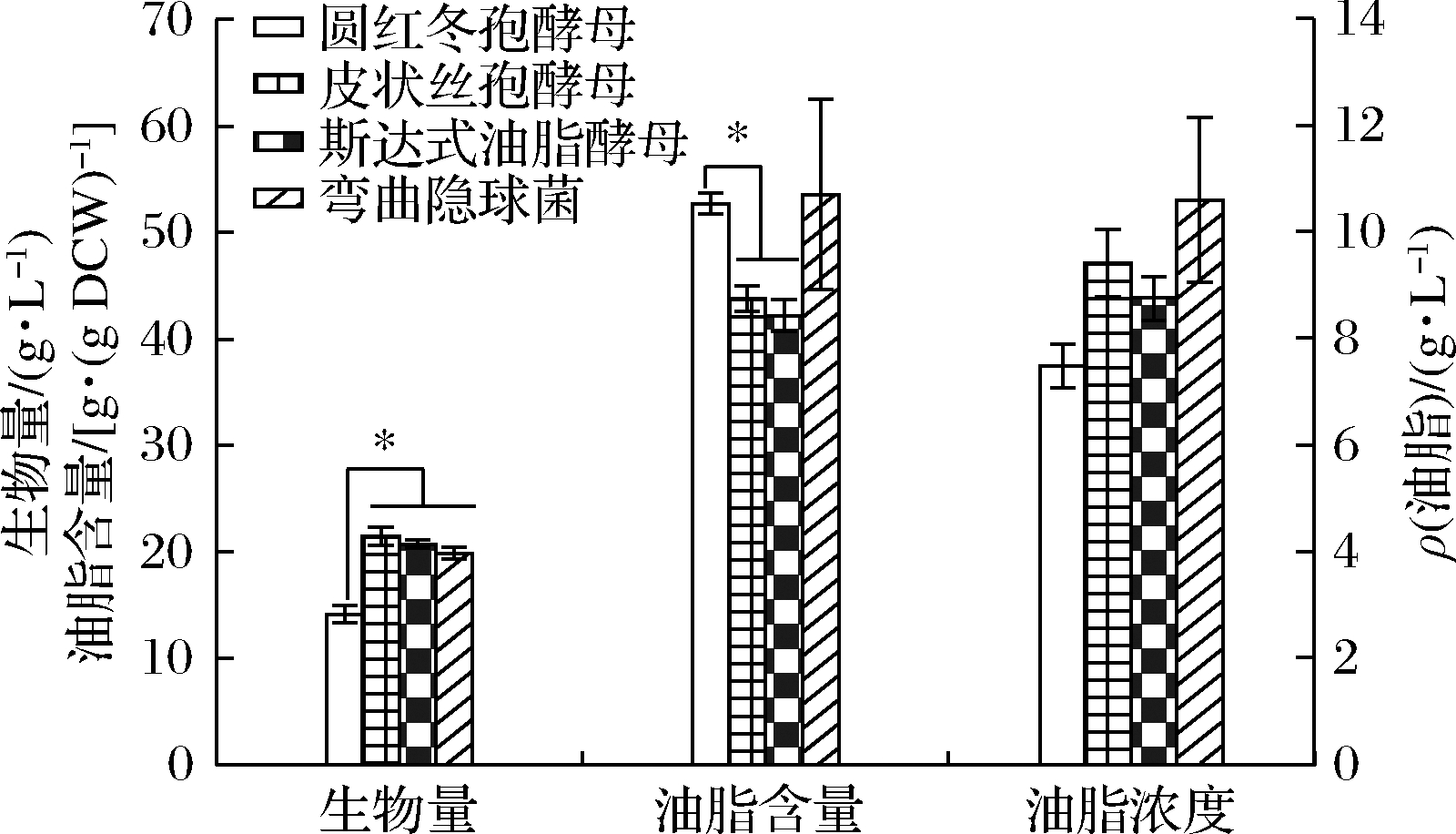
图1 四种产油酵母的生物量、油脂浓度和油脂含量
Fig.1 The biomass,lipid titer,and lipid content of the
four oleaginous yeasts.
注:*表示具有显著差异,P<0.05(下同)
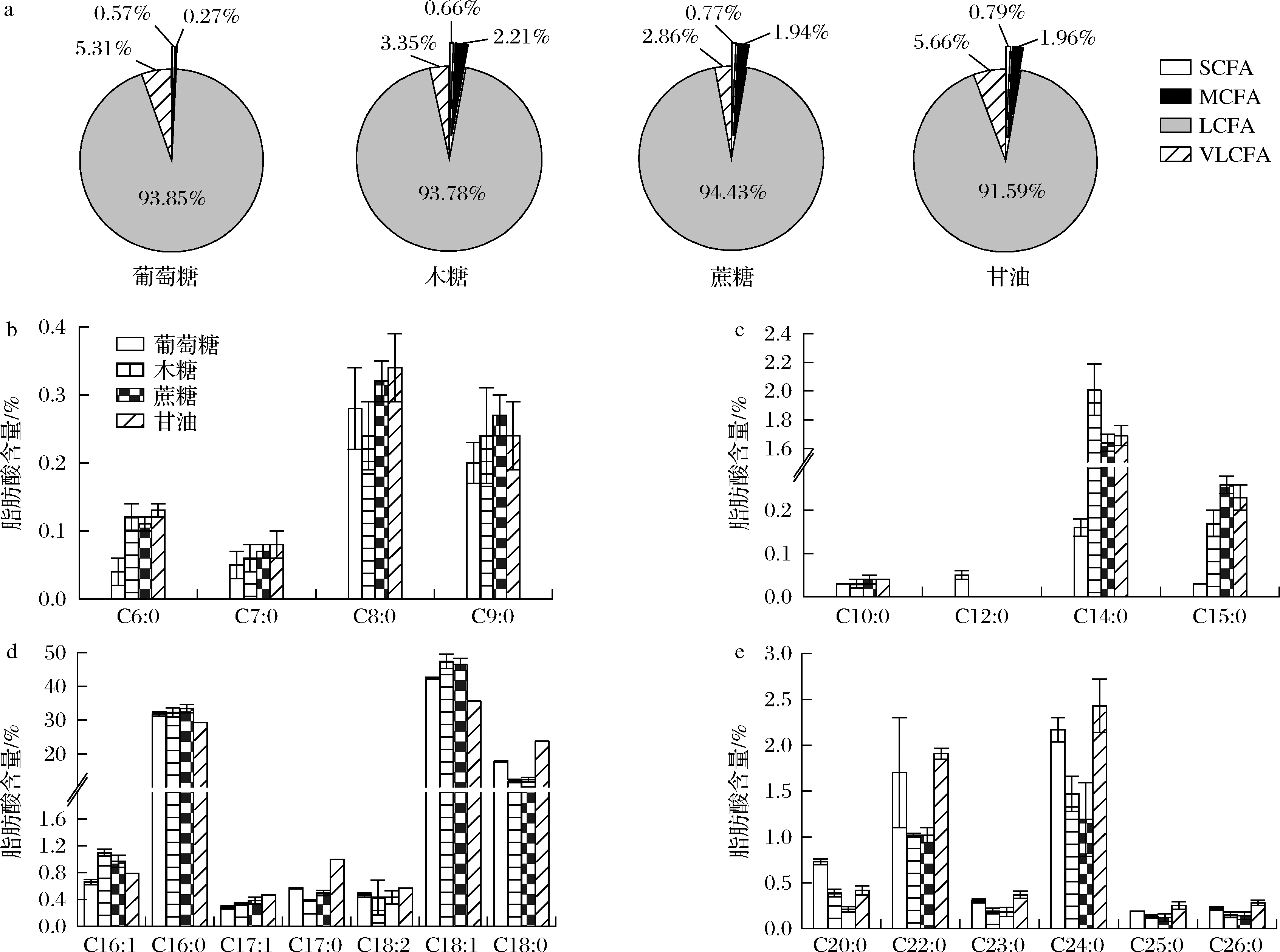
4株菌油脂中有18种共有脂肪酸,包括短链脂肪酸(short-chain fatty acids,SCFA,C<10):己酸(C6∶0)、庚酸(C7∶0)、辛酸(C8∶0)和壬酸(C9∶0);中链脂肪酸(medium-chain fatty acid,MCFA,10≤C<16):葵酸(C10∶0)、月桂酸(C12∶0)、肉豆蔻酸(C14∶0)和十五烷酸(C15∶0);长链脂肪酸(long-chain fatty acid,LCFA,16≤C<20):棕榈油酸(C16∶1)、棕榈酸(C16∶0)、十七碳烯酸(C17∶1)、十七烷酸(C17∶0)和油酸(C18∶1),硬脂酸(C18∶0);超长链脂肪酸(very long-chain fatty acid,VLCFA,C ≥ 20):二十烷酸(C20∶0)、二十二烷酸(C22∶0)、二十三烷酸(C23∶0)和二十四烷酸(C24∶0)(图2-b~2-e)。除皮状丝孢酵母外,另3株产油酵母油脂中还含有二十五烷酸(C25∶0)和二十六烷酸(C26∶0);亚油酸(C18∶2)仅在圆红冬孢酵母油脂中出现(图2-d)。
4株产油酵母油脂中LCFA占总脂肪酸的90%左右,其中C18∶1、C18∶0和C16∶0在圆红冬孢酵母中含量分别为38.38%、17.71%和35.77%;在皮状丝孢酵母中为11.73%、11.94%和66.71%;在斯达式油脂酵母中为19.12%、23.54%和43.97%;在弯曲隐球菌中为20.25%、28.51%和40.08%(图2-a),与之前报道基本一致[19]。产油酵母油脂中SCFA含量为0.57%~2.44%,MCFA含量为0.28%~1.67%,VLCFA含量为5.30%~8.11%,这些脂肪酸总量仅占总脂肪酸的10%左右(图2-a)。

a-脂肪酸类别;b-SCFA;c-MCFA;d-LCFA;e-VLCFA
图2 四种产油酵母油脂的脂肪酸组成
Fig.2 Fatty acid composition of lipids from the four oleaginous yeasts.
2.2 培养条件对圆红冬孢酵母的脂肪酸组成的影响
2.2.1 碳源对圆红冬孢酵母的脂肪酸组成的影响
碳源因代谢路径的不同,其能量和还原度会有细微差别。在合成油脂过程中,碳源不仅影响产油酵母生长、油脂积累和脂肪酸的组成,还会影响油脂的功能和用途[19-20]。圆红冬孢酵母能够利用葡萄糖高效合成胞内油脂,油脂中的脂肪酸多达21种,在所试酵母中具有一定代表性。因此,以圆红冬孢酵母为研究对象,探究碳源、温度和pH对产油酵母的脂肪酸组成的影响。葡萄糖、木糖、蔗糖和甘油是常用的微生物油脂生产碳源,以该4种碳源为底物时,圆红冬孢酵母油脂产量为12.16~16.61 g/L,油脂含量为48.6%~54.52%(图3);所得油脂中分别检测到了21、20、20和20种脂肪酸,但在后3种碳源为底物所获的油脂中未检测到C12∶0(图4-c)。
在4种所试碳源中,圆红冬孢酵母油脂中的LCFA含量均占到总脂肪酸的90%以上(图4-a)。以葡萄糖为碳源时,油脂中C18∶1、C18∶0和C16∶0的含量分别为42.38%、17.71%和30.78%;以木糖为碳源时,其含量为分别为47.45%、11.85%和32.24%;以蔗糖为碳源时,其含量分别为46.54%、12.22%和33.39%;以甘油为碳源时,其含量分别为35.68%、23.79%和29.29%(图4-d)。在这4种碳源中,SCFA的总含量为0.57%~79%;MCFA的总含量为0.27%~2.21%;VLCFA的总含量为2.86%~5.66%(图4-a)。总体而言,木糖和蔗糖有利于圆红冬孢酵母积累C18∶和C16∶0;甘油有利于C17∶0和C18∶0的积累;葡萄糖和甘油则有利于VLCFA的合成与积累。
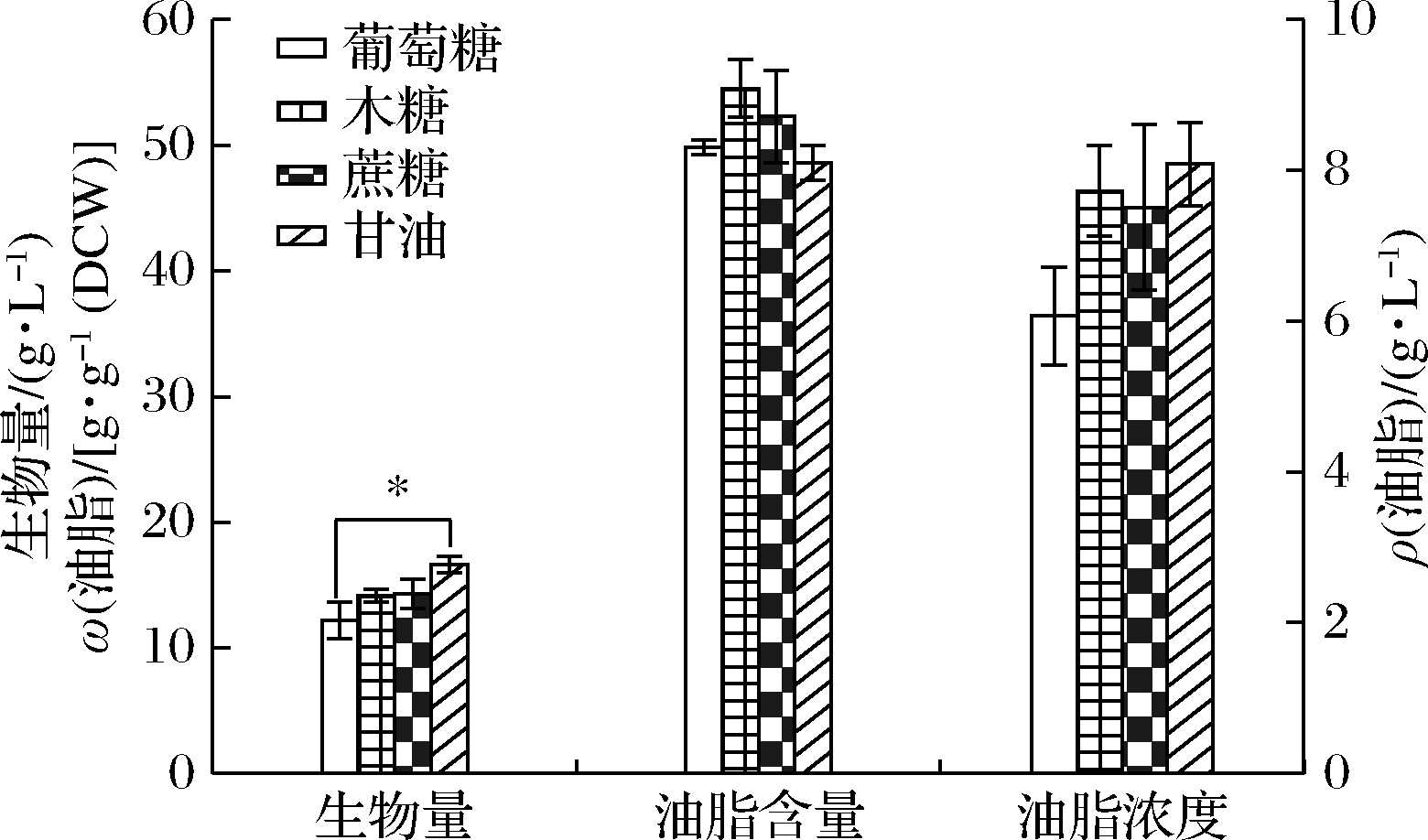
图3 碳源对圆红冬孢酵母的生物量、油脂浓度和
油脂含量的影响
Fig.3 Effect of carbon source on the biomass,lipid titer,
and lipid content of R.toruloides
a-脂肪酸类别;b-SCFA;c-MCFA;d-LCFA;e-VLCFA
图4 碳源对圆红冬孢酵母的脂肪酸组成和含量的影响
Fig.4 Effects of carbon source on the fatty acid composition and content of R.toruloides
2.2.2 温度对圆红冬孢酵母的脂肪酸组成的影响
培养温度能够影响细胞内酶的活性,扰动细胞内代谢途径及强度,改变细胞(膜)中饱和脂肪酸(saturated fatty acid,SFA)和不饱和脂肪酸(unsaturated fatty acids,UFA)的比例[21]。在试验温度范围内,圆红冬孢酵母中油脂产量为6.57~9.28 g/L,油脂含量49.01%~61.13%,油脂产量和含量均呈现先升高后降低的趋势,表明低温或高温均不利于生物量和油脂积累(图5)。
如图6所示,在所试温度范围内,油脂中LCFA的含量始终占总脂肪酸的90%以上,其中C18∶1的含量在30.21%~41.70%,C18∶0的含量在14.30%~16.86%,波动不大;C16∶0的含量在35.56%~44.82%。SCFA总含量在0.43%~1.58%;MCFA含量为2.04%~2.64%;VLCFA含量为3.07%~5.86%,近1.9倍的变化。此外,结果还表明培养温度为20 ℃时有利于C8∶0、C9∶0、C12∶0以及C17系奇数碳脂肪酸的积累,但20 ℃时仅检测到17种脂肪酸,未检测到C10∶0、C18∶2、C25∶0和C26∶0;37 ℃有利于C20∶0、C22∶0和C24∶0等VLCFA的积累。
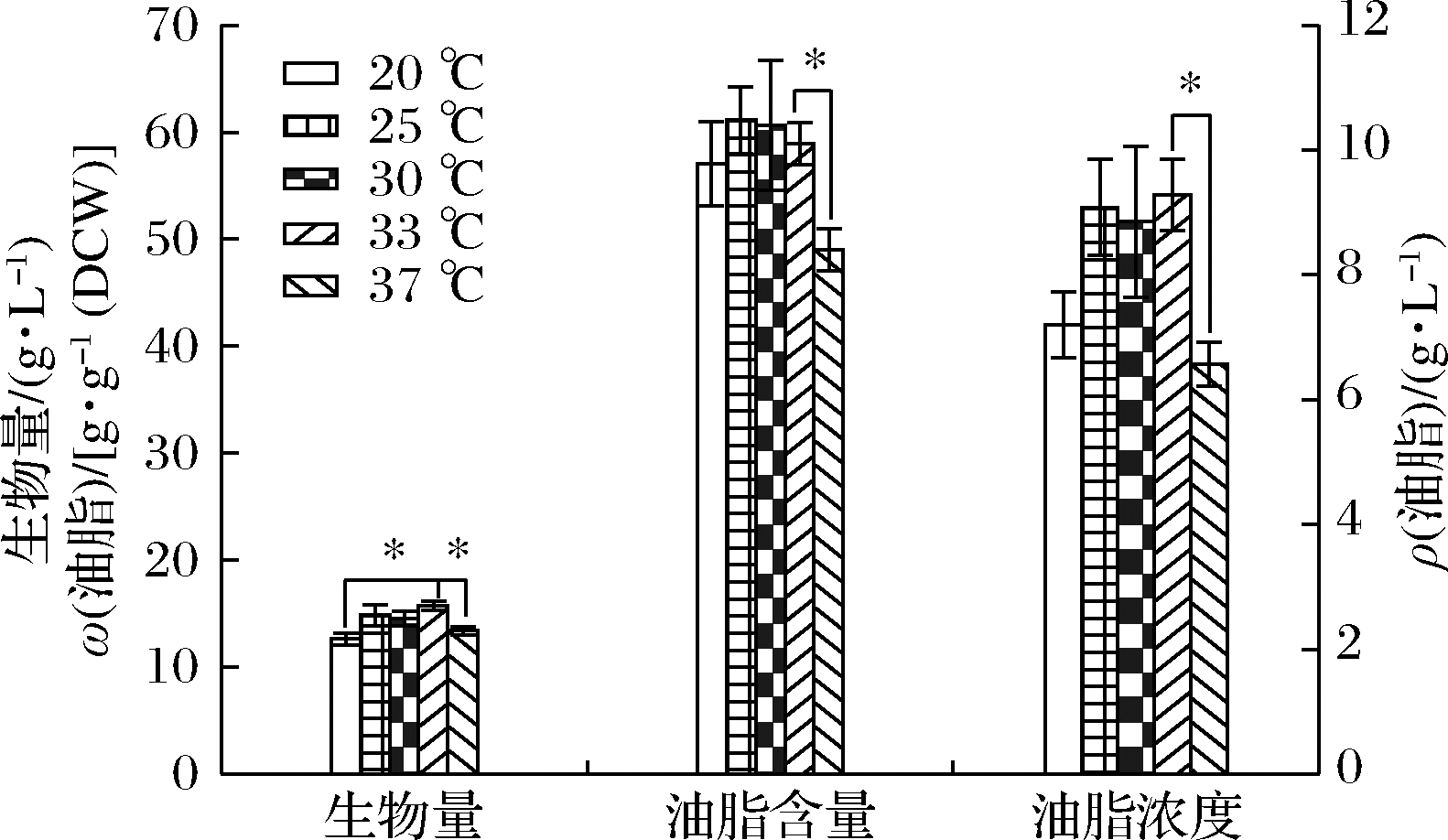
图5 温度对圆红冬孢酵母的生物量、油脂浓度和
油脂含量的影响
Fig.5 Effect of temperatures on the biomass,lipid titer,
and lipid content of R.toruloides
∑C18/∑C16和C18∶1/C18∶0可分别作为延长酶和Δ9去饱和酶活性的参数[22]。调控温度能够改变油脂中SFA与UFA的比例。当温度较低时,∑C18/∑C16和值都比较低,提示延长酶和Δ9去饱和酶活性较低,影响了相应脂肪酸的合成。
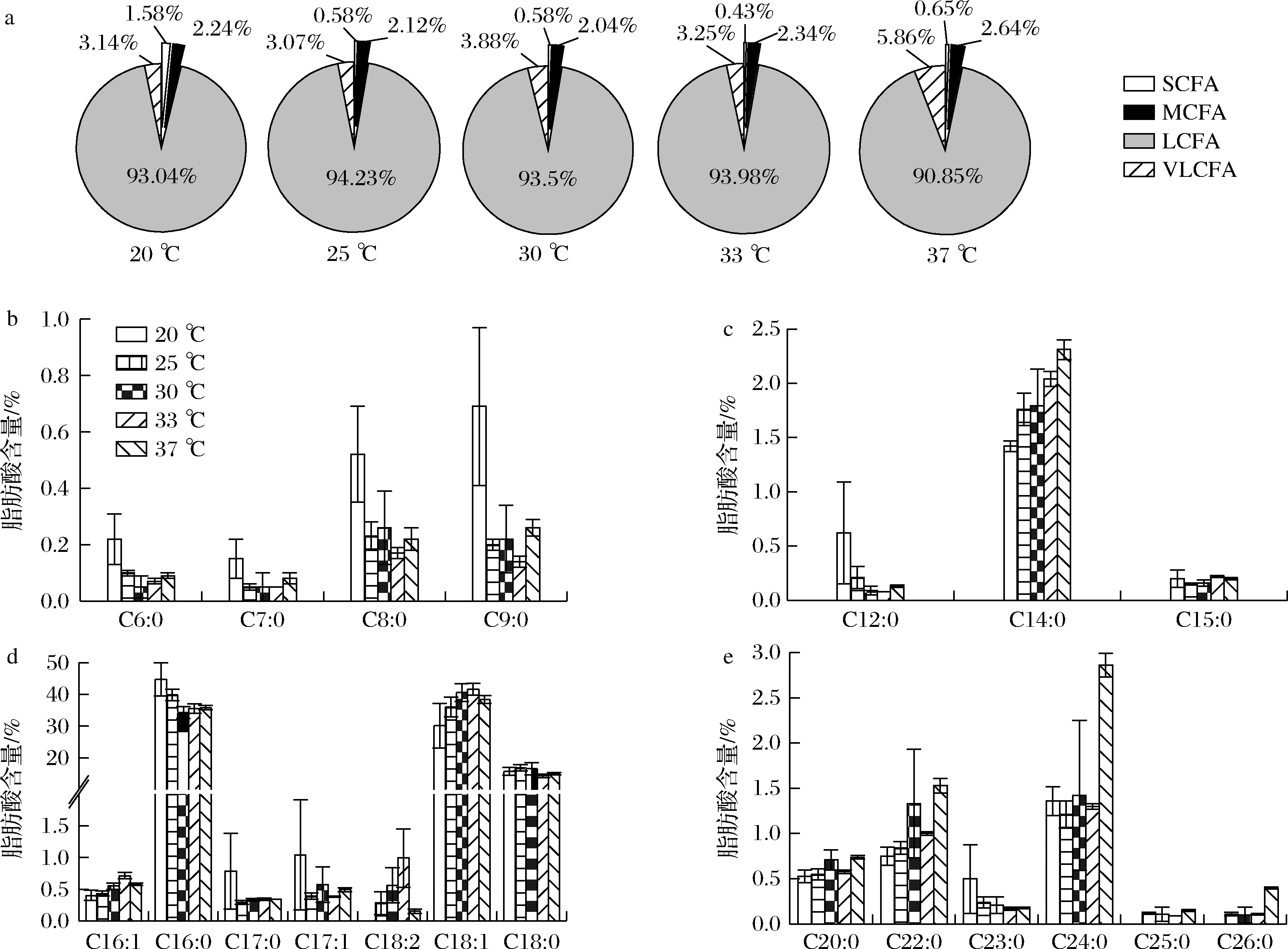
a-脂肪酸类别;b-SCFA;c-MCFA;d-LCFA;e-VLCFA
图6 温度对圆红冬孢酵母的脂肪酸组成和含量的影响
Fig.6 Effect of temperature on the fatty acid composition and content of R.toruloides
2.2.3 pH对圆红冬孢酵母的脂肪酸组成的影响
培养基pH能够改变蛋白质等生物大分子所带电荷,引起细胞膜电荷变化,从而改变微生物吸收利用营养物质的能力[23]。培养基中初始pH为4~8时,圆红冬孢酵母中油脂产量为77.06~9.16 g/L,油脂含量为48.41%~58.90%(图7)。
如图8所示,C18∶1含量为40.03%~43.60%,C18∶0含量为11.23%~13.63%,C16∶0含量为32.95%~36.16%,表明初始pH值对C16∶0、C18∶0和C18∶1的含量影响较小。在pH为7和8时,C16∶1含量是其他pH时1.5倍左右。在pH为5时有利于C18∶2的积累。pH在4~8,SCFA含量为0.32%~0.63%,MCFA的含量为2.10%~2.26%,VLCFA的含量为2.59%~3.35%。当pH为5时,SCFA含量降至最低;pH为4时,C22∶0的含量最高。
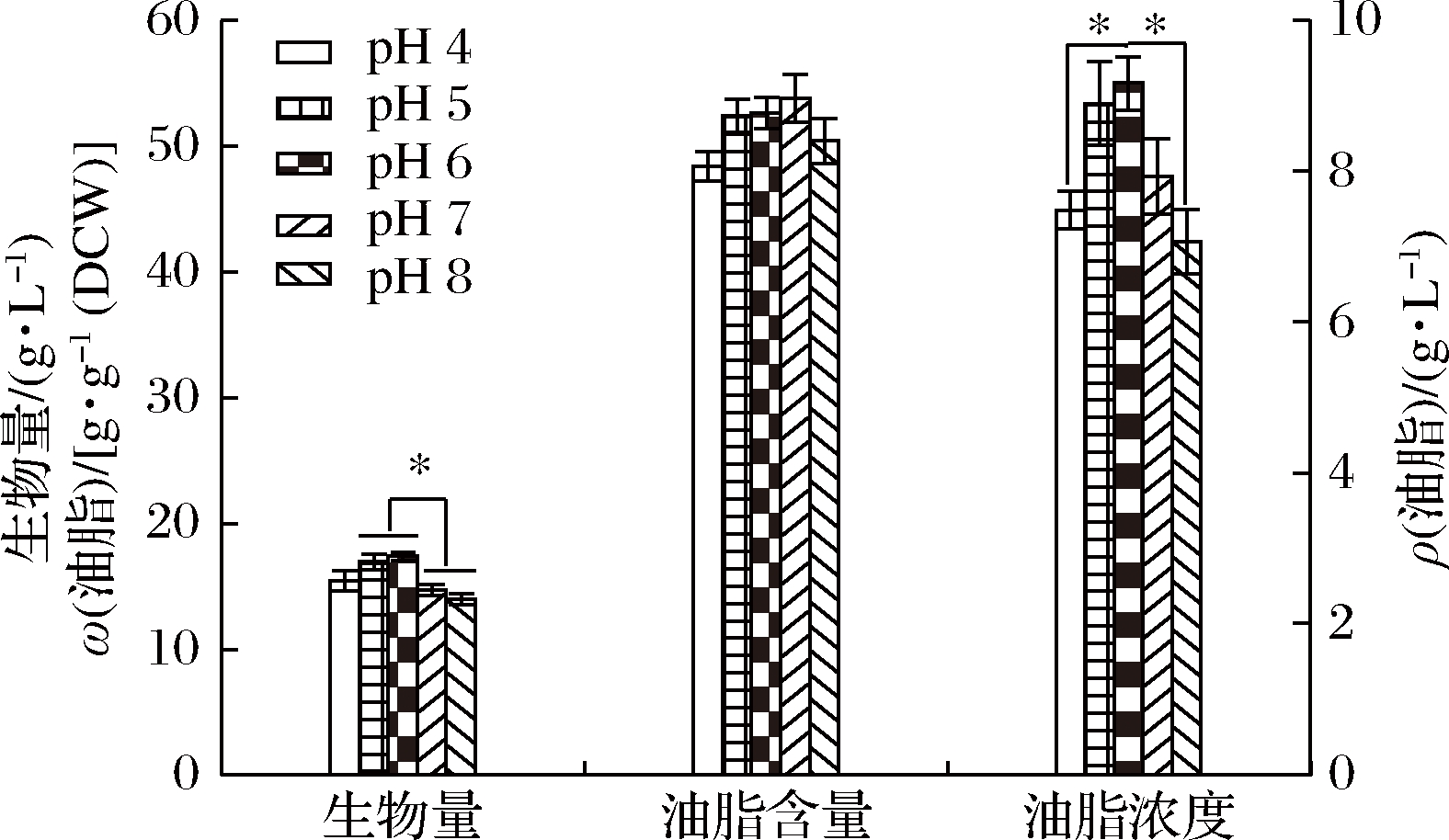
图7 初始pH对圆红冬孢酵母的生物量、
油脂浓度和油脂含量
Fig.7 Effect of initial pH on the biomass,lipid concentration,
and lipid content of R.toruloides

a-脂肪酸类别;b-SCFA;c-MCFA;d-LCFA;e-VLCFA
图8 初始pH对圆红冬孢酵母的脂肪酸组成和含量的影响
Fig.8 Effect of initial pH on the fatty acid composition and content of R.toruloides
3 结论
本文解析了圆红冬孢酵母、皮状丝孢酵母、斯达式油脂酵母和弯曲隐球酵母的油脂脂肪酸组成,证明产油酵母能够合成和积累链长介于6~26的多种脂肪酸。通过调控培养条件,能够改变产油酵母油脂中脂肪酸的组成。碳源和温度对油脂脂肪酸组成的影响较大,主要影响C16和C18系脂肪酸、SCFA和VLCFA在油脂中组成比例,而初始pH则会影响油脂产量和含量。本研究丰富了产油酵母脂肪酸组成的相关信息,为后续构建脂质细胞工厂合成特定脂肪酸及衍生物提供了依据。
[1] XUE S J,CHI Z,ZHANG Y,et al.Fatty acids from oleaginous yeasts and yeast-like fungi and their potential applications[J].Critical Reviews in Biotechnology,2018,38(7):1 049-1 060.
[2] MAAG H.Fatty acid derivatives:Important surfactants for household,cosmetic and industrial purposes[J].Journal of the American Oil Chemists’ Society,1984,61(2):259-267.
[3] JOHANSSON I,SVENSSON M.Surfactants based on fatty acids and other natural hydrophobes[J].Current Opinion in Colloid & Interface Science,2001,6(2):178-188.
[4] ZHANG Z M,JIANG P P,LIU D K,et al.Research progress of novel bio-based plasticizers and their applications in poly(vinyl chloride)[J].Journal of Materials Science,2021,56(17):10 155-10 182.
[5] CLAUSEN C A,COLEMAN R D,YANG V W.Fatty acid-based formulations for wood protection against mold and sapstain[J].Forest Products Journal,2010,60(3):301-304.
[6] JENKINS B,WEST J A,KOULMAN A.A review of odd-chain fatty acid metabolism and the role of pentadecanoic acid(c15:0) and heptadecanoic acid(c17∶0) in health and disease[J].Molecules(Basel,Switzerland),2015,20(2):2 425-2 444.
[7] SAWANGKEAW R,NGAMPRASERTSITH S.A review of lipid-based biomasses as feedstocks for biofuels production[J].Renewable and Sustainable Energy Reviews,2013,25:97-108.
[8] PROBST K V,SCHULTE L R,DURRETT T P,et al.Oleaginous yeast:A value-added platform for renewable oils[J].Critical Reviews in Biotechnology,2016,36(5):942-955.
[9] ADRIO J L.Oleaginous yeasts:Promising platforms for the production of oleochemicals and biofuels[J].Biotechnology and Bioengineering,2017,114(9):1 915-1 920.
[10] LI Y H,ZHAO Z B,BAI F W.High-density cultivation of oleaginous yeast Rhodosporidium toruloides Y4 in fed-batch culture[J].Enzyme and Microbial Technology,2007,41(3):312-317.
[11] TAKAKU H,MATSUZAWA T,YAOI K,et al.Lipid metabolism of the oleaginous yeast Lipomyces starkeyi[J].Applied Microbiology and Biotechnology,2020,104(14):6 141-6 148.
[12] GÖRNER C,REDAI V,BRACHARZ F,et al.Genetic engineering and production of modified fatty acids by the non-conventional oleaginous yeast Trichosporon oleaginosus ATCC 20509[J].Green Chemistry,2016,18(7):2 037-2 046.
[13] YAN Q,PFLEGER B F.Revisiting metabolic engineering strategies for microbial synthesis of oleochemicals[J].Metabolic Engineering,2020,58:35-46.
[14] LIPP M,ANKLAM E.Review of cocoa butter and alternative fats for use in chocolate—Part A.Compositional data[J].Food Chemistry,1998,62(1):73-97.
[15] SINGH R,ARORA A,SINGH V.Biodiesel from oil produced in vegetative tissues of biomass-A review[J].Bioresource Technology,2021,326:124772.
[16] YANG X B,JIN G J,WANG Y D,et al.Lipid production on free fatty acids by oleaginous yeasts under non-growth conditions[J].Bioresource Technology,2015,193:557-562.
[17] UPRETY B K,RAKSHIT S K.Use of essential oils from various plants to change the fatty acids profiles of lipids obtained from oleaginous yeasts[J].Journal of the American Oil Chemists' Society,2018,95(2):135-148.
[18] SZCZWPANSKA P,HAPETA P,LAZAR Z.Advances in production of high-value lipids by oleaginous yeasts[J].Critical Reviews in Biotechnology,2022,42(1):1-22.
[19] GONG Z W,WANG Q,SHEN H W,et al.Co-fermentation of cellobiose and xylose by Lipomyces starkeyi for lipid production[J].Bioresource Technology,2012,117:20-24.
[20] DIAMANTOPOULOU P,FILIPPOUSI R,ANTONIOU D,et al.Production of added-value microbial metabolites during growth of yeast strains on media composed of biodiesel-derived crude glycerol and glycerol/xylose blends[J].FEMS Microbiology Letters,2020,367(10):fnaa063.
[21] ABELN F,CHUCK C J.The role of temperature,pH and nutrition in process development of the unique oleaginous yeast Metschnikowia pulcherrima[J].Journal of Chemical Technology and Biotechnology,2020,95(4):1 163-1 172.
[22] MOUSTOGIANNI A,BELLOU S,TRIANTAPHYLLIDOU I E,et al.Alterations in fatty acid composition of Cunninghamella echinulata lipids induced by orange essential oil[J].Environmental Biotechnology,2014,10(1):1-7.
[23] PEREIRA A S,MIRANDA S M,LOPES M,et al.Factors affecting microbial lipids production by Yarrowia lipolytica strains from volatile fatty acids:Effect of co-substrates,operation mode and oxygen[J].Journal of Biotechnology,2021,331:37-47.