水凝胶是聚合物通过物理或化学作用而高度交联形成的,具有三维网络结构,且聚合物存在各种官能团,这赋予了水凝胶与其他物质结合的优良特性:可以吸收大量的水而不溶解;能与药物通过物理或者共价非共价结合,实现递送和缓释作用,且释放表现出一定的环境敏感性。一般来说,构成水凝胶聚合物的来源主要有两类:(1) 天然高分子聚合物(生物聚合物),如多糖(海藻酸盐[1]、纤维素[2]、壳聚糖[3]、淀粉[4]等),蛋白质(乳清蛋白[5]、玉米醇溶蛋白[6]、酪蛋白等[7]),脂类(脂质体)[8];(2) 合成高分子聚合物,如聚丙烯酸[9]、聚丙烯酰胺[10]和聚乙二醇[11]等。
而天然聚合物具有较好的生物相容性,安全性高、易降解,因此,用食品来源的生物聚合物合成的食品水凝胶用于生物活性物质的递送更受青睐。
多酚是一类有利于人体健康的植物次级代谢产物,具有多种功能活性,如抗炎、抗氧化、抗癌、抗神经性疾病、抗糖尿病等[12]。但由于多酚的一些理化特性,比如溶解度低、紫外稳定性差、不耐酸碱、在胃肠道中被动扩散、易代谢排出等,导致大多数多酚的生物利用度很低,在临床上不能发挥出其理想的生物活性。而水凝胶的特殊结构,可通过物理或化学的方式与多酚结合,能保护多酚在不良环境下不受损害,且能够提高多酚的溶解度,进而提高多酚的生物利用度[13]。因此,水凝胶作为有效的递送系统引起了人们很大的兴趣[14]。本文综述了食品水凝胶的特性,食品水凝胶-多酚递送体系构建方法及其在提高多酚生物利用度方面的优势,并对食品水凝胶发展前景进行了展望。
1 食品水凝胶的特性
食品水凝胶之所以被选择作为多酚递送体系的材料,与其优良的特性密切相关。食品水凝胶具有优良的生物相容性和生物降解性,故其能作为安全的载体物质而不对人体产生伤害。同时食品水凝胶特殊的物理或化学结构,使其具有载药性,并且能控制药物释放的速度。一些经过特殊设计的水凝胶,可以将药物运送至指定位置靶向释放,大大提高药物的利用率。
1.1 生物降解性和生物相容性
生物降解性是指聚合物在微生物或化学的作用下,化学键被破坏后分解成低聚物和单体的过程,对于人体来说,即物质能在体内分解代谢,不会累积造成伤害。生物相容性是指食品水凝胶进入人体后,不会引起人体的炎症或免疫反应。食品水凝胶主要是基于蛋白质、多糖和脂类等食品级原料制备的,可被胃肠道中分泌的胃蛋白酶、淀粉酶及脂肪酶很好地降解[15]。部分多糖(如膳食纤维)在小肠中不被消化吸收,但能在结肠中通过微生物发酵,产生有益人体健康的次生代谢产物[16]。正是因为大部分食品水凝胶具有优良的生物降解性和生物相容性,所以能携带多酚进入人体而不产生毒副作用。
1.2 载药性和控释性
由于食品水凝胶中的特殊网状或多孔结构,及部分官能团(如苯环、羟基、羧基、肽键和磺酸基)能促进氢键、疏水及范德华力等相互作用,从而具有一定的药物负载能力[3]。载药的方式主要包括:(1)物理包埋;(2)非共价相互作用;(3)共价相互作用。在某些特定的条件下或快或慢地释放出负载药物。常见的控释机制可分为3种类型:扩散控释、溶胀控释和化学控释。
大分子物质一般是通过物理包埋方式负载到水凝胶网络结构中;而小分子物质如多酚负载到水凝胶网络结构的主要方式是通过与聚合物之间的非共价和共价相互作用[17]。
物理包埋的物质很容易随着水凝胶的膨胀而扩散出来,其扩散速度很大程度上受到水凝胶孔径的影响。若被载药物比水凝胶的孔径小很多,则药物很容易就从水凝胶中扩散出来。反之,如果比孔径大很多,则不容易从水凝胶中扩散。孔径大小取决于水凝胶的制备方法、聚合物种类和浓度、交联方式以及外部环境等[18]。用海藻酸盐制备的水凝胶因具有较大的孔径而容易造成多酚的扩散损失,在制备过程中需添加其他聚合物(如菊粉)以克服海藻酸盐水凝胶孔径大的问题[19-20]。
对于通过共价或者非共价作用与水凝胶结合的药物,其释放机制还是与水凝胶的溶胀有关,药物的解离、药物与聚合物的相互作用以及水凝胶的膨胀都会受到外界环境如温度、pH、离子强度及酶等的影响,通过改变外界环境条件则可以控制药物的释放[21]。在特定环境的化学作用或酶作用下触发水凝胶基质分解,结构破坏,导致药物释放[22]。如壳聚糖基水凝胶在碱性条件下的去质子化会增强与多酚的结合,而在酸性条件下会提高多酚的释放率,一定程度上能用于癌症的靶向治疗[23]。
1.3 靶向性
通过设计食品水凝胶颗粒,如选择合适的生物聚合物,或将生物聚合物改性,使其可以将多酚保留、保护并运送至胃肠道内的特定区域或者指定细胞内定点释放。而定点释放主要是基于水凝胶对环境的敏感性,主要包括pH、离子、温度及酶等。制备水凝胶成分的性质决定了负载多酚的水凝胶颗粒靶向释放的部位。通常利用基于部分蛋白、多糖,如乳清蛋白、淀粉、海藻酸钠等的水凝胶可用于将多酚输送至小肠中释放,以提高其生物利用度[5,19]。但蛋白质和淀粉等在上消化道内均可消化,不适合开发结肠递送系统的水凝胶颗粒。膳食纤维基水凝胶不会在上消化道中被消化降解,但在结肠中,存在的微生物浓度远高于胃肠道其他区域[24],膳食纤维基水凝胶可以被微生物分解,触发多酚的释放。壳聚糖基水凝胶在pH 5(对应肿瘤细胞微环境)的环境中加速多酚的释放,从而使其具有一定的靶向给药的应用潜力[23]。
2 食品水凝胶-多酚递送体系的构建方法
食品水凝胶-多酚递送体系的构建分为2种:
(1)第一步是形成多酚-聚合物小液滴或溶液,第二步是将聚合物通过物理或化学方法交联形成凝胶。具体方法分别是自上而下(top-down)和自下而上(bottom-up)。自上而下是指通过特定的机械装置驱动多酚-聚合物液滴的形成,再通过物理或者化学方法使聚合物凝胶化(挤压法、喷雾干燥法、乳液模板法等)。自下而上是指多酚/聚合物根据环境条件(pH、离子强度、温度等)改变,利用分子间的亲和力聚集形成水凝胶颗粒(如反溶剂沉淀法、凝聚法等)。
(2)通过自上而下或自下而上的方法合成不含多酚的水凝胶,然后通过喷雾干燥或冷冻干燥等干燥方法形成水凝胶颗粒,最后浸泡到含有多酚的水溶液中充分溶胀以吸收多酚,称之为溶胀吸附法。
表1概括了主要方法的优势或者不足,下文仅对这些方法的原理进行简要描述。
表1 食品水凝胶-多酚递送体系构建方法的特点
Table 1 Characteristics of the construction method of food hydrogel-polyphenol delivery system

构建方法优势不足参考文献挤压法(传统、静电)反应条件简单传统挤压法所需装置简易静电挤压法可批量生产小尺寸水凝胶颗粒材料选择有限传统挤压法形成的水凝胶颗粒较大且多孔,包封的多酚易扩散传统挤压法规模化生产难度较大[25]喷雾干燥法干燥过程迅速适合封装热敏性多酚可较大批量制备样品生物聚合物浓度不能太高形成的凝胶水化易分解需要样品的量太大,且易损耗[26]
续表1

构建方法优势不足参考文献溶胀吸附法递送体系的构建较简单可与多种构建方法相结合材料选择和水凝胶的制备方法较难对负载多酚的量和稳定性难以保证[13,23]乳液模板法能产生特定尺寸的水凝胶耗费时间较长可能需要有机溶剂的加入[27-28]反溶剂沉淀法能形成尺寸较小的微凝胶操作条件简单,成本较低-[29]
2.1 挤压法
将包含多酚的水凝胶基质液体混合物通过喷嘴或注射器针头等小孔挤压,使其以液滴的形式滴入交联液中凝胶化,形成负载多酚的水凝胶颗粒(图1)。喷头直径、液滴流速及黏度决定水凝胶颗粒的大小。由于传统挤压法的一些不足,所以在原有的基础上加上电场,称之为静电挤压法。有研究将装有海藻酸钠和多酚混合液的注射器固定在注射泵中,并施加一定的电压,使液滴以一定的流速滴入预先制备好的交联液中[30]。电场的加入使带电的聚合物液体中产生排斥的静电相互作用而分散成为更小的液滴,从而可以批量准确地生产尺寸更小的水凝胶颗粒。
目前挤压法主要是用于以海藻酸钠为基质的水凝胶微球的制备,而用于其他材料的研究相对较少。但是海藻酸盐水凝胶机械稳定性较低,在极端环境结构容易坍塌,该问题可以通过添加多糖比如菊粉得以部分解决[31]。
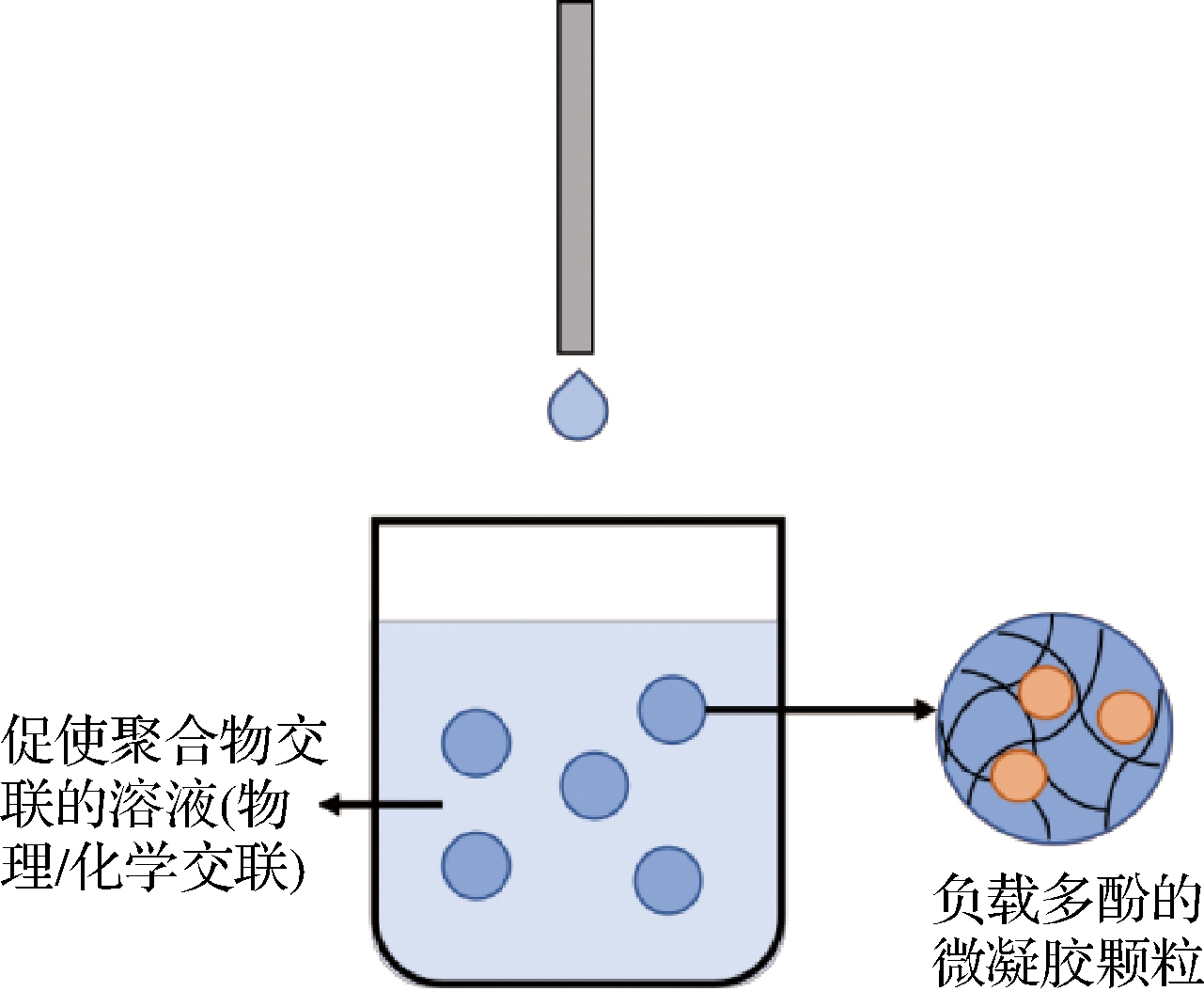
图1 利用挤压法构建的多酚-水凝胶颗粒
Fig.1 Polyphenol-hydrogel particles constructed
by extrusion method
2.2 喷雾干燥法和喷雾冷却法
喷雾干燥法是将包含多酚的生物聚合物溶液通过雾化装置分解成大量细小液滴,在加热室内通过热气流进行快速干燥形成粉末,然后通过旋风分离器收集。喷雾干燥法形成凝胶通常有2种方式:
(1)制备出含有多酚的水凝胶分散液,再通过喷雾干燥得到水凝胶微胶囊。KAVOUSI等[32]用芹菜种子浆液和酪蛋白酸钠2种食品级生物聚合物混合,加入姜黄素充分搅拌,然后通过滴入体积分数为1% HCl溶液调节pH至4来实现凝聚,再经充分搅拌后形成水凝胶悬浮液。最后经喷雾干燥得到载药水凝胶微胶囊。
(2)可以使生物聚合物在干燥的过程中直接交联形成凝胶,最后得到微凝胶粉末。但这个方法需要对聚合物进行改性处理引入基团,从而在蒸发加热过程中发生原位Diels-Alder反应形成水凝胶颗粒。如WEI等[33]先用N-马来酰丙氨酸和琥珀酸酰胺将淀粉改性,然后通过喷雾干燥和Diels-Alder反应制备出载药淀粉水凝胶微球,实验结果表明该水凝胶微球具有良好的生物相容性,且能提高药物的稳定性和生物利用度。
喷雾冷却法使用与喷雾干燥相似的雾化装置,将雾化后的含有多酚的生物聚合物液滴送入到冷却室中形成凝胶。该方法适合易在低温下形成冷至凝胶的生物聚合物,如明胶和琼脂等。但应用这一方法制备水凝胶递送体系的例子较少,可能是未来的一个研究方向。
2.3 溶胀吸附法
溶胀吸附法是常见也简单的食品水凝胶-多酚递送体系的构建方法,将干燥后的水凝胶块、微球、颗粒等浸泡在含有多酚的水溶液中充分溶胀,多酚随着溶剂一同进入到水凝胶网络中(图2)。
HU等[13]利用salecan和N,N,N-三甲基壳聚糖(TMC)2种食品级多糖的静电相互作用制备出了一种新型聚电解质复合物水凝胶,经冷冻干燥后完全浸泡在1%的绿茶多酚溶液中24 h。结果表明,绿茶多酚的包封率随着salecan/TMC比率增加而增加,在7/3时达到最大为94.1%;绿茶多酚在酸性胃液环境中释放率极低,而在碱性小肠环境中大量释放,有利于溶解性多酚在小肠的吸收。
而有研究团队以L-组氨酸或半胱氨酸偶联壳聚糖,包埋于植物合成的氧化锌纳米颗粒(zinc oxide nanoparticles,ZNPs),最后利用双醛纤维素(dialdehyde cellulose,DAC)为交联剂制备出了纳米杂化水凝胶,同样经冷冻干燥后浸泡于含有柚皮素、姜黄素等难溶于水多酚的溶液中,使游离的多酚充分分散在水凝胶网络中。以该方法制得的纳米杂化水凝胶在弱酸性条件下的释药速率明显高于弱碱性环境,而肿瘤细胞的微环境也为微酸性,表现出一定的靶向性[23]。
溶胀吸附法理论上也可与挤压法和喷雾干燥法结合。先利用挤压法制备水凝胶颗粒悬浮液,经冷冻干燥或者喷雾干燥得到微凝胶颗粒,再浸泡到含有多酚的水溶液中吸附多酚;或者使生物聚合物在干燥的过程中直接形成凝胶,再浸泡到含多酚的水溶液中。

图2 溶胀吸附法构建水凝胶-多酚递送体系的过程
Fig.2 The process of constructing hydrogel-polyphenol
delivery system by swelling adsorption
2.4 乳液模板法
乳液模板法是利用油包水(W/O或O/W/O)乳液作为模板,将含有油和疏水表面活性剂的油相与含有多酚和生物聚合物的水相溶液均质形成W/O或O/W/O乳状液,使水相均匀地分散在油相中。然后通过适当的方式使生物聚合物凝胶化,比如升高/降低温度形成冷至/热至凝胶,或者加入交联液,扩散进水相中使生物聚合物交联。最后通过离心、过滤或用有机溶剂萃取以除去残留的油相,再将水凝胶颗粒干燥或分散在水溶液中[34](图3)。SUNG等[27]利用玉米油和含有乳清蛋白的水相合成了O/W/O乳液,然后经加热使乳清蛋白凝固,形成水凝胶颗粒。这种凝胶颗粒可用于包裹亲脂性生物活性成分。

a-通过均质形成W/O乳液;b-物理或化学交联诱导水相凝胶化;
c-去除油相
图3 乳液模板法步骤
Fig.3 Steps of emulsion template method
采用乳液模板法时,可以通过改变均质条件(压力和次数)或溶液组成(油水比、乳化剂种类及比例)来控制水滴的大小,以产生具有特定尺寸的水凝胶[28]。
2.5 其他方法
反溶剂沉淀法很早就已用于纳米颗粒的合成,该法的前提是生物聚合物在一种溶剂中溶解性较好,而在另一种溶剂中溶解性较差。首先将多酚与聚合物溶解在溶解度较好的溶液中,然后向溶液中注入抗溶剂,由于疏水相互作用,生物聚合物分子彼此缔合并形成水凝胶颗粒。
光刻法是将含有多酚的生物聚合物倒入特定尺寸和形状的模板(光刻法制备)中,通过物理或化学的方式使其凝胶化。该法适合制备特定尺寸和大小的水凝胶颗粒,但不太适合大规模制备[35]。
凝聚法也称为相分离法。将要封装的物质分散在含生物聚合物的溶液中,通过改变pH、温度、离子强度或者加入凝聚诱导剂、抗溶剂等使聚合物与溶液发生相分离,形成“水包水(W1/W2)”乳状液。驱动相分离的动力为吸引时,称为静电络合,而驱动相分离的动力为排斥作用时,称之为热力学不相容。然后通过物理或化学凝胶方法,使凝聚相沉积在要封装的化合物周围,形成负载封装化合物的聚凝层颗粒。通过该方法制备的水凝胶颗粒对pH和离子强度敏感度高[36]。
当然还有隧道法、剪切法、高压微流化法等等。在构建水凝胶-多酚递送体系时,应根据材料的特性和所需水凝胶的性质而选择合适的方法。对于易于胶凝的物质且对尺寸没有特别要求,可以选择挤压法;需要合成特定尺寸或尺寸较小的水凝胶颗粒可以选择乳液模板法或者反溶剂沉淀法;喷雾干燥法适合聚合物浓度较低的情况,且可以较大批量合成;对于溶胀吸附法,可以根据材料的不同,利用多种方法合成干燥的水凝胶颗粒,然后再溶胀吸附多酚。该法前提是合成的水凝胶颗粒在干燥的过程中三维结构不坍塌且具有良好的复水性和吸附性。
3 食品水凝胶递送体系提高多酚生物利用度的优势
生物利用度就是摄取的营养物质最终进入体内循环并在特定部位发挥生理作用的那一部分。而生物利用度是由多种影响因素共同决定的。排除个体差异,对于多酚而言,影响其生物利用度的主要因素包括在水溶液的溶解度、在各种人体环境中的稳定性及吸收代谢特性(表2)。
表2 常见食品水凝胶对多酚生物利用度的提高
Table 2 Improvement of the bioavailability of polyphenols in common food hydrogels

生物聚合物分子链结构常见交联方法多酚包封率/%提高生物利用度的表现参考文献壳聚糖席夫碱交联物理加热柚皮苷90.55槲皮素92.84姜黄素89.89稳定性好,能持续给药在pH 5时释放量最大,细胞毒性较游离酚提高了15~30倍,具有一定的靶向性;有一定的抑菌效果[23]乳清蛋白-离子交联pH(酸)诱导酶诱导姜黄素90负载姜黄素的乳清蛋白微凝胶具有较高的抗氧化活性;在模拟胃肠道下,有缓释的效果[37]海藻酸盐离子交联葡萄皮多酚68具有pH敏感性,在pH 1.4时海藻酸盐水凝胶保持完好;pH 7.4时转变成可溶性黏性层,迅速释放出酚类物质;能在一定程度上减少目标蛋白的糖基化[38]果胶离子交联花色苷67.9~93.9与游离花色苷相比,果胶水凝胶中的花色苷热稳定性更好[39]壳聚糖/海藻酸盐--胡桃木多酚34~85具有pH敏感性,在胃液中延缓多酚释放,而在小肠中消化促进多酚释放[40]结冷胶离子交联芹菜素-具有pH敏感性,在酸性条件(pH 1.2)缓释药物,在弱碱性(pH 7.4)快速释放药物[41]淀粉糊化老化槲皮素59.55负载到水凝胶中的槲皮素在大鼠血浆和肝脏中的可持续性和稳定性均高于未负载的槲皮素[42]
3.1 提高多酚的水溶解度
水溶解度对多酚的利用很重要,决定多酚能否很好地被人体吸收利用。对于口服的多酚来说,只有在水中溶解才能被胃肠道上皮细胞吸收[43]。多酚可以与生物聚合物链上的官能团相互作用而结合形成负载多酚的水凝胶颗粒,负载多酚的水凝胶颗粒表面足够高的电荷和良好的水合性可以使其在水中保持稳定,从而提高多酚的溶解度。有研究表明,姜黄素水溶液在贮存一定时间后,由于沉淀而变得完全无色。但将姜黄素包封在乳清蛋白微凝胶中,能在水中形成均一的分散液,且未观察到沉淀的产生,这表明乳清蛋白包封的姜黄素水溶解度得到很大的提升[37]。还有研究将脂质体包裹的姜黄素与硫代壳聚糖制备形成水凝胶,也能明显提高姜黄素的溶解度[3]。HUANG等[44]制备负载多酚的脂质体壳聚糖水凝胶微粒也可用来增强槲皮素、白藜芦醇和表儿茶素的溶解性。
3.2 增强多酚的稳定性
多酚在游离的情况下很容易受到pH、温度、酶、盐离子、微生物等的影响,导致其化学结构发生改变,从而降低甚至失去生物化学活性,导致其生物利用度下降。由于水凝胶的载药性及控释特性,可保护并延缓多酚的释放,缩短多酚在不良环境的暴露时间,减少多酚的氧化和降解等,从而提高多酚的稳定性。水凝胶对多酚的缓释作用可保证持续给药和有长时间的生物活性,而不是突然释放被快速代谢,从而提高人体对多酚的利用度。比如有研究制备的壳聚糖基纳米杂化水凝胶在保证正常细胞的生物相容性同时,在pH为5时释放时间延长至12 h,且具有肿瘤细胞靶向性[25]。已有很多研究表明蛋白质和多酚结合能够提高多酚的稳定性,并且能改善多酚的抗氧化特性,如牛血清蛋白、β-乳球蛋白、酪蛋白等[45-46]。而蛋白基水凝胶就结合了水凝胶和蛋白质的优良特性。有研究将合成的乳清蛋白微凝胶用于负载姜黄素,结果表明负载姜黄素的乳清蛋白微凝胶抗氧化性明显提高,且在模拟胃肠条件下具有缓释作用[37]。
增强稳定性也能在一定程度降低多酚的首过效应。首过效应是指药物首次通过肠壁或经门静脉进入肝时被主要存在于肠道和肝脏中的多种酶代谢,从而使全身循环的药物减少[47]。首过代谢的结果是,摄入的多酚中只有一小部分到达全身循环,这导致多酚的口服生物利用度很低。水凝胶可以减少多酚在胃肠道不利条件下的暴露,从而最大程度地减少酶促和非酶促降解。
3.3 促进多酚的吸收
小肠是大多数营养物质的吸收部位,用凝胶封装能够增加多酚在胃肠道中的吸收。一方面,部分食品水凝胶能包封多酚,减少在口腔和胃部环境的释放,在小肠弱碱性条件下水凝胶分解释放出大量多酚,营造一个高浓度多酚环境,从而促进多酚的被动运输。有研究发现结冷胶和负载芹菜素的微乳液制备出复合水凝胶,在小肠弱碱性条件下受侵蚀影响而大量释放出芹菜素[41]。又如海藻酸盐水凝胶会在模拟小肠环境中迅速释放出多酚[38]。
另一方面,也可考虑细胞直接摄取负载多酚的纳米水凝胶颗粒以提高多酚的生物利用度。纳米凝胶体积极小,渗透性能好,它可以通过细胞旁路或跨细胞途径穿透小肠上皮细胞,并影响最小的毛细血管[21]。纳米凝胶可能通过与黏液的相互作用,可逆地打开上皮细胞之间的紧密连接而增加肠通透性,从而促进细胞旁路运输[48]。如阳离子多糖壳聚糖通过静电相互作用导致紧密连接成分结构重组和扩展,从而有效增强细胞旁路运输[49]。
4 展望
食品水凝胶表现出的优良特性使其在递送多酚方面表现出巨大的潜力。选择合适的基质材料和制备方法可以控制负载多酚水凝胶颗粒一些重要性质,如尺寸、生物相容性、载药性能、递送部位等。
新的可利用食品材料层出不穷,充分了解这些材料的性质,选择多种材料结合,或者利用一定的方法使基质材料改性,可使食品水凝胶具有更好的载药性、稳定性及靶向性等。每种制备方法都有自身的优点和缺点,因此需要确定和优化最合适的方法来用于多酚的递送。将多种方法结合来制备出性能品质更加优良的食品是凝胶载体,比如尺寸均匀,载药稳定,包埋率高等。食品水凝胶可以通过改善多酚的溶解性、提高多酚的稳定性以及促进多酚的吸收等方面来增强多酚的生物利用度。
但是,在设计和应用食品水凝胶递送系统时,仍存在许多挑战,目前研究还只局限于实验室,还没有大规模的用于生产。食品水凝胶中的多酚在胃肠道中的稳定性以及在特定区域内定向释放和被吸收的能力还需要得到进一步证明。因此还需要开发新的制备方法,开发新的材料,更多地开展细胞实验和完整的动物实验,探究食品水凝胶递送体系的稳定性、释放吸收特性以及最终多酚的利用程度等方面,并评价其安全性,最后进行人体实验探究其有效性及安全性,这样方可应用于食品医药工业。
[1] HERN NDEZ-GONZ
NDEZ-GONZ LEZ A C,TÉLLEZ-JURADO L,RODR
LEZ A C,TÉLLEZ-JURADO L,RODR G-UEZ-LORENZO L M.Alginate hydrogels for bone tissue engineering,from injectables to bioprinting:A review[J].Carbohydrate Polymers,2020,229:115514.
G-UEZ-LORENZO L M.Alginate hydrogels for bone tissue engineering,from injectables to bioprinting:A review[J].Carbohydrate Polymers,2020,229:115514.
[2] JOHNS M A,BERNARDES A,DE ![]() E R,et al.On the subtle tuneability of cellulose hydrogels:implications for binding of biomolecules demonstrated for CBM 1[J].Journal of Materials Chemistry B,2017,5(21):3 879-3 887.
E R,et al.On the subtle tuneability of cellulose hydrogels:implications for binding of biomolecules demonstrated for CBM 1[J].Journal of Materials Chemistry B,2017,5(21):3 879-3 887.
[3] LI R W,LIN Z,ZHANG Q,et al.Injectable and in situ-formable thiolated chitosan-coated liposomal hydrogels as curcumin carriers for prevention of in vivo breast cancer recurrence[J].ACS Applied Materials & Interfaces,2020,12(15):17 936-17 948.
[4] WANG H Y,JIANG L M,WU H H,et al.Biocompatible iodine-starch-alginate hydrogel for tumor photothermal therapy[J].ACS Biomaterials Science & Engineering,2019,5(7):3 654-3 662.
[5] KAZEMI-TASKOOH Z,VARIDI M.Designation and characterization of cold-set whey protein-gellan gum hydrogel for iron entrapment[J].Food Hydrocolloids,2021,111:106205.
[6] LIU F G,LI R R,MAO L K,et al.Ethanol-induced composite hydrogel based on propylene glycol alginate and zein:formation,characterization and application[J].Food Chemistry,2018,255:390-398.
[7] KLEEMANN C,SELMER I,SMIRNOVA I,et al.Tailor made protein based aerogel particles from egg white protein,whey protein isolate and sodium caseinate:Influence of the preceding hydrogel characteristics[J].Food Hydrocolloids,2018,83:365-374.
[8] HOMYAK C C,FERNANDEZ A,TOUVE M A,et al.Lipogels for encapsulation of hydrophilic proteins and hydrophobic small molecules[J].Biomacromolecules,2018,19(1):132-140.
[9] KRIWET B,WALTER E,KISSEL T.Synthesis of bioadhesive poly(acrylic acid) nano-and microparticles using an inverse emulsion polymerization method for the entrapment of hydrophilic drug candidates[J].Journal of Controlled Release,1998,56(1-3):149-158.
[10] YANG C H,WANG M X,HAIDER H,et al.Strengthening alginate/polyacrylamide hydrogels using various multivalent cations[J].ACS Applied Materials & Interfaces,2013,5(21):10 418-10 422.
[11] 高珊.聚乙二醇基水凝胶及复合凝胶的制备与研究[D].大连:大连海事大学,2017.
GAO S.Preparation and research of polyethylene glycol(PEG)hydrogels and composite gel[D].Dalian:Dalian Maritime University,2017.
[12] ARAIZA-CALAHORRA A,AKHTAR M,SARKAR A,et al.Recent advances in emulsion-based delivery approaches for curcumin:From encapsulation to bioaccessibility[J].Trends in Food Science and Technology,2018,71:155-169.
[13] HU X Y,WANG Y M,ZHANG L L,et al.Construction of self-assembled polyelectrolyte complex hydrogel based on oppositely charged polysaccharides for sustained delivery of green tea polyphenols[J].Food Chemistry,2020,306:125632.
[14] MCCLEMENTS D J.Advances in nanoparticle and microparticle delivery systems for increasing the dispersibility,stability,and bioactivity of phytochemicals[J].Biotechnology Advances,2020,38:107287.
[15] NORTON J E,GONZALEZ ESPINOSA Y,WATSON R L,et al.Functional food microstructures for macronutrient release and delivery[J].Food & Function,2015,6(3):663-678.
[16] TUOHY K M,CONTERNO L,GASPEROTTI M,et al.Up-regulating the human intestinal microbiome using whole plant foods,polyphenols,and/or fiber[J].Journal of Agricultural and Food Chemistry,2012,60(36):8 776-8 782.
[17] SUHAIL M,ROSENHOLM J M,MINHAS M U,et al.Nanogels as drug-delivery systems:A comprehensive overview[J].Therapeutic Delivery,2019,10(11):697-717.
[18] MCCLEMENTS D J.Recent progress in hydrogel delivery systems for improving nutraceutical bioavailability[J].Food Hydrocolloids,2017,68:238-245.
[19] GEORGE M,ABRAHAM T E.Polyionic hydrocolloids for the intestinal delivery of protein drugs:Alginate and chitosan—A review[J].Journal of Controlled Release,2006,114(1):1-14.
[20] ![]()
![]() A,DRVENICA I,et al.Calcium-alginate-inulin microbeads as carriers for aqueous carqueja extract [J].Journal of Food Science,2016,81(1):E65-E67.
A,DRVENICA I,et al.Calcium-alginate-inulin microbeads as carriers for aqueous carqueja extract [J].Journal of Food Science,2016,81(1):E65-E67.
[21] EICHENBAUM G M,KISER P F,DOBRYNIN A V,et al.Investigation of the swelling response and loading of ionic microgels with drugs and proteins:the dependence on cross-link density[J].Macromolecules,1999,32(15):4 867-4 878.
[22] WEI P J,SONG R M,CHEN C,et al.A pH-responsive molecularly imprinted hydrogel for dexamethasone release[J].Journal of Inorganic and Organometallic Polymers and Materials,2019,29(3):659-666.
[23] GEORGE D,MAHESWARI P U,BEGUM K M M S.Chitosan-cellulose hydrogel conjugated with L-histidine and zinc oxide nanoparticles for sustained drug delivery:Kinetics and in-vitro biological studies[J].Carbohydrate Polymers,2020,236:116101.
[24] VALLS R-M,LLAURAD E,FERN
E,FERN NDEZ-CASTILLEJO S,et al.Effects of low molecular weight procyanidin rich extract from French maritime pine bark on cardiovascular disease risk factors in stage-1 hypertensive subjects:randomized,double-blind,crossover,placebo-controlled intervention trial[J].Phytomedicine,2016,23(12):1 451-1 461.
NDEZ-CASTILLEJO S,et al.Effects of low molecular weight procyanidin rich extract from French maritime pine bark on cardiovascular disease risk factors in stage-1 hypertensive subjects:randomized,double-blind,crossover,placebo-controlled intervention trial[J].Phytomedicine,2016,23(12):1 451-1 461.
[25] BUREY P,BHANDARI B R,HOWES T,et al.Hydrocolloid gel particles:Formation,characterization,and application[J].Critical Reviews in Food Science and Nutrition,2008,48(5):361-377.
[26] SHEWAN H M,STOKES J R.Review of techniques to manufacture micro-hydrogel particles for the food industry and their applications[J].Journal of Food Engineering,2013,119(4):781-792.
[27] SUNG M R,XIAO H,DECKER E A,et al.Fabrication,characterization and properties of filled hydrogel particles formed by the emulsion-template method[J].Journal of Food Engineering,2015,155:16-21.
[28] MATALANIS A,JONES O G,MCCLEMENTS D J.Structured biopolymer-based delivery systems for encapsulation,protection,and release of lipophilic compounds[J].Food Hydrocolloids,2011,25(8):1 865-1 880.
[29] JOYE I J,MCCLEMENTS D J.Production of nanoparticles by anti-solvent precipitation for use in food systems[J].Trends in Food Science and Technology,2013,34(2):109-123.
![]() V,et al.Encapsulation of polyphenolic antioxidants from medicinal plant extracts in alginate-chitosan system enhanced with ascorbic acid by electrostatic extrusion[J].Food Research International,2011,44(4):1 094-1 101.
V,et al.Encapsulation of polyphenolic antioxidants from medicinal plant extracts in alginate-chitosan system enhanced with ascorbic acid by electrostatic extrusion[J].Food Research International,2011,44(4):1 094-1 101.
[31] ZEEB B,SABERI A H,WEISS,et al.Formation and characterization of filled hydrogel beads based on calcium alginate:Factors influencing nanoemulsion retention and release[J].Food Hydrocolloids,2015,50:27-36.
[32] KAVOUSI H R,FATHI M,GOLI S A H.Novel cress seed mucilage and sodium caseinate microparticles for encapsulation of curcumin:An approach for controlled release[J].Food and Bioproducts Processing,2018,110:126-135.
[33] WEI H L,LI W K,CHEN H L,et al.Simultaneous Diels-Alder click reaction and starch hydrogel microsphere production via spray drying[J].Carbohydrate Polymers,2020,241:116351.
[34] SADEGHI S,MADADLOU A,YARMAND M.Microemulsification-cold gelation of whey proteins for nanoencapsulation of date palm pit extract[J].Food Hydrocolloids,2014,35:590-596.
[35] DIEZ M,SCHULTE V A,STEFANONI F,et al.Molding micropatterns of elasticity on peg-based hydrogels to control cell adhesion and migration[J].Advanced Engineering Materials,2011,13(10):B395-B404.
[36] JOYE I J,MCCLEMENTS D J.Biopolymer-based nanoparticles and microparticles:Fabrication,characterization,and application [J].Current Opinion in Colloid & Interface Science,2014,19(5):417-427.
[37] MOHAMMADIAN M,SALAMI M,MOMEN S M,et al.Fabrication of curcumin-loaded whey protein microgels:structural properties,antioxidant activity,and in vitro release behavior[J].LWT-Food Science and Technology,2019,103:94-100.
[38] LAVELLI V,SRI HARSHA P S C.Microencapsulation of grape skin phenolics for pH controlled release of antiglycation agents[J].Food Research International,2019,119:822-828.
[39] DE MOURA S C S R,BERLING C L,GERMER S P M,et al.Encapsulating anthocyanins from Hibiscus sabdariffa L.calyces by ionic gelation:Pigment stability during storage of microparticles[J].Food Chemistry,2018,241:317-327.
[40] FENG R,WANG L,ZHOU P,et al.Development of the pH responsive chitosan-alginate based microgel for encapsulation of Jughans regia L.polyphenols under simulated gastrointestinal digestion in vitro[J].Carbohydrate Polymers,2020,250:116917.
[41] 赵新. 微乳液-多糖超分子自组装多酚载体[D].济南:山东师范大学,2019.
ZHAO X.Microemulsion-polysaccharide supramolecular self-assembled polyphenol carrier[D].Jinan:Shandong Normal University,2019.
[42] DOOSTI M,SEYED DORRAJI M S,MOUSAVI S N,et al.Enhancing quercetin bioavailability by super paramagnetic starch-based hydrogel grafted with fumaric acid:An in vitro and in vivo study[J].Colloids and Surfaces B:Biointerfaces,2019,183:110487.
[43] GAO S,HU M.Bioavailability challenges associated with development of anti-cancer phenolics[J].Mini-Reviews in Medicinal Chemistry,2010,10(6):550-567.
[44] HUANG J,WANG Q,CHU L L,et al.Liposome-chitosan hydrogel bead delivery system for the encapsulation of linseed oil and quercetin:Preparation and in vitro characterization studies[J].LWT-Food Science and Technology,2020,117:108615.
[45] HE Z Y,XU M Z,ZENG M M,et al.Interactions of milk α-and β-casein with malvidin-3-O-glucoside and their effects on the stability of grape skin anthocyanin extracts[J].Food Chemistry,2016,199:314-322.
[46] LANG Y X,LI E H,MENG X J,et al.Protective effects of bovine serum albumin on blueberry anthocyanins under illumination conditions and their mechanism analysis[J].Food Research International,2019,122:487-495.
[47] YAO M F,MCCLEMENTS D J,XIAO H.Improving oral bioavailability of nutraceuticals by engineered nanoparticle-based delivery systems[J].Current Opinion in Food Science,2015,2:14-19.
[48] BAO C,JIANG P,CHAI J J,et al.The delivery of sensitive food bioactive ingredients:Absorption mechanisms,influencing factors,encapsulation techniques and evaluation models[J].Food Research International,2019,120:130-140.
[49] DI COLO G,ZAMBITO Y,ZAINO C.Polymeric enhancers of mucosal epithelia permeability:Synthesis,transepithelial penetration-enhancing properties,mechanism of action,safety issues[J].Journal of Pharmaceutical Sciences,2008,97(5):1 652-1 680.