活性羰基化合物(reactive carbonyl species,RCS)是一类活泼小分子,含有一个或多个羰基[1]。常见RCS主要包括乙二醛(glyoxal,GO)、甲基乙二醛(methylglyoxal,MGO)、丙烯醛(acrolein,ACR)、巴豆醛(crotonaldehyde,CRO)、糠醛(furfural,FUR)、4-羟基壬烯醛及5-羟甲基-2-糠醛等。这些RCS被人体摄入后会通过消化道、呼吸道、皮肤黏膜等产生危害,如能通过迈克尔加成反应(Michael addition reaction)或席夫碱反应(Schiff base reaction)与蛋白质、核酸、磷脂的亲核位点发生共价结合,导致细胞毒性和致突变性。研究表明,RCS体内动态平衡浓度增加源于氧化应激,而活性氧体内动态平衡浓度增加也是羰基应激的结果,两者相互影响,相互增加,形成恶性循环。而由于RCS相对于活性氧自由基而言更为稳定,其对人体危害也更高。常见慢性疾病如糖尿病、阿尔茨海默氏病、尿毒症[2]等均与RCS相关。RCS来源之一为日常膳食,包括未加工产品如水果、蔬菜、鸡蛋、鱼类和肉类,以及在食品加工中通过碳水化合物和氨基酸的热降解,还原糖和蛋白质的美拉德反应及糖自身的焦糖化反应、脂质过氧化反应和微生物代谢发酵等反应形成[3],常见加工食品如奶酪、酒精饮料、甜甜圈、炸薯条等均含有RCS,相关报道呈逐年递增之势。
目前,国内外研究已经报道了RCS存在于各类酒品中,如白酒、葡萄酒、啤酒、果酒等。在啤酒加工过程中,RCS不仅产生于煮沸和发酵阶段,在啤酒储存老化过程中发生的美拉德反应也会产生RCS;而葡萄酒在原料的浸渍、发酵过程,以及成品的贮藏过程中均有RCS产生,葡萄成熟度越高、浸渍时间越长,葡萄酒中RCS含量越多[4]。啤酒、果酒等酒的加工工艺虽未经蒸馏,但其在糖化煮沸和发酵过程中产生一定量的RCS并存于酒体中。而白酒为蒸馏酒,在蒸馏过程中这些易挥发的RCS一并带入酒体。我国的白酒在酿造过程中均涉及到发酵和高温馏酒等步骤,除此之外,酱香型白酒和兼香型白酒的高温制曲,清香型白酒的高温润糁,凤香型白酒的潮火、大火和后火以及豉香型白酒的肉埕陈酿等步骤,均能产生一定量的RCS,如MGO,GO,ACR,FUR等[5]。由于RCS分子量较小,极性强,极易与乙醇、水混溶,因而长期存在于酒类产品中。
我国酿酒文化历史悠久,酒类产品中的RCS与饮食中的RCS含量的叠加,大大增加了由饮食摄入RCS的量,这类物质在体内的积聚给人体健康带来威胁。因此酒类产品的质量安全状况与我国人民的生命健康息息相关,这使得对酒类产品中RCS的研究愈发重要。
1 酒中RCS的种类和来源
1.1 GO
1.1.1 GO的理化性质和毒性
GO是一种α-氧代醛,室温下为液体,熔点约为15 ℃,通常以水合低聚物的形式存在于水溶液中(GO含量为30%~50%),属于高反应活性的糖基化因子,其能够破坏人体中的核苷酸结构,从而抑制细胞中DNA的合成,引发DNA的病变[6]。大鼠的GO经口半数致死量(median lethal dose,LD50)为606 mg/kg。此外,GO能够与蛋白质发生糖化反应,引发蛋白质功能的紊乱,一些如阿尔兹海默症、白内障和动脉粥样硬化等慢性疾病均与GO息息相关[7],GO也是引起高血糖和糖尿病的原因之一,有研究表明,GO还具有细胞毒性,其细胞半致死浓度为(3.6±0.1) mmol/L[8]。
1.1.2 GO在酒类产品中的来源及含量
据文献报道,GO存在于多种酒精饮料中,主要源自酿酒酵母的发酵及酿酒原料在制酒中发生的美拉德反应和油脂氧化等[9]。RODR GUEZ-C
GUEZ-C CERES等[10]发现鲜酿啤酒中的GO质量浓度为2.8~6.5 mg/L。而经过陈酿后啤酒中GO的质量浓度上升至(28.6±0.2) mg/L[9]。另外,不同种麦芽(浅色麦芽、深色麦芽、煮沸的麦芽和烘焙的麦芽)酿造啤酒中GO的含量差别非常大,变化范围为0.464~70.180 mg/kg[11]。不同品种的葡萄酒,GO含量也存在区别,白葡萄酒、红葡萄酒及酒精加强型葡萄酒中的GO含量分别为2.15~12.72、4.34~15.54和15.30~28.63 mg/L,酒精加强型葡萄酒中GO含量远高于白、红葡萄酒,同时,随着贮存时间的增加,3种葡萄酒中的GO含量随之增加[12]。陈年酒精加强型葡萄酒中GO含量甚至是新鲜酒精加强型葡萄酒的6倍以上[13]。果酒中GO含量可在3.43~60.48 mg/L范围内浮动[14],不同种类果酒中GO含量差异极大,其原因尚有待深入探讨。我们前期测定了国内不同香型白酒(浓香型、清香型、酱香型等12种香型)中GO的含量,为0.02~0.49 mg/L,与啤酒、葡萄酒和果酒等酒类相比较而言,白酒中GO含量较低。
CERES等[10]发现鲜酿啤酒中的GO质量浓度为2.8~6.5 mg/L。而经过陈酿后啤酒中GO的质量浓度上升至(28.6±0.2) mg/L[9]。另外,不同种麦芽(浅色麦芽、深色麦芽、煮沸的麦芽和烘焙的麦芽)酿造啤酒中GO的含量差别非常大,变化范围为0.464~70.180 mg/kg[11]。不同品种的葡萄酒,GO含量也存在区别,白葡萄酒、红葡萄酒及酒精加强型葡萄酒中的GO含量分别为2.15~12.72、4.34~15.54和15.30~28.63 mg/L,酒精加强型葡萄酒中GO含量远高于白、红葡萄酒,同时,随着贮存时间的增加,3种葡萄酒中的GO含量随之增加[12]。陈年酒精加强型葡萄酒中GO含量甚至是新鲜酒精加强型葡萄酒的6倍以上[13]。果酒中GO含量可在3.43~60.48 mg/L范围内浮动[14],不同种类果酒中GO含量差异极大,其原因尚有待深入探讨。我们前期测定了国内不同香型白酒(浓香型、清香型、酱香型等12种香型)中GO的含量,为0.02~0.49 mg/L,与啤酒、葡萄酒和果酒等酒类相比较而言,白酒中GO含量较低。
1.2 MGO
1.2.1 MGO的理化性质和毒性
MGO又称丙酮醛,为2-氧代丙醛,黄色或黄棕色透明液体,有辛辣气味。2017年10月,世界卫生组织国际癌症研究机构将MGO列在Ⅲ类致癌物的清单中。大鼠MGO的LD50为531 mg/kg。在体内,MGO能够引发线粒体功能紊乱,与蛋白质发生不可逆的反应,形成非酶糖基化终产物,与糖尿病并发症、衰老、尿毒症等疾病息息相关[16]。此外,体内、外实验表明,由于MGO能够使一些癌基因和抑癌基因的表达发生改变,因此蓄积大量MGO存在致癌风险[17]。
1.2.2 MGO在酒类产品中的来源及含量
MGO与GO常常共存于酒类产品中,主要来源于酒中糖酵解、微生物发酵等步骤[18],常常随着酒类产品放置时间的延长而增加,在啤酒陈酿过程中MGO含量由544.0 μg/L增加到662.4 μg/L,增加量超20%。CHATTERJEE等[19]使用同种方法测定了购自当地市场的啤酒、白葡萄酒和红葡萄酒中MGO的含量,分别为1.75~3.52、31.46~23.92和9.41~12.38 μmol/L,其中啤酒中MGO的含量远低于葡萄酒,而红葡萄酒和白葡萄酒中MGO含量存在显著性差异。JEONG等[14]则统计了韩国玛格丽米酒(64种)、啤酒(31种)、果酒(24种)和韩国清州黄酒(10种)中MGO的含量,玛格丽米酒、啤酒、果酒和清州黄酒含量分别为:0.42~27.00、1.44~8.41、1.79~78.13和4.18~58.64 μg/g,依然是啤酒含量最低,其中果酒的MGO含量上限最高差异也最大,可能与果酒中高糖含量有关,因为糖酵解是MGO来源之一。虽然米酒和啤酒中MGO含量低于果酒,但因韩国米酒和啤酒的人均摄入量远高于果酒的人均摄入量,因此从米酒或啤酒中摄入的MGO需高度重视,按照MGO最高含量并根据日摄入量得,韩国每人每天可从米酒和啤酒中摄入33.45和49.14 μg/kg 体重的MGO。此外,我们前期测定了12种不同香型的白酒中的MGO含量为0.03~0.96 mg/L,其中酱香型白酒中MGO含量最高,而豉香型白酒中MGO含量最低。相比较而言,白酒中MGO的含量低于葡萄酒、果酒和啤酒。
1.3 ACR
1.3.1 ACR的理化性质和毒性
作为最简单的α,β-不饱和醛,ACR是一种无色或淡黄色、易挥发、高度易燃、室温下具有高反应活性的液体。ACR有两个活性基团,即羰基(C![]() O)和乙烯基(C
O)和乙烯基(C![]() C),而其高反应活性正来源于这两个基团的共轭。两个活性基团能够发生Diels-Alder缩合、二聚化聚合、迈克尔加成等反应,与蛋白质、核酸等亲和分子发生亲核反应,直接导致大分子的重排和键合[20]。ACR由于其具强烈的毒性,被世界卫生组织国际癌症研究机构列为Ⅲ类致癌物,有急性毒性实验结果表明,兔子、小鼠和大鼠ACR的LD50为7~46 mg/kg[21]。据文献报道,动脉粥样硬化、阿尔兹海默症、急性肺损伤、膀胱癌等均与ACR密切相关[22]。
C),而其高反应活性正来源于这两个基团的共轭。两个活性基团能够发生Diels-Alder缩合、二聚化聚合、迈克尔加成等反应,与蛋白质、核酸等亲和分子发生亲核反应,直接导致大分子的重排和键合[20]。ACR由于其具强烈的毒性,被世界卫生组织国际癌症研究机构列为Ⅲ类致癌物,有急性毒性实验结果表明,兔子、小鼠和大鼠ACR的LD50为7~46 mg/kg[21]。据文献报道,动脉粥样硬化、阿尔兹海默症、急性肺损伤、膀胱癌等均与ACR密切相关[22]。
1.3.2 ACR在酒类产品中的来源及含量
ACR存在于各种酒中,其主要由3-羟基丙醛(3-hydroxypropionaldehyde,3-HPA)脱水生成,而3-HPA主要由甘油(酒精发酵过程中酵母作用的第三大产物,含量仅次于乙醇和二氧化碳),在克雷伯杆菌属(Klebsiella),柠檬酸杆菌属(Citrobacter)和乳杆菌属(Lactobacillus)等微生物内,被辅酶B12与甘油脱水酶转化而成,而这种转化在低pH的酒精饮料(如葡萄酒)和涉及高温加工的酒精饮料(如利口酒)的高温蒸馏中更易发生[23]。HERNANDES等[24]针对9种啤酒进行研究,检测到ACR的含量为0.3~2.5 μg/L,ACR含量相对较低。LEDAUPHIN等[25]则测定了自制新鲜蒸馏获得的苹果白兰地酒中ACR的含量,为0.7~5.2 mg/L,随着酒放置时间的延长,ACR的含量有所下降,而市售苹果白兰地酒ACR检测为0.6 mg/L。FERRIRA等[26]分析了Campanha Gaùcha地区市售20种葡萄酒,其中50%的葡萄酒中测出ACR,其含量为1~29.8 μg/L,根据风险评估计算,男性每日饮用300 mL该地区的葡萄酒,其包含的ACR就可能会对健康造成威胁。针对我国白酒,我们实验室前期测定了12种不同香型的白酒中ACR的含量,约为0.13~0.61 mg/L,不同香型白酒的ACR含量差异相对较小,不同产地的白酒中ACR的含量相比,江苏省的白酒ACR含量相对较高。
1.4 FUR
1.4.1 FUR的理化性质和毒性
FUR又名呋喃甲醛,常温下为无色透明油状液体,其包含一个呋喃杂环和一个醛基官能团。早在1978年,FUR就被证明能够诱导DNA突变[27],同时,其还被证明与小鼠肝脏肿瘤的形成和肺组织损伤密切相关,具有细胞毒性作用[28],其大鼠口服的LD50为50~127 mg/kg,为高毒物质。2017年10月,世界卫生组织国际癌症研究机构将FUR列为Ⅲ类致癌物。
1.4.2 FUR在酒类产品中的来源及含量
FUR是酒类产品中含有的重要醛类之一,主要由戊聚糖在酸性条件下水解成戊糖,再脱水环化而成,或由酵母发酵产生。酒精饮料中的FUR还可能是在浸渍和陈酿过程中,木桶热处理时半纤维素等成分被降解为戊糖进而脱水生成[29],FUR含量也受木桶材质类型和加热条件影响,在不同的木桶中酿造红葡萄酒或白葡萄酒时,FUR含量可在0~135.2 μg/L区间内变化[30]。虽然FUR能够赋予酒类产品的异香,但浓度过大时不仅会呈现严重的辣味甚至焦苦味还会对人体健康造成威胁。对于啤酒而言,FUR常常被认为是啤酒老化的重要标志,随着啤酒老化,FUR常常呈线性增加的趋势。新鲜啤酒中FUR约为40 mg/L,而陈酿啤酒中FUR含量达到200 mg/L,是新鲜啤酒的5倍之多[31]。蒸馏酒中含有一定的FUR,如波本威士忌、鸡尾酒等,含量为12.4、2.06 mg/L,其他酒精饮料如咖啡酒、樱桃酒、杏仁酒中也含有一定的FUR,含量分别为24.1、4.44和5.09 mg/L[32]。在中国白酒中,FUR的浓度与白酒香型相关,一般而言,酱香型白酒FUR含量较高而清香型白酒FUR含量较低。许汉英[33]发现FUR含量与不同香型白酒发酵时间和发酵温度呈正相关,而酱香型白酒因其发酵时间长,发酵温度高,使得酒中FUR含量较高,这也使得FUR成为酱香型白酒的一个标志组分。虽然FUR对白酒的醇香具有一定的贡献,然而,作为对人体明显有害的醛类化合物,目前尚未有相关标准对FUR含量进行限定。过高含量的FUR具致癌性、致突变性、细胞毒性等,研究表明当FUR质量浓度为30 mg/kg时,有40.3%的大鼠胎鼠的内脏畸变,而当FUR质量浓度达60 mg/kg时,有6.02%小鼠精子发生畸变[34]。相关预警和含量监控需要提上议程。
1.5 CRO
1.5.1 CRO的理化性质和毒性
CRO为无色或略带黄色的液体,可燃,具有催泪性和氧化性。其作为ACR的同源物,具有高毒性,大鼠口服急性毒性的LD50为80 mg/kg,而小鼠口服的急性毒性的LD50为104 mg/kg,且大鼠、小鼠口服后出现胃溃疡、坏死等症状[35]。CRO进入体内后,能够刺激呼吸系统,引起鼻腔急性炎症的同时对肺造成损害[36],同时其能降低细胞活力并诱导细胞自噬,导致细胞凋亡。此外,CRO还有致突变性、致瘤和致癌性[37]。
1.5.2 CRO在酒类产品中的来源及含量
CRO同样主要来源于美拉德反应,目前报道的啤酒中的CRO含量较低,约为0.107 mg/L。在朗姆酒制作过程中,原料甘蔗汁的加热、预浓缩、发酵和老化等多个加工过程中均会形成CRO,含量因制作方式的不同而不同,约为7.19~18.7 mg/L[38]。我们前期检测发现在不同香型的白酒中CRO含量也不同,其范围为0.12~9.52 mg/L,其中豉香型白酒CRO含量最低,而酱香型白酒CRO含量最高,同时,我们还发现贵州省生产的白酒CRO平均含量最高,为7 mg/L。因此,白酒中CRO含量需引起重视。
2 白酒中RCS检测方法
2.1 气相色谱法(GC)
气相色谱法主要利用试样中各组分在气相和固定液体相间的分配系数不同而进行测定,常用检测RCS的检测器主要为:氢离子火焰检测(flame ionization detector,FID)、电子捕获检测器(electron capture detector,ECD)、氮磷检测器(nitrogen phosphorus detector,NPD)和质谱(MS)。RCS类小分子化合物沸点低,易于挥发,为能够有效分离,常采用衍生化预处理,常用的气相色谱法的衍生化试剂包括:1,2-二氨基苯(o-phenylenediamine,DB),N-甲基肼(mono methylhydrazine,MMH),3-甲基苯丙噻唑酮肼(3-methyl-2-benzothiazolinonehydrazone hydrochlorid,MBTH)、2,2,2-三氟乙基肼(2,2,2-trifluoroethyl hydrazine,TFEH),邻-(2,3,4,5,6-五氟苄基)羟胺盐酸盐[o-(2,3,4,5,6-pentafluorobenzyl)hydroxylamine,PFBHA]、邻五氟苯基肼(2,3,4,5,6-pentafluorophenyl hydrazine,PFPH)等。常见酒精产品中RCS的气相检测方法见表1。
表1 酒类产品中RCS的气相检测方法
Table 1 Gas chromatography detection methods of RCS in alcoholic products
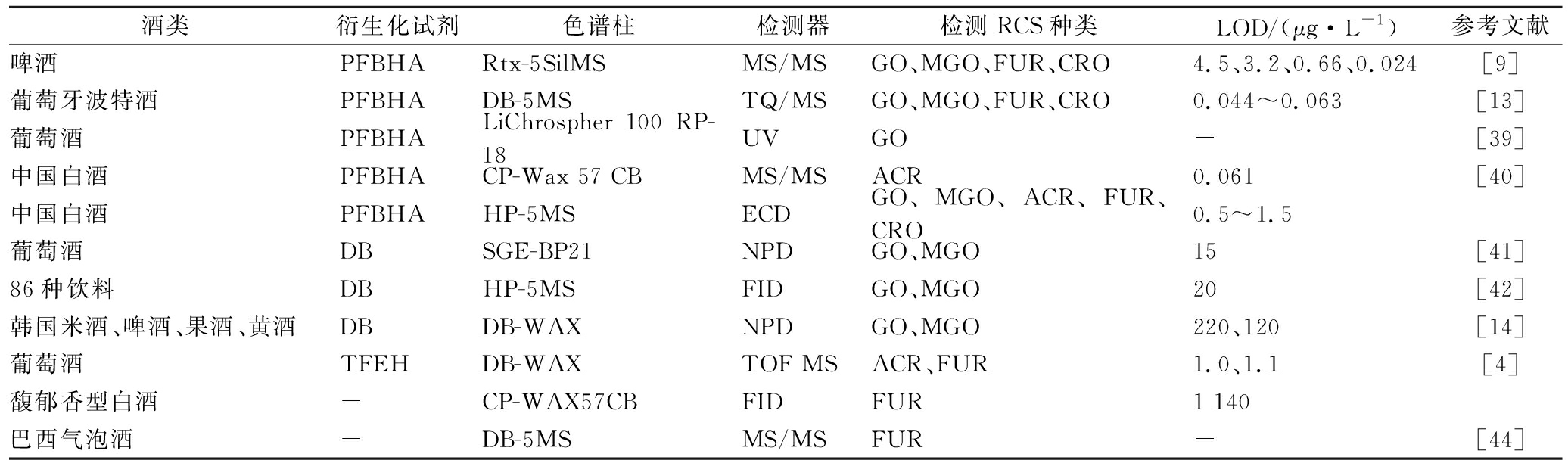
酒类衍生化试剂色谱柱检测器检测RCS种类LOD/(μg·L-1)参考文献啤酒PFBHARtx-5SilMSMS/MSGO、MGO、FUR、CRO4.5、3.2、0.66、0.024[9]葡萄牙波特酒PFBHADB-5MSTQ/MSGO、MGO、FUR、CRO0.044~0.063[13]葡萄酒PFBHALiChrospher 100 RP-18UVGO-[39]中国白酒PFBHACP-Wax 57 CBMS/MSACR0.061[40]中国白酒PFBHAHP-5MSECDGO、MGO、ACR、FUR、CRO0.5~1.5葡萄酒DBSGE-BP21NPDGO、MGO15[41]86种饮料DBHP-5MSFIDGO、MGO20[42]韩国米酒、啤酒、果酒、黄酒DBDB-WAXNPDGO、MGO220、120[14]葡萄酒TFEHDB-WAXTOF MSACR、FUR1.0、1.1[4]馥郁香型白酒-CP-WAX57CBFIDFUR1 140巴西气泡酒-DB-5MSMS/MSFUR-[44]
在气相色谱分析RCS中,衍生化试剂PFBHA使用范围最为广泛。已有使用PFBHA衍生化分析测定啤酒、波特酒、葡萄酒、中国白酒等酒类产品中RCS的检测方法,涉及包括GO、MGO、ACR、FUR和CRO在内的多种RCS。MS/MS、UV、ECD三种检测器均适用于PFBHA衍生物的检测,检测限(limit of detection,LOD)均较低,最低甚至可达0.024 μg/L。其次,DB主要作为测定GO、MGO的衍生化试剂,NPD和FID均能用于DB衍生化物的测定,然而,到目前为止,以DB为衍生化试剂测定GO、MGO的LOD较PFBHA高,检测精度不及PFBHA。其他如OPD也可作为酒类产品中GO、MGO的衍生化试剂,然而其LOD为220和120 μg/L[14],为DB的10倍,检测准确度远不及DB和PFBHA,更准确的方法有待开发。
样品的衍生化预处理常受到反应条件限制和基质干扰,同时使得测定方法繁琐、耗时、增加成本。已有研究发现,FUR能够不衍生化直接测定。FID和MS/MS均可作为检测器,然而LOD为1 140 μg/L,较使用衍生化试剂高约10~100倍。
以上研究均采用气相色谱法,在分析醛类风味物质的同时将部分RCS检出或单一测定某种RCS。目前针对酒中多种RCS同步检测的专用方法,尚缺乏相关研究,我们前期报道了采用GC-ECD 同步测定12种醛类,包括5种RCS的方法,操作便捷,方法灵敏度高,不同RCS均能在色谱上基线分离,LOD<2 ng/mL。
2.2 液相色谱法(LC)
高效液相色谱法不通过汽化加热直接进样,有利于热敏性物质的检测,同样用于酒类产品的检测。液相色谱法测定RCS通常采用二极管阵列检测器(PDA/DAD)、荧光检测器(UV)、质谱(MS)。由于RCS多为小分子极性化合物,有挥发性,且有较强的亲水性,使得其在色谱柱中常常不保留地流出,同时,其缺少显色基团,没有可离子化的官能团,难以直接采用色谱法分析,因此样品通常要进行衍生化处理,常用的衍生化试剂主要包括:DB、亚硫酸氢盐、2,4-二硝基苯肼(2,4-dinitrophenylhydrazine,DNPH)、N-丙基-4-肼基-1,8-萘酰亚胺(N-propyl-4-hydrazino-1,8-naphthalimide,NPHNA)、4-(2,3-二甲基-6-喹喔啉基)-1,2-苯二胺[4-(2,3-dimethyl-6-quinoxalinyl)-1,2-benzenediamine,DQB]、3,4-二氨基吡啶(3,4-diaminopyridine,3,4-DAP)等。常见酒精产品中RCS的液相检测方法见表2。
表2 酒类产品中RCS的液相检测方法
Table 2 Liquid chromatography detection methods of RCS in alcoholic products
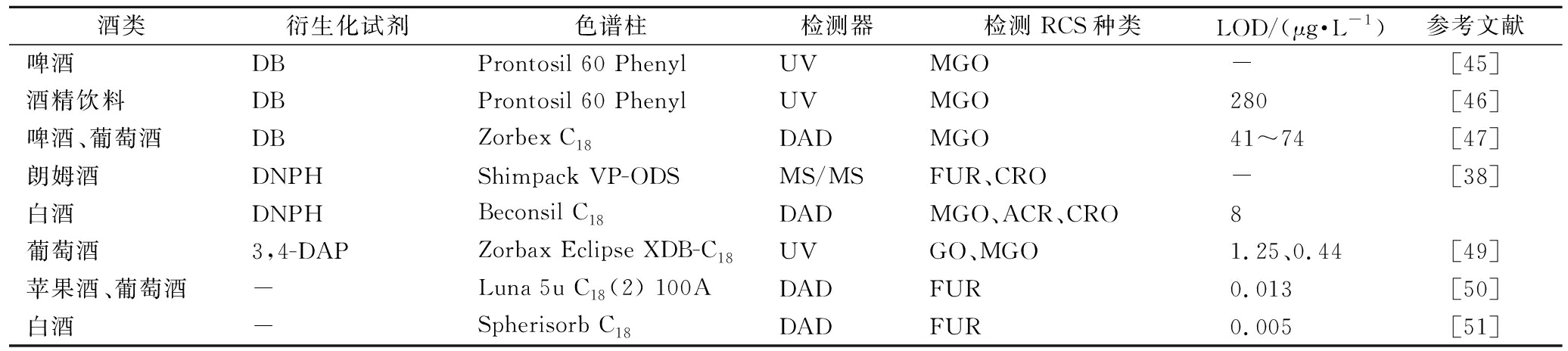
酒类衍生化试剂色谱柱检测器检测RCS种类LOD/(μg·L-1)参考文献啤酒DBProntosil 60 PhenylUVMGO-[45]酒精饮料DBProntosil 60 PhenylUVMGO280[46]啤酒、葡萄酒DBZorbex C18DADMGO41~74[47]朗姆酒DNPHShimpack VP-ODSMS/MSFUR、CRO-[38]白酒DNPHBeconsil C18DADMGO、ACR、CRO8葡萄酒3,4-DAPZorbax Eclipse XDB-C18UVGO、MGO1.25、0.44[49]苹果酒、葡萄酒-Luna 5u C18 (2) 100ADADFUR0.013[50]白酒-Spherisorb C18DADFUR0.005[51]
在液相色谱分析RCS方法中,DB可以同时作为气相色谱和液相色谱法测定MGO的衍生化试剂。UV和DAD均可作为DB衍生化物的检测器,在使用液相色谱测定中,DB-MGO衍生化物的LOD为41 μg/L,LOD较使用气相检测高,不及气相灵敏、稳定。除DB外,DNPH也常常用于RCS检测,其更适用于测定不同种类的RCS如MGO、ACR、FUR和CRO等,检测限较低,检测准确度高。此外,3,4-DAP与GO、MGO的衍生化反应也能用作葡萄酒中RCS含量测定的前处理。同气相检测相似,FUR同样可以不通过衍生化预处理直接使用HPLC分析,已有研究以DAD为液相检测器,以C18柱为色谱柱,直接进样检测了苹果酒、葡萄酒和白酒中的FUR,其LOD 0.013和0.005 μg/L较低,检测灵敏度甚至高于使用衍生化试剂检测FUR。
目前采用HPLC方法同时测定多种RCS的方法较少,即使使用衍生化试剂,由于RCS分子量相近,通常使用LC-DAD很难实现基线分离。有关液相同步测定多种RCS的方法尚有待进一步开发。
3 结论
综上,本文针对白酒、啤酒、葡萄酒、果酒等酒类产品中多种RCS,包括MGO、GO、ACR、FUR、CRO等在加工中可能的来源、不同产品中存在的种类和含量,不同种RCS的危害性,以及常用的检测方法进行了概括和总结。为进一步控制RCS的含量,提高产品安全性,提供了理论基础。尽管目前针对RCS,尚未出台相关的检测标准和限量规定,但随着对RCS的危害、致病机理等研究的逐步深入,随着消费者食品安全的要求不断提高,监控酒类产品中RCS的含量,提升安全预警性,对酒类产业的健康发展具有重要的现实意义,同时对酒类酿造工艺的提升和改进也提出了新的研究方向和挑战。
[1] TIAN C J,ZHEN Z.Reactive carbonyl species:diabetic complication in the heart and lungs[J].Trends in Endocrinology & Metabolism,2019,30(8):546-556.
[2] HO C T,WANG M F.Dietary phenolics as reactive carbonyl scavengers:Potential impact on human health and mechanism of action[J].Journal of Traditional and Complementary Medicine,2013,3(3):139-141.
[3] ABRAHAM K,ANDRES S,PALAVINSKAS R,et al.Toxicology and risk assessment of acrolein in food[J].Molecular Nutrition & Food Research,2011,55(9):1 277-1 290.
[4] LAGO L O,NICOLLI K P,MARQUES A B,et al.Influence of ripeness and maceration of the grapes on levels of furan and carbonyl compounds in wine-Simultaneous quantitative determination and assessment of the exposure risk to these compounds[J].Food Chemistry,2017,230(1):594-603.
[5] VAN BOEKEL MAJS.Formation of flavour compounds in the Maillard reaction[J].Biotechnology Advances,2006,24(2):230-233.
[6] HIRAMOTO K,KIDO K,KIKUGAWA K.DNA breaking by Maillard products of glucose-amino acid mixtures formed in an aqueous system[J].Journal of Agricultural and Food Chemistry,1994,42(3):689-694.
[7] THORNALLEY P J.Glycation free adduct accumulation in renal disease:The new AGE[J].Pediatric Nephrology,2005,20(11):1 515-1 522.
[8] DAGLIA M,AMOROSO A,ROSSI D,et al.Identification and quantification of α-dicarbonyl compounds in balsamic and traditional balsamic vinegars and their cytotoxicity against human cells[J].Journal of Food Composition and Analysis,2013,31(1):67-74.
[9] SAISON D,DE SCHUTTER D P,DELVAUX F,et al.Determination of carbonyl compounds in beer by derivatisation and headspace solid-phase microextraction in combination with gas chromatography and mass spectrometry[J].Journal of Chromatography A,2009,1216(26):5 061-5 068.
[10] RODR GUEZ-C
GUEZ-C CERES M I,PALOMINO-VASCO M,MORA-DIEZ N,et al.Dispersive liquid-liquid microextraction for a rapid determination of glyoxal in alcoholic beverages[J].Talanta,2017,168(1):100-104.
CERES M I,PALOMINO-VASCO M,MORA-DIEZ N,et al.Dispersive liquid-liquid microextraction for a rapid determination of glyoxal in alcoholic beverages[J].Talanta,2017,168(1):100-104.
[11] HELLWIG M,HENLE T.Maillard reaction products in different types of brewing malt[J].Journal of Agricultural and Food Chemistry,2020,68(48):14 274-14 285.
[12] DA SILVA FERREIRA A C,REIS S,RODRIGUES C,et al.Simultaneous determination of ketoacids and dicarbonyl compounds,Key Maillard intermediates on the generation of aged wine aroma[J].Journal of Food Science,2007,72(5):S314-S318.
[13] MOREIRA N,ARA JO A M,ROGERSON F,et al.Development and optimization of a HS-SPME-GC-MS methodology to quantify volatile carbonyl compounds in port wines[J].Food Chemistry,2019,270(1):518-526.
JO A M,ROGERSON F,et al.Development and optimization of a HS-SPME-GC-MS methodology to quantify volatile carbonyl compounds in port wines[J].Food Chemistry,2019,270(1):518-526.
[14] JEONG J-H,CHA J,LEE K-G.Validation of analytical method for α-dicarbonyl compounds using gas chromatography-nitrogen phosphorous detector and their levels in alcoholic beverages[J].International Journal of Food Science & Technology,2017,52(6):1 491-1 497.
[15] 司波,袁雯雯,贾梦玮,等.气相色谱-电子捕获检测器法分析不同产地、不同香型白酒中活性羰基化合物[J].食品与发酵工业,2021,47(22):241-248.
SI B,YUAN W W,JIA M W,et al.Reactive carbonyl species in Chinese Baijiu from different origins and flavor types by gas chromatography-electron capture detector[J].Food and Fermentation Industries,2021,47(22):241-248.
[16] RABBANI N,THORNALLEY P J.Dicarbonyls linked to damage in the powerhouse:Glycation of mitochondrial proteins and oxidative stress[J].Biochemical Society Transactions,2008,36(Pt 5):1 045-1 050.
[17] NIYATI-SHIRKHODAEE F,SHIBAMOTO T.Gas chromatographic analysis of glyoxal and methylglyoxal formed from lipids and related compounds upon ultraviolet irradiation[J].Journal of Agricultural and Food Chemistry,1993,41(2):227-230.
[18] RODRIGUES J A,BARROS A A,RODRIGUES P G.Differential pulse polarographic determination of α-dicarbonyl compounds in foodstuffs after derivatization with o-phenylenediamine[J].Journal of Agricultural and Food Chemistry,1999,47(8):3 219-3 222.
[19] CHATTERJEE S,CHEN A C.Voltammetric detection of the α-dicarbonyl compound:Methylglyoxal as a flavoring agent in wine and beer[J].Analytica Chimica Acta,2012,751(2):66-70.
[20] OU J Y,ZHENG J,HUANG J Q,et al.Interaction of acrylamide,acrolein,and 5-hydroxymethylfurfural with amino acids and DNA[J].Journal of Agricultural and Food Chemistry,2020,68(18):5 039-5 048.
[21] FAROON O,RONEY N,TAYLOR J,et al.Acrolein health effects[J].Toxicology and Industrial Health,2008,24(7):447-490.
[22] BURCHAM P C.Acrolein and human disease:Untangling the knotty exposure scenarios accompanying several diverse disorders[J].Chemical Research in Toxicology,2017,30(1):145-161.
[23] BAUER R,COWAN D A,CROUCH A.Acrolein in wine:Importance of 3-hydroxypropionaldehyde and derivatives in production and detection[J].Journal of Agricultural and Food Chemistry,2010,58(6):3 243-3 250.
[24] HERNANDES K C,SOUZA-SILVA É A,ASSUMPÇ O C F,et al.Validation of an analytical method using HS-SPME-GC/MS-SIM to assess the exposure risk to carbonyl compounds and furan derivatives through beer consumption[J].Food Additives & Contaminants:Part A,2019,36(12):1 808-1 821.
O C F,et al.Validation of an analytical method using HS-SPME-GC/MS-SIM to assess the exposure risk to carbonyl compounds and furan derivatives through beer consumption[J].Food Additives & Contaminants:Part A,2019,36(12):1 808-1 821.
[25] LEDAUPHIN J,LEFRANCOIS A,MARQUET N,et al.Development of an accurate and sensitive gas chromatographic method for the determination of acrolein content in calvados and cider[J].LWT-Food Science and Technology,2006,39(9):1 045-1 052.
[26] FERREIRA D C,NICOLLI K P,SOUZA-SILVA É A,et al.Carbonyl compounds in different stages of vinification and exposure risk assessment through Merlot wine consumption[J].Food Additives & Contaminants:Part A,2018,35(12):2 315-2 331.
[27] ZDZIENICKA M,TUDEK ![]() M,et al.Mutagenic activity of furfural in Salmonella typhimurium TA100[J].Mutation Research,1978,58(2-3):205-209.
M,et al.Mutagenic activity of furfural in Salmonella typhimurium TA100[J].Mutation Research,1978,58(2-3):205-209.
[28] REYNOLDS S H,STOWERS S J,PATTERSON R M,et al.Activated oncogenes in B6C3F1 mouse liver tumors:Implications for risk assessment[J].Science,1987,237(4820):1 309-1 316.
[29] PERESTRELO R,RODRIGUEZ E,C MARA J S.Impact of storage time and temperature on furanic derivatives formation in wines using microextraction by packed sorbent tandem with ultrahigh pressure liquid chromatography[J].LWT-Food Science and Technology,2017,76:40-47.
MARA J S.Impact of storage time and temperature on furanic derivatives formation in wines using microextraction by packed sorbent tandem with ultrahigh pressure liquid chromatography[J].LWT-Food Science and Technology,2017,76:40-47.
[30] ![]() D,KLEJDUS B,MIKE
D,KLEJDUS B,MIKE O,et al.Application of solid-phase extraction for determination of phenolic compounds in barrique wines[J].Analytical and Bioanalytical Chemistry,2003,377(2):340-345.
O,et al.Application of solid-phase extraction for determination of phenolic compounds in barrique wines[J].Analytical and Bioanalytical Chemistry,2003,377(2):340-345.
[31] GUIDO L F,RODRIGUES P G,RODRIGUES J A,et al.The impact of the physiological condition of the pitching yeast on beer flavour stability:An industrial approach[J].Food Chemistry,2004,87(2):187-193.
[32] ALC ZAR A,JURADO J M,PABLOS F,et al.HPLC determination of 2-furaldehyde and 5-hydroxymethyl-2-furaldehyde in alcoholic beverages[J].Microchemical Journal,2006,82(1):22-28.
ZAR A,JURADO J M,PABLOS F,et al.HPLC determination of 2-furaldehyde and 5-hydroxymethyl-2-furaldehyde in alcoholic beverages[J].Microchemical Journal,2006,82(1):22-28.
[33] 许汉英. 白酒中糠醛含量与香型之间关系的研究[J].酿酒,2002,29(5):37-39.
XU H.Study on relativity between furfural content and fragrance style of Chinese liquor[J].Liquor Making,2002,29(5):37-39.
[34] 王金山, 牛凤云,孙萍,等.糠醛毒性的研究[J].卫生毒理学杂志,1994,(S1):21-23.
WANG J S,NIU F Y,SUN P,et al.Study on toxicity of furfural[J].Journal of Health Toxicology,1994,8(S1):21-23.
[35] FERON V J,TIL H P,VRIJER F,et al.Aldehydes:Occurrence,carcinogenic potential,mechanism of action and risk assessment[J].Mutation research,1991,259(3-4):363-385.
[36] SKOG E.A toxicological investigation of lower aliphatic aldehydes[J].Acta Pharmacologica Sinica,1950,6:229-318.
[37] VOULGARIDOU G P,ANESTOPOULOS I,FRANCO R,et al.DNA damage induced by endogenous aldehydes:Current state of knowledge[J].Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis,2011,711(1-2):13-27.
[38] SAMPAIO O M,RECHE R V,FRANCO D W.Chemical profile of rums as a function of their origin.The use of chemometric techniques for their identification[J].Journal of Agricultural and Food Chemistry,2008,56(5):1 661-1 668.
[39] FLAMINI R,DALLA VEDOVA A.Glyoxal/glycolaldehyde:A redox system involved in malolactic fermentation of wine[J].Journal of Agricultural and Food Chemistry,2003,51(8):2 300-2 303.
[40] 朱梦旭. 白酒中易挥发的有毒有害小分子醛及其结合态化合物研究[D].无锡:江南大学,2016.
ZHU M X.Volatile toxic and small molecular aldehydes and their derivatives in Chinese liquor[D].Wuxi:Jiangnan University,2016.
[41] DE REVEL G,PRIPIS-NICOLAU L,BARBE J C,et al.The detection of α-dicarbonyl compounds in wine by formation of quinoxaline derivatives[J].Journal of the Science of Food and Agriculture,2000,80(1):102-108.
[42] WANG C,LU Y L,HUANG Q J,et al.Levels and formation of α-dicarbonyl compounds in beverages and the preventive effects of flavonoids[J].Journal of Food Science and Technology,2017,54(7):2 030-2 040.
[43] 朱明, 殷红,靳喜庆,等.气相色谱-氢火焰离子化检测器法测定白酒中50种风味物质[J].中国酿造,2021,40(5):168-172.
ZHU M,YIN H,JIN X,et al.Determination of 50 flavor substances in Baijiu by gas chromatography-flame ionization detector[J].China Brewing,2021,40(5):168-172.
[44] GABBARDO E,CELOTTI E,GABBARDO M.Comparison between sensory evaluation and SPME GC-MS in Brazilian's sparkling wines[J].BIO Web of Conferences,2019,12:02027.
[45] NOBIS A,KUNZ O S,GASTL M,et al.Influence of 3-DG as a key precursor compound on aging of lager beers[J].Journal of Agricultural and Food Chemistry,2021,69(12):3 732-3 740.
[46] DEGEN J L,HELLWIG M,HENLE T.1,2-Dicarbonyl compounds in commonly consumed foods[J].Journal of Agricultural and Food Chemistry,2012,60(28):7 071-7 079.
[47] MAHAR K P,KHUHAWAR M Y,KAZI T,et al.Quantitative analysis of glyoxal,methyl glyoxal and dimethyl glyoxal from foods,beverages and wines using HPLC and 4-nitro-1,2-phenylenediamine as derivatizing reagent[J].Asian Journal of Chemistry,2010,22(9):6 983-6 990.
[48] 司波, 袁雯雯,顾会会,等.高效液相色谱分析白酒及加工中活泼羰基化合物[J].食品与发酵工业,2021,47(10):240-245.
SI B,YUAN W W,GU H H,et al.Simultaneous determination of reactive carbonyl species in Chinese Baijiu and its processing by HPLC[J].Food and Fermentation Industries,2021,47(10):240-245.
[49] RODR GUEZ-C
GUEZ-C CERES M I,PALOMINO-VASCO M,MORA-DIEZ N,et al.Novel HPLC-fluorescence methodology for the determination of methylglyoxal and glyoxal.Application to the analysis of monovarietal wines “Ribera del Guadiana”[J].Food Chemistry,2015,187(15):159-165.
CERES M I,PALOMINO-VASCO M,MORA-DIEZ N,et al.Novel HPLC-fluorescence methodology for the determination of methylglyoxal and glyoxal.Application to the analysis of monovarietal wines “Ribera del Guadiana”[J].Food Chemistry,2015,187(15):159-165.
[50] HU G F,HERNANDEZ M,ZHU H H,et al.An efficient method for the determination of furan derivatives in apple cider and wine by solid phase extraction and high performance liquid chromatography—Diode array detector[J].Journal of Chromatography A,2013,1284(5):100-106.
[51] 王建刚, 李丽.反相高效液相色谱法测定白酒中糠醛[J].理化检验(化学分册),2010,46(12):1 470-1 471.
WANG J G,LI L.Determination of furfural in liquor by RP-HPLC[J].Physical Testing and Chemical Analysis(Part B:Chemical Analysis),2010,46(12):1 470-1 471.