人体肠道内有1014个共生微生物,它们形成人体最大的、最复杂的微生态系统,在调节宿主健康和疾病方面发挥着重要的作用[1-2]。膳食是影响肠道微生物群组成的关键可改变因素,膳食干预已成为调节微生物群组成和代谢活性的潜在有效策略[3]。
抗消化的寡糖(non-digestible oligosaccharides,NDOS)介于单糖和多糖之间,通常由≤10个单糖组成。近年来,越来越多的NDOS被用作益生元,调节肠道微生物结构及其代谢产物,进而改善人类健康[4-5],如低聚半乳糖、低聚果糖和低聚木糖等[6-7]。NDOS被肠道微生物群降解,可促进特定微生物的生长并产生短链脂肪酸;短链脂肪酸主要由乙酸盐、丙酸盐和丁酸盐组成,它们在能量稳态[8]、肠道屏障功能[9]、脂质和碳水化合物代谢[10]中发挥重要的生理功能。
黄原胶常由油菜黄单胞菌以低成本大量生产,是美国食品和药物管理局(Food and Drug Administration,FDA)批准的安全的食品添加剂。黄原胶寡糖是潜在的可商业化的寡糖,之前的研究通过黄原胶酸水解制备得到纯度为94%的黄原胶寡糖,黄原胶寡糖由葡萄糖、甘露糖和葡萄糖醛酸组成,摩尔比为42.72∶36.73∶19.47,其聚合度范围为2~8。该黄原胶寡糖具有抵抗模拟唾液和胃肠液消化的能力,可以稳定转运到大肠[11]。在3个健康人的混合粪菌的体外发酵中黄原胶寡糖可增加产丁酸相关细菌的丰度和短链脂肪酸的水平[11-12],然而其对个体的肠道菌群及其代谢产物的动态调控过程仍不清楚。肠道反应器通过动态地模拟人体肠道的微生物发酵环境而逐渐引起关注。本实验室自主研发了新型模拟胃肠道反应器[13],该胃肠道反应器的构造情况、控制系统以及其功能特性已验证了进行动态发酵的可行性[14]。本研究通过3个健康人粪便微生物的体外静态分批发酵和1个健康人粪便微生物的体外胃肠道反应器动态发酵共同探究黄原胶寡糖对粪便微生物结构及其代谢产物的影响。
1 材料与方法
1.1 实验材料
黄原胶寡糖,本实验室提供[11];果寡糖,Sigma公司;TIANamp粪便基因组DNA提取试剂盒,天根生化科技有限公司;Silica gel 60 F254薄层层析板,北京安捷飞科技有限公司;其他试剂,国药集团化学试剂有限公司。
1.2 仪器与设备
HYQX-Ⅱ厌氧培养箱,上海跃进医疗器械有限公司;7890A气相色谱仪,美国安捷伦科技有限公司;DHG-Ⅲ鼓风干燥箱,上海新苗医疗器械制造有限公司;BGR新型模拟胃肠道反应器,本实验室提供[13]。
1.3 实验方法
1.3.1 薄层色谱法(thin-layer chromatography,TLC)
TLC用于评价黄原胶寡糖的降解。将发酵上清液(2 μL)点在10 cm×10 cm的薄层层析板上,然后将薄层层析板转移到鼓风干燥箱中,在60 ℃下干燥3 min。将薄层层析板放在V(正丙醇)∶V(水)=7∶3的展开剂中展开100 min。然后将薄层层析板转移到鼓风干燥箱中,在60 ℃下干燥3 min。将干燥的薄层层析板浸入地黄酚试剂(900 mg地黄酚、25 mL水、375 mL乙醇、50 mL浓硫酸)中染色,并立即在105 ℃下加热4 min显色。
1.3.2 体外静态粪便菌群发酵方法
新鲜的健康人粪便是从3名健康捐赠者(1名男性和2名女性,年龄在35~50岁,BMI在24.60~29.24 kg/m2)中用无菌的粪便收集管收集,然后放进厌氧产气袋中,置于冰上。健康捐赠者在粪便样本捐赠之前至少2个月没有服用益生菌或益生元。将这3个新鲜的粪便分别用灭菌的0.1 mol/L PBS稀释以获得10%质量分数的粪便浆液,并在无菌条件下通过4层纱布海绵过滤以除去食物残留物。基础营养培养基(g/L)包含NaCl 0.1,K2HPO40.04,KH2PO40.04,NaHCO32.0,L-半胱氨酸盐酸盐 0.5,胆盐 0.5,MgSO40.01,CaCl20.01,血红素 0.025,维生素K 0.002,蛋白胨 2.0,酵母提取物 2.0,刃天青0.001,Tween 80 1 mL。基础营养培养基用作空白对照;将果寡糖以0.5%的质量分数添加到基础营养培养基中作为阳性对照组;将黄原胶寡糖以0.5%的质量分数添加到基础营养培养基中。然后在8 h内将3名捐赠者粪便浆液分别以体积分数10%接种到以上培养基中。每组在3个平行容器中于37 ℃厌氧培养箱中孵育48 h。发酵液以12 000 r/min离心3 min,细菌沉淀用于检测菌群变化,上清液用于检测乙酸,丙酸和丁酸变化。
1.3.3 体外动态胃肠道反应器发酵方法
用无菌粪便收集管采集1名健康捐赠者(1名男性,年龄为45岁,BMI为27.86 kg/m2)的粪便,然后放进厌氧产气袋中,置于冰上。健康捐赠者在粪便样本捐赠之前至少2个月没有服用益生菌或益生元。将新鲜粪便用灭菌的0.1 mol/L PBS稀释以获得10%质量分数的粪便浆液,并在无菌条件下通过4层纱布海绵过滤以除去食物残留物。基础发酵培养基(g/L)成分为:淀粉5,阿拉伯半乳聚糖 1.0,果胶 2.0,木聚糖 1.0,酵母提取物 3.0,胰蛋白胨 1.0,酪蛋白 2.0,L-半胱氨酸 0.5,KCl 1.0,NaCl 0.5,K2HPO4 0.5,KH2PO4 0.5,CaCl2·6H2O 0.15,MgSO4·7H2O 0.01,氯化血红素 0.025,胆汁盐 0.4,FeSO4·7H2O 0.005,吐温80 1 mL,维生素混合液1 mL,pH值为5.8。其中维生素混合液(g/L)成分为:甲萘醌 1.0,D-生物素 2.0,维生素B12 0.5,泛酸 10.0,烟酰胺 5.0,对氨基苯甲酸 5.0,硫胺素 4.0。在实验期将淀粉换成等量的5 g/L黄原胶寡糖,即为黄原胶寡糖培养基。
向肠道反应器(bionic gastrointestinal reactor,BGR)中装入160 mL基础发酵培养基(反应器的总体积为230 mL),用4.0和6.8的pH校准液对pH电极进行校准,然后在115 ℃条件下灭菌20 min。待反应器自然冷却至室温,于超净工作台内向基础发酵培养基中以体积分数10%接入粪便浆液。接种后,将BGR转移至固定位置,然后胃肠道反应器联通循环水装置,通过以规则的时间间隔将温水泵入玻璃夹套和柔性软管之间的空间,实现模拟肠道蠕动,温水使模型内腔处于37 ℃。将pH值设置为5.8(模拟近端结肠的pH值),并通过pH传感器结合泵入NaOH溶液(0.5 mol/L)使pH值自动调节在5.8左右。每隔8 h向BGR徐徐通入10 min N2以排出BGR中的氧气使系统保持厌氧状态。
BGR中粪便菌群经过16 h发酵后达到稳定阶段,然后进行2 h饥饿处理使培养基中的碳源(淀粉)消耗殆尽,此时记录为初始发酵时间(0 h)。然后以2 mL/min的速度用泵排出40 mL BGR中培养基,之后以2 mL/min的速度泵入40 mL黄原胶寡糖培养基,进入实验期。每隔12 h补料40 mL黄原胶寡糖培养基,每隔12 h取样,如此连续发酵48 h。发酵结束后,将得到的每个样品12 000 r/min离心3 min,细菌沉淀用于检测菌群变化,上清液用于检测乙酸,丙酸和丁酸变化。使用TLC检测发酵液上清液中黄原胶寡糖的降解。
1.3.4 短链脂肪酸浓度的检测方法
通过使用气相色谱法(gas chromatography,GC)分析短链脂肪酸的浓度,包括乙酸,丙酸和丁酸。将1 mL发酵液的上清液转移至新的离心管中。将250 μL HCl溶液和1 mL乙醚添加至上清液,以终浓度为1 mmol/L 2-甲基丁酸作为内标,并将试管涡旋3 min。收集上层的有机组分并用无水硫酸钠脱水,收集上清液并使其通过0.22 μm孔径的过滤器。使用配备有HP-INNOWAX色谱柱的GC分析短链脂肪酸的浓度。烘箱温度为60 ℃,并在4 min内升至190 ℃;进样器温度设置为220 ℃,检测器温度设置为250 ℃;将5 μL样品以1∶20的分流比注入GC仪器,氮气用作载气,流速为1.5 mL/min。根据内标法计算短链脂肪酸的浓度。
1.3.5 粪便菌群组成的检测方法
通过QIAamp DNA Stool Mini Kit提取细菌基因组DNA。使用通用引物338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)扩增16S rRNA基因的V3~V4区。使用TruSeq-DNA PCR-Free样品制备试剂盒生成测序文库,并通过MiSeq PE250平台进行焦磷酸测序。分别使用FLASH(1.2.7版)和Qiime(1.9.1版)进行配对末端读段的组装和质量控制。Uparse(v7.0.1001)将具有>97%相似性的序列修剪分配给相同的操作分类单位(operational taxonomic units,OTU)。Silva数据库(heep://www.arb-silva.de/)基于mothur算法用于注释生物分类信息。使用R软件进行冗余分析。
1.4 数据分析
所有实验均重复3次,结果表示为平均值±标准偏差。使用Origin软件作图,采用SPSS软件进行Tukey’s test,P<0.05表示统计学分析中差异显著。
2 结果与分析
2.1 体外粪便菌群发酵中黄原胶寡糖的消耗
通过体外静态分批发酵和动态的胃肠道反应器发酵,探究黄原胶寡糖对健康人肠道菌群及其代谢产物的影响。在健康人粪便菌群发酵过程中,黄原胶寡糖的降解通过TLC方法进行检测。如图1-a所示,在体外静态粪便菌群发酵中,果寡糖和黄原胶寡糖经过3个健康人的粪便菌群发酵48 h后基本完全降解。在黄原胶寡糖的体外动态粪便菌群发酵中,本文呈现了BGR中的一组典型数据。如图1-b所示,黄原胶寡糖在24~36 h的发酵过程中开始被部分降解,并且优先降解黄原胶寡糖中低分子质量的成分;黄原胶寡糖在36~48 h的发酵过程中被完全降解。以上结果表明黄原胶寡糖在粪便菌群发酵48 h后可被完全降解,并且主要在24~48 h的发酵过程中被降解。MOON等[15]指出阿拉伯低聚糖的缓慢发酵可能使得短链脂肪酸在整个结肠内发挥有益的健康影响。FU等[16]指出在结肠远端发酵的碳水化合物可能是改善人类结肠远端出现的大多数结肠癌病例的有效策略。因此,黄原胶寡糖的延迟降解可能有助于黄原胶寡糖在结肠远端发挥作用。

a-静态; b-动态
空白-1,空白-2和空白-3分别代表健康捐赠者1,捐赠者2和捐赠者3的粪便在基础营养培养基中发酵48 h的发酵液;果寡糖-1,果寡糖-2和果寡糖-3分别代表健康捐赠者1,捐赠者2和捐赠者3的粪便在果寡糖培养基中发酵48 h的发酵液;黄原胶寡糖-1,黄原胶寡糖-2和黄原胶寡糖-3分别代表健康捐赠者1,捐赠者2和捐赠者3的粪便在黄原胶寡糖培养基中发酵48 h的发酵液;0、12、24、36 和48 h分别代表健康捐赠者
4的粪便在体外动态发酵过程中0、12、24、36和48 h的发酵液样品
图1 在体外静态和动态粪便菌群发酵中黄原胶寡糖的消耗
Fig.1 Xanthan gum oligosaccharides consumption in in vitro static batch fecal fermentation and dynamic BGR fecal fermentation
2.2 黄原胶寡糖对粪便菌群主要代谢产物的影响
乙酸、丙酸和丁酸是肠道微生物发酵碳水化合物的主要终产物,在宿主健康中发挥重要的作用[17]。如图2所示,在体外静态粪便菌群发酵48 h后,与空白相比,黄原胶寡糖可显著增加乙酸、丙酸、丁酸和总短链脂肪酸的浓度,浓度分别为31.30、11.57、5.19和48.07 mmol/L;与果寡糖相比,尽管黄原胶寡糖的丙酸和总短链脂肪酸产量低于果寡糖,但是黄原胶寡糖的丁酸产量显著高于果寡糖的丁酸产量,是果寡糖丁酸产量的2.66倍。此外,与空白相比,黄原胶寡糖和果寡糖的发酵液pH值均明显下降,其中果寡糖的pH值下降最多,这与果寡糖的总短链脂肪酸产量最高相对应。
如图3所示,在0~24 h的发酵过程中,黄原胶寡糖对乙酸、丙酸、丁酸的产量影响不大;在36~48 h的发酵过程中,乙酸、丙酸、丁酸和总短链脂肪酸的产量和NaOH的消耗量均显著增加,这与黄原胶寡糖在24~48 h的发酵过程中降解的结果一致。在发酵48 h时,乙酸、丙酸、丁酸和总短链脂肪酸的浓度分别达到49.44、28.64、1.65和79.72 mmol/L,与0 h相比,分别增加1.67、1.40、6.25和1.58倍。

a-乙酸;b-丙酸;c-丁酸;d-总短链脂肪酸;e-pH
图2 在体外静态粪便菌群发酵中短链脂肪酸浓度和pH的变化
Fig.2 Changes in short-chain fatty acid levels,and pH in vitro static batch fermentation
注:值为平均值±标准偏差(n=3);*表示P<0.05(下同)

a-乙酸;b-丙酸;c-丁酸;d-总短链脂肪酸;e-pH和NaOH的消耗量
图3 在体外动态粪便菌群发酵中短链脂肪酸浓度、pH和NaOH的消耗量的变化
Fig.3 Changes in short-chain fatty acid levels,pH and NaOH consumption in vitro dynamic BGR fermentation
结果表明在体外静态和动态粪便菌群发酵中黄原胶寡糖均可显著增加乙酸、丙酸、丁酸和总短链脂肪酸的产量,尤其是丁酸的产量。已有研究指出具有β(1→4)糖苷键的二糖比具有α(1→2,1→3,1→4,1→5)和 β(1→1,1→2,1 →3,1→5)糖苷键的二糖产生更多的丁酸盐[18],这暗示黄原胶寡糖发酵中丁酸产量的增加可能与黄原胶寡糖中的β(1→4)糖苷键相关。丁酸在糖异生和脂肪生成代谢途径中发挥有益的作用[19]。例如丁酸可改善大鼠原代脂肪细胞中激素调节的脂质代谢和胰岛素刺激的葡萄糖摄取[20]。以上结果说明黄原胶寡糖可能通过增加丁酸的产量,参与改善宿主健康。
2.3 黄原胶寡糖对粪便菌群结构的影响
通过16S rRNA测序检测粪便菌群组成的变化。在体外静态和动态粪便菌群发酵中,根据97%的序列相似性分别检测到482和555个OTU。如图4所示,在体外静态和动态粪便菌群发酵中,拟菌门(Bacteroidota)、厚壁菌门(Firmicutes)和变形菌门(Proteobacteria)为优势菌门。在体外静态粪便菌群发酵中,与空白相比,黄原胶寡糖可降低粪便菌群中Firmicutes/Bacteroidota的比例,黄原胶寡糖的动态发酵呈现相似的降低的Firmicutes/Bacteroidota的比例(图5)。多个研究表明[21],肥胖动物和人类的肠道微生物群表现出更高的厚壁菌门/拟杆菌门比率,建议将该比率作为潜在的生物标志物,不过这仍需更多的证据。以上结果暗示黄原胶寡糖可能通过降低肠道菌群中Firmicutes/Bacteroidota的比例改善宿主肠道菌群结构。
体外静态粪便菌群发酵中,在门水平和属水平上,果寡糖和黄原胶寡糖发酵后的3个不同健康人来源的粪便菌群呈现差异的变化(图4和图6)。在属水平,与空白和果寡糖相比,黄原胶寡糖在3个不同健康人的粪便菌群发酵中可同时增加Parabacteroides属和Hungatella属的相对丰度。此外,通过lefse分析果寡糖和黄原胶寡糖中显著变化的菌群,发现与果寡糖相比,黄原胶寡糖可显著增加Parabacteroides属、Hungatella属和Lachnoclostridium属的相对丰度。
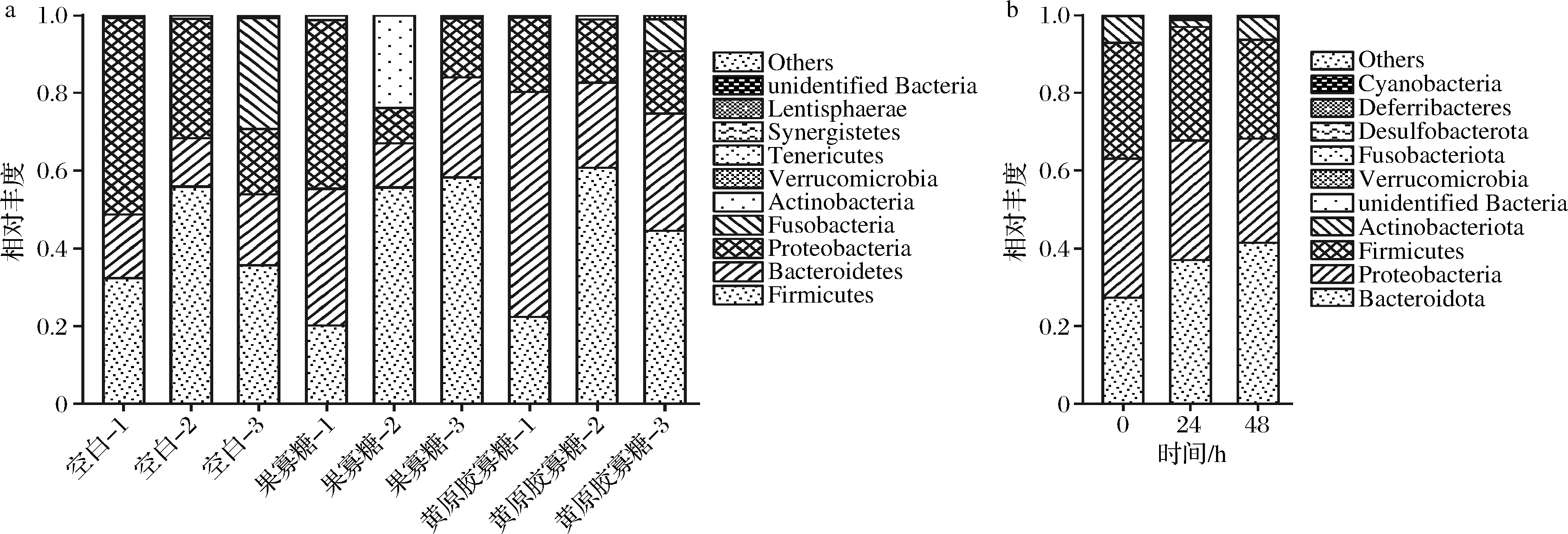
a-静态;b-动态
图4 在体外静态和动态粪便菌群发酵中门水平上主要的10个菌群的相对丰度变化
Fig.4 Relative abundance of dominant phyla(top 10) in in vitro static batch fermentation and dynamic BGR fermentation
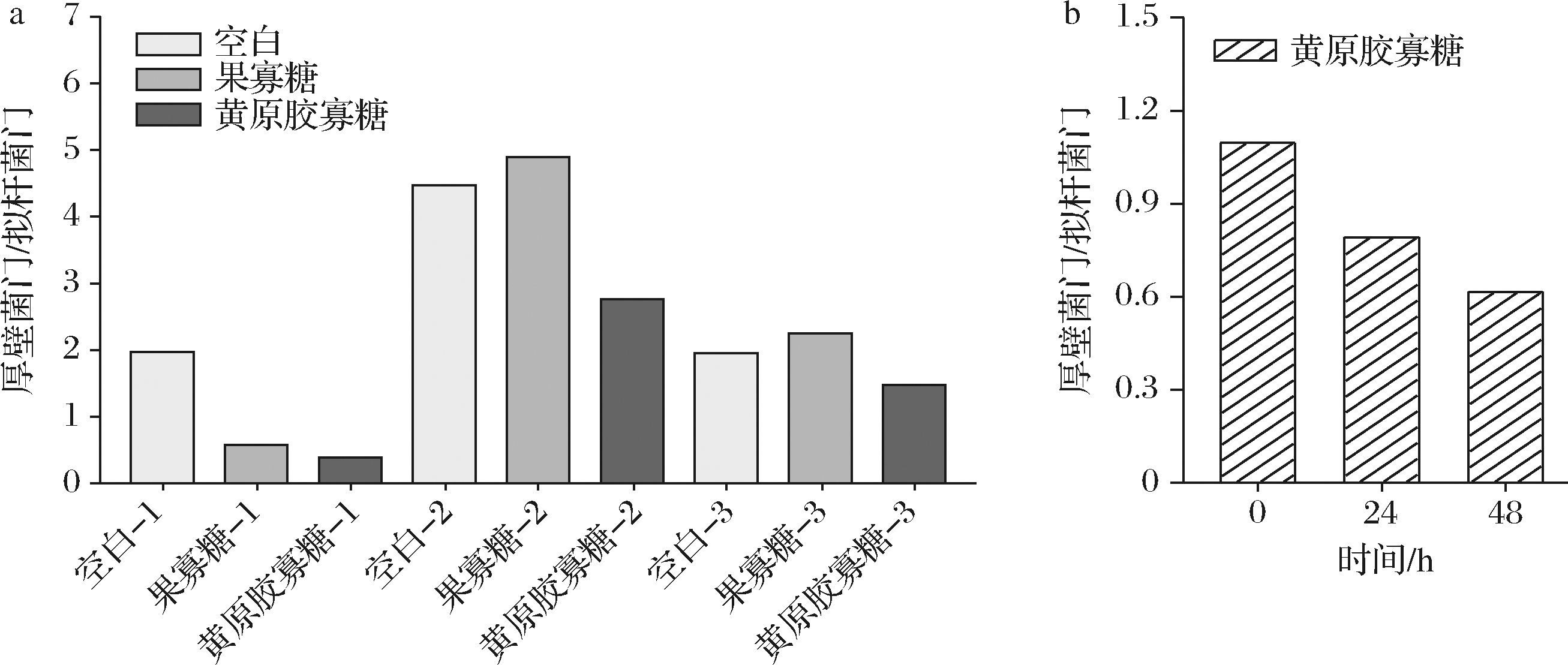
a-静态;b-动态
图5 在体外静态和动态粪便菌群发酵中Firmicutes/Bacteroidota的比例的变化
Fig.5 Changes in Firmicutes to Bacteroidetes ratios in in vitro static batch fermentation and dynamic BGR fermentation

a-静态;b-动态
图6 在体外静态和动态粪便菌群发酵中属水平上主要的10个菌群的相对丰度变化
Fig.6 Relative abundance of dominant genera(top 10) in in vitro static batch fermentation and dynamic BGR fermentation
此外,与果寡糖相比,黄原胶寡糖可显著增加科水平上毛螺菌科(Lachnospiraceae)的相对丰度。毛螺菌科(Lachnospiraceae)和Lachnoclostridium属被认为是肠道中产生丁酸盐的细菌[16],在黄原胶寡糖的体外粪便菌群发酵中,毛螺菌科(Lachnospiraceae)和Lachnoclostridium属的富集可能与丁酸产量的显著增加相关。
体外动态粪便菌群发酵中,与0和24 h相比,黄原胶寡糖在48 h发酵时可极大的增加属水平上Parabacteroides、Lachnospira(属于Lachnospiraceae)和UBA1819的相对丰度。狄氏副拟杆菌(Parabacteroides distasonis)是Parabacteroides属的主要成员之一,可通过在肠道中生产琥珀酸和次级胆汁酸减轻小鼠肥胖和代谢功能障碍[22]。毛螺菌科(Lachnospiraceae)被认为是包含产丁酸菌的重要的一个科,Lachnoclostridium属和Lachnospira属的产丁酸菌也属于毛螺菌科(Lachnospiraceae)[16]。
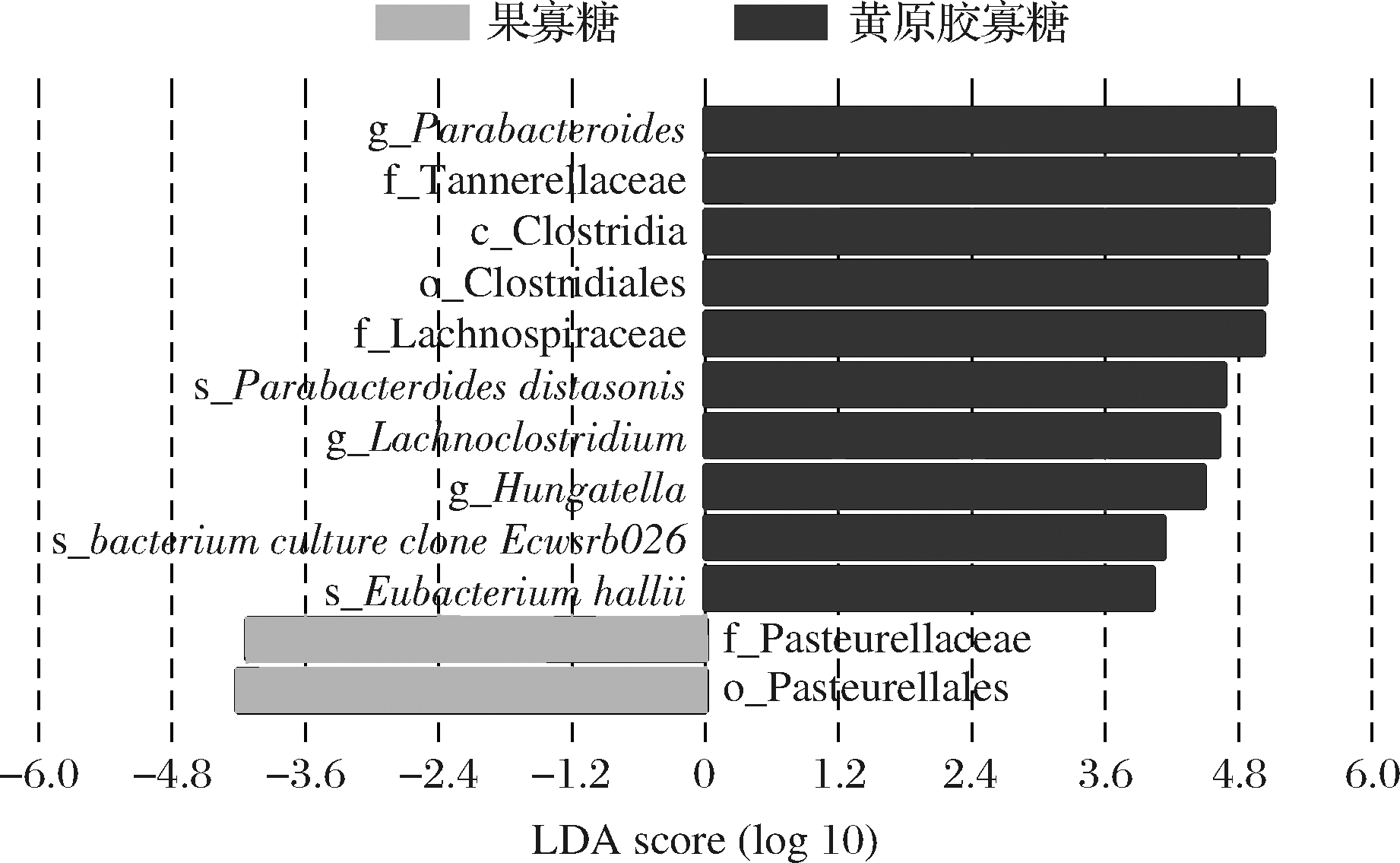
图7 LEfSe分析在体外静态粪便菌群发酵中显著变化的
菌群(LDA score>4.0)
Fig.7 LEfSe was used to analyze significantly differential taxa
(LDA score>4.0) in vitro static batch fermentation
产丁酸菌在人类健康中起着至关重要的作用,包括为肠道上皮细胞提供能量、维持肠道细菌平衡和调节宿主细胞反应[23]。以上结果表明,在体外静态和动态粪便菌群发酵中,黄原胶寡糖可明显富集毛螺菌科(Lachnospiraceae)和Parabacteroides属,进而改善肠道菌群结构。
3 结论
本文通过体外静态和动态粪便菌群发酵评价黄原胶寡糖的益生元潜能。在体外静态粪便菌群发酵中,48 h时,黄原胶寡糖基本被完全降解,显著增加乙酸、丙酸、丁酸和总短链脂肪酸的产量(P<0.05);与果寡糖相比,黄原胶寡糖表现出较强的产丁酸能力。在体外动态粪便菌群发酵中,黄原胶寡糖主要在24~48 h的发酵过程中被降解并显著增加乙酸、丙酸、丁酸、总短链脂肪酸的产量和NaOH的消耗量(P<0.05)。在体外静态和动态粪便菌群发酵中,黄原胶寡糖均可降低Firmicutes/Bacteroidota的比例,增加毛螺菌科(Lachnospiraceae)和Parabacteroides属的相对丰度,进而参与改善宿主肠道菌群结构。研究结果表明黄原胶寡糖具有一定的益生活性。
[1] WANG B H,YAO M F,LV L,et al.The human microbiota in health and disease[J].Engineering,2017,3(1):71-82.
[2] MARCHESI J R,ADAMS D H,FAVA F,et al.The gut microbiota and host health:A new clinical frontier[J].Gut,2016,65(2):330-339.
[3] LEEMING E R,JOHNSON A J,SPECTOR T D,et al.Effect of diet on the gut microbiota:Rethinking intervention duration[J].Nutrients,2019,11(12):2862.
[4] GENTILE C L,WEIR T L.The gut microbiota at the intersection of diet and human health[J].Science,2018,362(6 416):776-780.
[5] HO A L,KOSIK O,LOVEGROVE A,et al.In vitro fermentability of xylo-oligosaccharide and xylo-polysaccharide fractions with different molecular weights by human faecal bacteria[J].Carbohydrate Polymers,2018,179:50-58.
[6] PERDIJK O,VAN BAARLEN P,FERNANDEZ-GUTIERREZ M M,et al.Sialyllactose and galactooligosaccharides promote epithelial barrier functioning and distinctly modulate microbiota composition and short chain fatty acid production in vitro[J].Frontiers in Immunology,2019,10:94.
[7] SALMINEN S,COLLADO M C,ENDO A,et al.The international scientific association of probiotics and prebiotics(ISAPP) consensus statement on the definition and scope of postbiotics[J].Nature Reviews Gastroenterology & Hepatology,2021,18(9):649-667.
[8] DE VADDER F,KOVATCHEVA-DATCHARY P,GONCALVES D,et al.Microbiota-generated metabolites promote metabolic benefits via gut-brain neural circuits[J].Cell,2014,156(1-2):84-96.
[9] KELLY C J,ZHENG L,CAMPBELL E L,et al.Crosstalk between microbiota-derived short-chain fatty acids and intestinal epithelial HIF augments tissue barrier function[J].Cell Host & Microbe,2015,17(5):662-671.
[10] FROST G,SLEETH M L,SAHURI-ARISOYLU M,et al.The short-chain fatty acid acetate reduces appetite via a central homeostatic mechanism[J].Nature Communications,2014,5:3611.
[11] XU J J,WANG R Y,ZHANG H T,et al.In vitro assessment of prebiotic properties of oligosaccharides derived from four microbial polysaccharides[J].LWT,2021,147:111544.
[12] XU J J,LIU W B,WU J R,et al.Metabolic profiles of oligosaccharides derived from four microbial polysaccharides by faecal inocula from type 2 diabetes patients[J].International Journal of Food Sciences and Nutrition,2021,72(8):1 083-1 094.
[13] 詹晓北,李志涛,张文龙,等.一种肠道体外可视化仿生反应器:CN108008088A[P].2018-05-08.
ZHAN X B,LI Z T,ZHANG W L,et al.A bionic reactor for intestinal visualization in vitro:CN108008088B[P].2019-08-20.
[14] LI Z T,HU G A,ZHU L,et al.In vitro digestion and fecal fermentation of highly resistant starch rice and its effect on the gut microbiota[J].Food Chemistry,2021,361:130095.
[15] MOON J S,SHIN S Y,CHOI H S,et al.In vitro digestion and fermentation properties of linear sugar-beet Arabinan and its oligosaccharides[J].Carbohydrate Polymers,2015,131:50-56.
[16] FU X D,LIU Z M,ZHU C L,et al.Nondigestible carbohydrates,butyrate,and butyrate-producing bacteria[J].Critical Reviews in Food Science and Nutrition,2019,59(sup1):S130-S152.
[17] VALDES A M,WALTER J,SEGAL E,et al.Role of the gut microbiota in nutrition and health[J].BMJ(Clinical Research Ed.),2018,361:k2179.
[18] HARRIS H C,EDWARDS C A,MORRISON D J.Impact of glycosidic bond configuration on short chain fatty acid production from model fermentable carbohydrates by the human gut microbiota[J].Nutrients,2017,9(1):E26.
[19] MANDALIYA D K,SESHADRI S.Short Chain Fatty Acids,pancreatic dysfunction and type 2 diabetes[J].Pancreatology,2019,19(4):617-622.
[20] HEIMANN E,NYMAN M,DEGERMAN E.Propionic acid and butyric acid inhibit lipolysis and de novo lipogenesis and increase insulin-stimulated glucose uptake in primary rat adipocytes[J].Adipocyte,2015,4(2):81-88.
[21] MAGNE F,GOTTELAND M,GAUTHIER L,et al.The firmicutes/bacteroidetes ratio:A relevant marker of gut dysbiosis in obese patients?[J].Nutrients,2020,12(5):1 474.
[22] WANG K,LIAO M F,ZHOU N,et al.Parabacteroides distasonis alleviates obesity and metabolic dysfunctions via production of succinate and secondary bile acids[J].Cell Reports,2019,26(1):222-235.e5.
[23] LOUIS P,YOUNG P,HOLTROP G,et al.Diversity of human colonic butyrate-producing bacteria revealed by analysis of the butyryl-CoA:Acetate CoA-transferase gene[J].Environmental Microbiology,2010,12(2):304-314.