巴戟天是茜草科巴戟属植物巴戟天的干燥根,广泛分布于热带、亚热带和温带地区,在我国主要种植于广东、广西、福建、海南等地,是我国著名的草本植物之一[1]。巴戟天中含有丰富的糖类、蒽醌类、环烯醚萜类、氨基酸类等生物活性成分[2],其具有抗抑郁、抗肿瘤、抗衰老、增强生殖能力等多种药理作用[3-5]。
中药炮制可起到增强药效、削弱毒性、改变功效活性等作用,其中发酵炮制是最古老且有效的方式之一,该方法主要通过微生物的生长代谢来充分利用和改变中药材原始的药效活性,从而达到促进活性成分的提取分离、增强药效等目的[6],目前关于微生物发酵炮制巴戟天的研究仍非常有限。有研究发现,微生物发酵炮制能显著提高巴戟天中的活性成分含量,如经乳酸芽胞杆菌DU-106发酵后,巴戟天中多糖含量提高了30.09%,果糖等寡糖含量也有所提高[7]。
人体中的α-葡萄糖苷酶和α-淀粉酶是碳水化合物水解的主要酶,酶解中分解的葡萄糖会进入血糖中,从而使人体的血糖水平升高[8];胰岛素抵抗(insulin resistance,IR)是2型糖尿病、高血压病、动脉粥样硬化等一系列代谢相关疾病发生、发展的原动力,是其共同的病理生理基础[9]。目前,我国已成为世界上糖尿病患者最多的国家,糖尿病是亟待解决的重大公共卫生问题。
因中药降血糖的作用温和且持久,因此研究中草药有效成分的降血糖活性及其机制对治疗糖尿病具有重大意义。而目前有关巴戟天降血糖功效及其作用机制的研究较少,仅有关于巴戟天不同极性萃取相的抗氧化及降血糖活性[10],以及巴戟天多糖的降血糖和抗氧化作用的研究[11],故本研究利用发酵能提高巴戟天中多糖和寡糖含量的特点,以发酵巴戟天为原料,探究了巴戟天中多糖、寡糖的降血糖功效及其药效机理,旨在能更有效地利用巴戟天资源,同时为巴戟天在降血糖方面的药理作用提供科学依据。
1 材料与方法
1.1 材料与试剂
发酵巴戟天,由本研究室(华南农业大学食品学院新资源食品与功能性原料研究及评价中心)利用Bacillus sp.DU-106发酵得到[12];HepG2细胞,中国科学院细胞库;二甲基亚砜(dimethylsulfoxide,DMSO)、四甲基偶氮唑盐(methylthiazoletetrazolium,MTT),Amresco公司;DMEM高糖培养基,Gibco公司;4-硝基苯基-α-D-吡喃葡萄糖苷(4-Nitrophenyl-α-D-glucopyranoside,PNPG)、α-葡萄糖苷酶、α-淀粉酶,美国Sigma公司;盐酸二甲双胍片,贵州天安药业股份有限公司;葡萄糖测定试剂盒,上海荣盛生物药业有限公司;阿卡波糖,齐云生物试剂有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
UV759紫外分光光度计,上海精密科学仪器有限公司;HH-4数显恒温水浴锅,常州市华普达数学仪器有限公司;SH CO2细胞恒温培养箱、BPH-9042恒温培养箱,上海一恒科学仪器有限公司;Countess 2细胞计数仪、VarioskanTMLUX多功能酶标仪,赛默飞世尔科技(中国)有限公司。
1.3 实验方法
1.3.1 发酵巴戟天中多糖、寡糖的提取方法
将样品烘干、粉碎过2号筛,在料液比为1∶42(g∶mL)、提取温度为61 ℃、提取时间为1.6 h的条件下,加入体积分数为45%的乙醇溶液进行水提醇沉,取上清液以4 000 r/min的转速离心15 min,在提取液中加入一定量的无水乙醇,体积分数为80%,4 ℃下静置24 h,离心分离。
对沉淀物进行水溶解,并随后加入一定量乙醇,将体积分数保持在60%,静置处理2 d之后进行分离获得上清液,加入乙醇,体积分数为80%,静置48 h后离心分离,将沉淀物加入定量水溶解后冷冻干燥,即获得巴戟天粗寡糖;分离得到的沉淀部分加入定量水溶解,高速离心后向沉淀中再加入一定体积水和乙醇,使乙醇的终体积分数为60%,再进行离心和醇沉,重复操作3次,合并上清液在4 ℃下透析36 h(截留分子质量>1 000 Da),将透析得到的溶液冷冻干燥,得到巴戟天粗多糖。
1.3.2 发酵巴戟天活性组分的纯化及其对α-葡萄糖苷酶活性的作用
将巴戟天粗寡糖冻干粉溶解后过D-900型离子交换大孔树脂进行纯化[13];将巴戟天粗多糖冻干粉溶解后经阴离子层析柱DEAE-Sepharose Fast Flow纯化[7];根据1.3.5.1的方法测定巴戟天组分纯化前后对α-葡萄糖苷酶活性抑制的作用。
1.3.3 多糖含量测定
参考文献[7]采用苯酚-硫酸法对巴戟天多糖含量进行测定,多糖标准曲线方程y=7.072 7x-0.014 1,R2=0.999 1(n=9)。
1.3.4 寡糖含量测定
参考文献[7]采用HPLC-ELSD法对巴戟天寡糖含量进行测定,通过研究对比发现,需对D-果糖、D(+)-无水葡萄糖、蔗糖、1-蔗果三糖、耐斯糖、1F-果呋喃糖基、耐斯糖等进行测定。
1.3.5 发酵巴戟天有效组分对体外酶活性抑制实验
1.3.5.1 α-葡萄糖苷酶活性抑制实验
参考许有瑞等[14]的方法,并稍作改进。反应体系如表1,其中加入阿卡波糖溶液和待测样品溶液的质量浓度梯度都为0.4、0.8、1.2、1.6、2.0、2.4 g/L,样液充分混匀后置于37 ℃恒温箱中反应15 min,再加入20 μL PNPG底物于各个组别中,充分混匀后用塑料膜密封微孔板并置于37 ℃恒温箱中反应30 min,最后加入80 μL Na2CO3溶液终止液以终止反应,置于波长405 nm下进行测定,计算出抑制率及半抑制率(IC50)。本研究设置3组平行,每组进行3次重复,抑制率计算如公式(1)所示,其中A1、A2、A3、A4分别为实验组、样品对照组、空白对照组和空白组吸光值。
抑制率![]()
(1)
表1 α-葡萄糖苷酶活性抑制体系 单位:μL
Table 1 Inhibition system of α-glucosidase activity
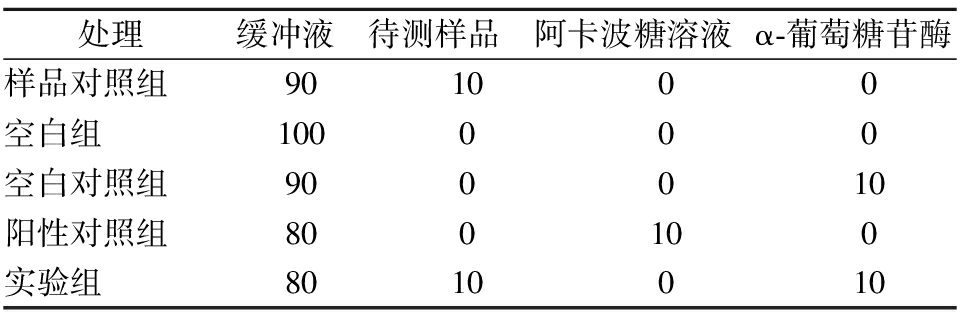
处理缓冲液待测样品阿卡波糖溶液α-葡萄糖苷酶样品对照组901000空白组100000空白对照组900010阳性对照组800100实验组8010010
1.3.5.2 α-淀粉酶活性抑制试验
参考MCCUE等[15]的方法,并稍作修改。反应体系如表2,其中加入阿卡波糖溶液和待测样品溶液的质量浓度梯度都为0.24、0.5、1、2、4、8 g/L,充分混匀后置于37 ℃恒温箱中孵化10 min,将溶解于pH 6.8 PBS的1%淀粉溶液预热至37 ℃并转移0.5 mL于试管中,充分混匀后置于37 ℃恒温箱中反应10 min,加入1 mL DNS并置于沸水浴中5 min,冰浴冷却后用去离子水稀释,置于波长520 nm下进行吸光值测定,计算出抑制率及半抑制率(IC50)。本研究设置3组平行,每组进行3次重复,抑制率按公式(1)计算。
表2 α-淀粉酶活性抑制体系 单位:mL
Table 2 Inhibition system of α-amylase activity
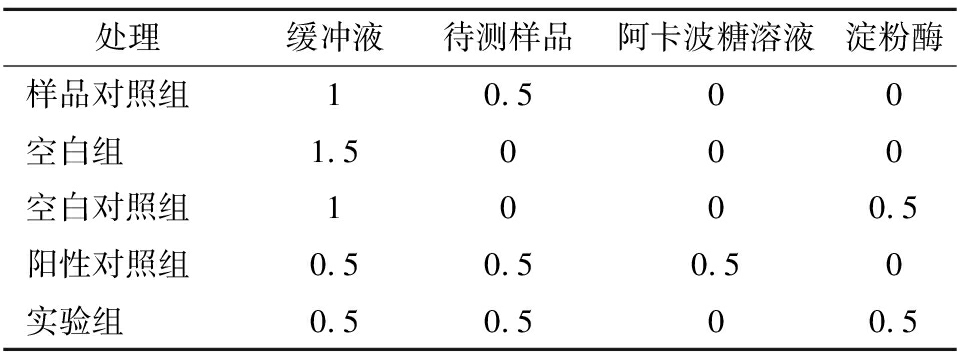
处理缓冲液待测样品阿卡波糖溶液淀粉酶样品对照组10.500空白组1.5000空白对照组1000.5阳性对照组0.50.50.50实验组0.50.500.5
1.3.5.3 两种有效组分对体外酶抑制活性协同作用实验
参考余娜[16]的方法。基于实验测定得到2种有效组分样品和阿卡波糖的IC50(g/L),以各组分的IC50为基础配制5个质量浓度的样品和阿卡波糖溶液,分别为0.25 IC50、0.5 IC50、IC50、2 IC50、4 IC50。研究2种组分间对α-葡萄糖苷酶抑制的交互作用时,将各个浓度按体积比1∶1混合,根据上述1.3.5.1和1.3.5.2方法分别测定混合后对α-葡萄糖苷酶和α-淀粉酶的抑制活性。相互作用指数CI值(combination index)由CompuSyn软件分析计算,作为评价成分间是否存在协同或拮抗作用的指标。
1.3.6 发酵巴戟天有效组分对IR-HepG2细胞葡萄糖摄取量的影响
1.3.6.1 胰岛素抵抗HepG2细胞模型的建立
参考包桥桥等[17]的方法,取处于对数生长期且状态良好的细胞,在含质量浓度为0.01 g/L胰岛素的DMEM培养基上培养24 h,随后以无血清无酚红DMEM专用高糖培养基进行同步化操作,时长为12 h,在细胞壁覆盖超过80%之后开始测定,获得上清液中的葡萄糖比例,从而以细胞对应的葡萄糖消耗程度(glucose consuming,GC)表示。通过比较模型组和正常HepG2细胞组的GC值判断是否成功得到胰岛素抵抗HepG2细胞模型(IR-HepG2细胞)。造模成功后,运用细胞计数仪计数并调整细胞密度为1×105个/mL。
1.3.6.2 有效组分对IR-HepG2细胞增殖能力的影响
参考程玥等[18]的方法,在实验组中加入100 μL不同质量浓度(0.5、1、2、4、8、16 g/L)的多糖和寡糖组分,每个浓度设置4个复孔;对照组运用含有DMSO溶液的培养基;在空白对照组中不加入细胞、药物试样;在正常组中运用含有DMEM的培养基。处理后置于37 ℃、5.0% CO2细胞培养箱中培养24 h,随后在CCK-8溶液中反应2 h,采用酶联免疫检测仪在波长450 nm对孔吸光值进行测定,细胞存活率按公式(2)计算,其中A1、A2、A3和A4分别为实验组、对照组、空白对照组和正常组吸光值。
细胞存活率![]()
(2)
1.3.6.3 三种有效组分单独及复配后对IR-HepG2细胞葡萄糖消耗的影响
参考WANG等[19]的实验方法,并稍作修改。空白对照组仅加入200 μL无血清无酚红的DMEM高糖培养基,在正常组每个孔内加入200 μL正常 HepG2细胞培养液,模型组、实验组和阳性对照组中每个孔加入200 μL IR-HepG2细胞培养液,将一系列浓度的样品以及复配组分样品(根据1.3.5部分筛选)加入实验组,阳性对照组加入二甲双胍使终质量浓度为1.0 g/L,每组重复6孔。添加完试剂后置于37 ℃、5.0% CO2细胞培养箱中培养24 h,采用葡萄糖试剂盒测定葡萄糖比例,从而获得GC值。
1.4 数据处理
数据结果采用Excel 2016、Origin 9.1和CompuSyn等统计分析软件进行数据分析并作图。
2 结果与分析
2.1 发酵巴戟天中有效组分的纯化及降血糖组分的确定
由表3可知,巴戟天粗多糖经过一系列除杂处理以及阴离子层析柱DEAE-Sepharose Fast Flow纯化后,其总多糖含量达到98.3%,其对α-葡萄糖苷酶活性抑制率也显著提高到23.62%;同样,巴戟天粗寡糖组分经D-900型离子交换大孔树脂纯化后,其纯度为93.2%,对α-葡萄糖苷酶活性抑制率也显著增强到6.63%。
表3 有效组分的纯化及其纯化后对α-葡萄糖苷酶
活性的抑制率 单位:%
Table 3 Purification of the active components and their
inhibition rate on α-glucosidase activity after purification

纯化组分纯度IRaIRb多糖98.315.8023.62∗寡糖93.23.206.63∗
注:IRa和IRb分别表示质量浓度为1 g/L的样品组分在纯化前后对α-葡萄糖苷酶的抑制率;*表示IRa和IRb相比具有显著差异(P<0.005)
通过对巴戟天中多糖和寡糖进行纯化且进行α-葡萄糖苷酶活性试验,可初步筛选出巴戟天发挥降血糖功效的活性成分。巴戟天中的多糖和寡糖对酶的抑制率随着纯度的升高而增大,说明巴戟天中的多糖和寡糖组分对抑制α-葡萄糖苷酶的活性起着主要的调节作用。故本研究中分离纯化出的2种有效成分可以作为后续实验的基础。
2.2 有效组分体外对α-葡萄糖苷酶活性抑制研究
2.2.1 有效组分对α-葡萄糖苷酶抑制作用研究
由图1可知,2种有效降糖组分对α-葡萄糖苷酶的抑制作用会随浓度提升而不断加强,且可以获得较好的线性关系。在同等浓度下,不同组分对α-葡萄糖苷酶的抑制活性由强到弱排序为:阿卡波糖>多糖>寡糖。发酵巴戟天多糖的降血糖作用在低浓度时较弱,但在质量浓度1.6~2.4 g/L其活性显著增强,有接近阿卡波糖活性的趋势;寡糖对α-葡萄糖苷酶活性抑制效果较弱,对酶的抑制作用随浓度上升而缓慢增强。结果表明,这2种有效成分都能抑制α-葡萄糖苷酶的活性,此结果与许定舟等[20]和WANG等[21]的研究结果一致。
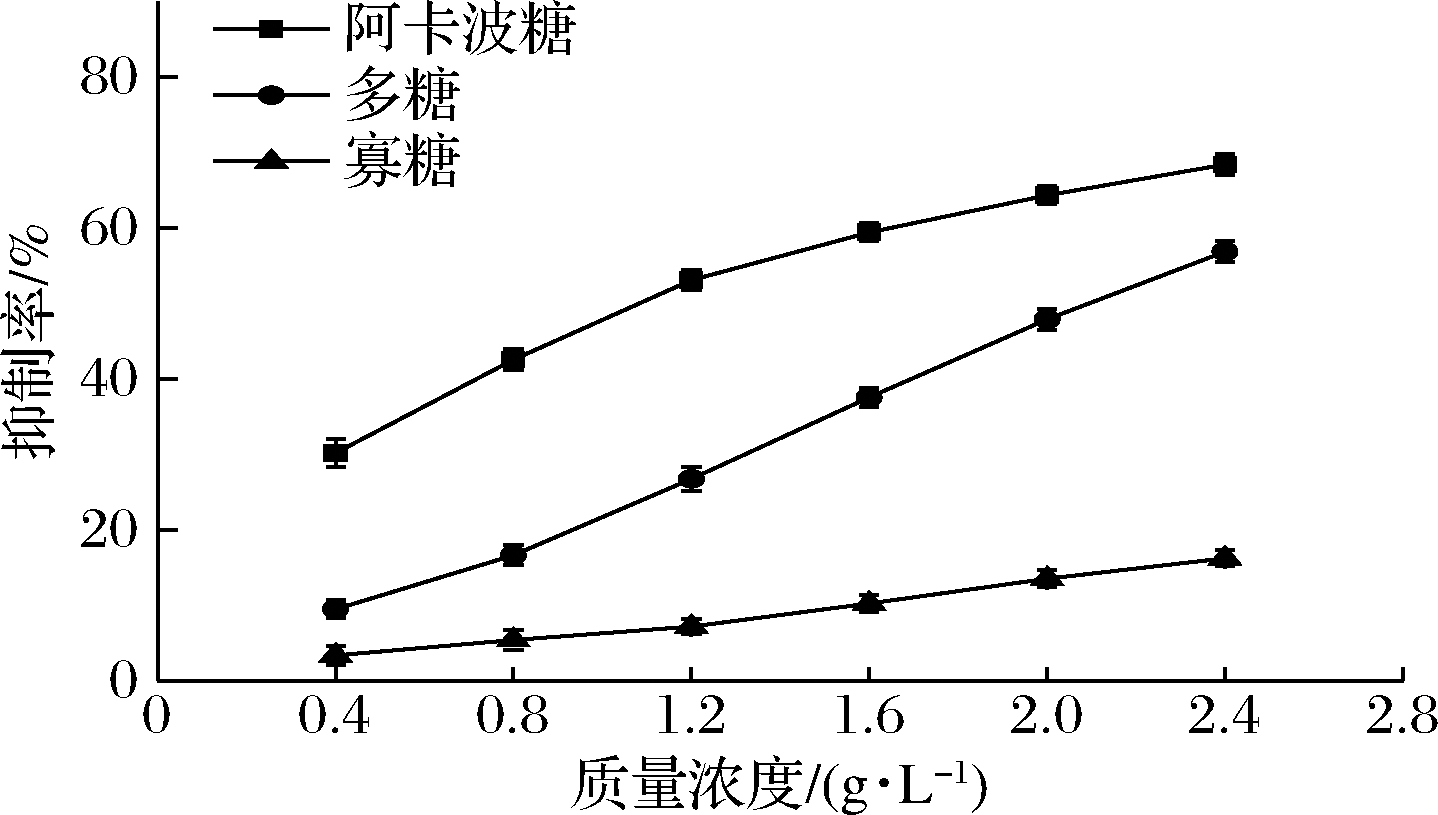
图1 发酵巴戟天不同活性组分对α-葡萄糖苷酶
活性抑制作用
Fig.1 Inhibition of α-glucosidase activity by different active
components of fermented M.officinalis
2.2.2 有效组分对α-葡萄糖苷酶抑制活性协同作用研究
通过将不同组分配制成不同的浓度进行酶抑制活性实验,得出巴戟天多糖的IC50为2.151 g/L,寡糖的IC50较大(12.438 g/L),说明在相同浓度下,巴戟天多糖的降血糖效果更接近阳性对照组的阿卡波糖(IC50=1.05 g/L);由表4可知,这2种组分及其复配后在5个质量浓度下对α-葡萄糖苷酶的抑制作用随着浓度的增大而增强,均呈现出剂量依赖效应,另外,表中的各组分复配前后的r值均大于0.95,说明不同组分的剂量和效应之间的线性关系非常良好,实验数据具有关联性和可靠性。
表4 两种有效组分复配前后对α-葡萄糖苷酶的抑制作用
Table 4 Inhibition of α-glucosidase before and after the
combination of two active components
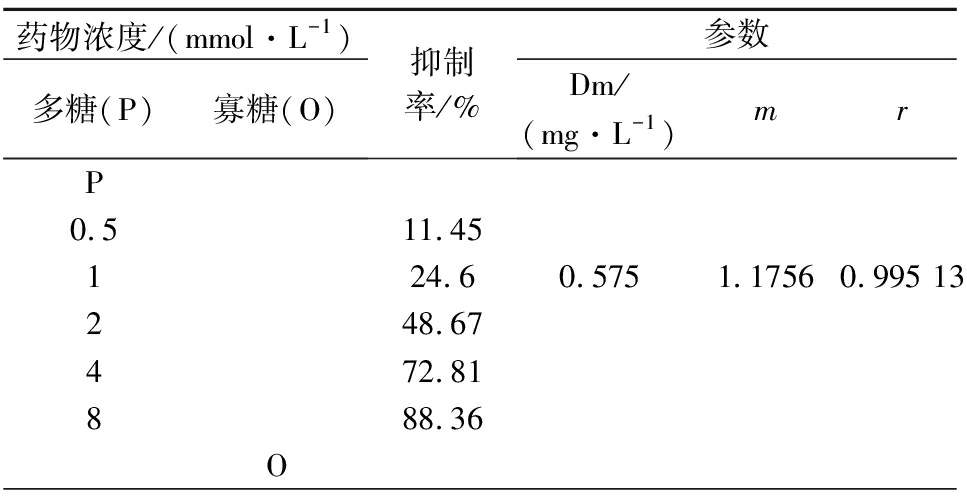
药物浓度/(mmol·L-1)多糖(P)寡糖(O)抑制率/%参数Dm/(mg·L-1)mrP0.511.45124.60.5751.17560.995 13248.67472.81888.36O
续表4

药物浓度/(mmol·L-1)多糖(P)寡糖(O)抑制率/%参数Dm/(mg·L-1)mr319.12634.781248.2512.4381.0270.9992466.254881.23P+O0.5316.451626.6321250.226.225 441.430 960.994 2642478.2984889.9
注:Dm值表示抑制率在50%时的剂量浓度;r、m均表示剂效之间相关性,其中r>0.95,表明活性物质的剂量与效应具有良好的线性关系(下同)
由图2可知,在5个不同质量浓度下有效组分进行复配后对α-葡萄糖苷酶的协同抑制作用也有差异,多糖与寡糖复配组在抑制率≤25%时,CI>1,说明多糖和寡糖的复配在抑制率达到25%的范围内是相互拮抗的关系,当质量浓度升高时,CI<1且逐渐减小,表明复配后其协同作用会随着浓度的增大而显现出来,并且浓度越大,协同作用越显著。
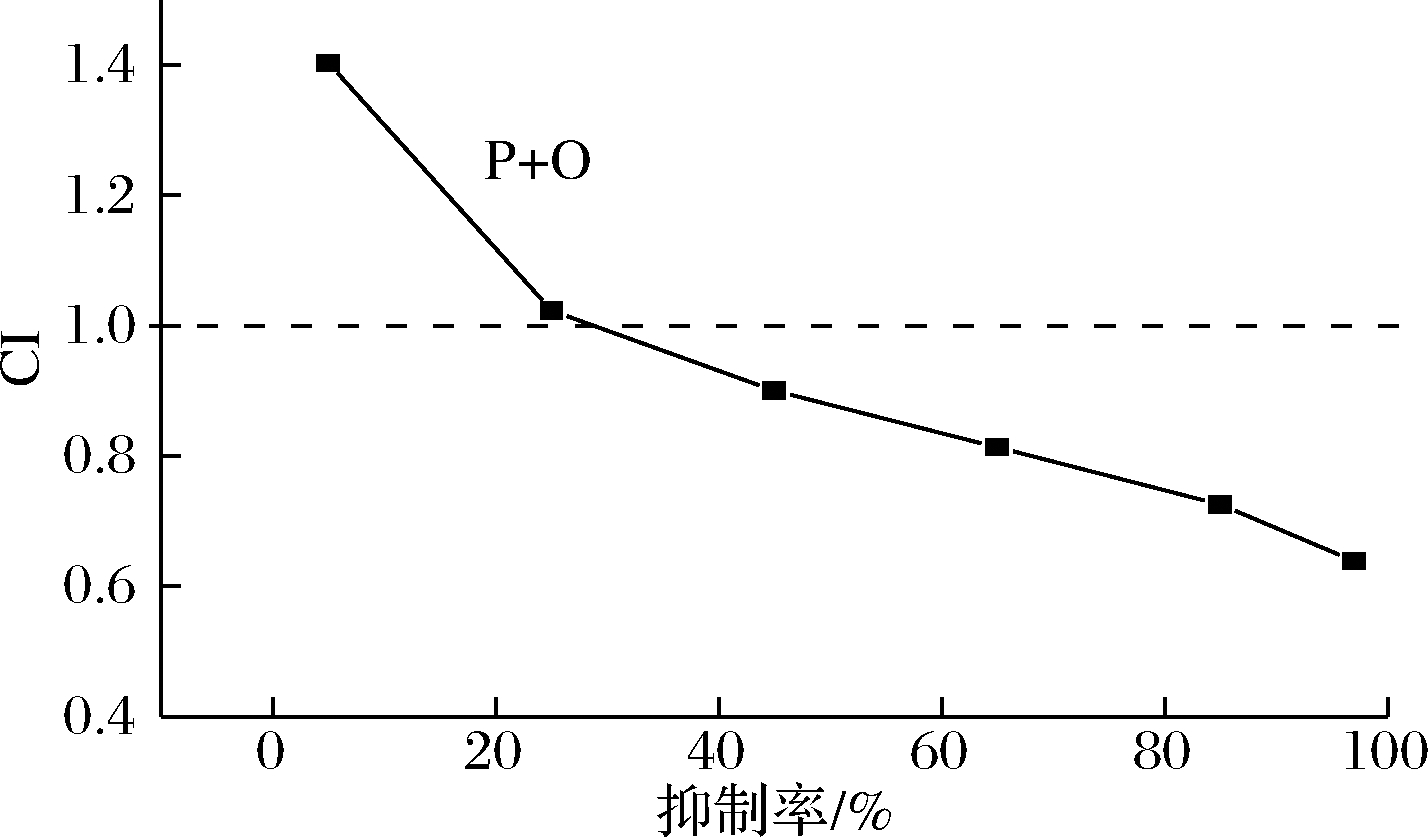
图2 两种有效组分联合作用后的剂量-效应曲线
Fig.2 The dose-response curve of the two active
components after combination
2.3 有效组分体外对α-淀粉酶活性抑制研究
2.3.1 有效组分对α-淀粉酶抑制作用研究
由图3可知,巴戟天中的2种活性成分都对α-淀粉酶有一定抑制作用,并且均随着浓度的增大而明显增强,此结果与相关研究结果一致[22-23]。有效组分中寡糖对α-淀粉酶的抑制最弱,当质量浓度为8 g/L时,巴戟天多糖和寡糖对α-淀粉酶的抑制率分别为(72.39±0.38)%和(65.2±0.55)%,两者的抑制率均低于阳性对照组中阿卡波糖的抑制率。α-淀粉酶是人体内将淀粉水解并转化为葡萄糖和低聚糖的关键酶之一,因此研究巴戟天有效组分对α-淀粉酶的抑制作用对糖尿病的治疗和预防有科学价值。
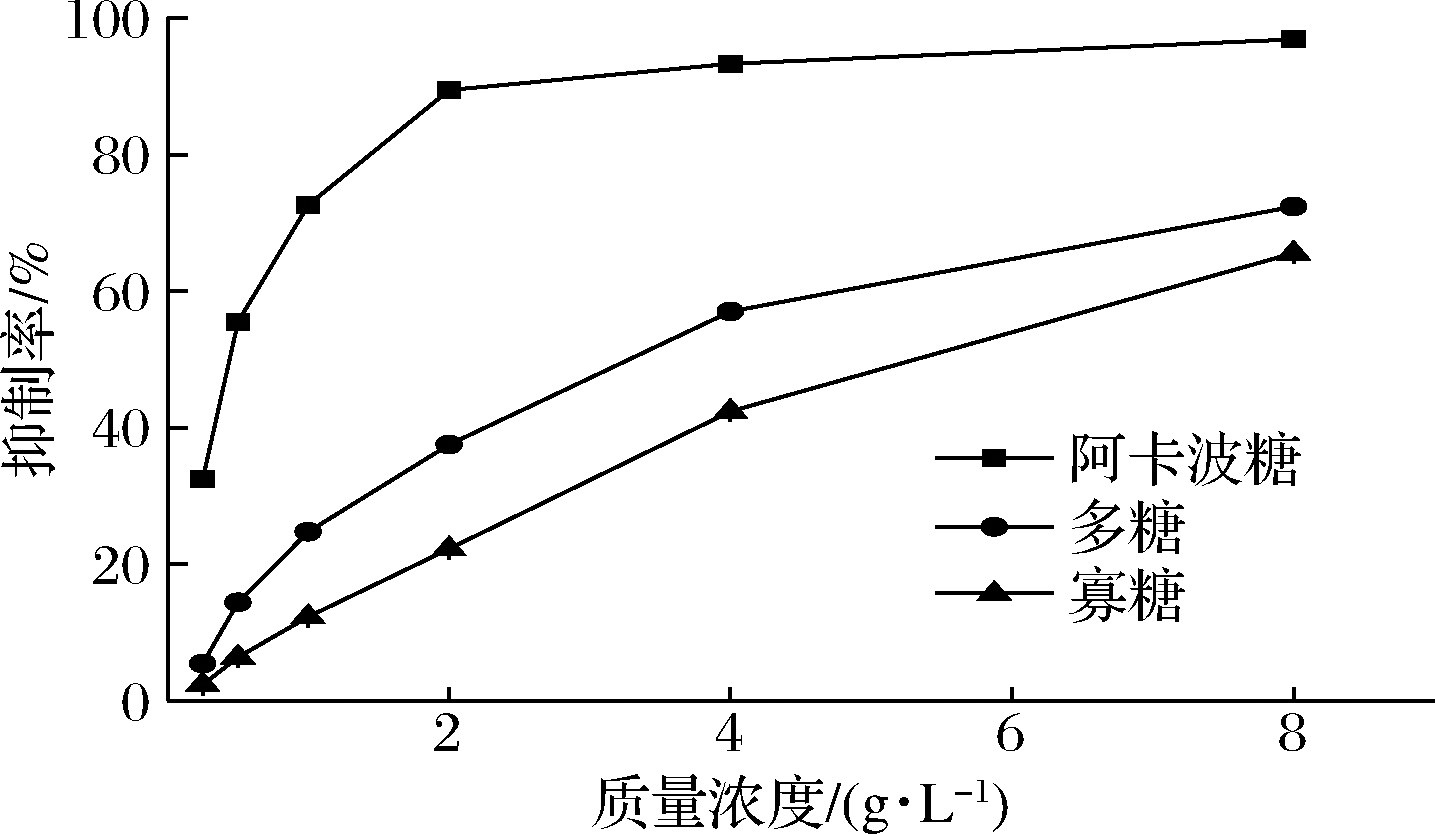
图3 发酵巴戟天不同活性组分对α-淀粉酶活性抑制作用
Fig.3 Inhibition of α-amylase activity by different active
components of fermented M.officinalis
2.3.2 有效组分对α-淀粉酶抑制活性协同作用研究
有效降糖组分多糖和寡糖对α-淀粉酶的IC50分别为3.104、5.008,说明多糖的抑制效果强于寡糖,均高于阳性对照组阿卡波糖(IC50=0.441 g/L)。由表5可知,2种成分复配后的r值>0.95,表明剂量与效应之间的线性关系良好。因此,研究组分间协同效应的剂量-效应曲线可根据表5中的数据制作得到。
表5 两种有效组分复配前后对α-淀粉酶的抑制作用
Table 5 Inhibition of α-amylase before and after the
combination of the two active components
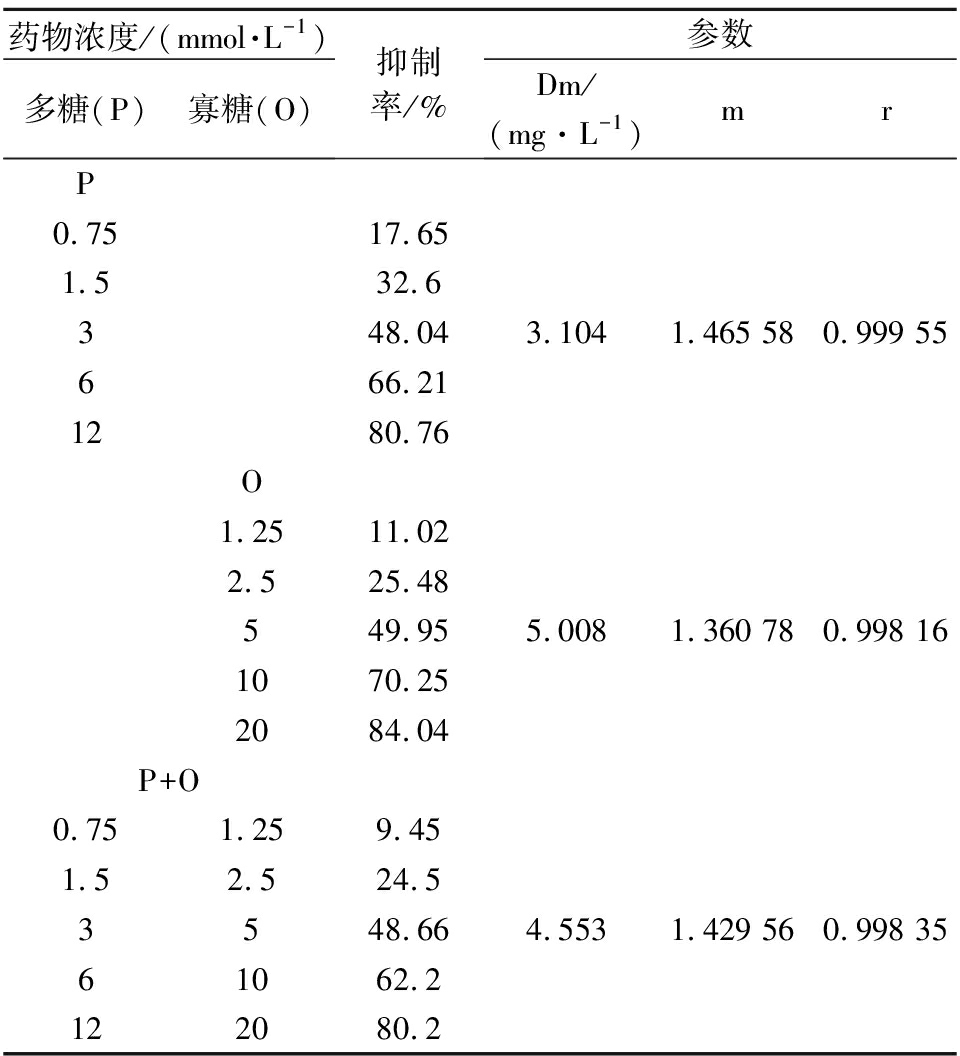
药物浓度/(mmol·L-1)多糖(P)寡糖(O)抑制率/%参数Dm/(mg·L-1)mrP0.7517.651.532.6348.043.1041.465 580.999 55666.211280.76O1.2511.022.525.48549.955.0081.360 780.998 161070.252084.04P+O0.751.259.451.52.524.53548.664.5531.429 560.998 3561062.2122080.2
由图4可知,虽然组分复配后的CI值呈现随着抑制率升高而降低的趋势,但始终大于1,表明多糖和寡糖之间对于抑制α-淀粉酶活性只具有简单相加作用,甚至拮抗作用。
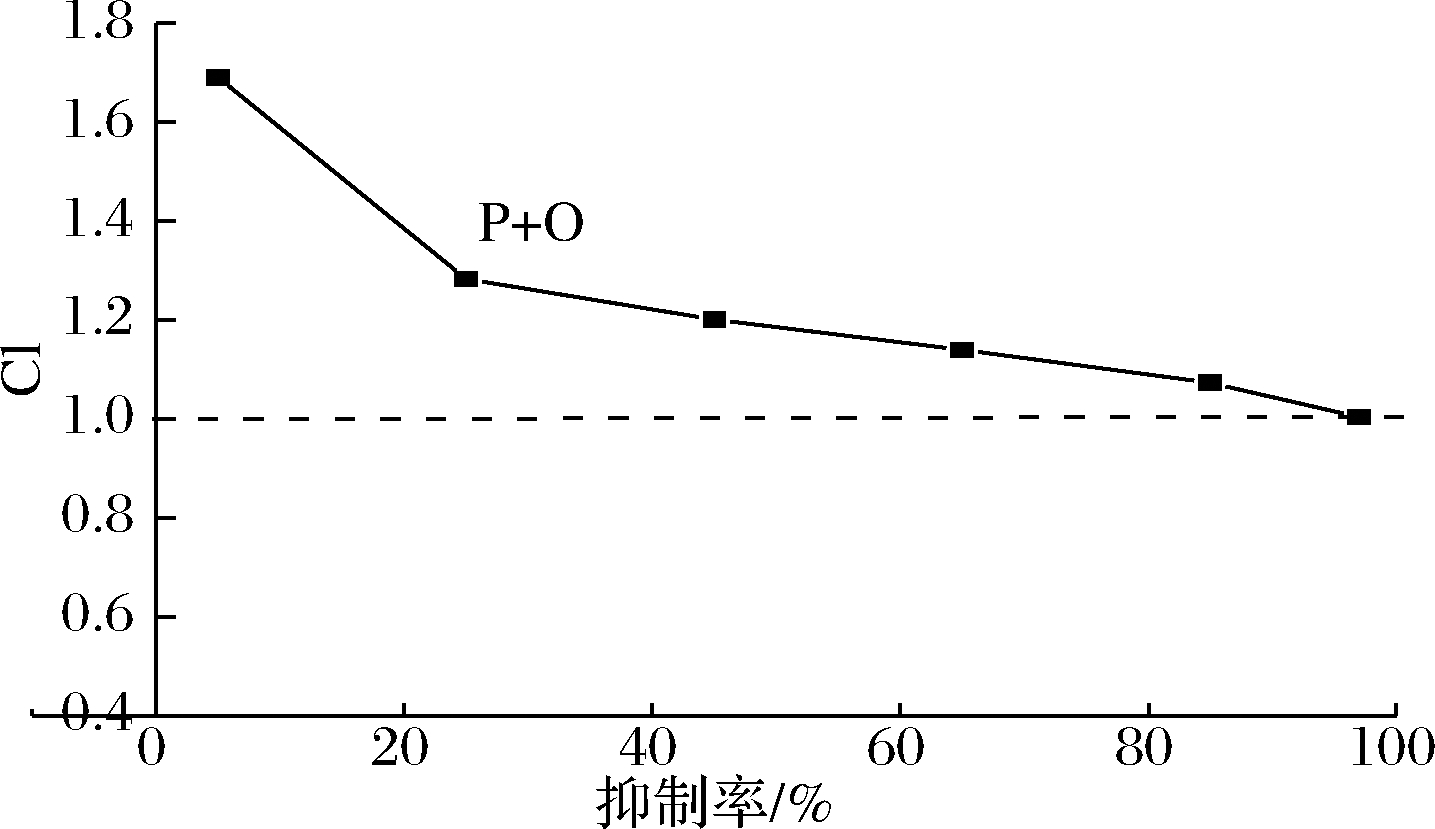
图4 两种有效组分联合作用后的剂量-效应曲线
Fig.4 The dose-response curve of the two active
components after combined action
2.4 有效组分对IR-HepG细胞活性和葡萄糖摄取量的影响
2.4.1 有效组分单独及复配对IR-HepG2细胞活性的影响
如图5、图6所示,以样品溶剂DMSO作为对照,与正常组相比没有显著的差异,说明样品溶剂对细胞的生长没有抑制作用。
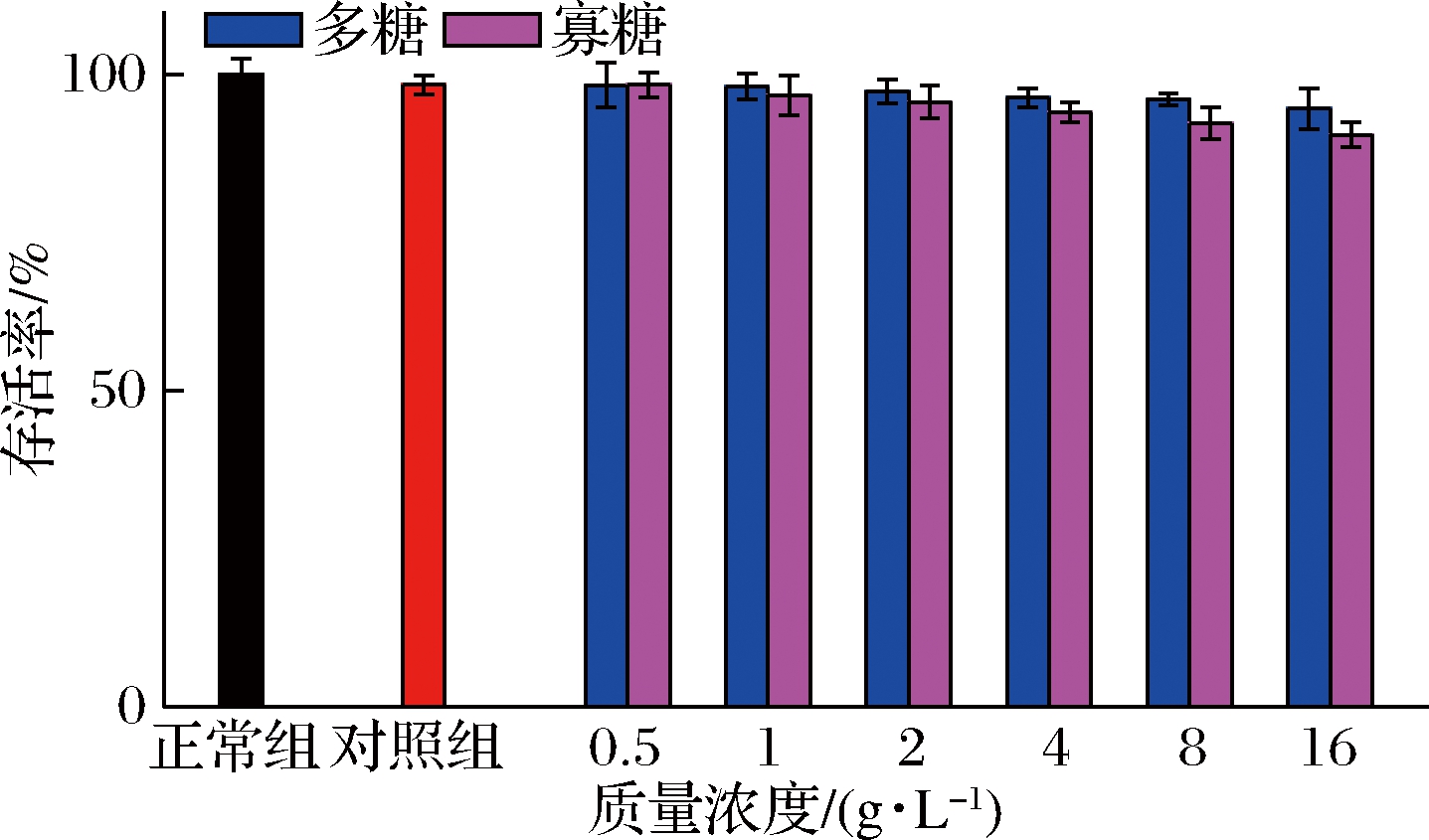
图5 不同质量浓度的有效组分单独对IR-HepG2
细胞活性的影响
Fig.5 Effects of different concentrations of active components
on the activity of IR-HepG2 cells
与对照组的细胞存活率相比,巴戟天多糖和寡糖单独或复配作用时,细胞的存活率会出现轻微地下降,但细胞的存活率都在90%以上,说明有效组分并不影响IR-HepG2细胞的正常生长,故后续试验所选用的有效组分单独作用和复配作用质量浓度分别在0.5~16 g/L和0.5 IC50、IC50和2 IC50范围内。
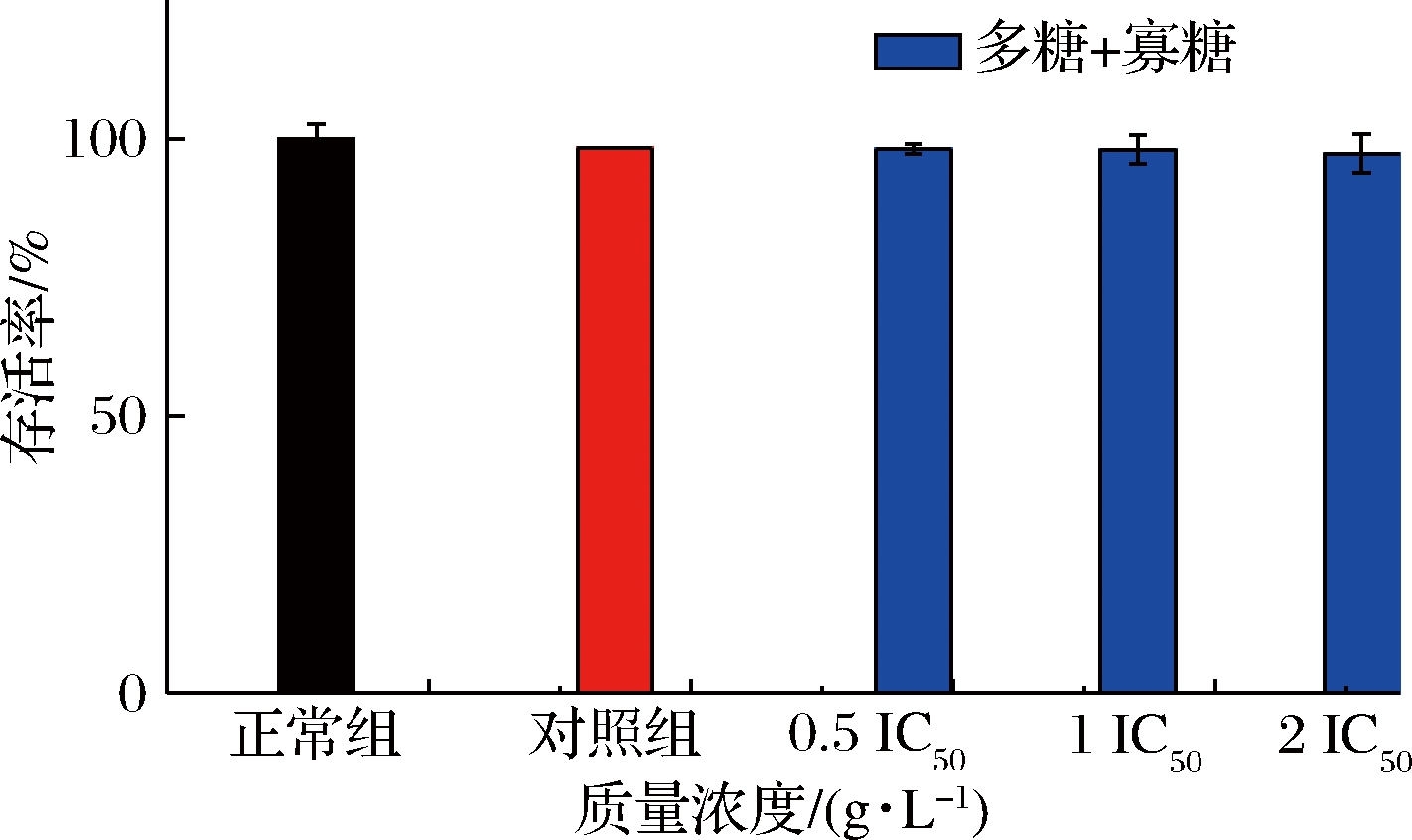
图6 不同浓度的有效组分复配对IR-HepG2细胞活性的影响
Fig.6 Effects of different concentrations of active components
on the activity of IR-HepG2 cells
2.4.2 有效组分单独及复配对IR-HepG2细胞葡萄糖消耗量的影响
从表6可知,和正常组相比,模型组葡萄糖消耗量明显较少,差额为40.90%,这意味着造模发挥作用,结果具有显著性差异。
表6 有效组分单独及复配对IR-HepG2细胞
葡萄糖消耗量的影响
Table 6 Effects of active components on glucose
consumption in IR-HepG2 cells alone or in combination
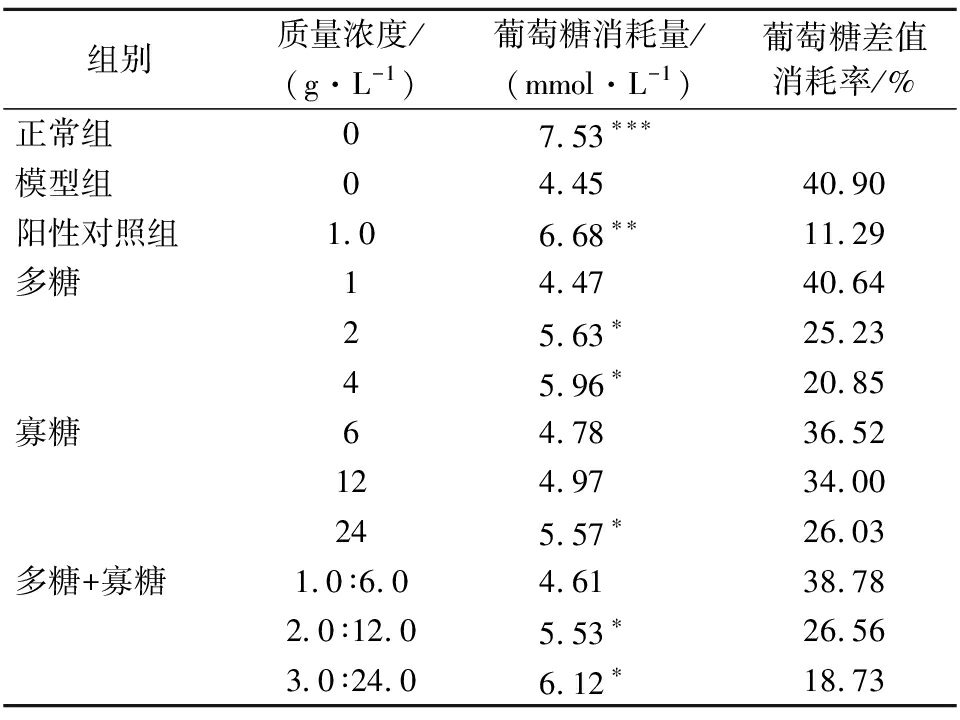
组别质量浓度/(g·L-1)葡萄糖消耗量/(mmol·L-1)葡萄糖差值消耗率/%正常组07.53∗∗∗模型组04.4540.90 阳性对照组1.0 6.68∗∗11.29 多糖14.4740.64 25.63∗25.23 45.96∗20.85 寡糖64.7836.52 124.9734.00 245.57∗26.03 多糖+寡糖1.0∶6.04.6138.78 2.0∶12.05.53∗26.56 3.0∶24.06.12∗18.73
注:*、**、***分别表示与模型组比较葡萄糖消耗量,P<0.05、P<0.01、P<0.001
阳性对照组中IR-HepG2细胞在二甲双胍的作用下葡萄糖消耗量较模型组显著增大,但与正常组的葡萄糖消耗量仍有显著的差异,并存在11.29%的葡萄糖差值。与正常组相比,0.5 IC50的较低浓度下3组实验组均与模型组的葡萄糖消耗量没有显著性差异,但随着质量浓度的升高,在单组分样品的作用下IR-HepG2细胞葡萄糖消耗量明显增大,此结果与刘亚萍等[24]实验结果相似。多糖+寡糖组与2种单一有效组分比较,IR-HepG2细胞的葡萄糖消耗量也有所增加。因此,中高剂量的单组分和复配组分样品组都能够促进IR-HepG2细胞中葡萄糖的消耗,具有较好的降糖活性。
3 结论
发酵巴戟天中多糖和寡糖单独或联合使用均对α-葡萄糖苷酶和α-淀粉酶的活性具有明显的抑制作用,且抑制效果与组分的质量浓度呈正相关;同时,这2种有效组分均能在一定程度上改善IR-HepG2细胞胰岛素抵抗作用,促进IR-HepG2细胞的葡萄糖摄取。本研究结果为巴戟天降血糖活性成分的作用机制提供了理论依据,对治疗糖尿病具有重要意义。
[1] 宫璐, 汪鹏,谭瑞湘,等.南药巴戟天的全球产地区划[J].世界中医药,2017,12(5):986-988.
GONG L,WANG P,TAN R X,et al.Global producing area of south Chinese medicine Morinda officinalis How[J].World Chinese Medicine,2017,12(5):986-988.
[2] 周妍妍, 周晓洁,闫博文,等.巴戟天化学成分及药理作用研究进展[J].辽宁中医药大学学报,2021,23(10):1-5.
ZHOU Y Y,ZHOU X J,YAN B W,et al.Chemical components and pharmacological effect of Bajitian(Morindae officinalis Radix)[J].Journal of Liaoning University of Traditional Chinese Medicine,2021,23(10):1-5.
[3] XU L,XU D,HAN Y,et al.BDNF-GSK-3β-β-Catenin pathway in the mPFC is involved in antidepressant-like effects of Morinda officinalis oligosaccharides in rats[J].The International Journal of Neuropsychopharmacology,2017,20(1):83-93.
[4] CHEN D L,LI N,LIN L,et al.Confocal mirco-Raman spectroscopic analysis of the antioxidant protection mechanism of the oligosaccharides extracted from Morinda officinalis on human sperm DNA[J].Journal of Ethnopharmacology,2014,153(1):119-124.
[5] 赖满香, 阮志燕,许意平.补肾中药巴戟天药理作用研究进展[J].亚太传统医药,2017,13(1):63-64.
LAI M X,RUAN Z Y,XU Y P.Research progress on pharmacological effect of Morinda officinalis[J].Asia Pacific Traditional Medicine,2017,13(1):63-64.
[6] DONG J W,LI X J,ZHAO H Y,et al.Improving the acetylcholinesterase inhibitory effect of Illigera aromatica by fermentation with Clonostachys rogersoniana[J].Journal of Bioscience and Bioengineering,2019,128(5):525-528.
[7] 代文豪. 发酵法炮制巴戟天工艺优化及其活性成分变化研究[D].广州:华南农业大学,2018.
DAI W H.Optimization fermentation conditions of Morinda officinalis and study on the content and activity changes of active components after fermentation[D].Guangzhou:South China Agricultural University,2018.
[8] 张舒媛, 李博,王东超,等.中药治疗糖尿病肾病研究进展[J].中国中医药信息杂志,2015,22(12):121-123.
ZHANG S Y,LI B,WANG D C,et al.Research progress on traditional Chinese medicine in treatment of diabetic nephropathy[J].Chinese Journal of Information on Traditional Chinese Medicine,2015,22(12):121-123.
[9] RAMALINGAM L,MENIKDIWELA K,LEMIEUX M,et al.The renin angiotensin system,oxidative stress and mitochondrial function in obesity and insulin resistance[J].Biochimica et Biophysica Acta,2017,1 863(5):1 106-1 114.
[10] 曾铁鑫, 姚志仁,李豫,等.巴戟天不同极性萃取相的抗氧化及降血糖活性[J].食品与发酵工业,2020,46(19):192-196.
ZENG T X,YAO Z R,LI Y,et al.Antioxidant and hypoglycemic activities of different parts partitioned from the ethanol extract of Morinda officinalis How[J].Food and Fermentation Industries,2020,46(19):192-196.
[11] 刘霄. 巴戟天多糖的降血糖和抗氧化作用研究[J].中药材,2009,32(6):949-951.
LIU X.Study on hypoglycemic and antioxidant effects of Morinda officinalis polysaccharide[J].Journal of Chinese Medicinal Materials,2009,32(6):949-951.
[12] 谭丽容, 代文豪,罗志锋,等.不同菌种发酵对巴戟天活性成分含量的影响[J].中国酿造,2018,37(12):121-125.
TAN L R,DAI W H,LUO Z F,et al.Effect of fermentation with different strains on active components content in Morinda officinalis How[J].China Brewing,2018,37(12):121-125.
[13] 杨欣, 宋健平,关业枝,等.D-900型大孔树脂纯化巴戟天低聚糖的工艺优选[J].中国实验方剂学杂志,2016,22(3):16-19.
YANG X,SONG J P,GUAN Y Z,et al.Optimization of purification technology for oligosaccharides in Morindae officinalis Radix by D-900 macroporous resin[J].Chinese Journal of Experimental Traditional Medical Formulae,2016,22(3):16-19.
[14] 许有瑞, 倪京满,孟庆刚,等.甘草中α-葡萄糖苷酶抑制剂的初步研究[J].中药材,2005,28(10):890-891.
XU Y R,NI J M,MENG Q G,et al.Preliminary study on the α-glucosidase inhibitor from Glycyrrhiza uralensis Fisch[J].Journal of Chinese Medicinal Materials,2005,28(10):890-891.
[15] MCCUE P,KWON Y I,SHETTY K.Anti-amylase,anti-glucosidase and anti-angiotensin i-converting enzyme potential of selected foods[J].Journal of Food Biochemistry,2005,29(3):278-294.
[16] 余娜. 黄酮与1-DNJ协同抑制α-葡萄糖苷酶的作用及机制[D].大连:大连理工大学,2020.
YU N.The synergistic mechanism of flavonoids and 1-DNJ in inhibiting α-glucosidase[D].Dalian:Dalian University of Technology,2020.
[17] 包桥桥, 李梦茹,黄榕,等.异鼠李素调控AKT-FOXO1通路改善胰岛素抵抗HepG2细胞糖代谢作用机制[J].食品工业科技,2020,41(23):320-324.
BAO Q Q,LI M R,HUANG R,et al.The mechanism of isorhamnetin regulating AKT-FOXO1 pathways on improve the insulin resistance model of HepG2 cells[J].Science and Technology of Food Industry,2020,41(23):320-324.
[18] 程玥, 毛竹君,张芯,等.黄芪多糖缓解HepG2细胞胰岛素抵抗模型的分子机制研究[J].预防医学,2020,32(2):121-124.
CHENG Y,MAO Z J,ZHANG X,et al.Molecular mechanism of Astragalus polysaccharide in alleviating insulin resistance in HepG2 cells[J].Preventive Medicine,2020,32(2):121-124.
[19] WANG C,LI W W,CHEN Z Q,et al.Effects of simulated gastrointestinal digestion in vitro on the chemical properties,antioxidant activity,α-amylase and α-glucosidase inhibitory activity of polysaccharides from Inonotus obliquus[J].Food Research International,2018,103:280-288.
[20] 许定舟, 苏薇薇,王永刚,等.不同分子量麦冬寡糖体外抑制α-葡萄糖苷酶活性的研究[J].中国热带医学,2017,17(2):126-129.
XU D Z,SU W W,WANG Y G,et al.Inhibitory effect of Ophiopogonis japonicas oligosaccharides at different molecular weights on α-glucosidase activity in vitro[J].China Tropical Medicine,2017,17(2):126-129.
[21] WANG B H,CAO J J,ZHANG B,et al.Structural characterization,physicochemical properties and α-glucosidase inhibitory activity of polysaccharide from the fruits of wax apple[J].Carbohydrate Polymers,2019,211:227-236.
[22] 杨玉洁, 刘静宜,谭艳,等.多糖降血糖活性构效关系及作用机制研究进展[J].食品科学,2021,42(23):355-363.
YANG Y J,LIU J Y,TAN Y,et al.Progress in understanding the structure-activity relationship and hypoglycemic mechanism of polysaccharides[J].Food Science,2021,42(23):355-363.
[23] 刘伟, 刘倩楠,张良,等.草莓多糖树脂法脱色工艺优化及其化学性质研究[J].食品工业科技,2020,41(10):38-46,51.
LIU W,LIU Q N,ZHANG L,et al.Optimization of decoloration process by macroporous resins and its chemical properties of strawberry polysaccharides[J].Science and Technology of Food Industry,2020,41(10):38-46;51.
[24] 刘亚萍, 李雨蒙,王梦,等.菊粉复配灵芝多糖对HepG2细胞胰岛素抵抗的调节作用[J].中国食品添加剂,2018(12):116-121.
LIU Y P,LI Y M,WANG M,et al.Regulating effect of inulin combined with Ganoderma lucidum polysaccharide on insulin-resistance of HepG2 cell[J].China Food Additives,2018(12):116-121.