自溶酶是细菌合成用以降解细胞壁肽聚糖的酶类,也称肽聚糖水解酶(peptidoglycan hydrolase,PGH)[1-2]。细菌快速生长时,合成的自溶酶作用于细胞壁肽聚糖形成孔洞和缝隙[3-4],可插入新合成的肽聚糖使细胞体积增大,自溶酶还有助于子细胞的分离[5],在细菌生长繁殖中起作用。此时,只有细胞壁特定部位肽聚糖限定程度的水解,保证细胞的正常生长,才不会合成过多的自溶酶导致细胞裂解死亡,因此,自溶酶的活性需要极为精准的调控[6]。在细菌进入衰亡期时也会合成PGH以及其他水解酶类,在细菌细胞程序性死亡中起作用。细菌细胞壁肽聚糖是由糖链、肽尾和肽桥组成的单体连成的网状结构[7],为了精确控制肽聚糖的水解,细菌细胞往往编码多种PGH,如N-乙酰葡萄糖苷糖胺酶,N-乙酰胞壁质酶、N-乙酰胞壁酰-L-丙氨酸酰胺酶、内肽酶和羧肽酶以及转糖基酶[8]。
乳酸菌是一类重要的益生菌,在多种发酵食品生产中都需要其大量生长繁殖以发挥作用[9-10]。但有时也需要控制乳酸菌的生长,如酸奶后熟过程中需要抑制乳酸菌的生长[11-12],以减少酸度的增加及过多的乳清形成。在白酒酿造过程中,乳酸菌产生乳酸,降低酒醅pH,促进酒精发酵顺利进行,而且乳酸及其酯化形成的乳酸乙酯均是白酒的重要风味物质[13],乳酸菌在白酒酿造中起到重要作用。但是,每年春末夏初酒醅中的乳酸菌大量增殖会导致乳酸过量,既降低新酒产量,过多的乳酸乙酯又改变了新酒主体风味物质比例,影响了新酒质量[14],是白酒生产中亟需解决的问题。本文以酒醅来源的高自溶度L.plantarum SL32-2为研究对象,考察其自溶酶的酶学性质及底物特异性,为白酒生产过程中乳酸菌的控制提供新的思路和策略。
1 材料与方法
1.1 主要材料与试剂
菌株:Lactobacillus plantarum SL32-2从某清香型白酒厂地缸上层酒醅中分离(本实验室保存)。
主要试剂:MRS培养基,生物试剂,北京奥博星生物技术责任有限公司;KH2PO4、LiCl、MgCl2,均为分析纯,天津科密欧化学试剂有限公司;马脲酰-L-苯丙氨酸、对硝基乙酰苯胺、牛血红蛋白、对硝基苯胺,均为分析纯,上海宇淳生物科技有限公司;二硝基水杨酸、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA),均为分析纯,天津市光复科技发展有限公司;柠檬酸,分析纯,天津市风船化学试剂科技有限责任公司;NaOH、苯酚,均为分析纯,洛阳市化学试剂厂。
DNS试剂:酒石酸钾钠18.2 g,溶于50 mL蒸馏水中,加热,于热溶液中依次加入3,5-二硝基水杨酸0.03 g,NaOH 2.1 g,苯酚0.5 g,搅拌至完全溶解。
茚三酮试剂:称取茚三酮1 g于盛有35 mL热水的烧杯中使其溶解,加入40 mg氯化亚锡,搅拌过滤(作防腐剂)。滤液置冷暗处过夜,加水至50 mL,摇匀备用。
LiCl-Tris(pH 8.0)缓冲液:配制0.05 mmol/L的Tris-HCl(pH 8.0),加入0.01 mmol/L MgCl2和0.001 mmol/L EDTA,待溶解后,加入1 mol/L LiCl,放入4 ℃冰箱保存。
1.2 仪器与设备
GI80DS高温灭菌锅,致微(厦门)仪器有限公司;PHS-3C型酸度计,上海仪电科学仪器股份有限公司;ZHJH-C1112B智城超净工作台、ZXMP-R1230恒温恒湿培养箱,上海智城分析仪器制造有限公司;KQ-3OOE型超声波清洗机,昆山市超声仪器有限公司;可见分光光度计,上海美谱达仪器有限公司;D-37520低速冷冻离心机,赛默飞世尔科技(中国)有限公司;电热鼓风干燥箱,上海一恒科学仪器有限公司;Microfuge 20R高速冷冻离心机,贝克曼库尔特商贸(中国)有限公司。
1.3 试验条件
1.3.1 菌株的活化
将L.plantarum SL32-2接种于MRS液体培养基中,37 ℃静置培养24 h后于4 ℃冰箱保存备用。
1.3.2 生长曲线绘制与自溶度测定
生长曲线绘制:将活化后的L.plantarum SL32-2以2%(体积分数,下同)的接种量接种于MRS液体培养基中,37 ℃静置培养,定期取样测OD650 nm值。
自溶度测定[15]:与生长曲线绘制时同时取样,离心(4 500 r/min,10 min,4 ℃)收集菌体,无菌水洗涤2次,重悬于磷酸盐缓冲液(phosphate buffer saline,PBS)(50 mmol/L,pH 6.5),取部分样品测定初始OD650 nm,读数记为A0,剩余样品置于37 ℃继续温育72 h后,测定OD650 nm,读数记为At,自溶度计算如公式(1)所示:
自溶度![]()
(1)
1.3.3 自溶酶的制备
将活化的L.plantarum SL32-2以2%的接种量接种于100 mL MRS液体培养基中,37 ℃培养4 h后,离心(4 500 r/min,10 min,4 ℃)收集菌体,并用无菌水洗涤2次,悬浮于1 mL浓度为1 mol/L LiCl的抽提液中,4 ℃静置1 h,离心(12 000×g,15 min,4 ℃)收集上清液,经0.22 μm无菌滤膜过滤后即自溶酶粗酶液[16]。
1.3.4 自溶酶作用底物的提取
将活化后的L.plantarum SL32-2以2%的接种量接种于MRS液体培养基中,37 ℃培养4 h后,离心(4 500 r/min,10 min,4 ℃)收集菌体,然后用无菌水洗涤2次后,4 ℃保藏备用。
1.3.5 自溶酶活性检测
将自溶酶粗酶液加入到底物乳酸菌PBS中,调整菌液吸光值为0.3左右,记为A0,将乳酸菌PBS调整到相同的吸光度值作为对照。在37 ℃恒温条件下分别反应2、4 h后测OD600 nm,自溶酶处理组记为A1,对照组记为A2,自溶酶的活性计算如公式(2)所示[17]:
自溶酶活性![]()
(2)
1.3.6 底物特异性
还原糖含量测定用DNS法,具体参考王明瑞等[18]的方法。氨基酸含量测定用茚三酮比色法,具体参考邓湘波等[19]的方法。
β-N-乙酰-葡萄糖胺酶活性测定:以对硝基苯-N-乙酰-β-D-氨基葡萄糖苷为显色底物,3 mL的反应体系中加入0.9 mL的PBS(0.1 mol/L,pH 7.0),0.1 mL底物溶液(1 mmol/L),2 mL酶液,37 ℃反应6 h,410 nm处检测释放的对硝基苯胺。酶活力单位(U)定义为:在最适条件下,每小时生成1 μmol对硝基苯胺所需要的酶量为1个酶活力单位[20]。
乙酰胞壁酰胺酶活性测定:以对硝基乙酰苯胺为底物,3 mL的反应体系中加入0.9 mL的PBS(0.1 mol/L,pH 7.0),0.1 mL 1 mmol/L底物溶液,2 mL酶液,37 ℃反应6 h,410 nm处检测释放的对硝基苯胺。酶活力单位(U)定义为:在最适条件下,每小时生成1 μmol对硝基苯胺所需要的酶量为1个酶活力单位[21]。
内肽酶活性测定:以牛血红蛋白为底物,3 mL反应体系中加入0.4 mL的柠檬酸缓冲液(pH 4.8)和0.2 mL柠檬酸缓冲液(pH 4.8)配制的1%(质量分数)的牛血红蛋白,38 ℃保温10 min后,加2.4 mL酶液,38 ℃下反应1 h,然后加入1 mL质量分数为10%的三氯乙酸终止反应(对照管在反应前加三氯乙酸),4 ℃下静止30 min后,离心(4 500 r/min,5 min,4 ℃),上清液用于茚三酮反应,测定单位蛋白质生成的氨基酸。酶活力单位(U)定义为:在最适条件下,每小时生成1 μmol氨基酸所需要的酶量为1个酶活力单位[22]。
羧肽酶活性测定:以马脲酰-L-苯丙氨酸为底物,3 mL反应体系中加入0.4 mL的柠檬酸缓冲液(pH 4.8),0.2 mL的柠檬酸缓冲液(pH 4.8)配制的质量分数为0.3%的马脲酰-L-苯丙氨酸,38 ℃保温10 min后,加2.4 mL酶液,38 ℃下反应1 h,然后加入1 mL质量分数为10%的三氯乙酸终止反应(对照管在反应前加三氯乙酸),4 ℃下静止30 min后,离心(4 500 r/min,5 min,4 ℃),上清液用于茚三酮反应,测定单位蛋白质生成的氨基酸量。酶活力单位(U)定义为:在最适条件下,每小时生成1 μmol氨基酸所需要的酶量为1个酶活力单位[22]。
2 结果与分析
2.1 L.plantarum SL32-2的生长曲线和自溶度曲线
L.plantarum SL32-2的生长曲线和自溶度曲线如图1所示。活化后的L.plantarum SL32-2在MRS液体培养基中生长迅速,延滞期较短约为2 h,对数生长期为2~20 h,之后进入稳定期,OD650 nm可达5.08,40 h后进入衰亡期。图1中自溶度曲线表明,L.plantarum SL32-2在培养4 h有1个自溶度高峰,自溶度高达46%,此时菌株正处在对数早期,之后自溶度迅速下降,在15%~20%波动,整体变化趋势与乳酸菌LB-3自溶酶的变化趋势一致[23]。说明在对数早期,乳酸菌自溶酶活性较高,在细胞壁肽聚糖上形成大量缝隙以填充新的肽聚糖,使菌体快速生长繁殖。在进一步分析L.plantarum SL32-2自溶酶的特性时,取对数早期4 h的发酵液提取自溶酶。
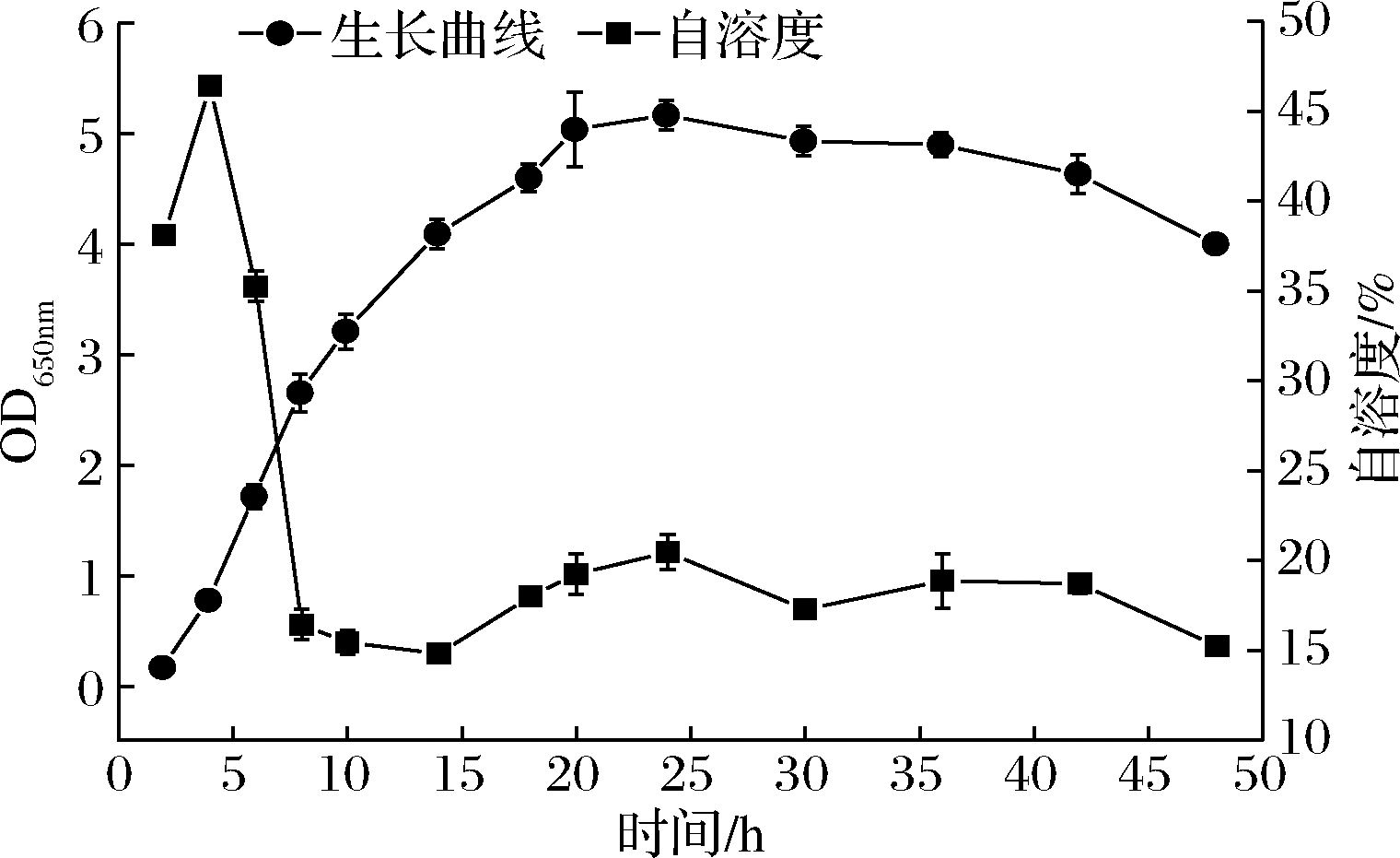
图1 L.plantarum SL32-2的生长曲线及自溶度曲线
Fig.1 Growth curve and autolysis rate of L.plantarum SL32-2
2.2 反应体系对L.plantarum SL32-2自溶酶活性的影响
为进一步了解L.plantarum SL32-2自溶酶在胞外的活性,以该菌细胞作为底物,与自溶酶在不同反应体系混合后测定自溶酶活性,自溶酶活性用OD600 nm下降百分率表示,结果见图2。在不同的反应体系中,反应时间为2 h时,OD600 nm下降百分率最大,表明在该时间段内自溶酶的活性最高,之后OD600 nm下降百分率变化缓慢,因此,在后续试验中选取2 h作为反应时间。同时,随着自溶酶比例升高,OD600 nm下降百分率增大,表明自溶酶的活性有所提高,当反应体系为V(底物乳酸菌)∶V(自溶酶)=1∶2时,自溶酶活性最高,OD600 nm下降百分率可达23.33%。在后面的试验中选择V(底物乳酸菌)∶V(自溶酶)=1∶2进行。
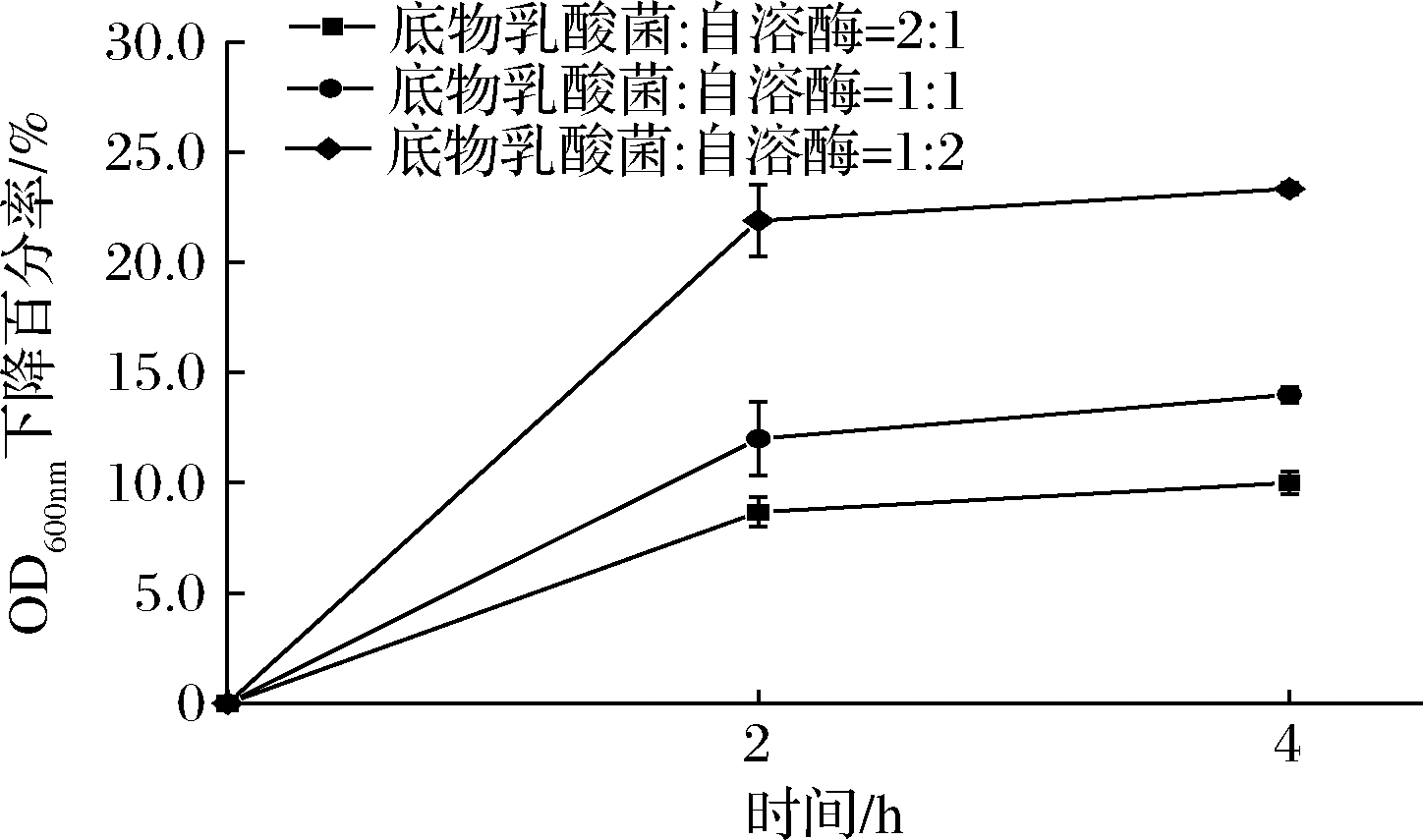
图2 反应体系对L.plantarum SL32-2自溶酶活性的影响
Fig.2 Effect of reaction systems on the autolysin activity
of L.plantarum SL32-2
2.3 温度对L.plantarum SL32-2自溶酶活性的影响
乳酸菌自溶酶可能是多种组分体系,因为常以混合形式应用,仍需明确其自溶酶体系的酶学性质。为了解L.plantarum SL32-2自溶酶体系的最适温度,试验于27、32、37、42、47 ℃下检测自溶酶活性,结果如图3所示。
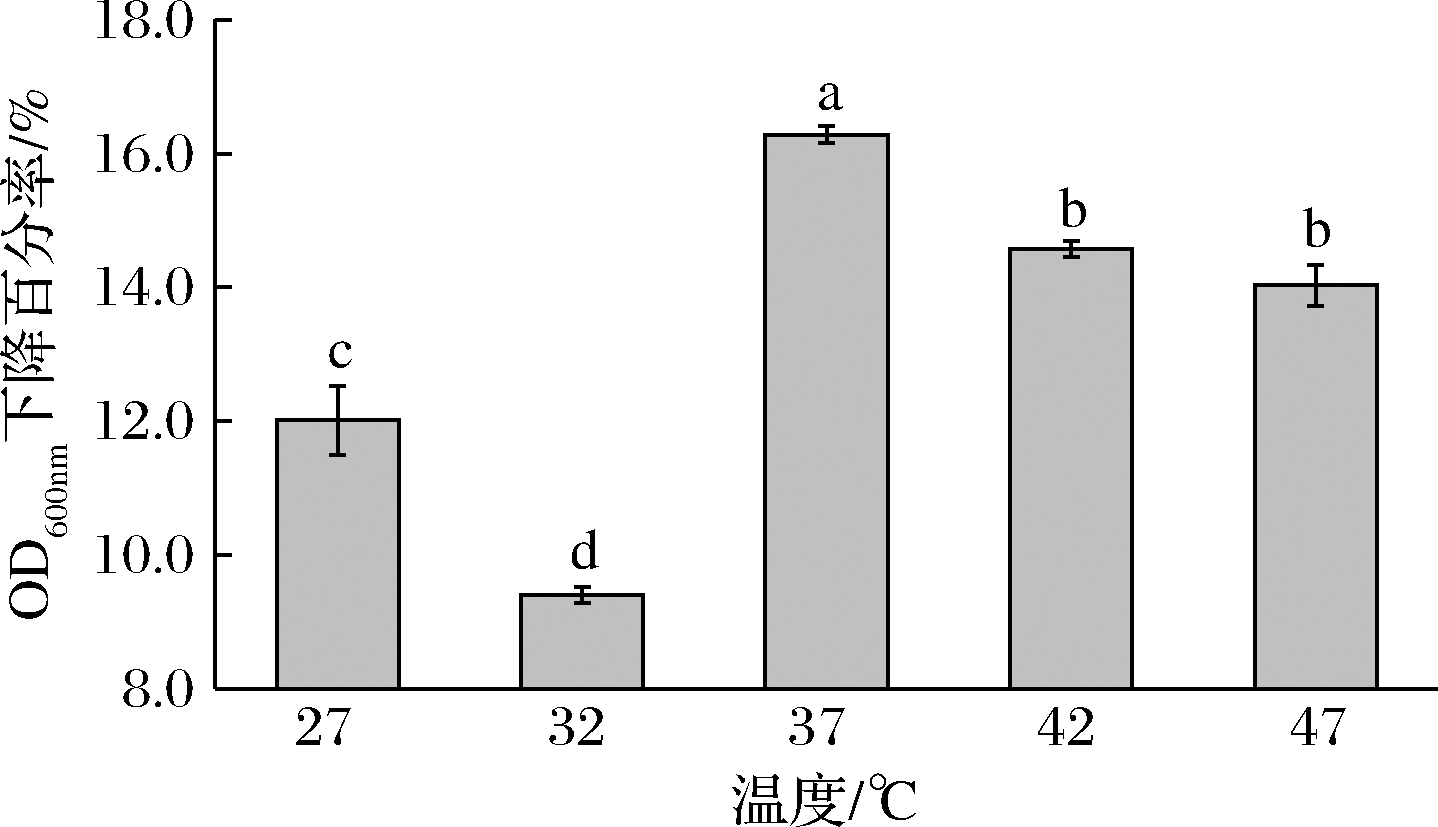
图3 温度对L.plantarum SL32-2自溶酶活性的影响
Fig.3 Effect of temperature on the autolysin activity
of L.plantarum SL32-2
注:不同字母表示差异性显著,P<0.05(下同)
随着温度的升高,自溶酶的活性呈现先降低后升高的趋势,之后自溶酶活性基本趋于稳定,37 ℃时,自溶酶的活性最高,OD600 nm下降百分率为16.28%;之后自溶酶活性开始下降,42 ℃、47 ℃时OD600 nm下降百分率分别为14.47%和14.08%。从干酪中分离的Lactobacillus casei BL23中提取的N-乙酰胞壁酸酶AclB最适温度为37 ℃,与本试验结论一致[17]。
2.4 pH对L.plantarum SL32-2自溶酶活性的影响
为进一步了解L.plantarum SL32-2自溶酶的最适pH,在pH值为 5.5、6.5、7.5及8.5的条件下检测自溶酶活性,结果如图4所示。随着pH的升高,L.plantarum SL32-2自溶酶的活性呈现先上升后下降的趋势,当pH为7.5时,自溶酶的活性最高,OD600 nm下降百分率为26.7%;当pH>7.5,自溶酶活性开始降低,pH为8.5时OD600 nm下降百分率为21.48%。从意大利腊肠中分离的Lactobacillus sakei中提取的N-乙酰胞壁酰-L-丙氨酸酰胺酶最适pH为8.0,与本试验结果比较接近[24]。
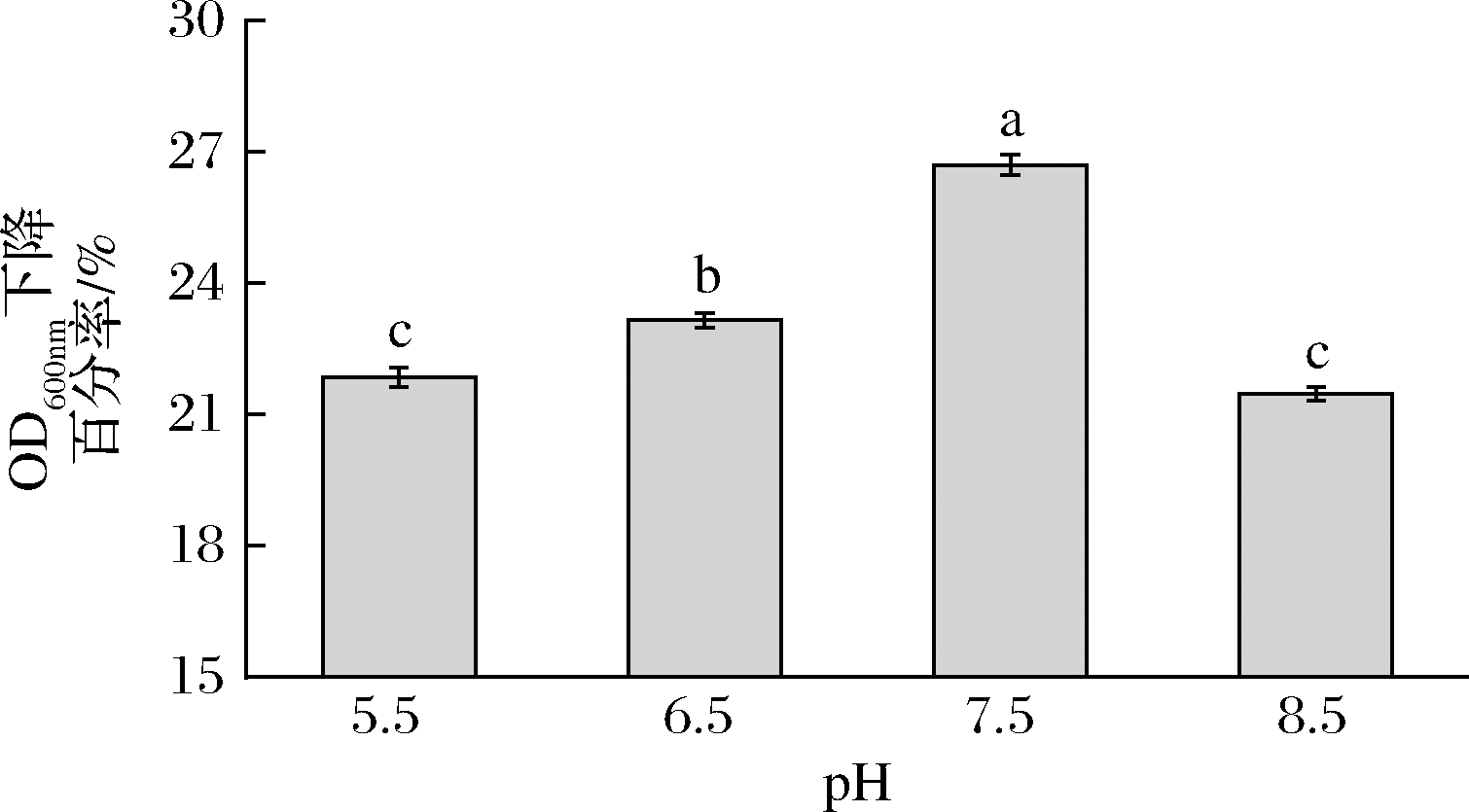
图4 pH对L.plantarum SL32-2自溶酶活性的影响
Fig.4 Effect of pH on the autolysin activity
of L.plantarum SL32-2
2.5 L.plantarum SL32-2自溶酶底物特异性分析
乳酸菌与金黄色葡萄球菌的肽聚糖结构类似,糖链均由N-乙酰葡萄糖胺和N-乙酰胞壁酸通过β-1,4糖苷键交替连接而成;乳酸菌肽聚糖的四肽尾是-L-丙氨酸-2-γ-D-谷氨酸-3-X-4-D-丙氨酸,其中的X可能是L-赖氨酸(L-Lys)、内消旋二氨基庚二酸(mDAP)或L-鸟氨酸(L-Orn),肽桥可以由1条四肽尾的第4位氨基酸与另1条四肽尾的第3位氨基酸交联形成,也可以通过1个D-氨基酸或多个L-氨基酸连接形成[25],可见,乳酸菌肽聚糖多样性表现在肽桥和肽尾。肽聚糖复杂结构使得细菌可编码多个PGH。为了解L.plantarum SL32-2自溶酶的底物特异性,在有无外加自溶酶的条件下,比较自溶前后缓冲液中的还原糖和氨基酸含量变化,判断是否有切断糖链和肽链的酶类,并同时检测自溶度。从图5中可以看出,L.plantarum SL32-2自溶前还原糖为1.59 mg/mL,自溶后增加到2.38 mg/mL,增加了0.50倍,说明L.plantarum SL32-2自溶酶可降解肽聚糖糖链部分;添加自溶酶后还原糖质量浓度由自溶前的1.49 mg/mL,增加到自溶后的3.06 mg/mL,增加了1.05倍,L.plantarum SL32-2的自溶度在添加自溶酶后也由17.21%增加到29.25%(图6),说明自溶酶在胞外显著促进了乳酸菌的自溶。L.plantarum SL32-2自溶前氨基酸为0.041 mg/mL,自溶后增加到1.101 mg/mL,增加了25.83倍,说明L.plantarum SL32-2自溶酶可降解肽聚糖的肽链部分;添加自溶酶后氨基酸由自溶前的0.040 mg/mL,增加到自溶后的1.753 mg/mL,增加了42.83倍,再次说明自溶酶在胞外显著促进了乳酸菌的自溶。由上可知,无论是否外加自溶酶,自溶后氨基酸增加量都远大于还原糖,证明作用于肽尾和肽桥的自溶酶组分活性更高。
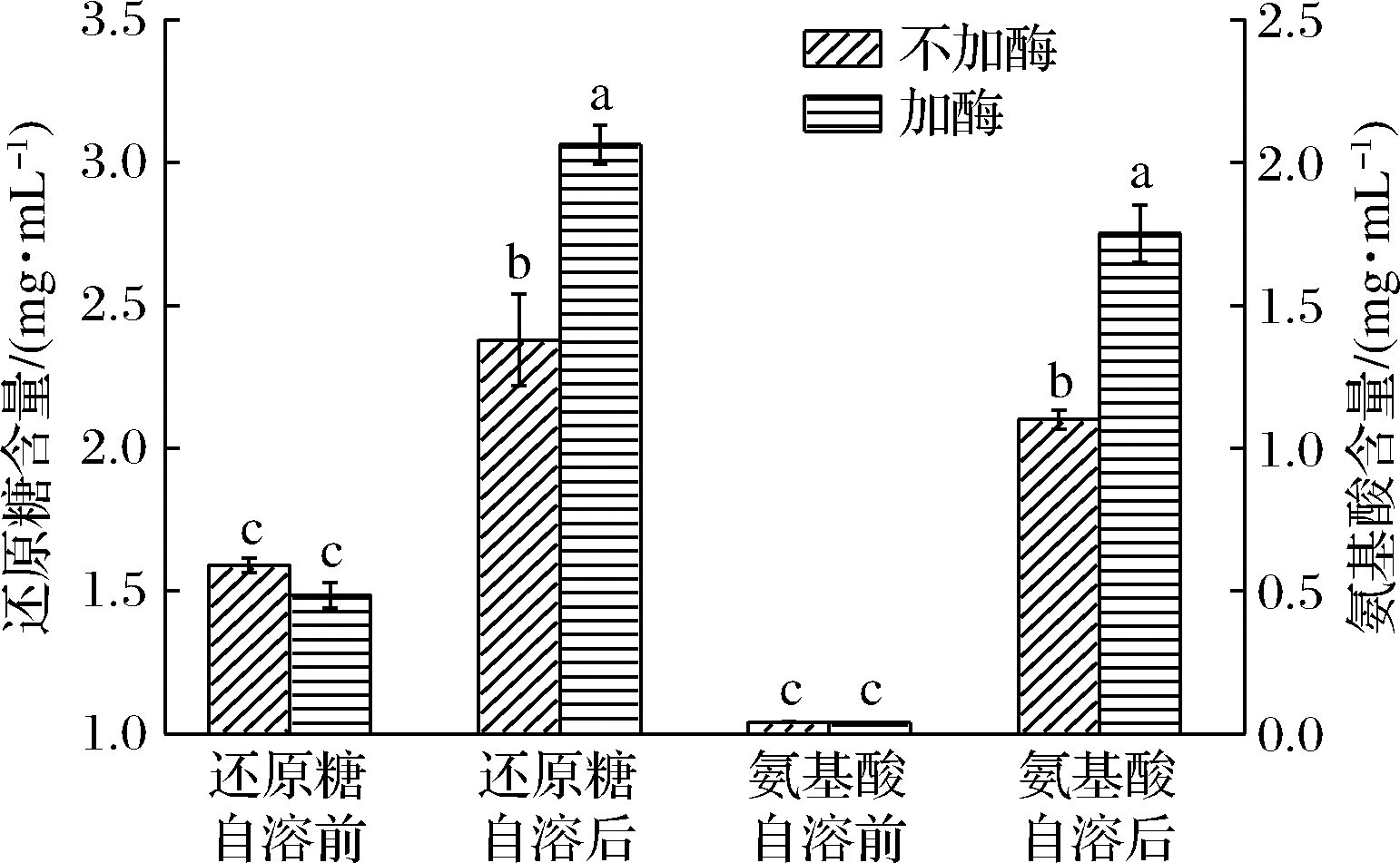
图5 添加自溶酶对L.plantarum SL32-2自溶前后
还原糖和氨基酸变化量的影响
Fig.5 Effect of adding autolysin on the concentrations
of reducing sugars and amino acids before and after
autolysis of L.plantarum SL32-2

图6 添加自溶酶对L.plantarum SL32-2自溶度的影响
Fig.6 Effect of adding autolysin on the autolysin
rate of L.plantarum SL32-2
由于乳酸菌自溶酶组分较多,所作用的底物各不相同,将L.plantarum SL32-2自溶酶分别作用于对硝基苯-N-乙酰-β-D-氨基葡萄糖苷、对硝基乙酰苯胺、马脲酰-L-苯丙氨酸和牛血红蛋白4种底物,检测β-N-乙酰-葡萄糖胺酶、乙酰胞壁酰胺酶、羧肽酶以及内肽酶的活性,结果如图7所示。β-N-乙酰-葡萄糖胺酶、乙酰胞壁酰胺酶、羧肽酶、内肽酶的活性分别为0.003 6、0.002 7、1.126 7、2.098 7 U。表明作用于肽链的内肽酶和羧肽酶活性远高于作用于糖链的β-N-乙酰-葡萄糖胺酶及连接糖链和肽的酰胺酶,由此可知,内肽酶及羧肽酶是L.plantarum SL32-2最主要的PGH。
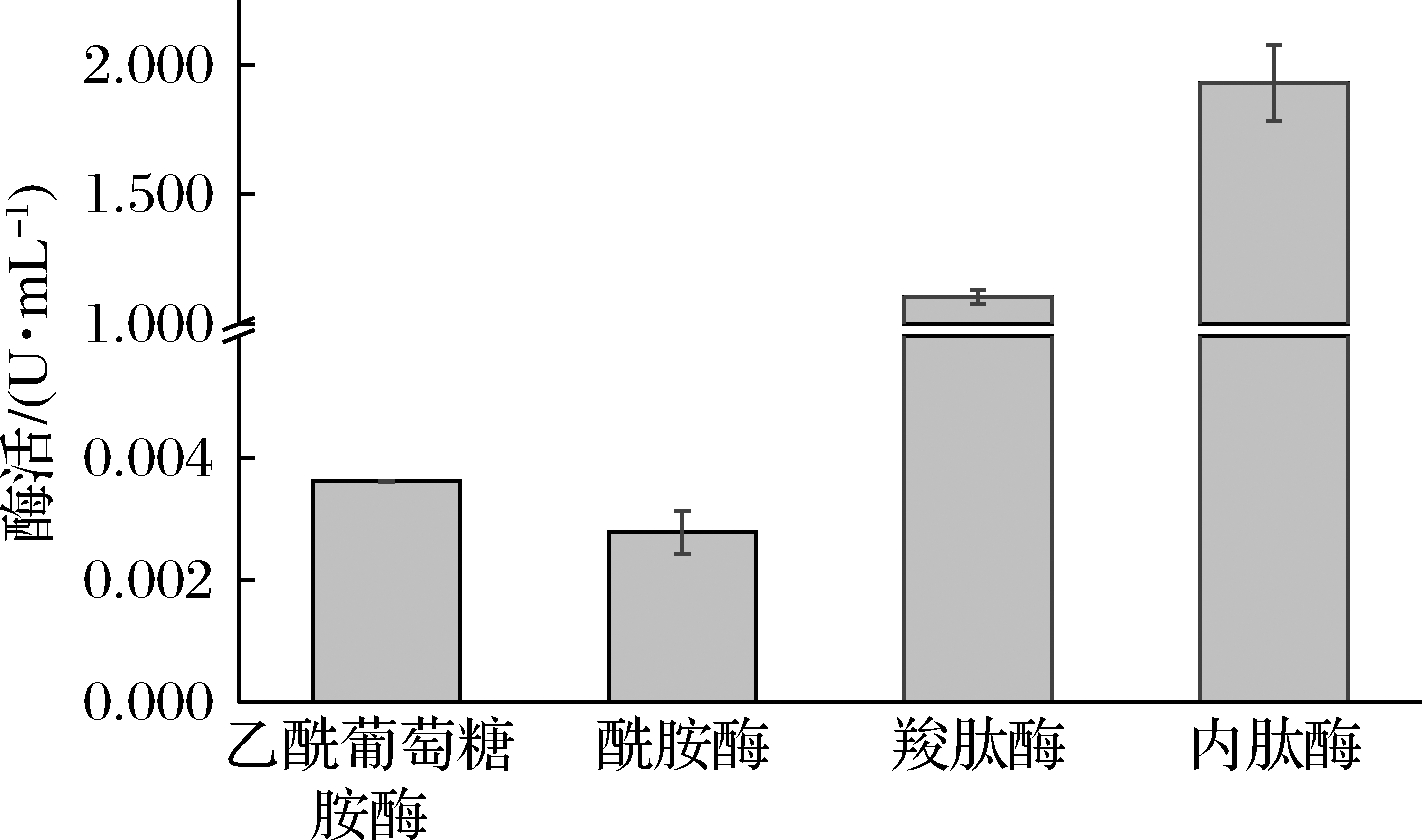
图7 L.plantarum SL32-2自溶酶底物特异性分析
Fig.7 Analysis of substrate specificity of autolysin
from L.plantarum SL32-2
3 结论
细菌生长过程中合成的自溶酶除了用于细胞生长分裂和程序性死亡外,还可在饥饿诱导条件下筛选高自溶度菌株用于干酪生产[26],也可以提取自溶酶用于控制乳酸菌的生长繁殖。本试验主要研究了酒醅来源L.plantarum SL32-2自溶酶特性及底物特异性,结果表明,L.plantarum SL32-2在对数期早期自溶度最高,其自溶酶最适pH为7.5,最适温度为37 ℃;将自溶酶添加到该细菌细胞缓冲液中,自溶度增加了12.04%、缓冲液中还原糖增加了1.05倍、氨基酸增加了42.83倍;进一步分析自溶酶的底物特异性发现,L.plantarum SL32-2自溶酶中β-N-乙酰葡萄糖胺酶、酰胺酶、羧肽酶、内肽酶的活性分别为0.003 6、0.002 7、1.126 7、2.098 7 U,说明L.plantarum SL32-2作用于肽链的酶活性远高于作用于糖链的酶,并且其自溶酶在细胞内外均能促进乳酸菌裂解,因此有望通过添加自溶酶的方式,控制乳酸菌的过量生长。
[1] CHEN S W,WU Y F,NIU H Y,et al.Imbalance between peptidoglycan synthases and hydrolases regulated lysis of Lactobacillus bulgaricus in batch culture[J].Archives of Microbiology,2021,203(7):4 571-4 578.
[2] KIM B,ESPINOSA J,HANG H C.Biochemical analysis of NlpC/p60 peptidoglycan hydrolase activity[J].Methods in Enzymology,2020,638:109-127.
[3] EGAN A J F,ERRINGTON J,VOLLMER W.Regulation of peptidoglycan synthesis and remodelling[J].Nature Reviews Microbiology,2020,18(8):446-460.
[4] 崔文明, 逄晓阳,张书文,等.N-乙酰胞壁质酶缺失对保加利亚乳杆菌LJJ自溶及形态的影响[J].中国农业科学,2014,47(15):3 058-3 068.
CUI W M,PANG X Y,ZHANG S W,et al.Effect of N-acetylmuramidase knockout on autolysis and morphology of Lactobacillus bulgaricus LJJ[J].Scientia Agricultura Sinica,2014,47(15):3 058-3 068.
[5] WEAVER A I,JIMÉNEZ-RUIZ V,TALLAVAJHALA S R,et al.Lytic transglycosylases RlpA and MltC assist in Vibrio cholerae daughter cell separation[J].Molecular Microbiology,2019,112(4):1 100-1 115.
[6] 王凯旋. 乳酸菌肽聚糖的制备、结构及其生理功能研究[D].南京:南京农业大学,2017.
WANG K X.Preparation,structual characterization and function of peptidoglycan from lactic acid bacteria[D].Nanjing:Nanjing Agricultural University,2017.
[7] 刘朝, 乔建军,朱宏吉.乳酸菌肽聚糖的研究进展[J].微生物学通报,2016,43(1):188-197.
LIU Z,QIAO J J,ZHU H J.Research progress in peptidoglycan of lactic acid bacteria[J].Microbiology China,2016,43(1):188-197.
[8] INAMURA S,FUKASE K,KUSUMOTO S.Synthetic study of peptidoglycan partial structures.Synthesis of tetrasaccharide and octasaccharide fragments[J].Tetrahedron Letters,2001,42(43):7 613-7 616.
[9] 许女, 李雅茹,王超宇,等.传统发酵食品中乳酸菌的抗生素耐药性评估及耐药基因分析[J].中国食品学报,2020,20(7):160-171.
XU N,LI Y R,WANG C Y,et al.Antimicrobial resistance evaluation and resistant gene profiles of lactic acid bacteria isolated from traditional fermented foods[J].Journal of Chinese Institute of Food Science and Technology,2020,20(7):160-171.
[10] 吕懿超, 李香澳,王凯博,等.乳酸菌作为生物保护菌的抑菌机理及其在食品中应用的研究进展[J].食品科学,2021,42(19):281-290.
LYU Y C,LI X G,WANG K B,et al.Antimicrobial mechanism of lactic acid bacteria as biopreservative organisms and their application in food industry:A review[J].Food Science,2021,42(19):281-290.
[11] 吴小艳, 刘文星,刘忠义,等.芒果酸奶发酵及后熟过程中乳酸菌素的产生及其抑菌作用[J].食品与发酵工业,2021,47(7):183-188.
WU X Y,LIU W X,LIU Z Y,et al.Production and bacteriostasis of lactobacillin during the fermentation and ripening of mango yoghurt[J].Food and Fermentation Industries,2021,47(7):183-188.
[12] 陈一萌, 李思宁,唐善虎,等.不同稳定剂对凝固型牦牛酸奶在冷藏后熟过程中品质及风味的影响[J].食品工业科技,2018,39(4):188-196.
CHEN Y M,LI S N,TANG S H,et al.Effect of different stabilizers on the quality and flavors of set-style yak yoghurt during post-fermentation storage[J].Science and Technology of Food Industry,2018,39(4):188-196.
[13] 王新叶, 李芳香,张依香,等.乳酸降解菌在白酒酿造中的研究进展[J].中国酿造,2021,40(6):7-10.
WANG X Y,LI F X,ZHANG Y X,et al.Research progress on lactic acid-degrading bacteria in Baijiu-making process[J].China Brewing,2021,40(6):7-10.
[14] 宋瑞滨, 邵泽良,宋军.浓香型白酒生产过程中乳酸乙酯含量控制措施探讨[J].酿酒,2020,47(5):22-27.
SONG R B,SHAO Z L,SONG J.Discussion on control measures of ethyl lactate content in Luzhou-flavor liquor production[J].Liquor Making,2020,47(5):22-27.
[15] BUIST G,KARSENS H,NAUTA A,et al.Autolysis of Lactococcus lactis caused by induced overproduction of its major autolysin,AcmA[J].Applied and Environmental Microbiology,1997,63(7):2 722-2 728.
[16] IYER J L,SHETTY P,PAI J S.Evaluation of whole cells of Bacillus subtilis as substrate for measurement of autolysin activity[J].Process Biochemistry,2005,40(5):1 593-1 597.
[17] 徐毅. 乳酸菌高效膜蛋白表达系统的构建及其自溶性质的研究[D].济南:山东大学,2012.
XU Y.A high-yield membrane protein expression system and autolysis in lactic acid bacteria[D].Jinan:Shandong University,2012
[18] 王明瑞, 侯彦喜,张亚丹.3,5-二硝基水杨酸法测定发酵液中多糖含量[J].现代食品,2020(4):216-222.
WANG M R,HOU Y X,ZHANG Y D.Determination of polysaccharide content in fermentation broth by 3,5-dinitrosalicylic acid method[J].Modern Food,2020(4):216-222.
[19] 邓湘波, 邓湘平.茚三酮比色法测定湘西腊肉甘氨酸含量[J].食品工程,2019(4):55-59.
DENG X B,DENG X P.Determination of glycine in Xiangxi bacon by ninhydrin colorimetric method[J].Food Engineering,2019(4):55-59.
[20] 张婧, 梁俊容,段然,等.小肠结肠炎耶尔森菌β-N-乙酰葡萄糖胺酶调控机制及AmpD蛋白对AmpCβ-内酰胺酶表达的作用[J].中华预防医学杂志,2018,52(6):653-660.
[21] 孙卫忠, 胡晓梅,饶贤才,等.铜绿假单胞菌噬菌体PaP1内溶素基因克隆、表达及活性分析[J].第三军医大学学报,2008,30(13):1 268-1 271.
SUN W Z,HU X M,RAO X C,et al.Cloning,expression and enzymatic assay of bacteriophage PaP1 endolysin against Pseudomonas aeruginosa[J].Acta Academiae Medicinae Militaris Tertiae,2008,30(13):1 268-1 271.
[22] 王东, 于振文,王旭东.硫素对冬小麦籽粒蛋白质积累的影响[J].作物学报,2003,29(6):878-883.
WANG D,YU Z W,WANG X D.Effects of sulfur on protein accumulation in kernels of winter wheat[J].Acta Agronomica Sinica,2003,29(6):878-883.
[23] 冯镇, 张兰威,姚伟.培养时间对乳酸菌自溶影响及菌体形态学变化[J].中国乳品工业,2006,34(7):28-30.
FENG Z,ZHANG L W,YAO W.Influence of incubation time on the autolytic activity of lactic acid bacteria and the morphological changes of lactic acid bacteria[J].China Dairy Industry,2006,34(7):28-30.
[24] LOPEZ-ARVIZU A,ROCHA-MENDOZA D,PONCE-ALQUICIRA E,et al.Characterization of antibacterial activity of a N-acetylmuramoyl-L-alanine amidase produced by Latilactobacillus sakei isolated from salami[J].World Journal of Microbiology & Biotechnology,2021,37(4):65.
[25] BERNARD E,ROLAIN T,COURTIN P,et al.Characterization of o-acetylation of n-acetylglucosamine:A novel structural variation of bacterial peptidoglycan[J].Journal of Biological Chemistry,2011,286(27):23 950-23 958.
[26] 陈森怡, 刘振民,焦晶凯,等.干酪用乳酸菌的特性比较及新鲜干酪的制作[J].食品科学,2020,41(22):112-118.
CHEN S Y,LIU Z M,JIAO J K,et al.Comparison of characteristics of lactic acid bacteria as starter cultures for cheese and application in fresh cheese production[J].Food Science,2020,41(22):112-118.