酱香型白酒酿造工艺复杂,具有“四高两长”的特点。高温制曲是酱香酒白酒酿造工艺中最关键的环节,高温大曲中微生物的种类、数量、结构等直接决定着白酒的产量和质量。
随着测序技术的发展,人们对酒曲和发酵过程中微生物群落结构和多样性变化有了更深入的了解,在此基础上,通过分离和筛选功能菌种制备强化曲,以强化酒曲性能、改善白酒品质得到广泛关注。WANG等[1]在大曲中强化添加地衣芽胞杆菌,结果发现芳香化合物和吡嗪类物质含量显著提高。卢君等[2]在白酒酿造过程中,利用菌种强化和工艺优化相结合的方式,将酱香型白酒基酒中四甲基吡嗪含量提高了202.75%。崔香香等[3]将分离得到的谢瓦散囊菌CICC 41584应用到浓香型白酒大曲生产中,通过固态发酵发现该菌株能够显著提升白酒大曲中关键风味成分。SU等[4]从糟醅中筛选到2株功能酵母并将其应用于小曲酒生产中,发酵结束时,酸、醇的含量分别提高了42.5%和11.8%。因此,强化曲在白酒酿造过程中具有广阔的应用前景。
本试验利用3株酵母菌和2株细菌分别制备强化曲,添加至六轮次生产摊晾后的糟醅中进行强化发酵,通过检测分析酒醅理化指标和挥发性成分动态变化,探究利用功能微生物制备强化曲对固态发酵的影响,从而为利用强化曲在白酒酒质提升方面的应用提供理论依据。
1 材料与方法
1.1 试验菌种
试验菌种信息如表1所示。
表1 供试菌株明细
Table 1 Details of strains used in this experiment

菌种名称编号来源异常威客汉姆酵母(Wickhamomyces anmalus)FBKL 2.00K8酱香酒醅汉逊德巴利酵母(Debaryomyces coudertiii)FBKL 2.0130酱香大曲蜂生假丝酵母(Starmerella apicola,Candida)FBKL 2.0117酱香酒醅解淀粉芽胞杆菌(Bacillus amyloliquefaciens)FBKL 1.0122酱香大曲地衣芽胞杆菌(Bacillus licheniformis)FBKL 1.0199酱香大曲
注:以上菌种均保藏于贵州省发酵工程与生物制药重点实验室
1.2 试验试剂和仪器
1.2.1 主要试剂
2-辛醇,德国Dr.Ehrenstorfer GmbH;盐酸、硫酸、NaOH,分析纯,重庆川东化工集团有限公司;葡萄糖、NaCl,分析纯,成都金山化学试剂有限公司;次甲基蓝、KH2PO4,分析纯,天津科密欧化学试剂有限公司;麦芽汁肉汤培养基,MRS肉汤培养基,上海博微生物科技有限公司;琼脂粉,北京索莱宝科技有限公司。
1.2.2 主要仪器
FA2004 N电子天平,上海菁海仪器有限公司;ZQP-75G台式全温振荡培养箱,天津市莱玻特瑞仪器设备有限公司;JJ-CJ-1FD洁净工作台,苏州市金净净化设备科技有限公司;YXQ-100A立式压力蒸汽灭菌锅,上海博迅实业有限公司医疗设备厂;E-201-C-9型pH计,上海鸿盖仪器有限公司;Agilent 7890A GC-5975C MSD气相色谱-质谱联用仪、DB-WAX(30 m×250 μm×0.25 μm)毛细管色谱柱,美国Agilent公司;50/30 μm DVB/CAR/PDMS萃取头,美国Supelco公司。
1.3 试验方法
1.3.1 强化曲的制备
按如下流程制备强化曲:
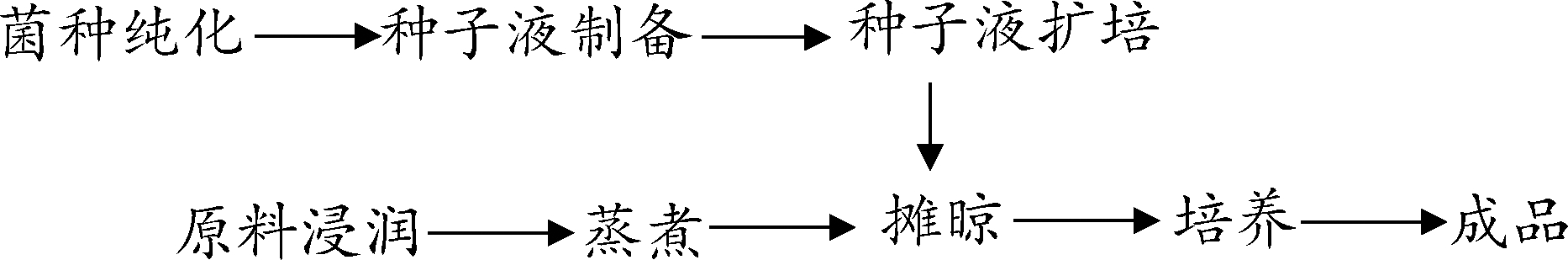
种子液制备:将保藏的功能菌种在麦芽汁琼脂培养基上接种纯化,酵母在30 ℃培养1 d,无菌接种到100 mL无菌麦芽汁培养基,30 ℃ 160 r/min培养24 h,制备种子液;细菌在37 ℃培养2 d,无菌接种到100 mL无菌麦芽汁培养基,37 ℃ 160 r/min培养24 h,制备种子液。
种子液扩培:称取1 kg 麦芽糖,6 L 沸水,将麦芽糖与水按照1∶6(g∶mL)混合,搅拌均匀后,转移至卡氏罐中,于 121 ℃ 下灭菌20 min,冷却至室温,加入10%(体积比),微充氧,培养2~3 d。
强化曲制备:取麸皮0.5 kg,加300 mL自来水,搅拌均匀,灭菌,曲盘灭菌,灭菌麸皮均匀分散在曲盘中,在无菌操作台冷却,接种细菌或酵母种子液大约100 mL,用无菌玻璃棒混合均匀,放入已经杀菌的培养箱,30 ℃培养1 d,打开培养箱门0.5~1 cm排湿,1 d后麸曲干燥,装袋备用。
理化指标测定:麸皮和强化曲的水分、酸度、淀粉含量、氨基酸态氮、酯化力等理化指标均依据 QB/T 4257—2011《酿酒大曲通用分析方法》进行测定;酸性蛋白酶酶活测定方法参考 SB/T 10317—1999《蛋白酶活力测定法》,糖化酶酶活力测定采用DNS法[5],纤维素酶酶活测定参考赵玉萍等[6]的方法,脂肪酶酶活测定方法参考国标GB/T 23535—2009《脂肪酶制剂》。
1.3.2 固态发酵试验
将制备好的强化曲运送至茅台镇某酒厂,在六轮次生产中进行固态发酵试验。分别取摊晾后的酒醅20 kg,按m(强化曲)∶m(普通曲粉)=1∶5的比例添加强化曲和生产用曲,搅拌均匀,装入麻袋中,封口,堆在堆子中上部进行堆积发酵,堆积发酵结束后移入窖池中上层进行窖池发酵。在堆积前、堆积后、开窖后取样测定理化指标、挥发性风味物质。
酒醅的水分、酸度、还原糖依据 T/CBJ 004—2018 《固态发酵酒醅通用分析方法》测定,酒醅氨基酸态氮依据GB 5009.235—2016 《食品中氨基酸态氮的测定》测定。
1.3.3 样品中挥发性风味物质的检测
样品预处理:准确称取5.0 g 待检测样品置于20 mL顶空瓶中,加入5 μL 2-辛醇溶液(0.822 mg/mL),迅速拧紧瓶盖密封。在45 ℃恒温条件下,160 r/min平衡10 min。
气相色谱-质谱检测:样品中挥发性物质采用气质联用仪检测。色谱条件:色谱柱为DB-WAX(30 m×250 μm×0.25 μm)毛细管色谱柱;进样口温度为250 ℃;升温程序:初始温度40 ℃,以1 ℃/min 升到45 ℃,保持2 min,以3 ℃/min 升到84 ℃,保持2 min,以3 ℃/min升到120 ℃,保持3 min,以3 ℃/min 升到200 ℃,以5 ℃/min升到230 ℃,运行时间71.667 min。质谱条件:电离方式为电子电离源,离子源温度230 ℃,电离能量70 eV,质量扫描范围20~350 u。
各色谱峰的质谱图结果经NIST11.L标准物质质谱图进行比对,筛选相似度>80的物质进行定性,各挥发性风味物质成分的相对百分含量使用峰面积归一化计算,按公式(1)计算:
挥发性物质相对含量![]()
(1)
式中:S组分,组分峰面积;m内标,内标物质量;S内标,内标物峰面积;m样品,样品质量。
2 结果与分析
2.1 强化菌产酶特性及其对麸曲理化指标的影响
实验测定5种单菌强化曲的酸性蛋白酶、糖化酶、纤维素酶和脂肪酶活力,结果如表2 所示。5株强化菌均产糖化酶,糖化酶活力在(80.64±0.02)~(120.96±0.03) U/g,差异不显著,这表明5种强化菌产糖化酶的能力相差不大;5种强化菌只有FBKL 1.0199产蛋白酶,活力为(26.88±0.03) U/g,这表明细菌FBKL 1.0199分解蛋白质的能力比另外4种强化菌强;产纤维素酶的强化菌有FBKL 2.0117、FBKL 1.0122、FBKL 1.0199,其中FBKL 1.0199的产纤维素酶能力最强,为(4.53±0.90) U/g,FBKL 2.0117、FBKL 1.0122的纤维素酶活力差异不显著;产脂肪酶的强化菌有FBKL 2.00K8、FBKL 2.0117、FBKL 2.0130,三者酶活力差异不显著,表明3种强化菌的产脂肪酶能力相近。
表2 强化曲水解酶系活力 单位:U/g
Table 2 Activities of hydrolytic enzymes of fortified Daqu

菌粉种类FBKL2.00K8FBKL2.0117FBKL1.0122FBKL2.0130FBKL1.0199酸性蛋白酶0.00±0.00b0.00±0.00b0.00±0.00b0.00±0.00b26.88±0.03a糖化酶95.04±0.01a119.04±0.02a80.64±0.02a120.96±0.03a93.6±0.01a纤维素酶0.00±0.00b1.98±0.21b1.93±0.69b0.00±0.00b4.53±0.90a脂肪酶47.80±0.22a35.60±0.17ab0.00±0.00b48.90±0.15a0.00±0.00b
注:同一指标肩标不同字母表示差异显著(P<0.05)(下同)
对未添加强化菌的麸皮以及5种单菌强化曲的理化指标(水分、酸度、淀粉含量、氨基酸态氮含量、酯化力)测定结果如表3所示。麸皮及5种单菌强化曲的水分含量由大到小依次为:麸皮>FBKL 2.00K8>FBKL 2.0130>FBKL 2.0117>FBKL 1.0122>FBKL 1.0199,其中强化曲FBKL 1.0199的水分含量最低,这可能与其丰富的酶系有关,FBKL 1.0199代谢产生的各种酶需要以水分为介质分解原料中的各种大分子物质,造成强化曲FBKL 1.0199的水分含量最低[7]。有研究表明,酱香大曲中的核心菌群Bacillus能够产生蛋白酶、淀粉酶等物质,与水分呈负相关[8-9]。未添加强化菌的麸皮与5种强化曲的酸度为FBKL 1.0199>FBKL 2.00K8>FBKL 2.0117>FBKL 1.0122>麸皮>FBKL 2.0130,其中强化曲FBKL 2.0130的酸度最低,这可能因为酵母FBKL 2.0130不产蛋白酶,分解蛋白质产氨基酸能力弱,且生长代谢需要消耗大量氨基酸,造成强化曲FBKL 2.0130的酸度最低。未添加强化菌的麸皮与5种强化曲的淀粉含量为:麸皮>FBKL 2.0117>FBKL 2.0130 FBKL 1.0122>FBKL 2.00K8>FBKL 1.0199,5种强化曲的淀粉含量比地方标准 DB 52/T 872 规定偏高,这可能与5种强化曲的糖化酶活力有关,糖化酶活力越高,原料中淀粉利用率越高,强化曲的糖化酶活力低,淀粉含量偏高。有研究表明,霉菌对大曲的糖化力影响较大[10]。
酯化力、氨基酸态氮含量是反映曲粉品质的重要指标。试验制得的5种强化曲酯化力在(52.07±0.27)~(146.73±0.23) U,酯化力反映了曲粉的产香能力;氨基酸态氮含量在(0.66±0.01)~(3.21±0.16) g/kg,这与微生物数量和代谢有着密切的关系。
表3 强化曲的理化指标
Table 3 The physical and chemical indicators of fortified Daqu

菌粉种类麸皮FBKL 2.00K8FBKL 2.0117FBKL 1.0122FBKL 2.0130FBKL 1.0199微生物数量/(CFU·g-1) 0 5.90×1085.70×1085.10×1083.00×1083.60×108 水分含量/%12.70±0.00a11.09±0.09c9.89±0.26d9.20±0.07e10.81±0.12b4.90±0.17f酸度/[mmol·(10 g)-1)]0.24±0.02c1.22±0.09a0.62±0.05b0.55±0.05b0.18±0.00c1.38±0.09a淀粉含量/[g·(100 g)-1]38.35±0.00a21.10±0.01c26.50±0.01b23.76±0.01bc25.92±0.01b17.52±0.02c酯化力/[mg·(50 g·7 d)-1]0.00±0.00b52.07±0.27b146.73±0.23a108.80±0.29ab137.27±0.13a71.00±0.28ab氨基酸态氮/(g·kg-1)0.71±0.03d1.61±0.13c3.21±0.16a2.22±0.06b0.66±0.01d2.15±0.28b
本实验 5 种强化曲由5种强化菌制备而成,因此强化曲的理化指标及酶活力存在差异。水分含量的差异反映了强化菌的生长代谢及产酶特性;酸度、氨基酸态氮含量的差异反映了强化菌的有机酸代谢能力和脂肪、蛋白质的分解能力[11],如强化菌FBKL 1.0199蛋白酶活力高,相对应酸度、氨基酸态氮含量也高。这些差异反映了不同强化菌制备的强化曲品质具有差异性。
2.2 强化曲对酒醅理化指标的影响
如图1-a所示,堆积发酵、入窖发酵期间,空白对照组、添加FBKL 2.0117、FBKL 1.0199强化曲粉的酒醅水分含量逐渐升高,至开窖时分别为53.75%、54.96%,而添加FBKL 2.00K8、FBKL 1.0122、FBKL 2.0130强化曲粉的酒醅水分含量波动较大,至开窖时水分含量分别为51.08%、51.79%、52.50%。添加不同单菌强化曲的酒醅水分含量变化趋势的差异,可能与微生物繁殖代谢产生与消耗水分速率不同有关。
如图1-b所示,随着堆积发酵、入窖发酵的进行,酒醅的酸度逐渐上升,至开窖时达到最大,添加强化曲FBKL 2.00K8、FBKL 2.0117、FBKL 1.0122、FBKL 2.0130、FBKL 1.0199的酒醅的酸度分别为4.0、3.9、4.0、4.0、4.4和4.1 mmol/(10 g),与空白对照组变化趋势一致。
如图1-c所示,在堆积发酵期间,还原糖含量急剧下降,入窖发酵后,还原糖含量逐渐上升,与空白对照变化趋势一致。堆积发酵期间,酵母菌大量繁殖,生长代谢消耗还原糖,还原糖含量下降;入窖发酵后,酵母繁殖速率减慢,还原糖消耗速率减慢,且伴随着淀粉水解生成还原糖,还原糖含量逐渐上升。
如图1-d所示,添加强化曲FBKL 2.00K8、FBKL 2.0117、FBKL 2.0130的酒醅和空白组酒醅中氨基酸态氮含量变化趋势相同,在堆积发酵期间,酵母大量增殖,氨基酸态氮消耗速率大,且蛋白质分解速率慢,含量有所下降;入窖发酵后,厌氧环境中酵母生长受到抑制,氨基酸态氮积累,含量升高;添加FBKL 1.0122、FBKL 1.0199的酒醅中蛋白质分解速率快,氨基酸态氮含量逐渐升高。

a-水分含量;b-酸度;c-还原糖含量;d-氨基酸态氮
图1 不同发酵阶段酒醅理化指标
Fig.1 Physical and chemical indicators of fermented grains at different fermentation periods
注:不同字母表示同组数据在不同时期差异显著,P<0.05
2.3 强化曲对酒醅中挥发性成分的影响
2.3.1 强化曲对酒醅中挥发性成分种类影响
通过测定不同发酵阶段酒醅的挥发性成分含量,可以更好地了解微生物群落变化对酿造的影响。本文以HS-SPME-GC-MS技术,检测堆积发酵前、堆积发酵后、开窖时酒醅中挥发性成分,酒醅中共检测到45种挥发性成分,其中包含12种酯类物质、10种醇类物质、6种醛类物质、5种酸类物质、3种烯烃类物质、2种吡嗪类物质和7种其他类物质。
由图2-a可知,细菌类强化曲在堆积前、堆积后、开窖时挥发性成分种类分别为41种、36种、32种,在堆积前酒醅共有的挥发性成分有19种,空白对照组酒醅中有8种特有成分,为邻异丙基甲苯、苯甲醚、壬醛、2,3,5-三甲基吡嗪、异丁酸、5-甲基呋喃醛、丁二酸二乙酯、萜品烯,添加强化曲FBKL 1.0122的酒醅中有2种特有成分,为庚酸乙酯、1-乙基环己醇,添加强化曲FBKL 1.0199的酒醅中有6种特有成分,为丁酸乙酯、戊酸乙酯、环辛四烯、乙偶姻、乙酸苯乙酯和己酸;堆积后酒醅共有的挥发性成分有20种,空白对照组酒醅中有6种特有成分,为2,3,5-三甲基吡嗪、异丁酸、3-甲硫基丙醇、邻苯二甲醚、丙二醇、乙偶姻,添加强化曲FBKL 1.0122的酒醅中有1种特有成分,为己酸,添加强化曲FBKL 1.0199的酒醅中有4种特有成分,为苯甲醚、1-乙基环己醇、5-甲基呋喃醛、乙酸苯乙酯;开窖时酒醅中共有的挥发性成分有21种,空白对照组酒醅中有3种特有成分,为丁酸乙酯、1-乙基环己醇、3-甲硫基丙醇,添加强化曲FBKL 1.0122的酒醅中有4种特有成分,为辛酸乙酯、己酸、乙酸苯乙酯、N-甲基-2-吡咯甲醛。

a-空白对照与细菌类强化曲挥发性成分种类差异;
b-空白对照与酵母类强化曲挥发性成分解类差异
图2 不同发酵阶段挥发性成分韦恩图
Fig.2 Wayne diagram of volatile components at different
fermentation periods
由图2-b可知,酵母类强化曲在堆积前、堆积后、开窖时挥发性成分种类分别为39种、35种、32种,在堆积前酒醅种共有的挥发性成分有18种,空白对照组酒醅中有3种特有成分,为邻异丙基甲苯、苯甲醚、5-甲基呋喃醛,添加强化曲FBKL 2.00K8的酒醅中有4种特有成分,为2,3,5,6-四甲基吡嗪、己酸、3-甲基哒嗪、3-吡啶甲醇,添加强化曲FBKL 2.0117的酒醅中有3种特有成分,为丁酸乙酯、异丁醇、庚酸乙酯;堆积后酒醅中共有的挥发性成分有15种,空白对照组酒醅中有5种特有成分,为4-异丙基甲苯、乙偶姻、丙二醇、3-甲硫基丙醇、萜品烯,添加强化曲FBKL 2.00K8的酒醅中有2种特有成分,为5-甲基呋喃醛、己酸,添加强化曲FBKL 2.0117的酒醅中有2种特有成分,为邻异丙基甲苯、1-乙基环己醇;开窖时酒醅共有的挥发性成分有20种,空白对照组酒醅中有2种特有成分,为1-乙基环己醇、3-吡啶甲醇,添加强化曲FBKL 2.00K8的酒醅中有1种特有成分,为乙偶姻,添加强化曲FBKL 2.0130的酒醅中有2种特有成分,为环辛四烯、2,3,5,6-四甲基吡嗪。
综上所述,在发酵结束时,空白对照和添加强化曲的实验组酒醅共有挥发性成分种类最多,空白对照和细菌类强化曲、酵母类强化曲共有的挥发性成分分别为21种、20种,添加强化曲FBKL 1.0122、FBKL 2.0130、FBKL 2.00K8的酒醅中的特有成分分别为4、2、1种。
2.3.2 强化曲对酒醅中挥发性成分含量影响

图3 不同发酵阶段酒醅中挥发性成分含量的热图
Fig.3 The heat map of volatile components in fermented
grains at different fermentation periods
通过半定量分析可以发现,在12种酯类物质中,以乙酸乙酯为主,苯乙酸乙酯、棕榈酸乙酯次之。在10种醇类物质中,以苯乙醇、糠醇为主,苯乙醇能够赋予白酒玫瑰花香味[12];糠醇是酱香型白酒焦香和烘焙香的关键来源[13]。在6种酸类物质中,主要为乙酸,其次是丁酸,乙酸可以烘托缓和白酒的主体香味,丁酸能够赋予白酒愉悦的水果香味、增强白酒的窖香[14-15]。
对检测到的微量成分进行热图绘制,并进行聚类分析。由图3可知,堆积发酵前,挥发性成分主要有乙酸乙酯、乙酸异戊酯、戊酸乙酯、正己酸乙酯、辛酸乙酯、乙酸、糠醛、苯乙烯、苯甲醛、丁二醇、丁酸、糠醇;堆积发酵后,乙酸异戊酯、戊酸乙酯、正己酸乙酯、辛酸乙酯含量降低,乙酸、苯乙烯、苯甲醛、丁二醇、丁酸、糠醇含量增加,挥发性成分种类明显增多,这可能与堆积发酵期间微生物大量繁殖,发生或正在进行一系列代谢反应消耗、生成各类风味成分有关;入窖发酵至结束,挥发性成分种类达到最多,主要有乙酸乙酯、丁酸乙酯、异丁醇、乙酸异戊酯、正己酸乙酯、丁二酸二乙酯、苯乙酸乙酯、棕榈酸乙酯、苯乙醇、苄醇、糠醇、乙酸、丙酸、丁酸、糠醛、苯甲醛、2,3,5-三甲基吡嗪、2,3,5,6-四甲基吡嗪。其中,丁酸乙酯、2,3,5-三甲基吡嗪、5-甲基呋喃醛、丁二酸二乙酯在入窖发酵后,含量才逐渐增加;乙酸糠酯在堆积发酵后,含量逐渐减少;乙酸乙酯、异丁醇、正己酸乙酯、苯甲醛、丙酸、丁二醇、丁酸、糠醇、棕榈酸乙酯、苯乙醇、苄醇含量随着发酵的进行逐渐增加,发酵结束时含量最高。
由图3可知,开窖时,添加产乙酸乙酯强化曲FBKL 2.00K8的酒醅中乙酸乙酯含量最高,为9.257 μg/g,相对于空白对照的6.177 μg/g,乙酸乙酯含量增长了49.9%。添加产苯乙醇强化曲FBKL 2.0117、FBKL 2.0130的酒醅中苯乙醇含量和空白对照组相差不大,分别为 2.38、2.583、2.623 μg/g。添加产吡嗪类物质强化曲FBKL 1.0122、FBKL 1.0199的酒醅中2,3,5-三甲基吡嗪含量分别为0.074、0.075 μg/g,相对于空白组的0.067 μg/g,2,3,5-三甲基吡嗪含量分别提升了11.9%、10.4%,研究表明吡嗪类物质由美拉德反应、微生物反应、蛋白质和氨基酸加热分解等途径产生[16],能够赋予白酒甜香、果香以及花香[17]
3 总结
本试验利用3株酵母菌、2株细菌制备单菌强化曲,进行固态发酵实验并运用顶空固相微萃取-气质联用技术对不同发酵阶段酒醅中挥发性成分进行检测分析,共鉴定出45种挥发性成分,主要包括:酯类、醇类、醛类、酸类、吡嗪类。挥发性成分种类差异分析表明,开窖时添加强化曲FBKL 1.0122、FBKL 1.0199的酒醅和空白酒醅共有的挥发性物质有21种,添加强化曲FBKL 2.00K8、FBKL 2.0117、FBKL 2.0130的酒醅和空白酒醅共有的挥发性物质有20种。挥发性成分含量分析表明,添加强化曲 FBKL 2.00K8使酒醅中乙酸乙酯含量提升了49.9%,优于许银等的36.6%[18];添加强化曲FBKL 1.0122、FBKL 11.0199使酒醅中2,3,5-三甲基吡嗪含量分别增长了11.9%、10.4%。
随着“健康中国2030”规划纲要的实施,绿色、健康已经成为未来发展趋势,对于酱香型白酒品质要求也会提高,从大曲、酒醅中筛选功能微生物制备强化曲以提升酱香型白酒酒质具有广阔的应用前景。本试验以菌株FBKL 2.00K8、FBKL 1.0122、FBKL 1.0199制备强化曲,并进行固态发酵实验,结果表明强化曲能够提升酒醅中挥发性成分含量,为酱香型白酒酒质提升提供理论基础。
[1] WANG P,WU Q,JIANG X J,et al.Bacillus licheniformis affects the microbial community and metabolic profile in the spontaneous fermentation of Daqu starter for Chinese liquor making[J].International Journal of Food Microbiology,2017,250:59-67.
[2] 卢君, 张颖,李福荣,等.菌种强化结合工艺优化提高酱香白酒基酒中四甲基吡嗪含量的研究[J].中国酿造,2020,39(10):162-166.
LU J,ZHANG Y,LI F R,et al.Enhancement of tetramethylpyrazine in sauce-flavor Baijiu base liquor by strain strengthening combined with process optimization[J].China Brewing,2020,39(10):162-166.
[3] 崔香香, 白飞荣,于学健,等.谢瓦散囊菌CICC 41584产香特性及在浓香型白酒大曲生产中的应用[J].食品与发酵工业,2019,45(21):60-67.
CUI X X,BAI F R,YU X J,et al.Aroma characteristics of Eurotium chevalieri CICC 41584 and its application in aroma Baijiu Daqu production[J].Food and Fermentation Industries,2019,45(21):60-67.
[4] SU C,ZHANG K Z,CAO X Z,et al.Effects of Saccharomycopsis fibuligera and Saccharomyces cerevisiae inoculation on small fermentation starters in Sichuan-style Xiaoqu liquor[J].Food Research International,2020,137:109425.
[5] 孙淑琴, 邵冬梅.比色法快速测定糖化酶活力新方法[J].河北省科学院学报,1997(2):35-39.
SUN S Q,SHAO D M.The summarize of computer network's technology[J].Journal of the Hebei Academy of Sciences,1997(2):35-39.
[6] 赵玉萍, 杨娟.四种纤维素酶酶活测定方法的比较[J].食品研究与开发,2006,27(3):116-118.
ZHAO Y P,YANG J.Comparison of four cellulase activity measurement methods[J].Food Research and Development,2006,27(3):116-118.
[7] 霍颖玙. 酱香强化麦曲的初步研究[D].贵阳:贵州大学,2019.
HUO Y Y.Preliminary study on Maotai-flavor strengthened Daqu[D].Guiyang:Guizhou University,2019.
[8] 林钰宽, 吴生文,游勇,等.不同培曲工艺对特香型大曲微生物群落结构的影响[J].食品与发酵工业,2022,48(6):1-9.
LIN Y G,WU S W,YOU Y,et al.Effects of different Daqu culture techniques on microbial community structure and physicochemical indices in Texiang Daqu[J].Food and Fermentation Industries,2022,48(6):1-9.
[9] WANG W Y,LIU R L,SHEN Y,et al.The potential correlation between bacterial sporulation and the characteristic flavor of Chinese Maotai liquor[J].Frontiers in Microbiology,2018,9:1435.
[10] 印丽, 邱树毅,曹文涛,等.酱香型白酒核心产区大曲的酶系分析[J].现代食品科技,2021,37(3):89-96.
YIN L,QIU S Y,CAO W T,et al.Analysis of Daqu enzymes from the core production area of Maotai-flavor liquor[J].Modern Food Science and Technology,2021,37(3):89-96.
[11] 胡宝东. 酱香大曲的强化及其特性研究[D].贵阳:贵州大学,2016.
HU B D.The research on strengthening of Maotai-flavor Daqu and its characteristics[D].Guiyang:Guizhou University,2016.
[12] 卢延想, 梁慧珍,陈鹏,等.高温大曲中产香酵母的筛选及特征香气分析[J].食品研究与开发,2021,42(11):167-174.
LU Y X,LIANG H Z,CHEN P,et al.Screening and characteristic aroma analysis of aroma-producing yeasts in high-temperature Daqu[J].Food Research and Development,2021,42(11):167-174.
[13] 王迪. DQ酱香型白酒中微量成分及主体风味的研究[D].邯郸:河北工程大学,2020.
WANG D.Study on minor component and main flavor in Daqu Jiang-flavour Chinese spirits[D].Handan:Hebei University of Engineering,2020.
[14] 刘凡, 仇钰莹,周新虎,等.洋河浓香型白酒酒醅中产酸细菌与有机酸合成的相关性研究[J].食品与发酵工业,2018,44(12):22-29.
LIU F,QIU Y Y,ZHOU X H,et al.The correlation between organic acid producing bacteria and organic acids biosynthesis in fermented grains of Yanghe strong-aroma spirit[J].Food and Fermentation Industries,2018,44(12):22-29.
[15] XIAO Z B,YU D,NIU Y W,et al.Characterization of aroma compounds of Chinese famous liquors by gas chromatography-mass spectrometry and flash GC electronic-nose[J].Journal of Chromatography B,2014,945-946:92-100.
[16] 许佩勤, 方毅斐,庄俊钰,等.白酒中吡嗪、呋喃类化合物的分析方法研究[J].食品与发酵科技,2017,53(2):85-93.
XU P Q,FANG Y F,ZHUANG J Y,et al.Study on the analytical methods of pyrazines and furans in liquor[J].Food and Fermentation Sciences & Technology,2017,53(2):85-93.
[17] 孙啸涛, 王宗元,刘淼,等.涡旋辅助液液微萃取结合GC-MS法检测67种白酒中四甲基吡嗪、4-甲基愈创木酚和4-乙基愈创木酚[J].食品科学,2017,38(18):73-79.
SUN X T,WANG Z Y,LIU M,et al.Determination of tetramethylpyrazine-4-methyl guaiacol and 4-ethyl guaiacol in 67 Chinese Baijiu samples by vortex assisted liquid-liquid microextration combined with gas chromatography-mass spectrometry[J].Food Science,2017,38(18):73-79.
[18] 许银, 杨强,张龙,等.高产乙酸乙酯酵母菌的筛选及其在清香型小曲白酒生产中的应用[J].中国酿造,2021,40(8):76-80.
XU Y,YANG Q,ZHANG L,et al.Screening of high-yield ethyl acetate yeast and its application in the light-flavor Xiaoqu Baijiu production[J].China Brewing,2021,40(8):76-80.