D-泛酸是水溶性的B族复合维生素(B5),作为合成辅酶A和酰基载体蛋白的一种前体发挥作用[1-2]。作为一种重要的生长因子,D-泛酸参与碳水化合物、蛋白质和脂肪酸的代谢[3]。目前,D-泛酸被广泛用于医药、食品、饲料工业等领域[4-5]。
D-泛酸的生产方法主要包括物理诱导结晶法、化学拆分法和生物法。物理诱导结晶法工艺成熟,但只能生产泛酸钙,无法用于其他泛酸衍生物的生产。化学拆分法是目前最主要的合成方法,但拆分剂价格昂贵,分离困难,还存在毒性和环境污染问题[6-7]。通过合理运用微生物或酶来生产D-泛酸,不仅能够保证泛酸的拆分质量而且还能减低反应成本[8],相较化学法,生物法具有更加绿色环保的优点[9]。生物酶法是利用泛酸合成酶催化D-泛解酸和β-丙氨酸进行缩合反应生成D-泛酸,反应条件温和,没有副产物的生成,更有利于产品分离[10-12]。20世纪90年代,就有学者开始研究生物发酵法生产D-泛酸,并取得了一定的成果。但是目前D-泛酸的产量尚未达到工业化生产的要求,主要原因是D-泛酸代谢途径长、分支代谢多,目的产物D-泛酸的积累量不高[13];其次,在D-泛酸合成过程中,需要很多前体物质,对培养基要求和发酵控制比较苛刻[14-16]。
本文以实验室前期构建的E.coli DPA21/pBCST3为D-泛酸生产菌株,在5 L发酵罐水平进行关键发酵参数的优化,主要包括在分批发酵实验中对发酵温度、pH、转速进行优化,以及在补料分批发酵实验中对葡萄糖和β-丙氨酸的流加方式和浓度进行优化,以进一步提高D-泛酸的产量,初步建立高效的发酵调控工艺,为后期的工业化生产提供依据。
1 材料与方法
1.1 菌种
E.coli DPA21/pBCST3,保藏于浙江工业大学生物工程研究所。E.coli DPA21的基因型为DPA17ΔpoxB ΔpflB ΔldhA ΔilvE。
1.2 培养基
种子培养基(LB培养基)(g/L):蛋白胨10、酵母粉5、NaCl 10。
发酵培养基:葡萄糖30 g/L、(NH4)2SO4 16 g/L、KH2PO4 2 g/L、酵母粉2 g/L、金属盐溶液1 mL/L、L-异亮氨酸20 mg/L、MgSO4·7H2O 1.0 g/L、异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactopyranoside,IPTG)0.2 mmol/L、卡那霉素(kanamycin,Kan)50 mg/L、维生素B1 5 mg/L、维生素B12 2 mg/L、β-丙氨酸 3 g/L。
金属盐溶液(g/L):CaCl2 10、FeSO4·7H2O 10、ZnSO4·7H2O 1、CuSO4 0.20、NiCl2·7H2O 0.02。
补料培养基:葡萄糖500 g/L、(NH4)2SO410 g/L、KH2PO414 g/L、酵母粉2 g/L、金属盐溶液1 mL/L、L-异亮氨酸 20 mg/L、MgSO4·7H2O 16 g/L、IPTG 0.2 mmol/L、Kan 50 mg/L、维生素B1 5 mg/L、维生素B12 2 mg/L;根据需要添加质量浓度为30~50 g/L的β-丙氨酸。
1.3 培养方法
1.3.1 种子培养
从培养成熟的平板中挑出单一的菌落,接入到装有50 mL种子培养基(含有50 mg/L Kan)的500 mL三角瓶中,于37 ℃、150 r/min培养14 h。
1.3.2 发酵罐发酵培养
按照15%的接种量将种子液接入5 L发酵罐中进行发酵培养。发酵罐装液量为2 L,培养温度(30±1)℃,通气量为1.5 vvm,流加30%的氨水和30%的磷酸溶液自动控制pH使其维持在(6.8±0.1),初始搅拌转速为400 r/min,后期通过偶联搅拌转速对溶氧(dissolved oxygen,DO)(维持在15%左右)进行调节,直到发酵结束。
流加培养:在分批发酵的基础上,根据实验设定来补加补料培养基。
1.4 分析方法
1.4.1 细胞浓度测定
取适量的发酵液用蒸馏水进行适当的稀释后,用Eppendorf BioPhotometer测量600 nm处的吸光值(OD600),使用发酵液上清液作为对照,根据标准曲线换算成菌体干重(dry cell weight,DCW),按公式(1)计算:
DCW(g/L)=0.393 5×OD600+0.014 8
(1)
1.4.2 葡萄糖含量检测
葡萄糖浓度采用DNS法[17]进行检测。
1.4.3 D-泛酸检测
将发酵液样品在12 000 r/min离心5 min,取1 mL上清液按照一定的比例进行稀释使D-泛酸的含量检测值在仪器的检测范围内;通过无菌滤膜过滤后,D-泛酸的浓度使用HPLC进行检测。
HPLC检测条件:仪器为日本日立(HITACHI)公司Primaide,色谱柱型号为Eclipse XD8-C18(5 μm,4.6 mm×250 mm),柱温30 ℃,检测器为紫外检测器,检测波长210 nm,流动相体积比A(磷酸)∶B(乙腈)∶C(水)=1∶50∶950,流速0.9 mL/min,进样量10 μL。
1.5 数据处理
数据用Excel和Origin 2018软件处理。
2 结果与分析
2.1 5 L发酵罐分批培养条件的优化
2.1.1 不同培养温度对产D-泛酸的影响
温度是影响微生物生长和存活的主要环境因素之一,温度对发酵的影响主要表现在对细胞生长、产物合成、发酵液的物理性质和生物合成方向等方面。为确定最佳发酵温度,在其他条件不变的条件下,分别设置不同的温度(27、30、33 ℃)进行分批发酵实验。
如图1所示,在3种不同的温度下,菌体生长情况在发酵后期无显著差别,葡萄糖在22 h左右消耗完,此时细胞干重开始呈现稳定趋势。但由于D-泛酸的生物合成与菌体生长并不是完全耦合的,在基质消耗完全后仍会利用发酵液中的有机酸(D-泛解酸、α-酮戊二酸和α-酮异戊酸)和氨基酸(β-丙氨酸、L-谷氨酸)等其他物质继续合成D-泛酸,最终产量分别达到5.31、7.30和6.56 g/L。当发酵温度从27 ℃升高至30 ℃时,D-泛酸产量随之增加;随着发酵温度的进一步升高(33 ℃),D-泛酸产量随之下降,原因可能为高温会影响D-泛酸合成途径中一些关键酶的活力。因此,选择30 ℃作为分批发酵的温度。

a-菌体生长;b-D-泛酸生产;c-葡萄糖消耗
图1 不同培养温度下D-泛酸发酵参数
Fig.1 Fermentation parameters of D-pantothenic acid at different temperatures
2.1.2 不同pH对D-泛酸生产的影响
随着菌种对培养基中碳、氮源的利用以及有机酸和氨基酸的积累,培养液的pH会发生一定的变化。pH值主要影响菌体内某些关键酶的活性,从而影响产物的产量。pH对D-泛解酸内酯水解酶活力影响显著[18],而D-泛酸内酯水解酶是泛酸合成中的关键酶,当pH为6.0~7.5时最有利于D-泛酸的合成。因此本实验选择pH为6.2~7.4进行研究。
由图2可知,在pH 6.2~7.4,pH为6.8时的菌体生长和D-泛酸合成量在整个培养过程中均略高于其他pH值时的水平,因此,选择pH 6.8作为发酵pH。

a-菌体生长;b-D-泛酸生产;c-葡萄糖消耗
图2 不同pH条件下D-泛酸发酵参数
Fig.2 Fermentation parameters of D-pantothenic acid at different pH
2.1.3 不同DO对D-泛酸生产的影响
大肠杆菌是兼性厌氧菌,在发酵过程中对氧气的需求比较严格。过低的DO会导致菌体生长代谢受阻;而过量的氧会形成超氧化物O2-和过氧化物基![]() 破坏细胞组分,进而影响微生物生长[19]。为了确定发酵过程中最佳的DO,在其他条件不变的情况下,分别设置DO为5%、15%和25%进行实验,通过偶联发酵罐的搅拌转速来研究DO对D-泛酸发酵的影响。
破坏细胞组分,进而影响微生物生长[19]。为了确定发酵过程中最佳的DO,在其他条件不变的情况下,分别设置DO为5%、15%和25%进行实验,通过偶联发酵罐的搅拌转速来研究DO对D-泛酸发酵的影响。
如图3所示,在发酵的前12 h,菌体生长情况基本一致,而发酵12 h后呈现不同的变化降势,5%、15%和25%条件下的DCW分别为7.08、7.57和7.44 g/L。DO为5%时菌体量较低,这说明搅拌转速过低可能会造成供氧不足,从而影响菌体生长;而过高的转速会产生剪切力,对菌体造成一定损伤,使其过早衰亡或自溶[20]。而18 h后,DO为15%时的D-泛酸产量高于其他2个溶氧条件下的产量,综合考虑菌体生长、D-泛酸产量以及工业生产中能耗的因素,选择15%作为分批发酵的溶氧水平。
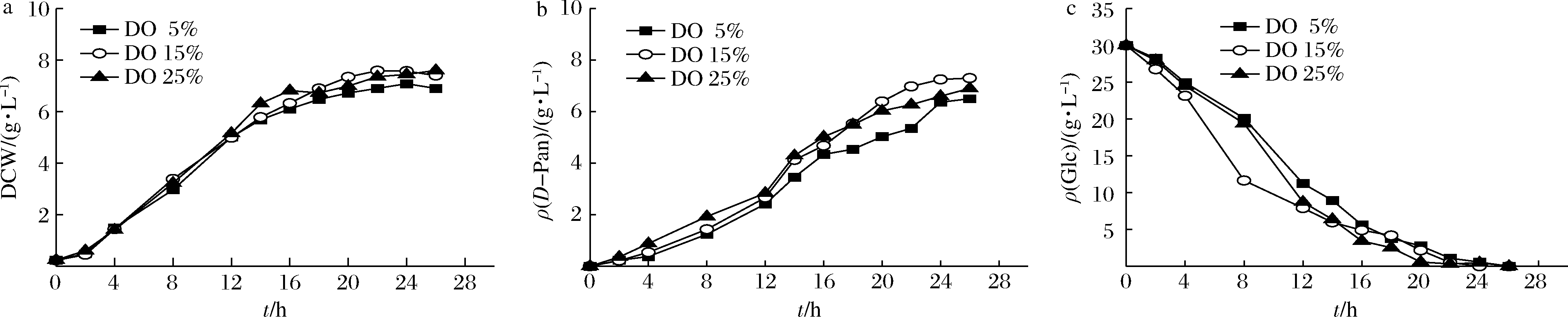
a-菌体生长;b-D-泛酸生产;c-葡萄糖消耗
图3 不同DO条件下D-泛酸发酵参数
Fig.3 Fermentation parameters of D-pantothenic acid at different DO levels
2.2 β-丙氨酸补料方式和浓度对发酵的影响
在发酵参数确定的基础上,对β-丙氨酸的补料方式进行优化。主要分为β-丙氨酸与糖混合流加和β-丙氨酸单独流加2种方式,β-丙氨酸的质量浓度为30、40、50 g/L。
由图4和图5可知,在2种不同的β-丙氨酸补料条件下,D-泛酸的最高产量均在β-丙氨酸质量浓度40 g/L时,混合流加方式下最高产量为40.25 g/L,高于分开流加时的27.38 g/L。比较在同一种β-丙氨酸流加方式不同浓度时,发现在发酵20 h左右,即开始补糖时,D-泛酸的合成速率出现差异,流加质量浓度为50 g/L时,D-泛酸合成速率最高,但快速进入生产稳定期。流加质量浓度为40 g/L时,D-泛酸合成速率先增大后减小,缓慢进入稳定期。当流加质量浓度为30 g/L时,D-泛酸的合成速率较补料前有所下降,但D-泛酸产量一直处于缓慢增长状态。说明β-丙氨酸的流加浓度对D-泛酸的合成有显著的影响。原因可能为在20 h左右菌体内合成D-泛酸的相关酶活力较高,能够将较高浓度的β-丙氨酸转化合成D-泛酸。在35 h左右,菌体的活力开始下降,不能够迅速地将β-丙氨酸进行转化,此时,β-丙氨酸消耗速率小于补给速率,使胞外β-丙氨酸大量积累,从而抑制D-泛酸的合成。
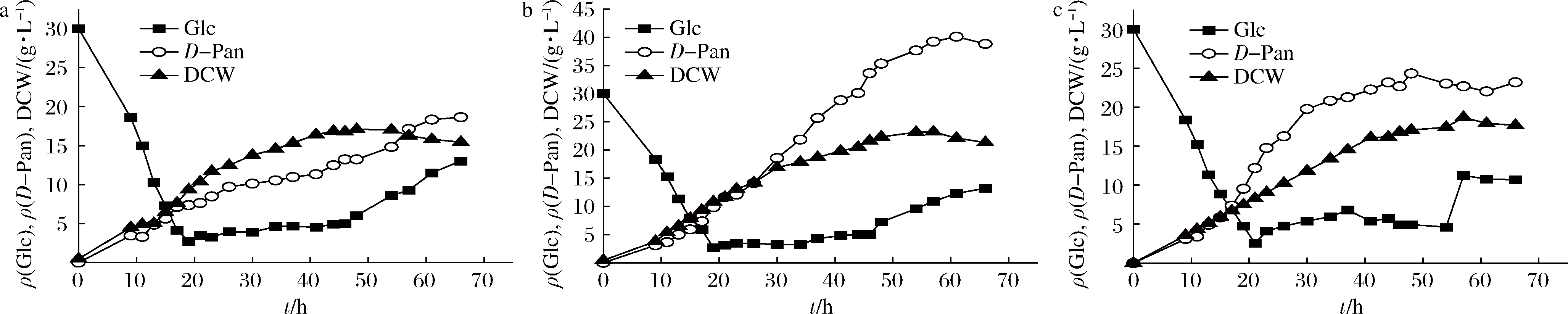
a-30 g/L;b-40 g/L;c-50 g/L
图4 混合流加方式下β-丙氨酸的浓度优化
Fig.4 Optimization of β-alanine concentration in mixed feeding mode
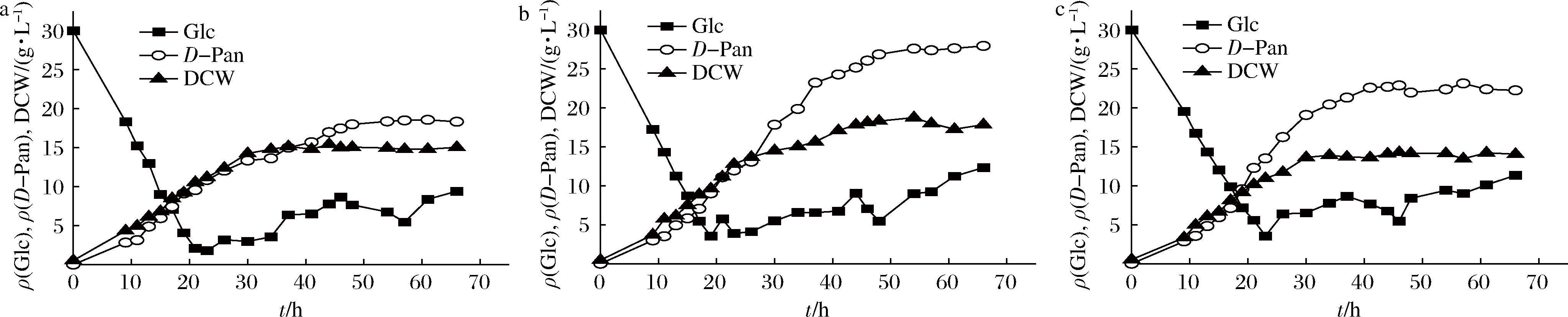
a-30 g/L;B-40 g/L;C-50 g/L
图5 单独流加方式下β-丙氨酸的浓度优化
Fig.5 Optimization of β-alanine concentration under separate feeding mode
2.3 葡萄糖补料方式优化
在β-丙氨酸的补料工艺确定的基础上,对补糖工艺进行优化。葡萄糖作为一种重要的发酵底物,对微生物生长和代谢至关重要。从前期的分批发酵实验中发现,在D-泛酸分批发酵结束时,菌体生长和D-泛酸合成都没有出现快速的下降。因此在葡萄糖耗尽之前如果及时补充葡萄糖,将可以提高产物转化率。目前,葡萄糖的流加方式有很多种,本实验结合D-泛酸合成的特性,采用2种补料方式,即脉冲补料和匀速补料进行D-泛酸的发酵。理论上较低的葡萄糖浓度更有利于发酵[21],根据前期的预实验和ZHANG等[16]的研究,发现糖质量浓度维持在5 g/L左右时有利于D-泛酸的积累。所以当残余葡萄糖质量浓度下降到5 g/L或以下时开始进行葡萄糖流加。
2.3.1 不同脉冲浓度对D-泛酸发酵的影响
由图6可知,在3种不同脉冲(5~10、5~20、5~30 g/L)条件下,DCW变化趋势相似。在发酵后期,当脉冲质量浓度为5~30 g/L时,D-泛酸的合成早于其他2种条件下达到平衡,但产量较低;而脉冲质量浓度为5~10 g/L时,D-泛酸的产量明显高于其他2种条件下的水平,达到41.5 g/L,表明低浓度的葡萄糖更有利于D-泛酸的合成。

a-5~10 g/L;b-5~20 g/L;c-5~30 g/L
图6 不同脉冲糖浓度对D-泛酸发酵的影响
Fig.6 Effects of different pulsed glucose concentrations on D-pantothenic acid production
2.3.2 不同恒速补糖对D-泛酸发酵的影响
分别以2.0、2.5和3.0 g/(L·h)进行匀速补糖。由图7-a可知,当补糖速率为2.0 g/(L·h)时,发酵过程中出现较长时间的低糖(<5 g/L)阶段,菌体生长较缓慢。而当补糖速率为2.5 g/(L·h)时(图7-b),糖质量浓度可以很好地控制在5~10 g/L,菌体生长速率也相对更快,最终D-泛酸产量达到32.33 g/L。而当补糖速率为3.5 g/(L·h)时(图7-c),发酵后期由于补糖速率超过菌体耗糖速率,发酵液中糖浓度过高而导致菌体生长和D-泛酸受到影响。总体而言,在匀速补料条件下,D-泛酸的最高产量(32.33 g/L)明显低于间歇性补料(5~10 g/L)的最高产量(41.5 g/L)。因此,最佳的葡萄糖流加方式为脉冲补料,质量浓度为5~10 g/L。
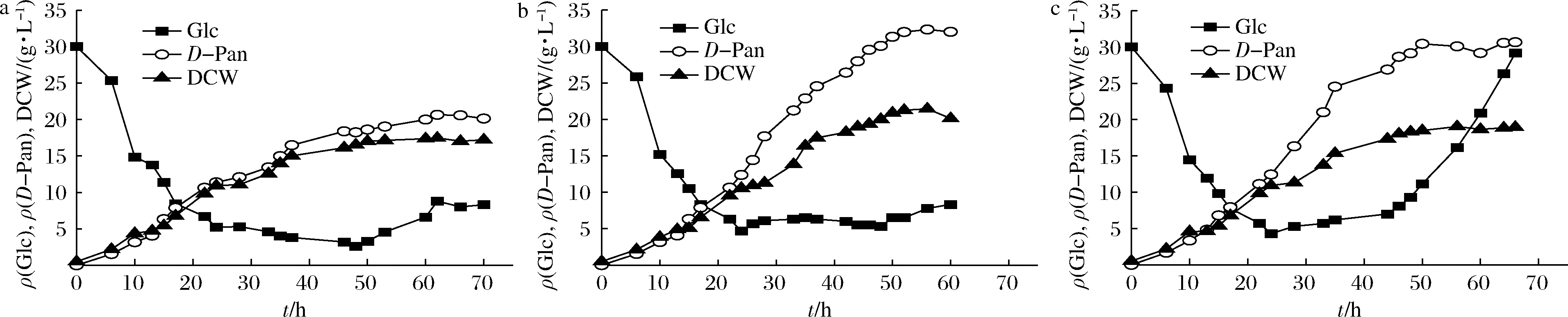
a-2.0 g/(L·h);b-2.5 g/(L·h);c-3.0 g/(L·h)
图7 不同匀速补糖对D-泛酸发酵的影响
Fig.7 Effects of different rates of glucose supplementation on D-pantothenic acid production
3 结论
通过对D-泛酸发酵培养条件进行考察,确定5 L发酵罐的最佳培养条件为温度30 ℃、pH 6.8、DO 15%,确定了最佳的β-丙氨酸流加方式,即与葡萄糖溶液混合流加,且β-丙氨酸质量浓度最佳为40 g/L。在此基础上,通过比较脉冲补料和匀速补料方式确定葡萄糖以5~10 g/L的质量浓度进行脉冲式补料对于提高D-泛酸的产量效果更好,D-泛酸的最高产量达到41.5 g/L。后续需进一步缩短反应时间,简化发酵操作流程来提高产量以达到工业化生产标准。
[1] WEBB M E,SMITH A G,ABELL C.Biosynthesis of pantothenate[J].Natural Product Reports,2004,21(6):695-721.
[2] 杨延辉, 肖春玲.泛酸的功能和生物合成[J].生命的化学,2008,28(4):448-452.
YANG Y H,XIAO C L.The functions and biosynthesis of pantothenate[J].Chemistry of Life,2008,28(4):448-452.
[3] 李明中.D-泛酸钙的应用与合成[J].四川化工与腐蚀控制,1999(2):56-58.
LI M Z.Application and synthesis of calcium D-pantothenate[J].Sichuan Chemical Industry and Corrosion Control,1999(2):56-58.
[4] 孙志浩, 华蕾.生物技术法制备D-泛酸钙和D-泛醇[J].精细与专用化学品,2004,12(10):11-15.
SUN Z H,HUA L.Progress on production of D-calcium pantothenate and D-panthenol by biotechnology[J].Fine and Specialty Chemicals,2004,12(10):11-15.
[5] YAO C X,CHOU J D,WANG T,et al.Pantothenic acid,vitamin C,and biotin play important roles in the growth of Lactobacillus helveticus[J].Frontiers in Microbiology,2018,9:1 194.
[6] EVANS D A,WU J,MASSE C E,et al.A general method for the enantioselective synthesis of pantolactone derivatives[J].Organic Letters,2002,4(20):3 379-3 382.
[7] HEIDLINDEMANN M,HAMMEL M,SCHEFFLER U,et al.Chemoenzymatic synthesis of vitamin B5-intermediate(R)-pantolactone via combined asymmetric organo-and biocatalysis[J].The Journal of Organic Chemistry,2015,80(7):3 387-3 396.
[8] 李伟. 生物催化技术在精细化工中的应用[J].化工设计通讯,2018,44(6):145.
LI W.Application of biocatalysis technology in fine chemical industry[J].Chemical Engineering Design Communications,2018,44(6):145.
[9] 杜明山. 绿色水产饲料添加剂开发现状及前景展望[J].安阳大学学报,2003,2(2):130-132.
DU M S.The present developing situation of green aquatic fodder additives and the future prospect[J].Journal of Anyang University,2003,2(2):130-132.
[10] HIKICHI Y,MORIYA T,MIKI H,et al.Production of D-pantoic acid and D-pantothenic acid:US5518906[P].1996-05-21.
[11] MIYATAKE K,NAKANO Y,KITAOKA S.Pantothenate synthetase of Escherichia coli B I.physicochemical properties[J].The Journal of Biochemistry,1976,79(3):673-678.
[12] MIKI H,YAMAGUCHI T,HIKICHI Y,et al.Production method of D-pantothenic acid and plasmids and microorganisms thereof:Japan,EP19910311927[P].1993-04-14.
[13] RIEPING M,THIERBACH G,PFEFFERLE W,et al.Method for the fermentative production of D-pantothenic acid using strains of the family Enterobacteriaceae:US6184006[P].2001-02-06.
[14] CHASSAGNOLE C,DIANO A,LÉTISSE F,et al.Metabolic network analysis during fed-batch cultivation of Corynebacterium glutamicum for pantothenic acid production:First quantitative data and analysis of by-product formation[J].Journal of Biotechnology,2003,104(1-3):261-272.
[15] SAHM H,EGGELING L.D-pantothenate synthesis in Corynebacterium glutamicum and use of panBC and genes encoding L-valine synthesis for D-pantothenate overproduction[J].Applied and Environmental Microbiology,1999,65(5):1 973-1 979.
[16] ZHANG B,ZHANG X M,WANG W,et al.Metabolic engineering of Escherichia coli for D-pantothenic acid production[J].Food Chemistry,2019,294:267-275.
[17] 于鲁浩, 杨俊慧,孟庆军,等.玉米粉中淀粉含量的快速测定方法[J].山东科学,2012,25(1):19-23.
YU L H,YANG J H,MENG Q J,et al.Fast determination of maize starch content in cornflour[J].Shandong Science,2012,25(1):19-23.
[18] 郑莉莉. D-泛解酸内酯水解酶产生菌的筛选及条件优化的研究[D].济南:山东轻工业学院,2009.
ZHENG L L.Screeming of D-pantolactone hydrolase producing strains and optimizing of technology conditions[D].Jinan:Shandong Polytechnic University,2009.
[19] WANG J Y,RONG H W,ZHANG C S.Evaluation of the impact of dissolved oxygen concentration on biofilm microbial community in sequencing batch biofilm reactor[J].Journal of Bioscience and Bioengineering,2018,125(5):532-542.
[20] 范西强, 陈艳娟,宋敏,等.剪切力对链霉菌谷氨酰胺转胺酶发酵的影响[J].华北农学报,2008,23(S2):126-128.
FAN X Q,CHEN Y J,SONG M,et al.Effects of shear force on microbial transglutaminase fermentation[J].Acta Agriculturae Boreali-Sinica,2008,23(S2):126-128.
[21] 冯志彬, 赵彦宏,王东阳,等.以高浓度葡萄糖为碳源的L-苏氨酸发酵工艺研究[J].中国酿造,2008,27(22):94-96.
FENG Z B,ZHAO Y H,WANG D Y,et al.Study on L-threonine fermentation under high glucose concentration[J].China Brewing,2008,27(22):94-96.