普鲁兰酶(EC 3.2.1.41)属于α-淀粉酶家族,是一种常在工业上使用的淀粉酶,它可以特异性的水解支链淀粉、糊精、普鲁兰糖等的α-1,6糖苷键[1],以达到脱支的作用。依据普鲁兰酶水解糖苷键原理的不同和生成产物的差异,其主要分为 I 型普鲁兰酶和 II 型普鲁兰酶[2]。I 型普鲁兰酶负责水解α-1,6 糖苷键,产物是麦芽三糖和一些线性寡糖;II 型普鲁兰酶,是一种双功能酶,它不仅可以水解 α-1,6 糖苷键,还能够随机水解淀粉直链上的 α-1,4 糖苷键,生成还原性末端[3]。因此在糖化过程中,普鲁兰酶常与其他淀粉酶如糖化酶、α-淀粉酶、β-淀粉酶或环糊精葡萄糖基转移酶复配来快速分解淀粉。此外,普鲁兰酶也被广泛应用于生产果葡糖浆、抗性淀粉、乙醇燃料、啤酒等其他领域[4]。
尽管已有多种生产普鲁兰酶的微生物被发现,但野生型菌的普鲁兰酶产量偏低,难以实现大规模的工业生产。随着基因工程和酶工程的迅速发展,普鲁兰酶最近在多种模式菌株中实现了异源表达,包括大肠杆菌[5]、枯草芽胞杆菌[6]、地衣芽胞杆菌[7]、短小芽胞杆菌[8]、毕赤酵母等[9]。但大肠杆菌和短小芽胞杆菌不是安全菌株,毕赤酵母的诱导表达需要甲醇的添加,会导致食品安全问题,且毕赤酵母的发酵时间较长。根据GB 2760—2014《食品安全国家标准 食品添加剂使用标准》规定,食品级普鲁兰酶生产菌株仅为产气克雷伯氏菌(Klebsiella aerogenes)、枯草芽胞杆菌(Bacillus subtilis)、嗜酸普鲁兰芽胞杆菌(Bacillus acidopullulyticus)、地衣芽胞杆菌(Bacillus licheniformi)和长野解普鲁兰杆菌(Pullulanibacillus naganoensis)。总体来看,提高普鲁兰酶在B.subtilis中的表达对于满足普鲁兰酶工业应用需求具有非常重要的意义。B.subtilis是革兰氏阳性菌种的模式菌株,其作为表达宿主被广泛使用,具有以下诸多优点:(1)属于公认的食品级安全菌株(GRAS认证)[10];(2)无明显的密码子偏好性,表达异源蛋白时具有天然优势[11];(3)分泌能力强,其具有Sec、Tat等4条蛋白分泌途径以及大量鉴定的信号肽,可以有效地分泌蛋白至胞外以及简化后续纯化过程[12];(4)生长速率快,培养、发酵周期短[11];(5)具有透彻的研究背景和丰富的基因改造工具[13]。
本研究中,将融合信号肽AprE[14]的Bacillus deramificans普鲁兰酶基因在B.subtilis WB600中表达。先后通过启动子类型优化、培养基组分单因素和响应面优化,提高了普鲁兰酶的表达水平,并在5 L罐上进行放大培养。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与质粒
菌株B.subtilis WB600-E.coli JM109为实验室保藏;质粒pP43 NMK由实验室保存;质粒pUC57-Pul由上海生工公司合成,其含有B.subtilis内源信号肽AprE和来源于Bacillus deramificans的普鲁兰酶基因(GenBank:KT897705.1),并根据B.subtilis密码子偏好性进行优化。
1.1.2 引物
本文中的引物如表1所示。
表1 本研究所用的引物
Table 1 Primers used in this study

引物名称序列(5′-3′)Pul-FagaggaatgtacacatgagaagtaaaaaattatggataagPul-RtacgccattaagcttattttttaccgtgatctggagaaacPul--plasmid-FcggtaaaaaataagcttaatggcgtaatcatggtcatagcPul-plasmid-RtacttctcatgtgtacattcctctcttacctatClone-Rcgggtttcgccacctctgact223-Faaaaatgggctcgtgttgtataatattctcatagtttgaagtaagagaggaatgtacacatgagaa223-Rgtcaaataaaatttaaattaaaaattctatgattcctcaattaggtggcacaaatgtgaggcattttcg556-Fttatttgaaaggaattatcgtataatatcagaaaggaggtgataaaatgagaagtaaaaaattatgg556-Rcaaccctctatttcgagaggccgtttttttgaccaaaatcccttaacgtgagttttcgttc566-Fcactcttttgagaatatgttatattatcaggtaagagaggaatgtacacatgagaa566-Rtcaaccctctatttcgagaggccgttttttttaggtggcacaaatgtgaggcattttcg6 366-Fttaaaatagactttgcatataatggacttgtaagagaggaatgtacacatgagaa6 366-RcgaaaatgcctcacatttgtgccacctaagactcattaattaacagatttgtattgacalytR-FttgtgccacctaactaaccctacataagtaccttctlytR-RcattcctctcttacaaattactttcattatgagttaaatttclytR-plasmid-FgtaatttgtaagagaggaatgtacacatglytR-plasmid-RcttatgtagggttagttaggtggcacaaatgtgaggcattxylA-FtaagggattttggtcactaaaaaaaatattgaaaaxylA-RaattttttacttctcatgtgtacatttcacctcctttgtgattxylA-plasmid-FtattttttttagtgaccaaaatcccttaacgxylA-plasmid-RaatcacaaaggaggtgaaatgtacacatgagaagtasrfA-FggattttggtcaatcgacaaaaatgtcatgaaagaatsrfA-RgtacatttcacctcctttattgtcatacctcccctaatctttataagcasrfA-plasmid-Ftcatgacatttttgtcgattgaccaaaatcccttaacgtga
1.1.3 试剂
Prime STARDNA聚合酶、DNA Ligation Kit 试剂盒、DNA连接酶(solution I)、琼脂糖,TaKaRa公司(大连);柱回收试剂盒、胶回收试剂盒,Invitrogen;质粒提取试剂盒、氨苄青霉素、卡娜霉素、即用型无缝克隆试剂盒、尿素、硫酸铵、胰蛋白胨、甘油、葡萄糖、果糖、蔗糖、麦芽糖,生工生物工程(上海)股份有限公司;蛋白胨、酵母粉,OXIOD公司;玉米浆,上海源叶生物科技有限公司;SDS-PAGE蛋白电泳试剂盒和标准蛋白,Invitrogen;其他试剂均为国产分析纯。
1.1.4 培养基
LB培养基(g/L):酵母粉5,蛋白胨10,氯化钠10。固体培养基在此基础上添加2%琼脂粉。
TB发酵培养基(g/L):甘油5,蛋白胨12,酵母粉 24,磷酸二氢钾2.31,磷酸氢二钾 16.37。
5 L罐补料培养基(g/L):葡萄糖 500,玉米浆 65,酵母浸膏 35,CaCl2 0.13。
1.2 实验方法
1.2.1 普鲁兰酶基因的合成与表达载体的构建
利用引物Pul-F/R PCR扩增普鲁兰酶基因,引物Pul-F/R-plasmid扩增pP43 NMK质粒骨架,通过无缝克隆试剂盒,将片段融合构建质粒P43-Pul。质粒的提取参考试剂盒说明书。
1.2.2 普鲁兰酶重组质粒的转化与鉴定
将重组质粒转化至E.coli 109感受态细胞中,在含质量浓度100 μg/mL氨苄西林的LB固定培养基中培养。以Pul-F和Clone-R为引物,对转化子进行菌落PCR验证。阳性转化子进行基因测序确认。
1.2.3 B.subtilis转化、培养与表达
将测序正确后的质粒转化到B.subtilis,并在LB固定培养基中培养。将单菌落接种到含有20 mL LB培养基的250 mL摇瓶中,37 ℃、220 r/min培养8 h活化种子液。接着取1 mL种子液转接至装有25 mL TB培养基的250 mL摇瓶内,37 ℃下发酵,定时测量细胞OD600值和普鲁兰酶酶活力。以上培养基添加卡纳霉素(50 μg/mL)。
1.2.4 启动子表达变体的构建
根据文献报道,选用强组成型启动子(PlytR,P223,P556和P566和P6366)[15-17]、诱导型启动子(PxylA)[18]、自诱导型启动子(PsrfA)[15]分别替换原有组成型启动子P43(启动子序列见表2)。P223、P566和P6366均为短启动子,将其直接设计在引物的非同源部分。所用引物对为223-F/223-R、566-F/566-R、6 366-F/6 366-R,PCR产物通过DNA Ligation Kit连接试剂盒,环化后构建启动子变体。剩余启动子通过引物对lytR-F/R、xylA-F/R和srfA-F/R扩增,通过引物对lytR-plasmid-F/R、xylA-plasmid-F/R、srfA-plasmid-F/R扩增质粒载体,并通过一步克隆试剂盒构建启动子变体。重组质粒的提取和鉴定同上述方法。
表2 本研究所选用的启动子
Table 2 The promoters selected in this study

启动子序列(5′-3′)P223ttgaggaatcatagaatttttaatttaaattttatttgacaaaaatgggctcgtgttgtataatattctcatagtttgaaP556aaaaaacggcctctcgaaatagagggttgttatttgaaaggaattatcgtataatatcagP566aaaaaacggcctctcgaaatagagggttgacactcttttgagaatatgttatattatcagP6366gactcattaattaacagatttgtattgacattaaaatagactttgcatataatggacttPlytRctaaccctacataagtaccttcttttgtttcaatgttactgtctggcgatacatcttcaccttgactcttttgactattaaccccgcaacccgaaagaagcaatataaagaacagtaaagcaataaattttttcatttttttcacctcattatattttatcgtcaacctattttatattttaaagaaaaattaagaaacaatgaaacttttttttataaaaaacgactattttaggatttcattcttgtattaaatagagttgtatttattggaaatttaactcataatgaaagtaatttPsrfAatcgacaaaaatgtcatgaaagaatcgttgtaagacgctcttcgcaagggtgtctttttttgcctttttttcggtttttgcgcggtacacatagtcatgtaaagattgtaaattgcattcagcaataaaaaaagattgaacgcagcagtttggtttaaaaatttttatttttctgtaaataatgtttagtggaaatgattgcggcatcccgcaaaaaatattgctgtaaataaactggaatctttcggcatcccgcatgaaacttttcacccatttttcggtgataaaaacatttttttcatttaaactgaacggtagaaagataaaaaatattgaaaacaatgaataaatagccaaaattggtttcttattagggtggggtcttgcggtctttatccgcttatgttaaacgccgcaatgctgactgacggcagcctgctttaatagcggccatctgttttttgattggaagcactgctttttaagtgtagtactttgggctatttcggctgttagttcataagaattaaaagctgatatggataagaaagagaaaatgcgttgcacatgttcactgcttataaagattaggggaggtatgacaatPxylActaaaaaaaatattgaaaatactgacgaggttatataagatgaaaataagttagtttgtttaaacaacaaactaataggtgatgtacttactatatgaaataaaatgcatctgtatttgaatgaatttatttttaagggggaaatcac
1.2.5 优化培养基配方和产酶条件
以TB培养基为基础,选用2种无机氮源(尿素、硫酸铵)、3种有机氮源(胰蛋白胨、玉米浆、酵母膏)替换原有蛋白胨;选用2种单糖碳源(葡萄糖、果糖)、2种双糖碳源(蔗糖、麦芽糖)替代原有甘油;额外添加1 mmol/L金属离子(MgCl2、ZnCl2、CaCl2、FeCl3、AlCl3)考察金属离子的影响。
1.2.6 重组B.subtilis的5 L罐发酵
接种生长在抗性平板上的单菌落至多个含有50 mL LB培养基的300 mL摇瓶中,培养8 h以达到对数期,活化种子液。然后将种子液按照5%的体积比接种至含有2.5 L发酵培养基的5 L发酵罐中。以50%的氨水和30%的磷酸控制pH在7.0。发酵温度控制在37 ℃,搅拌转速与溶氧偶联,设定值为30%(搅拌转速下限300 r/min,上限900 r/min),通气量为1.5 vvm。实时监测残糖值情况,当残糖<5 g/L时(底物耗尽,溶氧开始反弹)进行补料控制,使残糖维持在10 g/L左右。实时监测细胞生长和酶活力,当酶活性数值连续2次下降时,终止发酵。
1.2.7 普鲁兰酶酶活力检测和SDS-PAGE分析
分别取1 mL的底物(1.0%普鲁兰酶溶液)和0.9 mL的0.1 mol/L pH 4.5的醋酸缓冲液于试管中,60 ℃水浴预热10 min左右。加入0.1 mL稀释的酶液样品,振荡混匀,反应10 min,加入2 mL DNS终止反应,沸水浴7 min,冰水中冷却。向上述反应体系中加入10 mL的蒸馏水,混匀,在540 nm下测量其吸光值[19]。
蛋白样品上样量为 5 μL,与4×SDS蛋白上样缓冲液按体积比3∶1混合、煮沸,进行SDS-PAGE凝胶电泳,设置恒压120 V。
2 结果分析
2.1 重组B.subtilis的构建
2.1.1 普鲁兰酶表达质粒的构建
为实现普鲁兰酶在B.subtilis中的胞外表达,根据B.subtilis密码子偏好性合成N-端融合信号肽AprE的普鲁兰酶基因,并克隆至质粒pUC57。再以重组质粒为模板,扩增AprE-普鲁兰酶基因片段。结果如图1-a所示,PCR产物在2 000~3 000 bp间有明显条带,与目的基因的理论大小(2 259 bp)一致。使用引物对Pul-plasmid-F/R扩增pP43 NMK表达质粒骨架。如图1-b所示,PCR产物在7 500 bp处有明显条带,与质粒大小吻合。以上片段通过无缝克隆试剂盒构建重组质粒P43-Pul,导入E.coli JM109中,转化子PCR验证。如图1-c所示,PCR产物与目标条带的理论大小(2 767 bp)一致。转化子测序正确后,获得普鲁兰酶表达质粒P43-Pul。
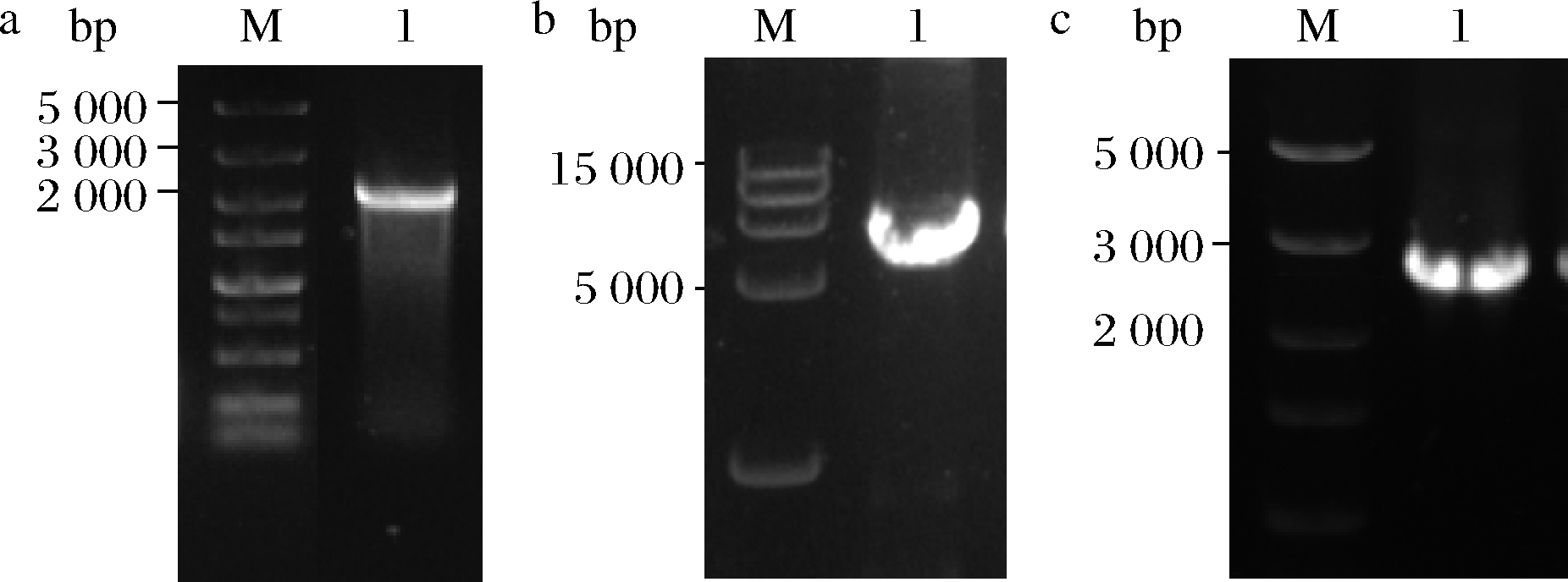
a-合成基因片段PCR扩增;b-pP43 NMK质粒骨架扩增;c-重组菌菌落PCR
a-M-1 kb Marker,1-Pul合成基因扩增片段验证;b-M-15 kb Marker,1-pP43 NMK质粒扩增片段验证;c-转化子菌落PCR验证
图1 普鲁兰酶重组质粒的构建与验证
Fig.1 Construction and verification of pullulanase recombinant plasmid
2.1.2 普鲁兰酶表达质粒在B.subtilis中的表达
将质粒P43-Pul转入B.Subtilis WB600并在含有卡那霉素的固体培养基上生长。将单菌落经LB种子液活化后,接种至TB培养基发酵培养。发酵过程曲线如图2所示,通过测量取样,发酵36 h后普鲁兰酶达到最高酶活力,为29.6 U/mL。

图2 普鲁兰酶在B.subtilis WB600中的发酵过程曲线
Fig.2 Fermentation curve of pullulanase in B.subtilis WB600
发酵结束后,对上清液进行SDS-PAGE,如图3所示。根据氨基酸序列预测该酶的理论分子质量为79 kDa,在约79 kDa处检测出明显条带,说明目的基因成功在B.subtilis中异源表达。

M-蛋白质marker;1-普鲁兰酶发酵12 h的粗酶液;2-普鲁兰酶发酵24 h的粗酶液;3-普鲁兰酶发酵30 h的粗酶液;4-普鲁兰酶发酵36 h的粗酶液;5-普鲁兰酶发酵42 h的粗酶液
图3 重组普鲁兰酶的SDS-PAGE电泳分析图
Fig.3 SDS-PAGE analysis of the recombinant pullulanase
2.1.3 普鲁兰酶启动子的优化
蛋白的表达始于靶基因的有效转录,而转录强度直接受启动子控制[20]。为进一步增强普鲁兰酶表达,选取多种强启动子替换原有启动子P43,包括合成组成型P223[16],P556[16],P566[16]和P6366[17],天然组成型PlytR[15],诱导型PxylA[18]和自诱导型PsrfA[15](表2)。诱导型启动子PxylA在菌体OD600值达到0.4时添加3%的木糖;其他启动子发酵条件同P43一致。摇瓶发酵后,统一在36 h测定普鲁兰酶酶活力。如图4所示,除合成启动子P223和自诱导启动子PsrfA,其他5株启动子替换的重组菌酶活力均有明显提高。在P566启动子下,重组菌的酶活力在36 h达到最高值58.1 U/mL,是优化前的1.96倍(图4)。这说明通过替换强启动子来提高蛋白表达是一种有效的策略。然而,P566启动子是P43启动子强度的500多倍[16],但在普鲁兰酶表达中效果有所下降。一个重要原因是蛋白表达是复杂过程,既取决于酶基因序列及其表达元件(如启动子),也受制于发酵条件。
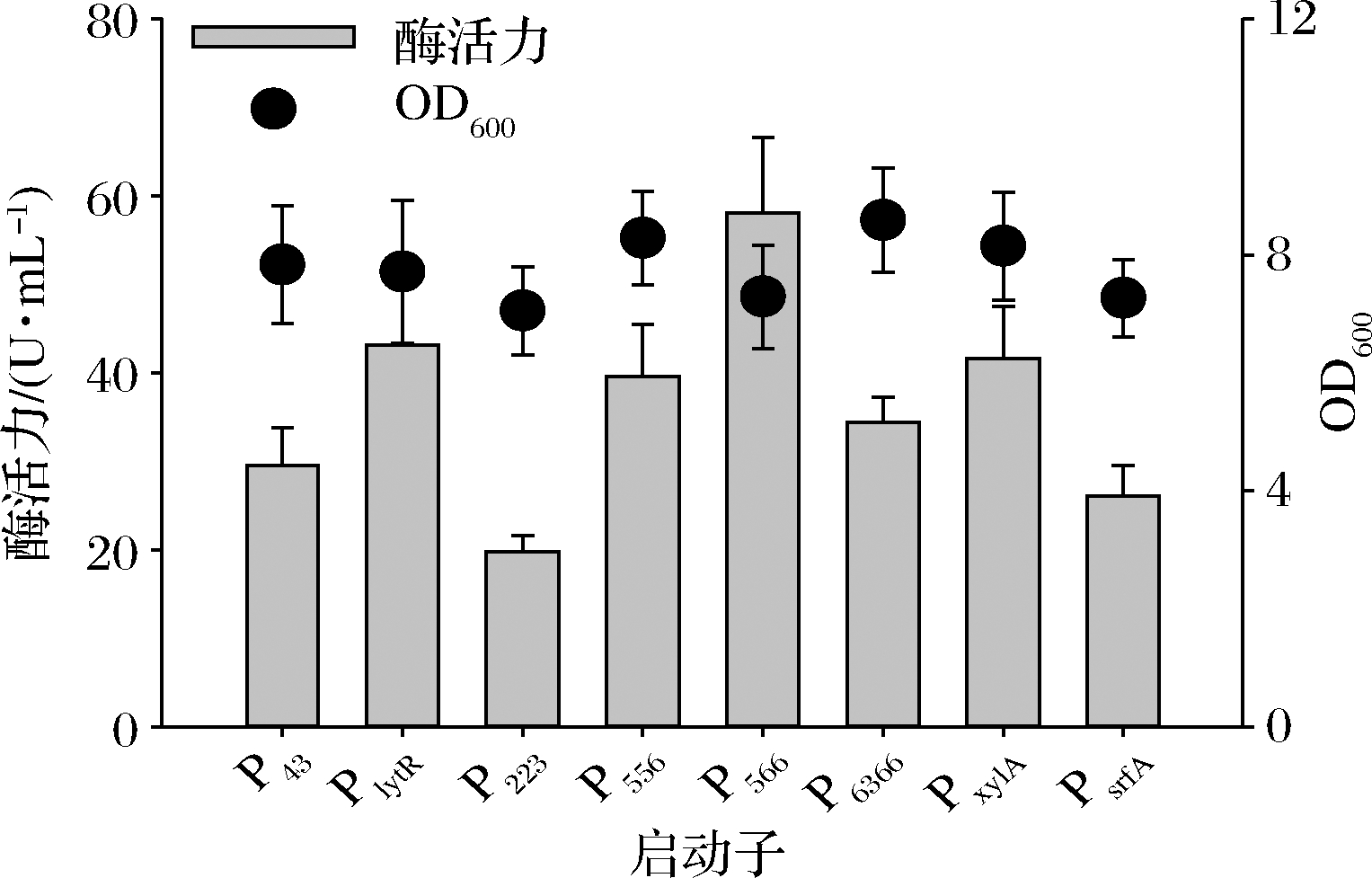
图4 启动子对普鲁兰酶表达的影响
Fig.4 The influence of promoters on the expression of pullulanase
2.2 发酵条件对普鲁兰酶表达的影响
2.2.1 发酵培养基的单因素优化
不同种类的培养基对重组菌的生长与产酶影响较大。本研究首先使用单因素优化,来确定培养基的最佳组分,发酵结果如图5所示。

图5 培养基组分对普鲁兰酶表达的影响
Fig.5 Effect of medium components on the expression of pullulanase
氮源是微生物生长所必须的基础物质[21]。本研究使用了2种无机氮源(尿素和硫酸铵)、3种有机氮源(胰蛋白胨、玉米浆、酵母膏)来考察对于普鲁兰酶生产的影响。如图5所示,以玉米浆为氮源时酶活力最高为66.3 U/mL,其余依此为胰蛋白胨、蛋白胨、酵母膏、硫酸铵、尿素。总体而言,有机氮源更有利于酶的表达。碳源是是蛋白中心骨架构成的重要元素[22]。如图5所示,以葡萄糖为碳源时酶活力最高,为61.2 U/mL。金属离子可以改变细胞膜通透性以促进蛋白分泌[23]。本研究选择了5种金属离子考察对产酶的影响。尽管添加Ca2+时可提高18%的酶活力,但Zn2+、Al3+添加后却导致酶活力大幅下降,说明金属离子并不一定利于普鲁兰酶胞外表达,跟金属离子价位也无明显关系。此外,不同培养基可使酶活力差异达到1.7倍,进一步了证明发酵条件对酶表达的重要性。然而,将各单因素最佳条件直接组合,会陷入局部最优的情况,而非全局最佳的情况。
2.2.2 发酵培养基的响应面优化
根据单因素试验结果,以响应面设计原理,对每个组分质量浓度进行优化并设计了4因素3水平 BBD 实验,因素编码情况见表3,通过Design Expert V8.06设计实验及分析结果(表4),模型评价结果见表5所示。
表3 因素水平编码表
Table 3 Coding table of factors and levels

因素A:玉米浆质量浓度/(g·L-1)B:酵母膏质量浓度/(g·L-1)C:葡萄糖质量浓度/(g·L-1)D:Ca2+/(mmol·L-1)-16122.50.50122451118367.51.5
表4 Box-Behnken设计方案及结果
Table 4 Design and results of Box-Behnken

编号玉米浆/(g·L-1)酵母膏/(g·L-1)葡萄糖/(g·L-1)Ca2+/(mmol ·L-1)酶活力/(U·mL-1)预测值/(U·mL-1)112245186.485.7218242.5168.660.73123650.582.468.5412367.5176.283.75123651.559.456.3618365164.565.5712247.51.5104.195.5812245173.985.7912362.5163.673.81012242.51.567.264.21162451.577.878.012182450.562.670.813121250.579.380.11462450.567.372.91518247.5197.998.21612122.5173.674.31761251103.596.41812127.51122.3120.519182451.552.755.52012245190.685.72112245191.185.7226247.5195.5101.12312242.50.570.072.52412245186.785.72518125176.672.22612247.50.5100.597.427121251.570.482.1286365167.665.9296242.5185.082.5
表5 回归模型方差分析表
Table 5 Variance analysis of experimental results
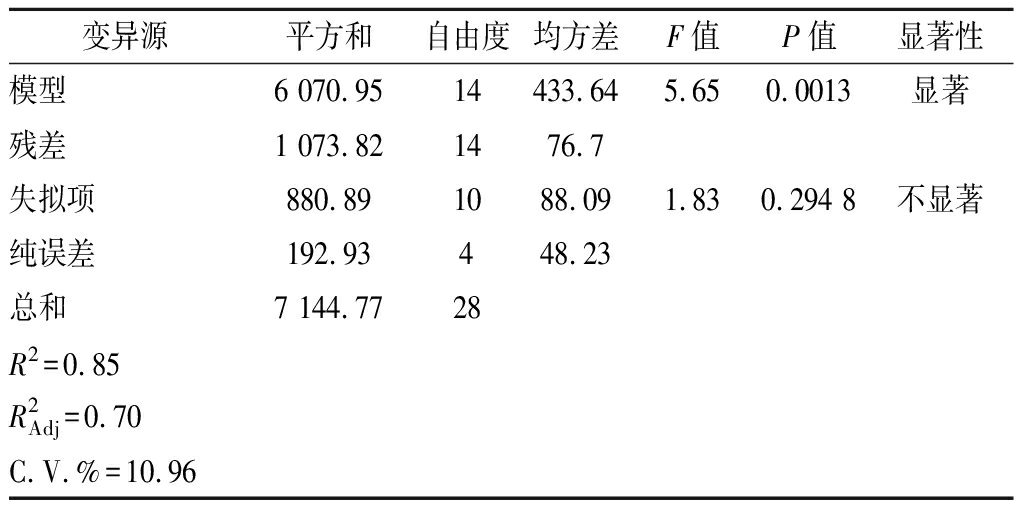
变异源平方和自由度均方差F值P值显著性模型6 070.9514433.645.650.0013显著残差1 073.821476.7失拟项880.891088.091.830.294 8不显著纯误差192.93448.23总和7 144.7728R2=0.85R2Adj=0.70C.V.%=10.96
根据BBD实验设计,建立了酶活力与培养基组分间的回归方程:酶活力=15.70+1.52A+1.71B-2.61C+101.80D+0.08AB+0.31AC-1.70AD-0.30BC-0.59BD+1.29CD-0.18A2-0.03B2+1.04C2-39.40D2。由模型显著性检验表明,P值和失拟项分别为0.001 3(显著)和0.294 8(不显著),说明拟合程度较好。此外,模型R2为0.85,说明能解释约85%总变异,可信度较好。基于此,软件预测培养基的最佳组分为玉米浆14.8 g/L,蛋白胨7.3 g/L,葡萄糖17.5 g/L,Ca2+1.2 mmol/L。在此条件下,发酵36 h后酶活力达到129.4 U/mL,相比培养基优化前提高了4.4倍。与单因素优化相比,基于模型拟合的响应面优化效果更为明显;与全因子组合实验(43)相比,实验方案仅有29组,显著减少了实验工作量。
2.2.3 发酵培养基的5 L罐培养
在5 L罐上进行放大培养,发酵过程如图6所示。接种8 h内,残糖降低17%为14.1 g/L,OD600达到12(为最大值的26%)。表明此时为细胞生长前期,对营养物质需求较少。此后,OD600迅速增加,残糖几乎与OD600完全呈相反态势,快速降低。在24 h左右,OD600首次超过最大值的80%,此后细胞生长明显放缓。恰好此时残糖也首次降低至补料时间点(溶氧开始反弹,残糖为4.65,<5)。由于B.subtilis在营养贫瘠时会形成芽胞以抵御不良情况,并且芽胞形成是不可逆,对于工业生产不利。并且芽胞也是食品保存的一大障碍和安全隐患[24]。可以通过补加葡萄糖来抑制芽胞的形成,但是过量的葡萄糖会导致葡萄糖效应,限制菌体生长和酶蛋白的合成[24]。因此本实验保持葡萄糖质量浓度在10 g/L左右以平衡两者关系。如图5所示,在补料后,酶活力跟细胞生长出现了2次上升的态势。最终在发酵53 h后,酶活力达到最高,为226.4 U/mL。根据发酵过程曲线可知,酶活力与OD600曲线紧密偶联,符合P566组成型启动子的特征[16](图6、图7)。但是酶合成和细胞生长同步,在一定程度上带来细胞代谢压力,影响细胞最终的产酶能力[25]。为进一步提高产酶水平,将对重组菌的发酵进行过程控制,包括分批、分阶段的温度和补料控制策略等。
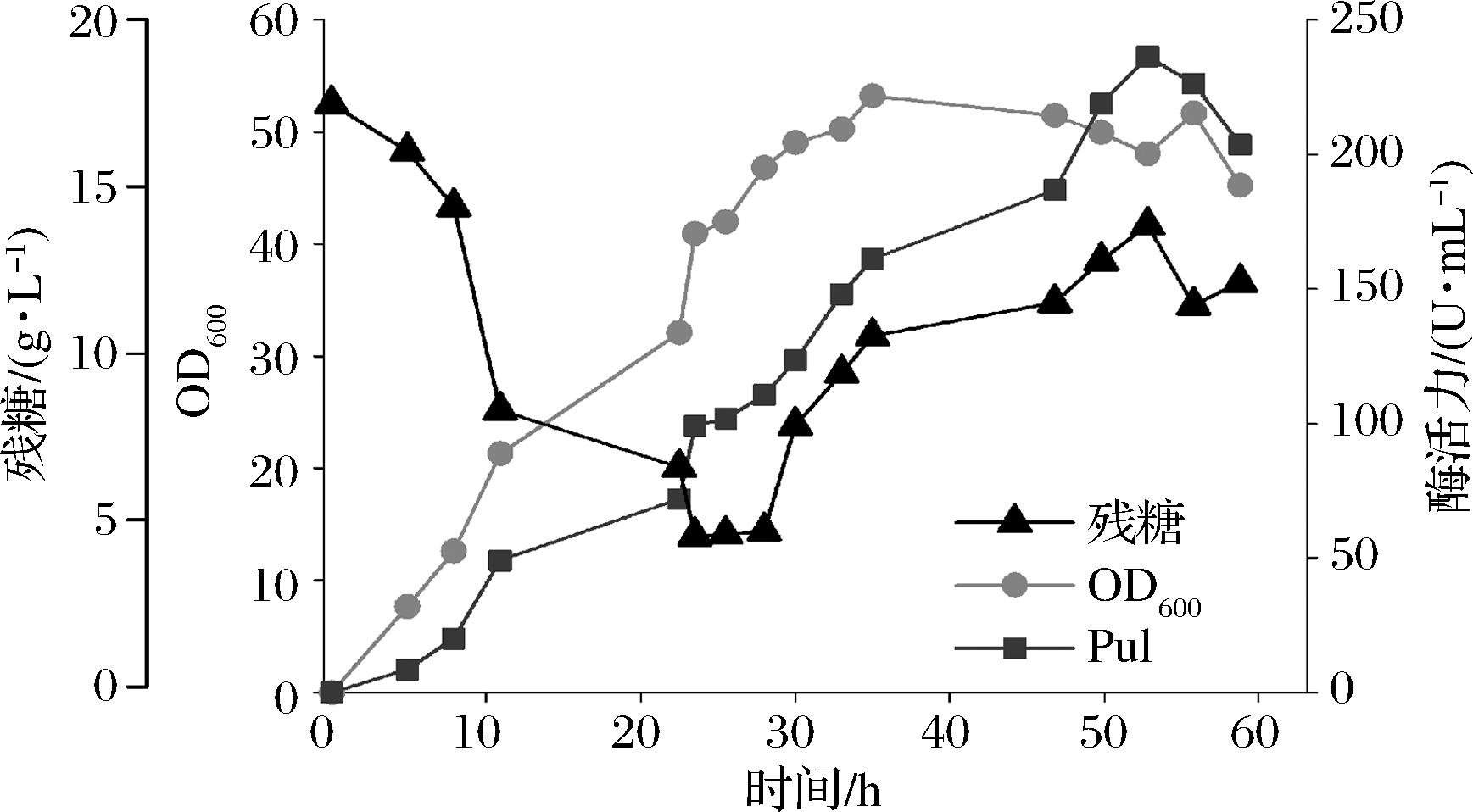
图6 重组普鲁兰酶在5 L发酵罐的发酵过程曲线
Fig.6 The fermentation process curve of pullulanase in 5 L fermenter
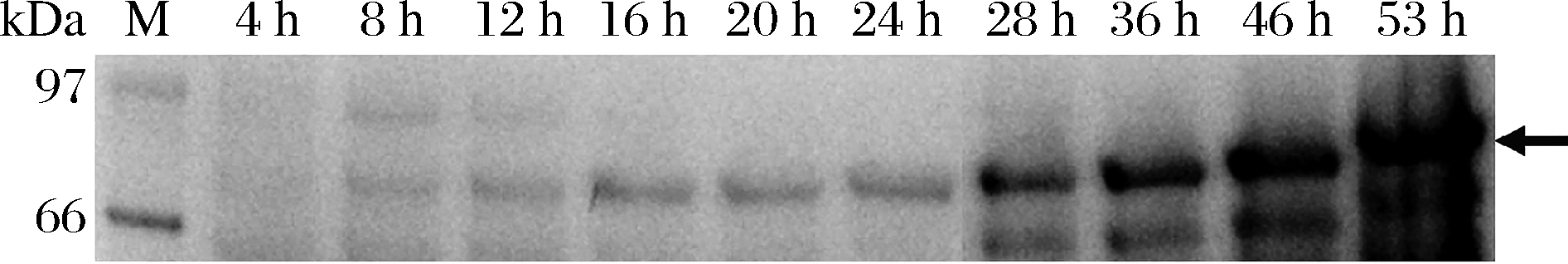
图7 重组普鲁兰酶在5 L罐的SDS-PAGE电泳分析图
Fig.7 SDS-PAGE analysis of the recombinant pullulanase in 5 L fermenter
3 结论
本文成功将来源于Bacillus deramificans的普鲁兰酶基因在B.subtilis中异源表达。通过强启动子替换、培养基组成的单因素和响应面优化策略,使酶活力提高至优化前的4.4倍。最后在5 L罐进行放大培养,通过葡萄糖补料控制,在发酵53 h后达到最高酶活力,是初始优化前的7.7倍。以上说明通过优化基因的内在调控元件和外在发酵环境,可以显著增强B.subtilis目的蛋白的表达,为应用枯草芽胞杆菌生产其他异源蛋白提供了方法学参考。
[1] KOTZIA G A,LABROU N E.Engineering thermal stability of l-asparaginase by in vitro directed evolution[J].The FEBS Journal,2009,276(6):1 750-1 761.
[2] KIM J H,SUNAKO M,ONO H,et al.Characterization of the C-terminal truncated form of amylopullulanase from Lactobacillus plantarum L137[J].Journal of Bioscience and Bioengineering,2009,107(2):124-129.
[3] MATHUPALA S P,PARK J H,ZEIKUS J G,et al.Evidence for α-1,6 and α-1,4-glucosidic bond cleavage in highly branched glycogen by amylopullulanase from Thermoanaerobacter ethanolicus[J].Biotechnology Letters,1994,16(12):1 311-1 316.
[4] 周念波,孙杰,王晶,等.普鲁兰酶在食品工业中的应用[J].食品工程,2008(2):18-20.
ZHOU N B,SUN J,WANG J,et al.Application of pullulanase in food industry[J].Food Engineering,2008(2):18-20.
[5] ZOU C,DUAN X G,WU J.Enhanced extracellular production of recombinant Bacillus deramificans pullulanase in Escherichia coli through induction mode optimization and a glycine feeding strategy[J].Bioresource Technology,2014,172:174-179.
[6] 王越.长野芽胞杆菌普鲁兰酶基因在枯草芽胞杆菌中的整合表达[D].无锡:江南大学,2019.
WANG Y.Integrative expression of Bacillus naganoensis pullulanase from Bacillus subtilis[D].Wuxi:Jiangnan University,2019.
[7] ABDEL-NABY M A,OSMAN M Y,ABDEL-FATTAH A F.Production of pullulanase by free and immobilized cells of Bacillus licheniformis NRC22 in batch and continuous cultures[J].World Journal of Microbiology and Biotechnology,2011,27(12):2 903-2 911.
[8] 邹纯.重组Bacillus deramificans普鲁兰酶的高效胞外表达及其应用[D].无锡:江南大学,2016.
ZOU C.High-efficient extracellular expression of recombinant Bacillus deramificans pullulanase and its appilication[D].Wuxi:Jiangnan University,2016.
[9] 王兵波.一种普鲁兰酶嵌合体及其在毕赤酵母中的高效表达[D].无锡:江南大学,2016.
WANG B B.A pullulanases chimera and its high level expression in Pichia pastoris[D].Wuxi:Jiangnan University,2016.
[10] LIU Y F,LIU L,LI J H,et al.Synthetic biology toolbox and chassis development in Bacillus subtilis[J].Trends in Biotechnology,2019,37(5):548-562.
[11] SCHUMANN W.Production of recombinant proteins in Bacillus subtilis[J].Advances in Applied Microbiology,2007,62:137-189.
[12] HARWOOD CR,CRANENBURGH R.Bacillus protein secretion:An unfolding story[J].Trends In Microbiology,2008,16(2):73-79.
[13] XU K D,TONG Y,LI Y,et al.Rational design of the N-terminal coding sequence for regulating enzyme expression in Bacillus subtilis[J].ACS Synthetic Biology,2021,10(2):265-276.
[14] BELDA E,SEKOWSKA A,LE FèVRE F,et al.An updated metabolic view of the Bacillus subtilis 168 genome[J].Microbiology(Reading,England),2013,159(Pt 4):757-770.
[15] YANG S,DU G C,CHEN J,et al.,Characterization and application of endogenous phase-dependent promoters in Bacillus subtilis[J]. Applied Microbiology and Biotechnology,2017,101(10):4 151-4 161.
[16] LU Z H,YANG S H,YUAN X,et al.CRISPR-assisted multi-dimensional regulation for fine-tuning gene expression in Bacillus subtilis[J].Nucleic Acids Research,2019,47(7):e40.
[17] SAUER C,VER LOREN VAN THEMAAT E,BOENDER L G M,et al.Exploring the nonconserved sequence space of synthetic expression modules in Bacillus subtilis[J].ACS Synthetic Biology,2018,7(7):1 773-1 784.
[18] YAMASHIRO D,YOSHIOKA M,ASHIUCHI M.Bacillus subtilis pgsE(Formerly ywtC)stimulates poly-γ-glutamate production in the presence of zinc[J].Biotechnology and Bioengineering,2011,108(1):226-230.
[19] DUAN X G,WU J.Enhancing the secretion efficiency and thermostability of a Bacillus deramificans pullulanase mutant(D437H/D503Y)by N-terminal domain truncation[J].Applied and Environmental Microbiology,2015,81(6):1 926-1 931.
[20] LIU X Y,GUPTA S T P,BHIMSARIA D,et al.De novo design of programmable inducible promoters[J].Nucleic Acids Research,2019,47(19):10 452-10 463.
[21] 李业英.碳源、氮源及其他条件对VB12发酵影响的研究[D].保定:河北大学,2004.
LI Y Y.Research on effects of carbon and nitrogen resource and other components of medium on VB12 production[D].Baoding:Hebei University,2004.
[22] 缪静,杨在东,冯志彬,等.碳源对γ-聚谷氨酸发酵的影响[J].中国酿造,2010,29(3):70-72.
MIAO J,YANG Z D,FENG Z B,et al.Effect of carbon source on γ-polyglutamic acid production[J].China Brewing,2010,29(3):70-72.
[23] 罗宇笛,李啸,张江,等.金属离子对重组大肠杆菌发酵生产α-环糊精葡萄糖基转移酶的影响[J].天津农业科学,2014,20(12):10-15.
LUO Y D,LI X,ZHANG J,et al.Effects of metal ions on production of α-CGTase by a recombinant e.coli strain[J].Tianjin Agricultural Sciences,2014,20(12):10-15.
[24] FUJITA M,GONZ LEZ-PASTOR J E,LOSICK R,High-and low-threshold genes in the Spo0A regulon of Bacillus subtilis[J].Journal of Bacteriology,2005,187(4):1 357-1 368.
LEZ-PASTOR J E,LOSICK R,High-and low-threshold genes in the Spo0A regulon of Bacillus subtilis[J].Journal of Bacteriology,2005,187(4):1 357-1 368.
[25] ![]()
![]() T H.Fed-batch biomolecule production by Bacillus subtilis:A state of the art review[J].Trends in Biotechnology,2016,34(4):329-345.
T H.Fed-batch biomolecule production by Bacillus subtilis:A state of the art review[J].Trends in Biotechnology,2016,34(4):329-345.