胶原蛋白是哺乳动物中含量最丰富的蛋白质,占人体总蛋白的30%左右,是细胞外基质的重要组分[1-2]。胶原蛋白是由3条肽链相互缠绕构成三股螺旋结构并自组装形成的结构蛋白,是组织的主要蛋白质,包括皮肤、骨骼、韧带、肌腱和软骨等,为生物体增加了热稳定性、弹性和机械强度,起着支撑器官、保护肌体的功能[3]。目前,胶原蛋白的制备主要可分为:化学合成胶原多肽、动植物细胞表达、动物提取[4-5]和微生物表达[6-8]。以化学合成多肽为基底的胶原材料虽然可控性强、纯度高,但其价格昂贵、不适合批量生产;动植物细胞培养难度高、价格高昂、周期长、产量低;目前动物组织提取为制备胶原蛋白的主要途径,然而其容易携带病原体。相比于以上几种制备途径,微生物表达体系具有成本低,周期短和表达量高等明显优势。大肠杆菌(Escherichia coli)作为常用的微生物表达系统之一,因其具有操作简单、发酵周期短等优点,是研究胶原蛋白表达及性质的理想模式宿主。
酿脓链球菌(Streptococcus pyogenes)胶原蛋白是目前研究比较深入的细菌胶原蛋白,其序列中不含羟脯氨酸,无需进行翻译后修饰。BARBARA BRODSKY团队利用大肠杆菌异源表达酿脓链球菌胶原蛋白Scl2,并证明胶原样区域能正确折叠,对成纤维细胞没有毒性,不会引发SJL/J和Arc两种小鼠细胞的免疫反应[9-12]。此外,Scl2具有成为生物材料的潜力,例如通过戊二醛交联的Scl2能够形成稳定的材料,支持细胞附着[9];Scl2通过光交联位点功能化并与聚乙二醇二丙烯酸酯(polyethylene glycol diacrylate,PEGDA)交联形成水凝胶,可以作为控制细胞特异性粘附、增殖和分化的新型生物材料[13]。酿脓链球菌胶原蛋白Scl2的热稳定性约37 ℃,其稳定性主要是通过带电残基之间的静电相互作用[14-15]。高温度(>37 ℃)或者高盐环境会破坏Scl2胶原蛋白的二级结构,限制了其作为生物材料的体外应用。
胶原蛋白单链由连续的Xaa-Yaa-Gly三联体构成,脯氨酸(Pro)通常出现在Xaa位置,羟脯氨酸(Hyp)在Yaa位置[16-17]。Gly的酰胺基团上的氮与相邻链X位的羰基氧能形成链间氢键,提高胶原蛋白的热稳定性,(POG)n和(PPG)n胶原肽具有较高的热稳定性,一直被用作研究胶原三股螺旋内氨基酸相互作用力的模式序列[18-20]。本研究以来源于S.pyogenes的胶原蛋白Scl2的三股螺旋区域B为对象进行序列设计,在B序列不同位置嵌合不同长度的高脯氨酸Pro-Pro-Gly序列,通过对发酵条件的优化提高胶原蛋白的表达量,并研究了高脯氨酸序列Pro-Pro-Gly嵌合的位置和长度对胶原蛋白热稳定的影响,为设计提高重组胶原蛋白的热稳定性,拓展其应用范围提供了策略。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒
本研究中所使用的菌株、质粒如表1所示。
表1 本研究所用的菌株及质粒
Table 1 Strains and plasmids used in this study

菌株和质粒相关特征来源菌株JM109E.coli,wild type,used for gene cloning本实验室BL21(DE3)E.coli,wild type,used for protein expression本实验室质粒pET28aE.coli expression vector,Kanr本实验室pET28a-Sp2BpET28a carrying the Sp2B genes,Kanr本研究pET28a-P10NpET28a carrying the P10N genes,Kanr本研究pET28a-P10CpET28a carrying the P10C genes,Kanr本研究pET28a-P10MpET28a carrying the P10M genes,Kanr本研究pET28a-P5pET28a carrying the P5 genes,Kanr本研究pET28a-P10pET28a carrying the P10genes,Kanr本研究pET28a-P15pET28a carrying the P15genes,Kanr本研究
1.1.2 培养基
LB培养基(g/L):酵母粉5,蛋白胨10,NaCl 10。
LB固体培养基(g/L):酵母粉5,蛋白胨10,NaCl 10,琼脂粉15。
TB培养基(g/L):酵母粉24,蛋白胨12,甘油4,K2HPO4 12.54,KH2PO4 2.31。
1.1.3 仪器
振荡培养箱,上海知楚仪器有限公司;电子天平,Mettler Toledo仪器有限公司;琼脂糖水平电泳仪,美国BIO-RAD公司;AKTATM pure蛋白纯化仪,美国General Electric公司;基质辅助激光飞行时间质谱仪,美国Bruker Daltonics公司;恒温水浴锅,上海东兴建材试验设备有限公司;圆二色谱仪,英国Applied Photophysics公司。
1.2 实验方法
1.2.1 重组菌株的构建
以化脓性链球菌胶原蛋白Scl2的序列为基础(NCBI 序列号:AAL50184),截短其胶原三股螺旋区域序列并在序列中嵌合高脯氨酸含量的胶原序列(Pro-Pro-Gly)n(n为5,10或15),优化(针对大肠杆菌)并合成基因(GENEWIZ,CHN),并添加5′Nco I和5′UTR([GC])和3′BamH I,然后克隆到pET28a载体中。将重组质粒转化到E.coli BL21(DE3)中,用含50 μg/mL的卡那霉素抗性平板筛选阳性转化子,进一步利用Nco I和BamH I对重组质粒进行双酶切验证,得到阳性克隆。
1.2.2 菌种培养方法
种子制备:将验证正确的重组基因工程菌划线至带卡那霉素抗性的LB平板,37 ℃过夜培养,挑取单菌落转接至20 mL LB液体培养基中活化,在37 ℃、200 r/min过夜振荡培养。
摇瓶发酵:按1%接种量将种子接种于带卡那霉素抗性的TB培养基,于37 ℃下培养至诱导菌体浓度后,加入诱导剂,转至诱导温度继续培养,对于所产胶原蛋白热稳定较低的菌株,采用25 ℃诱导,其他菌株均于最优诱导温度下诱导表达。
5 L发酵罐:按1%接种量将种子接种到3 L的TB培养基,于37 ℃培养,菌株生长中后期约3 h左右加入终浓度为1.0 mmol/L的异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactopyranoside,IPTG),35 ℃诱导表达,并间隔时间取样测定菌体浓度和蛋白表达量。
1.2.3 重组胶原蛋白工程菌生长曲线测定
将验证正确的基因工程重组菌株划线至LB平板(含50 μg/mL卡那霉素),然后挑取单菌落于LB液体培养基中(含50 μg/mL卡那霉素),每隔1 h取样测定其菌体浓度,绘制生长曲线。
1.2.4 发酵条件优化
诱导菌体浓度优化:将种子液以1%接种量接入含有卡那霉素(终质量浓度50 μg/mL)的30 mL TB培养基中,37 ℃,200 r/min振荡培养,在OD600约为0.6、1、2.5和4.5时加入IPTG(终浓度1 mmol/L)进行诱导,于25 ℃下诱导培养12 h,测定菌液于600 nm的吸收值(OD600),同时收集1 mL菌体进行基质辅助激光解吸电离飞行时间质谱(matrix-assisted laser desorption/ionization time of flight mass spectrometry,MALDI-TOF-MS)分析胶原蛋白的蛋白表达情况。
诱导温度优化:在最佳诱导时机下,诱导温度分别设置为25、30、35、40 ℃,发酵12 h。取1 mL样品测定OD600及胶原蛋白表达量。
发酵时间优化:在最佳诱导时机和温度的条件下,分别在发酵1、2、4、8、12、24 h时,取1 mL样品测定OD600及胶原蛋白表达量。
诱导剂浓度优化:在最佳诱导时机、温度和诱导时间下,分别以终浓度为0.2、0.4、0.6、0.8、1.0、1.2 mmol/L的IPTG诱导。诱导12 h结束后,取1 mL样品测定OD600及胶原蛋白表达量。
1.2.5 胶原蛋白的制备
发酵后的菌液于8 000 r/min离心5 min收集发酵液中菌体。然后重悬于结合缓冲液A(20 mmol/L Na2HPO4、20 mmol/L NaH2PO4、500 mmol/L NaCl、10 mmol/L咪唑、pH 7.4)中,随后通过超声波破碎仪破碎细胞,12 000 r/min离心20 min后,取上清液过0.22 μm滤膜。然后利用His TrapTM HP 5 mL柱进行亲和纯化,利用结合缓冲液A平衡5个柱体积后,注入样品,继续用结合缓冲液A洗脱杂蛋白。然后用洗脱缓冲液B(20 mmol/L Na2HPO4、20 mmol/L NaH2PO4和500 mmol/L NaCl,1 mol/L咪唑,pH 7.4)梯度洗脱,收集130、160和400 mmol/L咪唑浓度下的洗脱峰,透析脱盐后,利用冷冻干燥机冻干样品用于实验。通过SDS-PAGE分析蛋白纯度及MALDI-TOF-MS鉴定分子质量。
1.2.6 圆二色谱
将冻干的胶原蛋白粉末(1 mg/mL)溶于pH 7.4的10 mmol/L磷酸盐缓冲液中,然后在4 ℃放置24 h以上。全波长扫描在4 ℃下进行,波长范围为190~260 nm,每步间隔1 nm,平均停留时间为5 s。热变实验在220 nm下进行,在4~80 ℃温度范围内升温,升温速率为10 ℃/h,每个温度下平衡8 s。熔融温度(Tm)通过拟合热变曲线的一阶导数求得。
1.2.7 分析方法
菌体浓度(OD600)测定:取菌液稀释适当倍数,利用可见光分光光度计在600 nm下测量其吸收值。SDS-PAGE:取发酵后的菌液,将所有样品OD600稀释为5,取40 μL加入10 μL的5×蛋白上样缓冲液(碧云天,中国),于100 ℃煮沸10 min后,10 000 r/min离心2 min,取10 μL进行SDS-PAGE(12%分离胶,5%浓缩胶)分析,具体操作均参考说明书(BIO-RAD,美国)。胶原蛋白表达量比较:利用凝胶成像仪(BIO-RAD,美国)对SDS-PAGE电泳图进行观察和拍照,利用ImageJ分析计算目的蛋白条带的灰度值,与蛋白标准品(TaKaRa,日本)中条带灰度值比较,计算不同发酵条件下的胶原蛋白表达量。
2 结果与分析
2.1 序列设计
本研究以来源于S.pyogenes的Scl2胶原蛋白序列为基础进行设计,序列包含三聚体球状结构域(V)、截短后的胶原域B和富含脯氨酸的(Pro-Pro-Gly)n序列(图1-a),其中胶原域B是Scl2胶原结构域(CL)中热稳定性最高的一段,命名为Sp2B[11]。为了研究富脯氨酸序列的嵌合位置和长度对胶原蛋白稳定性的影响,分别在胶原域B的N端、C端或中间嵌合(Pro-Pro-Gly)10序列,命名为P10N、P10C和P10M,以及在Sp2B的N和C端同时嵌合(Pro-Pro-Gly)n(n为5,10或15),得到胶原蛋白P5、P10及P15。在所设计序列N端嵌合His标签后连接至载体pET28a,并利用Nco I和BamH I双酶切验证(图1-b,以P10为例)。将构建成功的重组质粒导入E.coli BL21(DE3),得到7株产胶原蛋白的基因工程菌株。

a-富脯氨酸胶原蛋白的设计示意图;b-重组质粒pET28a-P10双酶切验证:泳道1-重组质粒pET28a-P10双酶切结果;M-DNA标准品;c-重组工程菌胶原蛋白表达分析:1-E.coli BL21(DE3)/pET28a菌种全细胞蛋白;2-E.coli BL21(DE3)/pET28a-P10菌株全细胞蛋白;M-蛋白质分子质量标准品
图1 序列设计示意图、重组质粒构建及表达鉴定图
Fig.1 Sequence design diagram,recombinant plasmid construction and expression identification diagram
2.2 重组产胶原蛋白工程菌发酵条件优化
2.2.1 重组产胶原蛋白工程菌的表达测试及生长曲线测定
取重组菌株E.coli BL21(DE3)/pET28a-P10和未嵌合外源胶原蛋白基因的菌株E.coli BL21(DE3)/pET28a(阴性对照)进行表达验证,如图1-c所示,与阴性对照比较,发酵后的E.coli BL21(DE3)/pET28a-P10全细胞经SDS-PAGE分析,在目标分子质量附近出现目的条带,表明基因工程重组菌株E.coli BL21(DE3)/pET28a-P10已成功构建,重组胶原蛋白P10的产量约为30 mg/L。选取重组菌株E.coli BL21(DE3)/pET28a-P10进行生长曲线的测定和发酵优化实验。
细菌的生长过程分4个时期,延滞期、对数期、稳定期和衰亡期。其中对数期是细胞活性最强、比生长速率最大的时期。为确定重组基因工程菌的对数期,取重组菌株E.coli BL21(DE3)/pET28a-P10进行生长曲线的测定。结果如图2所示,基因工程重组菌E.coli BL21(DE3)/pET28a-P10在0~1 h期间处于延滞期,1 h后进入对数期,OD600呈明显的上升趋势,6 h后处于稳定期。10 h后菌体的生长速率开始下降。由此得出活化的菌株应在2~6 h(OD600约为1~5)菌龄时接入TB培养基中,此时菌种生长活力最好。
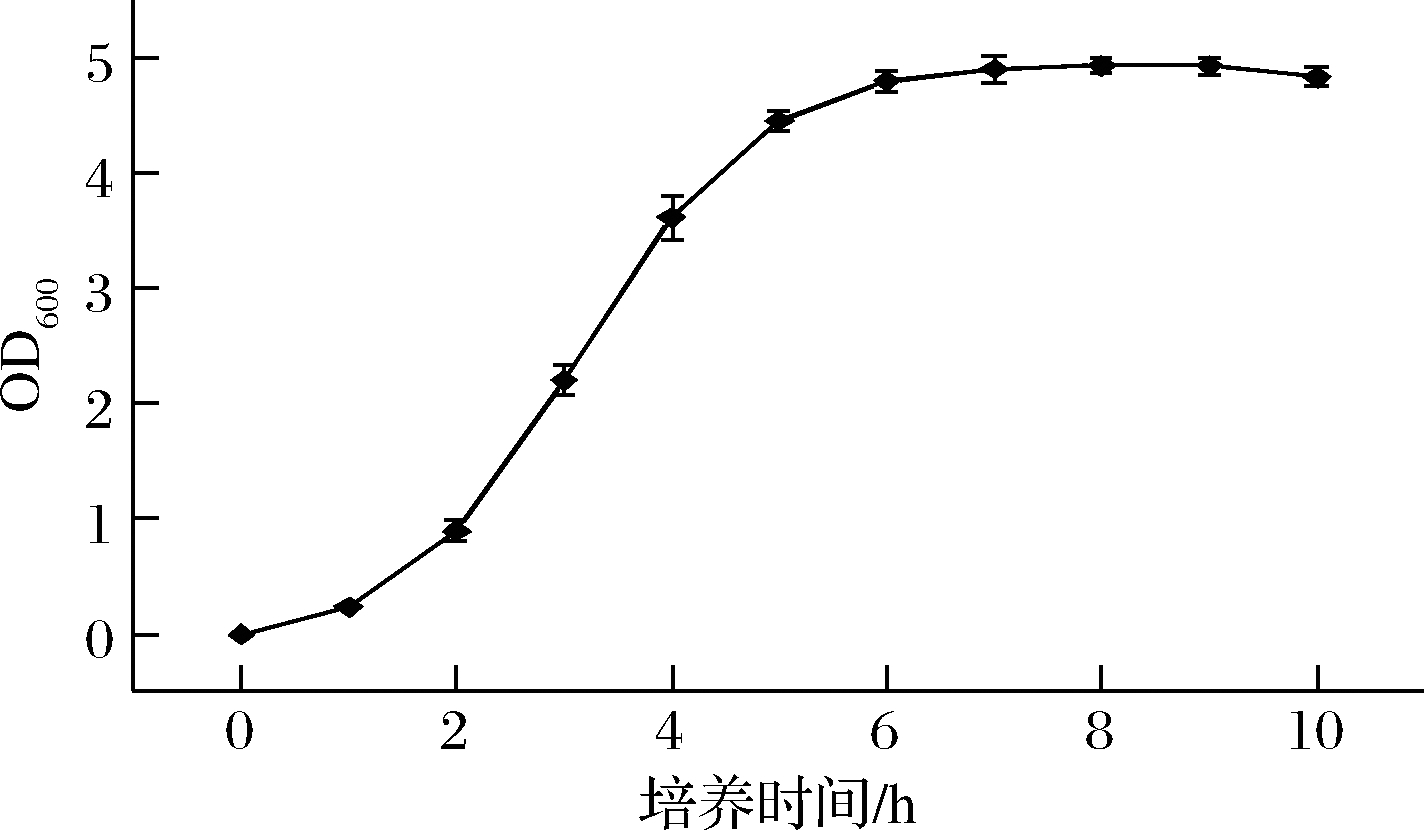
图2 重组菌E.coli BL21(DE3)/pET28a-P10摇瓶种子的生长曲线
Fig.2 Growth curve of recombinant bacteria E.coli BL21(DE3)/pET28a-P10
2.2.2 初始诱导菌体浓度对胶原蛋白产量的影响
以1%接种量接入含有卡那霉素的30 mL TB培养基中,分别在指数生长前期(OD600≈0.6)、中期(OD600≈1.0)、中后期(OD600≈2.5)和后期(OD600≈4.5)时加入1 mmol/L的IPTG,对应的诱导时间为1.5、2、3、5 h,然后转至25 ℃发酵24 h,结果如图3所示。

泳道P10-重组菌株E.coli BL21(DE3)/pET28a-P10表达纯化后的胶原蛋白P10(下同)
a-蛋白表达;b-菌体生长
图3 诱导菌体浓度对蛋白表达和菌体生长的影响
Fig.3 Effect of induction time point on protein expression and cell growth
利用ImageJ对SDS-PAGE中目的条带进行灰度分析,比较同OD600量细胞中胶原蛋白的量,在指数生长前期(1.5 h)、中期(2 h)和中后期(3 h)诱导时,胶原蛋白表达量相当,均为0.13 mg/mL左右,都高于指数生长后期(5 h)的蛋白表达量(0.09 mg/mL)。但在指数生长前期和中期诱导时,最后收集得到的菌体量较少。可能是诱导剂的添加时间过早会影响菌体的生长,而诱导剂添加过晚不利于蛋白的表达。综合考虑,选择在指数生长中后期(3 h),OD600约为2.5左右时诱导。
2.2.3 诱导温度对胶原蛋白产量的影响
为了考察诱导温度对菌体生长和蛋白产量的影响,以1%接种量接入含有卡那霉素的30 mL TB培养基中,在初始OD600值为2.5时加入1 mmol/L的IPTG,分别于25、30、35和40 ℃下诱导24 h。如图4所示,诱导温度对重组菌生长和胶原蛋白表达影响显著,随着培养温度的上升,诱导24 h后的OD600略微降低,但胶原蛋白表达量明显升高,分别为0.04、0.08、0.15、0.14 mg/mL,确定最佳诱导温度为35 ℃。
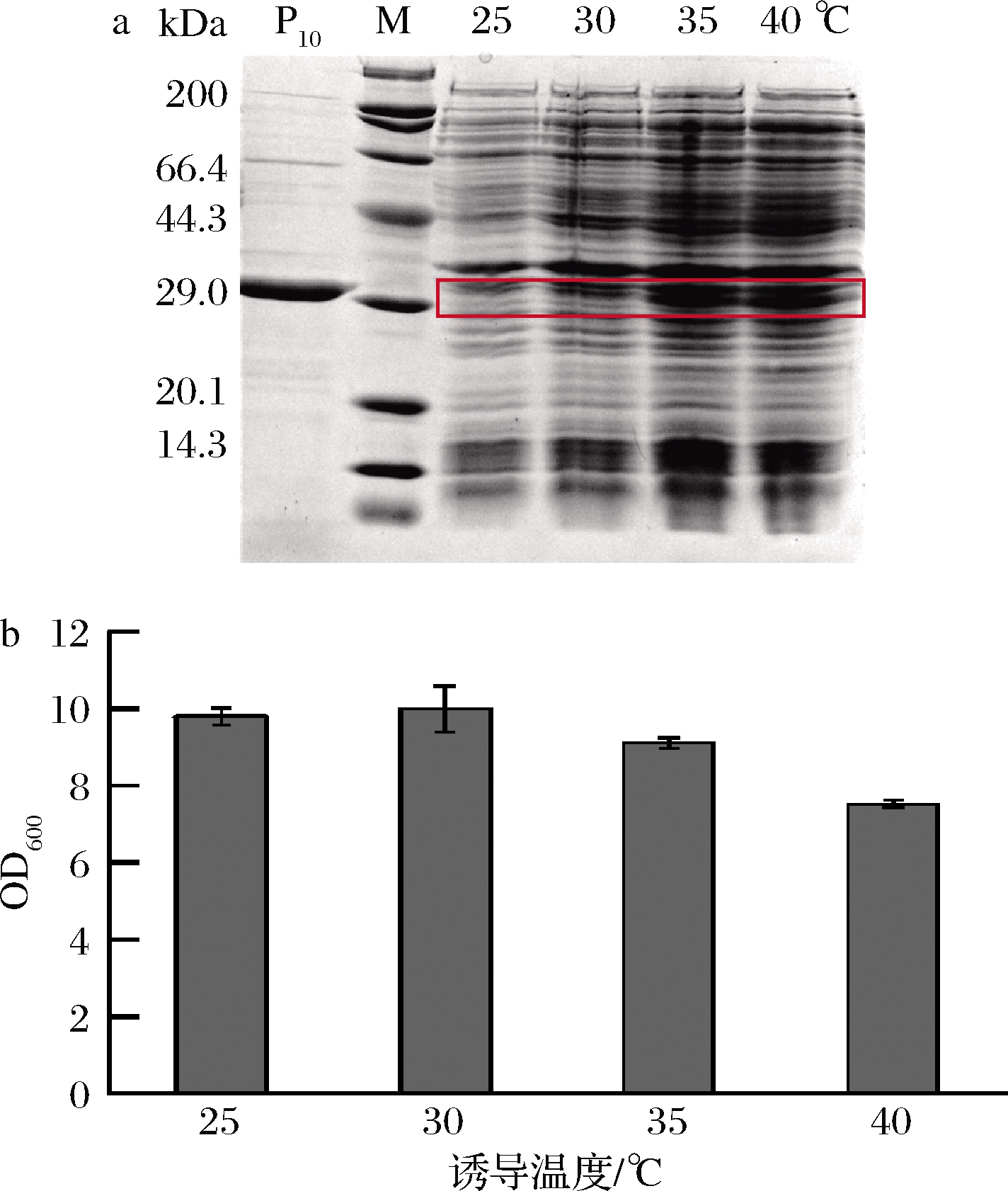
a-蛋白表达;b-菌体生长
图4 诱导温度对蛋白表达和菌体生长的影响
Fig.4 Effect of induction temperature on protein expression and cell growth
2.2.4 发酵时间对胶原蛋白产量的影响
发酵时间的长短能够影响胞内蛋白的富集量。以1%接种量接入含有卡那霉素的30 mL TB培养基中,在初始OD600值为2.5时加入1 mmol/L的IPTG,在发酵1、2、4、8、12、24 h后分别测定菌体生长情况和目的胶原蛋白的表达情况。如图5所示,1~8 h,目的胶原蛋白P10表达量没有明显的提高,从0.03 mg/mL上升到0.06 mg/mL。12 h以后显著提高(0.09 mg/mL),24 h时表达量最高,为0.12 mg/mL。结果表明,此蛋白在重组菌中的表达方式可能为非生长偶联型,即生长到稳定期后再大量表达。考虑到TB培养基内营养有限以及发酵周期的延长,确定诱导后的发酵时间为24 h。
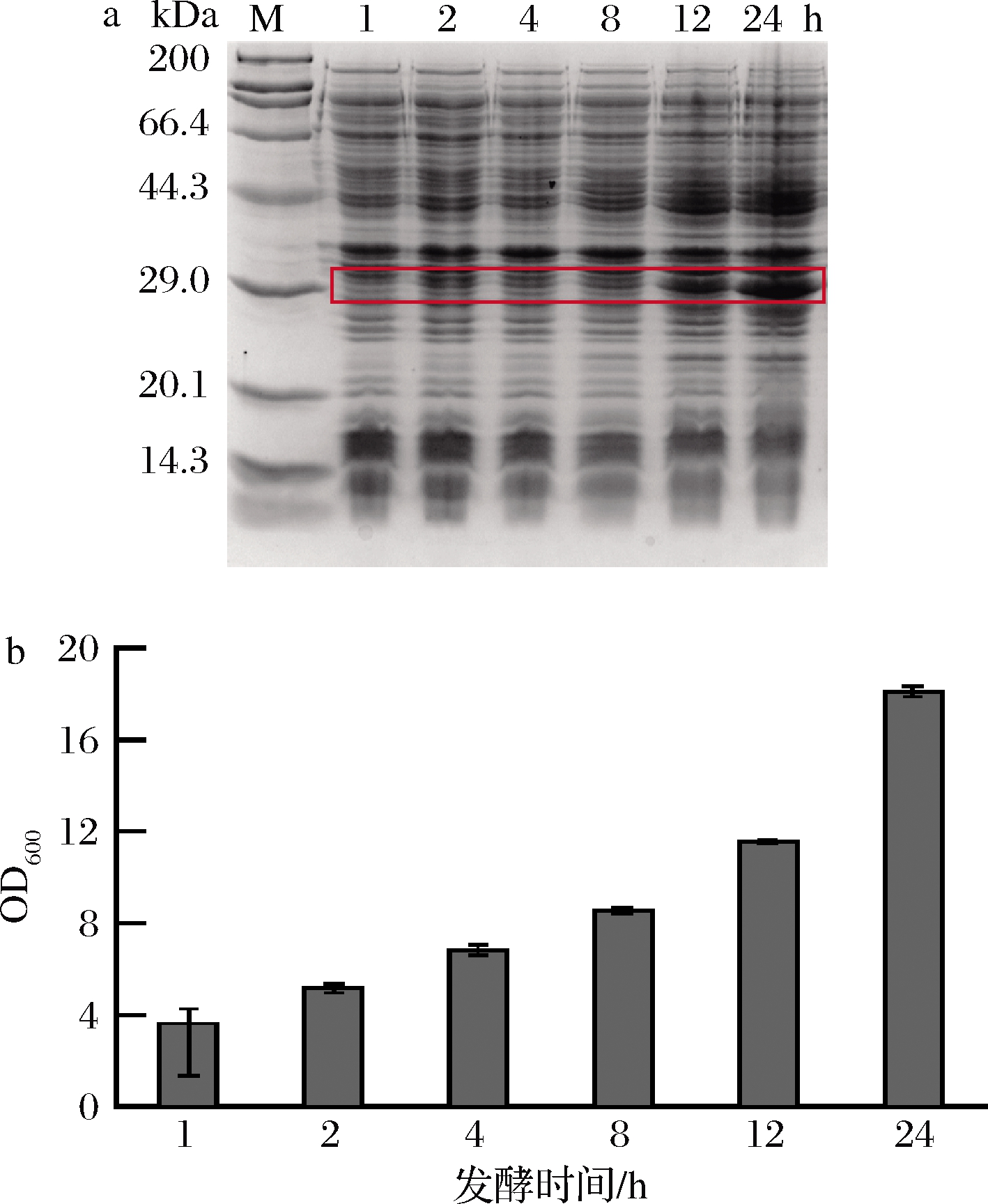
a-蛋白表达;b-菌体生长
图5 诱导时长对蛋白表达和菌体生长的影响
Fig.5 Effect of induction time on protein expression and cell growth
2.2.5 诱导剂浓度对胶原蛋白产量的影响
诱导剂IPTG浓度能够显著影响蛋白的表达水平,在前期研究中,IPTG的浓度为1.0 mmol/L。以1%接种量接入含有卡那霉素的30 mL TB培养基中,在初始OD600值为2.5时,分别加入0.2、0.4、0.6、0.8、1.0、1.2 mmol/L的IPTG,分别于35 ℃下诱导24 h。由图6可知,诱导剂浓度对菌体生长无显著影响,在IPTG终浓度为1.0 mmol/L时,重组胶原蛋白表达效果最好,确定最佳IPTG浓度为1.0 mmol/L,摇瓶优化后的产量约为110 mg/L。
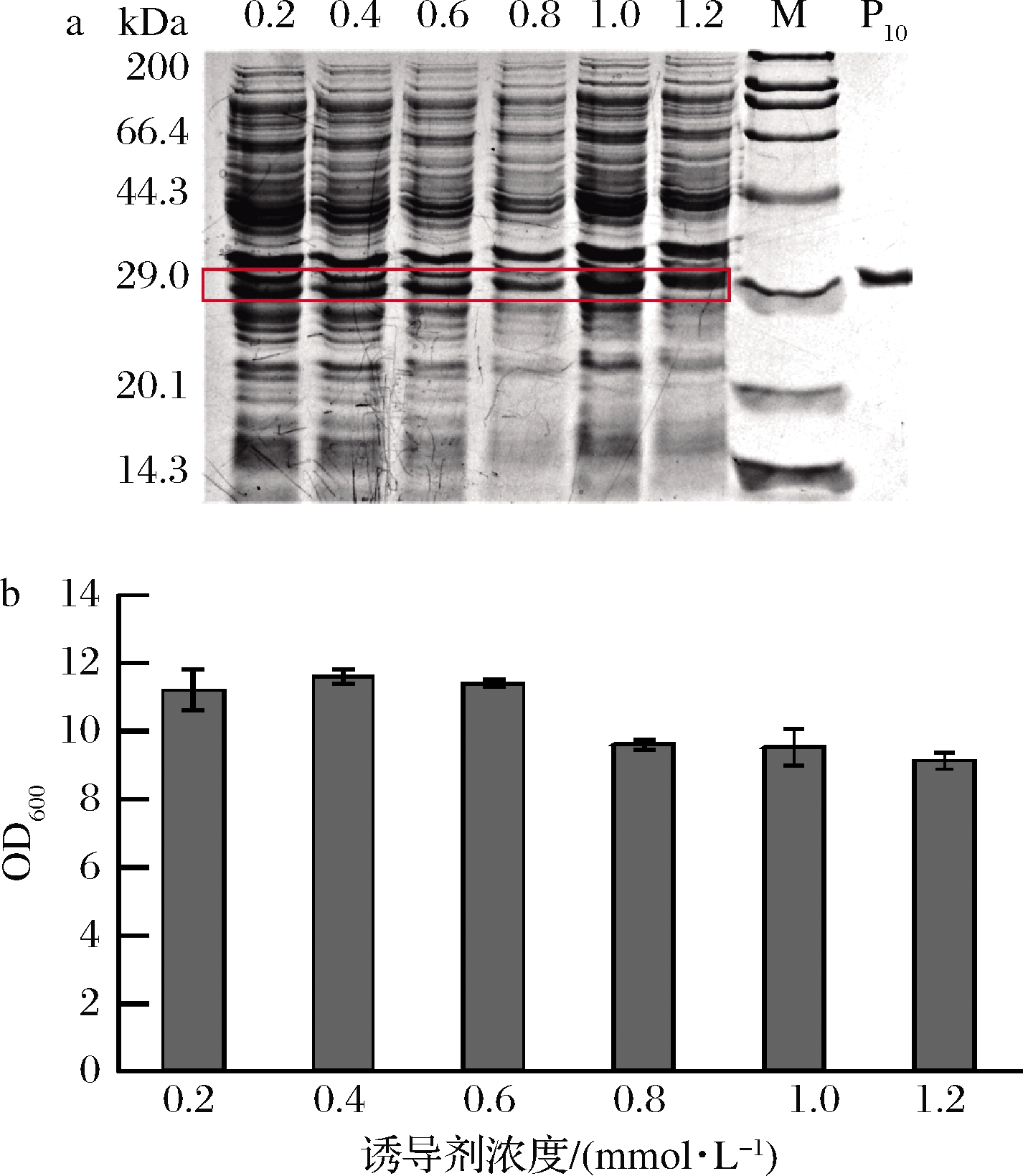
a-蛋白表达;b-菌体生长
图6 诱导剂浓度对蛋白表达和菌体生长的影响
Fig.6 Effect of IPTG concentration on protein expression and cell growth
2.2.6 5 L发酵罐水平蛋白表达
为进一步提高目的胶原蛋白产量,将重组菌株E.coli BL21(DE3)/pET28a-P10在5 L的发酵罐进行扩大培养。如图7所示,诱导12 h细胞密度最大,可能是发酵液中营养物质不足,菌体生长提前到达衰亡期。利用ImageJ对SDS-PAGE中目的条带灰度进行定量分析,结果显示,胶原蛋白的产量不断积累。在添加诱导剂后的前8 h,菌体稳定生长,胶原蛋白表达不明显;8 h后,胶原蛋白表达量明显增加;发酵12、18以及24 h时,同OD600量的细胞产蛋白量无明显差异(0.17 mg/mL),显著高于前8 h的蛋白量(0.05~0.14 mg/mL)。12 h后胶原蛋白表达量无明显增加,但发酵结束后收集得到的菌体量不断减少,故选择发酵时间为12 h。经过优化后的5 L发酵罐产量约为150 mg/L,约为摇瓶初始产量的5倍。
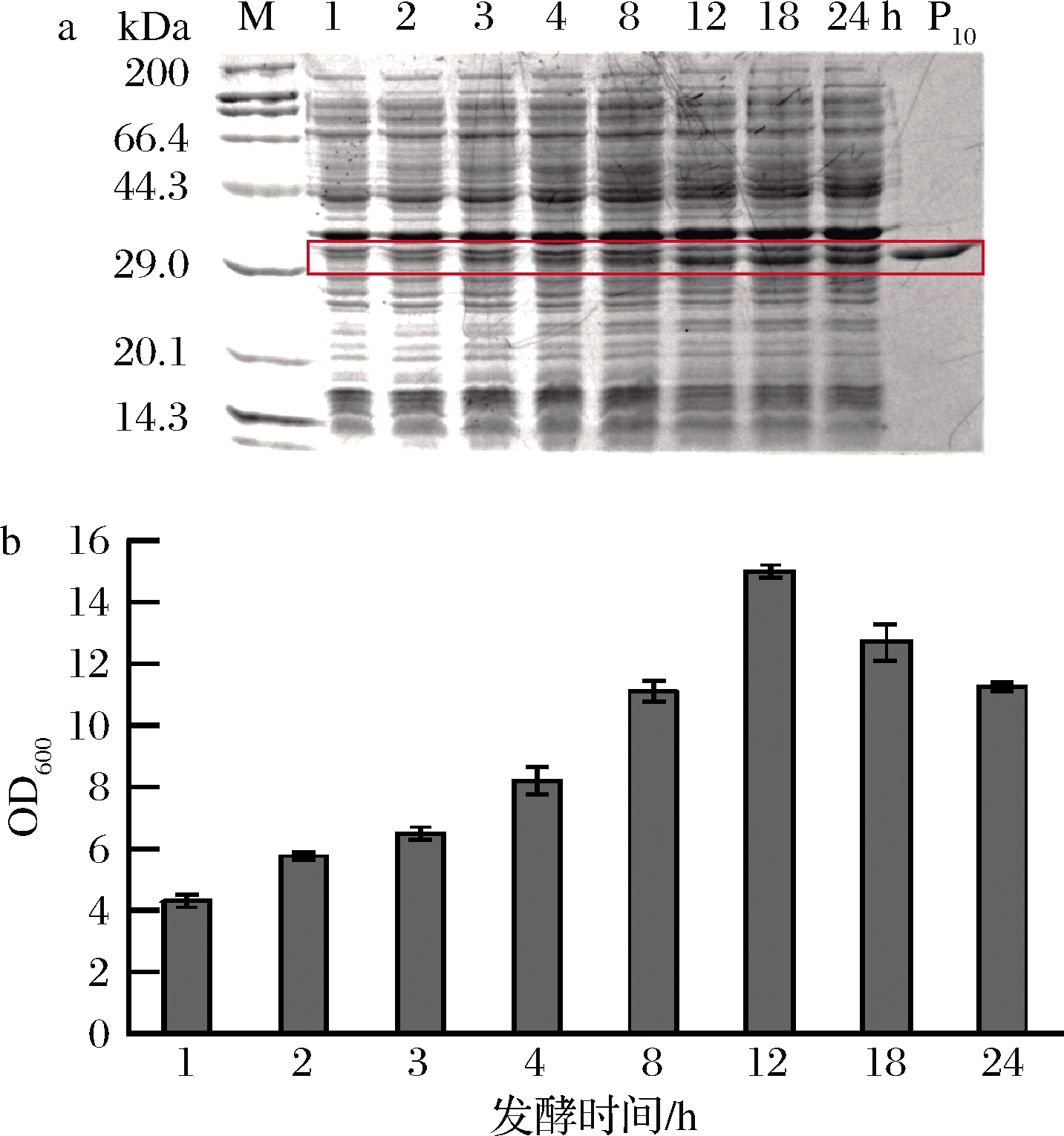
a-蛋白表达;b-菌体生长
图7 5 L发酵罐中蛋白表达和菌体生长
Fig.7 The protein expression and cell growth on 5 L fermentor
2.3 重组富脯氨酸胶原蛋白的纯化及鉴定
将发酵后的重组菌E.coli BL21(DE3)/pET28a-P10全细胞利用超声波破碎仪破壁后,离心收集上清液,利用序列N端的His标签进行亲和纯化,收集洗脱蛋白,经SDS-PAGE验证(图7和图10-a),160和400 mmol/L咪唑洗脱峰均为目的蛋白洗脱峰,得到高纯度的胶原蛋白P10。因为胶原蛋白为棒状结构,相比于蛋白标准品的球状蛋白,其迁移速度相对较慢[10]。为进一步验证所制备得到的蛋白为目的胶原蛋白,利用MALDI-TOF-MS对其分子质量进行鉴定。质谱结果显示(图8),P10胶原蛋白的分子质量为22 859 Da,和理论相对分子质量相吻合(Mw=22 843 Da),确定为目的胶原蛋白P10。
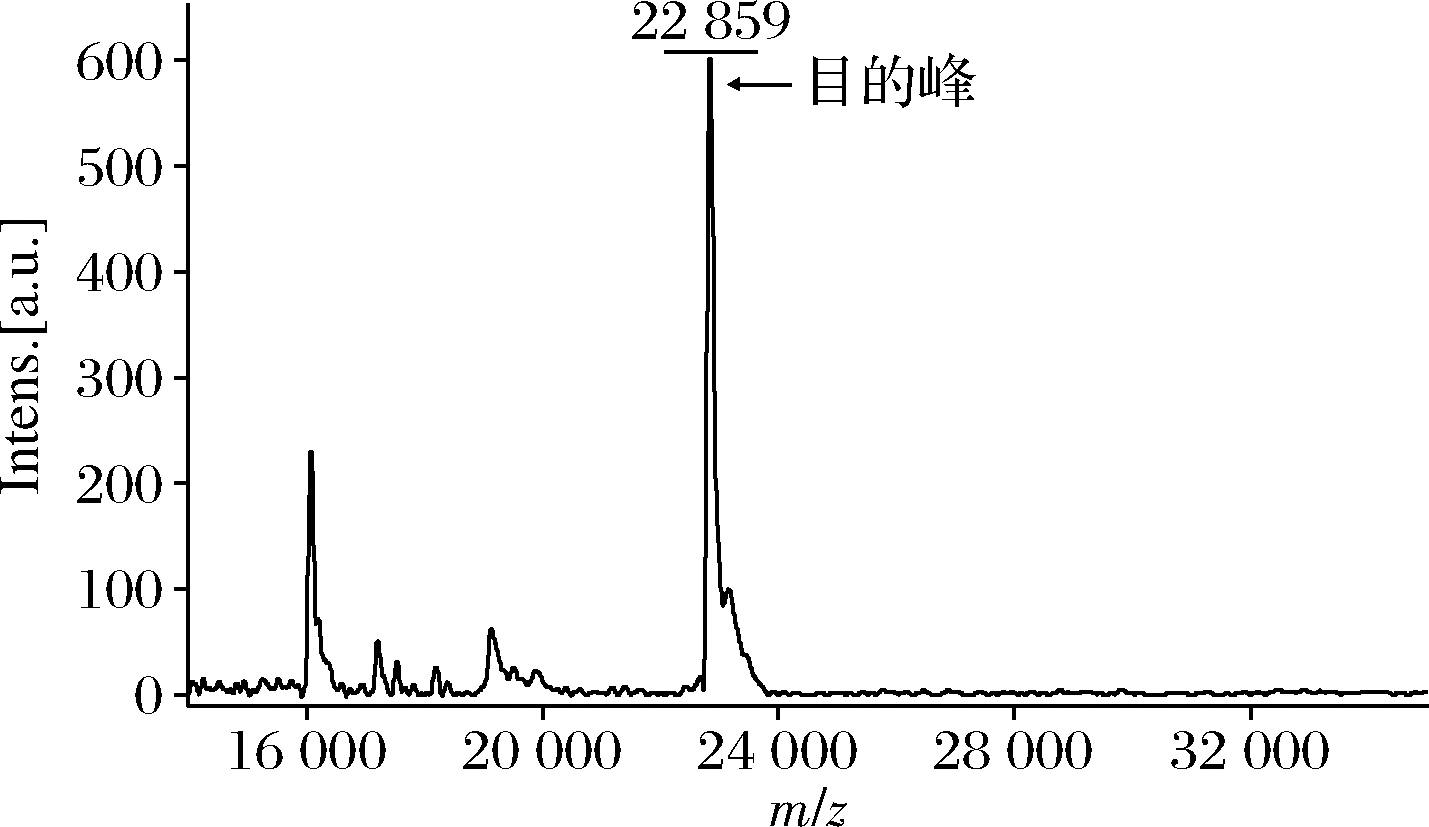
图8 胶原蛋白P10的飞行时间质谱鉴定
Fig.8 MALDI-TOF-MS of collagen protein P10
2.4 高脯氨酸序列位置对胶原蛋白热稳定性的影响
2.4.1 胶原蛋白的纯化及鉴定
以截短的S.pyogenes Scl2胶原蛋白B区域为基础(Sp2B),分别构建Sp2B、在Sp2B的N、C端或者中间嵌合(Pro-Pro-Gly)10短肽的P10N、P10C和P10M菌株,以上述优化后的条件进行诱导表达,将超声破壁后上清液过膜处理,利用N端的His标签进行亲和纯化,纯化方法同2.3,洗脱得到胶原蛋白Sp2B、P10N、P10C和P10M,经SDS-PAGE分析,纯度均大于95%(图9-a)。
2.4.2 胶原蛋白的热稳定性
Sp2B由富含α-螺旋的球状结构域和三股螺旋的胶原蛋白结构域组成,α-螺旋在192和222 nm有负的特征吸收峰,典型的胶原三股螺旋在220 nm下有正的特征吸收峰。如图9-b所示,Sp2B表现为α-螺旋和胶原蛋白三股螺旋的叠加谱图,这与YU等[11]的研究一致。根据图9-c热变结果拟合出Sp2B的Tm为29 ℃,P10C和P10M的Tm值为40 ℃(表2),相比于未融合(Pro-Pro-Gly)10短肽的胶原蛋白Sp2B提高了11 ℃[11]。
表2 重组胶原蛋白热稳定性及理论分子质量
Table 2 The stability and molecular weight of recombinant collagen
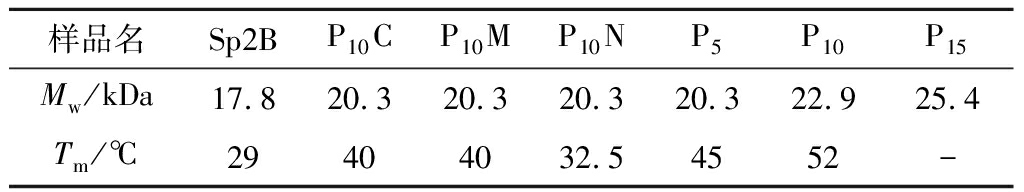
样品名Sp2BP10CP10MP10NP5P10P15Mw/kDa17.820.320.320.320.322.925.4Tm/℃29404032.54552-
注:P15没有折叠形成二级结构,无Tm值
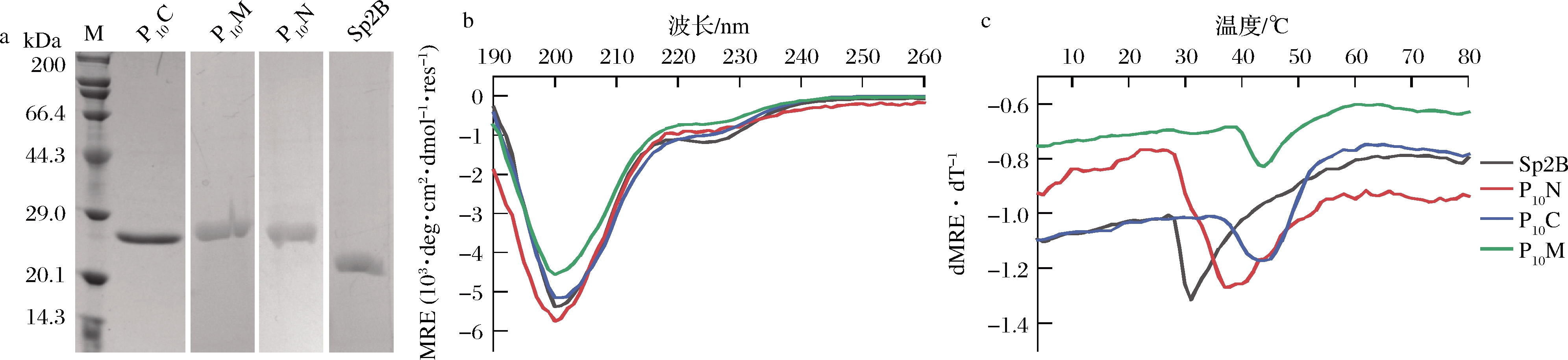
a-纯化后胶原蛋白的SDS-PAGE鉴定;b-全波长谱图;c-热变曲线
图9 不同位置嵌合富脯氨酸序列胶原蛋白的纯化及圆二色谱图
Fig.9 Purification and circular dichroism spectrum of collagen with proline rich sequence inserted at different sites
在胶原蛋白序列的N端嵌合(Pro-Pro-Gly)10短肽的P10N,其Tm为32.5 ℃,相比于在胶原序列的C端和中间嵌合(Pro-Pro-Gly)10短肽的热稳定性低,说明在胶原区域的C端和中间嵌合(Pro-Pro-Gly)10短肽更利于热稳定性的提高。
2.5 高脯氨酸序列长度对胶原蛋白热稳定性的影响
2.5.1 胶原蛋白的纯化及鉴定
分别在Sp2B的N和C端嵌合(Pro-Pro-Gly)n(n为5、10或15)短肽,构建P5、P10和P15菌株,以上述优化后的条件进行诱导表达,将超声破壁后上清过膜处理,利用N端的His标签进行亲和纯化,纯化方法同2.3,洗脱得到胶原蛋白P5、P10和P15,经SDS-PAGE分析,纯度均大于95%(图10-a)。
2.5.2 胶原蛋白的热稳定性
图10-b显示,P5和P10的全波长扫描谱图也显示为α-螺旋和胶原蛋白三股螺旋的叠加谱图,而P15在220 nm左右的特征吸收峰相对较小,说明三股螺旋成分降低。进一步的热变实验结果表明(图10-c和表1),P5和P10正确折叠形成了三股螺旋结构,而P15未能正确折叠。在球状结构域和胶原区域之间嵌合Pro-Pro-Gly短肽会影响胶原区域的折叠,嵌合(Pro-Pro-Gly)15会导致胶原区域无法正确折叠形成三股螺旋结构。P5和P10的Tm值分别为45、52 ℃,相比于Sp2B提高约16、23 ℃,表明在胶原序列中嵌合一定长度Pro-Pro-Gly短肽能够有效提高胶原蛋白的热稳定性,但是当Pro-Pro-Gly短肽重复过多时,如P15,会导致胶原三股螺旋的错配而破坏胶原三股螺旋的正确折叠。
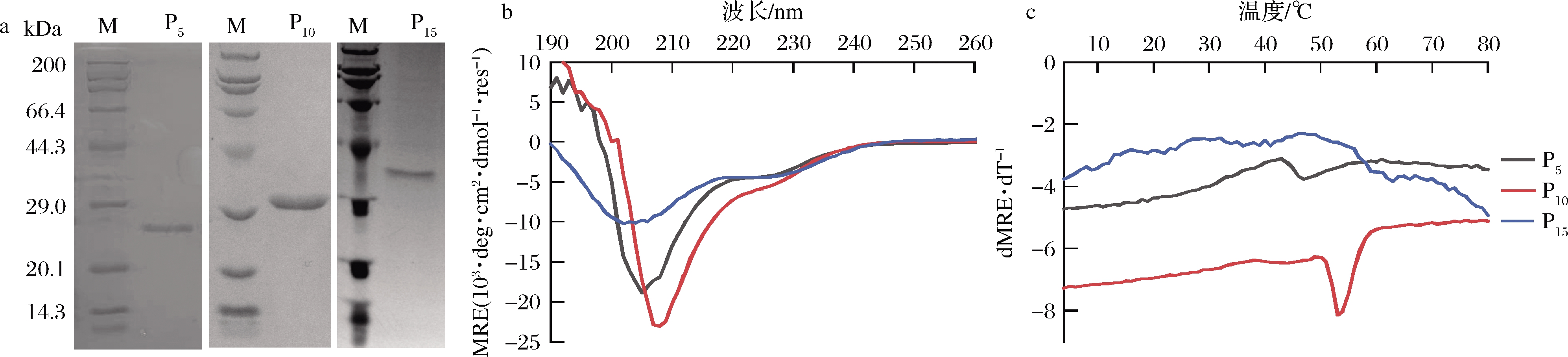
a-纯化后胶原蛋白的SDS-PAGE鉴定;b-全波长谱图;c-热变曲线
图10 嵌合不同长度富脯氨酸序列胶原蛋白的纯化及圆二色谱图
Fig.10 Purification and circular dichroism spectrum of collagen with different length proline rich sequence
3 结论
本研究在截短的天然细菌胶原蛋白中嵌合富脯氨酸的Pro-Pro-Gly短肽,通过单因素实验研究了不同培养条件对重组菌株生长和胶原蛋白表达的影响,确定了重组菌株摇瓶发酵的最佳条件:初始诱导菌体浓度OD600为2.5、发酵周期24 h、诱导剂终浓度1.0 mmol/L、诱导温度35 ℃。并利用5 L发酵罐扩大制备重组富脯氨酸胶原蛋白,产量约为150 mg/L,为摇瓶初始表达量的5倍。嵌合富氨基酸序列(Pro-Pro-Gly)n的位置对胶原蛋白的热稳定性有一定的影响,在胶原序列中间和C端嵌合(Pro-Pro-Gly)10更利于热稳定性的提高,相比于原始胶原蛋白Sp2B提高了11 ℃,在N端嵌合提高了3.5 ℃。富脯氨酸序列的长度对热稳定性有较大的影响,与原始胶原蛋白Sp2B相比较,在N端和C端同时嵌合5和10个富脯氨酸序列Pro-Pro-Gly的胶原蛋白热稳定性分别提高了16、23 ℃,这对高热稳定性胶原蛋白材料的设计提供了基础。
[1] YU Z X,AN B,RAMSHAW J A M,et al.Bacterial collagen-like proteins that form triple-helical structures[J].Journal of Structural Biology,2014,186(3):451-461.
[2] 安锋利,王建林,权美平,等.胶原蛋白的应用及其发展前景[J].贵州农业科学,2011,39(1):8-11.
AN F L,WANG J L,QUAN M P,et al.The application and development prospects of collagen[J].Guizhou Agricultural Sciences,2011,39(1):8-11.
[3] 胡敏华.胶原蛋白的生理学功能及其应用[J].畜禽业,2007(9):7-8.
HU M H.The physiological function and application of collagen[J].Livestock and Poultry Industry,2007(9):7-8.
[4] 吴雷,郑娟,刘文涛,等.鸡关节软骨Ⅱ型胶原蛋白结构及性能表征[J].食品与发酵工业,2016,42(11):86-90.
WU L,ZHENG J,LIU W T,et al.Structure and properties of type Ⅱ collagen in chicken cartilage[J].Food and Fermentation Industries,2016,42(11):86-90.
[5] 王雪蒙,于玮,马良,等.兔皮胶原蛋白的提取及其结构鉴定[J].食品与发酵工业,2016,42(4):209-213.
WANG X M,YU W,MA L,et al.Optimization of extraction process for rabbit-skin collagen and identification of its structure[J].Food and Fermentation Industries,2016,42(4):209-213.
[6] 范代娣,段明瑞,米钰,等.重组E.coli工程菌高密度培养生产人源型胶原蛋白[J].化工学报,2002,53(7):752-754.
FAN D D,DUAN M R,MI Y,et al.High density fermentation of recombinant E.coli for production of human-like collagen[J].Journal of Chemical Industry and Engineering(China),2002,53(7):752-754.
[7] YOSHIZUMI A,YU Z X,THIAGARAJAN G,et al.High expression and physical properties of bacterial collagen[J].Matrix Biology,2008,27:53.
[8] PENG Y Y,STOICHEVSKA V,HOWELL L,et al.Preparation and characterization of monomers to tetramers of a collagen-like domain from Streptococcus pyogenes[J].Bioengineered,2014,5(6):378-385.
[9] PENG Y Y,YOSHIZUMI A,DANON S J,et al.A Streptococcus pyogenes derived collagen-like protein as a non-cytotoxic and non-immunogenic cross-linkable biomaterial[J].Biomaterials,2010,31(10):2 755-2 761.
[10] YOSHIZUMI A,YU Z X,SILVA T,et al.Self-association of Streptococcus pyogenes collagen-like constructs into higher order structures[J].Protein Science,2009,18(6):1 241-1 251.
[11] YU Z X,BRODSKY B,INOUYE M.Dissecting a bacterial collagen domain from Streptococcus pyogenes sequence and length-dependent variations in triple helix stability and folding[J].Journal of Biological Chemistry,2011,286(21):18 960-18 968.
[12] STOICHEVSKA V,AN B,PENG Y Y,et al.Formation of multimers of bacterial collagens through introduction of specific sites for oxidative crosslinking[J].Journal of Biomedical Materials Research Part A,2016,104(9):2 369-2 376.
[13] COSGRIFF-HERNANDEZ E,HAHN M S,RUSSELL B,et al.Bioactive hydrogels based on designer collagens[J].Acta Biomaterialia,2010,6(10):3 969-3 977.
[14] MOHS A,SILVA T,YOSHIDA T,et al.Mechanism of stabilization of a bacterial collagen triple helix in the absence of hydroxyproline[J].Journal of Biological Chemistry,2007,282(41):29 757-29 765.
[15] HAN R L,ZWIEFKA A,CASWELL C C,et al.Assessment of prokaryotic collagen-like sequences derived from streptococcal Scl1 and Scl2 proteins as a source of recombinant GXY polymers[J].Applied Microbiology and Biotechnology,2006,72(1):109-115.
[16] RAMSHAW J A M,SHAH N K,BRODSKY B.Gly-X-Y tripeptide frequencies in collagen:A context for host-guest triple-helical peptides[J].Journal of Structural Biology,1998,122(1-2):86-91.
[17] PERSIKOV A V,RAMSHAW J A M,BRODSKY B.Prediction of collagen stability from amino acid sequence[J].Journal of Biological Chemistry,2005,280(19):19 343-19 349.
[18] PERSIKOV A V,RAMSHAW J A M,KIRKPATRICK A,et al.Peptide investigations of pairwise interactions in the collagen triple-helix[J].Journal of Molecular Biology,2002,316(2):385-394.
[19] CHEN C C,HSU W,HWANG K C,et al.Contributions of cation-π interactions to the collagen triple helix stability[J].Archives of Biochemistry and Biophysics,2011,508(1):46-53.
[20] PERSIKOV A V,RAMSHAW J A M,KIRKPATRICK A,et al.Electrostatic interactions involving lysine make major contributions to collagen triple-helix stability[J].Biochemistry,2005,44(5):1 414-1 422.