啤酒是以酒花和麦芽汁为原料,由啤酒酵母酿制而成的酒精饮料[1]。酵母代谢产生的风味物质决定了啤酒的感官特性。根据风味物质的化学属性,可将其分为醇类、醛类、酸类、酯类、酮类、内酯类化合物、缩醛类化合物、吡嗪类化合物、呋喃类化合物、芳香族化合物、硫化物等[2-3]。其中,高级醇是指3个或3个以上碳原子的醇类的统称,同时也称为杂醇油[1],是啤酒中重要的风味物质,主要包括正丙醇、异丁醇、异戊醇、活性戊醇、苯乙醇[4-5]。
啤酒中高级醇的含量一般为70~100 mg/L,而优质啤酒对高级醇含量的控制更为严格,通常在50~90 mg/L [6]。适量的高级醇能赋予啤酒独特的香味,含量过低,酒体不丰满,口感较差;但含量过高时,不仅会影响酒体的协调性,还会对饮用者的身体产生明显的副作用[7-9]。啤酒高级醇含量过高是业内普遍存在的问题,如何将高级醇含量控制在合理范围对于提升啤酒品质具有重要的意义。目前,高级醇的调控主要有两种手段:一是通过原辅料、发酵温度、溶氧量等指标调控来优化发酵工艺;二是从发酵菌种出发,通过选育低产高级醇的优良酵母菌株从根本上降低高级醇含量。
近年来,随着对诱变技术的深入研究,由清华大学邢新会研究团队自主研发的常压和室温等离子(atmospheric and room temperature plasma,ARTP)诱变技术已经成为了一种新型的育种方法。与传统的诱变技术相比,此项技术具有操作简便、安全性高、高通量诱变、高总突变率和正向突变率高的特点[10],已经广泛应用于细菌、真菌、微藻等多种微生物的改造[11-15]。
筛选过程是选育低产高级醇酵母菌株的关键限速步骤。传统的摇瓶发酵筛选方法虽然准确度较高,但操作繁琐、周期长、工作量大,无法做到菌株的快速筛选[16]。近年来,高通量筛选得到了快速发展。研究表明,分光光度法可以实现高级醇含量的快速检测[17]。此外,微孔板的高通量筛选技术在菌株筛选方面也取得了良好的效果,提高了筛选效率[18-19]。这些均为低产高级醇酵母菌株的高通量筛选提供了新的策略。
本研究以工业酵母(Saccharomyces cerevisiae)680bg为出发菌株,利用ARTP诱变技术对其菌悬液进行处理,运用微孔板培养法结合分光光度法,建立高通量筛选方法,以期筛选低产高级醇菌株,为啤酒酵母的选育提供依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
Saccharomyces cerevisiae 680bg,德国专用小麦啤酒上面酵母,由某啤酒公司提供。
1.1.2 主要试剂
酵母浸粉,北京奥博星生物技术有限公司;胰蛋白胨,天津市英博生化试剂有限公司;葡萄糖,分析纯,天津市永大化学试剂开发中心;琼脂粉、琼脂糖,Solarbio公司;NaCl、亚铁氰化钾,均为分析纯,天津市北方化玻购销中心;H2SO4,天津市化学试剂一厂;dNTP,TaKaRa公司;PEG3350,分析纯,北京索莱宝科技有限公司;酒石酸钾钠,分析纯,天津市北方天医化学试剂厂;正丙醇标准品、异丁醇标准品、2-苯乙醇标准品,均为色谱纯,天津联星化工有限公司;CuSO4,天津市化学试剂六厂;对二甲氨基苯甲醛,分析纯,天津市大茂化学试剂厂。
1.1.3 主要仪器
T gL-16C台式离心机,上海安亭科技仪器厂;UVmini-1240紫外分光光度计,岛津仪器(苏州)有限公司;gL20A型高速冷冻离心机,中科院生物物理所技术服务公司;ARTP-II型ARTP等离子体诱变仪,北京思清源生物科技有限公司;全自动生长曲线分析仪,芬兰BIOSCREEN公司;7890A气相色谱仪,美国安捷伦科技公司。
1.1.4 主要培养基
(1)YEPD培养基:2%葡萄糖,2%蛋白胨,1%酵母浸粉,pH自然,115 ℃灭菌20 min。固体培养基需在此基础上再添加2%琼脂粉。
(2)LB培养基:1%蛋白胨,1%NaCl,0.5%酵母浸粉,pH自然,115 ℃灭菌20 min。固体培养基需在此基础上再添加2%琼脂粉。
(3)麦芽汁培养基:由某啤酒公司提供。
1.2 实验方法
1.2.1 680bg菌株生长曲线的绘制
从斜面上挑取菌种1环接种到装有5 mL YEPD液体培养基的试管中,30 ℃条件下静置培养过夜。按2%~5%接种量接种,在培养温度为30 ℃,600 nm下用全自动生长曲线分析仪测定菌株的吸光值,期间每隔1 h测定菌液的OD600值。以培养时间为横坐标,OD600值为纵坐标,绘制菌株的生长曲线。
1.2.2 啤酒发酵工艺
取斜面菌种1环接种于盛有50 mL麦芽汁培养基(麦汁浓度为12 °P)的三角瓶中(250 mL),25 ℃培养36 h。将种子液在6 500 r/min的条件下离心3 min,弃上清液,以25 mL的无菌水洗涤2次。按照100 g/L的接种量接种于装有150 mL麦汁(麦汁浓度为12 oP)的250 mL三角瓶中,16 ℃静置发酵7 d。
1.2.3 ARTP诱变条件的确定
取培养至对数中期的菌液离心,弃上清液,用无菌生理盐水将其稀释成OD600值在0.6~0.8的菌悬液。准确吸取10 μL菌液均匀的涂于无菌金属载片表面后立即进行ARTP诱变处理。调节各项参数,使载片与放射源之间距离为2.5 mm、仪器功率为100 W、气流量参数为10 SLM。分别从0、10、20、25、30、35、40、45 min开始处理样品。诱变后,将载片转移至装有1 mL生理盐水的1.5 mL的EP管中,振荡2 min。取适量菌悬液涂布于初筛平板上,30 ℃倒置培养48 h。观察菌株生长情况,计算菌落数与致死率。最后以诱变时间为横坐标、诱变时间对应的致死率为纵坐标绘制致死曲线。
1.2.4 高通量筛选方法的建立
为了从大批诱变菌株中快速高效地筛选出低产高级醇工业酵母菌株,建立了分光光度法结合48孔板发酵的高通量筛选方法。将诱变处理后的菌悬液稀释涂布于YEPD固体平板上,30 ℃培养36 h。挑选单菌落于新的YEPD平板上,30 ℃继续培养24 h。用干净的枪头将诱变菌株挑入装有1 mL麦汁的48孔板中,16 ℃连续发酵适当时间后离心取上清液稀释。在比色管中加入1.2 mL稀释后的上清液,置于冰水浴中,沿管壁缓慢的加入0.8 mL 0.5%的对二甲氨基苯甲醛浓硫酸溶液,轻轻晃动各管使反应液混匀,沸水浴15 min,冷却备用。将反应液加到96孔透明酶标板中,在520 nm下测其吸光度。
1.2.5 突变株的复筛验证
运用高通量筛选方法虽然可以快速地筛选出高级醇含量降低的菌株,但是准确性较差,为了提高实验的精确度,还需将初筛菌株摇瓶发酵后利用气相色谱技术进行复筛验证。将初筛菌株与出发菌株680bg按小麦啤酒发酵工艺条件进行250 mL体系的三角瓶发酵,发酵结束后检测发酵液的高级醇含量、酒精度、发酵度等重要指标。选择高级醇含量显著降低,其他生理指标不变的菌株继续发酵3轮,最后将高级醇含量降低、各项生理指标不变且遗传性能稳定的菌株定为筛选出来的优良菌株。
1.2.6 发酵性能分析
通过CO2排放量的测定来监测整个发酵过程,每隔12 h称重1次,当12 h失重≤0.1 g时,表明发酵已经结束。测定发酵液残糖含量、酒精度以及真正发酵度。发酵液蒸馏后采用气相色谱仪检测高级醇含量。
检测条件:FID检测器,毛细管色谱柱HP-INNOWAX(50 m×320 μm×1.0 μm)载气为纯度为99.99%的高纯氮气,分流比1∶10。进样口温度200 ℃,检测器温度200 ℃,进样量1 μL。采用程序升温,50 ℃保持8 min,5 ℃/min升温,升温至180 ℃,保持15 min,每个样品处理时间43 min,为保持数据的准确性,每个样品进样2次,取平均值。
1.2.7 诱变菌株遗传稳定性能分析
将活化的诱变菌株于种子培养基中进行连续8次传代培养,再通过摇瓶发酵检验每代突变菌株产高级醇能力及各项基本性能的稳定性。
2 结果与分析
2.1 680bg菌株生长曲线的绘制
一般选择处于对数中期的菌株进行ARTP离子诱变,为了确定菌株680bg对数中期,依照方法1.2.1测定并绘制了680bg的生长曲线。结果如图1所示,酵母菌株680bg在培养5.5 h时处于对数中期,所以选取培养5.5 h的酵母细胞进行诱变处理。

图1 出发菌株680bg的生长曲线
Fig.1 The growth curve of original strain 680bg
2.2 ARTP诱变致死曲线的绘制
据报道,诱变的致死率约为80%~85%时,诱变效果较好。因此,依据方法1.2.3,对出发菌株680bg进行诱变处理,并绘制致死率曲线,结果如图2所示。出发菌株680bg的致死率随照射时间的延长而逐步增大,当诱变时间为35 s时酵母菌株的致死率为81%,诱变50 s时菌株已经全部死亡。因此,选取35 s作为后续处理的诱变时间。
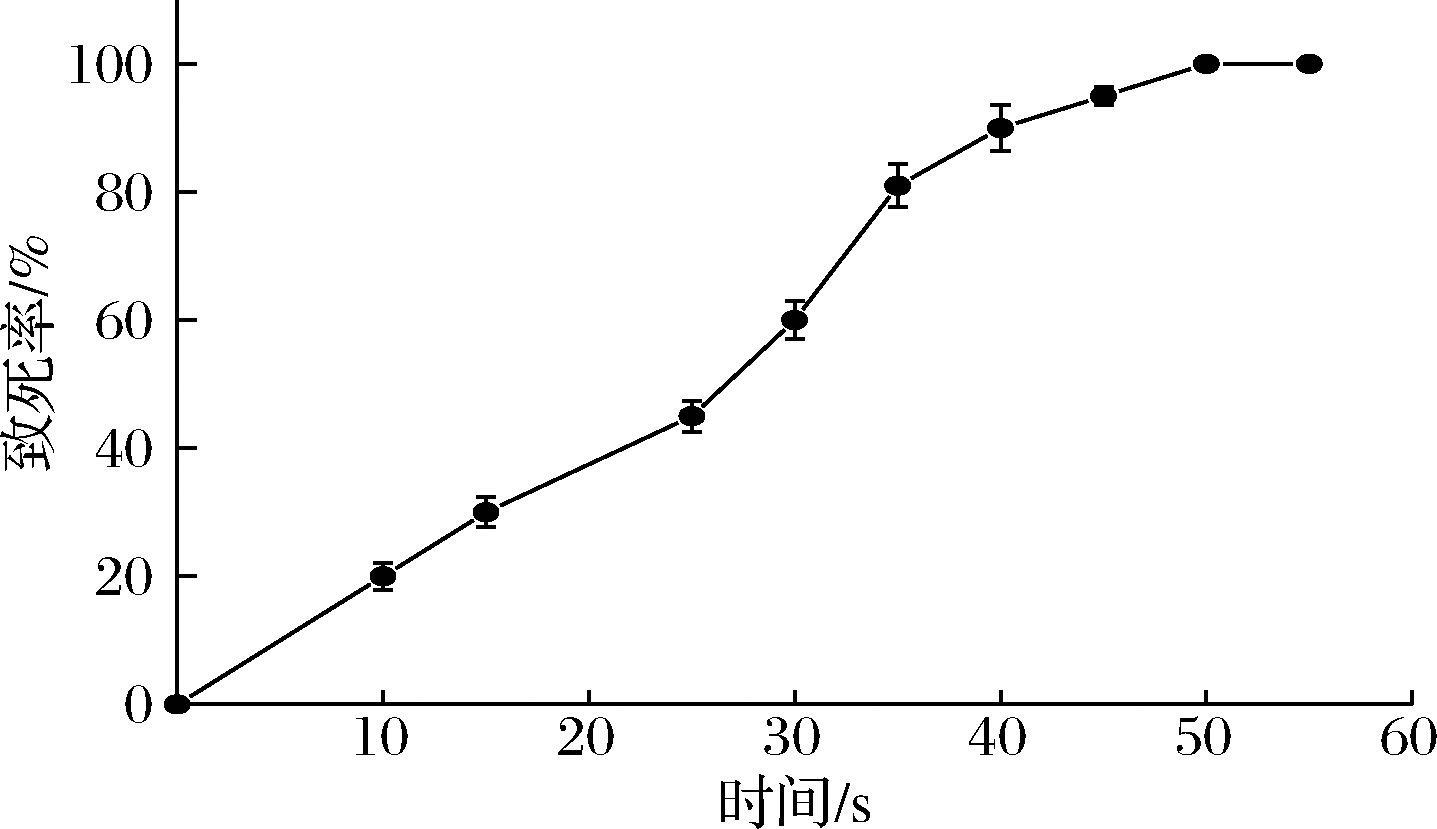
图2 出发菌株680bg的致死率曲线
Fig.2 The lethal rate curve of original strain 680bg
2.3 诱变菌株的初筛
目前高级醇的检测方法主要包括比色法和气相色谱法[20],其中气相色谱法可以准确地测量出高级醇含量,但是操作起来较为繁琐,耗时耗力,不适合初筛工作。比色法操作简单方便,虽不能准确测量出高级醇具体数值,但却能粗略地评价高级醇(主要是异丁醇与异戊醇)含量。前期研究表明,出发菌株680bg代谢生成的高级醇主要是异丁醇和异戊醇。因此,本研究利用比色法对菌株进行初筛选,而后利用气相色谱法对菌株进行复筛验证。
2.3.1 诱变菌株初筛方法的建立
高级醇经浓硫酸脱水后转化的不饱和烃可与对二甲氨基苯甲醛发生缩合反应生成橙黄色化合物,该产物在520 nm处有最大吸收值,且含量与吸收值符合朗伯-比尔定律[17]。为了确定发酵液中的高级醇含量与其在520 nm处吸光值相关性,以发酵液中高级醇浓度为横坐标,520 nm处吸光值为纵坐标绘制了标准曲线,并且得出吸光值与高级醇之间关系式为y=0.002 6x-0.007 6。由此可知,发酵液中的高级醇浓度与其在波长520 nm处吸光值之间存在正相关性。然而,该标准曲线的R2仅为0.986 65,不能准确反应高级醇的含量。因此,该方法只适用于菌株的初步筛选。
2.3.2 诱变菌株培养时间的确定
为了测定诱变菌株在48孔板中的最优培养时间,将出发菌株分别培养12、24、36、48、60、72、84 h后,按1.2.4介绍的方法测量其在各个时间点产生高级醇所对应的OD520值。由图3可知,在培养12~48 h期间,菌株代谢产生的高级醇含量急剧增加,在培养60 h后高级醇生成速率变慢,直到72 h时,高级醇含量趋于稳定,不再增加。因此,选取72 h作为后续实验的培养时间。
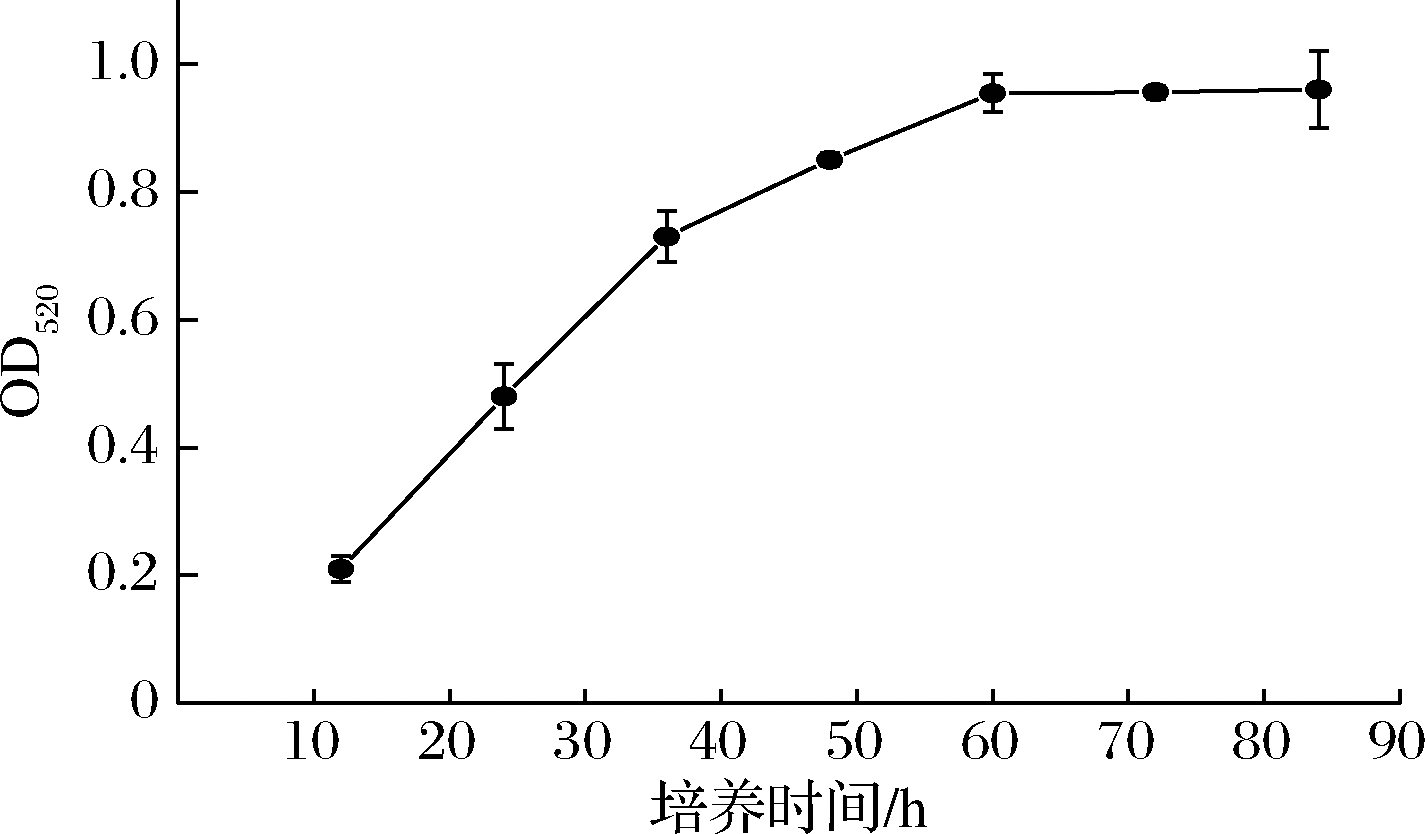
图3 出发菌株680bg在不同培养时间下高级醇的生成量(OD520)
Fig.3 The higher alcohols production(OD520)of original strain 680bg at different cultivation times
2.3.3 诱变菌株初筛结果
将出发菌株与诱变菌株培养72 h后,依照方法1.2.4所描述的内容对其进行比色法处理,以诱变菌株为横坐标,其所对应的OD520值与出发菌株OD520值的比值为纵坐标绘制了如图4所示的柱状图,将比值在0.4~0.65的菌株初步认定为低产高级醇的菌株,共筛选得到51株诱变菌株。

a-初筛菌株;b-初筛菌株
图4 低产高级醇菌株的初筛
Fig.4 Preliminary screening for strains with lower yield of high alcohol
2.4 诱变菌株复筛
由于比色法只能粗略地检测高级醇的含量,且此法受温度等因素的影响较大,难免会产生一定的偏差,为了更加精确地筛选出低产高级醇菌株,需要对51株初筛菌株与出发菌株680bg进行发酵验证。
2.4.1 高级醇含量比较
采用1.2.2介绍的发酵工艺培养菌株7 d,取发酵液离心、蒸馏,用气相色谱技术检测诱变菌株与出发菌株高级醇含量。结果如表1所示,经过诱变、反复筛选,共得到了8株低产高级醇菌株,其中,ARTP-162菌株产生的高级醇含量是所有菌株中最低的,与出发菌株相比降低了约21%,其他的诱变菌株(ARTP-5、ARTP-12、ARTP-32、ARTP-65、ARTP-109、ARTP-113、ARTP-129)的高级醇含量也较出发菌株分别降低了14.3%、12%、11.25%、9.9%、12.1%、12.8%、11.1%。
表1 诱变菌株与出发菌株高级醇含量 单位:mg/L
Table 1 Comparison of higher alcohol contents between mutated strain and the original strain
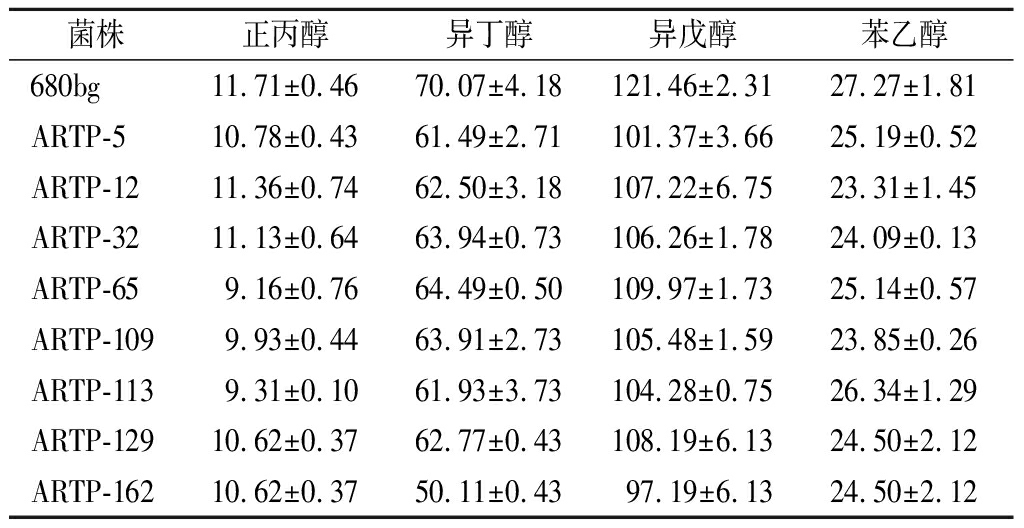
菌株正丙醇异丁醇异戊醇苯乙醇680bg11.71±0.4670.07±4.18121.46±2.3127.27±1.81ARTP-510.78±0.4361.49±2.71101.37±3.6625.19±0.52ARTP-1211.36±0.7462.50±3.18107.22±6.7523.31±1.45ARTP-3211.13±0.6463.94±0.73106.26±1.7824.09±0.13ARTP-659.16±0.7664.49±0.50109.97±1.7325.14±0.57ARTP-1099.93±0.4463.91±2.73105.48±1.5923.85±0.26ARTP-1139.31±0.1061.93±3.73104.28±0.7526.34±1.29ARTP-12910.62±0.3762.77±0.43108.19±6.1324.50±2.12ARTP-16210.62±0.3750.11±0.4397.19±6.1324.50±2.12
2.4.2 基本理化指标比较
待发酵结束后,对所有菌株的酒精度、真正发酵度及发酵力等理化指标进行测定、分析。如表2所示,与出发菌株680bg相比,诱变菌株无论是在CO2释放量、酒精度还是真正发酵度上,均没有发生明显的变化。这意味着这些诱变菌株不仅具有低产高级醇的特性还保留了良好的发酵性能。
表2 出发菌株680bg及诱变菌株的基本发酵性能
Table 2 Fermentation performances of original strain 680bg and mutated strain
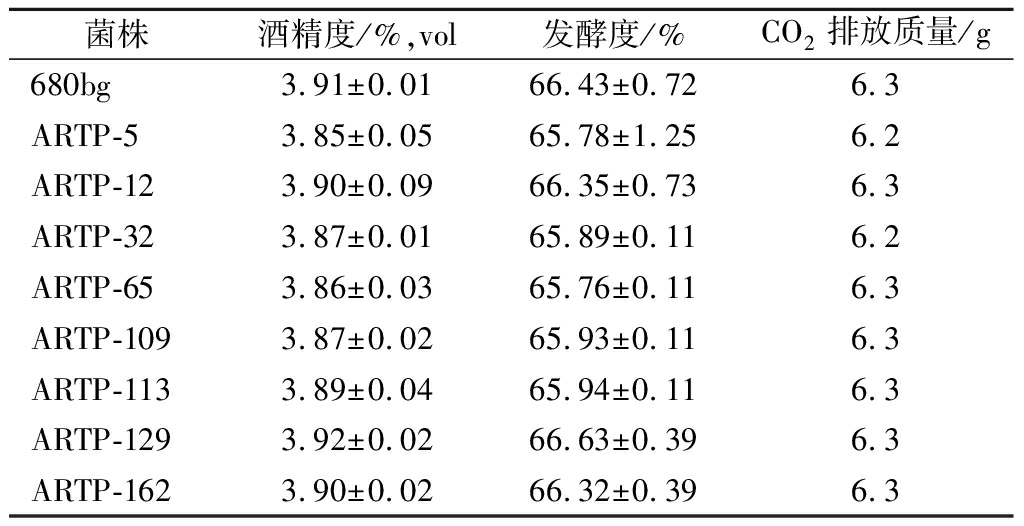
菌株酒精度/%,vol发酵度/%CO2排放质量/g680bg3.91±0.0166.43±0.726.3ARTP-53.85±0.0565.78±1.256.2ARTP-123.90±0.0966.35±0.736.3ARTP-323.87±0.0165.89±0.116.2ARTP-653.86±0.0365.76±0.116.3ARTP-1093.87±0.0265.93±0.116.3ARTP-1133.89±0.0465.94±0.116.3ARTP-1293.92±0.0266.63±0.396.3ARTP-1623.90±0.0266.32±0.396.3
2.5 诱变菌株遗产稳定性检测
通过连续传代实验,对菌株ARTP-162的遗传稳定性进行了分析。如图5所示,随着传代次数的增加,诱变菌株ARTP-162的产高级醇能力、酒精度、真正发酵度及CO2生成量等基本发酵性能并没有发生大变化,直至第八代也基本维持稳定,这表明诱变菌株ARTP-162遗传性能稳定,可用于工业化生产。
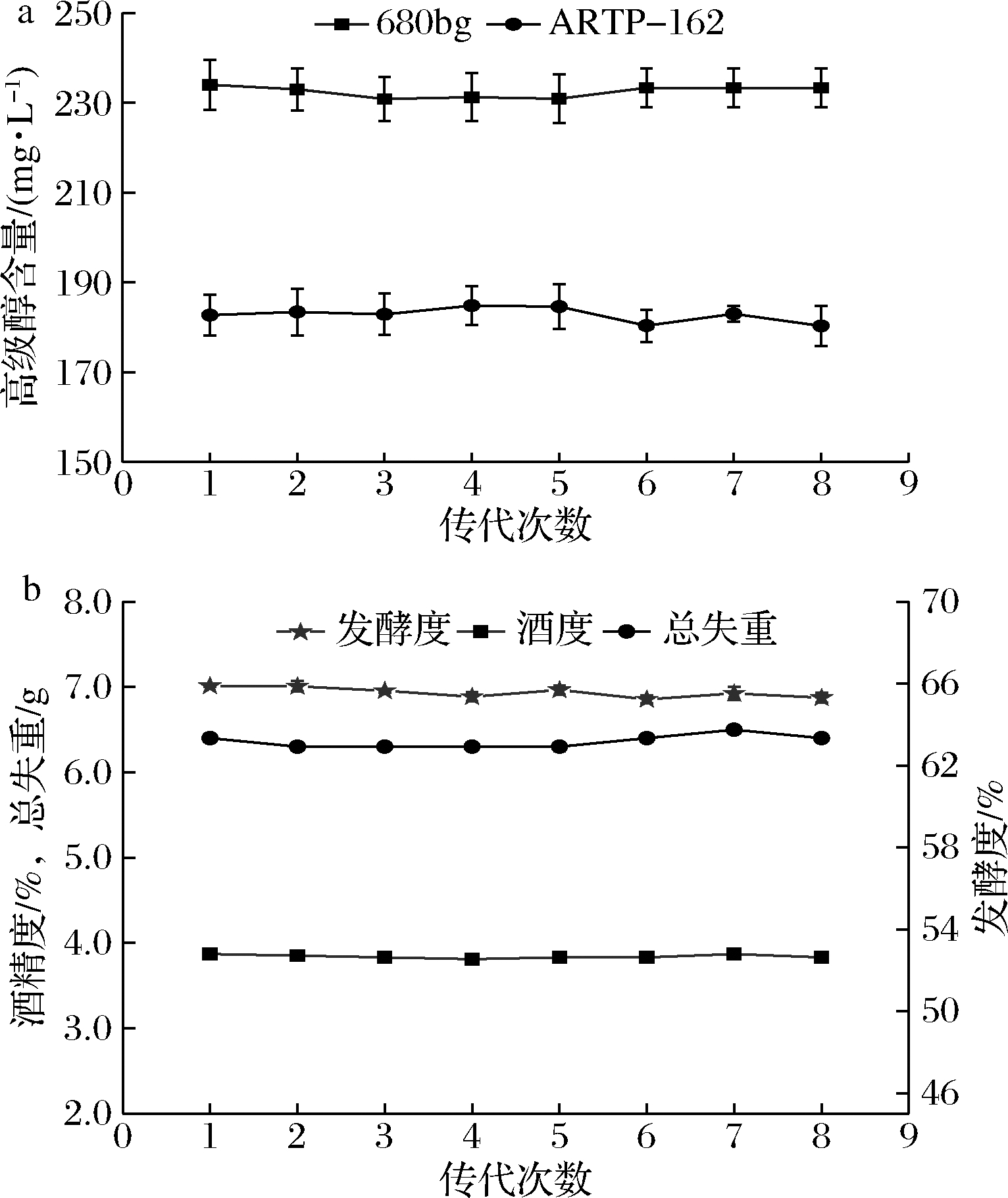
a-传代次数对菌株高级醇产量的影响;b-传代次数对菌株酒度、发酵度及总失重的影响
图5 诱变菌株的遗传稳定性分析
Fig.5 Analysis of genetic stability of mutagenic strain
3 结论
ARTP离子诱变是一种新型有效的诱变育种方法。本研究以菌株680bg为出发菌株,运用ARTP离子诱变手段对其进行诱变处理,经48孔板培养后用高级醇分光光度法快速检测菌株的高级醇含量,建立了完整有效的高通量筛选方法。经过两轮筛选,共得到了8株低产高级醇诱变菌株,其中诱变菌株ARTP-162降低效果最为显著,大约降低了21%,且遗传性能稳定。该方法的建立为低产高级醇菌株的选育提供了新的策略。
[1] PIRES E J,TEIXEIRA J A,BR NYIK T,et al.Yeast:The soul of beer′s aroma:A review of flavour-active esters and higher alcohols produced by the brewing yeast[J].Applied Microbiology and Biotechnology,2014,98(5):1 937-1 949.
NYIK T,et al.Yeast:The soul of beer′s aroma:A review of flavour-active esters and higher alcohols produced by the brewing yeast[J].Applied Microbiology and Biotechnology,2014,98(5):1 937-1 949.
[2] 范文来,徐岩.中国白酒风味物质研究的现状与展望[J].酿酒,2007,34(4):31-37.
FAN W L,XU Y.The review of the research of aroma compounds in Chinese liquors[J].Liquor Making,2007,34(4):31-37.
[3] HAZELWOOD L A,DARAN J M,VAN MARIS A J A,et al.The ehrlich pathway for fusel alcohol production:A century of research on Saccharomyces cerevisiae metabolism[J].Applied and Environmental Microbiology,2008,74(8):2 259-2 266.
[4] LARROQUE M N,CARRAU F,FARI A L,et al.Effect of Saccharomyces and non-Saccharomyces native yeasts on beer aroma compounds[J].International Journal of Food Microbiology,2021,337:108953.
A L,et al.Effect of Saccharomyces and non-Saccharomyces native yeasts on beer aroma compounds[J].International Journal of Food Microbiology,2021,337:108953.
[5] CHOI Y J,LEE J M,JANG Y S,et al.Metabolic engineering of microorganisms for the production of higher alcohols[J].mBio,2014,5(5):1 514-1 524.
[6] 于爱红,耿靖玮,弭孝涛,等.控制上面发酵小麦啤酒中高级醇含量的研究进展[J].中国酿造,2011,30(1):21-25.
YU A H,GENG J W,MI X T,et al.Research progress on higher alcohols control in top-fermentation wheat beer production[J].China Brewing,2011,30(1):21-25.
[7] WANG Y P,SUN Z G,ZHANG C Y,et al.Comparative transcriptome analysis reveals the key regulatory genes for higher alcohol formation by yeast at different α-amino nitrogen concentrations[J].Food Microbiology,2021,95:103713.
[8] 吴丹丽,李高磊,王明月,等.低产尿素与高级醇黄酒酵母菌株的筛选、鉴定与发酵[J].食品科学,2019,40(6):100-105.
WU D L,LI G L,WANG M Y,et al.Screening,identification and fermentation characteristics of yeast strains for low concentrations of urea and fusel alcohol in Chinese rice wine[J].Food Science,2019,40(6):100-105
[9] PROCOPIO S,QIAN F,BECKER T.Function and regulation of yeast genes involved in higher alcohol and ester metabolism during beverage fermentation[J].European Food Research and Technology,2011,233(5):721-729.
[10] ZHANG X,ZHANG X F,LI H P,et al.Atmospheric and room temperature plasma(ARTP)as a new powerful mutagenesis tool[J].Applied Microbiology and Biotechnology,2014,98(12):5 387-5 396.
[11] 秦艳飞,余飞,朱振坤,等.常压室温等离子(ARTP)诱变选育恩拉霉素高产菌株[J].食品与发酵科技,2018,54(3):32-36.
QIN Y F,YU F,ZHU Z K,et al.Mutation by using atmospheric and room temperature plasmas method for improving production of enramycin of Streptomyces fungicidious[J].Food and Fermentation Sciences & Technology,2018,54(3):32-36.
[12] LIU T,HUANG Z Y,GUI X,et al.Multi-omics comparative analysis of Streptomyces mutants obtained by iterative atmosphere and room-temperature plasma mutagenesis[J].Frontiers in Microbiology,2020,11:630309.
[13] LAROUSSI M,RICHARDSON J P,DOBBS F C.Effects of nonequilibrium atmospheric pressure plasmas on the heterotrophic pathways of bacteria and on their cell morphology[J].Applied Physics Letters,2002,81(4):772-774.
[14] LI X Y,LIU R J,LI J,et al.Enhanced arachidonic acid production from Mortierella alpina combining atmospheric and room temperature plasma(ARTP)and diethyl sulfate treatments[J].Bioresource Technology,2015,177:134-140.
[15] OTTENHEIM C,NAWRATH M,WU J C.Microbial mutagenesis by atmospheric and room-temperature plasma(ARTP):The latest development[J].Bioresources and Bioprocessing,2018,5(1):1-14.
[16] 李光,唐小玲,韦璇,等.Surfactin高产菌株的等离子体诱变及其高通量筛选[J].食品与发酵工业,2017,43(2):67-72.
LI G,TANG X L,WEI X,et al.High-throughput screening of Bacillus subtilis mutants with high yield of surfactinby ARTP[J].Food and Fermentation Industries,2017,43(2):67-72.
[17] 杜威,林玲,张兴亚,等.分光光度法测定黄酒中的高级醇[J].酿酒科技,2011(7):105-107.
DU W,LIN L,ZHANG X Y,et al.Determination of higher alcohols content in yellow rice wine by spectrophotometry[J].Liquor-Making Science & Technology,2011(7):105-107.
[18] 周扬,薛正莲,夏俊,等.常压室温等离子体(ARTP)诱变及高通量筛选那西肽高产菌株[J].工业微生物,2015,45(2):7-12.
ZHOU Y,XUE Z L,XIA J,et al.Mutation by using atmospheric and room temperature plasmas and high-throughput screening method for improving production of nosiheptide of Streptomyces actuosu[J].Industrial Microbiology,2015,45(2):7-12.
[19] 蔡莹瀛,夏苗苗,董会娜,等.常压室温等离子体(ARTP)诱变及高通量筛选维生素B12高产菌株[J].天津科技大学学报,2018,33(2):20-26.
CAI Y Y,XIA M M,DONG H N,et al.Mutation by using atmospheric pressure and room temperature plasmas and high-throughput screening method for improving vitamin B12 production[J].Journal of Tianjin University of Science & Technology,2018,33(2):20-26.
[20] 甄会英,王颉,李长文,等.分光光度法测定苹果酒中的高级醇[J].酿酒科技,2005(5):104-106.
ZHEN H Y,WANG J,LI C W,et al.Determination of higher alcohols in cider by spectrophotometry[J].Liquor-Making Science & Technology,2005(5):104-106.