富硒酵母是通过在培养基中添加亚硒酸钠(Na2SeO3),经过生物合成转化获得的有机硒含量高(1 000~2 500 mg/kg)、安全无毒,生理活性好的酵母硒补充剂。富硒酵母被广泛应用于保护心脏、治疗糖尿病、抗癌、抗衰老等需要添加强化硒营养的功能性食品、药品、化妆品中,发展前景十分广阔[1-3]。
果糖是一种常见的己酮糖,具有甜度高、升糖指数低以及渗透性好等优点[4]。康毅等[5]发现使用108 g/L果糖发酵酿酒酵母时,酿酒酵母的甘油产量最高;DANCH等[6]发现在培养基中添加果糖可以促进酿酒酵母对无机硒的吸收,但其分子机制尚不明确。
本研究以食品级多形汉逊酵母(Hansenula polymorpha)为出发菌株,通过对比不同碳源发酵组的酵母细胞生物量(dry cell weight,DCW)、胞内硒代蛋氨酸(selenomethionine,Se-Met)含量,并结合转录组测序分析,筛选果糖发酵组与葡萄糖发酵组之间的表达差异基因(differential expression genes,DEGs),进而富集分析与果糖代谢及无机硒吸收代谢相关的基因通路基因,为进一步解析果糖对多形汉逊酵母中的糖代谢和硒代谢影响的分子机制,以及优化酵母富硒发酵工艺提供参考。
1 材料与方法
1.1 材料与试剂
多形汉逊酵母(Hasenula polymorpha ATCC 26012),由陕西科技大学功能微生物研究室保存。
富硒-酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基:YPD培养基加无菌Na2SeO3母液(终浓度60 μmol/L)。
葡萄糖、D-果糖,天津科密欧公司;Na2SeO3、胰蛋白酶、硒代蛋氨酸,美国Sigma公司;TRIzol Reagent,美国Invtrogen公司;正己烷(色谱级)、乙腈(色谱级),Merck公司;其余试剂均为国产分析纯。
1.2 仪器与设备
1200高效液相色谱系统,美国Agilent公司;NexION 300D电感耦合等离子体质谱仪,美国Perkin-Elmer公司;ELX808多功能酶标仪,美国BioTek公司。
1.3 试验方法
1.3.1 多形汉逊酵母富硒发酵培养
菌种以YPD培养基复苏,经30 ℃、160 r/min发酵12 h,得到种子液。以10%的接种量,将种子液分别接种到葡萄糖-富硒-YPD和不同浓度的果糖-富硒-YPD(果糖含量分别为0、20、40、60、80、120、140、160、200 g/L)培养基中,经30 ℃,200 r/min培养72 h;12~24 h间隔取样,测定酵母DCW和Se-Met含量。
1.3.2 Se-Met的提取和含量分析[7-8]
取酵母发酵液5 mL,6 000 r/min离心10 min后,加入5 mL的30 mmol/L Tris-HCl和SiO2 beads,涡旋破碎,再加入胰蛋白酶,37 ℃孵育6 h,然后超声30 min,10 000 r/min离心10 min,收集上清液用HPLC-ICP-MS方法检测并计算酵母胞内Se-Met含量。HPLC条件:色谱柱为 SB-C18柱(250 mm×4.6 mm×5 μm,Agilent),流动相A(0.1%甲酸),流动相B(乙腈),流速1.0 mL/min,洗脱程序为:0% B~50% B,0~2 min;50% B~100% B,2~4 min;100% B,4~9 min;0% B,9~10 min。ICP-MS条件:载气流速1.0 L/min,反应气体3.5 mL/min 氢气,冷却气流15.0 L/min,同位素检测硒分子量为77、78、80和82。
1.3.3 RNA提取、测序和分析
取酵母发酵液2 mL,4 ℃、6 000 r/min离心10 min,用TRIzol试剂盒提取其总RNA,送北京诺禾致源生物信息科技有限公司进行cDNA文库构建和转录组测序。用Trinity软件[9]将测序获得的转录组Raw序列滤过得到Clean序列,再组装为Unigene序列;用HTSeq方法对基因的表达量进行FPKM(fragments per kilobase of transcript per million fragments mapped)定量[10];利用DESeq2方法[11]对比分析不同组酵母的基因表达量,以差异倍数变化超过2倍(|log2FC|>1)且错误发现率(false discovery rate,FDR)<0.01为标准,筛选果糖发酵组和葡萄糖发酵组之间的显著DEGs;再将DEGs比对到GO数据库和KEGG数据库,进行DEGs的GO功能和KEGG代谢通路富集[12-13],进一步注解参与果糖代谢、硒复合物合成代谢的关键酶基因。
2 结果与分析
2.1 果糖浓度对多形汉逊酵母生长和Se-Met产量的影响
将H.polymorpha种子液接种含不同浓度果糖的富硒培养基中进行发酵,结果如图1所示:在0~100g/L内随着果糖质量浓度增加,酵母生长和酵母细胞胞内Se-Met含量呈上升趋势,而当果糖质量浓度>120 g/L时,可能由于渗透压过高,对H.polymorpha生长产生抑制作用,导致其胞内Se-Met产量降低;发酵培养0~12 h时,各果糖浓度组的酵母DCW与Se-Met含量无显著差异;发酵24~48 h,80和100 g/L果糖质量浓度组的酵母DCW、Se-Met产量迅速增加,发酵48 h达到最高,随后可能由于营养消耗和代谢废物积累等因素导致DCW、Se-Met增速减缓,甚至略有下降。
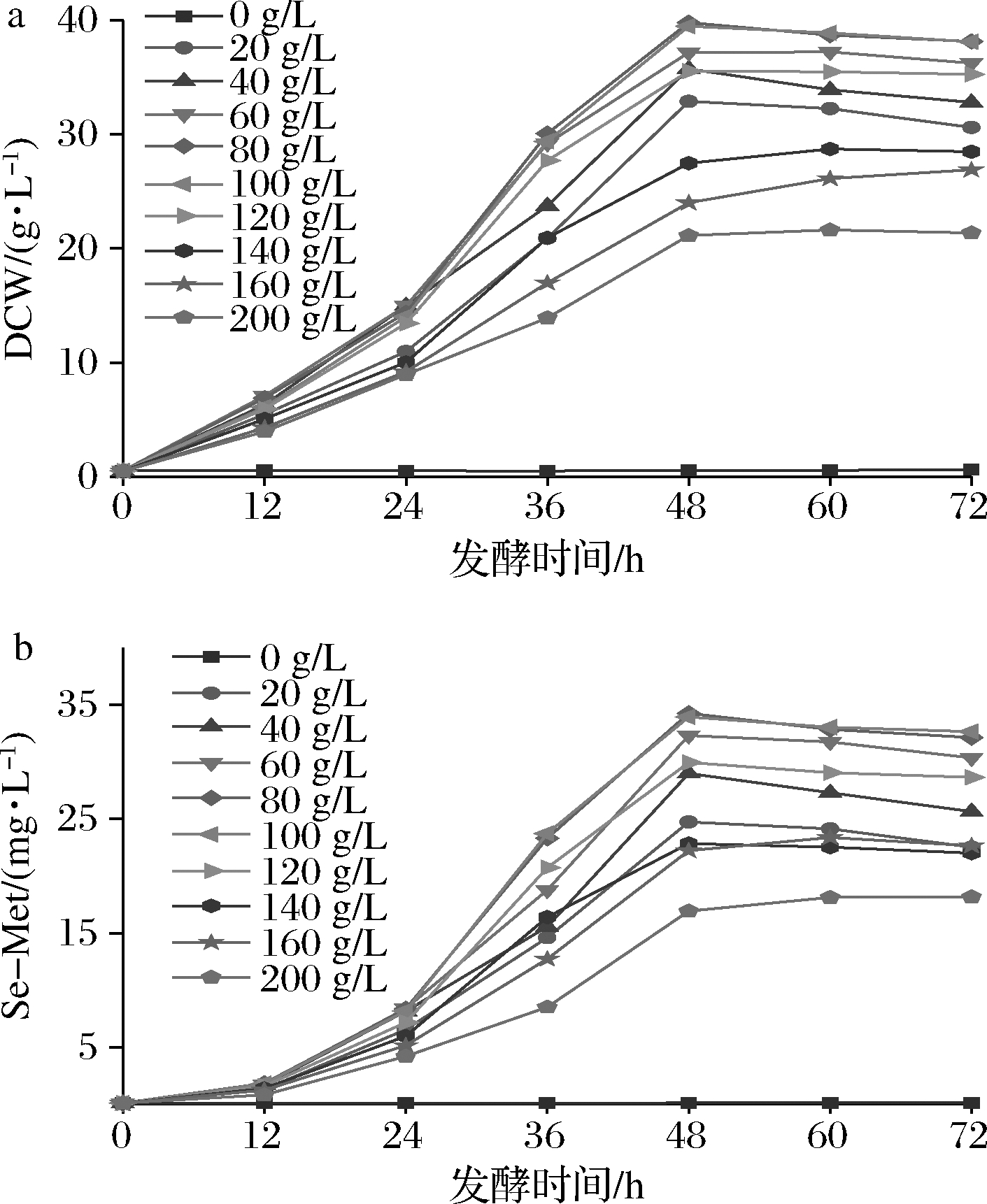
a-酵母DCW;b-酵母胞内Se-Met产量
图1 果糖浓度对多形汉逊酵母DCW和Se-Met产量的影响
Fig.1 Effects of fructose on DCW and Se-Met yield of H.polymorpha
2.2 果糖和葡萄糖对酵母生长和Se-Met含量的影响
分别以葡萄糖为碳源作为对照组,果糖为碳源作为试验组,发酵培养48 h时,80 g/L的葡萄糖组酵母的DCW最高,为(44.13±0.38)g/L;80 g/L果糖组酵母胞内Se-Met产量和含量分别为(34.27±0.39)mg/L和(0.87±0.04)mg/g,均高于80 g/L葡萄糖组的(34.13±0.72)mg/L和(0.77±0.01)mg/g。结果表明在浓度相同条件下,葡萄糖有利于促进酵母细胞生长,而果糖有利于酵母细胞中Se-Met的合成和积累。80与100 g/L果糖组酵母的DCW、Se-Met产量和含量无明显差异,从生产成本综合考虑,优选80 g/L果糖作为发酵碳源浓度。
表1 果糖和葡萄糖对多形汉逊酵母的DCW和Se-Met的影响
Table 1 Effects of fructose and glucose on DCW and Se-Met levels of H.polymorpha

葡萄糖果糖80 g/L0 g/L40 g/L60 g/L80 g/L100 g/L120 g/L140 g/L酵母DCW/(g·L-1)44.13±0.380.55±0.0235.75±0.2537.18±0.2139.81±0.19∗39.50±0.3835.55±0.3027.48±0.36Se-Met产量/(mg·L-1)34.13±0.720.11±0.0129.00±0.1632.33±0.2234.27±0.3933.98±0.2129.95±0.3722.86±0.37Se-Met含量/(mg·g-1)0.77±0.010.2±0.010.81±0.020.86±0.060.87±0.04∗0.87±0.050.85±0.040.83±0.02
注:*P <0.05,显著差异
2.3 转录组测序数据质量评估
分别取80 g/L葡萄糖发酵组(Glu组)和80 g/L果糖发酵组(Fru组)发酵48 h的培养液,提取总RNA并进行转录组测序。利用Fast QC法分析测序质量,结果如表2所示,Glu组获得44 086 312和44 232 706个Clean reads,Fru组得到42 454 102和42 354 868个Clean reads,4个样本转录组的Q30(0.1%碱基识别错误率)最小值为95.96%,表明转录组测序数据质量较高。将4个样本Clean reads与Unigene序列进行比对,结果匹配率为84.21%~85.80%,表明测序样本未受到污染。
表2 多形汉逊酵母的转录组测序质量分析
Table 2 Quality statistics of transcriptome of H.polymorpha
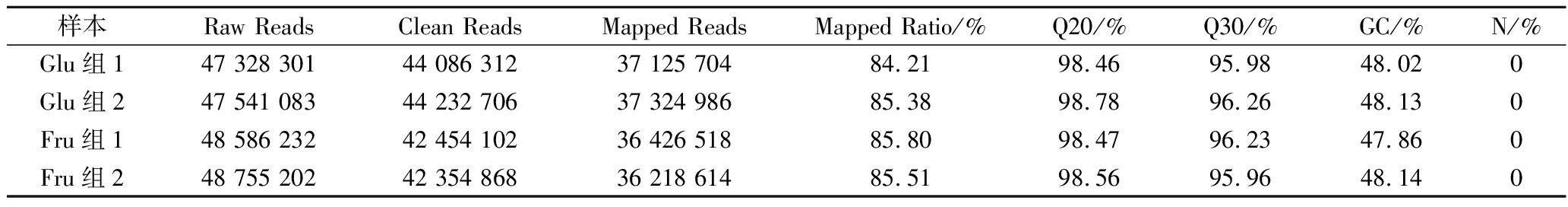
样本Raw ReadsClean Reads Mapped ReadsMapped Ratio/%Q20/%Q30/%GC/%N/%Glu组147 328 30144 086 31237 125 70484.2198.4695.9848.020Glu组247 541 08344 232 70637 324 98685.3898.7896.2648.130Fru组148 586 23242 454 10236 426 51885.8098.4796.2347.860Fru组248 755 20242 354 86836 218 61485.5198.5695.9648.140
2.4 果糖与葡萄糖发酵组间的DEGs
用FPKM计算各基因表达量,以|lg2FC|>1且FDR<0.01作为标准,结果Fru组与Glu组之间有221个DEGs,其中80个DEGs表达显著上调,141个DEGs表达显著下调(图2),表明果糖和葡萄糖对多形汉逊酵母的基因转录调控存在着显著差别。
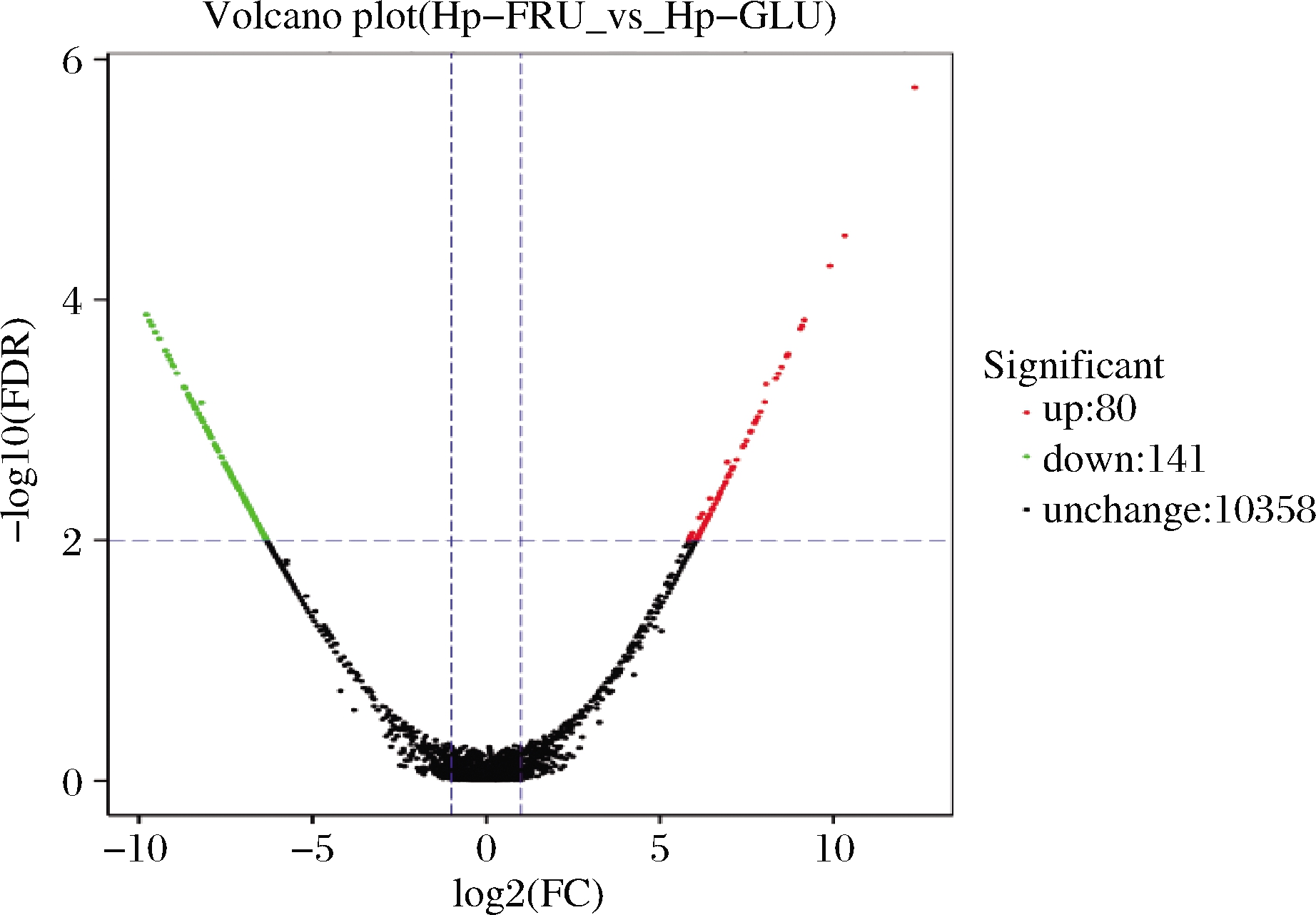
图2 果糖发酵组和葡萄糖发酵组之间的显著差异表达基因
Fig.2 DEGs between the Fru group and the Glu group
2.5 果糖与葡萄糖发酵组间DEGs的GO富集分析
将Fru组和Glu组之间的221个DEGs进行GO数据库比对,共计130个DEGs获得GO功能注释,其中21个DEGs富集在9个生物过程中;17个DEGs富集在11个细胞组分中;92个DEGs富集在10个分子功能中。其中富集最显著的30个GO term包括了3个分子功能、7个细胞组分和20个生物过程,主要涉及蛋氨酸生物合成(2个DEGs)、同型半胱氨酸S-甲基转移酶活性(2个DEGs)、糖酵解(3个DEGs)、戊糖磷酸支路(1个DEGs)、氧化还原反应(24个DEGs)、谷氨酸生物合成(2个DEGs)和电子传递链(2个DEGs)等(图3-a)。
2.6 果糖与葡萄糖发酵组间DEGs的KEGG代谢通路富集分析
将Fru组和Glu组之间的221个DEGs比对到KEGG数据库,共计108个DEGs被KEGG数据库注释到52条代谢途径中,包括5条细胞过程通路、1条环境信息处理、8条遗传信息处理和38条代谢通路。其中富集最显著的30条通路包括4条细胞过程、5条遗传信息和21条代谢通路,涉及过氧化物酶体(4个DEGs)、酵母减数分裂(4个DEGs)和内吞作用(2个DEGs)等与酵母细胞的抗氧化、生长繁殖、硒摄入有关通路;糖酵解/糖异生(6个DEGs)、戊糖磷酸途径(4个DEGs)、果糖和甘露糖代谢(3个DEGs)和N-聚糖生物合成(1个DEGs)等参与调节胞内果糖的转化和代谢的通路;半胱氨酸和蛋氨酸代谢(5个DEGs)、硒复合物代谢(2个DEGs)和谷胱甘肽代谢(1个DEGs)等参与硒代氨基酸、硒蛋白和谷胱甘肽的代谢通路(图3-b)。
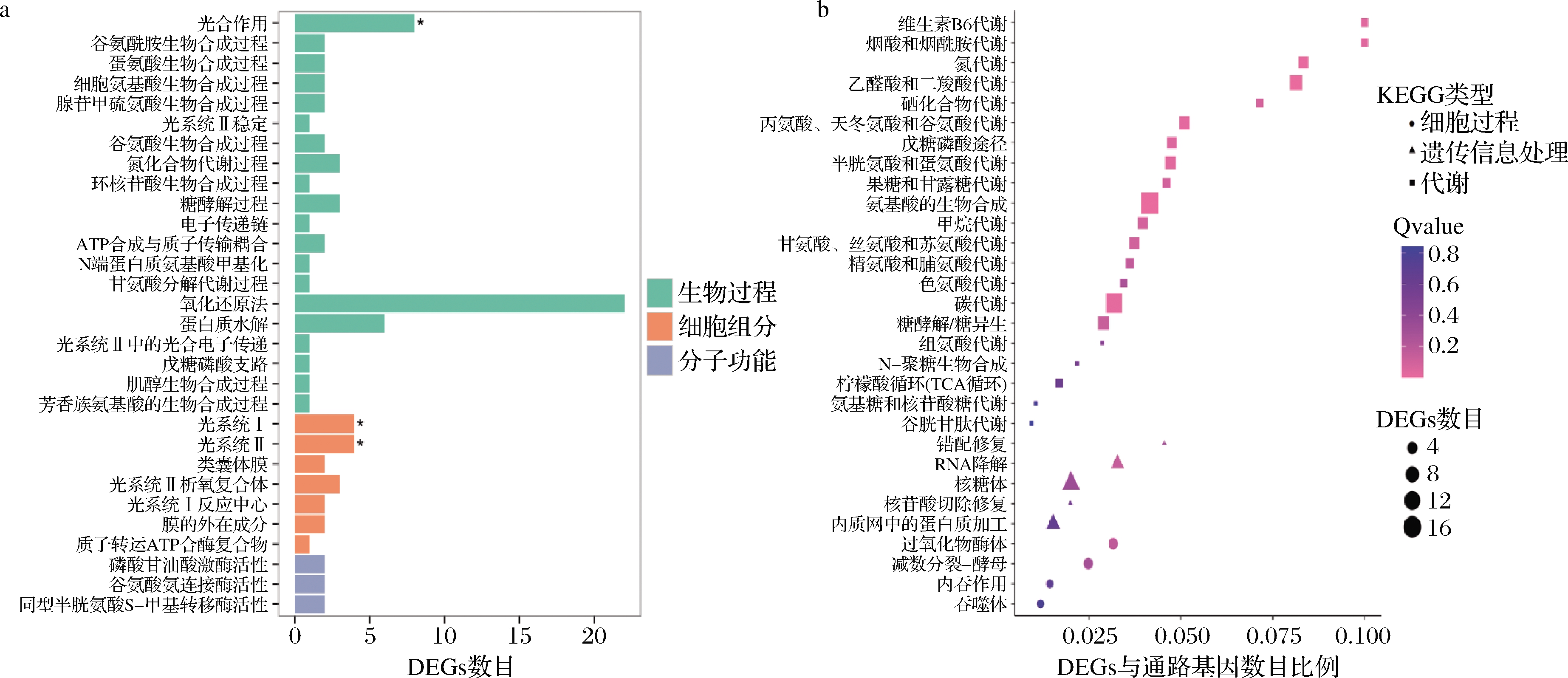
a-GO term;b-KEGG代谢通路
图3 果糖与葡萄糖发酵组间DEGs的GO term和KEGG代谢通路富集分析
Fig.3 Analysis of enriched GO terms and KEGG pathways of DEGs between the Fru group and the Glu group
2.7 与果糖代谢和硒代谢相关的DEGs
分析Fru组和Glu组之间的DEGs图谱,表明在Fru组中,酵母中ECU01(EC:4.1.2.13)和MPG1(EC:2.7.7.13)显著上调,而FBP1(EC:3.1.3.11)、GAPDH1(EC:1.2.1.12)、PGK(EC:2.7.2.3)显著下调。其中,EC:4.1.2.13催化1,6-二磷酸果糖与3-磷酸甘油醛之间的转换频率[14],EC:3.1.3.11催化1,6-二磷酸果糖转化为6-磷酸果糖[15-16],EC:1.2.1.12和EC:2.7.2.3是参与催化糖酵解的关键酶[15,17],EC:2.7.7.13催化1-磷酸甘露糖转化为GDP-甘露糖和甘露聚糖的合成[18]。这些酶基因表达量的改变,可能下调果糖进入糖酵解和磷酸戊糖通路的比例,促进果糖转化甘露糖和甘露聚糖,而作为细胞壁主要组分的甘露聚糖有利于硒的吸附和吸收[18]。此外,Fru组酵母中SAM1(EC:2.5.1.6)下调,MET6(EC:2.1.1.14)上调,有利于抑制L-蛋氨酸合成S-腺苷蛋氨酸,促进上游同型半胱氨酸积累,并依次催化硒半胱氨酸转化为硒胱硫醚、硒同型半胱氨酸,最后合成硒代蛋氨酸[19-20];Fru组酵母中GLT1(EC:1.4.1.13、EC:1.4.1.14)表达下调,GND1(EC:1.1.1.44)上调,有助于抑制胞内谷胱甘肽酶解为谷氨酸、甘氨酸和乙酰CoA,促进谷胱甘肽在细胞内积累;并维持谷胱甘肽的还原态[21-22],提高细胞的抗氧化能力(表3)。
表3 与果糖代谢和硒代谢相关的差异表达基因
Table 3 DEGs involved in fructose and selenium metabolism in H.polymorpha

基因名称酶编号KEGG注释lg2FCFDRGDHAEC:1.4.1.4glutamate dehydrogenase(NADP+) 7.007 50.002 8MPG1EC:2.7.7.13mannose-1-phosphate guanylyltransferase 6.847 10.003 5GND1EC:1.1.1.446-phosphogluconate dehydrogenase 6.181 30.008 4ECU01EC:4.1.2.13fructose-bisphosphate aldolase,class I 6.142 30.008 9MET6EC:2.1.1.14homocysteine methyltransferase 5.854 20.009 8GLT1EC:1.4.1.13、EC:1.4.1.14glutamate synthase(NADPH/NADH) -6.662 10.006 7FBP1EC:3.1.3.11fructose-1,6-bisphosphatase I -6.735 40.006 1PGKEC:2.7.2.3phosphoglycerate kinase -7.315 80.003 0SAM1EC:2.5.1.6S-adenosylmethionine synthetase -7.423 20.002 7GAPDH1EC:1.2.1.12glyceraldehyde 3-phosphate dehydrogenase -8.366 20.000 8
3 结论与讨论
硒是维持人体正常生命活动的必需元素,是人和动物体内谷胱甘肽过氧化物酶活性中心的必需基团,具有抗氧化、抗衰老、抗肿瘤等多种生物功能。通过微生物富集硒元素的富硒酵母不仅活性硒含量高,而且富含谷胱甘肽、蛋白质和维生素,是一种很好的硒补充剂[1-3,23]。
本文考察了多形汉逊酵母在含有不同浓度果糖和葡萄糖的富硒培养基中的生长和Se-Met产量变化,发现与相同浓度葡萄糖发酵组相比,80 g/L果糖组酵母细胞产量略低,但其胞内Se-Met含量较高,表明葡萄糖有利于多形汉逊酵母的生长,而果糖有利于硒的吸收和Se-Met等硒复合物的合成和积累[24]。MARINESCU等[25]用果葡糖浆[m(果糖)∶m(葡萄糖)=55∶45]作为碳源,并添加30~180 mg/L Na2SeO3进行发酵,发现有机硒含量达到625.81~2 215.67 mg/g,提示可以通过优化碳源中果糖与葡萄糖比例和含量,进一步提高酵母有机硒的转化率。
本研究采用Illumina HiSeq 2000平台对果糖发酵组与葡萄糖发酵组之间的转录组数据进行对比分析,筛选出221个DEGs,进一步KEGG富集分析表明这些DEGs主要在糖酵解、果糖和甘露糖代谢、谷氨酸、半胱氨酸和蛋氨酸代谢、硒复合物代谢和谷胱甘肽代谢、氧化还原通路中显著富集。其中MPG1(EC:2.7.7.13)、同型MET6(EC:2.1.1.14)和GND1(EC:1.1.1.44)在果糖发酵组中显著上调,为催化合成细胞壁甘露聚糖,促进硒的吸附和吸收[18],催化硒半胱氨酸转化合成硒代蛋氨酸和维持为谷胱甘肽的还原态[21],提高细胞的抗氧化能力提供酶促动力。
本研究部分解析了果糖对多形汉逊酵母菌硒代谢及其转录调控机制的影响,为进一步优化酵母富硒发酵工艺和分子育种提供一定的参考数据。
[1] CONSTANTINESCU-ARUXANDEI D,FR NCU
NCU ![]() L,et al.Selenium analysis and speciation in dietary supplements based on next-generation selenium ingredients[J].Nutrients,2018,10(10):1466.
L,et al.Selenium analysis and speciation in dietary supplements based on next-generation selenium ingredients[J].Nutrients,2018,10(10):1466.
[2] KIELISZEK ![]() S.Selenium:Significance,and outlook for supplementation[J].Nutrition,2013,29(5):713-718.
S.Selenium:Significance,and outlook for supplementation[J].Nutrition,2013,29(5):713-718.
[3] KIELISZEK M.Selenium-fascinating microelement,properties and sources in food[J].Molecules,2019,24(7):1 298.
[4] GEORGE A.How bad is fructose?[J].The American Journal of Clinical Nutrition,2007,86(4):895-896.
[5] 康毅,刘树文,骆艳娥,等.不同发酵条件对酿酒酵母甘油产量的影响[J].食品科学,2012,(17):179-183.
KANG Y,LIU S W,LUO Y,et al.Effects of different fermentation conditions on glycerol production of Saccharomyces cerevisiae[J].Food Science,2012,(17):179-183.
[6] DANCH A,CHMIELOVSKI J.Cell selenium bioaccumulation Saccharomyces cerevisiae[J].Acta Biologica Silesiana,1985,18:57-64.
[7] 谢倩,李建洪,黄文耀,等.HPLC-ICP-MS测定硒蛋白中硒代氨基酸的方法[J].中国卫生检验杂志,2015,25(5):636-638;641.
XIE Q,LI J H,HUANG W Y,et al.Determination of seleno amino acids in selenoprotein by HPLC-ICP-MS[J].Chinese Journal of Health Laboratong Technology,2015,25(5):636-638;641.
[8] DA SILVA E G,VEROLA MATAVELI L R,ZEZZI ARRUDA M A.Speciation analysis of selenium in plankton,Brazil nut and human urine samples by HPLC-ICP-MS[J].Talanta,2013,110(7):53-57.
[9] HAAS B J,PAPANICOLAOU A,YASSOUR M,et al.De novo transcript sequence reconstruction from RNA-seq using the Trinity platform for reference generation and analysis[J].Nature Protocols,2013,8(8):1 494-1 512.
[10] ANDERS S,PYL P T,HUBER W.HTSeq-a Python framework to work with high-throughput sequencing data[J].Bioinformatics,2015,31(2):166-169.
[11] LOVE M I,HUBER W,ANDERS S.Moderated estimation of fold change and dispersion for RNA-seq data with DESeq2[J].Genome Biology,2014,15(12):550.
[12] CONESA A,GÖTZ S,GARC A-G
A-G MEZ J M,et al.Blast2GO:A universal tool for annotation,visualization and analysis in functional genomics research[J].Bioinformatics(Oxford,England),2005,21(18):3 674-3 676.
MEZ J M,et al.Blast2GO:A universal tool for annotation,visualization and analysis in functional genomics research[J].Bioinformatics(Oxford,England),2005,21(18):3 674-3 676.
[13] MORIYA Y,ITOH M,OKUDA S,et al.KAAS:An automatic genome annotation and pathway reconstruction server[J].Nucleic Acids Research,2007,35(2):182-185.
[14] DALBY A R,TOLAN D R,LITTLECHILD J A.The structure of human liver fructose-1,6-bisphosphate aldolase[J].Acta Crystallographica.Section D,Biological Crystallography,2001,57(Pt 11):1 526-1 533.
[15] GIARDINA B J,CHIANG H L.Fructose-1,6-bisphosphatase,malate dehydrogenase,isocitrate lyase,phosphoenolpyruvate carboxykinase,glyceraldehyde-3-phosphate dehydrogenase,and cyclophilin a are secreted in Saccharomyces cerevisiae grown in low glucose[J].Communicative & Integrative Biology,2013,6(6):e27216.
[16] BELINCH N M M,GANCEDO J M.Glucose controls multiple processes in Saccharomyces cerevisiae through diverse combinations of signaling pathways[J].FEMS Yeast Research,2007,7(6):808-818.
N M M,GANCEDO J M.Glucose controls multiple processes in Saccharomyces cerevisiae through diverse combinations of signaling pathways[J].FEMS Yeast Research,2007,7(6):808-818.
[17] YIN Z K,HATTON L,BROWN A J P.Differential post-transcriptional regulation of yeast mRNAs in response to high and low glucose concentrations[J].Molecular Microbiology,2000,35(3):553-565.
[18] ORLEAN P.Architecture and biosynthesis of the Saccharomyces cerevisiae cell wall[J].Genetics,2012,192(3):775-818.
[19] SAHU U,RAJENDRA V K H,KAPNOOR S S,et al.Methionine synthase is localized to the nucleus in Pichia pastoris and Candida albicans and to the cytoplasm in Saccharomyces cerevisiae[J].Journal of Biological Chemistry,2017,292(36):14 730-14 746.
[20] XU X M,MIX H,CARLSON B A,et al.Evidence for direct roles of two additional factors,SECp43 and soluble liver antigen,in the selenoprotein synthesis machinery[J].Journal of Biological Chemistry,2005,280(50):41 568-41 575.
[21] WANG D H,ZHANG J L,DONG Y Y,et al.Glutathione is involved in physiological response of Candida utilis to acid stress[J].Applied Microbiology and Biotechnology,2015,99(24):10 669-10 679.
[22] MARGALEF-CATAL M,ARAQUE I,BORDONS A,et al.Genetic and transcriptional study of glutathione metabolism in Oenococcus oeni[J].International Journal of Food Microbiology,2017,242(2):61-69.
M,ARAQUE I,BORDONS A,et al.Genetic and transcriptional study of glutathione metabolism in Oenococcus oeni[J].International Journal of Food Microbiology,2017,242(2):61-69.
[23] 王婷,刘婵婵,任娟,等.亚硒酸钠促进多形汉逊酵母DL-1合成谷胱甘肽的转录组学分析[J].食品科学,2021,42(6):193-199.
WANG T,LIU C C,REN J,et al.Transcriptome analysis of Hansenula polymorpha DL-1 with sodium selenite-induced biosynthesis and accumulation of glutathione[J].Food Science,2021,42(6):193-199.
[24] ROSEN B P,LIU Z J.Transport pathways for arsenic and selenium:A minireview[J].Environment International,2009,35(3):512-515.
[25] MARINESCU G,STOICESCU A G,TEODOROF L.Industrial nutrient medium use for yeast selenium preparation[J].Food Technology,2011,35(1):45-53.