在主要的过敏食物中,贝类、鱼、花生和坚果更有可能引发危及生命的全身过敏反应[1]。贝类过敏在西方国家中很常见,且逐渐在亚洲部分地区的儿童和成人中变得普遍[2]。目前已发现6种贝类过敏原,包括原肌球蛋白、肌浆钙结合蛋白、精氨酸激酶、磷酸丙糖异构酶、肌浆蛋白轻链和肌钙蛋白[3-7]。抗原首次进入机体后会诱导B细胞产生免疫球蛋白E(immunoglobulin E,IgE)抗体,IgE与肥大细胞表面的FcεR I受体结合,使机体处于致敏状态。当机体再次暴露于相同抗原时,致敏细胞上的IgE会与其结合并导致肥大细胞脱颗粒,释放组胺、类花生酸、蛋白酶和其他趋化和促炎细胞因子等炎症介质,这些介质会募集白细胞,同时引起平滑肌收缩、血管扩张、黏液高分泌和血管通透性增加等生理病理学变化,这也是过敏症状的发病机制[8-9]。有证据表明,牡蛎的摄入、皮肤和黏膜接触以及雾化牡蛎蛋白的吸入可导致患者出现多种临床症状[10-12],而牡蛎中的精氨酸激酶(arginine kinase,AK)也被验证为过敏原。
过敏原致敏性可以通过比较序列同源性、IgE结合、血清检测、消化率和稳定性来评估,目前虾、蟹等过敏原的研究主要集中在这些方向,但合适的动物模型能更直接地确定蛋白质的过敏反应[13],但至今未见牡蛎AK动物致敏模型的相关报道。过敏食物评价的常用动物模型有BALB/c小鼠、棕色挪威大鼠、豚鼠等,BALB/c小鼠体积小,繁殖周期短,过敏原刺激后偏向Th2型细胞应答且可以产生高效价的IgE,所以选择该品系小鼠为IgE介导过敏反应的研究对象[14-15]。小鼠的给药途径包括口服灌胃、腹腔注射和表皮致敏,口服灌胃能更好地模拟人体经口摄入食物过敏原的实际情况,不过容易诱导免疫耐受。研究发现霍乱毒素会使IL-4、IL-5显著上升,而IL-2、IFN-γ基本无变化,并且能选择性发生以Th2为主的过敏反应,所以将它作为黏膜佐剂可有效克服耐受现象[16]。综上所述,本实验利用提取纯化的牡蛎AK和无毒的霍乱毒素B亚基(cholera toxin B subunit,CTB)致敏雌性BALB/c小鼠,通过观察BALB/c小鼠的全身主动过敏反应及体重,测定其血清中总IgE(tIgE)、特异性IgE(sIgE)水平和血浆中血项含量的变化,对空肠、肝脏、脾脏和肾脏进行苏木精-伊红(hematoxylin-eosin,HE)染色后观察病理变化,对空肠进行甲苯胺蓝染色来观察肥大细胞脱颗粒情况,初步建立牡蛎AK BALB/c小鼠过敏模型,为理解贝类过敏的有关免疫机制和研发预防及治疗食物过敏的药物及治疗策略提供有价值的依据。
1 材料与方法
1.1 实验材料
雌性BALB/c小鼠,6周龄,30只,维通利华动物公司,许可证号为SYXK(京)2017-0033;牡蛎AK经过提取纯化获得;小鼠IgE酶联免疫试剂盒,上海酶联生物科技有限公司;HRP标记的山羊抗小鼠IgE、抗凝剂EDTA-K2、TMB显色液、重组霍乱毒素B亚基,碧云天公司。以下所有实验得到中国食品发酵工业研究院福利伦理委员会的批准(批准文号:2019—0002)。
1.2 实验方法
1.2.1 BALB/c小鼠的致敏
雌性BALB/c小鼠适应1周后将其随机分为实验组(20只)和PBS对照组(10只),致敏前取血作为阴性血清。使用口服灌胃与腹腔注射牡蛎AK两种方式对实验组小鼠进行致敏(如图1):在第0、8、16、24、32、40天,实验组每只灌胃含有10 μg CTB及600 μg AK的200 μL PBS进行致敏;在第4、12、20、28、36天腹腔注射200 μL相同剂量的AK和CTB。在第45天用6 mg/mL的AK(200 μL)分别进行灌胃和腹腔注射激发。对照组灌胃等体积PBS(pH 7.4),步骤相同。分别于第16、28、36、40、45天内取血,离心收集血清,用于检测tIgE、sIgE;同时于第16、36、45天取血于7.5% EDTA-K2抗凝管中,离心收集血浆并冷冻于-80 ℃,用于测定血项水平的变化。
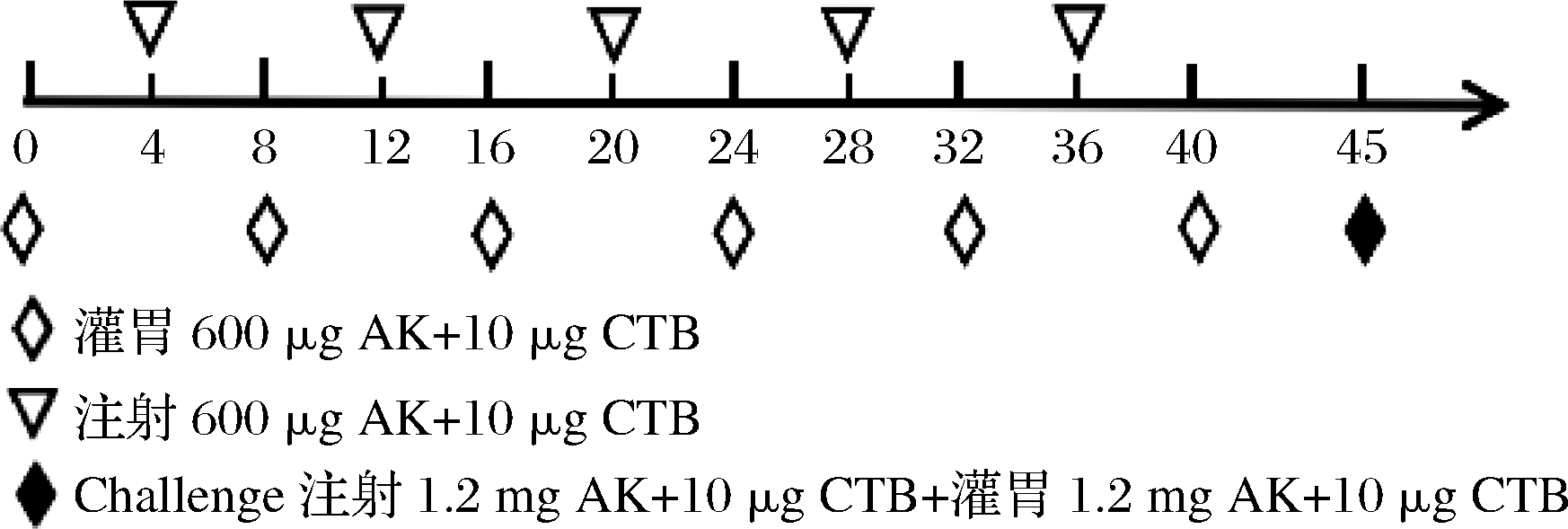
图1 BALB/c小鼠的致敏流程
Fig.1 Sensitization procedure of BALB/c mice
1.2.2 BALB/c小鼠的全身主动过敏反应评估
在第45天通过灌胃和腹腔注射高浓度牡蛎AK进行激发,激发后20~60 min进行体温测量,仔细察看小鼠全身过敏反应现象,同时根据过敏评分表(表1)确定其表型过敏级数[17-18]。
表1 过敏反应级数
Table 1 Allergy reaction grade

过敏症状分级级数无任何症状-0反复抓挠鼻,耳,头周围以及腹部±1除上述表现外,眼口周围浮肿,毛发竖立、活动减少、呼吸急促、腹泻等+2除上述表现外,喘息、眼、口或尾巴周围发绀、侧卧等++3除上述表现外,对刺激无反应或震颤、抽搐+++4除上述表现外,最终死亡++++5
平均过敏级数达到2级即确定发生表型过敏反应。平均反应级数和过敏率按公式(1)(2)计算:
(1)
(2)
式中:![]() 平均过敏级数;Ad,过敏级数;RA,过敏率,%;n,过敏动物数量;N,总动物数量。
平均过敏级数;Ad,过敏级数;RA,过敏率,%;n,过敏动物数量;N,总动物数量。
1.2.3 BALB/c小鼠体重和血项指标变化
致敏期间每2周称体重,计算平均体重。第16、36、45天分别取血于含有抗凝剂EDTA-K2的抗凝管中,使用血细胞分析仪对血浆中白细胞、中性粒细胞和嗜酸性细胞这3种血项指标进行计数。
1.2.4 tIgE、sIgE水平的检测
利用间接酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)测量BALB/c小鼠血清中sIgE,用质量浓度为50 μg/mL的牡蛎AK包被96孔板,4 ℃孵育过夜;添加300 μL/孔的5%脱脂奶粉(质量分数,下同)37 ℃封闭1 h;再取100 μL 2%脱脂奶粉稀释的BALB/c小鼠血清(1∶5)加入孔中,室温下孵育3 h;每孔添加100 μL HRP标记的山羊抗小鼠IgE(1∶2 000),37 ℃孵育1 h;用200 μL TMB避光孵育20 min,然后添加50 μL 2 mol/L的H2SO4溶液终止反应,用酶标仪于450 nm测量OD值。每两步之间都用PBST洗涤4次,所有实验均重复3次。使用ELISA试剂盒对BALB/c小鼠血清tIgE水平进行测定。
1.2.5 BALB/c小鼠脏器、肠道病理学分析
第45天激发采血后,处死小鼠,取其空肠、肝脏、脾脏、肾脏,放入10%的多聚甲醛固定后修剪;用不同浓度梯度的乙醇进行脱水处理,石蜡包埋后切片并进行HE染色,用显微镜观察组织形态;空肠甲苯胺蓝染色后观察其肥大细胞脱颗粒现象。
1.2.6 统计学分析
使用统计软件SPSS及OriginPro 8.0处理实验数据,组间检验采用t检验,P<0.01差异极显著(用**表示);P<0.05差异显著(用*表示)。
2 结果与分析
2.1 BALB/c小鼠的全身主动过敏反应结果
第45天口服激发30 min后,实验组表现出0~4级过敏症状(图2),其中有7只BALB/c小鼠不断对鼻子、耳朵、头周围及腹部进行抓挠,有5只眼或口周围出现浮肿且毛发竖立;4只经常喘息、侧卧,有3只对外界刺激反应迟钝并伴有颤抖症状,仅有1只无明显症状;对照组BALB/c小鼠均未出现过敏症状。尽管小鼠在不同过敏级别的数量上存在一些差异,但![]() 表明通过灌胃和腹腔注射AK的BALB/c小鼠从表型来看发生了过敏反应,且过敏率为95%。
表明通过灌胃和腹腔注射AK的BALB/c小鼠从表型来看发生了过敏反应,且过敏率为95%。
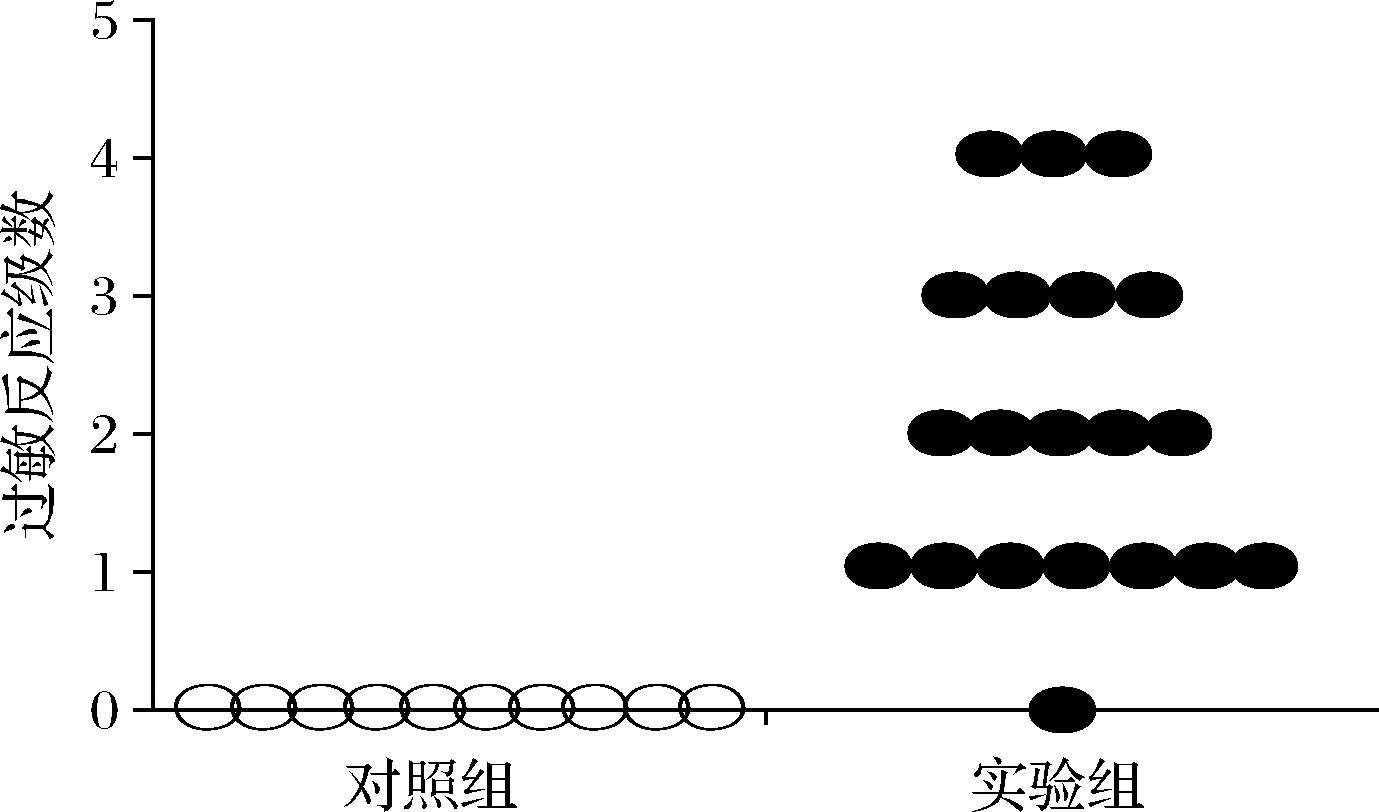
图2 BALB/c小鼠的过敏反应级数
Fig.2 Allergic reaction level of BALB/c mice
2.2 BALB/c小鼠体重和血项指标变化
2.2.1 BALB/c小鼠体重变化
体重变化情况如图3所示,所有BALB/c小鼠体重均逐渐增长,但与对照组相比,实验组体重增加缓慢。在0~14 d内差异不明显,之后实验组小鼠体重明比对照组轻,第42天两者平均体重差约0.5 g。这可能是因为过敏反应使其消化吸收系统功能紊乱,影响了小鼠的健康状态,所以体重增长趋势平缓。
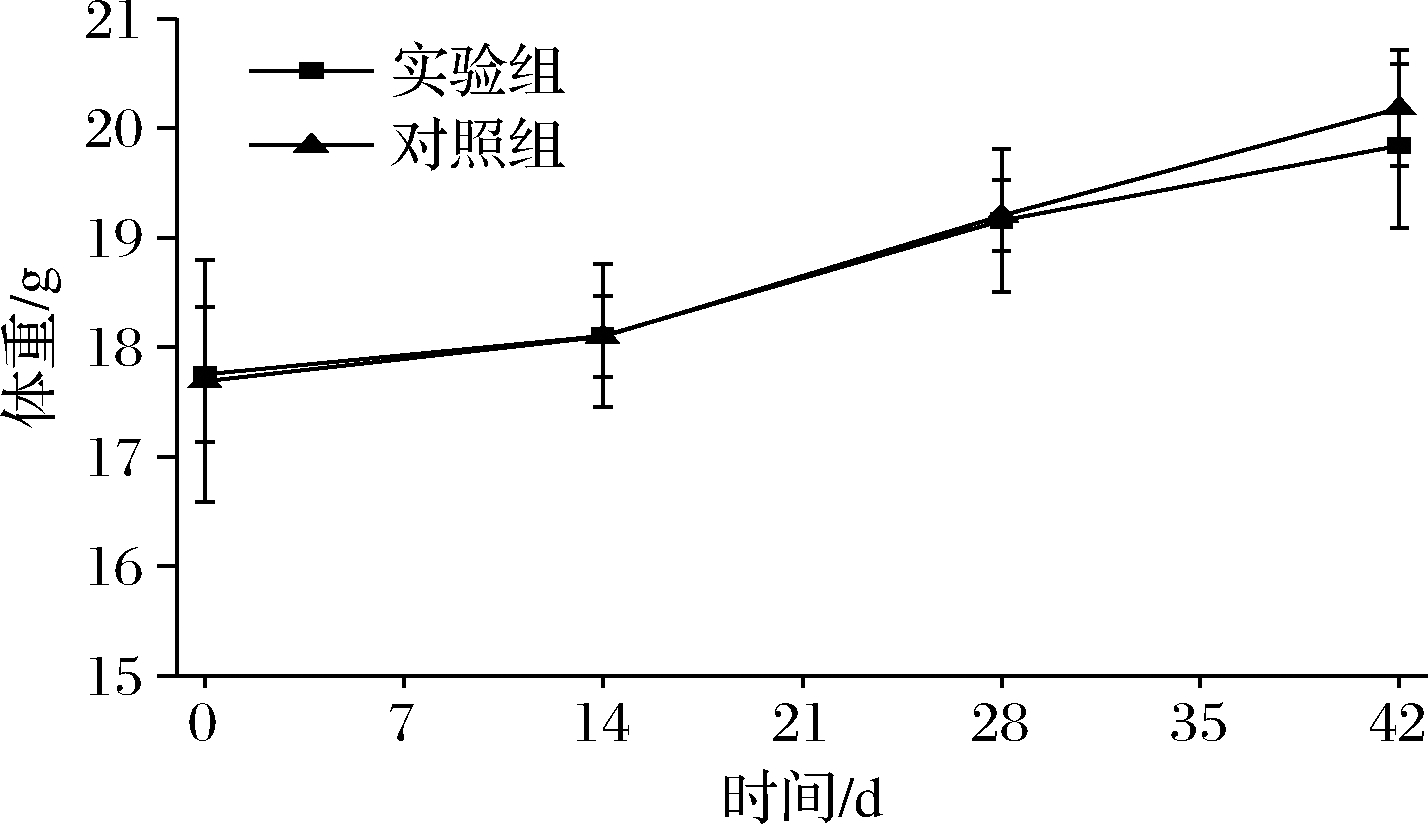
图3 BALB/c小鼠体重变化
Fig.3 Body weight changes of BALB/c mice
2.2.2 BALB/c小鼠血项指标变化情况
当同种过敏原再次进入处于致敏状态的机体时,机体内细胞会随之产生相应的应激反应,从而引起白细胞数目及分类的变化。白细胞是不均一的细胞群,按照其形态、功能和来源部位分为:粒细胞、单核细胞和淋巴细胞,粒细胞包括中性粒细胞(杆状核及分叶核)、嗜酸性粒细胞和嗜碱性粒细胞,不同类型的白细胞以不同形式在机体中发挥防卫作用[19]。从表2可知,随着致敏时间的增加,实验组小鼠白细胞数量也逐渐增加,而对照组基本无变化,在第36、45天呈现出显著性升高,这说明BALB/c小鼠在免疫期间一直处于过敏状态。实验组中性粒细胞在第45天呈现出显著差异,嗜酸性粒细胞在第36天开始呈现出极显著差异,这两种粒细胞数量整体呈增加趋势。嗜酸性粒细胞在过敏反应中具有调节作用,该细胞会释放有毒的颗粒蛋白和脂质介质,引起组织损伤和功能障碍,加剧炎症反应,但也能吞噬抗原抗体复合物[20]。这3种血项指标的变化也进一步说明了实验组BALB/c小鼠对AK产生过敏反应。
表2 BALB/c小鼠血项指标变化
Table 2 Changes in blood index of BALB/c mice
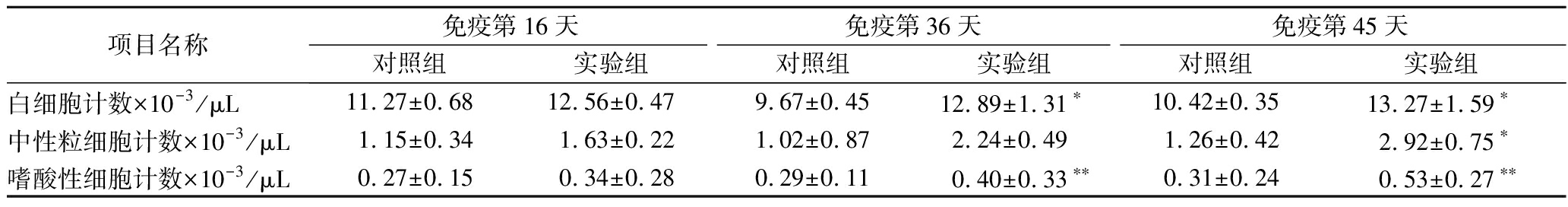
项目名称免疫第16天免疫第36天免疫第45天对照组实验组对照组实验组对照组实验组白细胞计数×10-3/μL11.27±0.6812.56±0.479.67±0.4512.89±1.31∗10.42±0.35 13.27±1.59∗中性粒细胞计数×10-3/μL1.15±0.341.63±0.221.02±0.872.24±0.491.26±0.422.92±0.75∗嗜酸性细胞计数×10-3/μL0.27±0.150.34±0.280.29±0.110.40±0.33∗∗0.31±0.240.53±0.27∗∗
2.3 血清中tIgE、sIgE的含量变化
2.3.1 血清中tIgE的含量
I型过敏机制由IgE介导,如图4所示,随着免疫时间的增加,实验组小鼠体内tIgE水平也不断升高,对照组基本维持在11 μg/mL左右。与对照组相比,第28天实验组的tIgE含量开始明显增加,之后呈上升趋势,到第45天激发后实验组血清中tIgE水平达到41.06 μg/mL,几乎是对照组的4倍。此外,与第16天比较后,实验组第45天tIgE含量表现出极显著的升高。免疫期间实验组tIgE不断增加,对照组不变,证明实验组BALB/c小鼠处于较严重的过敏状态。

图4 BALB/c小鼠血清总IgE含量
Fig.4 Total serum IgE content in BALB/c mice
2.3.2 血清中sIgE水平测定
血清中sIgE含量是评价过敏原致敏性的重要检测指标。图5显示的是BALB/c小鼠在不同阶段的血清sIgE水平变化情况,通过对血清sIgE抗体的检测,能够确定引发过敏反应的过敏原种类和致敏效果。从第16天到第45天,实验组sIgE抗体含量逐渐升高,且明显高于正常值。在激发实验后,与对照组sIgE含量相比有显著提高。因此,BALB/c小鼠的过敏反应是由牡蛎AK引起的。
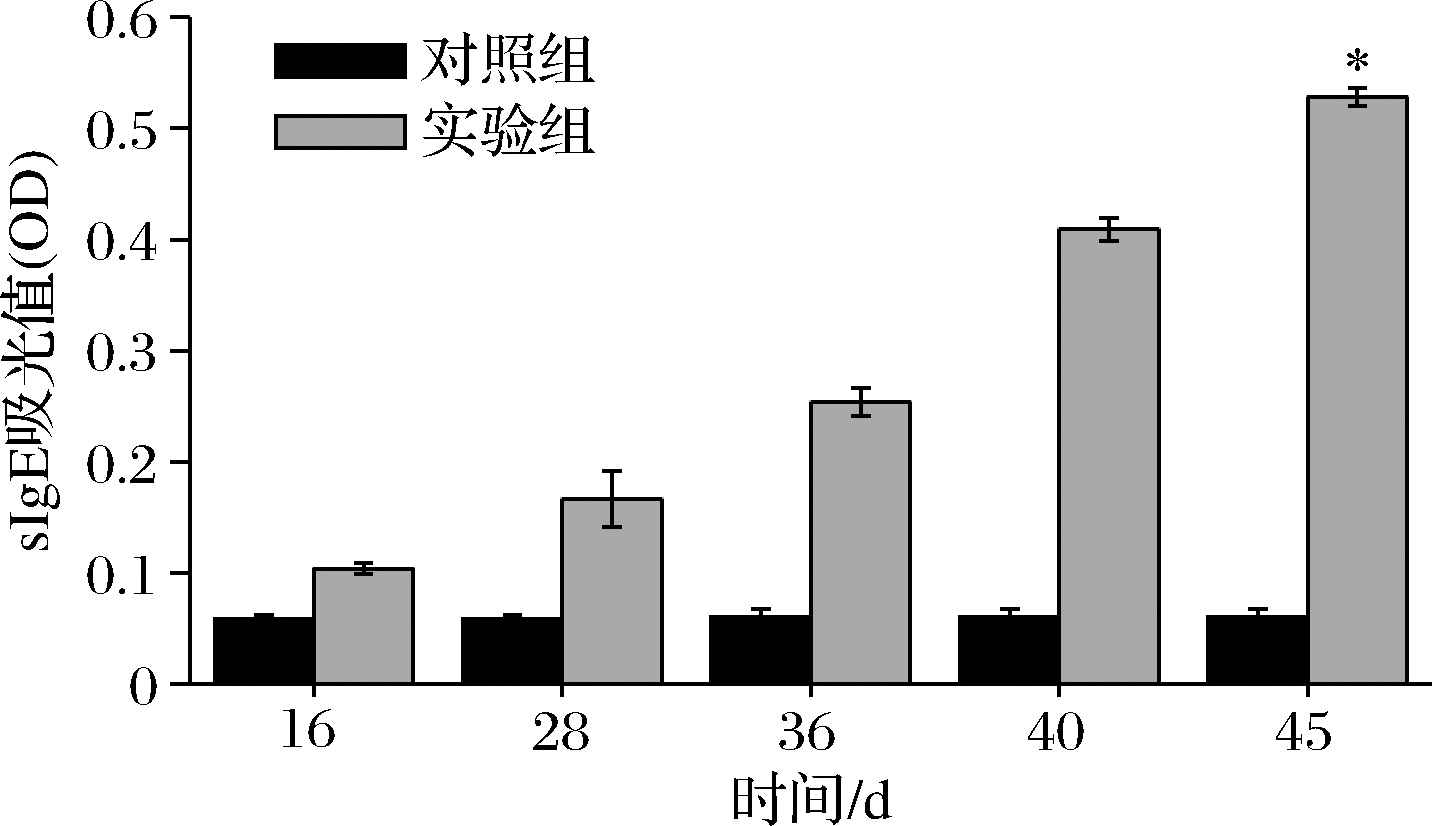
图5 BALB/c小鼠的sIgE变化
Fig.5 sIgE changes in BALB/c mice
将牡蛎过敏患者血清与BALB/c小鼠致敏血清的sIgE含量相比(图6),发现患者、小鼠的致敏血清与对照组对比后都出现极显著增加,但患者和鼠的过敏血清无显著性差异,从而成功获得其种属特异性AK致敏血清。
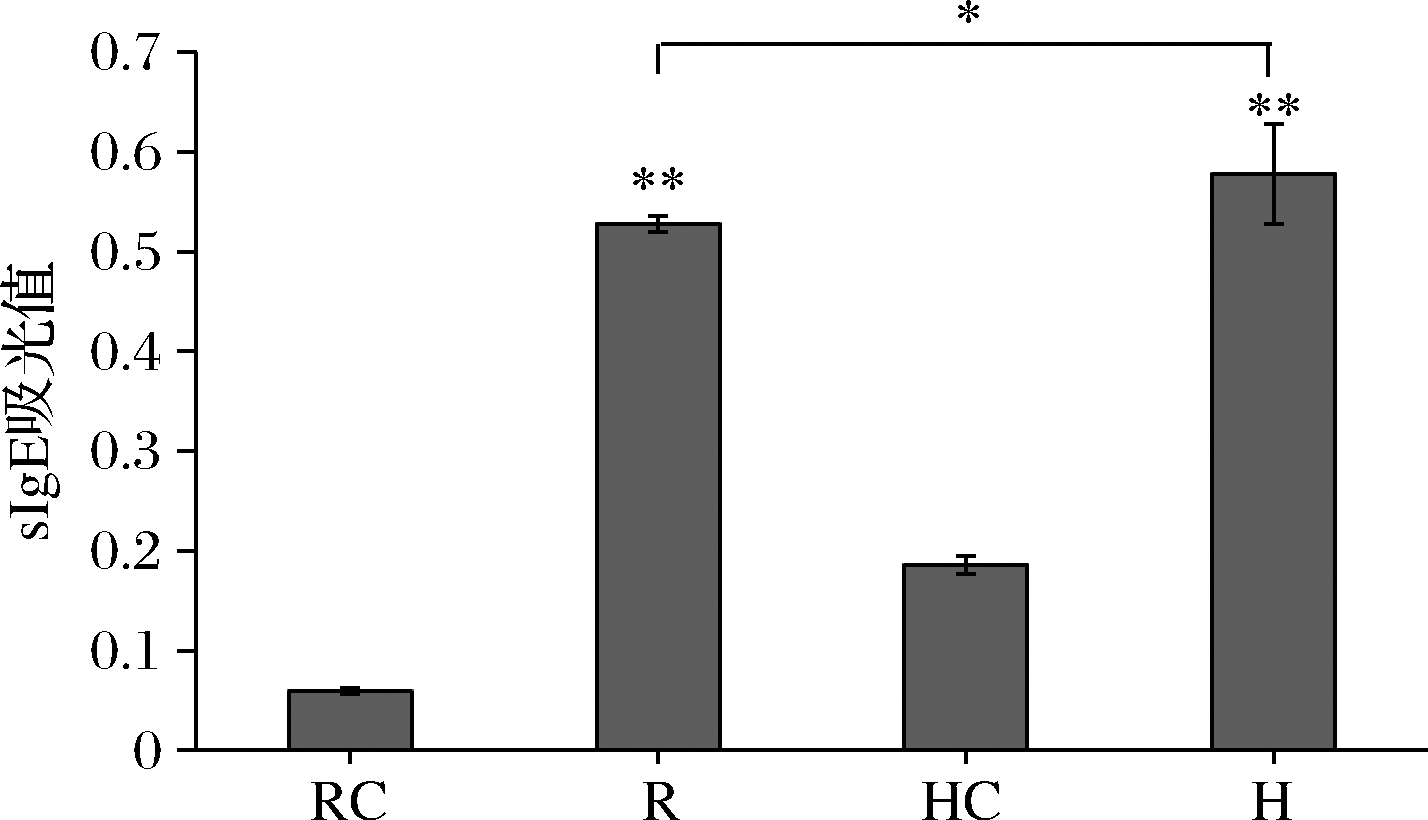
RC-对照组BALB/c小鼠血清;R-实验组BALB/c小鼠血清;HC-正常人血清;H-对牡蛎过敏的人血清
图6 人和BALB/c小鼠的sIgE比较
Fig.6 Comparison of sIgE between human and BALB/c mice
2.4 组织病理学染色分析
空肠、脾脏、肝脏、肾脏的组织切片如图7所示,对照组小鼠各脏器组织结构正常,基本无明显病理改变(图7-a1~图7-d1)。实验组肝脏中央静脉和肝窦都明显扩张充血,一些肝细胞索断开、收缩且使血液相互融合从而产生淤血带(图7-a2)。实验组肠绒毛上皮脱落、紊乱,肠黏膜间质中炎细胞局部浸润,血管充血水肿,组织疏松(图7-b2)。有研究发现,在鼠灌胃致敏模拟食物过敏中,其肠道产生过敏症状,慢性炎症导致屏障功能的调节和上皮渗透性的增加,小肠组织造成损伤,从而使肠道摄取更多的免疫完整的大分子[21]。实验组脾脏红髓部分充血,边缘窦有许多淋巴灶(图7-c2)。模型组肾脏患肾小球炎,血管球成分叶状,基底膜稍有增厚,炎症细胞增加(图7-d2)。这也许是因为过敏反应产生许多嗜酸性粒细胞,进入肾脏后使BALB/c小鼠的器官发生病变。

a-肝脏HE染色;b-空肠HE染色;c-脾脏HE染色;d-肾脏HE染色;e-空肠甲苯胺蓝染色;1-对照组;2-实验组
图7 器官HE与甲苯胺蓝染色结果
Fig.7 Results of organ HE and toluidine blue staining
空肠组织经甲苯胺蓝染色后如图7-e所示,肥大细胞颗粒呈蓝紫色,胞核为蓝色。对照组的小鼠肠道(图7-e1)固有层肥大细胞较少、胞膜完整、轮廓清晰,只有很小一部分脱颗粒,而模型组的肠(图7-e2)固有层肥大细胞增加,很多肥大细胞脱颗粒后胞膜破损、轮廓模糊。肥大细胞是I型过敏反应的重要效应细胞,IgE由B细胞受抗原刺激后分泌,肥大细胞表面的FcεR I受体能够结合IgE的Fc片段,当抗原再次入侵时,IgE的Fab片段识别和结合抗原,抗原、IgE和FcεR I之间的交联导致肥大细胞释放颗粒[22-23]。所以肥大细胞脱颗粒是过敏反应研究的主要阶段,其数量及脱颗粒情况能够良好的反映组织过敏情况。病理观察表明实验组BALB/c小鼠空肠已产生明显的过敏现象。
3 结论
由于经济全球化和人类饮食结构的改变,牡蛎引起的过敏性疾病发病率正逐渐增加,这对人们的身体健康和生活质量形成了极大的威胁。本研究利用天然牡蛎AK通过经口灌胃与腹腔注射结合并添加CTB佐剂的方式致敏BALB/c小鼠,同时从表型过敏级数、体重方面证明实验组小鼠已产生过敏反应,而且也许因为过敏反应使脏器受到损伤影响了小鼠的消化吸收,导致部分体重比对照组低,实验组血项指标均呈现升高趋势。另外,免疫期间模型组tIgE和sIgE水平也显著增多,组织病理学分析结果说明模型组脏器均出现组织损伤,空肠肥大细胞脱颗粒现象严重。本实验成功建立并分析了牡蛎AK小鼠致敏模型,获得了AK动物致敏血清,并从整体动物水平和形态学角度证明了牡蛎AK的致敏性。通过AK建立BALB/c小鼠致敏模型对研究食物过敏的致敏机制及临床上预防及治疗食物过敏具有重要的理论意义。接下来将建立细胞模型并对Th2型淋巴细胞水平及其相关细胞因子的质量浓度和通路进行详细研究。
[1] SICHERER S H,SAMPSON H A.Food allergy:Epidemiology,pathogenesis,diagnosis,and treatment[J].Journal of Allergy and Clinical Immunology,2014,133(2):291-307.e5.
[2] WILD L G,LEHRER S B.Fish and shellfish allergy[J].Current Allergy and Asthma Reports,2005,5(1):74-79.
[3] ZHANG J T,LIU W Y,ZHANG R X,et al.Hypoallergenic mutants of the major oyster allergen Cra g 1 alleviate oyster tropomyosin allergenic potency[J].International Journal of Biological Macromolecules,2020,164:1 973-1 983.
[4] PEDROSA M,BOYANO-MART NEZ T,GARC
NEZ T,GARC A-ARA C,et al.Shellfish allergy:A comprehensive review[J].Clinical Reviews in Allergy & Immunology,2015,49(2):203-216.
A-ARA C,et al.Shellfish allergy:A comprehensive review[J].Clinical Reviews in Allergy & Immunology,2015,49(2):203-216.
[5] LIANG Y L,CAO M J,SU W J,et al.Identification and characterisation of the major allergen of Chinese mitten crab(Eriocheir sinensis)[J].Food Chemistry,2008,111(4):998-1 003.
[6] GARC A-OROZCO K D,AISPURO-HERN
A-OROZCO K D,AISPURO-HERN NDEZ E,YEPIZ-PLASCENCIA G,et al.Molecular characterization of arginine kinase,an allergen from the shrimp Litopenaeus vannamei[J].International Archives of Allergy and Immunology,2007,144(1):23-28.
NDEZ E,YEPIZ-PLASCENCIA G,et al.Molecular characterization of arginine kinase,an allergen from the shrimp Litopenaeus vannamei[J].International Archives of Allergy and Immunology,2007,144(1):23-28.
[7] AYUSO R,GRISHINA G,IB ?EZ M D,et al.Sarcoplasmic calcium-binding protein is an EF-hand-type protein identified as a new shrimp allergen[J].Journal of Allergy and Clinical Immunology,2009,124(1):114-120.
?EZ M D,et al.Sarcoplasmic calcium-binding protein is an EF-hand-type protein identified as a new shrimp allergen[J].Journal of Allergy and Clinical Immunology,2009,124(1):114-120.
[8] BEAVEN M A,METZGER H.Signal transduction by Fc receptors:The Fc&RI case[J].Immunology Today,1993,14(5):222-226.
[9] DVORAK A M.Mast cell-derived mediators of enhanced microvascular permeability,vascular permeability factor/vascular endothelial growth factor,histamine,and serotonin,cause leakage of macromolecules through a new endothelial cell permeability organelle,the vesiculo-vacuolar organelle[J].Chemical Immunology and Allergy,2005,85:185-204.
[10] RANCÉ F,GRANDMOTTET X,GRANDJEAN H.Prevalence and main characteristics of schoolchildren diagnosed with food allergies in France[J].Clinical & Experimental Allergy,2005,35(2):167-172.
[11] GONZ LEZ GAL
LEZ GAL N I,GARC
N I,GARC A MENAYA J M,JIMÉNEZ FERRERA G,et al.Anaphylactic shock to oysters and white fish with generalized urticaria to prawns and white fish[J].Allergologia et Immunopathologia,2002,30(5):300-303.
A MENAYA J M,JIMÉNEZ FERRERA G,et al.Anaphylactic shock to oysters and white fish with generalized urticaria to prawns and white fish[J].Allergologia et Immunopathologia,2002,30(5):300-303.
[12] CASTILLO R,DELGADO J,QUIRALTE J,et al.Food hypersensitivity among adult patients:Epidemiological and clinical aspects[J].Allergologia et.Immunopathologia,1996,24(3):93-97.
[13] LIU G M,LI B,YU H L,et al.Induction of mud crab(Scylla paramamosain)tropomyosin and arginine kinase specific hypersensitivity in BALB/c mice[J].Journal of the Science of Food and Agriculture,2012,92(2):232-238.
[14] 申洪.免疫组织化学染色定量方法研究(Ⅲ)[J].中国组织化学与细胞化学杂志,1995,4(1):89-92.
SHEN H.Study on the quantitative methods of immunohistochemistry(Ⅲ)[J].Chinese Journal of Histochemistry and Cytochemistry,1995,4(1):89-92.
[15] LEE J B,CHEN C Y,LIU B,et al.IL-25 and CD4+TH2 cells enhance type 2 innate lymphoid cell-derived IL-13 production,which promotes IgE-mediated experimental food allergy[J].Journal of Allergy and Clinical Immunology,2016,137(4):1 216-1 225.
[16] 郝海霞,李润花,殷国荣.霍乱毒素作为黏膜佐剂的研究进展[J].中国病原生物学杂志,2012,7(1):70-74;13.
HAO H X,LI R H,YIN G R.Advances in the study of cholera toxin as a mucosal adjuvant[J].Journal of Pathogen Biology,2012,7(1):70-74;13.
[17] LI X M,SCHOFIELD B H,HUANG C K,et al.A murine model of IgE-mediated cow’s milk hypersensitivity[J].Journal of Allergy and Clinical Immunology,1999,103(2):206-214.
[18] GONIPETA B,PARVATANENI S,TEMPELMAN R J,et al.An adjuvant-free mouse model to evaluate the allergenicity of milk whey protein[J].Journal of Dairy Science,2009,92(10):4 738-4 744.
[19] 田越.白细胞分类计数的临床意义分析[J].中国健康月刊,2011,30(5):168-169.
TIAN Y.Analysis of clinical significance of white blood cell classification[J].China Health Monthly,2011,30(5):168-169.
[20] ROTHENBERG M E,HOGAN S P.The eosinophil[J].Annual Review of Immunology,2006,24(1):147-174.
[21] FERN NDEZ-BLANCO J A,ESTÉVEZ J,SHEA-DONOHUE T,et al.Changes in epithelial barrier function in response to parasitic infection:Implications for IBD pathogenesis[J].Journal of Crohn’s and Colitis,2015,9(6):463-476.
NDEZ-BLANCO J A,ESTÉVEZ J,SHEA-DONOHUE T,et al.Changes in epithelial barrier function in response to parasitic infection:Implications for IBD pathogenesis[J].Journal of Crohn’s and Colitis,2015,9(6):463-476.
[22] DHALIWAL B,PANG M O Y,YUAN D P,et al.Conformational plasticity at the IgE-binding site of the B-cell receptor CD23[J].Molecular Immunology,2013,56(4):693-697.
[23] BECKER J,OTT D,DIENER M.Impact of sensitization and inflammation on the interaction of mast cells with the intestinal epithelium in rats[J].Frontiers in Physiology,2019,10:329.