长期过量饮酒会导致肠道菌群紊乱,肝脏功能受损[1],而适量饮酒能够减少机体炎症反应的发生,降低高血压、冠心病、动脉粥样硬化、痴呆等疾病的发病风险[2-3]。
饮酒后,酒精主要通过胃肠道进入体内,其中90%~98%由门静脉进入肝脏进行后续的分解代谢,其余以尿液、汗液及呼吸的形式排出体外。酒精在消化道中吸收与器官的表面积密切有关,肠道由于具有肠绒毛等独特的生理结构,形成的黏膜表面积相对较大,是酒精在体内吸收代谢的重要器官。人体肠道细菌总量约为人体细胞总数的10倍[4]。肠道微生物种类繁多,以厚壁菌门(Firmicutes)及拟杆菌门(Bacteroidetes)为主(约占总肠道菌群90%以上)[5]。酒精作为典型的外源物质,能够引发菌群在数量与组成上的变化。饮酒者空肠液细菌培养实验发现,厌氧菌及需氧菌的相对丰度较未饮酒者明显增加,在酒精性肝损伤动物和人体模型中也观察到同样的结果[6-8]。在酒精暴露人群结肠组织检查的实验中发现,变形菌门相对丰度显著增加而拟杆菌门丰度显著降低[9]。宏基因组分析也证实了肠道菌群的多样性且优势菌门在摄入酒精后明显发生改变[10-11]。此外,过度饮酒还会影响肠道黏膜屏障功能,造成肠道菌群易位。酒精的摄入会抑制多种与肠道屏障功能相关蛋白的表达,如紧密连接蛋白(occludin and zona-occludens-1,ZO-1)、黏蛋白2(Mucin2)及胰岛再生源蛋白3(Reg3)等[12-13]。研究发现,大鼠灌胃乙醇仅7 d就可以检测到肠道细菌易位[14]。因此,在研究开发含酒精类功能饮品时,有必要考察其对肠道菌群的影响。
随着生活水平的提高,消费者健康意识的增强,白酒产品开始向优质、低度、营养健康、多品种方向发展,尤其是保健饮品开始迅速发展和流行[15]。枸杞是一种传统的中草药,具有多种生物活性和药理作用,可用来治疗高脂血症[16]、糖尿病[17]及癌症[18]等疾病。红枣含有蛋白质、糖类、有机酸、氨基酸、维生素A、维生素C等丰富的营养成分[19]。浸泡酒作为一种传统的食品加工工艺,制作简便,成本低廉,一直以来受到广泛的好评。本研究以红枣枸杞为原料,蒸馏白酒为基酒制备浸泡酒,旨在探究功能性浸泡酒对小鼠肠道菌群的影响,为综合利用低值农产品,增加红枣、枸杞附加值,进一步开发具有调节肠道菌群功能的保健酒提供依据。
1 材料与方法
1.1 材料与试剂
红枣、枸杞、浓香型蒸馏白酒(酒精度55%vol),无锡市欧尚超市;低聚果糖(分析纯),上海麦克林生物技术有限公司。
FastDNA Spin Kit for Feces细菌基因组提取试剂盒,北京联立信生物技术有限公司;PCR Clean Up Kit PCR纯化试剂盒,碧云天生物技术有限公司。
1.2 仪器与设备
Freezone Plus冷冻干燥机,美国labconco公司;5830R型离心机,德国Eppendorf公司。
1.3 实验方法
1.3.1 样品制备
以红枣、枸杞为原料,洗净晾干,红枣去核后,与枸杞共同切成2 mm左右的薄片,红枣、枸杞用浓香型蒸馏白酒以料液比1∶1∶10(g∶g∶mL)浸泡在陶罐中,加盖密封后25 ℃避光贮存3个月,得到酒精度为50%vol的浸泡酒。
1.3.2 动物分组
试验动物采用SPF级雄性c57/6 J小鼠,18~22 g,上海斯莱克实验动物有限责任公司。试验设蒸馏酒对照组(10 mL/kg BW)、低聚果糖对照组(低聚果糖 1.0 g/kg BW)、红枣枸杞浸泡酒低(10 mL/kg BW)、高(20.0 mL/kg BW)2个剂量组,每组10只。酒精剂量根据中国居民膳食营养素参考摄入量(2013年版)成人(60 kg)的酒精每日最高摄入量(30 mL)换算为酒精体积分数50%的浸泡酒,则推荐受试物成人每日摄入量为60 mL。换算为本次小鼠每日灌胃剂量为10.0 mL/kg BW,作为本次实验的低剂量组。高剂量组设为低剂量组的2倍,即20.0 mL/kg BW。根据参考文献[20],对于含乙醇的受试样品,如果乙醇体积分数超过15%,允许将其体积分数降至15%。因此将浸泡酒进行旋蒸,将乙醇体积分数降至15%,并调配至相应剂量。
1.3.3 实验周期及粪便采集
试验动物在温度为20~26 ℃、相对湿度为40%~70%的江南大学实验动物中心屏障设施SYXK(苏)2021-0056饲养。辐照灭菌饲料和垫料均由江苏省协同医药生物工程有限责任公司提供,苏饲证(2014)01008。动物实验方案经江南大学实验动物福利与伦理审查批准,审批号JN.No20200710b0501030[148]。
实验共计21 d,前7 d为适应期,第8~21天为灌胃期。小鼠饲养期间采用江南大学实验动物中心提供的动物用水和饲料。第21天灌胃结束后收集小鼠粪便样品,将单只小鼠转移至独立的已灭菌的鼠笼,采集新鲜粪便,置于冰上,2 h内带回实验室,保存于-80 ℃。实验结束,腹腔注射戊巴比妥钠溶液(200 mg/kg)使小鼠安乐死。
1.3.4 DNA提取及测序
将小鼠粪便通过干冰运送至华大基因测序公司,采用FastDNA Spin Kit for Feces 试剂盒提取小鼠粪便中的细菌基因组,设计扩增引物,以稀释后的基因组DNA为模板,扩增16S rRNA基因V3和V4区(前端引物343F序列为5′-TACGGRAGGCAGCAG-3′,后端引物798R序列为5′-AGGGTATCTAATCCT-3′)。采用PCR Clean Up Kit试剂盒进行PCR纯化,文库先由 Agilent Technologies 2100 bioanalyzer 进行质检,按照 Illumina 的标准流程在 Illumina HiSeq 2500 平台上测序,产生 2×250 bp 的配对端序列[21]。
1.3.5 生物信息学分析
测序结束后,利用Trimmomatic软件对原始双端序列进行去杂,去杂后的双端序列利用FLASH(fast length adjustment of short reads,v1.2.11)软件进行拼接,并利用UCHIME(v4.2.40)检测去除序列中的嵌合体序列。测序数据预处理生成优质序列之后,采用USEARCH(v7.0.1090)软件,按照97%的相似度进行操作分类单位(operational taxonomic unit,OTU)分类,对比Silva(version123)数据库比对注释,得到每个OTU对应的物种信息,物种比对注释使用RDP classifier软件,保留置信区间大于0.7的注释结果。对测得的有效数据进行分类单元聚类、OTUs丰度、Alpha/Beta多样性分析。基于粪便微生物群在多种分类水平上的相对丰度,统计分析不同组在各分类水平上的显著差异。利用PICRUSt1软件将测序得到的菌群组成“映射”到KEGG(Kyoto Encyclopedia of Genes and Genomes)数据库中,对菌群功能和代谢途径进行预测分析[22-23]。
1.4 数据分析
所有数据经 SPSS 25.0 统计软件进行显著性分析,P<0.05为差异显著。除特别说明外,结果均以平均值±标准偏差表述。使用Origin 8.0和 Graphpad Prism 8 软件进行作图。
2 结果与分析
2.1 菌群alpha多样性分析
由表1可知,Coverage指数均高于0.99,反映了此次测序深度已基本覆盖到样品中的所有物种。灌胃红枣枸杞浸泡酒后,ACE指数相对蒸馏酒对照组虽无显著性提高(P>0.05),但是从均值水平来看,具有增高的趋势。统计分析显示,实验后各组在Shannon和Simpson指数水平上无显著差异(P>0.05),但是红枣枸杞浸泡酒低、高剂量组Shannon指数均值大于蒸馏酒对照组,而Simpson指数均值小于蒸馏酒对照组,较大的Shannon指数与较小的Simpson指数可以反应更高的菌群多样性。综上分析,虽然红枣枸杞酒组相对于蒸馏酒对照组在alpha 多样性指数水平上无显著性差异,但是各指数均值呈现了增加或降低的变化趋势,表明红枣枸杞浸泡酒在一定程度上可增加小鼠肠道菌群的丰富度和多样性。
表1 各组样品的alpha多样性分析
Table 1 Alpha diversity of fecal microflora in different groups
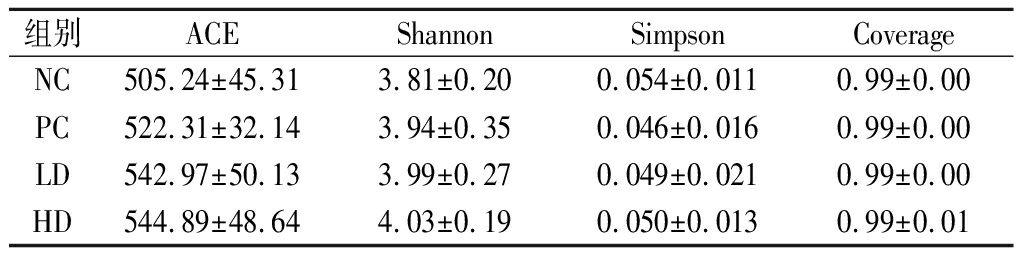
组别ACEShannonSimpsonCoverageNC505.24±45.313.81±0.200.054±0.0110.99±0.00PC522.31±32.14 3.94±0.350.046±0.0160.99±0.00LD542.97±50.133.99±0.270.049±0.0210.99±0.00HD544.89±48.64 4.03±0.190.050±0.0130.99±0.01
注:NC-蒸馏酒对照组;PC-低聚糖对照组;LD-浸泡酒低剂量组;HD-浸泡酒高剂量组(下同)
2.2 基于OTU丰度的主成分分析
为了探究不同组别之间的物种多样性差异,基于样本OTU的丰度对数据进行了主成分分析,采用的距离矩阵算法为Bray curtis(图1)。通过主成分分析可知,实验组和对照组发生明显的分离[permutational multivariate analysis of variance(PERMANOVA):P=0.001;R2=0.546],这表明实验组和对照组的肠道菌群的物种结构组成存在显著性差异。
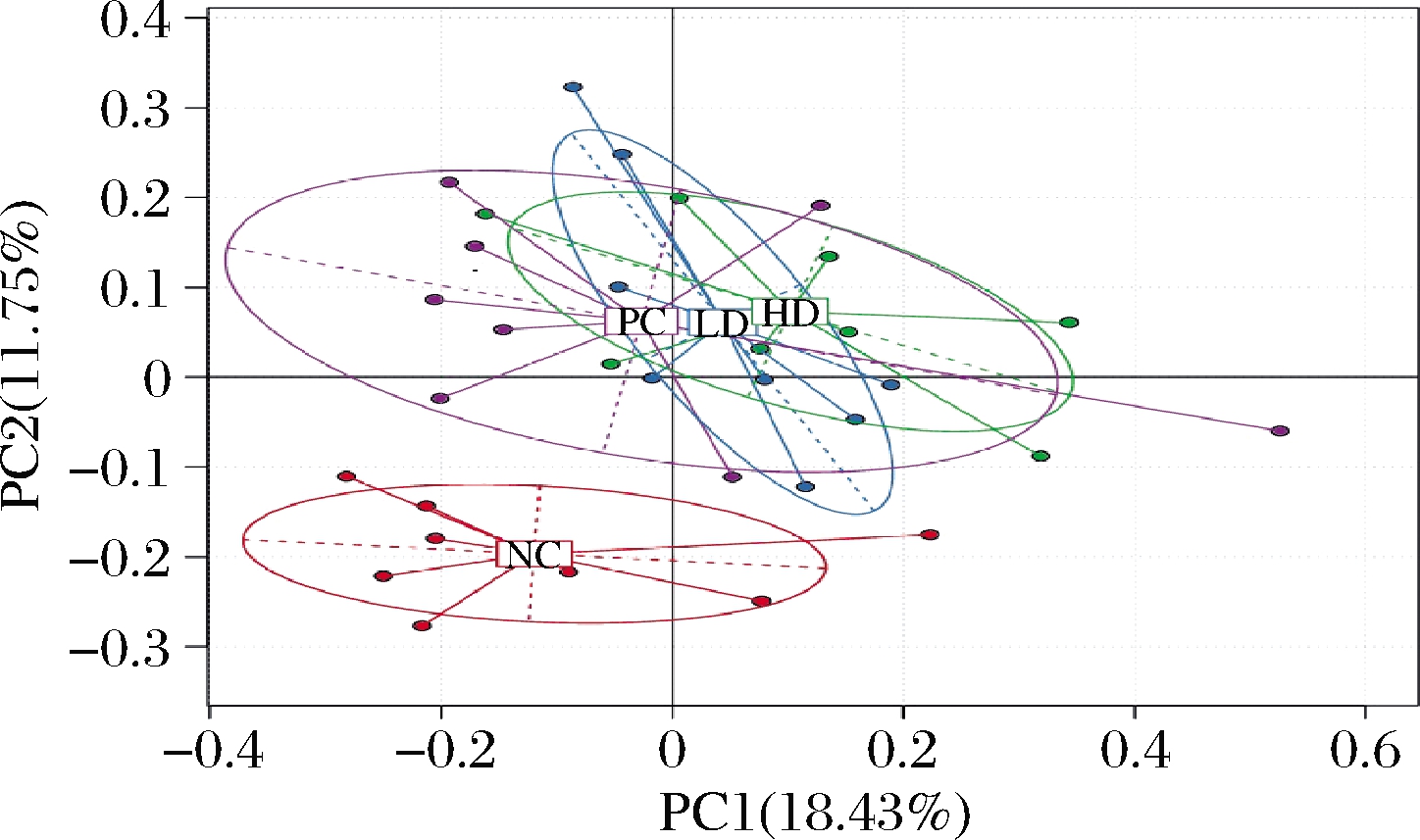
图1 基于OTU丰度的主成分分析
Fig.1 Principal component analysis based on OTU abundance
2.3 门水平菌群组成及物种差异性分析
针对小鼠粪便样本进行了各分类水平菌群组成分析,如图2-a所示,在门水平上,拟杆菌门(Bacteroidetes)及厚壁菌门(Firmicutes)在所有样本中为主导,平均占比>90%,其次为Proteobacteria、Verrucomicrobia、Actinobacteria、Tenericutes、TM7等,其他相对丰度<0.5%及未注释的物种统一归类于Unclassified。通过Stamp软件Tukey-Kramer算法对厚壁菌门/拟杆菌门比值进行分析,结果如图2-b所示,与蒸馏酒对照组相比,低剂量组、高剂量组、低聚糖组中厚壁菌门与拟杆菌门丰度比值显著降低(P<0.05)。低、高剂量红枣枸杞浸泡酒组相对于蒸馏酒对照组分别降低了50.87%和53.16%。研究表明,厚壁菌门/拟杆菌门比值的增加,与多种疾病如炎性肠病[24-25]、肥胖症[26]及便秘[27-28]的发生发展密切相关。研究结果表明,红枣枸杞浸泡酒可以调节肠道菌群结构,适当饮用可能具有改善相关病征的潜力,具体效果与机制需要进一步通过实验验证。
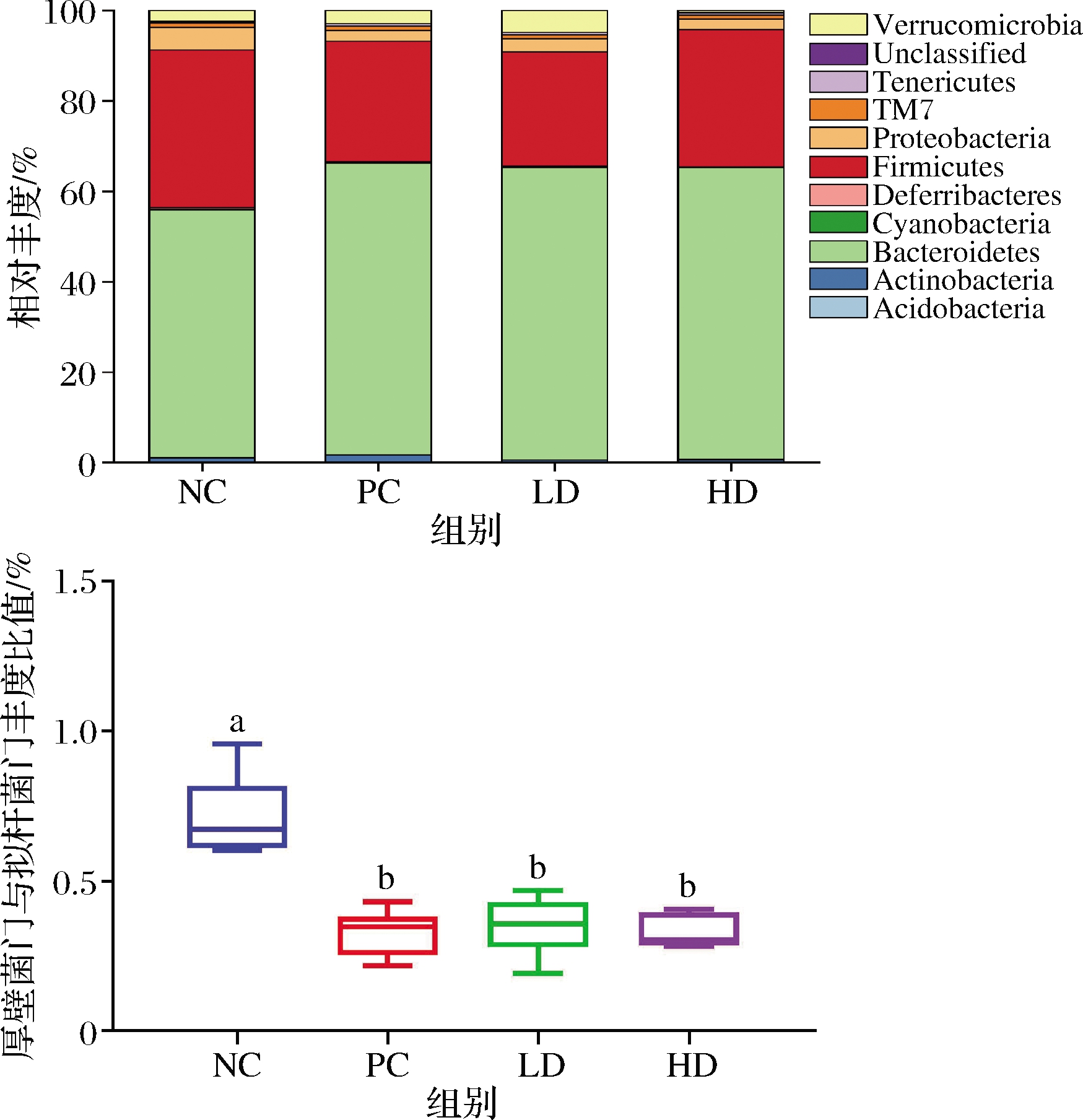
a-门水平相对丰度;b-厚壁菌门与拟杆菌门丰度比值
图2 肠道菌群在门水平物种相对丰度及厚壁菌门与拟杆菌门丰度比值
Fig.2 Composition of gut microbiota at phylum level and ratio of Firmicutes to Bacteroides
注:不同小写字母代表组间具有显著性差异(P<0.05)(下同)
2.4 属水平菌群组成及物种差异性分析
通过SPSS 25.0单因素ANOVA检验中最低显著性差异(least significant difference,LSD)统计检验方法对小鼠粪便样本进行了属水平菌群组成分析,如图3-a所示,对有显著差异的物种进行深入分析。结果表明,低、高剂量红枣枸杞浸泡酒组在拟杆菌属(Bacteroidetes,图3-b)、梭状菌属(Clostridium,图3-c)、乳杆菌属(Lactobacillus,图3-d)、阿德勒克罗伊茨菌属(Adlercreutzia,图3-e)及颤螺菌属(Oscillospira,图3-f)相对丰度水平上显著高于对照组(P<0.05)。WANG等[29]研究发现低聚糖类如低聚果糖、低聚半乳糖及低聚异麦芽糖等可增加小鼠肠道内容物中拟杆菌属丰度,与实验中低聚糖对照组结果相同。而红枣枸杞浸泡酒低、高剂量组在Bacteroidetes相对丰度上与阳性对照组无显著差别。已有研究发现,Clostridium可通过刺激肠道细胞增强神经递质类物质5-羟色胺的释放,从而间接发挥促进肠道蠕动等益生作用[30];且相关实验已证实低聚糖的干预会增加Clostridium相对丰度[31-32]。另外,研究表明,Lactobacillus与维持肠道系统的微生态平衡、pH值和肠道上皮完整性有关[33-34],肠道内Adlercreutzia、Oscillospira丰度的增加,可有效缓解肠易激综合征、炎症及肥胖相关病症[35-36]。因此,以上各菌属相对丰度的增加有利于宿主发挥明显的益生功能。综上所述,在属水平上差异分析结果表明适当饮用该浸泡酒可能具有优化宿主肠道菌群结构,发挥益生功能的潜力。
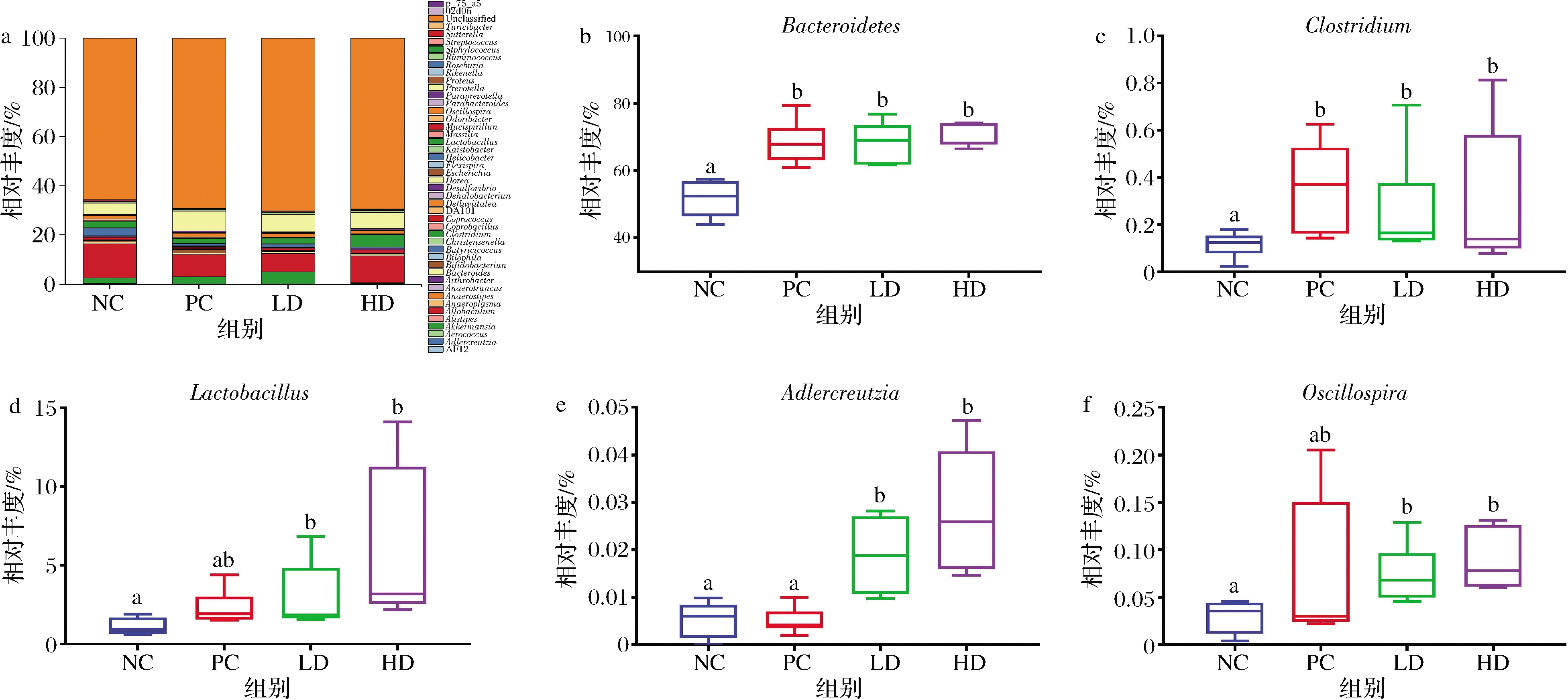
a-属水平相对丰度;b-拟杆菌属;c-梭状菌属;d-乳杆菌属;e-阿德勒克罗伊茨菌属;f-颤螺菌属
图3 肠道菌群在属分类水平中物种相对丰度组成及组间物种相对丰度差异
Fig.3 The composition of gut microbiota at the genus level and the comparison of each group at the relative abundance of difference genus
2.5 粪便菌群预测功能的差异性分析
为进一步了解红枣枸杞浸泡酒对肠道菌群预测功能的改变,对各组样品测序信息在 KEGG 代谢途径第2水平上的功能差异进行对比分析,结果如图4所示。低剂量组肠道菌群预测功能在多糖生物合成代谢、氨基酸代谢及辅酶因子维生素代谢方面显著高于蒸馏酒对照组(图4-a),高剂量组肠道菌群预测功能在核苷酸代谢、复制和修复功能及其他氨基酸代谢功能方面显著高于蒸馏酒对照组(图4-b)。上述结果表明,摄入红枣枸杞浸泡酒后,小鼠肠道菌群的一些代谢功能有一定的提高。结合图3-a、图3-b、图3-d 结果可知,Bacteroidetes和Lactobacillus在肠道菌群结构属水平中占据优势地位,两者相对丰度之和在各组中均大于50%。特别是在浸泡酒组中,两者相对丰度之和大于70%。因此,可推测Bacteroidetes和Lactobacillus两个属相对丰度的变化将会显著影响肠道菌群的功能。研究表明,拟杆菌属中物种具有多种益生作用,可帮助宿主分解利用多糖,产生短链脂肪酸为宿主提供能量[37]。此外,在促进肠黏膜的血管再生和免疫系统的发育方面也发挥着重要作用[38]。乳酸杆菌属是益生菌研究的主要对象,该菌属在改善胃肠道功能、增强免疫力等生理活动上发挥着重要作用[33-34]。因此,可推测摄入红枣枸杞浸泡酒后肠道菌群预测功能的差异可能主要是由肠道菌群相对丰度的变化引起的。

a-低剂量组与对照组;b-高剂量组与对照组
图4 低剂量、高剂量组与对照组在小鼠粪便菌群预测功能上的差异
Fig.4 Differences between low/high dose groups and the control group at the predicted functions of mice fecal microbiota
3 结论
本研究基于高通量测序评价了红枣枸杞浸泡酒对小鼠肠道菌群的影响,结果表明,各组与蒸馏酒对照组相比,小鼠肠道菌群均发生显著变化。在门水平上,其厚壁菌门与拟杆菌门丰度比值显著下降(P<0.05);在属水平上,乳酸菌属、拟杆菌属、梭菌属丰度显著增加(P<0.05);粪便菌群功能预测结果显示,摄入红枣枸杞浸泡酒后,小鼠肠道菌群的一些代谢功能有一定的提高。综上,可推测适当饮用红枣枸杞浸泡酒可能会调节宿主肠道菌群结构,促进肠道中有益菌的增殖,具有改善肠道功能和维持肠道微生态稳定的潜力。
[1] BAJAJ J S.Alcohol,liver disease and the gut microbiota[J].Nature Reviews Gastroenterology & Hepatology,2019,16(4):235-246.
[2] 罗强,刘杰,刘志刚.酱香型白酒中吡嗪类物质体外抗炎作用研究[J].中国酿造,2019,38(7):156-160.
LUO Q,LIU J,LIU Z G.In vitro anti-inflammatory effect of pyrazines in sauce-flavor Baijiu[J].China Brewing,2019,38(7):156-160.
[3] SABIA S,FAYOSSE A,DUMURGIER J,et al.Alcohol consumption and risk of dementia:23 year follow-up of Whitehall II cohort study[J].BMJ(Clinical Research Ed.),2018,362:k2927.
[4] QIN J J,LI R Q,RAES J,et al.A human gut microbial gene catalogue established by metagenomic sequencing[J].Nature,2010,464(7 285):59-65.
[5] LOZUPONE C A,STOMBAUGH J I,GORDON J I,et al.Diversity,stability and resilience of the human gut microbiota[J].Nature,2012,489(7 415):220-230.
[6] BODE J C,BODE C,HEIDELBACH R,et al.Jejunal microflora in patients with chronic alcohol abuse[J].Hepato-gastroenterology,1984,31(1):30-34.
[7] GABBARD S L,LACY B E,LEVINE G M,et al.The impact of alcohol consumption and cholecystectomy on small intestinal bacterial overgrowth[J].Digestive Diseases and Sciences,2014,59(3):638-644.
[8] BULL-OTTERSON L,FENG W K,KIRPICH I,et al.Metagenomic analyses of alcohol induced pathogenic alterations in the intestinal microbiome and the effect of Lactobacillus rhamnosus GG treatment[J].PLoS One,2013,8(1):e53028.
[9] MUTLU E A,GILLEVET P M,RANGWALA H,et al.Colonic microbiome is altered in alcoholism[J].American Journal of Physiology.Gastrointestinal and Liver Physiology,2012,302(9):G966-G978.
[10] YI Z W,XIA Y J,LIU X F,et al.Antrodin A from mycelium of Antrodia camphorata alleviates acute alcoholic liver injury and modulates intestinal flora dysbiosis in mice[J].Journal of Ethnopharmacology,2020,254:112681.
[11] ENGEN P A,GREEN S J,VOIGT R M,et al.The gastrointestinal microbiome:Alcohol effects on the composition of intestinal microbiota[J].Alcohol Research,2015,37(2):223-236.
[12] LIPPAI D,BALA S S,CATALANO D,et al.Micro-RNA-155 deficiency prevents alcohol-induced serum endotoxin increase and small bowel inflammation in mice[J].Alcoholism:Clinical and Experimental Research,2014,38(8):2 217-2 224.
[13] WANG Y,TONG J,CHANG B,et al.Effects of alcohol on intestinal epithelial barrier permeability and expression of tight junction-associated proteins[J].Molecular Medicine Reports,2014,9(6):2 352-2 356.
[14] YAN A W,E FOUTS D,BRANDL J,et al.Enteric dysbiosis associated with a mouse model of alcoholic liver disease[J].Hepatology,2011,53(1):96-105.
[15] 张艳.白酒产业结构优化升级路径的研究[J].酿酒科技,2020(5):131-135.
ZHANG Y.Structure optimization and upgrade path of Chinese baijiu industry[J].Liquor-Making Science & Technology,2020(5):131-135.
[16] 邱虹,罗燕枫,孙向平,等.宁夏无果枸杞芽茶对高血脂患者血脂水平及抗氧化功能的影响[J].宁夏医科大学学报,2015,37(11):1 249-1 252;1 282.
QIU H,LUO Y F,SUN X P,et al.Effect of ningxia fruitless wolfberry bud tea on blood lipid level and antioxidation in patients with hyperlipidemia[J].Journal of Ningxia Medical University,2015,37(11):1 249-1 252;1 282.
[17] 李晶,魏健.刺五加、枸杞子配伍对糖尿病模型小鼠降血糖作用的研究[J].食品研究与开发,2017,38(9):179-182.
LI J,WEI J.Effect of compatibility of Acanthopanaxs enticosus and Chinese wolfberry fruit on reducing blood sugar in diabetic model mice[J].Food Research and Development,2017,38(9):179-182.
[18] 孙云龙,庞博,刘鑫,等.枸杞多糖体外抗肿瘤及免疫学[J].中国老年学杂志,2018,38(20):5 057-5 059.
SUN Y L,PANG B,LIU X,et al.Antitumor and immunological effects of Lycium barbarum polysaccharides in vitro[J].Chinese Journal of Gerontology,2018,38(20):5 057-5 059.
[19] ZHANG Q,WANG L L,WANG Z T,et al.Variations of the nutritional composition of jujube fruit(Ziziphus jujuba Mill.)during maturation stages[J].International Journal of Food Properties,2020,23(1):1 066-1 081.
[20] 《保健食品检验与评价技术规范》(2003年版):SPGG 保健食品检验与评价技术规范(2003年版)-2003[S].
Technical specification for inspection and evaluation of health food(2003)[S].
[21] SINCLAIR L,OSMAN O A,BERTILSSON S,et al.Microbial community composition and diversity via 16S rRNA gene amplicons:Evaluating the Illumina platform[J].PLoS One,2015,10(2):e0116955.
[22] WANG Q,GARRITY G M,TIEDJE J M,et al.Naive Bayesian classifier for rapid assignment of rRNA sequences into the new bacterial taxonomy[J].Applied and Environmental Microbiology,2007,73(16):5 261-5 267.
[23] LANGILLE M G I,ZANEVELD J,CAPORASO J G,et al.Predictive functional profiling of microbial communities using 16S rRNA marker gene sequences[J].Nature Biotechnology,2013,31(9):814-821.
[24] XIAO L,FENG Q,LIANG S S,et al.A catalog of the mouse gut metagenome[J].Nature Biotechnology,2015,33(10):1 103-1 108.
[25] FRANK D N,ST AMAND A L,FELDMAN R A,et al.Molecular-phylogenetic characterization of microbial community imbalances in human inflammatory bowel diseases[J].Proceedings of the National Academy of Sciences of the United States of America,2007,104(34):13 780-13 785.
[26] TURNBAUGH P J,B CKHED F,FULTON L,et al.Diet-induced obesity is linked to marked but reversible alterations in the mouse distal gut microbiome[J].Cell Host & Microbe,2008,3(4):213-223.
CKHED F,FULTON L,et al.Diet-induced obesity is linked to marked but reversible alterations in the mouse distal gut microbiome[J].Cell Host & Microbe,2008,3(4):213-223.
[27] ZHU L X,LIU W S,ALKHOURI R,et al.Structural changes in the gut microbiome of constipated patients[J].Physiological Genomics,2014,46(18):679-686.
[28] CHOI C H,CHANG S K.Alteration of gut microbiota and efficacy of probiotics in functional constipation[J].Journal of Neurogastroenterology and Motility,2015,21(1):4-7.
[29] WANG L L,PAN M L,LI D Y,et al.Metagenomic insights into the effects of oligosaccharides on the microbial composition of cecal contents in constipated mice[J].Journal of Functional Foods,2017,38:486-496.
[30] YANO J M,YU K,DONALDSON G P,et al.Indigenous bacteria from the gut microbiota regulate host serotonin biosynthesis[J].Cell,2015,161(2):264-276.
[31] CHEN J,CHIA N,KALARI K R,et al.Multiple sclerosis patients have a distinct gut microbiota compared to healthy controls[J].Scientific Reports,2016,6:28484.
[32] MAUKONEN J,SATOKARI R,M TTÖ J,et al.Prevalence and temporal stability of selected clostridial groups in irritable bowel syndrome in relation to predominant faecal bacteria[J].Journal of Medical Microbiology,2006,55(Pt 5):625-633.
TTÖ J,et al.Prevalence and temporal stability of selected clostridial groups in irritable bowel syndrome in relation to predominant faecal bacteria[J].Journal of Medical Microbiology,2006,55(Pt 5):625-633.
[33] MADSEN K,CORNISH A,SOPER P,et al.Probiotic bacteria enhance murine and human intestinal epithelial barrier function[J].Gastroenterology,2001,121(3):580-591.
[34] O’CALLAGHAN A,VAN SINDEREN D.Bifidobacteria and their role as members of the human gut microbiota[J].Frontiers in Microbiology,2016,7:925.
[35] MCINTOSH K,REED D E,SCHNEIDER T,et al.FODMAPs alter symptoms and the metabolome of patients with IBS:A randomised controlled trial[J].Gut,2017,66(7):1 241-1 251.
[36] KONIKOFF T,GOPHNA U.Oscillospira:A central,enigmatic component of the human gut microbiota[J].Trends in Microbiology,2016,24(7):523-524.
[37] HOOPER L V,MIDTVEDT T,GORDON J I.How host-microbial interactions shape the nutrient environment of the mammalian intestine[J].Annual Review of Nutrition,2002,22:283-307.
[38] STAPPENBECK T S,HOOPER L V,GORDON J I.Nonlinear partial differential equations and applications:Developmental regulation of intestinal angiogenesis by indigenous microbes via Paneth cells[J].PNAS,2002,99(24):15 451-15 455.