益生菌是对宿主有益的活的微生物,其可以降低血清胆固醇、改善肠道健康、预防各种癌症、促进免疫反应和改善认知障碍[1-3]。益生菌通过黏附肠上皮细胞在肠道定植从而抑制肠道有害菌,改善肠道微生态平衡,进而改善胃肠道的生理平衡,以此对宿主产生有益作用[4]。乳酸菌的抗氧化等重要生物学功能在保障食品质量、提高食品品质方面具有重要作用[5-8]。发酵乳是益生菌最好的载体,功能性益生菌发酵乳的研究开发一直受到广泛关注[9]。
功能性低聚糖是由3~10个单位的不同聚合程度的单体组成的简单碳水化合物和可溶性膳食纤维[10]。菊粉、低聚果糖和低聚半乳糖是被广泛应用于食品工业中的功能性低聚糖[11-12]。低聚糖对益生菌的生长具有增殖作用,杨健等[13]研究了4种低聚糖对乳酸菌体外增殖过程的影响,发现低聚果糖对干酪乳杆菌和嗜酸乳杆菌的增殖效果最好。李雅丽等[14]研究了6种低聚糖对肠道益生菌生长情况以及代谢产物的影响,发现其对各益生菌的促生长和促产酸能力不同,以水苏糖和低聚半乳糖的效果最为显著。但低聚糖对益生菌发酵乳功能特性的影响研究鲜有报道。
为了凸显益生元发酵乳的益生性,应该和含有益生菌的发酵乳结合,从而构建益生元、益生菌、发酵乳三者的协同关系[15]。本文选取菊粉、低聚果糖和低聚半乳糖与实验室筛选得到的具有优良功能特性的3株益生菌进行合生元组合实验,制备合生元发酵乳,探究低聚糖对益生菌发酵乳活菌数、pH、酸度、总抗氧化能力和黏附能力的影响,并对其进行相关性分析,旨在探讨不同低聚糖对益生菌发酵乳功能特性的影响及其之间的相关性,为功能性合生元发酵乳的开发提供理论指导。
1 材料与方法
1.1 材料与设备
1.1.1 实验材料
试验菌株:鼠李糖乳杆菌LV108、鼠李糖乳杆菌 Hsryfm 1301、发酵乳杆菌DALI 02,扬州大学江苏省乳品生物技术与安全控制重点实验室保藏。
原料:全脂乳粉、脱脂乳粉,新西兰威士兰乳业公司;菊粉、低聚果糖、低聚半乳糖、蔗糖,上海昊岳食品科技有限公司;乙酸、丙酸、丁酸、异丁酸、戊酸、异戊酸,均为色谱纯,德国Dr.Ehrenstorfer GmbH公司;MEM培养液、MEM非必需氨基酸溶液、丙酮酸钠溶液、GlutaMAX谷氨酰胺添加剂,美国Gibco公司;0.25%胰酶细胞消化液、PBS,上海碧云天生物技术公司。
培养基:MRS培养基:液体用于菌种的活化,固体用于活菌计数;益生元选择培养基:分别用菊粉、低聚果糖、低聚半乳糖替换MRS中的葡萄糖,121 ℃,15 min灭菌冷却后备用,用于菌株生长曲线的测定;益生元增殖培养基:120 g/L全脂乳粉,60 g/L蔗糖复配过筛均质后分别添加20 g/L菊粉、低聚果糖、低聚半乳糖,105 ℃,5 min 灭菌冷却后备用,用于菌株增殖及功能测定;MEM培养基:77%(体积分数,下同)MEM、20% 优质胎牛血清、1% MEM非必需氨基酸溶液、1%丙酮酸钠溶液、1% GlutaMAX谷氨酰胺添加剂,4 ℃贮藏备用,用于Caco-2细胞的传代培养。
1.1.2 实验设备
JF-SX-500全自动灭菌锅,日本TOMYG公司;超净工作台SW-CJ-1F,苏州净化设备有限公司;高压均质机GYB 60-08,上海东华高压均质机厂;7890 A-7697 A气相色谱仪,美国Agilent公司;5804 R型高速冷冻离心机,德国Eppendorf公司;生长曲线测定仪,Bioscreen C;CO2细胞培养箱,美国赛默飞世尔科技有限公司;细胞计数仪IC 1000,上海睿钰生物科技有限公司。
1.2 实验方法
1.2.1 益生菌生长曲线的测定
分别以菊粉、低聚果糖、低聚半乳糖作为单一碳源代替MRS培养基中的葡萄糖。将实验菌株以3%接种量分别接种3种不同低聚糖为碳源的培养基中在自动生长曲线仪中37 ℃培养48 h。以菌液的OD600值为纵坐标绘制生长曲线。
1.2.2 益生菌发酵乳的制备
复配乳经标准化后,60 g/L的蔗糖分别添加20 g/L的低聚糖(菊粉、低聚果糖、低聚半乳糖),经均质、热处理后冷却,单菌发酵乳按3%的接菌量分别接入3株益生菌,37 ℃发酵18 h。
1.2.3 发酵乳活菌数的测定
将发酵乳摇晃均匀后进行梯度稀释。采用MRS固体培养基倾注法,37 ℃培养48 h,对发酵乳中的活菌进行计数。
1.2.4 发酵乳pH的测定
使用玻璃电极pH计测定样品的pH值。
1.2.5 发酵乳酸度的测定
称取5 g左右发酵乳样品,记录质量m,用40 mL蒸馏水稀释,并加酚酞指示剂,用0.1 mol/L的NaOH溶液滴定至微红色,并在30 s内不变色,记录体积V,按公式(1)计算样品酸度(°T):
酸度![]()
(1)
1.2.6 发酵乳总抗氧化能力的测定
样品总抗氧化能力按照T-AOC试剂盒说明书进行测定。称取27.8 mg试剂盒中的FeSO4·7H2O,用去离子水溶解并定容至1 mL,此时浓度即为100 mmol/L。用去离子水将100 mmol/L FeSO4·7H2O分别稀释至0.15、0.3、0.6、0.9、1.2和1.5 mmol/L的标准品溶液。取5 μL不同浓度的标准品溶液加入96孔板中,在孔中加180 μL FRAP工作液,37 ℃孵育3~5 min后,用酶标仪测定波长为593 nm处的OD值,绘制标准曲线,得到曲线公式。分别取5 μL稀释后的发酵乳加入96孔板中,在孔中加180 μL 光脱色荧光恢复技术(fluorescence recovery after photobleaching,FRAP)工作液,37 ℃孵育3~5 min后,用酶标仪测定波长为593 nm处的OD值,将样品的OD值代入总抗氧化标准曲线,求得结果。
1.2.7 益生菌在Caco-2细胞上的黏附
1.2.7.1 Caco-2细胞的培养
将Caco-2细胞接种于MEM培养基中并置于恒温培养箱(37 ℃,5% CO2,相对湿度90%)中培养。每两天更换一次培养液,当Caco-2细胞长满培养瓶底部80%时用含2.5 g/L的胰酶消化液消化后,进行传代。稳定传代至5代后可用于试验。
1.2.7.2 发酵乳中益生菌在Caco-2细胞上黏附能力的测定
参照文献[16]的方法并略作修改。在24孔细胞板上每孔加入1 mL发酵乳(pH经10 g/L NaOH溶液调节至7.0),37 ℃下在细胞培养箱里共孵育2小时。孵育结束后每孔用PBS重复清洗3次后加入0.15 mL胰酶消化液并放入细胞培养箱消化3 min左右。将细胞板置于显微镜观察到贴壁细胞漂浮在消化液中时加入0.35 mL MEM培养基终止消化。按照1.2.3的方法计算黏附在Caco-2细胞上的益生菌数量。黏附率按公式(1)计算:
黏附率![]()
(2)
式中:N0,发酵乳中原始益生菌活菌数;N1,黏附后益生菌活菌数。
1.3 统计学分析
实验数据均平行测定3次,使用平均值±标准差表示,所有数据均采用Excel 2019、SPSS 25.0和Origin 2019进行统计分析与绘图,各组均数比较采用Duncan法多重方差分析,P<0.05为显著性水平。
2 结果与分析
2.1 低聚糖对益生菌生长曲线的影响
以低聚糖作为单一碳源,测定不同益生菌的生长情况。由图1-a可知,LV108利用低聚果糖的生长促进效果最为明显,低聚半乳糖、菊粉次之。由图1-b可知,Hsryfm 1301在利用低聚糖生长时对低聚半乳糖显示出较好的嗜好性,显著高于菊粉和低聚果糖。由图1-c可知,DALI 02利用3种低聚糖生长情况排序为低聚果糖>菊粉>低聚半乳糖,在利用低聚果糖时OD600可达到1.4左右,高于菊粉和低聚半乳糖且接近葡萄糖组的生长情况。
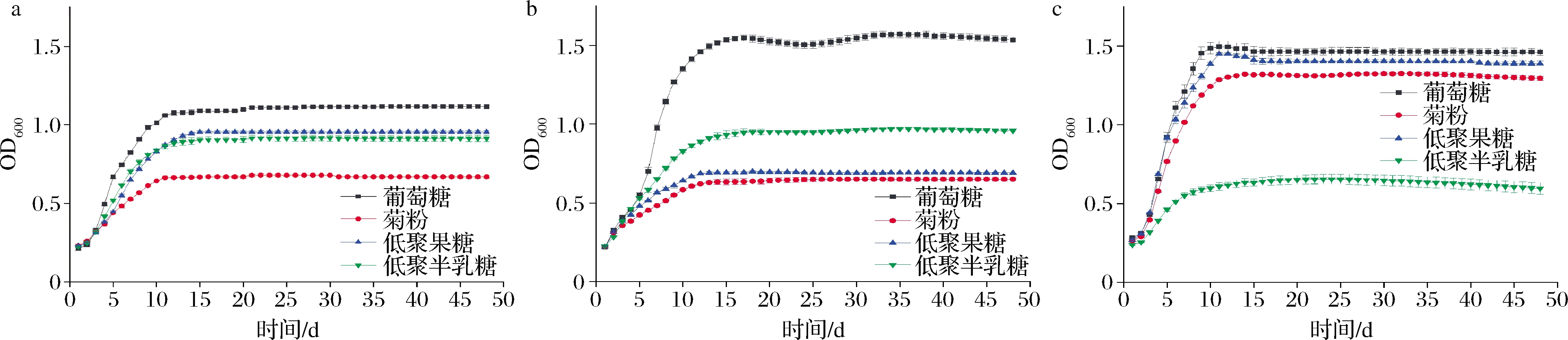
a-菌株 LV108;b-菌株 Hsryfm 1301;c-菌株 DALI 02
图1 益生菌利用低聚糖生长情况
Fig.1 Growth of probiotics using oligosaccharides
2.2 低聚糖对益生菌发酵乳活菌数的影响
在全脂牛乳中添加2%不同低聚糖制备益生菌发酵乳,发酵结束后进行活菌数测定。由图2可知,菊粉和低聚果糖对LV108发酵乳的活菌数增殖作用不显著(P>0.05),低聚半乳糖对LV108发酵乳活菌数增殖作用显著(P<0.05),活菌数由8.37×108增殖至9.13×108 CFU/mL。

LV108、Hsryfm 1301、DALI 02,分别表示使用3株菌发酵的发酵乳;I、F、G分别表示菊粉、低聚果糖、低聚半乳糖(下同)
图2 低聚糖对益生菌发酵乳活菌数的影响
Fig.2 Effect of oligosaccharides on the number of viable bacteria in probiotic fermented milk
注:不同的字母表示显著性差异(P<0.05)(下同)
低聚糖对Hsryfm 1301发酵乳的活菌数增殖效果排序为菊粉>低聚半乳糖>低聚果糖(P<0.05),菊粉和低聚果糖对DALI 02 发酵乳活菌数增殖效果接近且与其他组别差异显著(P<0.05)。LV108和Hsryfm 1301发酵乳活菌数显著高于DALI 02发酵乳(P<0.05),均在8×108 CFU/mL左右。3种低聚糖对Hsryfm 1301发酵乳中活菌数具有较好的增殖效果,其中菊粉对Hsryfm 1301发酵乳中活菌数增殖幅度最大,由8.17×108至1.24×109 CFU/mL,为空白组的1.52倍,显著高于其他低聚糖发酵乳。
2.3 低聚糖对益生菌发酵乳pH和酸度的影响
由图3可知,低聚半乳糖对3株益生菌发酵乳pH降低作用均不显著(P>0.05)。
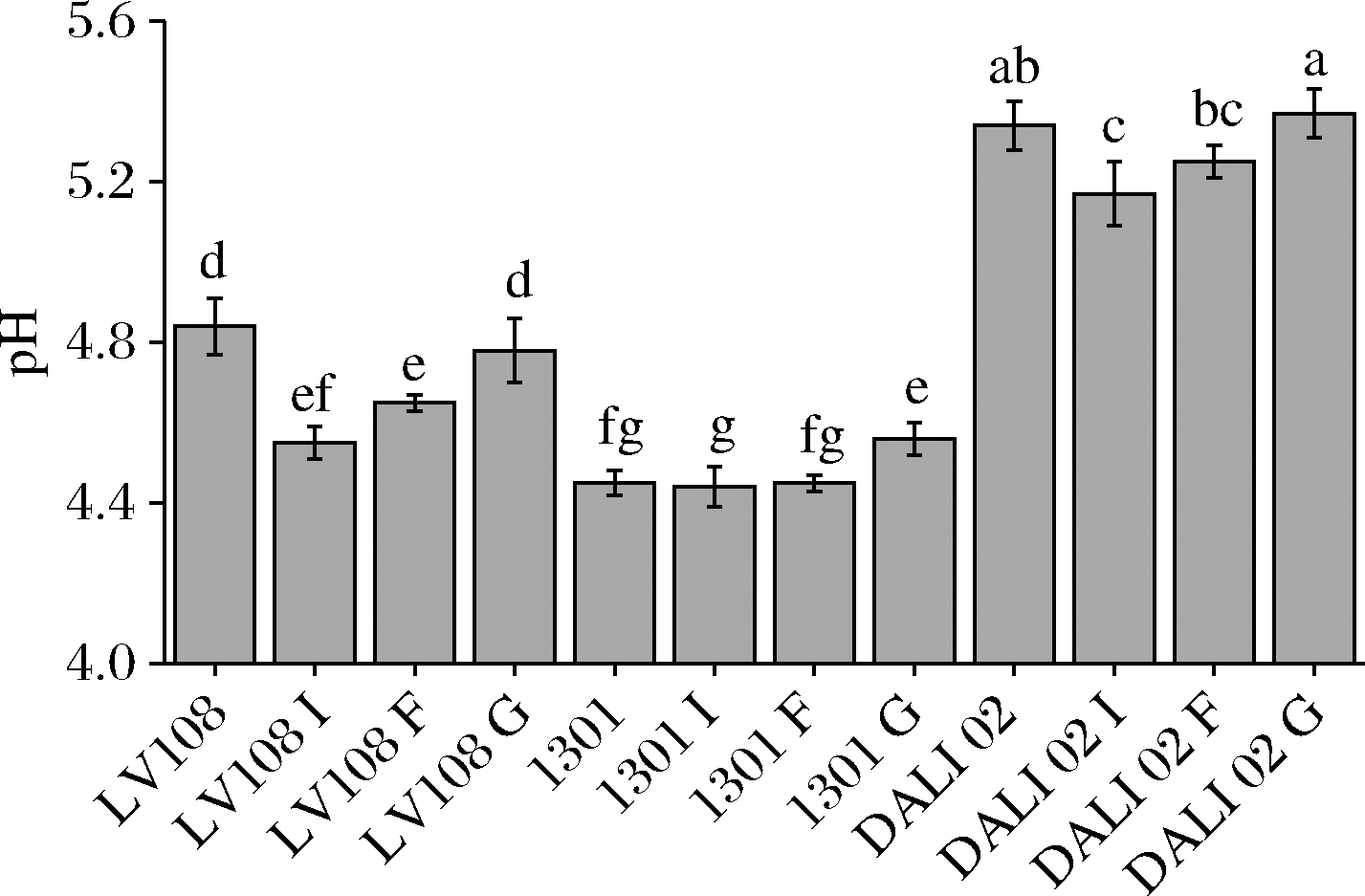
图3 低聚糖对益生菌发酵乳pH的影响
Fig.3 Effect of oligosaccharides on the pH of probiotic fermented milk
菊粉和低聚果糖均显著降低了LV108和DALI 02发酵乳的pH(P<0.05),其中菊粉对LV108发酵乳pH的降低效果最为明显,由4.84降至4.55,降低幅度为5.99%。菊粉和低聚果糖对Hsryfm 1301发酵乳pH的影响不显著(P>0.05),添加低聚半乳糖后Hsryfm 1301发酵乳的pH得到了提高,由4.45增至4.56,提高幅度为2.47%。
由图4可知,3种低聚糖均显著提高了LV108和DALI 02发酵乳的酸度(P<0.05),其中菊粉对LV108和DALI 02发酵乳酸度的提升最为显著,分别由72.12、63.54提升至85.66、71.86°T,提高幅度分别为18.69%、13.09%。添加菊粉和低聚果糖对Hsryfm 1301发酵乳酸度没有显著影响(P>0.05),而添加低聚半乳糖组的酸度得到了显著降低(P<0.05),由79.77降至77.50°T。
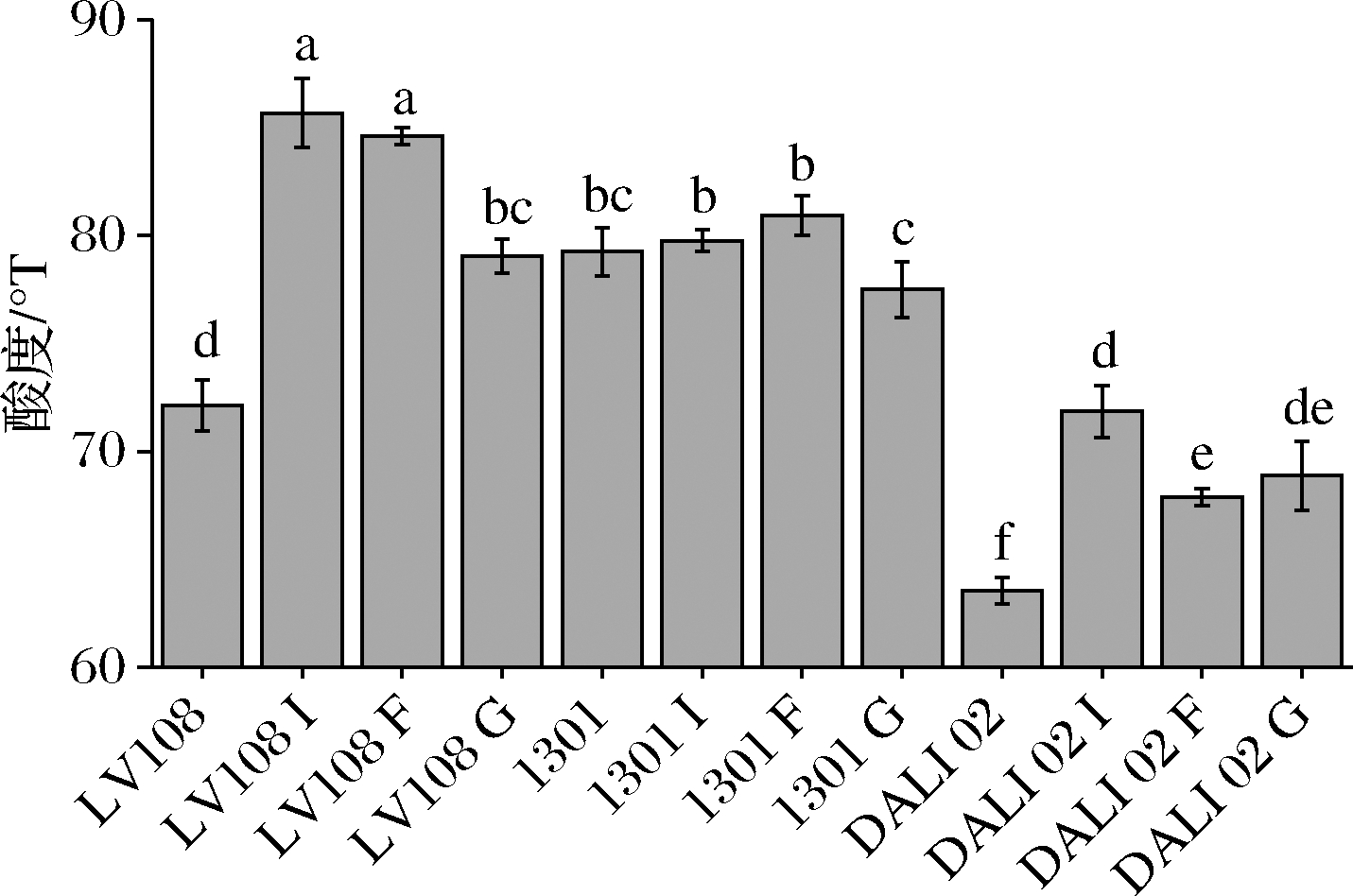
图4 低聚糖对益生菌发酵乳酸度的影响
Fig.3 Effect of oligosaccharides on the pH of probiotic fermented milk
2.4 低聚糖对益生菌发酵乳总抗氧化能力的影响
利用试剂盒对发酵乳进行总抗氧化能力测定。由图5可知,添加低聚果糖的LV108发酵乳总抗氧化能力为4.17 mmol/g prot,显著高于添加菊粉和低聚半乳糖组(P<0.05),为空白组的1.83倍。菊粉和低聚果糖对Hsryfm 1301发酵乳总抗氧化能力的增效作用显著优于低聚半乳糖(P<0.05)。对于DALI 02而言,3种添加低聚糖组之间的总抗氧化能力差异不显著且较之空白组均有1.5倍左右的提升,为4 mmol/g prot 左右。3种低聚糖对3株益生菌发酵乳在总抗氧化能力上表现出广谱的增强,未添加低聚糖组中Hsryfm 1301发酵乳总抗氧化能力最强,为4.01 mmol/g prot。添加菊粉的Hsryfm 1301发酵乳总抗氧化能力在所有添加低聚糖组别中最强,为4.85 mmol/g prot。
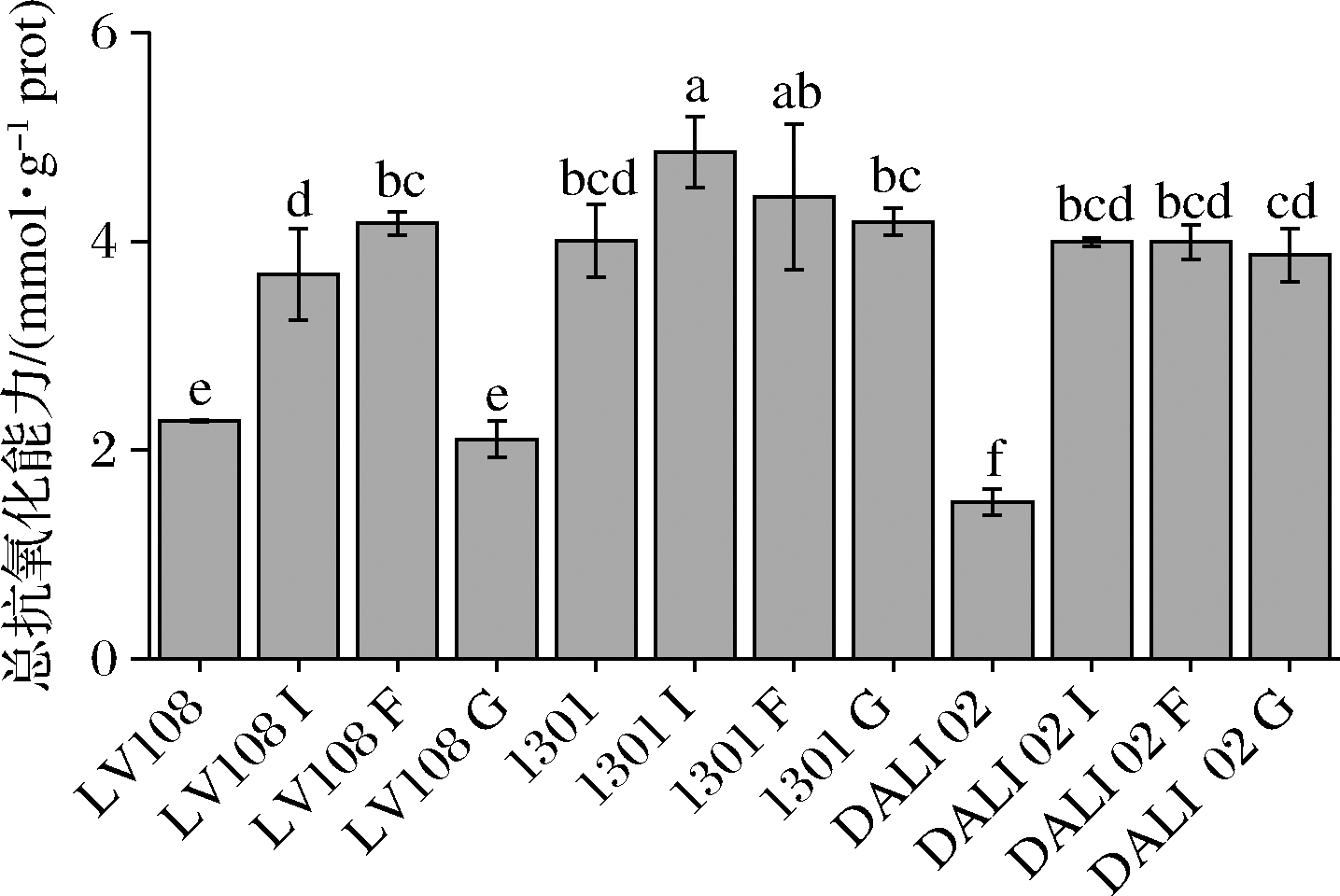
图5 低聚糖对益生菌发酵乳总抗氧化能力的影响
Fig.5 Effect of oligosaccharides on the total antioxidant capacity of probiotic fermented milk
2.5 低聚糖对发酵乳中益生菌对Caco-2细胞黏附的影响
在Caco-2细胞传代稳定后进行发酵乳中益生菌的黏附能力测定。由图6可知,添加菊粉和低聚半乳糖对LV108的黏附能力没有显著提升(P<0.05),LV108利用低聚果糖使其黏附率从0.56%提升至0.89%。Hsryfm 1301利用3种低聚糖对黏附能力的提升程度相当,均提升0.5倍左右。菊粉和低聚果糖对于DALI 02黏附的改善较大,其黏附率分别提升了0.98、0.66倍,低聚半乳糖对黏附能力没有改善。低聚果糖对发酵乳中3株益生菌黏附Caco-2能力具有广谱的提升作用,发酵乳中LV108和DALI 02黏附Caco-2能力在添加低聚半乳糖后没有显著变化(P<0.05)。
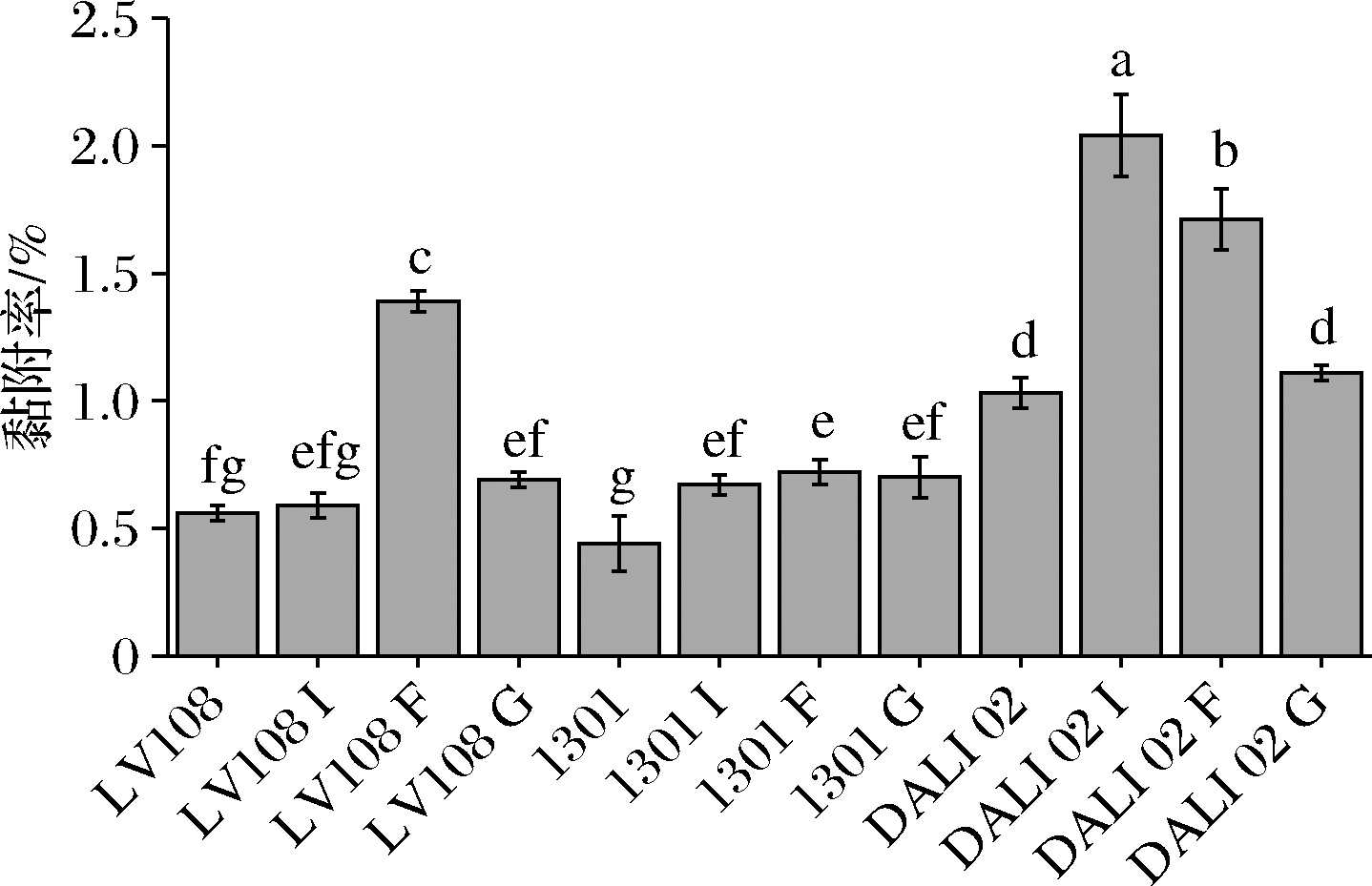
图6 低聚糖对益生菌发酵乳黏附Caco-2细胞的影响
Fig.6 Effect of oligosaccharides on adhesion of probiotic fermented milk to Caco-2 cells
2.6 相关性分析
对本文所测指标进行相关性分析,皮尔逊相关性分析结果如表1所示。总抗氧化能力与活菌数呈正相关(P<0.05),与pH呈负相关(P<0.05)。黏附Caco-2细胞能力与活菌数呈负相关(P<0.01),与pH呈正相关(P<0.01),与酸度呈负相关(P<0.05)。
表1 发酵乳功能特性之间的相关性研究
Table 1 Correlation analysis of the functional properties of fermented milk
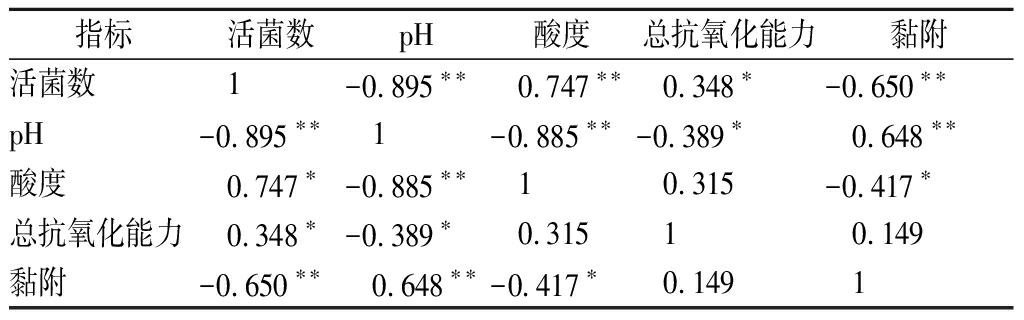
指标活菌数pH酸度总抗氧化能力黏附活菌数 1-0.895∗∗ 0.747∗∗ 0.348∗-0.650∗∗pH-0.895∗∗ 1-0.885∗∗-0.389∗ 0.648∗∗酸度 0.747∗-0.885∗∗ 1 0.315-0.417∗总抗氧化能力 0.348∗-0.389∗ 0.315 1 0.149黏附-0.650∗∗ 0.648∗∗-0.417∗ 0.149 1
注:*在 0.05 级别,相关性显著,**在 0.01 级别,相关性显著
3 结论与讨论
本文研究探讨了不同低聚糖作为单一碳源测定益生菌对其的利用情况,并对不同低聚糖对益生菌发酵乳的活菌数增殖、总抗氧化能力、抑菌能力、Caco-2细胞黏附能力进行了探究。
3株益生菌在低聚糖条件下的生长效果均低于在葡萄糖条件下的生长情况,这可能是由于葡萄糖是一种单糖,更适合益生菌的生长[17]。益生菌在利用低聚糖生长时会表现出差异性,主要的原因是益生菌代谢低聚糖的酶系统存在差异[18-19]。3种低聚糖对Hsryfm 1301和DALI 02发酵乳中活菌数具有较好的增殖效果,其中菊粉对Hsryfm 1301发酵乳中活菌数的增殖幅度最大,由8.17×108至1.24×109 CFU/mL,为空白组的1.52倍。
3种低聚糖对3株益生菌发酵乳在总抗氧化能力上表现出广谱的增强,益生菌的抗氧化作用在维持微生态平衡中发挥重要作用。研究发现,益生元和益生菌的协同混合对健康有积极的影响[20]。CERIELLO等[21]报道了一系列的糖尿病、发病机制和其他后续并发症是由氧化应激和炎症引起的,开发具有抗氧化能力的功能型食品对于治疗此类疾病是一种良好的策略。发酵乳的抗氧化能力与益生菌在发酵牛奶过程中释放的抗氧化肽密切相关[22],低聚糖协同益生菌可能在发酵牛奶过程中增强了抗氧化肽的释放。
低聚果糖对发酵乳中3株益生菌黏附Caco-2能力均具有提升作用,发酵乳中LV108和DALI 02黏附Caco-2能力在添加低聚半乳糖后没有显著变化(P>0.05)。作为益生元的寡糖也可以增强益生菌菌株的黏附能力,这表明开发新的共生产品可能是一种潜在的工具,以增加益生菌在肠道中的停留时间[23]。CAO等[17]研究发现当植物乳杆菌ATCC 14917与不同寡糖一起培养时黏附特性发生了变化,甘露寡糖培养下其黏附能力显著高于其他各组。甘露寡糖通过高表达黏附因子基因和多种乳酸菌表面蛋白来影响黏附特性[17]。
相关性分析结果显示,总抗氧化能力与活菌数呈正相关(P<0.05),与pH呈负相关(P<0.05)。黏附Caco-2细胞能力与活菌数呈负相关(P<0.01),与pH呈正相关(P<0.01),与酸度呈负相关(P<0.05)。本文探究了不同低聚糖对益生菌发酵乳功能特性的影响,为筛选出合适的低聚糖作为益生元提供理论依据,对合生元的筛选及具有特定功能的合生元发酵乳的开发具有指导意义。
[1] HOU Q C,LI C K,LIU Y H,et al.Koumiss consumption modulates gut microbiota,increases plasma high density cholesterol,decreases immunoglobulin G and albumin[J].Journal of Functional Foods,2019,52:469-478.
[2] KECHAGIA M,BASOULIS D,KONSTANTOPOULOU S,et al.Health benefits of probiotics:A review[J].ISRN Nutrition.2013:481651.
[3] LI C K,KWOK L Y,MI Z H,et al.Characterization of the angiotensin-converting enzyme inhibitory activity of fermented milks produced with Lactobacillus casei[J].Journal of Dairy Science,2017,100(12):9 495-9 507.
[4] FULLER,R.Probiotics in human medicine[J].Gut,1991,32(4):439-442.
[5] GHANY K A E,ELHAFEZ E A,HAMOUDA R A,et al.Evaluation of antioxidant and antitumor activities of Lactobacillus acidophilus bacteria isolated from Egyptian infants[J].International Journal of Pharmacology,2014,10(5):282-288.
[6] LI S Y,ZHAO Y J,ZHANG L,et al.Antioxidant activity of Lactobacillus plantarum strains isolated from traditional Chinese fermented foods[J].Food Chemistry,2012,135(3):1 914-1 919.
[7] JI K,JANG N Y,KIM Y T.Isolation of lactic acid bacteria showing antioxidative and probiotic activities from kimchi and infant feces[J].Journal of Microbiology and Biotechnology,2015,25(9):1 568-1 577.
[8] CHEN Q,KONG B H,SUN Q X,et al.Antioxidant potential of a unique LAB culture isolated from Harbin dry sausage:In vitro and in a sausage model[J].Meat Science,2015,110:180-188.
[9] DE MORAIS E C.Prebiotic addition in dairy products[M]//Probiotics,Prebiotics,and Synbiotics.Amsterdam:Elsevier,2016:37-46.
[10] IBRAHIM O O.Functional oligosaccharide:Chemicals structure,manufacturing,health benefits,applications and regulations[J].Journal of Food Chemistry & Nanotechnology,2018,4(4):DOI:10.17756/jfcn.2018-060.
[11] CATENZA K F,DONKOR K K.Recent approaches for the quantitative analysis of functional oligosaccharides used in the food industry:A review[J].Food Chemistry,2021,355:129416.
[12] 李烜,罗登林,向进乐,等.菊粉的性质、功能及在食品中的应用进展[J].中国粮油学报,2021,36(4):185-192.
LI X,LUO D L,XIANG J L,et al.Physicochemical properties,functions and applications of inulin in food:A review[J].Journal of the Chinese Cereals and Oils Association,2021,36(4):185-192.
[13] 杨健,马永强,姚笛.四种低聚糖对乳酸菌体外增殖过程的影响研究[J].饲料研究,2020,43(4):75-80.
YANG J,MA Y Q,YAO D.Study on effect of four oligosaccharides on proliferation process of lactic acid bacteria in vitro[J].Feed Research,2020,43(4):75-80.
[14] 李雅丽,王默涵,周志桥.6种低聚糖对肠道益生菌生长情况的影响及代谢产物分析[J].食品科技,2021,46(3):7-13.
LI Y L,WANG M H,ZHOU Z Q.Effects of six oligosaccharides on the growth of intestinal probiotics and analysis of metabolites[J].Food Science and Technology,2021,46(3):7-13.
[15] 何君,韩育梅,刘敏,等.益生元在发酵乳中的应用研究进展[J].食品工业科技,2017,38(8):379-383.
HE J,HAN Y M,LIU M,et al.Progress of research on the application of prebiotics in fermented milk[J].Science and Technology of Food Industry,2017,38(8):379-383.
[16] ZHANG T,JEONG C H,CHENG W N,et al.Moringa extract enhances the fermentative,textural,and bioactive properties of yogurt[J].LWT,2019,101:276-284.
[17] CAO P,WU L Y,WU Z,et al.Effects of oligosaccharides on the fermentation properties of Lactobacillus plantarum[J].Journal of Dairy Science,2019,102(4):2 863-2 872.
[18] WARD R E,NI ONUEVO M,MILLS D A,et al.In vitro fermentation of breast milk oligosaccharides by Bifidobacterium infantis and Lactobacillus gasseri[J].Applied and Environmental Microbiology,2006,72(6):4 497-4 499.
ONUEVO M,MILLS D A,et al.In vitro fermentation of breast milk oligosaccharides by Bifidobacterium infantis and Lactobacillus gasseri[J].Applied and Environmental Microbiology,2006,72(6):4 497-4 499.
[19] LEE J H,KARAMYCHEV V N,KOZYAVKIN S A,et al.Comparative genomic analysis of the gut bacterium Bifidobacterium longum reveals loci susceptible to deletion during pure culture growth[J].BMC Genomics,2008,9:247.
[20] SHAFI A,FAROOQ U,AKRAM K,et al.Prevention and control of diseases by use of pro-and prebiotics(synbiotics)[J].Food Reviews International,2014,30(4):291-316.
[21] CERIELLO A,MOTZ E.Is oxidative stress the pathogenic mechanism underlying insulin resistance,diabetes,and cardiovascular disease? The common soil hypothesis revisited[J].Arteriosclerosis,Thrombosis,and Vascular Biology,2004,24(5):816-823.
[22] SABEENA FARVIN K H,BARON C P,NIELSEN N S,et al.Antioxidant activity of yoghurt peptides:Part 1-in vitro assays and evaluation in ω-3 enriched milk[J].Food Chemistry,2010,123(4):1 081-1 089.
[23] CELEBIOGLU H U,OLESEN S V,PREHN K,et al.Mucin-and carbohydrate-stimulated adhesion and subproteome changes of the probiotic bacterium Lactobacillus acidophilus NCFM[J].Journal of Proteomics,2017,163:102-110.