乳酸菌胞外多糖(exopolysaccharide,EPS)是指乳酸菌在菌体生长过程中产生并分泌到细胞外、常渗入到培养基中的一种天然高分子聚合物[1]。乳酸菌是公认的安全级(Generally Regarded As Safe,GRAS)、绿色食品微生物,其所产EPS也被认为是安全可靠的,具有多种生物活性,包括抗氧化、抗肿瘤、降血糖、增强免疫力以及调节肠道菌群等[2-5]。乳酸菌EPS在抗氧化方面的优良特性,使其可以作为一种安全、无毒和来源广泛的天然抗氧化剂,是目前研究的热点。此外,乳酸菌EPS具有的多种理化特性使其可以作为理想的稳定剂和增黏剂应用于发酵食品中,起到改善乳制品口感、流变学特性和防止乳清析出的作用,使产品更稳定、质地更细腻[6]。
目前从我国传统发酵食品中分离出的产EPS的乳酸菌有嗜热链球菌(Streptococcus thermophilus)、肠膜明串珠菌(Leuconostoc mesenteroides)、植物乳杆菌(Lactobacillus plantarum)、嗜酸乳杆菌(Lactobacillus acidophilus)和瑞士乳杆菌(Lactobacillus helveticus)等[7-9]。其中S.thermophilus是链球菌属中唯一可应用在发酵食品中的菌株,是优良的基础发酵剂。目前高产EPS菌种资源相对匮乏,导致其广泛的开发和应用受到限制。科学家们也试图用基因工程的手段构建高产EPS菌株,但目前仍未取得较大进展[10]。
本研究拟从我国传统发酵食品中分离出高产EPS的乳酸菌,并进行分离提取,对LAB的生物学特性和其产EPS的抗氧化特性进行分析,同时探索乳酸菌制备的直投式发酵剂(directed vat set,DVS)在发酵乳中的应用。
1 材料与方法
1.1 材料与试剂
分菌样品酸奶、奶疙瘩、牦牛奶、骆驼奶、酥油、发酵面团、泡菜等采自于新疆、西藏、贵州、青海和四川等地。
MRS培养基,广东环凯微生物科技有限公司;M17培养基,青岛海博科技工业园生物科技有限公司;细菌基因组DNA快速抽提试剂盒,生工生物工程股份有限公司;API 50 CH碳水化合物鉴定试剂条、厌氧袋,法国生物梅里埃股份有限公司。
脱脂乳培养基:脱脂乳粉120 g,蔗糖20 g,葡萄糖20 g,蒸馏水840 mL,均质,105 ℃灭菌10 min。
1.2 仪器与设备
KB240生化培养箱,德国Binder公司;高速冷冻离心机,Eppendorf 股份公司;OLYMPUS BX61光学显微镜,Olympus 株式会社;FE20数显pH计,梅特勒-托利多公司;MyCyler PCR仪,Bio-RAD公司;DU800 紫外分光光度计,Beckman公司;DV2T黏度计,BROOKFIELD公司;AFL-W15A 乳品发酵监控仪,AMS Alliance iCinac公司;Bioscreen全自动生长曲线分析仪,Bioscreen公司。
1.3 试验方法
1.3.1 菌株分离纯化
取5 mL(或g)待分离样品加入装有45 mL生理盐水的蓝盖瓶中,搅拌混匀后,用生理盐水梯度稀释至适宜浓度,振荡混匀。取100 μL混匀样品液,分别涂布于MRS和M17培养基平板,37 ℃厌氧培养48 h。挑选具有乳酸菌特征的菌落,于平板上反复三区划线,获得纯菌株,于-80 ℃冷冻保存。
1.3.2 发酵性能优良菌株的筛选
菌株活化2代后,以2%(体积分数)接种量接种于100 mL脱脂乳培养基,37 ℃静置培养至脱脂乳凝固,观察并记录凝乳状态。对得到的酸乳进行评价,评价指标主要包括组织状态、拉丝长度、黏度和风味等,筛选出发酵性能优良菌株。
1.3.3 产EPS菌株的筛选
1.3.3.1 EPS的提取和纯化
采用刘刚等[11]的方法并稍作修改。菌株活化2代后,以2%(体积分数)接种量接种于脱脂乳培养基中,37 ℃恒温静置培养24 h后得到发酵乳。95 ℃水浴加热发酵乳10 min以除去其中可能降解EPS的酶,冷却到室温。8 000 r/min离心30 min后除去细胞和部分蛋白沉淀。向上清液中加入800 g/L的三氯乙酸(trichloroacetic acid,TCA)溶液至终质量浓度40 g/L,充分搅拌2 h后4 ℃静置过夜,12 000 r/min 4 ℃离心40 min得到含EPS的上清液。向上清液中加入3倍体积的预冷95%乙醇进行醇沉,4 ℃静置过夜,离心得EPS沉淀,加纯水溶解即得EPS溶液,装入透析袋中(截留分子质量14 kDa)透析48 h,每8 h换1次水,得到纯化EPS溶液。冷冻干燥48 h后,得干燥多糖。
1.3.3.2 EPS含量的测定
采用苯酚-硫酸法测定EPS的含量[12]。以葡萄糖含量(mg/L)为横坐标,吸光度值为纵坐标,绘制葡萄糖标准曲线,得到回归方程:y=0.009 1x-0.011(R2=0.998 4)。同法测得分离菌株所产EPS溶液在490 nm处的吸光度,带入回归方程计算EPS产量。
1.3.4 产EPS菌株的鉴定
将菌株于固体培养基划线,37 ℃培养24 h后,观察并记录菌株的形态特征。挑取平板菌落涂布于载玻片并革兰氏染色,于显微镜下观察菌体的细胞形态。菌株生理生化试验包括糖发酵特性(API 50 CH鉴定试剂条)、过氧化氢酶试验、液化明胶试验、精氨酸水解试验、硫化氢试验和吲哚试验等。
采用细菌基因组DNA快速抽提试剂盒得到菌株DNA,并进行PCR扩增[13],阳性PCR产物送至金唯智生物科技有限公司测序,测序结果在NCBI数据库中应用BLAST工具与GenBank数据库进行比对分析。
1.3.5 菌株生物学特性分析
1.3.5.1 菌株生长特性
对菌株的生长特性和产酸特性进行测定。菌株活化2代后以2%(体积分数)接种量接种于M17液体培养基中,40 ℃恒温静置培养24 h,采用细胞生长曲线跟踪仪和酸度跟踪仪监测菌株生长过程,并绘制菌株的生长曲线和产酸曲线。
1.3.5.2 菌株耐酸耐胆盐特性
菌株活化2代后,取对数生长末期菌液,离心去上清液,得新鲜菌泥。加入与培养液相同体积的pH值为1.5、2.5、3.5和4.5的M17液体培养基,充分混匀后,置于40 ℃恒温培养箱中培养4 h,于0、1、2、3和4 h分别取样,采用稀释涂布法进行活菌计数计算菌株耐酸性。加入与培养液相同体积的质量分数为0.03%、0.1%、0.2%和0.3%胆盐的M17液体培养基,充分混匀后,于40 ℃恒温培养箱中培养24 h,于0、4、8和24 h分别取样,采用稀释涂布法进行活菌计数,计算菌株耐胆盐性。菌株存活率计算如公式(1)所示:
菌株存活率![]()
(1)
式中:A1,菌株培养后活菌数的对数值;A2,菌株培养0 h活菌数的对数值。
1.3.6 EPS体外抗氧化性能测定
取菌株产EPS样品,配制成不同质量浓度(0.2、0.5、1.0、2.0、5.0和8.0 mg/mL)的EPS样品溶液,并以相同浓度的抗坏血酸(维生素C)做阳性对照,按照如下方法分别测定抗氧化指标和总还原力。
1.3.6.1 DPPH自由基清除能力的测定
采用WU等[14]方法并稍作修改。试管中加入2 mL EPS样品溶液,并加入2 mL 0.2 mmol/L的DPPH-甲醇溶液,混匀后,室温下于暗处反应1 h,测定517 nm处吸光值。以维生素C作阳性对照。DPPH自由基清除率计算如公式(2)所示:
DPPH清除率![]()
(2)
式中:A,以等体积甲醇代替DPPH溶液的吸光度;A0,等体积水替代多糖样品的吸光度;A1,EPS样品与DPPH反应后的吸光度。
1.3.6.2 ·OH清除能力的测定
采用Fenton法测定EPS对·OH的清除能力[15]。向含有1 mL 0.435 mmol/L的亮绿溶液,2 mL 0.5 mmol/L的FeSO4和1.5 mL 30 g/L H2O2的Fenton反应体系中加入1 mL EPS样品溶液,混匀后,37 ℃水浴 20 min,4 ℃、8 000 r/min离心10 min,取上清液,测定624 nm处吸光值。以维生素C作阳性对照。·OH清除率计算如公式(3)所示:
·OH清除率![]()
(3)
式中:A1,Fenton 试剂+样品+亮绿溶液体系的吸光度;A0,Fenton 试剂+亮绿的溶液体系吸光度;A,仅含亮绿溶液的吸光度。
1.3.6.3 ![]() 清除能力的测定
清除能力的测定
采用姜静等[16]的方法并稍作修改。向3 mL 50 mmol/L pH 8.2(含1 mmol/L的EDTA)的Tris-HCl缓冲溶液中加入1 mL EPS样品溶液,混匀,25 ℃水浴静置20 min,加入300 μL 25 mmol/L邻苯三酚溶液,混匀,25 ℃水浴反应5 min后,立即加入1 mL 盐酸终止反应,混匀后,测定325 nm处吸光值。以维生素C作阳性对照。![]() 清除率按公式(4)计算:
清除率按公式(4)计算:
![]() 清除率
清除率![]()
(4)
式中:A,只加入Tris-HCl缓冲溶液的吸光度;A0,加入邻苯三酚溶液的吸光度;A1,终反应吸光度。
1.3.6.4 总还原力的测定
采用铁氰化钾法测定EPS样品的总还原力[17]。取1 mL EPS样品溶液于试管中,加入1 mL 0.2 mol/L pH 6.6的PBS,1 mL 10 g/L的铁氰化钾溶液,混匀,50 ℃水浴反应 20 min后,骤冷,加入1 mL 5%TCA溶液,混匀,4 000 r/min离心10 min,取2.5 mL上清液,加入2.5 mL蒸馏水和0.5 mL 1 g/L FeCl3溶液,混匀,静置反应10 min后,测定700 nm处吸光值,以OD700 nm表示EPS样品的总还原力。OD700 nm值越大,代表还原能力越强。以维生素C作阳性对照。
1.3.7 DVS的制备
菌株于M17液体培养基活化2代后,以5%(体积分数)接种量接种于10 L发酵罐中进行高密度厌氧培养,发酵条件控制为40 ℃、恒pH 6.0,通气CO2,以发酵液在OD600 nm处的吸光值不变为发酵终点。8 000 r/min、4 ℃离心15 min,弃上清液,收集菌体沉淀。用无菌磷酸盐缓冲液(pH 7.0)漂洗菌体1次,得到的菌泥与脱脂乳、蔗糖、乳糖、谷氨酸钠、水等保护剂成分按一定比例充分搅拌混匀。混合液移至真空冷冻干燥机中冻干80 h,得到DVS。
1.3.8 DVS的应用
将脱脂乳粉120 g/L,蔗糖80 g/L溶于55 ℃蒸馏水中,均质,95 ℃灭菌10 min,冷却。将DVS按最终活菌数为1.0×106 CFU/mL的接种量接种于灭菌脱脂乳中,40 ℃静置培养7 h后,于4 ℃冷藏过夜,得到不需要增稠剂的酸乳。采用AFL-W15A乳品发酵监控仪监测发酵过程pH值变化。对DVS的发酵性能进行分析:采用数显pH计测定发酵乳pH值;依据GB/T 5009.239—2016《食品安全国家标准 食品酸度的测定》测定发酵乳酸度;采用直尺测定发酵乳拉丝长度(cm);采用DV2T黏度计测定发酵乳黏度;依据GB/T 4789.35—2016《食品安全国家标准 食品微生物学检验乳酸菌检验》测定发酵乳活菌数。
1.4 数据统计与分析
每个实验均设置3次重复,绘图采用Graph Pad Prism 8软件,数据分析采用SPSS 17.0软件,数据以平均值±标准偏差表示,显著水平设置为0.05。
2 结果与分析
2.1 高产EPS菌株的分离、鉴定与保藏
本研究从各种发酵样品中共分离得到483株乳酸菌。经过发酵性能初筛,筛选出6株黏度高、拉丝长度长且风味良好的菌株(图1)。其中菌株WHH3379的EPS产量显著高于其他5株菌,在脱脂乳培养基中的产量为(526.58±2.91)mg/L,高于嗜热链球菌Q4F8的EPS产量[11]。

图1 菌株胞外多糖产量
Fig.1 Exopolysaccharide yields of strains
注:字母不同表示差异显著(P<0.05)
WHH3379菌株在M17琼脂培养基的菌落为圆形,边缘整齐,略突起,正反面颜色一致,中央与边缘颜色一致,符合乳酸菌的基本特征(图2-a)。
显微镜下,该菌体呈球形、成对或成链状、无鞭毛、不运动、不产芽孢、革兰氏染色阳性(图2-b)。
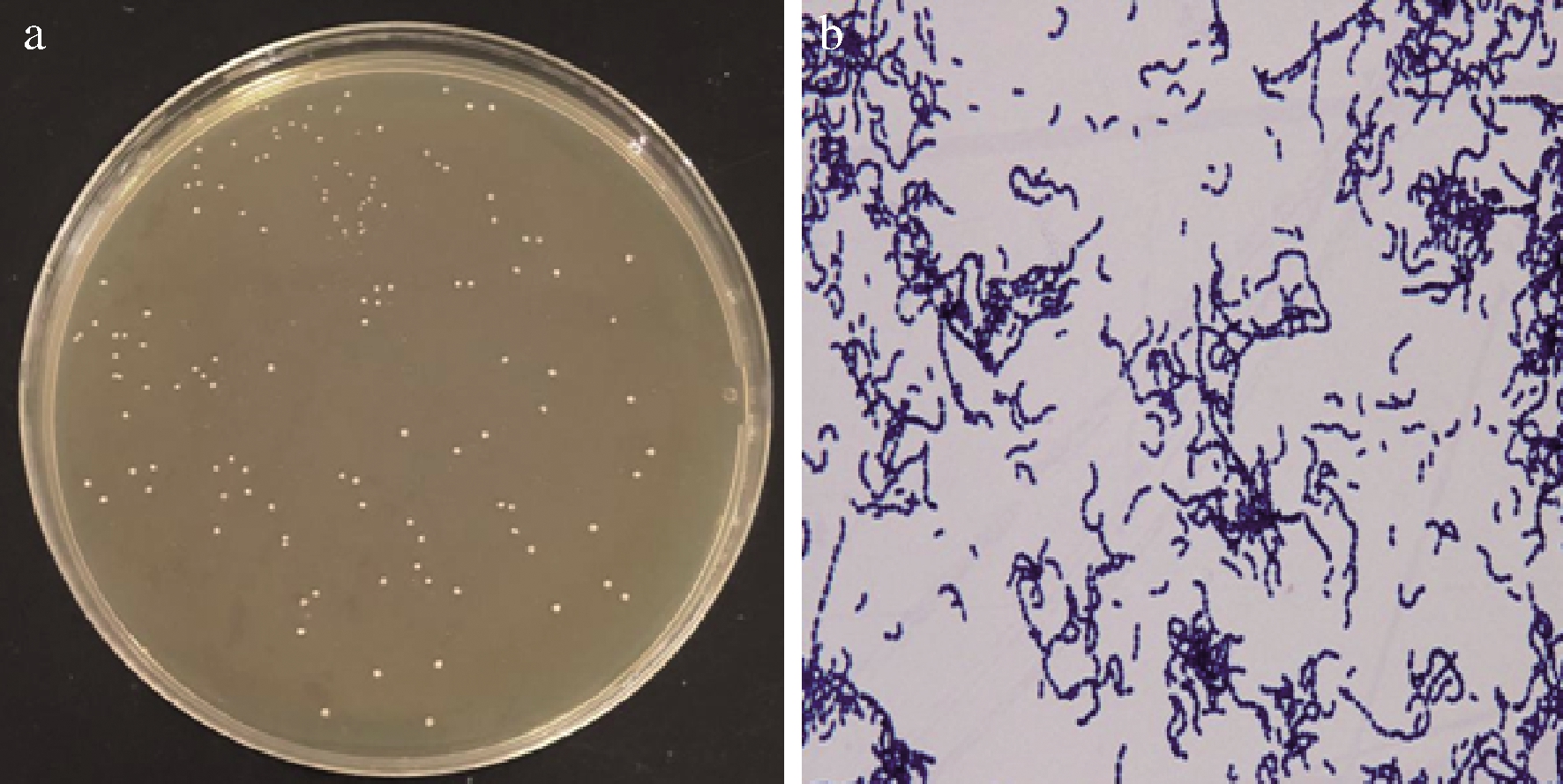
图2 WHH3379菌落形态(a)和菌体形态图(b)
Fig.2 Colonial(a)and cell morphologies(b)of strain WHH3379
菌株WHH3379可利用葡萄糖、乳糖和蔗糖3种碳水化合物(表1),不液化明胶,不水解精氨酸,不产硫化氢,过氧化氢酶试验和吲哚试验均呈阴性。将菌株WHH3379的16S rRNA基因序列的测序结果在NCBI数据库中应用BLAST工具与GenBank数据库已有序列进行比对分析,结果显示该菌株为嗜热链球菌(S.thermophilus),并将其命名为嗜热链球菌WHH3379。
表1 菌株WHH3379 API 50 CHL发酵实验结果
Table 1 API 50 CHL fermentation profiles of strain WHH3379
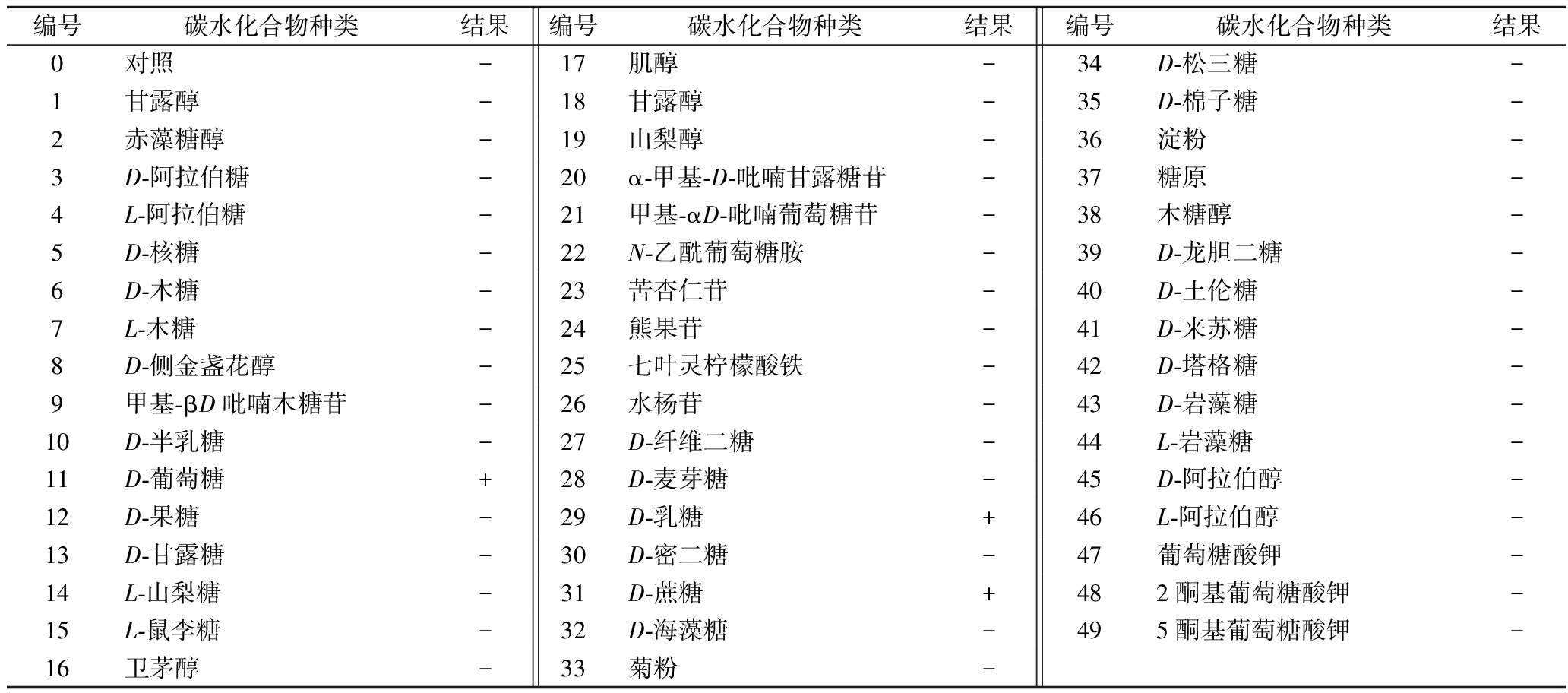
编号碳水化合物种类结果编号碳水化合物种类结果编号碳水化合物种类结果0对照-17肌醇-34D-松三糖-1甘露醇-18甘露醇-35D-棉子糖-2赤藻糖醇-19山梨醇-36淀粉-3D-阿拉伯糖-20α-甲基-D-吡喃甘露糖苷-37糖原-4L-阿拉伯糖-21甲基-αD-吡喃葡萄糖苷-38木糖醇-5D-核糖-22N-乙酰葡萄糖胺-39D-龙胆二糖-6D-木糖-23苦杏仁苷-40D-土伦糖-7L-木糖-24熊果苷-41D-来苏糖-8D-侧金盏花醇-25七叶灵柠檬酸铁-42D-塔格糖-9甲基-βD吡喃木糖苷-26水杨苷-43D-岩藻糖-10D-半乳糖-27D-纤维二糖-44L-岩藻糖-11D-葡萄糖+28D-麦芽糖-45D-阿拉伯醇-12D-果糖-29D-乳糖+46L-阿拉伯醇-13D-甘露糖-30D-密二糖-47葡萄糖酸钾-14L-山梨糖-31D-蔗糖+482酮基葡萄糖酸钾-15L-鼠李糖-32D-海藻糖-495酮基葡萄糖酸钾-16卫茅醇-33菊粉-
注:+:呈阳性;-:呈阴性(下同)
嗜热链球菌WHH3379是从青海海晏县农家自制酥油中分离得到,于2020年6月15日保藏于中国微生物菌种保藏管理委员会普通微生物菌种保藏中心,微生物保藏编号为CGMCC No.20089。
2.2 WHH3379生物学特性分析
2.2.1 WHH3379生长特性
由图3可知,嗜热链球菌WHH3379具有良好的生长情况和产酸速率,反映其较高的乳酸菌活力。嗜热链球菌WHH3379从2 h后快速生长进入对数生长期,6 h后即进入稳定期,显示出较快的生长速率;嗜热链球菌WHH3379在接种2 h后开始大量产酸,pH下降迅速,8 h后趋于平稳,pH为4.10左右,显示出优良的产酸速率。
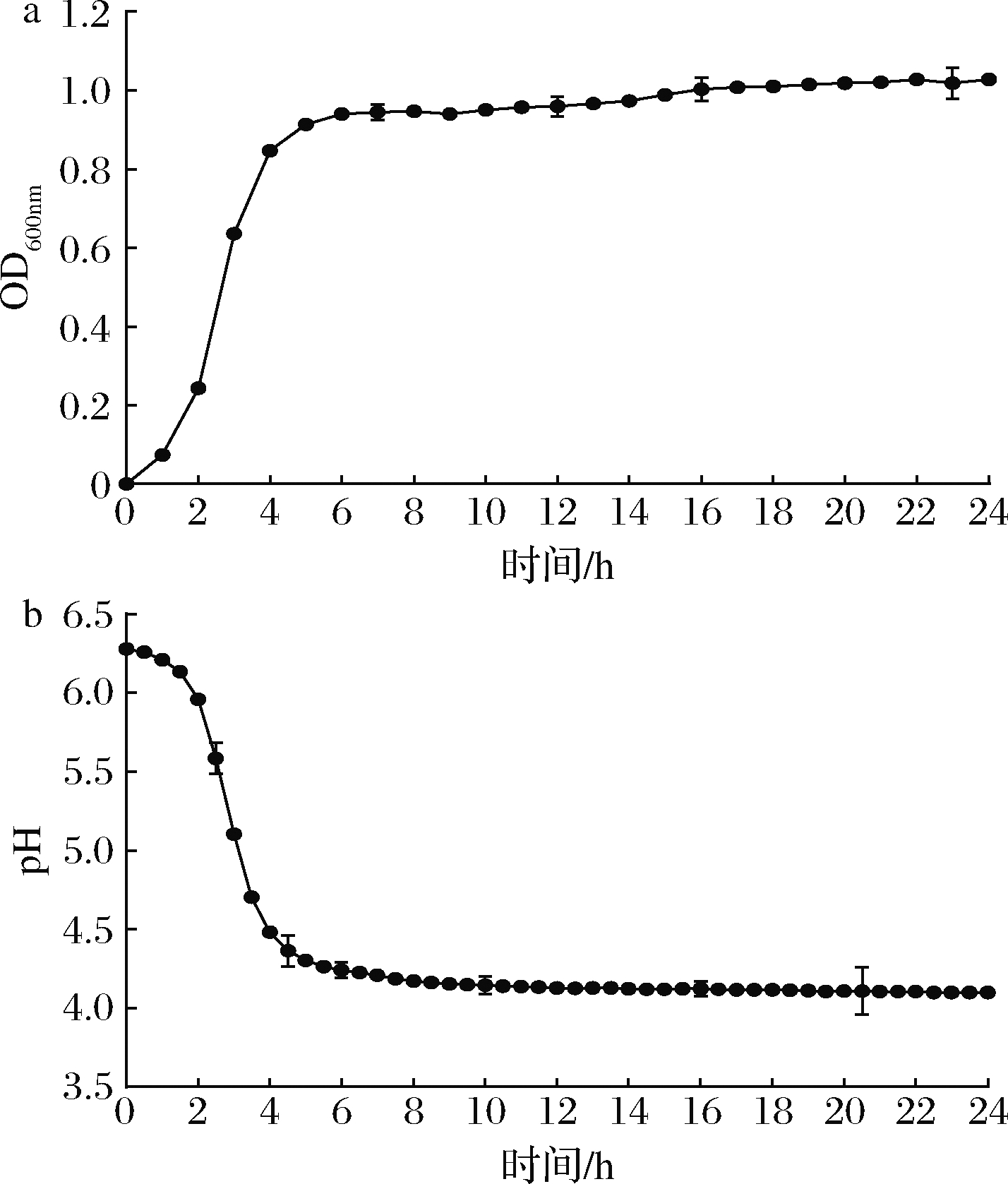
a-生长曲线;b-产酸曲线
图3 嗜热链球菌WHH3379的生长曲线和产酸曲线
Fig.3 Growth and acid production curves of S.thermophilus WHH3379
2.2.2 WHH3379耐酸耐胆盐特性
益生菌必须以活菌形态到达人体消化道才能更好的发挥其益生功能,而胃部的低pH环境会影响益生菌在肠道的定植[18],所以对酸的耐受性是衡量优良益生菌的重要指标。嗜热链球菌WHH3379的耐酸能力如图4-a所示,随着pH值的降低和培养时间的增加,菌株存活率有所降低。但是,在pH为2.5、3.5和4.5的酸度下孵育1 h后菌株存活率均>95%,孵育4 h后菌株存活率仍均>89%。再将pH进一步降低到1.5后,嗜热链球菌WHH3379孵育4 h后仍表现出了(72.85±1.18)%的存活率。从传统酸奶分离出的鼠李糖乳杆菌217-3在pH 1.5孵育4 h后的存活率为72%,来源于酵素液体的菌株B1在pH 1.5孵育4 h后的存活率为(95.57±3.07)%[19]。正常人体胃液的pH值在1.5~4.5波动变化,菌株可在pH 1.5~4.5维持较高的存活率,表明嗜热链球菌WHH3379具有优良的酸耐受性。
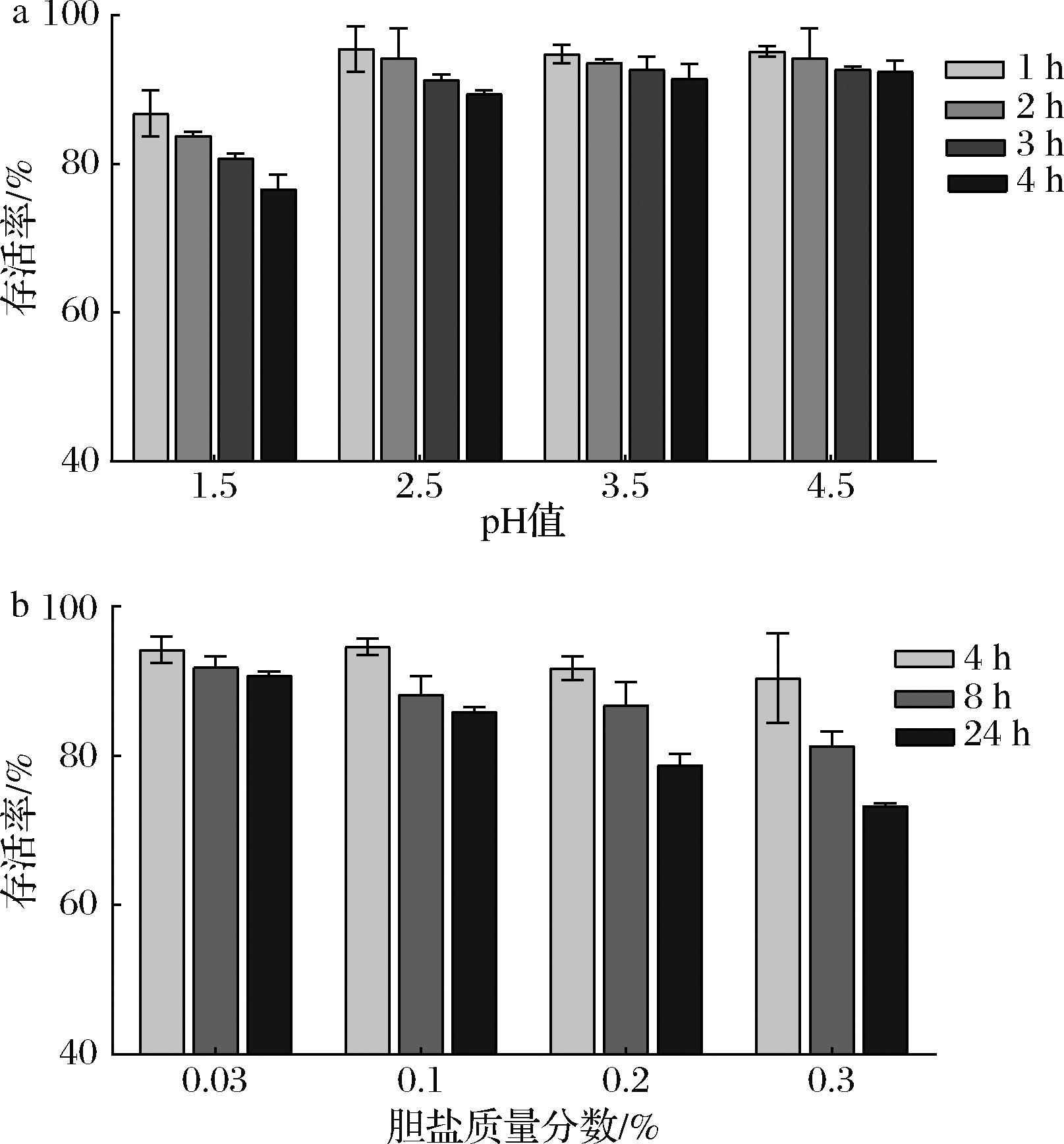
a-酸耐受性;b-胆盐耐受性
图4 嗜热链球菌WHH3379对酸、胆盐的耐受性测定
Fig.4 Tolerance of S.thermophilus WHH3379 to acids and bile salts
可以耐受人体小肠环境中的胆盐胁迫是衡量优良益生菌的重要指标,也是益生菌发挥功能的重要前提。嗜热链球菌WHH3379的耐胆盐能力如图4-b所示,随着胆盐浓度的增加和培养时间的增加,菌株存活率有所下降。嗜热链球菌WHH3379在胆盐含量为0.03%和0.1%的条件下孵育24 h后菌株存活率仍均>85%,在胆盐含量为0.3%的环境下培养4、8和24 h后的存活率分别为(90.83±1.05)%、(81.33±3.11)%和(73.41±1.45)%。植物乳杆菌KLDS 1.0318在0.3%胆盐培养4 h后的存活率仍可达95.40%[18],高于本研究中EPS的清除率。正常人体小肠的胆盐浓度在0.03%~0.3%波动[19],菌株在胆盐含量为0.03%~0.3%的条件下能够维持较高水平的存活率,表明嗜热链球菌WHH3379具有较好的胆盐耐受性。
2.3 WHH3379 EPS体外抗氧化活性分析
2.3.1 DPPH自由基清除能力的测定
菌株及其产物对DPPH自由基的清除作用可反映其降低过氧化自由基、烷自由基或脂质自由基连锁反应的能力[21]。如图5所示,随着WHH3379 EPS质量浓度的增加,对DPPH自由基清除能力也不断增加,表现出浓度依赖特征,但始终低于维生素C的清除率,当维生素C质量浓度为1 mg/mL时,清除率即可达到(90.3±1.35)%。当WHH3379 EPS质量浓度为5和8 mg/mL时,对DPPH自由基的清除率分别为(70.4±1.13)%和(79.9±2.26)%。假肠膜明串珠菌GX-3 EPS在质量浓度为5 mg/mL 时的清除率最大为65.34%[22],德式乳杆菌 EPS在质量浓度为5 mg/mL时的DPPH清除率为68.60%[23],均低于本研究中EPS对DPPH自由基的清除率。

图5 WHH3379 EPS对DPPH自由基的清除能力
Fig.5 DPPH radical scavenging capacity of WHH3379 EPS
2.3.2 ·OH清除能力的测定
·OH是最具反应活性和最危险的自由基,可通过活体免疫作用产生,对细胞和生物分子造成严重氧化应激损伤,从而导致衰老、癌症等疾病[24]。如图6所示,0.2~2 mg/mL质量浓度的WHH3379 EPS对·OH的清除能力>维生素C。当WHH3379 EPS质量浓度为5和8 mg/mL时,对·OH的清除率分别(68.9±0.98)%和(73.6±1.58)%,显示出良好的抗氧化性。融合魏斯氏菌H2产EPS对·OH的清除能力随EPS浓度的增加而提高,在5 mg/mL时的清除率为(42.56±0.16)%[16]。
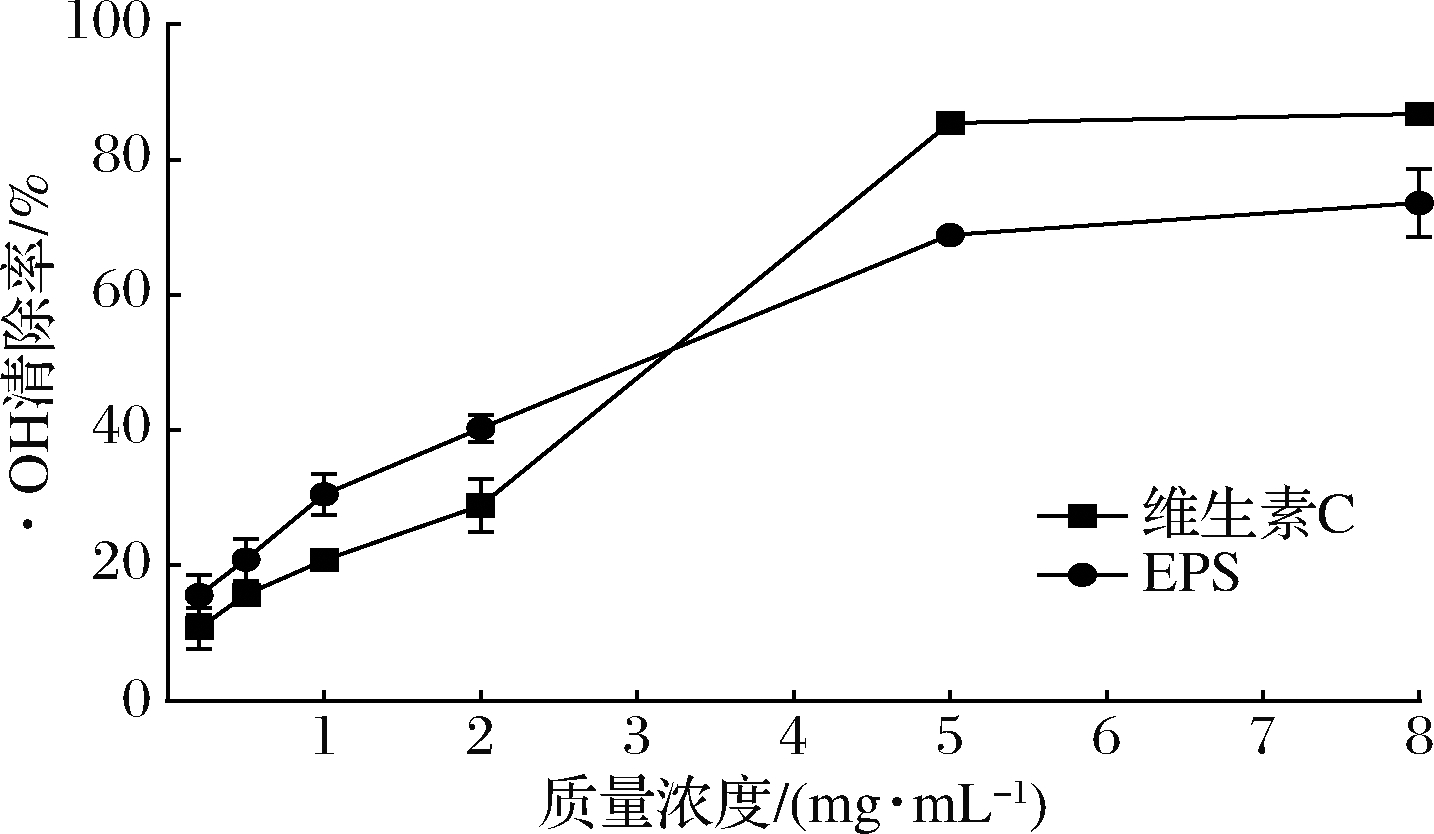
图6 WHH3379 EPS对·OH的清除能力
Fig.6 Hydroxyl radical scavenging capacity of WHH3379 EPS
![]() 清除能力的测定
清除能力的测定
![]() 是活性自由基的前体物质,可以与生物活性分子发生反应,造成脂质、DNA和蛋白质等的氧化损伤[25]。如图7所示,随着WHH3379 EPS浓度的增加,对
是活性自由基的前体物质,可以与生物活性分子发生反应,造成脂质、DNA和蛋白质等的氧化损伤[25]。如图7所示,随着WHH3379 EPS浓度的增加,对![]() 的清除率呈现不断提高后保持平稳的趋势,但始终低于维生素C。在WHH3379 EPS质量浓度为5和8 mg/mL时,对
的清除率呈现不断提高后保持平稳的趋势,但始终低于维生素C。在WHH3379 EPS质量浓度为5和8 mg/mL时,对![]() 清除率达到(60.3±0.21)%和(61.0±1.38)%。叶广彬等[23]研究发现假肠膜明串珠菌GX-3 EPS在质量浓度为5 mg/mL时对
清除率达到(60.3±0.21)%和(61.0±1.38)%。叶广彬等[23]研究发现假肠膜明串珠菌GX-3 EPS在质量浓度为5 mg/mL时对![]() 的清除率最大为(77.48±2.45)%,高于本研究EPS对
的清除率最大为(77.48±2.45)%,高于本研究EPS对![]() 的清除率。
的清除率。
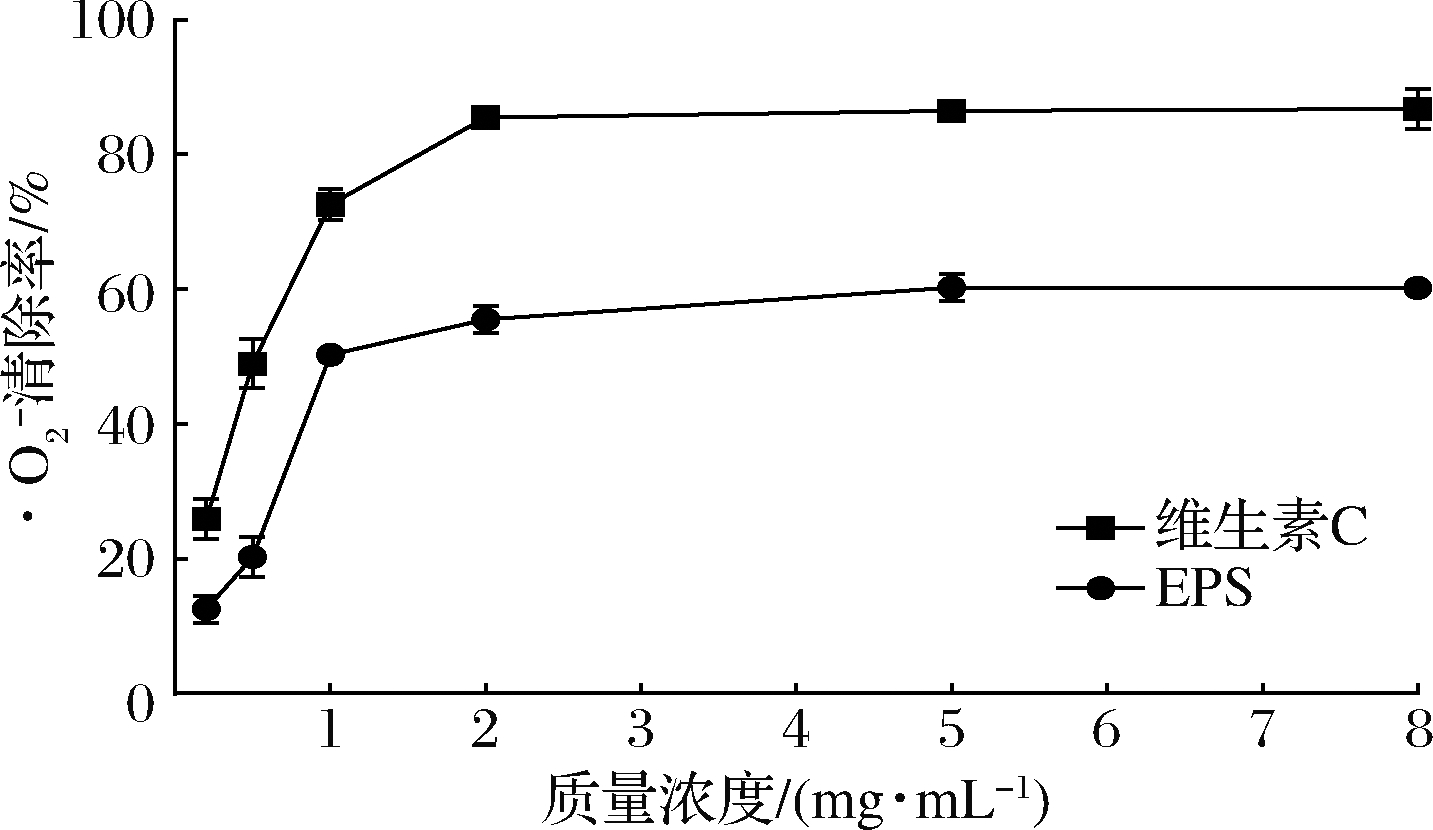
图7 WHH3379 EPS对![]() 的清除能力
的清除能力
Fig.7 Superoxide anion radical scavenging capacity of WHH3379 EPS
2.3.4 总还原力的测定
EPS可以通过提供氢原子的方式来阻断过氧化物的形成,破坏自由基反应链,防止氧化损伤,从而达到抗氧化效果。如图8所示,WHH3379 EPS的总还原力与样品浓度呈正相关,但始终低于维生素C。WHH3379 EPS在质量浓度为5和8 mg/mL时,其总还原力为(1.234±0.35)和(1.213±0.88),显著高于戊糖片球菌 SR2-2的EPS[26]。
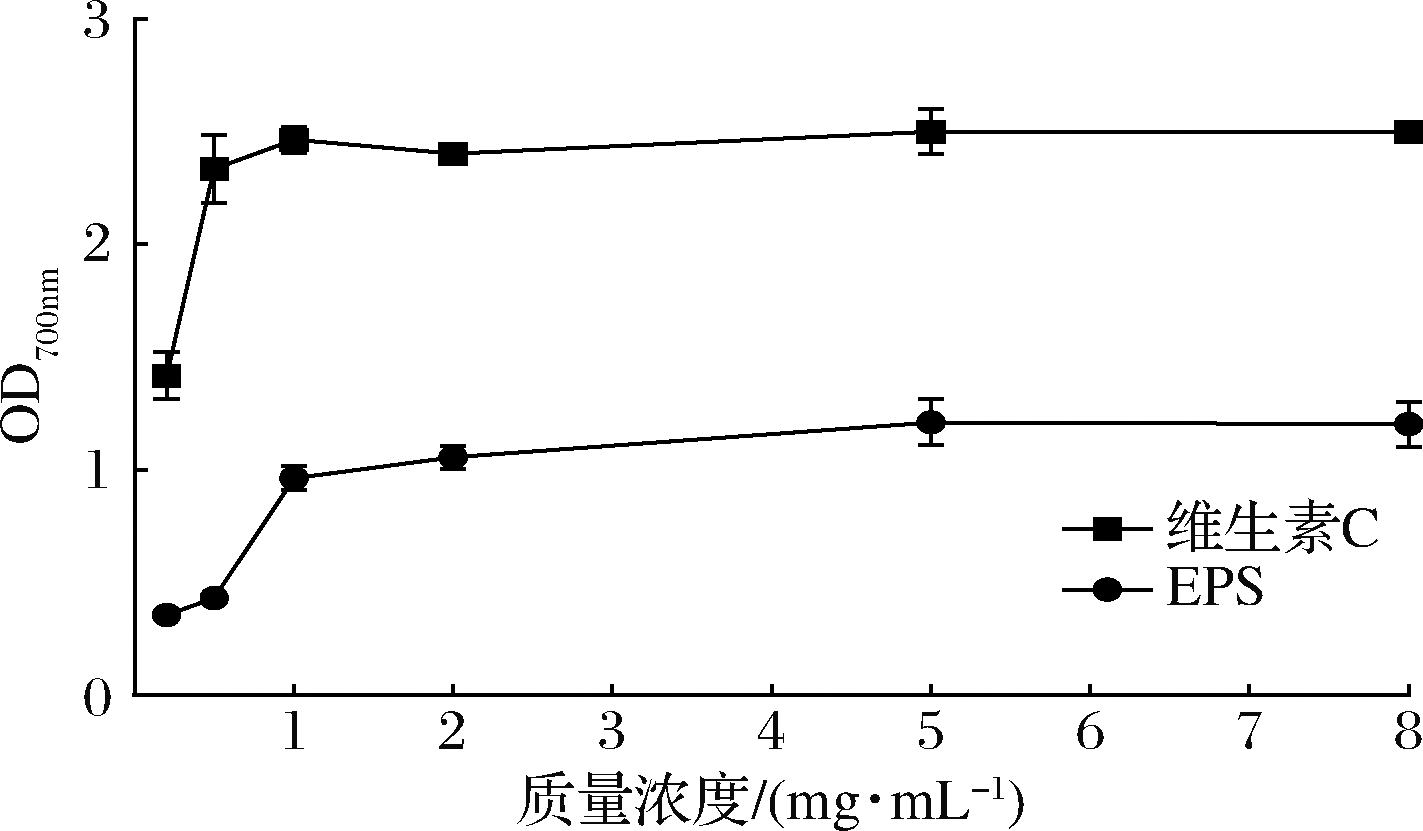
图8 WHH3379 EPS总还原力
Fig.8 Total reducing power of WHH3379 EPS
2.4 DVS的制备和应用
由高产EPS的嗜热链球菌WHH3379制得DVS,平板计数得嗜热链球菌WHH3379冻干菌粉活菌数为1.3×1011 CFU/g,达到发酵剂的活性要求。利用DVS发酵7 h得到的酸乳pH值为(4.42±0.15),酸度为(75.00±2.34)°T,拉丝长度可达(28.85±1.24)cm,黏度为(5 486±2.25)mPa·s和活菌数为1.89×108 CFU/mL(表2)。该发酵剂生产的发酵乳酸度适宜、产黏性好、感官评价高且后酸化现象不明显(图9),可作为一种功能性DVS应用于发酵食品中。
表2 WHH3379的发酵乳特性
Table 2 Characteristics of milk fermented by WHH3379 DVS

拉丝长度/cmpH值酸度/°T黏度/(mPa·s)活菌数/(CFU·mL-1)28.85±1.244.42±0.1575.00±2.345 486±2.251.89×108
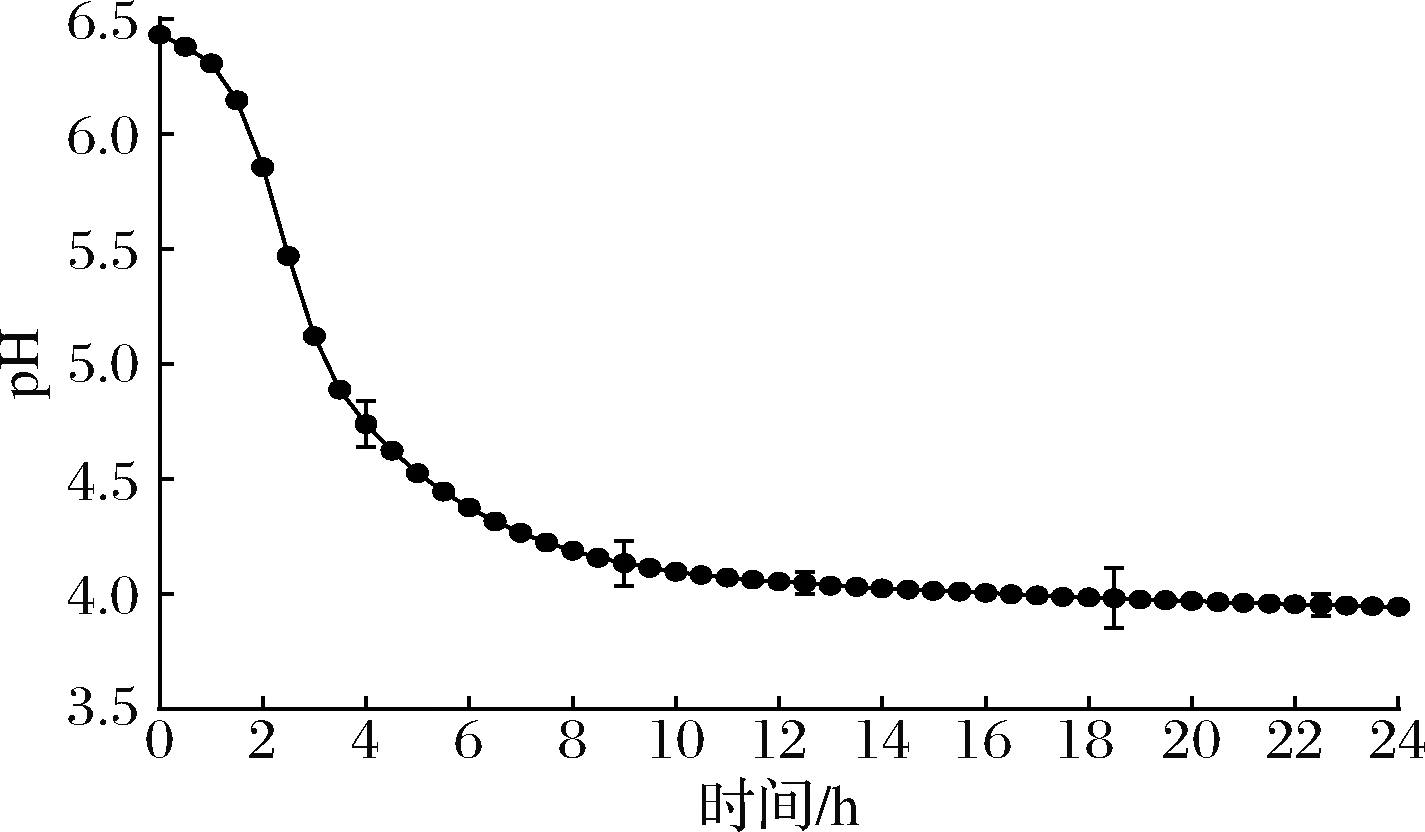
图9 WHH3379发酵乳产酸曲线
Fig.9 Acid production curve in WHH3379 fermented milk
3 讨论
乳酸菌EPS可作为稳定剂和增稠剂应用于乳品行业,起到改善乳制品质构和口感的作用,此外还具有抗氧化、抗肿瘤、增强免疫力及调节肠道菌群等多种益生功能[12]。EPS产量受到菌株类型、培养条件和培养基成分等因素的影响[11]。根据EPS产量可以将乳酸菌分为高产(≥180 mg/L)、中产(120~180 mg/L)和低产(<120 mg/L)EPS菌株[27]。本研究得到的嗜热链球菌WHH3379利用脱脂乳基料发酵得到的EPS产量为(526.58±2.91)mg/L,说明嗜热链球菌WHH3379是1株高产EPS的乳酸菌。
乳酸菌EPS在抗氧化方面的巨大潜力,使其可以作为一种安全、有效、无毒和来源广泛的天然抗氧化剂。其体外抗氧化功能主要通过清除体内各种自由基来实现,体内抗氧化功能主要通过提高机体抗氧化酶活性和增强机体抗脂质过氧化的作用来完成[28]。本研究中,嗜热链球菌WHH3379的EPS质量浓度在8 mg/mL时,对DPPH自由基、·OH和![]() 的清除率分别为(79.9±2.26)%、(73.6±1.58)%和(61.0±1.38)%,总还原力为(1.213±0.88),具有较好的抗氧化功能。
的清除率分别为(79.9±2.26)%、(73.6±1.58)%和(61.0±1.38)%,总还原力为(1.213±0.88),具有较好的抗氧化功能。
发酵乳具备的营养和益生功能越来越受到消费者的青睐,其市场需求量的增加也对相应发酵剂的稳定性和功能性提出要求。优良的发酵剂应该具有产酸快、产黏高、后酸化稳定和活菌数高等特点。本研究中由嗜热链球菌WHH3379制备的DVS得到的发酵乳黏度高,组织状态好,后酸化平缓,拉丝长度为(28.85±1.24)cm,黏度为(5 486±2.25)mPa·s,酸度为(75.00±2.34)°T和活菌数为1.89×108 CFU/mL,同时嗜热链球菌WHH3379 EPS又具有抗氧化功能,可作为一种功能性DVS应用于发酵食品中。
4 结论
本研究从青海农家自制酥油样品中分离得到1株高产EPS乳酸菌,经形态学鉴定、生理生化实验和分子生物学实验,鉴定该菌株为S.thermophilus,命名为嗜热链球菌WHH3379,微生物保藏编号为CGMCC No.20089。以嗜热链球菌WHH3379为出发菌株利用脱脂乳基料发酵,EPS产量为(526.58±2.91)mg/L。研究发现嗜热链球菌WHH3379具有良好的耐酸耐胆盐特性,且其产EPS具有良好的抗氧化活性。此外,由嗜热链球菌WHH3379制得的DVS具有优良的发酵特性,得到的发酵乳黏性高、质构细腻。因此,嗜热链球菌WHH3379作为高产EPS并具有益生功能的乳酸菌发酵剂具有广阔的工业应用前景。
[1] 陈海燕,李嘉雯,李婷,等.高产胞外多糖嗜热链球菌的筛选及胞外多糖的结构分析[J].中国食品学报,2021,21(4):286-294.
CHEN H Y,LI J W,LI T,et al.Selection of Streptococcus thermophilus for high extracellular polysaccharide production and structural analysis of extracellular polysaccharide[J].Journal of Chinese Institute of Food Science and Technology,2021,21(4):286-294.
[2] RAHBAR SAADAT Y,YARI KHOSROUSHAHI A,POURGHASSEM GARGARI B.A comprehensive review of anticancer,immunomodulatory and health beneficial effects of the lactic acid bacteria exopolysaccharides[J].Carbohydrate Polymers,2019,217:79-89.
[3] 高云云,李宝坤,卢士玲,等.新疆传统乳品中产胞外多糖乳酸菌的筛选及益生特性的研究[J].中国酿造,2020,39(5):28-34.
GAO Y Y,LI B K,LU S L,et al.Screening and probiotic characteristics of extracellular polysaccharide-producing lactic acid bacteria from traditional dairy products in Xinjiang[J].China Brewing,2020,39(5):28-34.
[4] ZHOU Y,CUI Y H,QU X J.Exopolysaccharides of lactic acid bacteria:Structure,bioactivity and associations:A review[J].Carbohydrate Polymers,2019,207:317-332.
[5] ABDHUL K,GANESH M,SHANMUGHAPRIYA S,et al.Antioxidant activity of exopolysaccharide from probiotic strain Enterococcus faecium(BDU7)from Ngari[J].International Journal of Biological Macromolecules,2014,70:450-454.
[6] ZHOU Q Q,FENG F,YANG Y F,et al.Characterization of a dextran produced by Leuconostoc pseudomesenteroides XG5 from homemade wine[J].International Journal of Biological Macromolecules,2018,107:2 234-2 241.
[7] S WÉN E,HUTTUNEN E,ZHANG X,et al.Structural analysis of the exopolysaccharide produced by Streptococcus thermophilus ST1 solely by NMR spectroscopy[J].Journal of Biomolecular NMR,2010,47(2):125-134.
WÉN E,HUTTUNEN E,ZHANG X,et al.Structural analysis of the exopolysaccharide produced by Streptococcus thermophilus ST1 solely by NMR spectroscopy[J].Journal of Biomolecular NMR,2010,47(2):125-134.
[8] 孙盛,陈作国,俞赟霞,等.产胞外多糖植物乳杆菌WHH589 的免疫活性及其在发酵乳中的应用[J].食品与发酵工业,2021,47(13):43-50.
SUN S,CHEN Z G,YU Y X,et al.The immunomodulatory activity of Lactobacillus plantarum WHH589 with extracellular polysaccharide-producing property and its application in fermented milk[J].Food and Fermentation Industries,2021,47(13):43-50.
[9] SARAVANAN C,SHETTY P K H.Isolation and characterization of exopolysaccharide from Leuconostoc lactis KC117496 isolated from idli batter[J].International Journal of Biological Macromolecules,2016,90:100-106.
[10] 唐艳,谢芳,杨承剑,等.水牛乳中高产胞外多糖乳酸菌的筛选与鉴定[J].中国酿造,2016,35(2):70-73.
TANG Y,XIE F,YANG C J,et al.Screening and identification of lactic acid bacteria with high yield extracellular polysaccharides from buffalo milk[J].China Brewing,2016,35(2):70-73.
[11] 刘刚,梁琪,宋雪梅,等.Plackett-Burman和Box-Behnken试验优化嗜热链球菌Q4F8产胞外多糖工艺[J].食品科学,2019,40(20):136-143.
LIU G,LIANG Q,SONG X M,et al.Optimization of extracellular polysaccharide production by Streptococcus thermophilus QF48 using Plackett-Burman and Box-Behnken design[J].Food Science,2019,40(20):136-143.
[12] 周晴晴.产胞外多糖假肠膜明串珠菌XG5的分离及多糖结构和性质的研究[D].天津:天津大学,2018.
ZHOU Q Q.Isolation of exopolysaccharide-producing Leuconostoc pseudomesenteroides XG5 and structure and properties analysis of exopolysaccharide[D].Tianjin:Tianjin University,2018.
[13] CHEN S,CHEN L,CHEN L,et al.Potential probiotic characterization of Lactobacillus reuteri from traditional Chinese highland barley wine and application for room-temperature-storage drinkable yogurt[J].Journal of Dairy Science,2018,101(7):5 780-5 788.
[14] WU H C,CHEN H M,SHIAU C Y.Free amino acids and peptides as related to antioxidant properties in protein hydrolysates of mackerel(Scomber austriasicus)[J].Food Research International,2003,36(9-10):949-957.
[15] PAN D D,MEI X M.Antioxidant activity of an exopolysaccharide purified from Lactococcus lactis subsp.lactis 12[J].Carbohydrate Polymers,2010,80(3):908-914.
[16] 姜静,杜仁鹏,郭尚旭,等.融合魏斯氏菌胞外多糖的分离纯化及其生化特性[J].食品科学,2020,41(1):9-15.
JIANG J,DU R P,GUO S X,et al.Separation,purification and biochemical properties of exopolysaccharides from Weissella confusa[J].Food Science,2020,41(1):9-15.
[17] PENG X Y,XIONG Y L,KONG B H.Antioxidant activity of peptide fractions from whey protein hydrolysates as measured by electron spin resonance[J].Food Chemistry,2009,113(1):196-201.
[18] 蒙月月,陆婧婧,占萌,等.植物乳杆菌KLDS 1.0318 产酸、耐酸、耐胆盐能力及其免疫特性研究[J].食品工业科技,2018,39(15):70-76.
MENG Y Y,LU J J,ZHAN M,et al.Study on the acid producing ability,acid and bile salt tolerance of Lactobacillus plantarum KLDS 1.0318 and its immunologic properties[J].Science and Technology of Food Industry,2018,39(15):70-76.
[19] 刘之园,贾俊霞,姜昊蔚,等.耐酸耐胆盐益生菌的筛选及其益生特性研究[J].中国酿造,2020,39(11):103-108.
LIU Z Y,JIA J X,JIANG H W,et al.Screening of probiotics resistant to acid and bile salt and their probiotic properties[J].China Brewing,2020,39(11):103-108.
[20] 卢承蓉,叶美芝,上官文丹,等.高产胞外多糖乳酸菌的诱变育种及其益生特性[J].食品与发酵工业,2020,46(12):14-20.
LU C R,YE M Z,SHANGGUAN W D,et al.Mutation breeding for high-yield exopolysaccharide lactic acid bacteria and evaluation of its probiotic properties[J].Food and Fermentation Industries,2020,46(12):14-20.
[21] 张莉.植物乳杆菌的黏附特性研究及其在益生菌干酪中的应用[D].长春:吉林大学,2013.
ZHANG L.Study on adhesion properties of Lactobacillus plantarum and applications in probiotic cheese[D].Changchun:Jilin University,2013.
[22] 叶广彬,陈源红,王长丽,等.假肠膜明串珠菌胞外多糖的分离纯化及其抗氧化特性研究[J].食品研究与开发,2019,40(3):31-37.
YE G B,CHEN Y H,WANG C L,et al.Separation,purification and antioxidant activity of exopolysaccharide from Leuconostoc pseudomesenteroides[J].Food Research and Development,2019,40(3):31-37.
[23] ADEBAYO-TAYO B,FASHOGBON R.In vitro antioxidant,antibacterial,in vivo immunomodulatory,antitumor and hematological potential of exopolysaccharide produced by wild type and mutant Lactobacillus delbureckii subsp.bulgaricus[J].Heliyon,2020,6(2):e03268.
[24] WANG X,SHAO C G,LIU L,et al.Optimization,partial characterization and antioxidant activity of an exopolysaccharide from Lactobacillus plantarum KX041[J].International Journal of Biological Macromolecules,2017,103:1 173-1 184.
[25] 吴琼,郑成,宁正祥,等.碱溶性银耳粗多糖的提取及其清除自由基作用的研究[J].食品科学,2007,28(6):153-155.
WU Q,ZHENG C,NING Z X,et al.Study on extraction and antioxidant effects of crude alkai-soluble Tremella polysaccharide[J].Food Science,2007,28(6):153-155.
[26] 张玉龙,胡萍,王金龙,等.产胞外多糖乳酸菌的筛选及抗氧化特性研究[J].中国酿造,2015,34(10):37-42.
ZHANG Y L,HU P,WANG J L,et al.Isolation of exopolysaccharides-producing lactic acid bacteria and its antioxidant properties[J].China Brewing,2015,34(10):37-42.
[27] 李向菲,周炜,印伯星,等.产胞外多糖能力不同的混合乳酸菌对二型糖尿病的影响[J].中国食品学报,2018,18(9):16-24.
LI X F,ZHOU W,YIN B X,et al.Effects of mixed lactic acid bacteria which producted exopolysaccharide on type 2 diabetic mice[J].Journal of Chinese Institute of Food Science and Technology,2018,18(9):16-24.
[28] ZHANG L,LIU C H,LI D,et al.Antioxidant activity of an exopolysaccharide isolated from Lactobacillus plantarum C88[J].International Journal of Biological Macromolecules,2013,54:270-275.