金银花是忍冬干燥的花蕾,具有解热、抗炎、抗菌、抗病毒、免疫调节、降血脂和抗氧化等生理功能[1-3]。1984年国家中医药管理局将其确定为35种名贵中药材之一,后来又被定为药食两用品种。
微生物具有极强的生物转化能力,能够改善食品的风味,减弱毒性,改变食品成分[4]。液态发酵中多采用单一菌种如植物乳杆菌、酵母菌等,发酵后抗氧化性得到不同程度的提高,总多酚的含量也得到一定的提升。陈康等[5]使用植物乳杆菌对金银花进行液态发酵,发现在浸提液中的绿原酸含量基本稳定。徐文流等[6]发现,金银花经红曲霉固态发酵后,绿原酸含量增加,抗氧化能力提高。为改善食品风味,近年来混合菌种发酵应用较为广泛,在红枣汁[7]、果酒[8]、蔬菜[9]等发酵中已经取得一些较好的结果。此外由于酵母菌和乳酸菌存在协同作用及代谢交换[10],也成为国内外学者研究的热点之一。目前关于多菌混合发酵金银花的研究较少,且研究多数集中在固态发酵改变物质的风味上,发酵的结果多数以物质总量表征[11],对发酵过程中各物质含量变化情况以及如何变化鲜有报道。本研究使用酿酒酵母和植物乳杆菌混合发酵金银花浸提液,采用超高效液相色谱飞行时间质谱(ultra high performance liquid chromatography time of flight mass spectrometry,UHPLC-Q-TOF-MS)和超高效液相色谱三重四极杆串联质谱(ultra high performance liquid chromatography triple quadrupole tandem mass spectrometry,UHPLC-QQQ-MS/MS)研究发酵前后金银花浸提液的有效组分变化,为混菌液态发酵金银花提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 实验菌种
酿酒酵母(Saccharomyces cerevisiae)、植物乳杆菌(Lactobacillus plantarum),本实验室筛选保藏。
1.1.2 实验材料
金银花,安徽皖印堂。
1.1.3 实验试剂
绿原酸(批号PCS-191210)、咖啡酸(批号PCS-200110)、阿魏酸(批号PCS-190803)、木犀草素(批号PCS-191218)、木犀草苷(批号PCS-190918)(HPLC>98%),北京世纪奥科生物技术有限公司;DPPH、ABTS,麦克林试剂;其余试剂为国药集团分析纯。
1.2 仪器与设备
ZQZY-88CV振荡培养箱,上海知楚仪器有限公司;SW MAGELLAN V7.2-SP1 TRA2PC多功能酶标仪,奥地利Tecan有限公司;LC-1290超高效液相色谱、C18超高效色谱柱(ZORBAX RRHD Eclipse Plus 2.1 mm×50 mm 1.8 μm)、LC-1290-TQ 6470 UHPLC-QQQ-MS/MS,美国Agilent科技有限公司;Tims Tof Pro飞行时间质谱仪,德国Bruker科技有限公司。
1.3 实验方法
1.3.1 种子培养
将活化后的酿酒酵母接种在PDA培养基中,32 ℃、150 r/min培养18 h待用,将活化的植物乳杆菌接种入MRS培养基中,35 ℃、150 r/min培养24 h待用,以OD600表征生物量。
1.3.2 金银花浸提液及发酵液的制备
取粉碎后的金银花,配制成质量分数为3%的浊液,水浴锅中65 ℃浸提120 min,8 000 r/min离心15 min,在上清液中添加1%的葡萄糖,使用水浴锅90 ℃消毒120 s,分别接种体积分数为2.5%的植物乳杆菌和酿酒酵母,在32 ℃、140 r/min发酵72 h获得发酵液。对照组以相同方法处理,于4 ℃冰箱保存待用。
1.3.3 黄酮含量的测定
采用AlCl3-NaNO2-NaOH比色法[12],结果以芦丁计(单位mg/mL),绘制标准曲线,回归方程Y=4.062 9x+0.037 76,R2=0.998 15。
1.3.4 多酚含量的测定
多酚含量的测定采用福林酚比色法测定[13],结果以焦性没食子酸计(单位mg/mL),绘制标准曲线,回归方程Y=18.4x+0.058 27,R2=0.993 07。
1.3.5 抗氧化活性检测
DPPH自由基清除率:参考文献[14]稍加调整。取样液2 mL于试管中,加入2 mL的DPPH溶液,空白组以无水乙醇作对照,样品溶液做参照,室温下避光反应20 min测定其在517 nm处的吸光值。清除率的计算如公式(1)所示:
DPPH自由基清除率![]()
(1)
式中:A样品,样品组在517 nm处吸光值;A对照,对照组在517 nm处吸光值;A空白,空白对照组在517 nm处吸光值。
ABTS阳离子自由基清除率:参考文献[15]稍加调整。ABTS工作液V(7.4 mmol/L ABTS)∶V(2.6 mmol/L K2S2O8)=1∶1避光保存过夜,用无水乙醇稀释后得到工作液。反应总体系1 mL,样品0.2 mL,工作液0.8 mL,反应时间30 min,以无水乙醇做空白对照。清除率的计算如公式(2)所示:
ABTS阳离子自由基清除率![]()
(2)
式中:A样品,样品组在734 nm处吸光值;A对照,对照组在734 nm处吸光值;A空白,空白对照组在734 nm处吸光值。
1.3.6 定性和定量分析
定性分析:使用UHPLC-Q-TOF-MS对发酵前后的浸提液进行组分分析,将对照组和发酵组进行稀释,使用0.22 μm滤膜过滤获得待测液。分析方法如下:离子源ESI源,UHPLC柱温40 ℃,进样量5 μL,流速0.3 mL/min,流动相分别为0.1%甲酸水(A)和甲醇(B)洗脱梯度(0~9 min,95%~90% A;10~20 min,75%~20%A;21~30 min,20%~10%A;30~35 min,10%~95%A)洗脱时间35 min,预实验结果显示金银花有效成分在负离子模式下响应较好,故TOF-MS采用负模式进行检测。质谱检测结果使用Metabo Scape软件进行谱库检索以及调取对应的二级碎片离子参考相应文献[2]确定对应物质。
定量分析:使用LC-MS对相应物质进行定量。液相条件:HPLC柱温40 ℃,进样量5 μL,流速0.3 mL/min,流动相分别为0.1%甲酸水(A)和甲醇(B)洗脱梯度(0~6 min,95%~92%A;6~10 min,92%~75%A;10~15 min,75%~60%A;15~20 min,60%~45%A;20~30 min,45%~15%A;30~40 min,15%~95%A)洗脱时间40 min。MS条件:干燥气流速5.0 L/min,温度300 ℃,鞘气流速11.0 L/min,温度250 ℃,喷雾气45.0 psi,毛细管电压3 500 V(-),正模式4 500 V(+)。各物质质谱检测条件及标准曲线见表1。
表1 标准曲线及质谱条件
Table 1 Standard curves and mass spectrometry measuring conditions
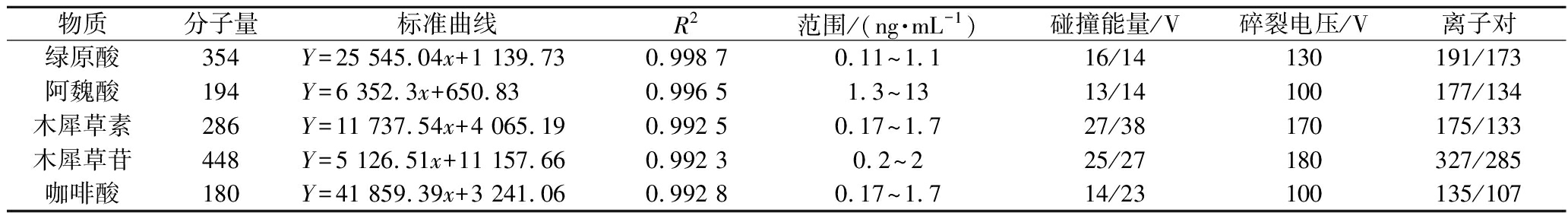
物质分子量标准曲线R2范围/(ng·mL-1)碰撞能量/V碎裂电压/V离子对绿原酸354Y=25 545.04x+1 139.730.998 70.11~1.116/14130191/173阿魏酸194Y=6 352.3x+650.830.996 51.3~1313/14100177/134木犀草素286Y=11 737.54x+4 065.190.992 50.17~1.727/38170175/133木犀草苷448Y=5 126.51x+11 157.660.992 30.2~225/27180327/285咖啡酸180Y=41 859.39x+3 241.060.992 80.17~1.714/23100135/107
2 结果与分析
2.1 菌体生长及pH变化
由图1可知,对照组OD600和pH变化不显著,发酵组OD600与pH变化明显;发酵组菌体快速增长并在24 h达到最大值,24 h后生物量维持相对稳定,发酵组pH在12 h内剧烈下降,由4.9下降至3.5。
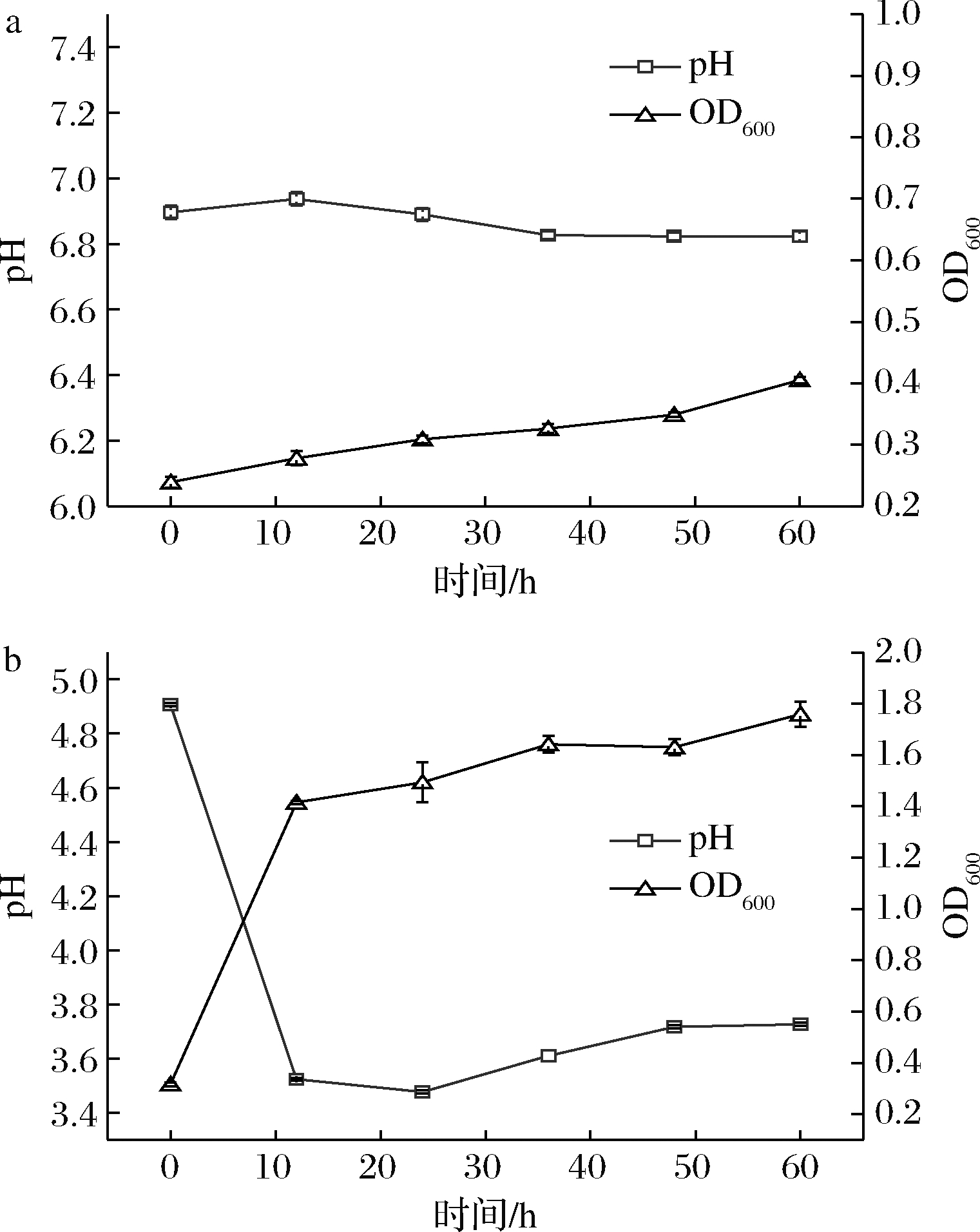
a-对照组;b-发酵组
图1 发酵过程中菌体量及pH变化
Fig.1 Changes of biomass and pH during fermentation
2.2 金银花发酵浸提液不同时间多酚和黄酮含量的变化
如图2所示,对照组黄酮和多酚含量呈现轻微下降趋势,分别由71和48 mg/g下降至67和47 mg/g,发酵组黄酮由72下降至65维持至24 h,24 h后逐渐回升增高由65提升到79 mg/g;多酚呈现出明显上升趋势,由47.7提升到59.4 mg/g。
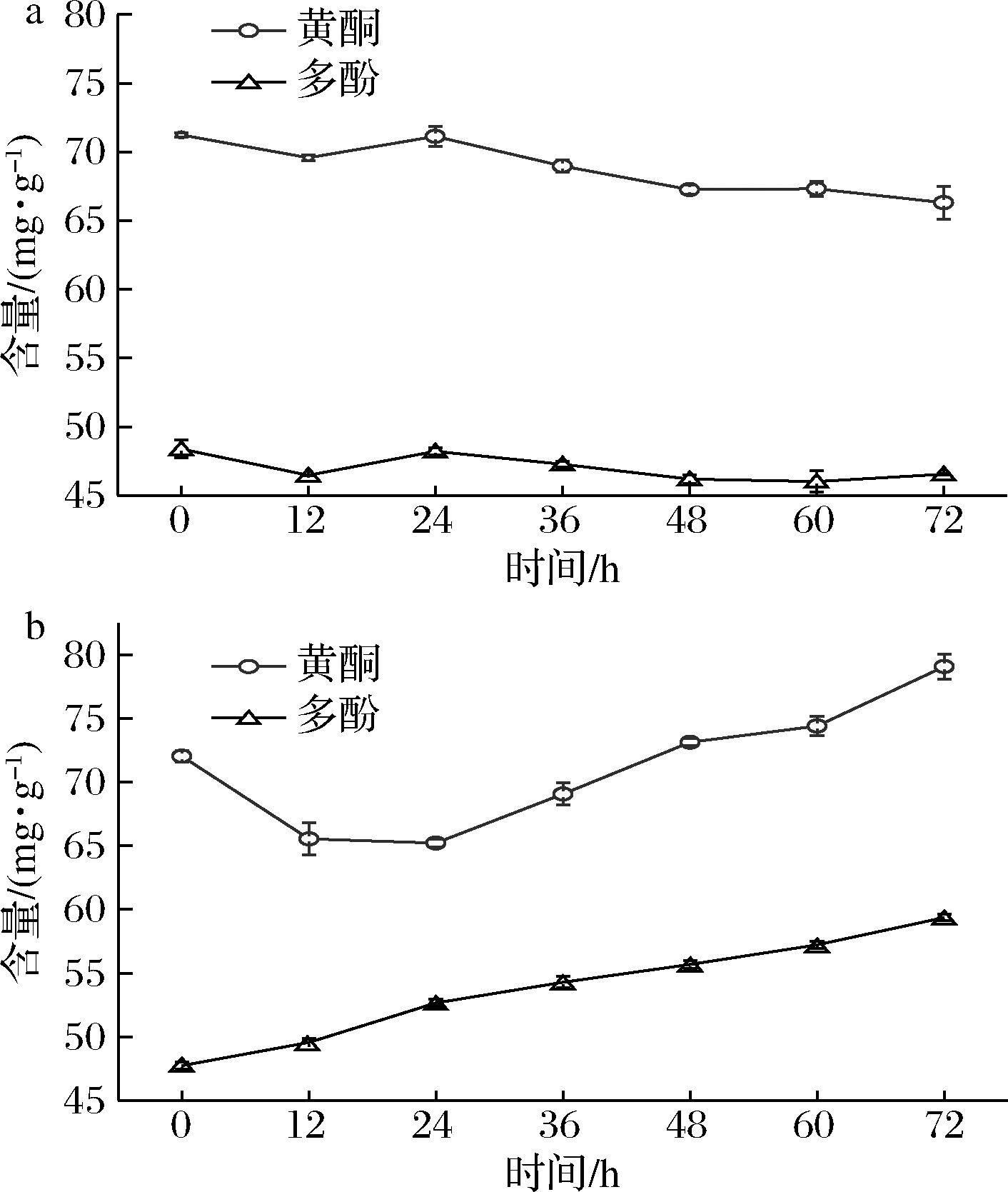
a-对照组;b-发酵组
图2 发酵过程中黄酮和多酚的含量变化
Fig.2 Concentration changes of total flavonoids and polyphenols during fermentation
2.3 发酵金银花浸提液不同时间自由基清除能力的变化
经发酵后金银花浸提液的抗氧化能力发生改变,结果如图3所示,在DPPH自由基清除实验中,对照组在0~72 h内整体相对稳定,发酵组的DPPH自由基清除率在各时间点均高于对照组,由初始的60%提升到71%,提升显著;ABTS阳离子自由基清除实验中发酵组的清除率在12 h时低于对照组,12 h后清除率较对照组得到提高。

a-DPPH自由基清除率;b-ABTS阳离子自由基清除率
图3 发酵过程中自由基清除能力变化
Fig.3 Changes of free radical scavenging ability during fermentation
2.4 发酵前后金银花浸提液组分定性结果
使用UHPLC-Q-TOF-MS分析对照组和发酵结束(72 h)浸提液的组分变化,以火山图和热图的形式展示结果(图4)。火山图展现出对照组与发酵组有较大的改变。由热图分析发现,发酵后浸提液中3,5-二咖啡酰奎尼酸、阿魏酰奎尼酸、木犀草素、莽草酸、脱氢莽草酸、肉桂酸等的含量有明显的提升(P<0.05),葡萄糖、甘露糖、蜜二糖、塔罗糖、奎尼酸、香豆素、木犀草苷、当药苦苷等的含量有着明显的降低(P<0.05)。十四烷二酸、十三碳二元酸、十二碳二元酸、壬二酸等二元酸的含量也有较明显的提升(P<0.1)。

a-火山图;b-组分热图
图4 对照组与发酵组火山图及组分热图的比较
Fig.4 Comparison of volcanic map and component heat map between the control and fermentation group
2.5 金银花有效组分的定量分析结果
依据2.4的检测结果,选取金银花的有效成分,使用LC-MS的多反应监测模式对发酵前后绿原酸、木犀草苷、木犀草素、阿魏酸、咖啡酸进行测定,结果如表2所示。5种物质含量的变化与TOF-MS的检测结果吻合,金银花浸提液经发酵,绿原酸含量由26.566 mg/g提升到31.338 mg/g,提升17.96%;木犀草苷由0.897 mg/g下降至0.063 mg/g;阿魏酸、咖啡酸和木犀草素的含量有所提高。
表2 发酵组的LC-MS定量结果
Table 2 Quantitative results by LC-MS of fermentation group
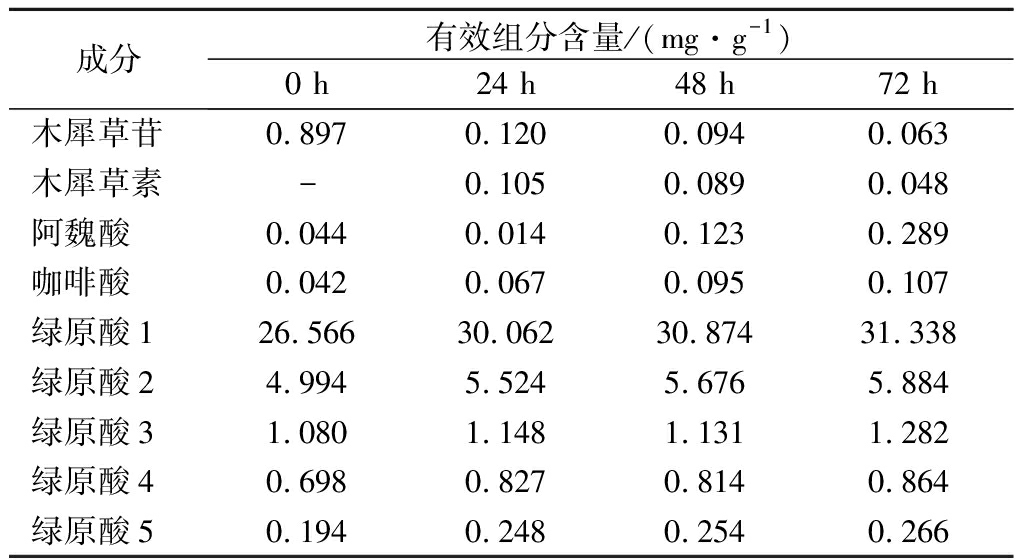
成分有效组分含量/(mg·g-1)0 h24 h48 h72 h木犀草苷0.8970.1200.0940.063木犀草素-0.1050.0890.048阿魏酸0.0440.0140.1230.289咖啡酸0.0420.0670.0950.107绿原酸126.56630.06230.87431.338绿原酸24.9945.5245.6765.884绿原酸31.0801.1481.1311.282绿原酸40.6980.8270.8140.864绿原酸50.1940.2480.2540.266
3 结论
采用UHPLC-Q-TOF-MS对金银花浸提液的成分进行定性分析,发现发酵使得浸提液的组分发生改变。其中有191种物质含量下降,182种物质含量上升。奎尼酸的含量明显下降(P<0.05),但莽草酸的含量却在明显增加(P<0.05),证明奎尼酸在发酵的过程中被利用。同时阿魏酰奎尼酸、绿原酸含量提升明显(P<0.05),因此在发酵的进程中可能产生了一些酶类,能够使咖啡酸和阿魏酸与奎尼酸反应,从而提高绿原酸和阿魏酰奎尼酸的含量。由木犀草苷含量的变化与木犀草素的变化推测,在发酵进程中产生某些物质能够将苷类物质的糖苷降解,暴露出苷元,当药苦苷、马钱苷含量的降低也源于此。
本研究采用植物乳杆菌和酿酒酵母混合发酵金银花浸提液,浸提液经发酵后,黄酮的含量提升10%、多酚的含量提升了24%;抗氧化性能得到提高,自由基清除率得到一定的提升,DPPH自由基清除率由55%提升到71%,ABTS阳离子自由基清除率由59%提升到64%;此外,部分糖苷类化合物被降解,分子量变小更易被吸收利用。因此,采用混菌发酵的方法能够提升金银花浸提液的品质,同时也为金银花饮品的开发提供了理论基础。
[1] 杜叶青,段治康,董舒卉,等.基于网络药理学的金银花活性成分抗炎作用机制的研究[J].中国药物化学杂志,2019,29(2):96-102.
DU Y Q,DUAN Z K,DONG S H,et al.Network pharmacology analysis of the anti-inflammatory pharmacological mechanisms of active ingredients from Lonicera japonica[J].Chinese Journal of Medicinal Chemistry,2019,29(2):96-102.
[2] 吴娇,王聪,于海川.金银花中的化学成分及其药理作用研究进展[J].中国实验方剂学杂志,2019,25(4):225-234.
WU J,WANG C,YU H C.Chemical constituents and pharmacological effect of Lonicerae japonicae flos[J].Chinese Journal of Experimental Traditional Medical Formulae,2019,25(4):225-234.
[3] 张敏敏,赵志国,刘倩,等.基于离线2D-HPLC-DPPH-ESI-Q-TOF/MS联用技术的金银花抗氧化成分系统筛选研究[J].中草药,2021,52(11):3 193-3 200.
ZHANG M M,ZHAO Z G,LIU Q,et al.Rapid discovery of trace antioxidants in Lonicerae japonicae flos by 2D-HPLC-DPPH-ESI-TOF/MS[J].Chinese Traditional and Herbal Drugs,2021,52(11):3 193-3 200.
[4] GAO H,WEN J J,HU J L,et al.Momordica charantia juice with Lactobacillus plantarum fermentation:Chemical composition,antioxidant properties and aroma profile[J].Food Bioscience,2019,29:62-72.
[5] 陈康,Oh Young Joo,李洪军,等.金银花乳杆菌发酵凉茶的研制[J].食品科学,2016,37(3):131-136.
CHEN K,JOO O,LI H J,et al.Development of honeysuckle herbal tea by fermentation with Lactobacillus plantarum[J].Food Science,2016,37(3):131-136.
[6] 徐文流,贝琦,梁诗雅,等.红曲霉发酵提高金银花的抗氧化活性[J].现代食品科技,2020,36(9):47-53;163.
XU W L,BEI Q,LIANG S Y,et al.Improvement of the antioxidative activities of flos Lonicerae japonicae through its solid-state fermentation with Monascus[J].Modern Food Science and Technology,2020,36(9):47-53;163.
[7] 梁鑫,陈思雨,赵育,等.乳酸菌和酵母菌发酵红枣汁工艺优化及成分分析[J].食品与发酵工业,2021,47(7):175-182.
LIANG X,CHEN S Y,ZHAO Y,et al.Process optimization and composition analysis of jujube juice fermentation by lactic acid bacteria and yeast[J].Food and Fermentation Industries,2021,47(7):175-182.
[8] ARROSYID M,MUSTOFA C H,SUTARYONO,et al.Effect of boiling time on content of the total flavonoid of kitolod(Isotoma longiflora(L.)C.Presl.)[J].Journal of Physics:Conference Series,2021,1 764:012023.
[9] 陈树俊,郑婕.复合果蔬发酵汁有机酸动态分析及体外模拟消化抗氧化活性和功能成分分析[J].食品科学,2021,42(7):90-97.
CHEN S J,ZHENG J.Dynamic analysis of organic acids in a mixture of vegetable and fruit juices during fermentation and changes in antioxidant activity and functional constituents during simulated gastrointestinal digestion[J].Food Science,2021,42(7):90-97.
[10] 刘豪栋,杨昳津,林高节,等.酵母与乳酸菌的相互作用模式及其在发酵食品中的应用研究进展[J/OL].食品科学,2021.http://kns.cnki.net/kcms/detail/11.2206.TS.20210413.1529.020.html
LIU H D,YANG Y J,LIN G J,et al.Research progress on interaction patterns between yeast and lactic acid bacteria and their application in fermented foods[J/OL].Food Science,2021.http://kns.cnki.net/kcms/detail/11.2206.TS.20210413.1529.020.html
[11] TAN M,CARO Y,SHUM-CHEONG-SING A,et al.Evaluation of mixed-fermentation of Saccharomyces cerevisiae with Saprochaete suaveolens to produce natural fruity beer from industrial wort[J].Food Chemistry,2021,346:128804.
[12] GENET S,ENGEDA D,YASSIN H,et al.Total phenolic content,flavonoid content and antioxidant activities of Trigonella foenum-graecum,Aframomum cororima and Lippiaadoensis var.koseret[J].Journal of Food Processing & Technology,2020,11(12):21-30.
[13] 王毕妮,曹炜,高慧,等.红枣酱的体外抗氧化作用[J].食品与发酵工业,2012,38(7):128-131.
WANG B N,CAO W,GAO H,et al.Antioxidant activity of jujube marmalade[J].Food and Fermentation Industries,2012,38(7):128-131.
[14] SANT’ANA L D,BUARQUE FERREIRA A B,LORENZON M C A,et al.Correlation of total phenolic and flavonoid contents of Brazilian honeys with colour and antioxidant capacity[J].International Journal of Food Properties,2014,17(1):65-76.
[15] QIN Y,CHEN J P,LI C Y,et al.Flavonoid glycosides from the fruits of Embelia ribes and their anti-oxidant and α-glucosidase inhibitory activities[J].Journal of Asian Natural Products Research,2021,23(8):724-730.