虫草素(cordycepin)又称虫草菌素,是一种腺苷类物质,别称3′-脱氧腺苷[1]。虫草素是蛹虫草的主要有效成分,具有抗肿瘤、抗炎症、抗辐射、抗氧化、降血压、抗衰老、提高免疫力和改善记忆等功能[2-5]。虫草素制备方法主要有生物发酵法和化学合成法。化学合成主要以腺苷或其衍生物为原料合成3′-脱氧核糖环卤代物,最后加氢脱卤制取。合成过程复杂反应苛刻、成本高、产率低,且反应过程中产生大量有机废液对环境造成不良影响,因此难以工业化生产[6]。发酵法是由蛹虫草液体或者固态培养,并经过膜分离及树脂纯化获得。固态培养生产周期长(50~60 d)、不易控制、产量低、劳动量大,不能满足工业原料需求。液体发酵生产周期短(15~25 d)、易于控制、产量高、应用潜力大[7-9]。
目前关于虫草素液体发酵的研究主要集中于育种和培养基优化。张楠等[10]以蛹虫草NS-810为菌种,通过单次单因素试验和正交实验,优化深层发酵产虫草素的最佳培养基,其配方为葡萄糖、土豆、鱼蛋白胨、(NH4)2SO4、KH2PO4、MgSO4、蚕蛹粉、维生素B1,优化后虫草素的总产量为1.14 g/L,较基础培养基提高了1.46倍。郑威等[11]在基础培养基为小米、葡萄糖、白糖、KH2PO4、MgSO4、蛋白胨、酵母浸膏、氨基酸条件下,分析了不同培养条件对虫草素合成的影响,结果发现拟青霉在温度21 ℃、38 h、维生素B1添加量0.08 g/L 时,拟青霉A20140822 发酵生产虫草素质量浓度最高达到1.465 g/L,比对照提高20%以上。MASUDA等[12]研究添加腺苷和腺嘌呤等对蛹虫草NBRC9787产虫草素发酵的影响,与对照组相比,虫草素浓度提高了15%。SHIH等[13]通过对虫草素生产工艺的优化设计,确定了生产虫草素的最佳工艺条件即在pH 6、酵母膏质量浓度为45 g/L,振荡培养8 d、静态培养16 d,虫草素的最大产量为2.2 g/L,明显高于未优化前的静态培养发酵水平。DAS等[14]利用突变体G81-3为发酵菌株,采用中心复合设计的响应面分析,得到最佳碳源为葡萄糖,质量浓度86.2 g/L,氮源为酵母提取物,质量浓度93.8 g/L,虫草素产量为6.84 g/L,是对照的2.79倍。虽然关于培养基优化的研究很多,但多局限于培养基的设计层面。对深层发酵和规模放大工艺少有研究。本论文在前期研究基础上[15]进一步探讨工艺放大可行性,为工业化应用奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 供试菌株
Cordyceps militaris CGMCC 18581由CICC14014诱变所得,现保藏于中国微生物菌种保藏管理委员会普通微生物中心。
1.1.2 试剂
甲醇、葡萄糖、MgSO4、KH2PO4、K2HPO4、NaCl,国药集团化学试剂有限公司;蛋白胨(食品级),河南信和生物科技有限公司;酵母粉,安琪酵母股份有限公司;腺嘌呤、虫草素,上海生工生物工程(上海)股份有限公司。
1.1.3 培养基
固体培养基(g/L):土豆汁200,复配葡萄糖20,MgSO41,琼脂20,pH不调控。
种子培养基(g/L):葡萄糖28,酵母膏15,蛋白胨20,KH2PO40.5,K2HPO420.5,MgSO41,用稀盐酸调pH至5.8。
发酵培养基(g/L):葡萄糖28,酵母膏15,蛋白胨20,KH2PO40.5,K2HPO420.5,MgSO41,吐温-80 0.5,腺嘌呤4,用稀盐酸调pH至5.8。
1.2 仪器与设备
1260高效液相色谱,安捷伦科技(中国)有限公司;752 N分光光度计,上海仪电有限公司;XSP10显微镜,万衡仪器有限公司;SX-700立式全自动灭菌锅,TOMY公司;ZQZY-CF振荡培养箱,上海知楚仪器有限公司;SW-CJ-1BU超净工作台,苏州安泰空气技术有限公司;定制多层反应器,迪必尔生物工程(上海)有限公司。
1.3 试验方法
1.3.1 培养基
菌株平板活化:将保藏的蛹虫草菌株转接至固体培养基,26 ℃培养6 d。
摇瓶种子培养:摇瓶培养作为一级种子培养(扩培次数定义为0),500 mL三角瓶装液量100 mL,121 ℃灭菌后降至常温保压。将平板菌丝体刮入摇瓶中。180 r/min、26 ℃培养2~3 d。
发酵罐种子培养:10 L搅拌罐培养作为2级种子培养(扩培次数定义为1,后续扩培均在10 L玻璃罐基础上进行扩培),装液量50%,121 ℃灭菌后降至常温保压。将摇瓶菌种通过火焰圈接种至种子罐。120~400 r/min、通气量6~10 L/h、26 ℃培养48~120 h。
摇瓶发酵培养:种子罐接有空消过的空补料瓶,通过压差将培养好的种子压入空瓶中,并在超净台中,按10%接种量接种至装有发酵培养基三角摇瓶中,26 ℃下静置发酵25 d。
发酵罐(多层反应器)发酵:按15%接种量接入装有35 L无菌发酵培养基的50 L发酵罐,混合后,通过压差和溢液方式装满无菌多层反应器,26 ℃、通气量1 000 L/h、压力0.07 MPa条件下发酵25 d。
1.3.2 分析方法
虫草素检测:取发酵液离心后上清液稀释20倍,0.22 μm滤膜过滤,得到待测样品液。采用液相色谱法测定虫草素含量。色谱条件:色谱柱Sepax HP-C18;检测器:紫外;波长254 nm;柱温30 ℃;流动相:甲醇∶KH2PO4(1.36 g/L)=25∶75;流速0.8 mL/min;进样量20 μL。以外标峰面积法进行定量分析。
生物量测定:发酵液离心后,用纯水洗涤3次,最终离心沉淀物置于80 ℃烘箱干燥至恒重,沉淀物干重与发酵液比值定为生物量浓度。
菌体形态检测:通过显微镜观察,物镜40倍。
底物转化率P按公式(1)计算:
(1)
式中:Cc,虫草素质量浓度,mg/mL;Ca,腺嘌呤质量浓度,mg/mL;Vi,发酵初体积,mL;Vt,发酵终体积,mL;1.86,理论转化率,即1 g腺嘌呤理论产1.86 g的虫草素。
采用Origin 8.1进行数据统计分析及作图,虫草素合成曲线用公式(2)所示数学模型:
(2)
式中:y,虫草素质量浓度,g/L;x,发酵时间,d;A1、A2和p为拟合常数。
2 结果与分析
2.1 种子质量对发酵的影响
2.1.1 转速影响
在维持溶氧不低于30%基础上,分别分析了不同转速对种子培养的影响。在较低转速下,菌丝生长速率相对较慢,直至发酵终点,菌体一直呈上升趋势(图1)。随着转速提高,前期菌体生长速率明显提升,在高转速下(400 r/min),培养3 d菌体量可以达到16 g/L以上,但发酵后期有菌体量下降趋势。
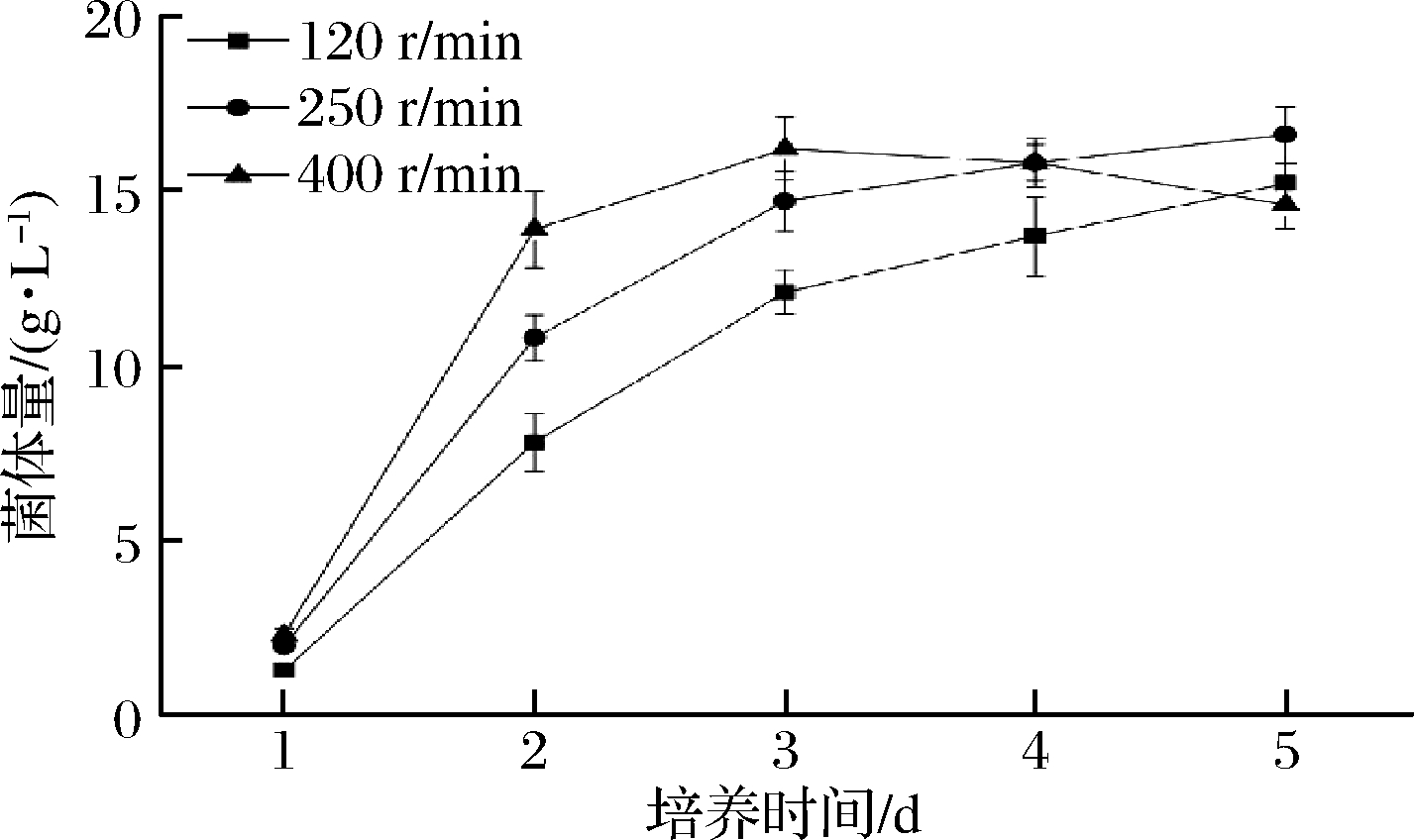
图1 不同转速对菌种生长的影响
Fig.1 Influence of different rotation speeds on the growth of strains
从图2-a可知,低转速下,菌丝体形态较为完整,高转速下出现自溶现象(图2-c)。钟思敏等[16]报道,在蛹虫草深层动态培养时,转速对菌体生长形态和产物转化等有显著影响,并发现最适转速为180 r/min,即低转速对发酵有利。

a-120 r/min;b-250 r/min;c-400 r/min
图2 不同转速下培养5 d的菌丝体形态
Fig.2 Morphology of mycelium cultured at different rotating speeds for 5 days
不同转速和培养时间下的菌种对虫草素发酵影响也较为明显,如图3所示,在低转速下,菌种生长周期长,培养5 d的菌种质量较佳。而在高转速下,培养时间长,菌种活性有明显下降,对虫草素合成有显著影响。因此选择转速250 r/min,培养周期3 d为宜,此时菌体质量浓度为14 g/L左右。
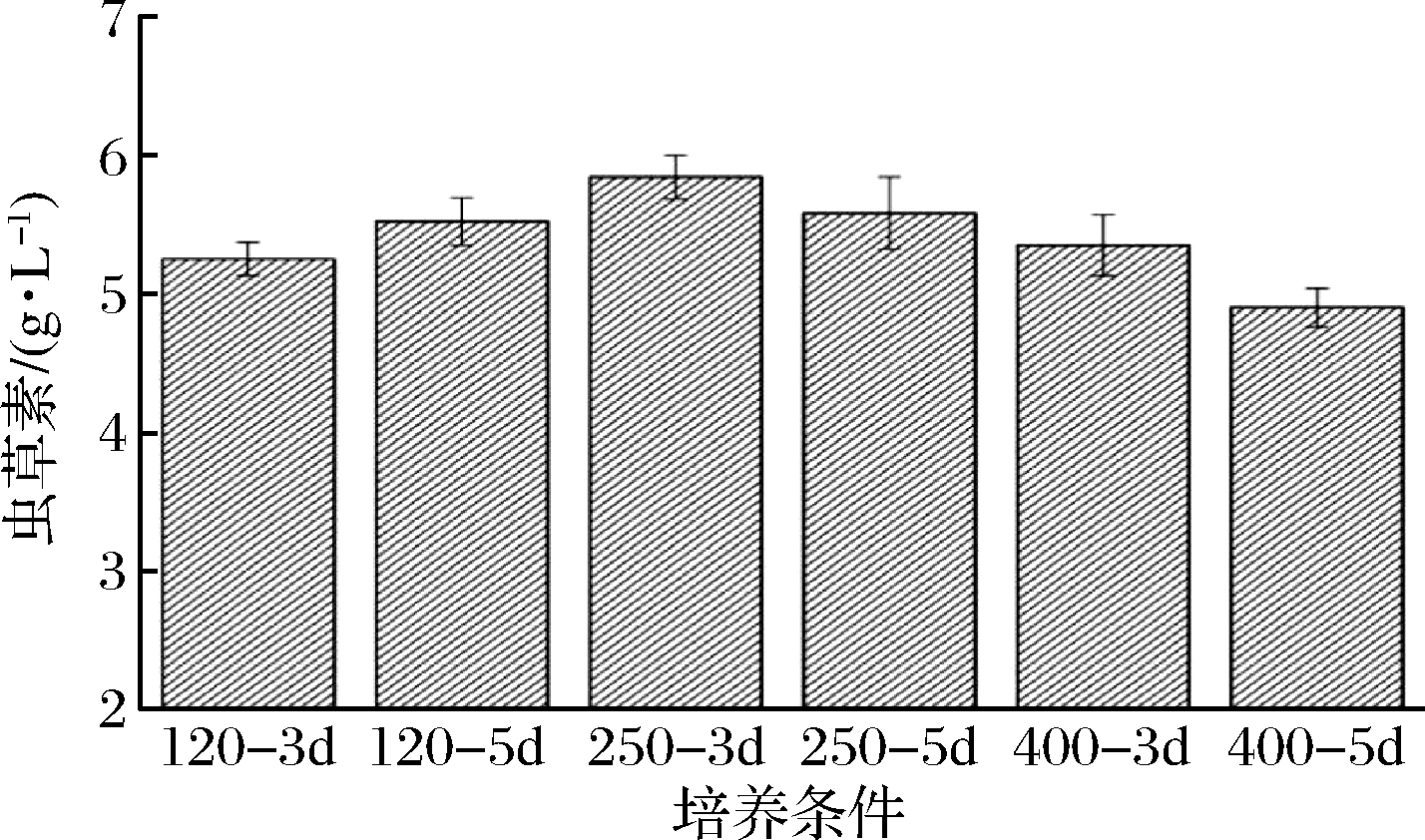
图3 不同培养条件对虫草素合成影响
Fig.3 Effects of different culture conditions on the synthesis of cordycepin
2.1.2 接种量影响
如表1所示,接种量小(5%),菌体生物量浓度偏低,即生长速率慢,从而导致虫草素浓度较低。提高接种量,生物量有明显提高。当接种量15%时,虫草素质量浓度达最高值6.03 g/L。
表1 不同接种量对发酵的影响
Table 1 Effects of different inoculation doses on fermentation

接种量/%生物量/(g·L-1)虫草素产量/(g·L-1)516.92±1.063.68±0.161019.09±1.215.61±0.281520.12±1.486.03±0.122522.12±1.525.50±0.32
房天琪[17]的研究也得到类似的结果,接种量为15%~20%时虫草素浓度相对较高;当接种量提高至25%时,生物量最高达到22 g/L以上,但虫草素有明显下降。这可能由于底物往菌体生长途径转化。
2.1.3 种子扩培级数影响
由于考虑到后期工艺放大情况,考察了菌种扩培次数对菌种质量的影响。以摇瓶培养定为扩培0次,10 L种子罐培养定为扩培1级,将种子罐培养的种子转接至另外10 L种子罐培养定为2级,以此类推。每级种子培养终指标为生物量14 g/L左右。从图4发现,菌种扩培2级后,种子质量对虫草素合成有明显影响,尤其在种子扩培4级时,虫草素浓度下降显著,这可能与菌种在多次传代后出现退化有关。所以在工艺放大应用时,菌种扩培次数尽量不超过2次。
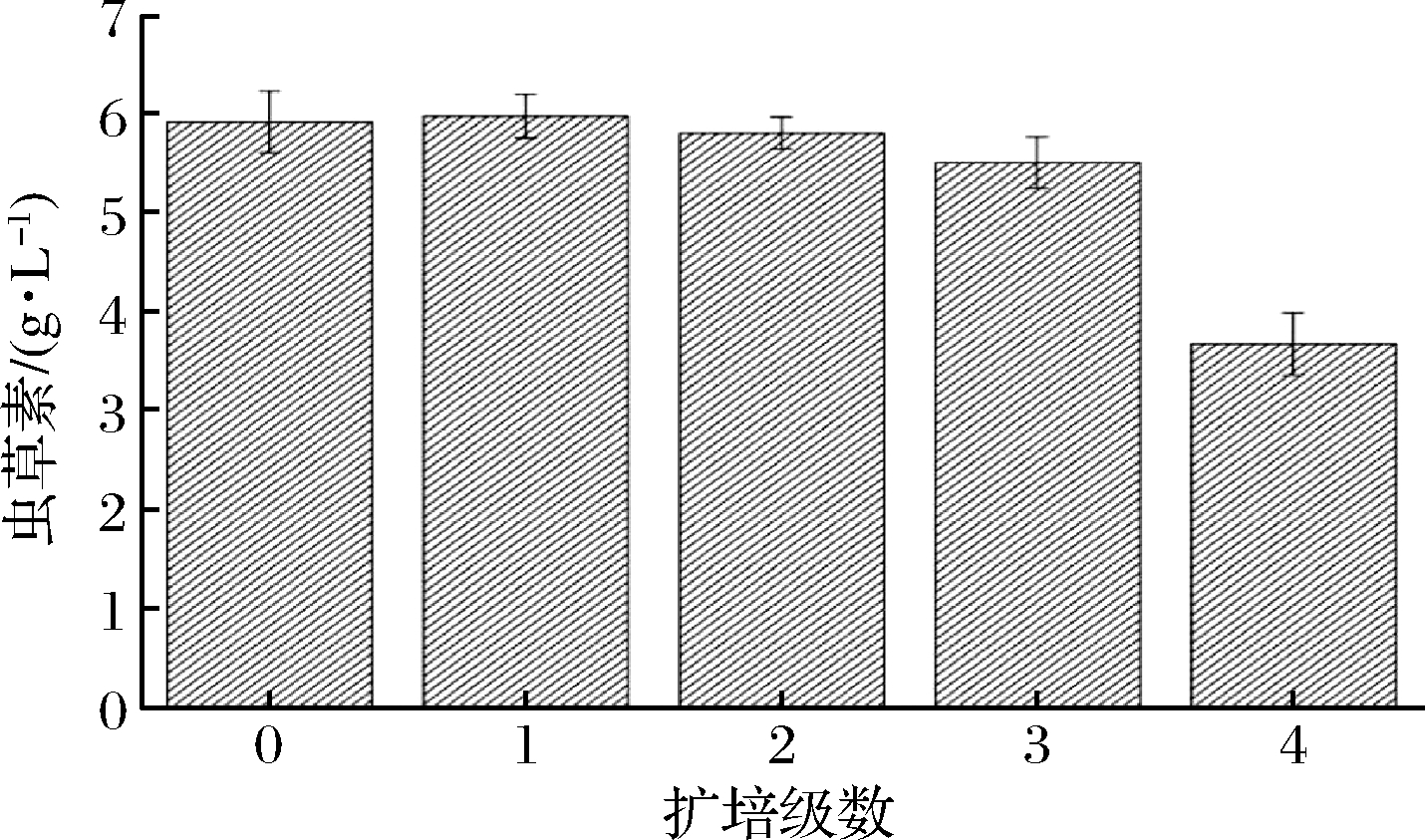
图4 不同扩培级数对虫草素发酵影响
Fig.4 Effects of different propagation times on cordycepin fermentation
2.2 装液高径比对发酵影响
以高径比2 cm/15 cm作为对照组,高径比较大(2 cm/5 cm)时,虫草素浓度及底物转化率显著降低。高径比较小(2 cm/30 cm)时,虫草素产量较高,但转化率没有提升。这主要由于表面积较大时,水分挥发严重,对中后期菌体生长有一定的副作用。另外,在高径比相似时,液面高度越大,对虫草素合成影响也越大,尤其当高度>4 cm时,虫草素和转化率都有明显下降。结果说明虫草素发酵需要较为合适的装液高径比,且装液高度对其发酵影响更大。研究表明,过多的装液量会导致溶解氧缺乏,不利于菌丝生长和代谢产物合成[18-19]。然而比表面积过大,也不利于虫草素发酵,除了挥发作用大,其对菌体生长影响也较明显。SUPARMIN等[20]通过转录组学分析深层液体发酵和浅层液体发酵体系的基因表达,发现低溶氧下的浅层液体发酵更有利于虫草素积累。
表2 不同高径比对虫草素发酵影响
Table 2 Effects of different height/diameter ratios on cordycepin fermentation
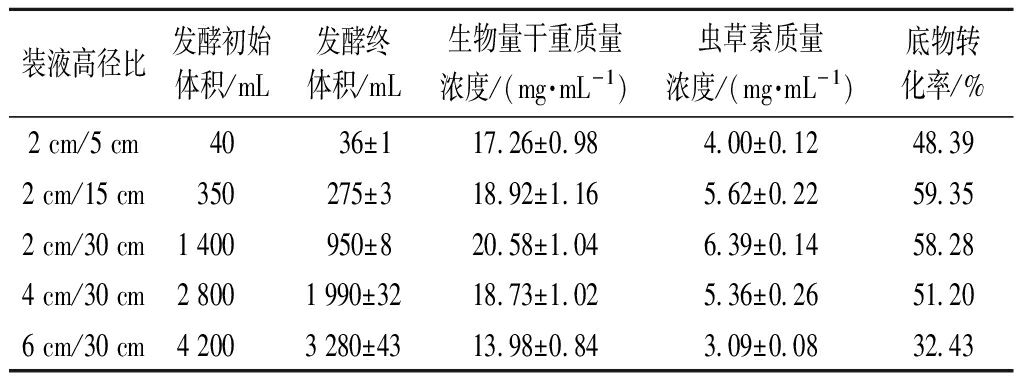
装液高径比发酵初始体积/mL发酵终体积/mL生物量干重质量浓度/(mg·mL-1)虫草素质量浓度/(mg·mL-1)底物转化率/%2 cm/5 cm4036±117.26±0.984.00±0.1248.392 cm/15 cm350275±318.92±1.165.62±0.2259.352 cm/30 cm1 400950±820.58±1.046.39±0.1458.284 cm/30 cm2 8001 990±3218.73±1.025.36±0.2651.206 cm/30 cm4 2003 280±4313.98±0.843.09±0.0832.43
2.3 120 L多层反应器验证
采用以上最佳高径比的尺寸设计了120 L(实际装液量40 L)多层反应器,如图5所示,内部为浅层托盘,直径40 cm,装液高度2.7 cm,托盘数量12个。

图5 120 L多层反应器
Fig.5 120 L multilayer reactor
接种发酵25 d结果如图6所示。该曲线采用常规生长曲线模型进行拟合,决定系数R2值为0.985。发酵5 d,几乎没有产量,发酵第5~15天虫草素合成速率明显提高,尤其在发酵第15~20天时,虫草素合成速率显著提高,之后增长速率稍有下降。这主要受生物量合成的影响,即前期菌体生长缓慢,菌体达到稳定期后,产物合成速率明显提高。
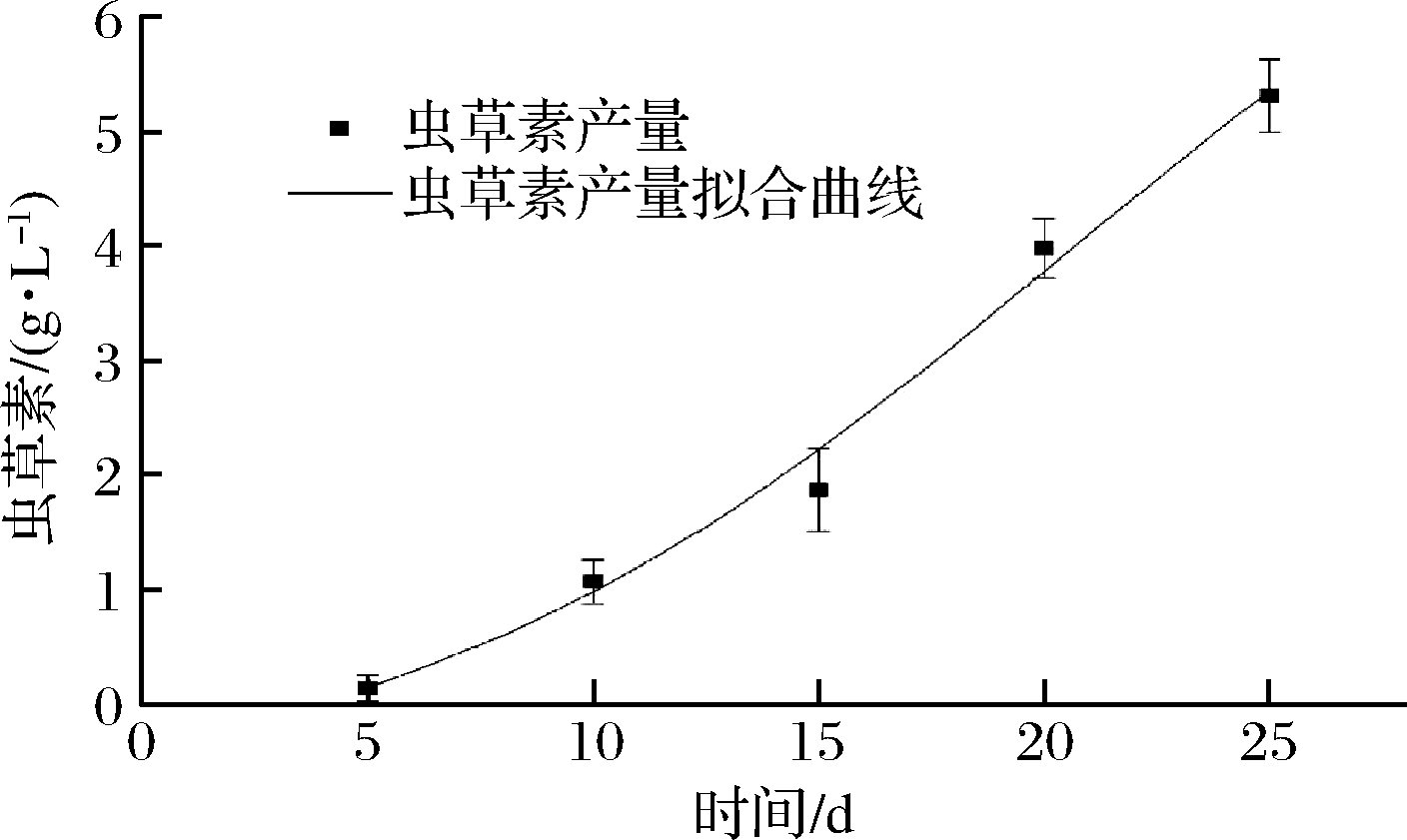
图6 虫草素产量随培养时间的变化
Fig.6 Variation of cordycepin concentration with culture time
发酵25 d后,发酵终体积31.5 L,虫草素质量为167.58 g,转化率57.0%。转化率稍低于小试结果(装液高径比2 cm/30 cm)。这可能与罐内气体管路设计不科学有关,使得气体分布效果不理想,从而影响发酵效果。
3 结论与讨论
本文首先以发酵生物量和虫草素产量为指标评估了菌种质量。通过对转速、接种量和扩培级数等进行优化分析,获得了最佳条件为:转速250 r/min,接种量15%,扩培级数1~2次。此条件下的虫草素发酵产量可达6 g/L左右。其次分析了不同装液量的高径比对虫草素发酵的影响,发现2 cm/30 cm为最适高径比,以上述最佳条件为依据,进行了120 L多层反应器发酵工艺验证。结果显示:发酵25 d,虫草素产量为5.32 g/L,转化率为57%,与小试工艺结果较为一致。本实验证明了工艺放大的可行性,为进一步工业化应用提供了参考
[1] 彭俊峰,凌建亚,张晗星,等.虫草素与DNA作用的光谱研究[J].光谱学与光谱分析,2004,24(7):858-861.
PENG J F,LING J Y,ZHANG H X,et al.Study on the interaction of cordycepin and DNA[J].Spectroscopy and Spectral Analysis,2004,24(7):858-861.
[2] JEONG M H,PARK Y S,JEONG D H,et al.In vitro evaluation of Cordyceps militaris as a potential radioprotective agent[J].International Journal of Molecular Medicine,2014,34(5):1 349-1 357.
[3] 胡贤达,岳颖,武鹏,等.虫草素药理作用研究及展望[J].中国生化药物杂志,2015,35(12):180-182;185.
HU X D,YUE Y,WU P,et al.Progress and prospects on pharmacological research of cordycepin[J].Chinese Journal of Biochemical Pharmaceutics,2015,35(12):180-182;185.
[4] LEE H H,PARK H,SUNG G H,et al.Anti-influenza effect of Cordyceps militaris through immunomodulation in a DBA/2 mouse model[J].Journal of Microbiology,2014,52(8):696-701.
[5] MASUDA M,DAS S K,HATASHITA M,et al.Efficient production of cordycepin by the Cordyceps militaris mutant G81-3 for practical use[J].Process Biochemistry,2014,49(2):181-187.
[6] 李启欢,阳如春,阮志忠,等.虫草素的全合成研究[J].有机化学,2013,33(6):1 340-1 344.
LI Q H,YANG R C,RUAN Z Z,et al.Total synthesis of cordycepin[J].Chinese Journal of Organic Chemistry,2013,33(6):1 340-1 344.
[7] 赵星月,李倩,刘文静,等.蛹虫草菌生物合成虫草素的研究进展[J].生物工程学报,2020,36(7):1 293-1 304.
ZHAO X Y,LI Q,LIU W J,et al.Advances in biosynthesis of cordycepin from Cordyceps militaris[J].Chinese Journal of Biotechnology,2020,36(7):1 293-1 304.
[8] WANG M,MENG X Y,YANG R L,et al.Cordyceps militaris polysaccharides can improve the immune efficacy of Newcastle disease vaccine in chicken[J].International Journal of Biological Macromolecules,2013,59:178-183.
[9] 狄志彪,马艳妮,陈新璐,等.液体发酵蛹虫草中虫草素含量分布的研究[J].中国酿造,2016,35(2):84-87.
DI Z B,MA Y N,CHEN X L,et al.Research on the content distribution of cordycepin in Cordyceps militaris by liquid fermentation[J].China Brewing,2016,35(2):84-87.
[10] 张楠,黎勇,徐洁,等.蛹虫草深层发酵产虫草素培养基的优化[J].北方园艺,2017(5):134-141.
ZHANG N,LI Y,XU J,et al.Medium optimization for cordycepin production from Cordyceps militaris by submerged fermentation[J].Northern Horticulture,2017(5):134-141.
[11] 郑威,周迎红,刘金龙.拟青霉A20140822发酵生产虫草素工艺的响应面优化研究[J].生物技术进展,2017,7(6):625-631;668.
ZHENG W,ZHOU Y H,LIU J L.Response surface optimization of the fermentation process of cordycepin by Paecilomyces varioti A20140822[J].Current Biotechnology,2017,7(6):625-631;668.
[12] MASUDA M,DAS S K,FUJIHARA S,et al.Production of cordycepin by a repeated batch culture of a Cordyceps militaris mutant obtained by proton beam irradiation[J].Journal of Bioscience and Bioengineering,2011,111(1):55-60.
[13] SHIH I L,TSAI K L,HSIEH C.Effects of culture conditions on the mycelial growth and bioactive metabolite production in submerged culture of Cordyceps militaris[J].Biochemical Engineering Journal,2007,33(3):193-201.
[14] DAS S K,MASUDA M,HATASHITA M,et al.Optimization of culture medium for cordycepin production using Cordyceps militaris mutant obtained by ion beam irradiation[J].Process Biochemistry,2010,45(1):129-132.
[15] 赵南,王松涛,刘庆国,等.蛹虫草复合诱变育种与温度驯化研究[J].江西农业学报,2020,32(4):108-112.
ZHAO N,WANG S T,LIU Q G,et al.Study on compound mutation breeding and temperature acclimation of Cordyceps militaris[J].Acta Agriculturae Jiangxi,2020,32(4):108-112.
[16] 钟思敏,杜梅,陈往滨,等.蛹虫草菌丝产虫草素液体培养条件的研究[J].菌物学报,2011,30(2):229-234.
ZHONG S M,DU M,CHEN W B,et al.Liquid culture conditions for promoting cordycepin secreted from Cordyceps militaris mycelia[J].Mycosystema,2011,30(2):229-234.
[17] 房天琪.北冬虫夏草的人工培养及虫草素的提纯研究[D].长春:长春工业大学,2012.
FANG T Q.The artificial cultivation of Cordyceps and the study of extraction and purification with cordycepin[D].Changchun:Changchun University of Technology,2012.
[18] 蔡水淋,郑永标,王明兹,等.响应面法优化蛹虫草深层培养产菌丝及虫草素的发酵工艺[J].农产品加工(学刊),2013(6):13-18;21.
CAI S L,ZHENG Y B,WANG M Z,et al.Enhanced production of mycelia biomass and cordycepin by submerged culture of Cordyceps militaris with response surface methodology[J].Academic Periodical of Farm Products Processing,2013(6):13-18;21.
[19] 任昕雯,李宇轩,吴兆琦.液体发酵条件对蛹虫草产虫草素的影响[J].陕西农业科学,2018,64(4):58-60.
REN X W,LI Y X,WU Z Q.Effect of liquid fermentation conditions on cordycepin production in Cordyceps militaris[J].Shaanxi Journal of Agricultural Sciences,2018,64(4):58-60.
[20] SUPARMIN A,KATO T,DOHRA H,et al.Insight into cordycepin biosynthesis of Cordyceps militaris:Comparison between a liquid surface culture and a submerged culture through transcriptomic analysis[J].PLoS One,2017,12(11):e0187052.