两亲性聚合物的疏水链段能通过疏水作用力形成一个疏水性内核,其亲水链段在水性介质中能自组装成亲水性外壳,形成的核-壳结构胶束对脂溶性成分具有良好的增溶作用、靶向递送、生物利用率提高和稳态化作用,为难溶性抗癌活性化合物和食品脂溶性成分的高效利用提供优异载体[1-2]。完全合成的两亲性嵌段共聚物在水溶液中能够形成规则的核壳胶束,受到广泛关注,但出于安全性考虑,其在食品中的应用受到限制。经过适度疏水改性的两亲性多糖基聚合物具有良好的自组装能力、可降解性、生物相容性和安全性,但与完全合成的嵌段共聚物不同,疏水化多糖形成的胶束结构更加复杂(图1-a),容易受到制备方法、自身结构因子、外界环境条件及共存组分的影响[3-6]。更为重要的是,两亲性聚合物在其自聚集过程中单体分子与胶束处于热力学和动力学平衡状态[7],因此,在聚合物胶束的应用过程中食品组分及其所处环境条件极易影响其稳定性。但目前关于制备方法、结构因子、环境条件及共存组分对聚合物胶束的影响主要集中于pH敏感型和热敏性聚合物胶束[8-9],而关于食品组分及加工条件对疏水化多糖胶束稳定性影响的研究较少。
辛烯基琥珀酸酐(octenyl succinic anhydride,OSA)作为常用的亲脂性酯化剂,常用于多糖进行疏水化改性,合成的OSA多糖能够作为食品脂溶性成分封装壁材、乳化剂、抗菌或可食膜材料、功能性食品配料[10-13],其中辛烯基琥珀酸燕麦β-葡聚糖酯(octenylsuccinated oat β-glucan,OSβG)所形成的核壳胶束能够增溶、靶向递送和控释食品脂溶性成分(如β-胡萝卜素等)[14];进一步研究发现,糖链内部结构因子(如分子质量、取代度)[15]、环境因子(如温度和pH)[3]均会影响其自聚集,但关于食品组分的影响规律尚不清楚。此外,食品组分可能会对聚合物胶束带来积极或消极的影响。已有研究发现氨基酸[16]、肽[17]、蛋白质[18]、多糖[19]和无机盐[16]等会影响表面活性剂的自聚集特性,主要取决于它们的性质、浓度和环境条件等。
氨基酸作为蛋白质的组成单元,也是具有酸碱性、亲疏水性及极性等多重性质的重要食品组分之一,在不同pH条件下氨基酸电离情况各异,根据环境pH条件,可电离出阴离子、双阴离子、阳离子、双阳离子和两性离子等,特别是多氨基或多羧基的酸性或碱性氨基酸就更加复杂。研究氨基酸对不同pH条件下OSβG自聚集行为的影响,对其在具体真实食品体系中的应用具有指导意义。鉴于OSβG自聚集行为主要与其亲/疏水性和所带的负电荷密度有很大关系,推测不同酸碱性和亲疏水性的氨基酸对OSβG自聚集行为有不同的影响。基于此选择了酸性(谷氨酸)、中性(异亮氨酸、苯丙氨酸、半胱氨酸、丙氨酸和丝氨酸)和碱性氨基酸(赖氨酸);同时,这7种氨基酸可划分为亲水性(谷氨酸、赖氨酸和丝氨酸)和疏水性(异亮氨酸、苯丙氨酸、半胱氨酸和丙氨酸)氨基酸2组(根据Eisenberg疏水值)[20]。本文以这7种氨基酸(分子结构见图1-b)作为食品氨基酸的代表,通过研究不同pH(3、6、10)条件下7种氨基酸对OSβG临界胶束浓度(critical micelle concentration,CMC)、OSβG胶束的粒径、多分散系数(polydispersity index,PDI)和Zeta电位的影响;进一步评价了其中的5种中性氨基酸(异亮氨酸、苯丙氨酸、半胱氨酸、丙氨酸和丝氨酸)在pH 6时对荷载姜黄素OSβG胶束的影响,旨在揭示食品组分氨基酸与其所处pH条件对OSβG自聚集行为的影响,为构建两亲性多糖胶束的稳定化应用提供理论依据。
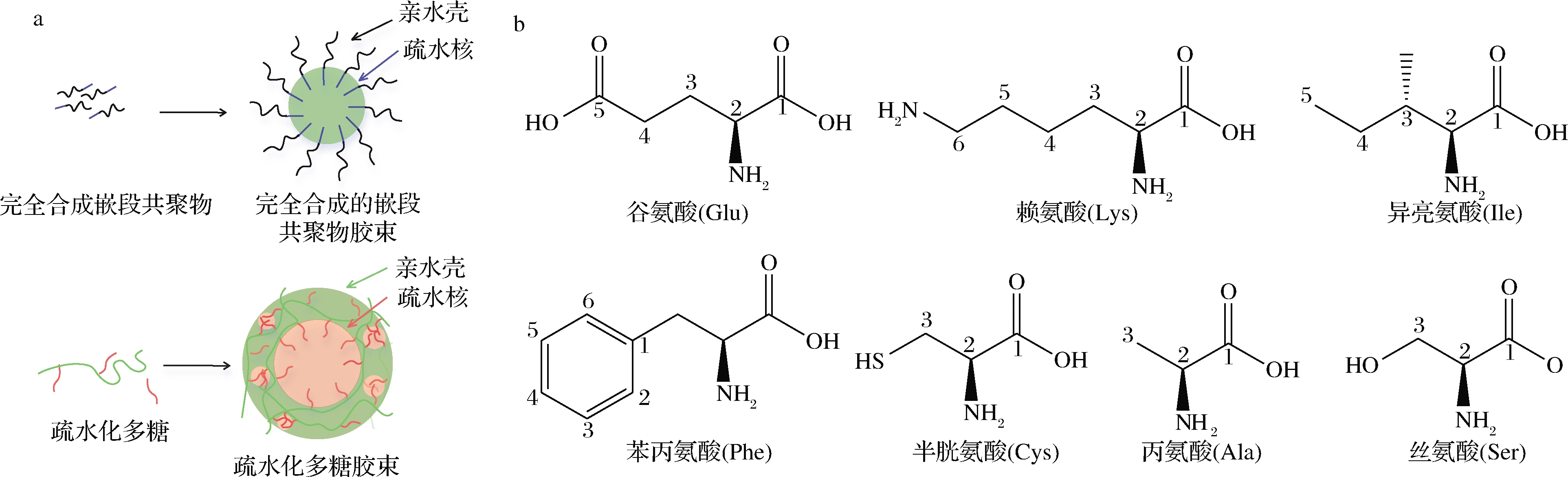
a-胶束结构示意图;b-7种氨基酸的分子结构
图1 完全合成的嵌段共聚物与疏水化多糖形成的胶束结构示意图[3]以及常见氨基酸的分子结构
Fig.1 The schematic structure diagrams of micelles formed by fully synthesized block copolymers and hydrophobic polysaccharides,and the molecular structure of common amino acids
1 材料与方法
1.1 材料与试剂
燕麦β-葡聚糖(食品级,纯度80%,分子质量1.68×105 g/mol),张家口一康生物科技有限公司;2-辛烯基琥珀酸酐(2-OSA,97%)、芘(光谱纯),美国Sigma-Aldrich公司;谷氨酸(Glu)、赖氨酸(Lys)、异亮氨酸(Ile)、苯丙氨酸(Phe)、半胱氨酸(Cys)、丙氨酸(Ala)、丝氨酸(Ser)、姜黄素,上海Adamas试剂有限公司;异丙醇、NaOH(分析纯),成都市科龙化工试剂厂;盐酸、乙醇(分析纯),重庆川东化工(集团)有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
BSA323S电子分析天平,赛多利斯科学仪器有限公司;H01-1D数显恒温磁力搅拌器,上海梅颖浦仪器仪表制造有限公司;FE28 pH计,METTLER-TOLEDO仪器有限公司;GL-16G高速离心机,上海安亭科学仪器厂;T25高速分散机,德国IKA仪器设备有限公司;Zetasizer Nano ZS马尔文激光粒度仪,英国Malvern仪器有限公司;F-2500荧光分光光度计,日本株式会社日立制作所。
1.3 试验方法
1.3.1 OSβG及其自聚集胶束的制备方法
OSβG的制备方法及其结构特性参见本课题组前期的研究[15]。将燕麦β-葡聚糖于纯水中(1.25 mg/mL),在80 ℃下搅拌2 h使其完全溶解,冷却后离心(3 000×g,10 min),向上清液中加入OSA,持续加入30 g/L NaOH,使pH维持在8~10,反应结束后,滴加2 mol/L HCl使溶液pH为6.5,再加入4倍异丙醇使之沉淀(65 ℃、6 h),离心(5 000×g,10 min),将获得的沉淀物溶于蒸馏水中,透析(MD44-14透析袋,分子截流量14 kg/mol,Union Carbide Co)24 h,冷冻干燥,即得OSβG(取代度为0.018)。将0.05 g OSβG分散于20 mL纯水中,加热至沸腾2 min、使之完全溶解,冷却后补充体积至20 mL,室温下磁力搅拌24 h,即得OSβG胶束。
1.3.2 不同pH条件下OSβG胶束与氨基酸混合体系的制备方法
采用30 g/L NaOH和2 mol/L HCl溶液调整氨基酸溶液和OSβG胶束溶液至相同的pH(3、6或10),向OSβG胶束溶液中加入一定量的相同pH不同种类的氨基酸溶液使得二者混合溶液中氨基酸的最终浓度为0.01 mol/L,在室温条件下搅拌3 h使两者充分混合,得到不同pH条件下的OSβG胶束与氨基酸混合体系,立即测定。
1.3.3 荷载姜黄素OSβG胶束的制备方法
向适量OSβG胶束中添加10 mg姜黄素粉末,采用高速分散器处理2 min(12 000 r/min),将分散液在室温下搅拌24 h,3 000 r/min离心10 min,向收集的上清液中加入氨基酸,使最终体系中氨基酸浓度为0.1 mol/L,涡旋振荡器处理2 min后立即测定。
1.3.4 临界胶束浓度的测定
采用荧光分光光度计测定芘标记OSβG溶液的荧光光谱,首先配制一系列浓度的OSβG与氨基酸混合溶液(OSβG质量浓度分别为1.2、0.6、0.3、0.15、0.075、0.002 5、0.007 5和0.000 75 mg/mL),调其pH值分别为3、6和10,将适量芘甲醇溶液(0.2 mmol/L)加入到10 mL离心管,氮吹使甲醇完全挥发,向其中加入10 mL OSβG与氨基酸混合溶液使最终芘的浓度为0.6 μmol/L,在室温条件下搅拌3 h后测定。测定条件:激发波长335 nm,发射和激发狭缝均为2.5 nm,收集波长为360~460 nm,以芘第一、第三吸收峰荧光强度的比值(I1/I3)与OSβG浓度的对数(lgC)作图,经过分段线性拟合求出各条件下OSβG的CMC值。
1.3.5 粒径、多分散系数和表面电荷的测定
采用马尔文激光粒度仪测定,测试条件为氩离子激光器,波长633 nm,温度25 ℃,散射角为90°,测定OSβG及其与氨基酸混合溶液的粒径、PDI和Zeta电位。
1.3.6 数据处理方法
试验数据均采用平均值±标准偏差表示(n=3)。使用SPSS 22.0进行数据统计分析,采用Tukey’s HSD进行方差分析。
2 结果与分析
2.1 不同pH条件下氨基酸对OSβG的CMC的影响
合成的OSβG交联物及其自聚集胶束的结构特性前期已经研究清楚[15],但当其应用于食品体系时,不可避免会受到食品加工条件及共存组分的冲击,以氨基酸作为食品组分代表物,研究氨基酸及其所处环境条件对OSβG的影响,具有实际意义。通常氨基酸的解离程度与溶液pH密切相关,在等电点(pI)时,氨基酸解离程度最小[21],明确不同pH条件下氨基酸的解离程度对解析其影响OSβG自聚集行为至关重要。因此,选择3个pH体系(3、6和10)。pH 3时谷氨酸解离程度最小,pH 6时,除具有酸碱性质的氨基酸外,各中性氨基酸均表现出最低解离程度,pH 10时赖氨酸有最小的解离度。不同pH条件下氨基酸对OSβG的CMC的影响见图2。

图2 不同pH条件下氨基酸对OSβG的CMC的影响
Fig.2 Effects of amino acids on the CMC of OSβG at different pH conditions
注:不同大写字母表示同组不同pH间存在显著差异(P<0.05);不同小写字母表示相同pH条件下各组间存在显著差异(P<0.05)(下同)
在强酸性条件下,由于OSβG分子的辛烯基琥珀酸链羧基完全质子化,导致缺乏静电斥力,使OSβG胶束的疏水核结构紧密堆积,芘分子更易渗透到胶束疏水核中,此时氨基酸对OSβG胶束化影响较小,导致pH 3时氨基酸对其CMC影响很小[22]。但pH 6时,各条件下CMC均增加,主要归功于OSβG分子的辛烯基琥珀酸链羧基逐渐去质子化,此时质子化和脱质子化的OSβG分子共存,静电斥力增强,导致OSβG胶束疏水核松散,使渗透到疏水区域的芘分子难以稳定存在,导致氨基酸对其CMC影响较大;当pH 10时OSβG分子的辛烯基琥珀酸链羧基完全脱质子化,静电斥力进一步增强,导致CMC进一步增加。在相同pH条件下,与对照组和酸性氨基酸组相比,碱性赖氨酸使OSβG的CMC呈现不同程度的增加趋势,说明具有酸碱性的氨基酸对OSβG的CMC的影响,与其环境pH密切相关。4种疏水性氨基酸的疏水性大小顺序为:异亮氨酸>苯丙氨酸>半胱氨酸>丙氨酸,结果说明它们对OSβG的CMC的影响与其亲/疏水性并非简单的线性关系,说明氨基酸对OSβG的CMC影响行为较为复杂。HE等[23]研究了碱性氨基酸对脱氧胆酸钠CMC的影响,结果发现,影响效果取决于氨基酸侧链所带的电荷,主要受静电和疏水相互作用控制。总之,结果说明pH主要通过质子化作用,氨基酸主要通过与OSβG的糖链形成氢键、与OSβG的OSA链形成静电斥力,二者协同影响OSβG的自聚集。
2.2 不同pH条件下氨基酸对OSβG胶束粒径和PDI的影响
如图3所示,当溶液pH=3时,氨基酸对OSβG胶束粒径影响很小,根本原因在于其OSA链羧基完全质子化,导致OSβG胶束收缩、粒径减小[24],此时氨基酸的影响可忽略;且pH=3时PDI均小于0.2(图4),说明此时OSβG胶束分散均匀。pH=6时,与未添加氨基酸的OSβG胶束相比,添加氨基酸的各组OSβG胶束粒径均减小,可能是氨基酸通过与OSβG胶束的糖链形成氢键、与OSA链形成疏水作用力,导致胶束收缩重排、PDI增加。pH=10时,氨基酸和OSβG分子均发生脱质子化,体系静电斥力增强,导致OSβG胶束发生重排,且不同氨基酸在pH 10条件下的电荷密度不同,导致了OSβG胶束粒径和PDI差异,其中此时碱性赖氨酸组的粒径最大。
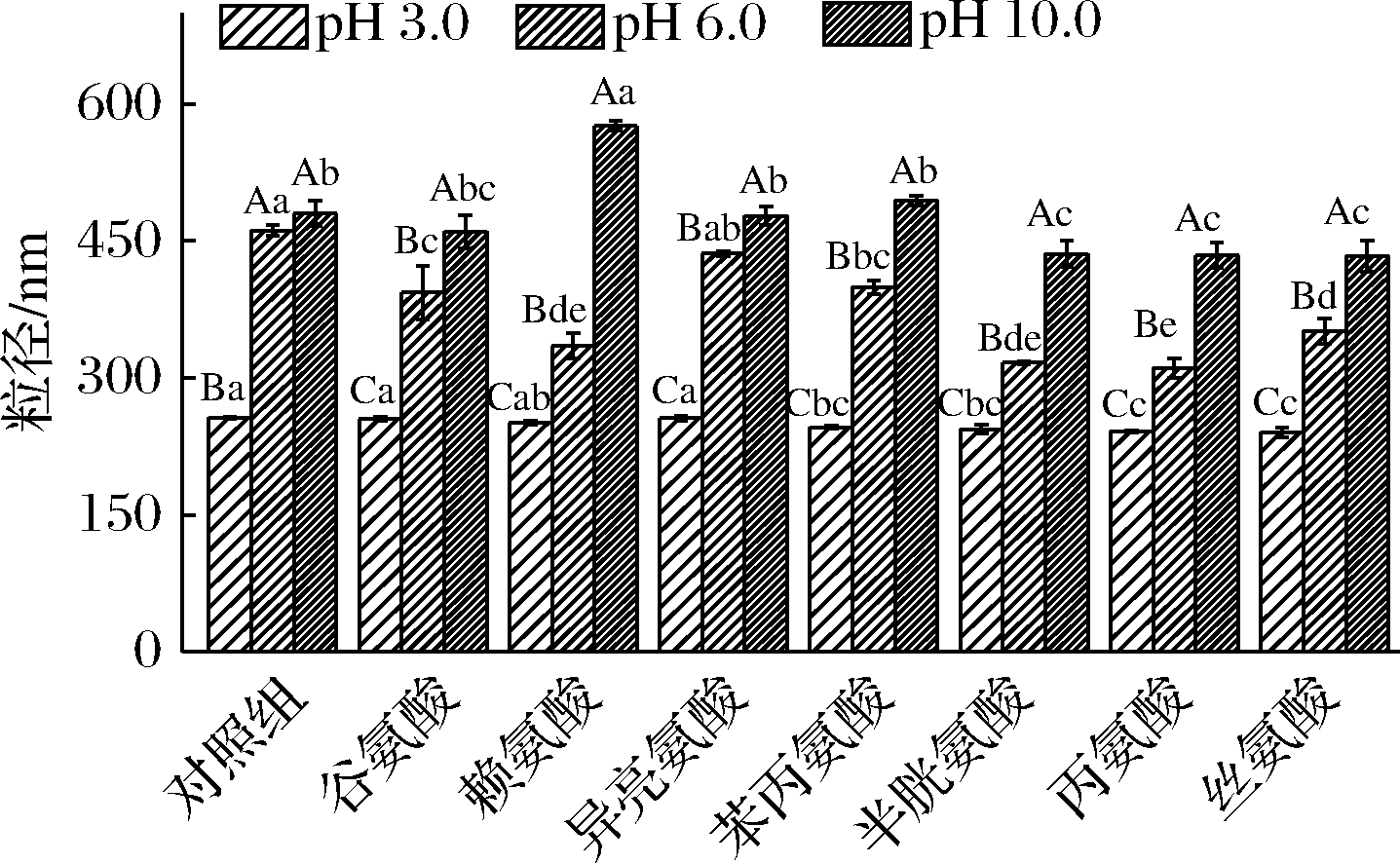
图3 不同pH条件下氨基酸对OSβG胶束粒径的影响
Fig.3 Effects of amino acids on the size of OSβG micelles at different pH conditions
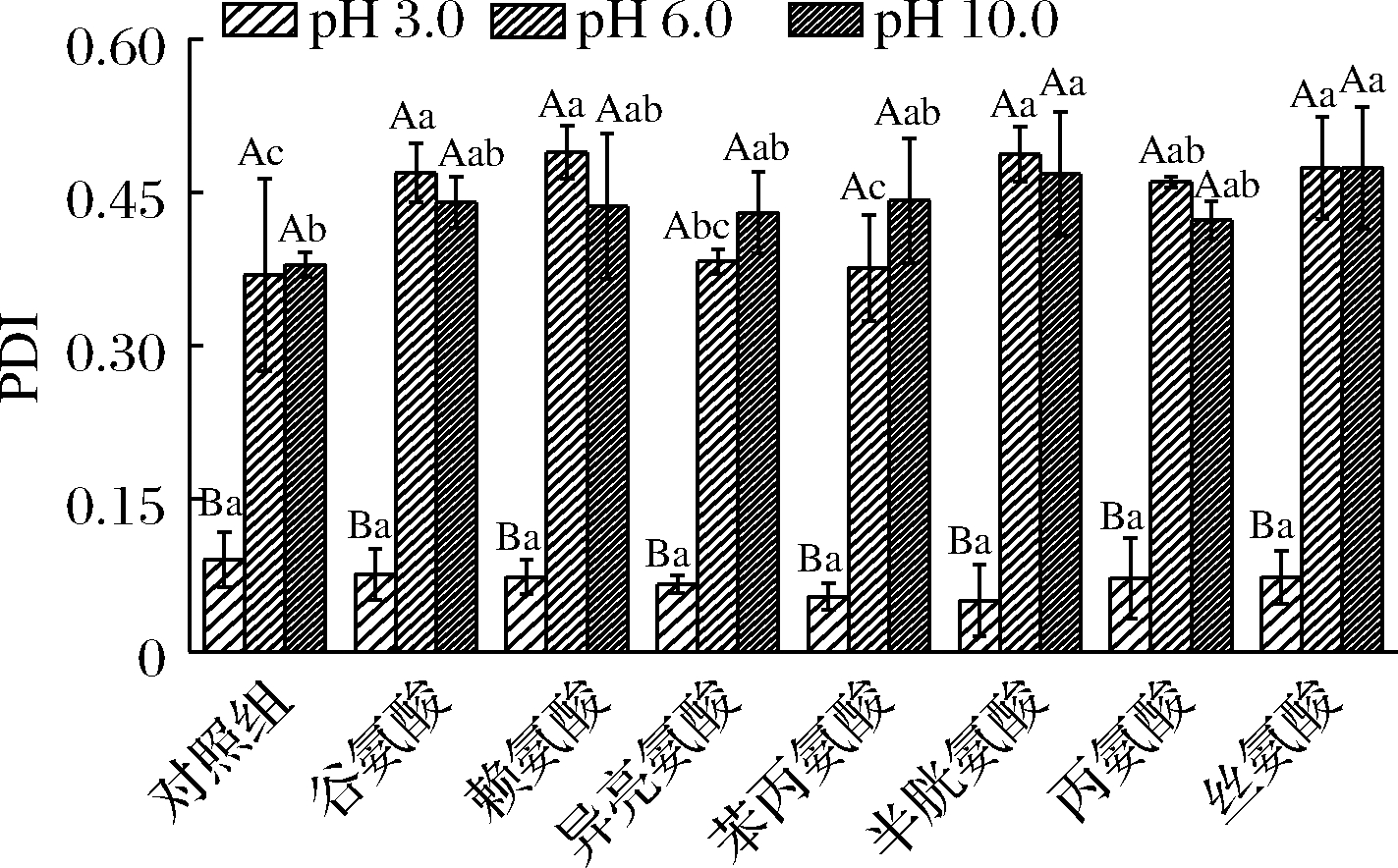
图4 不同pH条件下氨基酸对OSβG胶束PDI的影响
Fig.4 Effects of amino acids on PDI of OSβG micelles at different pH conditions
结果进一步说明:(1)不同种类的氨基酸对OSβG胶束结构的影响主要原因为pH对氨基酸侧链和OSβG羧基的解离作用,最终取决于分子间作用力的改变;(2)对于5种中性氨基酸而言,pH=3时其粒径无显著差异(除异亮氨酸外),pH=6和pH=10时异亮氨酸和苯丙氨酸组的粒径略大于其他3组,可能原因在于不同氨基酸的亲疏水性及其侧链链长差异导致。
2.3 不同pH条件下氨基酸对OSβG胶束Zeta电位的影响
Zeta电位常用于反映胶束的微结构及其稳定性[25]。为了进一步研究氨基酸对OSβG胶束的结构及其作用力的影响,测定了不同pH条件下氨基酸对OSβG胶束Zeta电位的影响,结果见图5。在所测试范围内,所有样品的Zeta电位均为负值。当氨基酸与OSβG胶束混合溶液pH为3时,氨基酸种类对OSβG胶束Zeta电位影响较小,主要是由于氨基酸与OSβG均质子化,降低了电荷密度,OSβG胶束的净电荷锐减,导致氨基酸对OSβG胶束的表面电荷影响较小[26]。当溶液pH=6时,此时pH接近中性氨基酸和OSβG胶束的解离常数pKa,此时溶液中性氨基酸解离程度相对较低,质子化与脱质子化OSβG分子共存,导致此时OSβG胶束Zeta电位主要受pH对氨基酸解离程度的影响和支配。
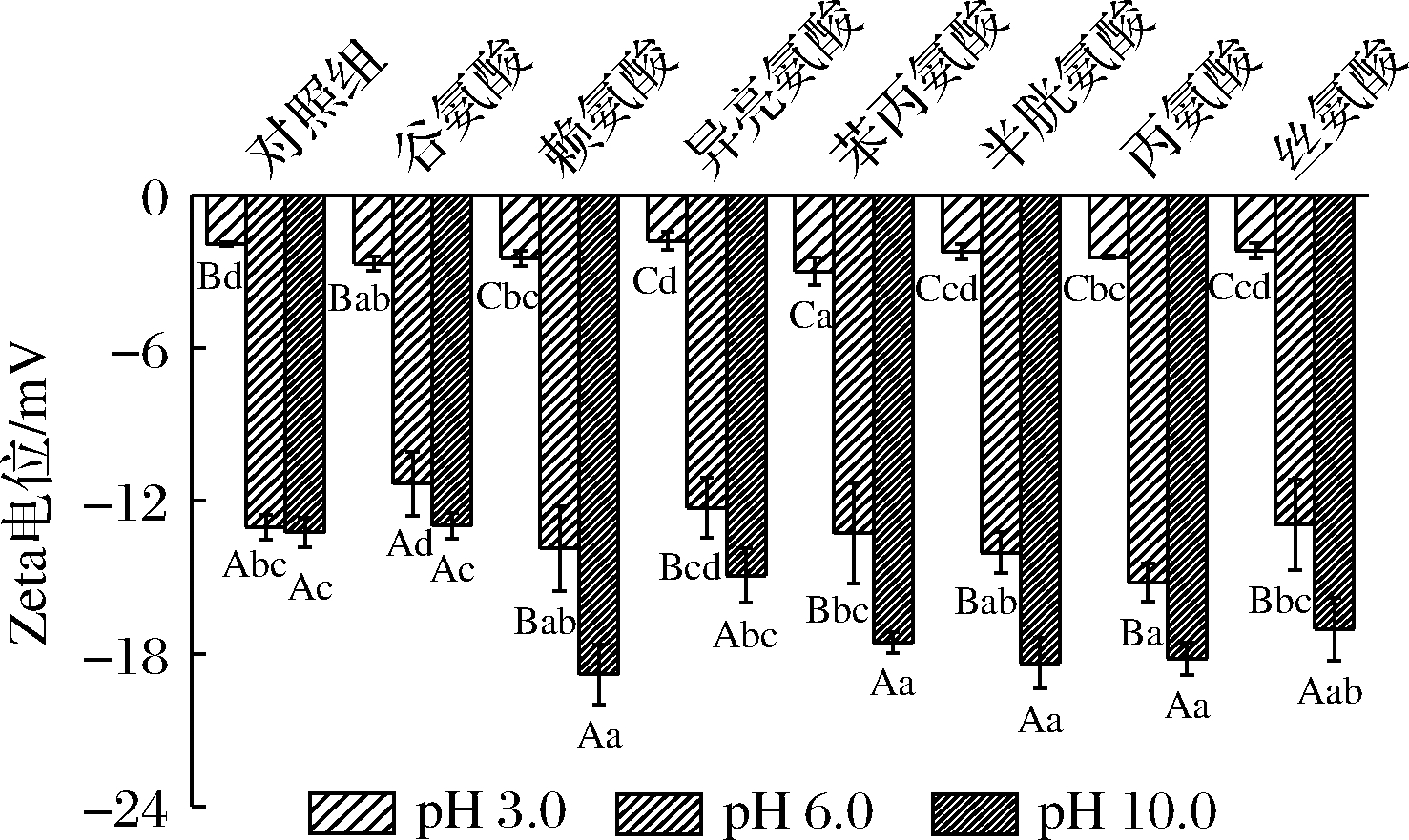
图5 不同pH条件下氨基酸对OSβG胶束Zeta电位的影响
Fig.5 Effects of amino acids on the Zeta potential of OSβG micelles at different pH conditions
当pH=10时,OSβG胶束的OSA链羧基全部脱质子化、带上大量负电荷,与此同时氨基酸根据其pKa值发生了不同程度的解离,且氨基酸分子侧链R基团的带电情况不同,使得不同种类氨基酸与OSβG分子接触的有效分子数不同,导致净电荷增加[27-28]。总之,不同pH条件下氨基酸对OSβG胶束Zeta电位的影响主要取决于二者电荷密度与解离状态及分子之间的静电斥力。
2.4 中性氨基酸对pH 6时荷载姜黄素OSβG胶束的粒径、PDI和表面电荷的影响
为了进一步对比氨基酸极性对OSβG胶束荷载能力的影响,考虑到OSβG的自聚集驱动力主要来自其辛烯基琥珀酰基之间的疏水相互作用,因此选择了4种疏水性氨基酸(异亮氨酸、苯丙氨酸、半胱氨酸和丙氨酸)和1种亲水性氨基酸(丝氨酸,作为对照),而酸性氨基酸和碱性氨基酸相对于中性氨基酸而言极性差异过大,因此没有选择。以脂溶性成分姜黄素作为被荷载目标物质,这5种中性氨基酸在pH=6和室温时对荷载姜黄素OSβG胶束的影响,结果见图6。与未添加氨基酸组相比,添加半胱氨酸、丙氨酸和丝氨酸使荷载姜黄素OSβG胶束粒径略有降低,添加异亮氨酸和苯丙氨酸均导致荷载姜黄素OSβG胶束粒径增加;添加半胱氨酸、丙氨酸和丝氨酸导致荷载姜黄素OSβG胶束的PDI和Zeta电位均增加,而添加异亮氨酸和苯丙氨酸导致荷载姜黄素OSβG胶束的PDI和Zeta电位呈现出与上述情况相反的变化趋势。前期研究发现,荷载姜黄素使OSβG胶束粒径减小[29],这5种中性氨基酸对荷载姜黄素OSβG胶束粒径的影响可能与氨基酸影响OSβG胶束亲疏水链的分布和定位有关。这说明通过添加氨基酸能够在一定程度上影响荷载胶束的结构,添加异亮氨酸和苯丙氨酸均导致荷载胶束粒径增加、PDI减少,这可能与异亮氨酸和苯丙氨酸导致更多OSβG的羧基基团裸露,使荷载胶束的净电荷增加(即Zeta电位绝对值增加);而半胱氨酸、丙氨酸和丝氨酸导致荷载胶束粒径收缩,导致羧基被屏蔽,净电荷减少。结果说明,这5种中性氨基酸的亲/疏水性并非其影响和决定荷载姜黄素OSβG胶束特性的唯一因素,还可能与其侧链链长、极性、所带电荷密度等均有关。OSβG胶束对目标疏水物质的增溶是一个较为缓慢的过程,伴随着其疏水链的取向和定位变化[30],氨基酸可能是通过诱导荷载姜黄素OSβG胶束亲疏水链的重排、聚集等进一步影响体系的均匀性和稳定性。由于试验中采用先形成荷载姜黄素OSβG胶束,而后再加入氨基酸进行影响和干扰,氨基酸作为被荷载物质的可能性也存在,但其在荷载姜黄素OSβG胶束的位置及分布规律还需要进一步深入研究。总之,该研究一方面明确了氨基酸对OSβG自聚集的影响规律,另一方面揭示了通过改变氨基酸种类及其所处环境条件调控OSβG自聚集行为及其特性的可行性。
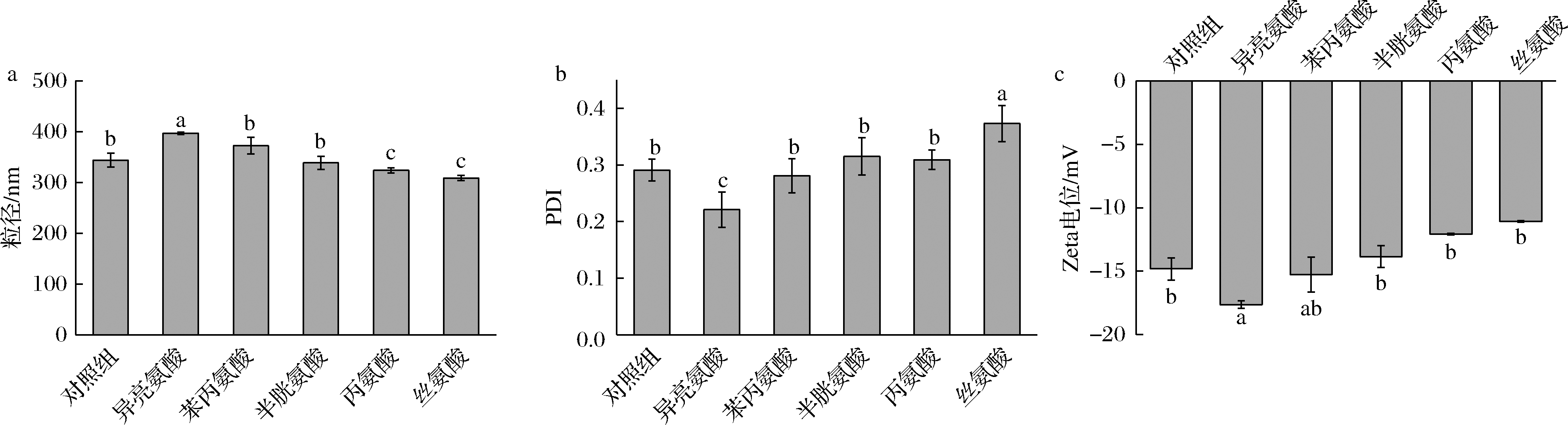
a-胶束粒径;b-PDI;c-Zeta电位
图6 氨基酸对荷载姜黄素OSβG胶束粒径、PDI和Zeta电位的影响
Fig.6 Effects of amino acids on the size,PDI and Zeta potential of curcumin-loaded OSβG micelles
3 结论
研究了不同pH(3、6、10)条件下氨基酸对OSβG自聚集行为的影响,通过测定OSβG的CMC、OSβG胶束的粒径、PDI和Zeta电位等参数,揭示了7种氨基酸及其所处pH条件对OSβG胶束形成的影响规律及其分子本质,进一步明确了其中5种中性氨基酸对荷载姜黄素OSβG胶束的影响。结果表明:(1)随着pH升高,各氨基酸存在条件下OSβG的CMC、OSβG胶束的粒径和净电荷均呈现增大趋势,主要原因在于pH通过影响氨基酸侧链和OSβG分子辛烯基琥珀酸链羧基的质子化与脱质子化程度,进一步导致OSβG胶束及其与氨基酸侧链间的分子间作用力(如氢键、静电斥力和疏水相互作用)的变化,实现对OSβG胶束上述指标的调控,即碱性环境介质在很大程度上阻碍其胶束化,而酸性介质则会促进其胶束化;(2)与未添加氨基酸相比,添加半胱氨酸、丙氨酸和丝氨酸使荷载姜黄素OSβG胶束粒径略有降低,添加异亮氨酸和苯丙氨酸均导致荷载姜黄素OSβG胶束粒径增加;添加半胱氨酸、丙氨酸和丝氨酸导致荷载姜黄素OSβG胶束的PDI和Zeta电位均增加,而添加异亮氨酸和苯丙氨酸导致荷载姜黄素OSβG胶束的PDI和Zeta电位呈现出与上述情况相反的变化趋势,这5种中性氨基酸的亲/疏水性并非其影响和决定荷载姜黄素OSβG胶束特性的唯一因素,还可能与其侧链链长和极性等性质有关。总之,选择氨基酸作为食品组分代表物,研究其在不同pH条件下对OSβG自聚集行为的影响及其本质规律,旨在揭示氨基酸对OSβG自聚集胶束形成的促进或阻碍效应,为构建稳态和可调控的OSβG胶束提供新的视角。
[1] VALENCIA G A,ZARE E N,MAKVANDI P,et al.Self-assembled carbohydrate polymers for food applications:A review[J].Comprehensive Reviews in Food Science and Food Safety,2019,18(6):2 009-2 024.
[2] WANG Z,DENG X P,DING J S,et al.Mechanisms of drug release in pH-sensitive micelles for tumour targeted drug delivery system:A review[J].International Journal of Pharmaceutics,2018,535(1):253-260.
[3] WU Z,ZHAO C Y,HUANG Y X,et al.Molecular mechanism underlying the effects of temperature and pH on the size and surface charge of octenylsuccinated oat β-glucan aggregates[J].Carbohydrate Polymers,2020,237:116115.
[4] LU X,CHEN J H,GUO Z B,et al.Using polysaccharides for the enhancement of functionality of foods:A review[J].Trends in Food Science & Technology,2019,86:311-327.
[5] 向卓亚, 赵国华,叶发银,等.两亲性多糖壳-核胶束稳定性研究进展[J].食品与机械,2016,32(7):207-213.
XIANG Z Y,ZHAO G H,YE F Y,et al.Stability of "shell-core" micelles formed by amphiphilic polysaccharides[J].Food and Machinery,2016,32(7):207-213.
[6] 肖丽,叶发银,赵国华.两亲性多糖的制备及其自聚集胶束的特性研究进展[J].食品科学,2017,38(1):263-268.
XIAO L,YE F Y,ZHAO G H.Advances in synthesis of amphiphilic polysaccharides and properties of their self-aggregated micelles[J].Food Science,2017,38(1):263-268.
[7] OWEN S C,CHAN D P Y,SHOICHET M S.Polymeric micelle stability[J].Nano Today,2012,7(1):53-65.
[8] HE D G,WANG S,LEI L,et al.Core-shell particles for controllable release of drug[J].Chemical Engineering Science,2015,125:108-120.
[9] HAN X,ZHANG X X,ZHU H F,et al.Effect of composition of PDMAEMA-b-PAA block copolymers on their pH-and temperature-responsive behaviors[J].Langmuir,2013,29(4):1 024-1 034.
[10] ALTUNA L,HERRERA M L,FORESTI M L.Synthesis and characterization of octenyl succinic anhydride modified starches for food applications.A review of recent literature[J].Food Hydrocolloids,2018,80:97-110.
[11] SWEEDMAN M C,TIZZOTTI M J,SCH FER C,et al.Structure and physicochemical properties of octenyl succinic anhydride modified starches:A review[J].Carbohydrate Polymers,2013,92(1):905-920.
FER C,et al.Structure and physicochemical properties of octenyl succinic anhydride modified starches:A review[J].Carbohydrate Polymers,2013,92(1):905-920.
[12] ZHANG R Y,BELWAL T,LI L,et al.Recent advances in polysaccharides stabilized emulsions for encapsulation and delivery of bioactive food ingredients:A review[J].Carbohydrate Polymers,2020,242:116388.
[13] PUNIA S.Barley starch modifications:Physical,chemical and enzymatic-A review[J].International Journal of Biological Macromolecules,2020,144:578-585.
[14] MA Y Q,LIU J,YE F Y,et al.Solubilization of β-carotene with oat β-glucan octenylsuccinate micelles and their freeze-thaw,thermal and storage stability[J].LWT-Food Science and Technology,2016,65:845-851.
[15] LIU J,LI J,MA Y Q,et al.Synthesis,Characterization,and aqueous self-assembly of octenylsuccinate oat β-glucan[J].Journal of Agricultural and Food Chemistry,2013,61(51):12 683-12 691.
[16] PATIDAR P,BAHADUR A.Modulating effect of different biomolecules and other additives on cloud point and aggregation of amphiphilic linear and starblock copolymer[J].Journal of Molecular Liquids,2018,249:219-226.
[17] WU S Y,YAN Z N,WEN X L,et al.Conductometric and fluorescence probe investigations of molecular interactions between dodecyltrimethylammonium bromide and dipeptides[J].Colloid and Polymer Science,2014,292(11):2 775-2 783.
[18] GELAMO E L,SILVA C H T P,IMASATO H,et al.Interaction of bovine(BSA)and human(HSA)serum albumins with ionic surfactants:Spectroscopy and modelling[J].Biochimica et Biophysica Acta(BBA)-Protein Structure and Molecular Enzymology,2002,1 594(1):84-99.
[19] BONNAUD M,WEISS J,MCCLEMENTS D J.Interaction of a food-grade cationic surfactant(Lauric Arginate)with good-grade biopolymers(pectin,carrageenan,xanthan,alginate,dextran,and chitosan)[J].Journal of Agricultural and Food Chemistry,2010,58(17):9 770-9 777.
[20] KHRUSTALEV V V,BARKOVSKY E V.Stabilization of secondary structure elements by specific combinations of hydrophilic and hydrophobic amino acid residues is more important for proteins encoded by GC-poor genes[J].Biochimie,2012,94(12):2 706-2 715.
[21] 王传怀,袁玉荪.等电状态两性化合物的电化学性质[J].南京大学学报(自然科学版),1985,21(1):192-201.
WANG C H,YUAN Y S.The electrochemical properties of the ampholytes in isoelectrical states[J].Journal of Nanjing University(Natural Sciences Edition),1985,21(1):192-201.
[22] LIU Y,GUO R.pH-dependent structures and properties of casein micelles[J].Biophysical Chemistry,2008,136(2):67-73.
[23] HE F,XU G Y,PANG J Y,et al.Effect of amino acids on aggregation behaviors of sodium deoxycholate at air/water surface:Surface tension and oscillating bubble studies[J].Langmuir,2011,27(2):538-545.
[24] XUE Y N,HUANG Z Z,ZHANG J T,et al.Synthesis and self-assembly of amphiphilic poly(acrylic acid-b-DL-lactide)to form micelles for pH-responsive drug delivery[J].Polymer,2009,50(15):3 706-3 713.
[25] LE-VINH B,LE N-M N,NAZIR I,et al.Chitosan based micelle with zeta potential changing property for effective mucosal drug delivery[J].International Journal of Biological Macromolecules,2019,133:647-655.
[26] JIANG X Y,LU G L,FENG C,et al.Poly(acrylic acid)-graft-poly(N-vinylcaprolactam):A novel pH and thermo dual-stimuli responsive system[J].Polymer Chemistry,2013,4(13):3 876-3 884.
[27] HE F,XU G Y,PANG J Y,et al.Effect of amino acids on aggregation behaviour of sodium deoxycholate in solution:A fluorescence study[J].Luminescence,2012,27(1):4-10.
[28] YANG Y,DONG J,LI X F.Micelle to vesicle transitions of N-dodecyl-1,ω-diaminoalkanes:Effects of pH,temperature and salt[J].Journal of Colloid and Interface Science,2012,380(1):83-89.
[29] LIU J,CHEN F,TIAN W N,et al.Optimization and characterization of curcumin loaded in octenylsuccinate oat β-Glucan micelles with an emphasis on degree of substitution and molecular weight[J].Journal of Agricultural and Food Chemistry,2014,62(30):7 532-7 540.
[30] WU Z,ZHAO C Y,LI R H,et al.Insights into micellization of octenylsuccinated oat β-glucan and uptake and controlled release of β-carotene by the resultant micelles[J].Journal of Agricultural and Food Chemistry,2019,67(26):7 416-7 427.