姜黄素是一种来源于姜黄的疏水性植物多酚,具有抗氧化、抗炎、抗菌、抗癌等多种生物活性[1-2]。然而由于遇光热不稳定、胃肠道稳定性差等原因,姜黄素的口服生物利用度偏低,严重影响其在食品及医药工业领域的应用[1,3-4]。近几十年来,相关领域开发出了一系列的递送体系,通过将姜黄素负载于脂质体、乳液、环糊精、聚合物纳米粒等载体内,提高姜黄素的水分散性、理化稳定性以及生物利用度[5-8]。
玉米醇溶蛋白(zein)是一种来源于玉米的食品级天然高分子材料,具有来源广泛、生物相容性好、生物可降解等优点[9-10]。同时zein还具有两亲性,虽不溶于水,但能够在水中形成纳米尺寸的胶体,是一种天然的纳米载体材料[11-13]。由于其独特的疏水性,zein表现出良好的隔绝水、热、氧等极端外部环境的性质,特别适合于易氧化水解的生物活性分子的负载,如姜黄素、维生素D3等[11,14-15]。然而通过溶剂共沉淀法得到的zein纳米粒,稳定性差,极易在水中团聚,造成活性物质的沉淀;同时易被食品或胃肠道中的蛋白酶降解,导致活性物质的泄露或失活。在制备过程中引入稳定剂,如表面活性剂、亲水性高分子等,可以改善zein纳米粒在不同pH下的分散性和稳定性[16-18]。
磷脂是不溶于水的双亲性小分子,在水中能够自组装形成脂质体[19]。将脂质体与纳米粒共挤出,可以将磷脂涂敷于纳米粒表面[20-21]。经脂质包衣后的纳米粒,不仅在不同pH环境、血液及体液中稳定性显著提高,同时具备脂质体的优良特性,如细胞毒性低、细胞亲和性高、表面抗原性低、体内循环时间长等[22-24]。
本实验以zein为载体材料制备负载姜黄素的纳米粒,并利用共挤出的方法,在纳米粒表面涂敷一层磷脂壳层,从而得到脂质包衣的姜黄素/zein纳米粒,如图1所示。接着对纳米粒进行稳定性表征,研究纳米粒在脂质包衣前后不同pH环境下的稳定性以及负载前后姜黄素的光热稳定性和抗氧化性,然后进一步表征了姜黄素纳米粒的体外释放特性。
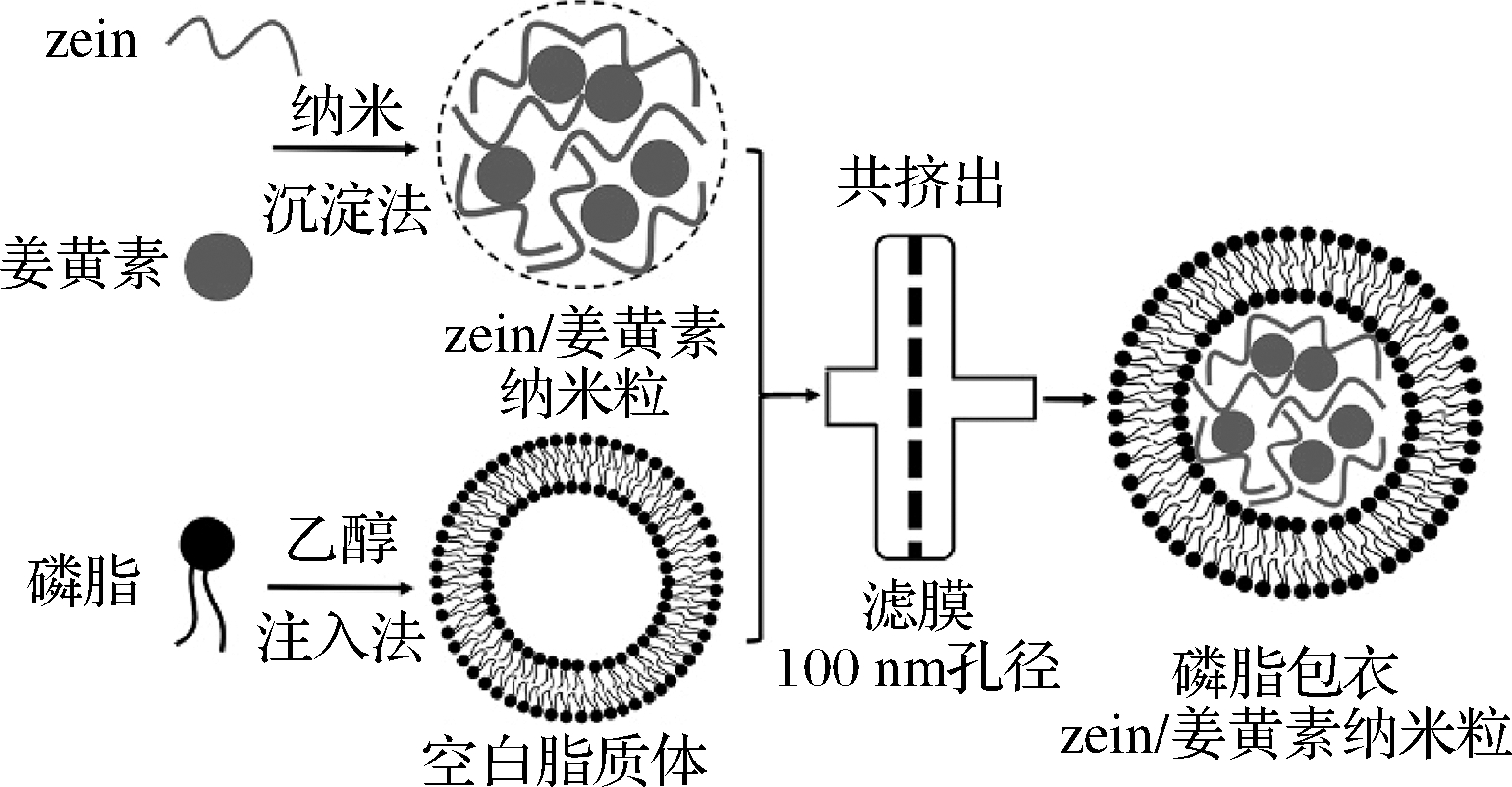
图1 脂质包衣zein/姜黄素纳米粒制备流程图
Fig.1 Schematic illustration for the fabrication of lipid coated zein/curcumin nano-complexation
1 材料与方法
1.1 材料与试剂
姜黄素、胆固醇、DPPH,上海阿拉丁生化科技股份有限公司;玉米醇溶蛋白,北京伊诺凯科技有限公司;氢化大豆卵磷脂,艾伟拓(上海)医药科技有限公司;其余有机溶剂均为国产分析纯。
1.2 仪器与设备
Zeta电位及纳米/亚微米粒度分析仪,美国贝克曼库尔特有限公司;SpectraMax iD3 多功能酶标仪,美国美谷分子仪器有限公司。
1.3 实验方法
1.3.1 负载姜黄素的zein纳米粒(NP)的制备
利用共沉淀法制备包裹姜黄素的zein纳米粒[25]。以体积分数为80%的乙醇溶液为溶剂,配制一系列质量浓度(2~20 mg/mL)的zein溶液。将姜黄素溶解于无水乙醇中,质量浓度为2 mg/mL。将2种溶液等体积混合均匀,采用“一针法”快速打入10 mmol/L的PB缓冲液(pH 4)中,继续搅拌30 min,旋转蒸发除去混合溶液中残余乙醇,即得NP混悬液。
1.3.2 脂质体的制备
采用乙醇注入法制备脂质体[26]。将氢化大豆卵磷脂和胆固醇共溶于无水乙醇中,其中氢化大豆卵磷脂质量浓度为3 mg/mL,胆固醇质量浓度为1 mg/mL,边搅拌边将溶液缓慢注入双蒸水中,水油体积比为6∶1,继续搅拌30 min,旋转蒸发除去混合溶液中残余的乙醇,即得脂质体混悬液。
1.3.3 脂质包衣纳米粒的制备
采用共挤出的方法制备脂质包衣的纳米粒[20]。将NP混悬液与脂质体混悬液等体积混合,并将混合溶液挤压通过100 nm的滤膜,重复挤出15次,即得到脂质包衣的纳米粒(NP@LIP)。
1.3.4 颗粒粒径及表面电位表征
利用Zeta电位及纳米/亚微米粒度分析仪测量颗粒的粒径、粒径分布及表面电位。重复测量3次取平均值。
1.3.5 包封率及载药量的测量
采用离心法进行包封率及载药量的测量。取2 mL的纳米粒混悬液,在10 000 r/min转速下离心30 min,未包裹的姜黄素离心至底部,弃去上清液,加入2 mL的乙醇溶液将沉淀复溶,并利用多功能酶标仪测量428 nm处的紫外吸收以得到姜黄素的质量浓度。通过公式(1)和公式(2)计算得出包封率和载药量:
包封率![]()
(1)
载药量![]()
(2)
1.3.6 不同pH水分散性表征
将制备好的纳米粒混悬液与5倍体积的不同pH的PB缓冲液(pH 2.5、4.5、5.5、6.6、7.4)均匀混合,室温下孵育4 h后,测量其粒径及粒径分布。
1.3.7 光照稳定性表征
将10 mL纳米粒混悬液或姜黄素水混悬液暴露于紫外光(0.3 W/m2,波长305 nm)中,每隔1 h取出200 μL混悬液与800 μL乙醇混合以破坏纳米粒,并测量姜黄素的质量浓度。
1.3.8 热稳定性表征
将10 mL纳米粒混悬液以及姜黄素水混悬液在80 ℃下进行孵育,每隔1 h取出200 μL混悬液与800 μL乙醇混合以破坏纳米粒,并测量姜黄素的质量浓度。
1.3.9 体外抗氧化性表征
通过DPPH自由基清除实验表征姜黄素纳米粒的体外抗氧化性能[18]。配制一系列质量浓度的姜黄素乙醇溶液、姜黄素水混悬液、NP混悬液、NP@LIP混悬液以及不含姜黄素的脂质包衣的zein纳米粒混悬液作为待测样品。将2 mL的DPPH乙醇溶液(100 μmol/L)与等体积的待测样品混合,避光、室温下孵育30 min,利用酶标仪测量混合液在570 nm处的吸光度,并利用公式(3)计算得出样品的DPPH自由基清除率:
DPPH自由基清除率![]()
(3)
式中:A0,空白孔的吸光度;A1,样品孔的吸光度。
1.3.10 体外释放实验
采用动态透析法在模拟胃肠道环境下进行姜黄素的体外释放实验[27]。以含有5% SDS的模拟胃液(pH 2.5,1 mg/mL胃蛋白酶)和含有5%SDS的模拟肠液(pH 6.6,4 mg/mL胰蛋白酶)为释放介质。取1 mL的NP、NP@LIP混悬液及姜黄素乙醇溶液置于透析袋内(截留分子质量=300 kDa),浸入20 mL的释放介质中,在37 ℃的摇床中孵育。前2 h以模拟胃液为释放介质,2 h后转移入模拟胃液中继续进行释放实验。在特定的时间点取出1 mL透析液,利用紫外-可见分光光度计测量姜黄素含量,并计算得出姜黄素的累积释放量。
1.3.11 数据分析与处理
所有数据均为3次平行实验结果的平均值,标准差以误差线表示。采用双尾学生t检验对数据进行统计学分析(SPSS),P<0.05时,认为两组数据具有显著性差异。
2 结果与分析
2.1 脂质包衣姜黄素/zein纳米粒的构建
利用图1中所示的两步法来构建脂质包衣的姜黄素/zein纳米粒。第1,通过纳米沉淀法制备NP,将姜黄素的质量浓度固定为1 mg/mL,考察了水油比对NP的影响,结果如图2-a所示。水油比<3时,姜黄素与zein只能形成较大的纳米粒(>200 nm)或沉淀;随水油比从4升高至9,NP粒径先由75 nm降低至64 nm后又升高至139 nm,(polydispersit index,PDI)由0.315降低至0.11。为了得到较小粒径的纳米粒及较高的固含量,选取水油比为6作为最优制备条件。图2-b为zein浓度对NP的影响。当zein质量浓度为2 mg/mL时,溶液出现大量沉淀,说明此浓度下,没有足够的zein对姜黄素进行有效包裹。当zein质量浓度高于4 mg/mL时,粒径为60~130 nm,同时粒径分布均匀(PDI<3)的纳米混悬液。图2-c所示为不同zein浓度下姜黄素的包封率和载药量。随zein浓度提高,包封率逐渐由56%提高至90%左右,载药量先由12%升高至16%后又逐渐降低至6%,当zein质量浓度为6 mg/mL时,载药量最大,对姜黄素的包载效果最好,因此选取zein质量浓度6 mg/mL作为最优的制备条件。
第2步,通过脂质体与第1步制备得到的NP纳米核心共挤出的方法构建脂质包衣的纳米粒(NP@LIP)。如图2-d所示,NP的初始粒径和表面电位分别为60 nm和29 mV,共挤出后,纳米混悬液的粒径增大至70 nm,同时表面电位转变为-7 mV,与空白脂质体的表面电位接近,由此说明,经共挤出,成功制备得到了脂质包衣的纳米粒(NP@LIP)。相比于表面涂敷表面活性剂或亲水性高分子的zein纳米粒体系[16-18],NP@LIP具备较高的包封率(80.1%)和载药量(7.4%)。
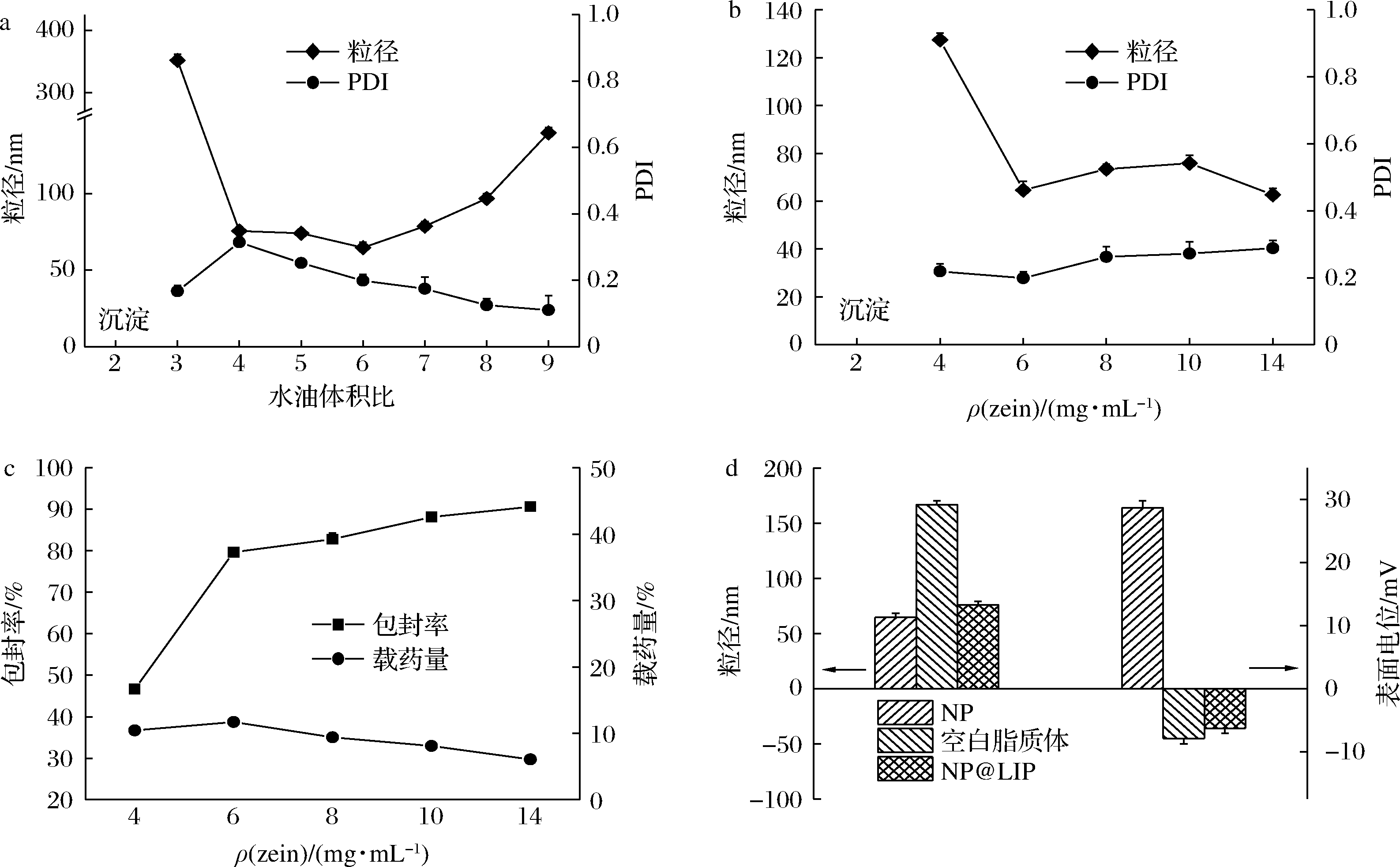
a-不同水油体积比下NP的粒径, PDI, Zein浓度=6 mg/mL; b-不同zein浓度下NP的粒径、PDI,油水比=6; c-不同zein浓度下NP中姜黄素的包封率和载药量; d-空白脂质体、NP及NP@LIP的粒径及表面电位
图2 NP及NP@LIP制备条件优化
Fig.2 Optimization of the fabrication of NP and NP@LIP
2.2 pH稳定性
如图3所示,研究了不同pH下,NP及NP@LIP的水分散性能。随溶液pH逐渐接近6.1,NP粒径逐渐增大,甚至发生沉淀。这是由于zein的等电点在6.1左右,当pH接近等电点时,NP表面电位下降,颗粒间容易发生聚集,甚至沉淀,水分散性下降[28]。当pH由2.5升高至7.4时,NP@LIP粒径虽略有增大,但仍保持良好的水分散性,这是由于NP@LIP具有脂质壳层作为保护,阻碍了颗粒间的聚集。以壳聚糖、酪蛋白酸钠等亲水性多糖或蛋白为稳定剂的zein纳米粒体系[29],其表面层分子的解离状态及表面电位极易受到pH变化的影响,导致其在不同pH环境中的稳定性具有较大差异。相比之下,脂质表面层的解离受pH影响较小,能够在较宽广的pH范围内保持良好的水分散性。
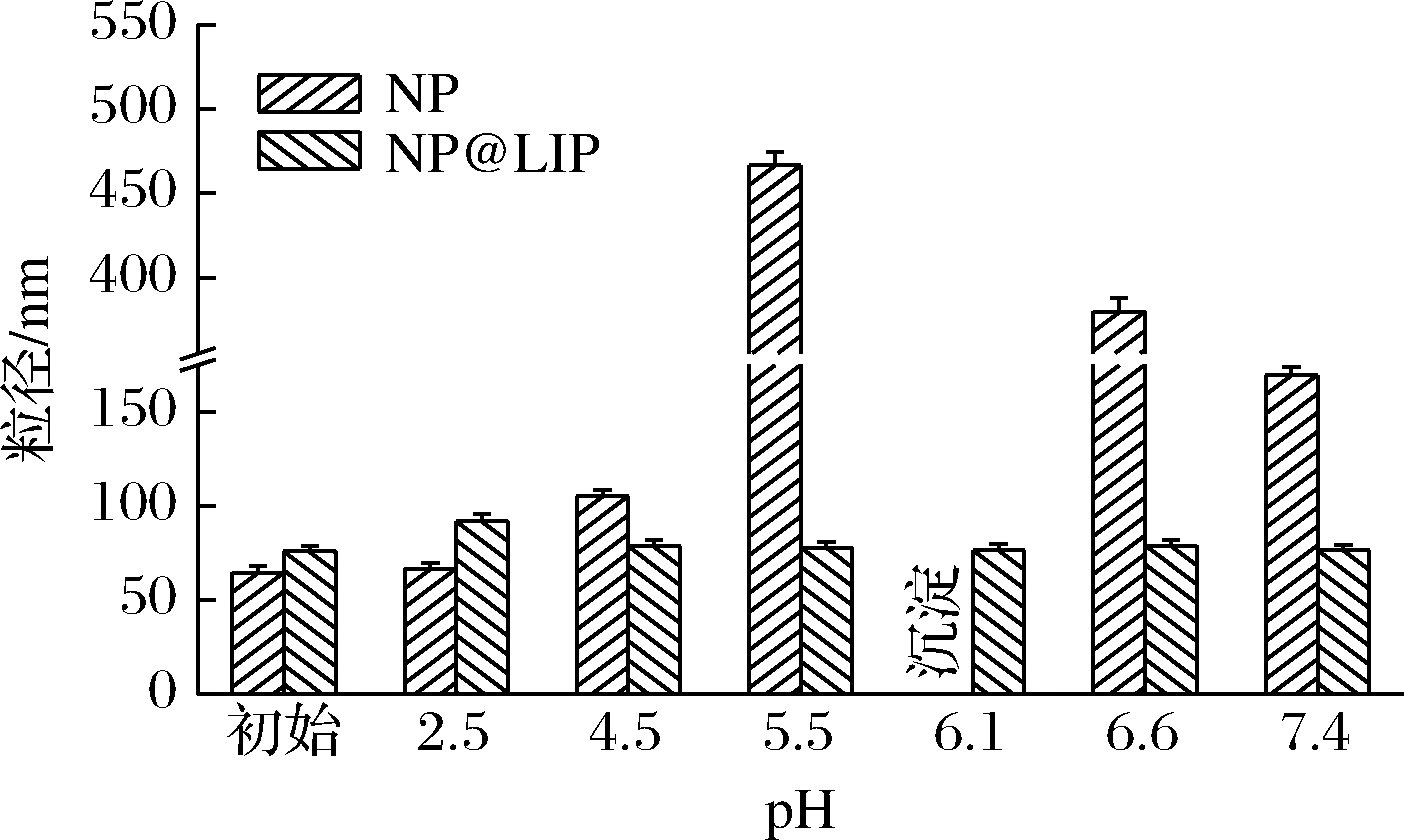
图3 不同pH条件下NP及NP@LIP的粒径
Fig.3 Size of NP and NP@LIP under different pH
2.3 紫外光照稳定性
探究了不同姜黄素纳米粒在紫外光照条件下的稳定性,结果如图4所示。未经包裹的姜黄素含量随光照时间迅速降低,4 h时仅剩余18%;NP及NP@LIP颗粒中姜黄素含量随时间降低较为缓慢,4 h时仍有57%的姜黄素剩余,表明经过负载后,姜黄素表现出更好的光照稳定性,这主要是由于zein的保护作用,磷脂涂覆层对姜黄素稳定性影响较小,该结果与其他研究类似[30]。
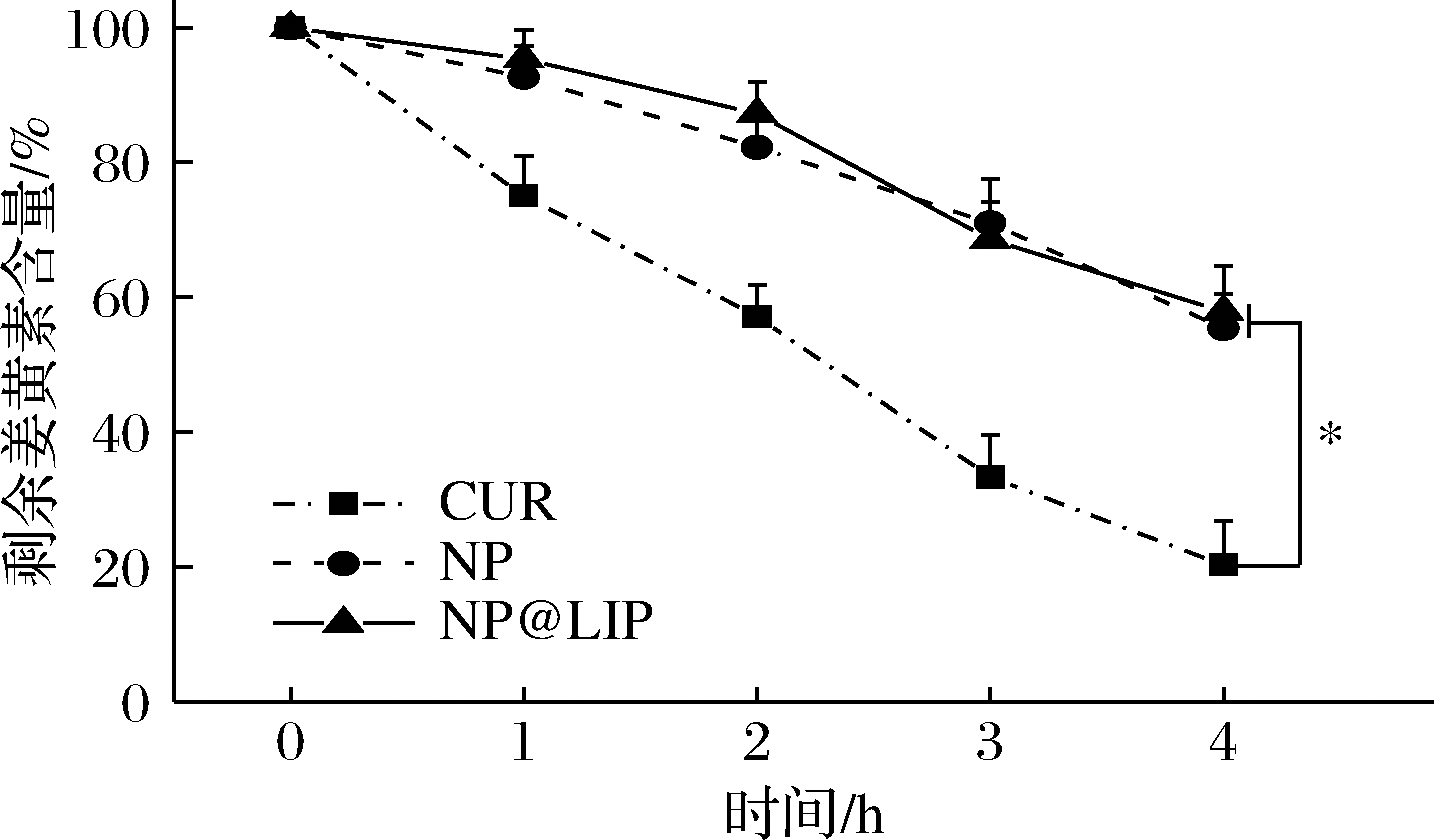
图4 不同姜黄素纳米粒中姜黄素的紫外光照稳定性
Fig.4 Light stability of curcumin in different formulations under UV irradiation
注:*P<0.05;**P<0.01;***P<0.001 CUR=姜黄素(下同)
2.4 热稳定性
探究了不同姜黄素纳米粒在高温(85 ℃)条件下的稳定性,结果如图5所示。未经包裹的自由姜黄素稳定性最差,2 h内即有70%的姜黄素损耗,10 h时基本全部降解。由于zein具有隔绝热、氧等极端环境条件的作用,NP中姜黄素表现出较好的稳定性,10 h时还剩余25.8%。NP@LIP表现出最好的热稳定性,10 h时,仍保留有35.7%的姜黄素。相比于NP,经脂质包衣后,NP@LIP的姜黄素热稳定性(热处理后剩余的姜黄素量)提高了约10%。其他类似研究也发现,相较于单纯的zein/姜黄素纳米粒,表面涂敷不同物质及结构的保护层后,姜黄素的热稳定性提升5%~12%[12-13]。由此说明,脂质壳层的引入能够进一步改善zein纳米粒中姜黄素的热稳定性,达到文献报道的水平[12-13]。
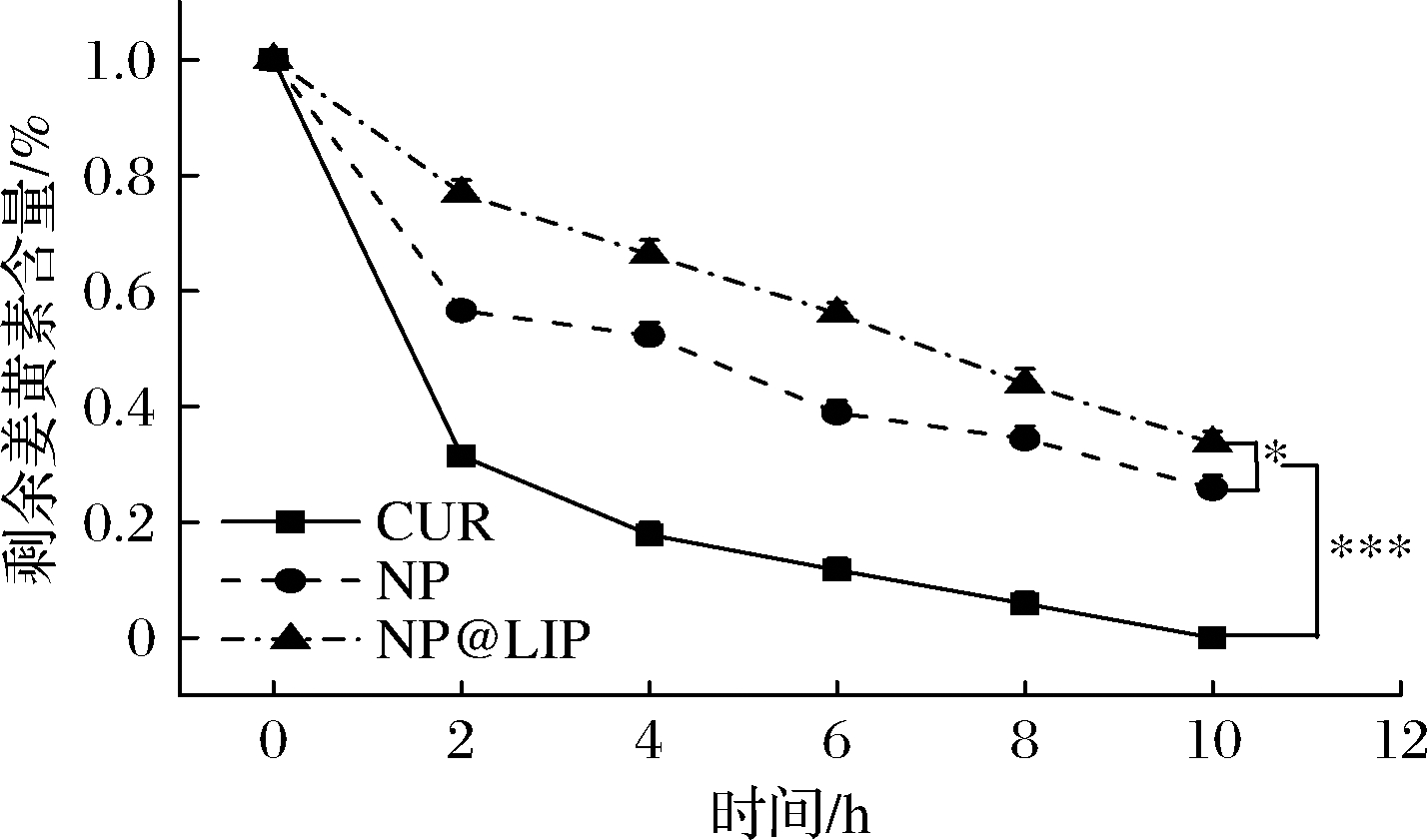
图5 不同姜黄素纳米粒中姜黄素在85 ℃条件下的热稳定性
Fig.5 Heat stability of curcumin in different formulations
2.5 抗氧化性
姜黄素是一类具备良好抗氧化活性的多酚类物质,然而较差的水溶性严重影响了姜黄素在生理环境下的抗氧化性能。通过将姜黄素纳米制剂化,改善其水分散性,显著提高姜黄素在水环境下的抗氧化能力[12]。通过DPPH自由基清除实验研究了不同姜黄素纳米粒的体外抗氧化性能,如图6所示。空白颗粒,即脂质包衣的zein纳米粒,在实验浓度范围基本无抗氧化活性,排除了载体材料对抗氧化性能的影响。由于姜黄素水溶性较差,在0.1~450 μg/mL的浓度范围内,姜黄素水混悬液的自由基清除率均远低于姜黄素乙醇溶液、NP以及NP@LIP,抗氧化活性最差。经zein包裹后,姜黄素水分散性提高,其抗氧化活性优于水混悬液。
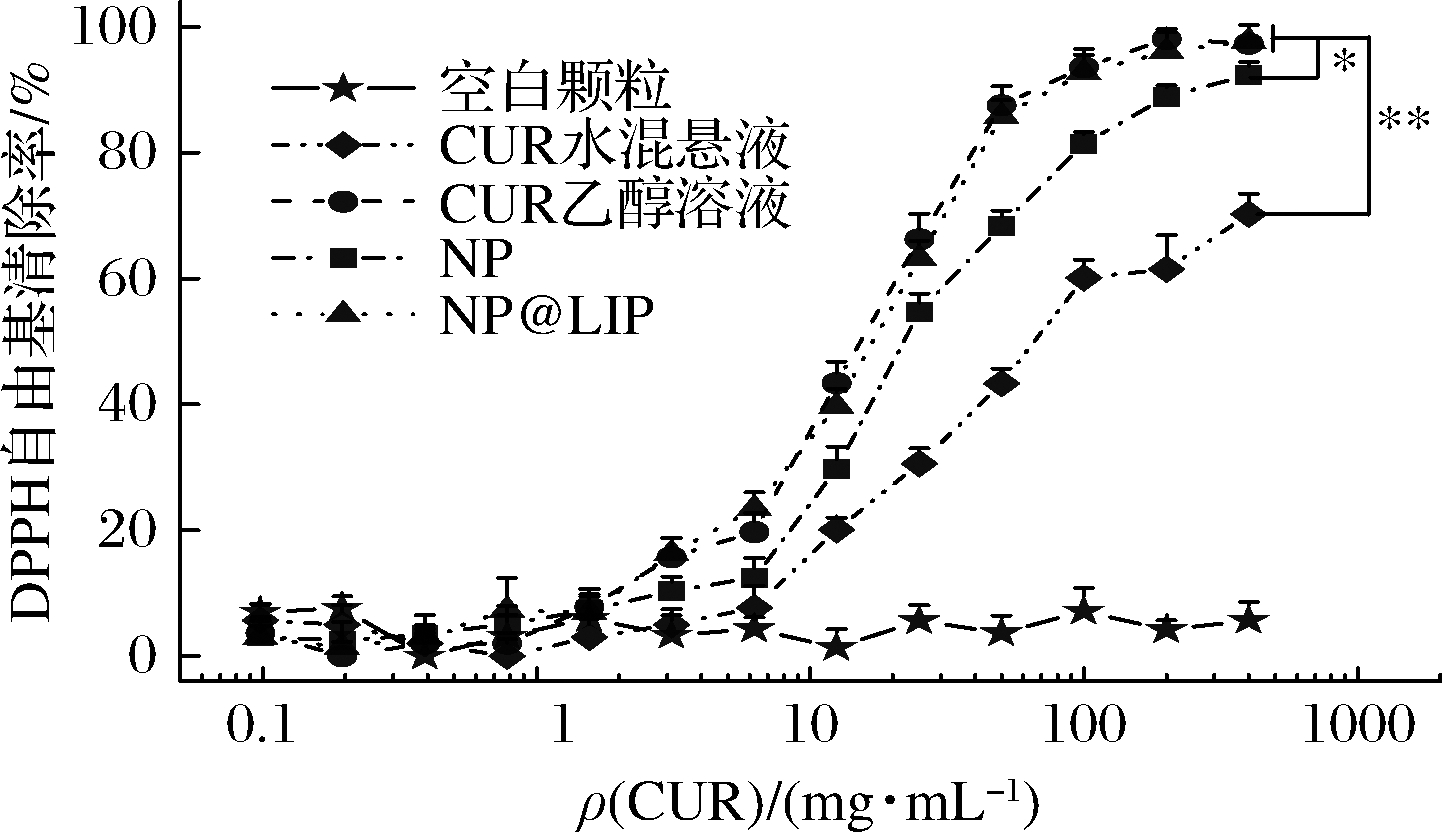
图6 不同姜黄素纳米粒的体外抗氧化性能
Fig.6 Antioxidation activity of different curcumin formulation
NP@LIP的抗氧化活性明显高于NP,这是由于脂质包衣层赋予了NP@LIP更好的水分散性以及稳定性,促进了姜黄素与DPPH自由基的充分接触,表现出与姜黄素乙醇溶液相似的抗氧化能力。
2.6 体外释放行为
通过不同姜黄素纳米粒的体外胃肠道模拟释放行为研究口服后姜黄素的小肠递送效率。胃排空时间约为2 h,因此初始2 h在模拟胃液中进行释放实验,而后转移至模拟肠液,以模拟姜黄素颗粒在整个口服过程中的释放行为。结果如图7所示,未经包裹的自由姜黄素、NP以及NP@LIP在模拟胃液中表现出不同程度的突释,自由姜黄素突释最为严重,2 h时有一半以上的姜黄素被释放出来;经zein负载后,NP的姜黄素突释较为平缓,2 h时仅有38%的姜黄素释放量;NP@LIP姜黄素的突释量最小,2 h时仅有27%,这可能是由于颗粒表面的磷脂层进一步阻止了姜黄素的释放。在进入模拟肠液后,自由姜黄素的释放速率基本不变,直至4 h基本释放完全;而NP及NP@LIP的释放速率显著减小,表现出明显的缓释的特征,且在24 h内基本释放完全,累积释放量分别为78%和76%。由此可知,脂质包衣的姜黄素/zein纳米粒具备良好的胃部保护效果,防止姜黄素在胃部泄露,同时在小肠中能够实现姜黄素的缓释。
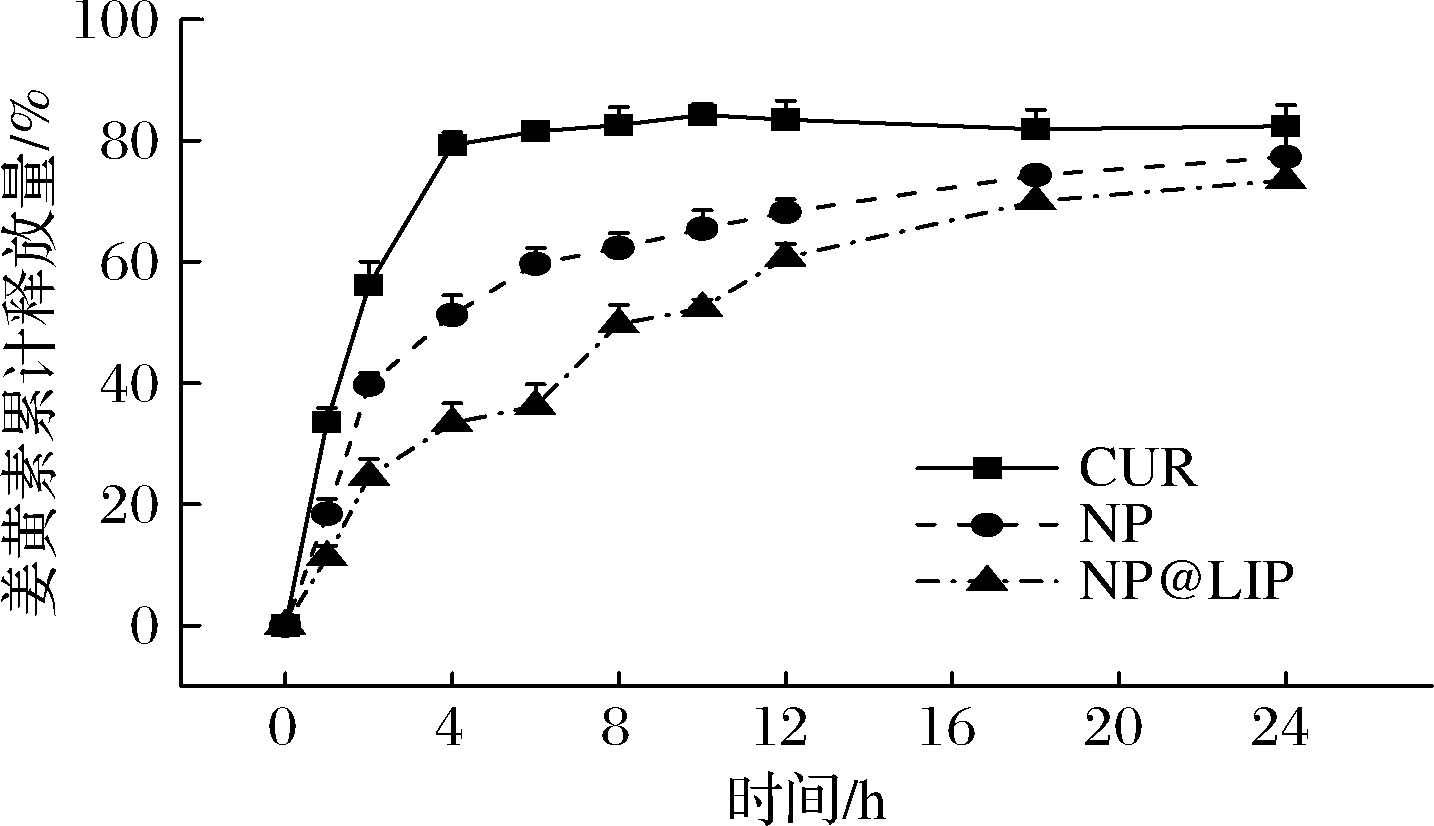
图7 不同姜黄素纳米粒在体外模拟胃肠液中的释放行为
Fig.7 Controlled release behavior of curcumin in different formulations in SGF and SIF
3 结论
本实验以磷脂及玉米醇溶蛋白为载体材料,采用共沉淀法及共挤出法成功制备了脂质包衣的负载姜黄素纳米粒,制得的纳米粒粒径微小、分布均匀同时具有较高的包封率及载药量。研究结果发现经过脂质包衣的姜黄素纳米粒在较广pH范围内均保持良好的水分散性,同时包裹后姜黄素的光热稳定性以及抗氧化性也获得显著提高。体外释放实验表明,脂质包衣的纳米粒能够更有效地阻止姜黄素在胃部的泄露,提高姜黄素口服递送至小肠的效率。本文构建的基于磷脂及玉米醇溶蛋白的核壳结构纳米递送体系能够显著提高姜黄素的理化性质和口服递送效率,极大地扩展了姜黄素在食品工业及生物医药领域的应用,同时还为疏水生物活性物质的性能改善及口服制剂提供了新的思路和方法。
[1] TSUDA T.Curcumin as a functional food-derived factor:Degradation products,metabolites,bioactivity,and future perspectives[J].Food & Function,2018,9(2):705-714.
[2] MEHANNY M,HATHOUT R M,GENEIDI A S,et al.Exploring the use of nanocarrier systems to deliver the magical molecule:Curcumin and its derivatives[J].Journal of Controlled Release,2016,225:1-30.
[3] SUBRAMANI P A,NARALA V R.Challenges of curcumin bioavailability:Novel aerosol remedies[J].Natural Product Communications,2013,8(1):121-124.
[4] MONIRUZZAMAN M,MIN T.Curcumin,curcumin nanoparticles and curcumin nanospheres:A review on their pharmacodynamics based on monogastric farm animal,poultry and fish nutrition[J].Pharmaceutics,2020,12(5):447.
[5] ARORA D,SANEJA A,JAGLAN S.Cyclodextrin-based delivery systems for dietary pharmaceuticals[J].Environmental Chemistry Letters,2019,17(3):1 263-1 270.
[6] NAYAK A P,MILLS T,NORTON I.Lipid based nanosystems for curcumin:Past,present and future[J].Current Pharmaceutical Design,2016,22(27):4 247-4 256.
[7] ZHU X W,CHEN J J,HU Y X,et al.Tuning complexation of carboxymethyl cellulose/cationic chitosan to stabilize Pickering emulsion for curcumin encapsulation[J].Food Hydrocolloids,2021,110:106135.
[8] SOBH R A,MOHAMED W S,MOUSTAFA A B,et al.Encapsulation of curcumin and curcumin derivative in polymeric nanospheres[J].Polymer-Plastics Technology and Engineering,2015,54(14):1 457-1 467.
[9] CORRADINI E,CURTI P S,MENIQUETI A B,et al.Recent advances in food-packing,pharmaceutical and biomedical applications of zein and zein-based materials[J].International Journal of Molecular Sciences,2014,15(12):22 438-22 470.
[10] DEMIR M,RAMOS-RIVERA L,SILVA R,et al.Zein-based composites in biomedical applications[J].Journal of Biomedical Materials Research Part A,2017,105(6):1 656-1 665.
[11] TURASAN H,KOKINI J L.Advances in understanding the molecular structures and functionalities of biodegradable zein-based materials using spectroscopic techniques:A review[J].Biomacromolecules,2017,18(2):331-354.
[12] MENG R,WU Z Z,XIE Q T,et al.Preparation and characterization of zein/carboxymethyl dextrin nanoparticles to encapsulate curcumin:Physicochemical stability,antioxidant activity and controlled release properties[J].Food Chemistry,2021,340:127893.
[13] CHEN S,HAN Y H,JIAN L,et al.Fabrication,characterization,physicochemical stability of zein-chitosan nanocomplex for co-encapsulating curcumin and resveratrol[J].Carbohydrate Polymers,2020,236:116090.
[14] KASAAI M R.Zein and zein-based nano-materials for food and nutrition applications:A review[J].Trends in Food Science & Technology,2018,79:184-197.
[15] LUO Y C,TENG Z,WANG Q.Development of zein nanoparticles coated with carboxymethyl chitosan for encapsulation and controlled release of vitamin D3[J].Journal of Agricultural and Food Chemistry,2012,60(3):836-843.
[16] WANG X Y,HUANG H M,CHU X Y,et al.Encapsulation and binding properties of curcumin in zein particles stabilized by Tween 20[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects,2019,577:274-280.
[17] YUAN Y K,LI H,ZHU J X,et al.Fabrication and characterization of zein nanoparticles by dextran sulfate coating as vehicles for delivery of curcumin[J].International Journal of Biological Macromolecules,2020,151:1 074-1 083.
[18] LIU Q G,JING Y Q,HAN C P,et al.Encapsulation of curcumin in zein/caseinate/sodium alginate nanoparticles with improved physicochemical and controlled release properties[J].Food Hydrocolloids,2019,93:432-442.
[19] PATIL Y P,JADHAV S.Novel methods for liposome preparation[J].Chemistry and Physics of Lipids,2014,177:8-18.
[20] ZENG Z P,ZHAO P F,LIU L X,et al.Lipid stabilized solid drug nanoparticles for targeted chemotherapy[J].ACS Applied Materials & Interfaces,2018,10(30):24 969-24 974.
[21] VAN DEUN J,ROUX Q,DEVILLE S,et al.Feasibility of mechanical extrusion to coat nanoparticles with extracellular vesicle membranes[J].Cells,2020,9(8):1797.
[22] TADA D B,SURANITI E,ROSSI L M,et al.Effect of lipid coating on the interaction between silica nanoparticles and membranes[J].Journal of Biomedical Nanotechnology,2014,10(3):519-528.
[23] TALU E,LOZANO M M,POWELL R L,et al.Long-term stability by lipid coating monodisperse microbubbles formed by a flow-focusing device[J].Langmuir,2006,22(23):9 487-9 490.
[24] KANG S X,HE Y Y,YU D G,et al.Drug-zein@lipid hybrid nanoparticles:Electrospraying preparation and drug extended release application[J].Colloids and Surfaces B:Biointerfaces,2021,201:111629.
[25] FENG S M,SUN Y X,WANG D,et al.Effect of adjusting pH and chondroitin sulfate on the formation of curcumin-zein nanoparticles:Synthesis,characterization and morphology[J].Carbohydrate Polymers,2020,250:116970.
[26] TONIAZZO T,PERES M S,RAMOS A P,et al.Encapsulation of quercetin in liposomes by ethanol injection and physicochemical characterization of dispersions and lyophilized vesicles[J].Food Bioscience,2017,19:17-25.
[27] KE X Y,TANG H Y,MAO H Q.Effective encapsulation of curcumin in nanoparticles enabled by hydrogen bonding using flash nanocomplexation[J].International Journal of Pharmaceutics,2019,564:273-280.
[28] CHEN H Q,ZHONG Q X.A novel method of preparing stable zein nanoparticle dispersions for encapsulation of peppermint oil[J].Food Hydrocolloids,2015,43:593-602.
[29] ZHANG Y Q,NIU Y G,LUO Y C,et al.Fabrication,characterization and antimicrobial activities of thymol-loaded zein nanoparticles stabilized by sodium caseinate-chitosan hydrochloride double layers[J].Food Chemistry,2014,142:269-275.
[30] PATEL A,HU Y C,TIWARI J K,et al.Synthesis and characterisation of zein-curcumin colloidal particles[J].Soft Matter,2010,6(24):6192.