银杏叶提取物具有抗氧化、抗疲劳、降血脂、降血压、增强免疫力、提高缺氧耐受力、抗肿瘤、改善老年人记忆力和心血管疾病等药理作用[1],而抗氧化能力是体现其功能活性的一类重要指标。银杏叶提取物可直接清除脂质自由基、脂质过氧化自由基和烷自由基等,终止自由基连锁反应,同时还参与调节和提高过氧化物歧化酶、谷胱甘肽过氧化物酶等的活性。研究表明,许多黄酮类物质的抗氧化活性超过维生素C,在体外可抗自由基攻击[2]。植物体内化学成分较多,且不同个体间差异较大。有研究表明,不同品种蓝莓的提取液功能成分、抗氧化能力差异显著[3]。此外,植物提取物同时包含多种功能成分,且各物质间具有一定的互作效应[4]。银杏叶中成分复杂,主要生物活性成分有类黄酮、萜内酯、多糖、原花青素等,其品质无法用单一成分量化和直接反映。银杏叶中的类黄酮、多糖、原花青素等均具有相当的抗氧化活性。DPPH自由基测定快速、简便,氧自由基吸收能力法(oxygen radical absorbance capacity,ORAC)具有很高的特异性和良好的结果重现性,是目前国内外评价天然产物抗氧化活性的2种主要方法,但这2种方法都不能全面、准确地反映天然产物的总抗氧化能力。目前,已有大量关于叶用银杏优良种质选育的报道[5-10],但基于高抗氧化的叶用银杏种质的筛选还未见报道。本研究选用4种方法测评23个银杏雄株叶提取液的抗氧化能力,同时测定提取液中功能性组分含量,分析两者的株间差异和相关性,筛选出高抗氧化能力的雄株,为高抗氧化银杏种质资源的筛选提供数据支撑。
供试银杏叶采自南京林业大学资源圃中移栽定植15年的23棵25年生银杏雄株,于2020年4月1日采集树冠外围向阳叶片,装于信封,烘箱内105 ℃杀青15 min,调至60 ℃烘至恒重,粉碎过80目筛后备用。
Synergy2酶标仪,美国伯腾仪器有限公司;JP-100ST超声波水浴锅,洁盟清洗设备有限公司;JK-WB-8A水浴锅,上海精学科学仪器有限公司;药品均为分析纯;水为超纯水。
1.3.1 甲醇提取液制备
称取叶干粉1.000 g,包于直径12.5 cm的滤纸中,用脱脂棉线捆绑成柱状滤纸包。先用100 mL石油醚于85 ℃水浴条件下在索氏提取器中对滤纸包除杂2.5 h,取出后于60 ℃烘箱中烘至恒重。再将除杂后的滤纸包用100 mL分析纯甲醇于80 ℃水浴条件下索氏提取4.5 h。减压浓缩后,残渣用分析甲醇定容至25 mL,即得供试样品提取液。每个样品重复3次。
1.3.2 抗氧化能力测定
DPPH自由基清除率的测定参考姜爱丽等[3]的方法,吸取0.2 mL提取液与4 mL DPPH-乙醇溶液(0.04 mg/mL)于10 mL比色管,充分混匀,室温避光静置30 min后,于517 nm下测定吸光值A样品。为扣除提取液底色的影响,以等量无水乙醇代替DPPH-乙醇溶液测定吸光值A对照,以等量无水乙醇代替提取液测定吸光值A空白,每个样品重复3次。DPPH自由基清除率按公式(1)计算:
DPPH自由基清除率![]()
(1)
·OH清除率的测定参考姚鑫[11]的方法,吸取1 mL FeSO4·7H2O(2.25 mmol/L)置于10 mL离心管,然后加入1 mL水杨酸溶液(2.25 mmol/L),再加入1 mL提取液,最后加入1 mL H2O2(2.2 mmol/L)启动反应,混匀,37 ℃水浴30 min,在536 nm处测定吸光值A样品。为扣除提取液底色的影响,以蒸馏水代替双氧水测定吸光值A对照;以蒸馏水代替样品提取液测定吸光值A空白,每个样品重复3次。·OH清除率按公式(2)计算:
·OH清除率![]()
(2)
![]() 清除率的测定参考张曦元[12]的方法,吸取pH 8.2的磷酸缓冲液4.5 mL置于10 mL比色管中,然后加入1 mL提取液,25 ℃水浴30 min,再加入0.4 mL邻苯三酚溶液(7 mmol/L)(25 ℃预温),充分混匀,置于25 ℃水浴锅反应4 min,最后滴入2滴10 mol/L盐酸终止反应。以磷酸缓冲液调零,于320 nm处测定吸光值A样品。为扣除底色影响,以蒸馏水代替样品提取液测定吸光值A对照,以蒸馏水代替样品溶液测定吸光值A空白,每个样品重复3次。
清除率的测定参考张曦元[12]的方法,吸取pH 8.2的磷酸缓冲液4.5 mL置于10 mL比色管中,然后加入1 mL提取液,25 ℃水浴30 min,再加入0.4 mL邻苯三酚溶液(7 mmol/L)(25 ℃预温),充分混匀,置于25 ℃水浴锅反应4 min,最后滴入2滴10 mol/L盐酸终止反应。以磷酸缓冲液调零,于320 nm处测定吸光值A样品。为扣除底色影响,以蒸馏水代替样品提取液测定吸光值A对照,以蒸馏水代替样品溶液测定吸光值A空白,每个样品重复3次。![]() 清除率按公式(3)计算:
清除率按公式(3)计算:
![]() 清除率
清除率![]()
(3)
总还原力的测定参考姚鑫[11]的方法,吸取0.3 mL提取液于10 mL试管中,然后加入3 mL FRAP工作液,充分混匀后,37 ℃水浴避光10 min,在593 nm处测定吸光值。以甲醇替代样品作为空白,每个样品重复3次。以FeSO4·7H2O为标准物,配成不同浓度的FeSO4·7H2O溶液,采用同样的方法制作标准曲线(y吸光值=1.094 2x+0.072 7,r=999 8),计算总还原力。样品测定的吸光值代入曲线方程,解得的x值即为样品总还原力,即以达到同样的抗氧化能力时,所需的FeSO4·7H2O物质的量。
1.3.3 功能成分含量测定
总黄酮含量的测定参考符群等[4]的方法,吸取提取液1.0 mL和5 mL 30%乙醇(体积分数,下同)置于10 mL离心管中,然后加入0.3 mL 50 g/L的NaNO2溶液,摇匀静置5 min,然后加入0.3 mL 100 g/L Al(NO3)3溶液,摇匀静置6 min,再加入2 mL 1 mol/L 的NaOH溶液并用30%乙醇定容至刻度,摇匀静置10 min,于510 nm处测吸光值。以30%乙醇溶液替代样品作为空白,每样品重复3次。以芦丁为标准物,用甲醇配成不同浓度的芦丁溶液,采用同样的方法制作标准曲线(y吸光值=1.330 1x芦丁+0.010 6,r=0.999 6),计算总黄酮含量。
萜内酯含量的测定参考张渝阳等[13]的方法,吸取提取液1.0 mL置于10 mL离心管,加入0.4 mL碱性羟胺溶液[V(139 g/L氯化羟胺)∶V(3.5 mol/L NaOH)=1∶2],混匀,5 min后加入0.4 mL 3 mol/L 盐酸,0.2 mL 60 g/L FeCl3·6H2O溶液,混匀,加入5 mL 70%乙醇,混匀,于517 nm处测吸光值,每个样品重复3次。以银杏内酯A对照品为标准物,用甲醇配成不同浓度的银杏内酯A溶液,采用同样的方法制作标准曲线(y吸光值=12.346x银杏内酯A+0.021,r=0.999 4),计算萜内酯含量。
多糖含量的测定参考姜爱丽等[3]的方法,吸取1 mL稀释20倍的提取液,置于10 mL离心管,加入1 mL 5% 苯酚溶液,摇匀,室温静置5 min,然后缓缓加入5 mL浓硫酸,摇匀,40 ℃水浴15 min,于490 nm处测定吸光值。每一样品重复3次。以D-葡萄糖(纯度≥99%)为标准物,配成0、0.05、0.1、0.15、0.2 mg/mL葡萄糖溶液,采用同样的方法制作标准曲线(y吸光值=4.082 5xD-葡萄糖+0.041 7,r=0.999),计算多糖含量。
原花青素含量的测定参考乔洪翔等[14]的方法,吸取提取液1.0 mL置于10 mL离心管,加入5 mL显色剂[将20 g/L香草醛溶液(无水乙醇溶解)和体积分数20%盐酸(无水乙醇定容)等体积混匀],30 ℃下水浴8 min,于496 nm处测吸光值,每个样品重复3次。以原花青素对照品为标准物,用80%乙醇配成不同浓度的原花青素溶液,采用同样的方法制作标准曲线(y吸光值=0.294 1x原花青素+0.040 5,r=0.999 1),计算原花青素含量。
采用Excel 2010进行数据整理,使用DPS7.04进行方差分析、Duncan多重比较、相关性分析和聚类分析。
方差分析和多重比较显示,银杏雄株叶提取液清除DPPH自由基![]() 的能力及总还原力在单株间均存在极显著差异(P<0.01),相应抗氧化指标的变异系数分别为19.99%、34.18%、37.04%和13.50%(表1),表现出较高的变异性。最高单株的相应抗氧化指标分别是最低单株的2.13、3.99、6.03、1.68倍。DPPH自由基清除率高于均值的单株有10个,由高到低依次为6#、2#、9#、4#、10#、12#、1#、11#、16#、13#;·OH清除率高于均值的单株有12个,由高到低依次为
的能力及总还原力在单株间均存在极显著差异(P<0.01),相应抗氧化指标的变异系数分别为19.99%、34.18%、37.04%和13.50%(表1),表现出较高的变异性。最高单株的相应抗氧化指标分别是最低单株的2.13、3.99、6.03、1.68倍。DPPH自由基清除率高于均值的单株有10个,由高到低依次为6#、2#、9#、4#、10#、12#、1#、11#、16#、13#;·OH清除率高于均值的单株有12个,由高到低依次为![]() 清除率高于均值的单株有11个,由高到低依次为6#、2#、9#、17#、12#、11#、16#、15#、22#、1#、3#;总还原力高于均值的单株有11个,由高到低依次为6#、10#、2#、16#、11#、4#、9#、15#、12#、1#、13#。
清除率高于均值的单株有11个,由高到低依次为6#、2#、9#、17#、12#、11#、16#、15#、22#、1#、3#;总还原力高于均值的单株有11个,由高到低依次为6#、10#、2#、16#、11#、4#、9#、15#、12#、1#、13#。
表1 银杏叶提取液抗氧化能力的株间差异分析
Table 1 Antioxidant capacity of Ginkgo biloba extract among plants
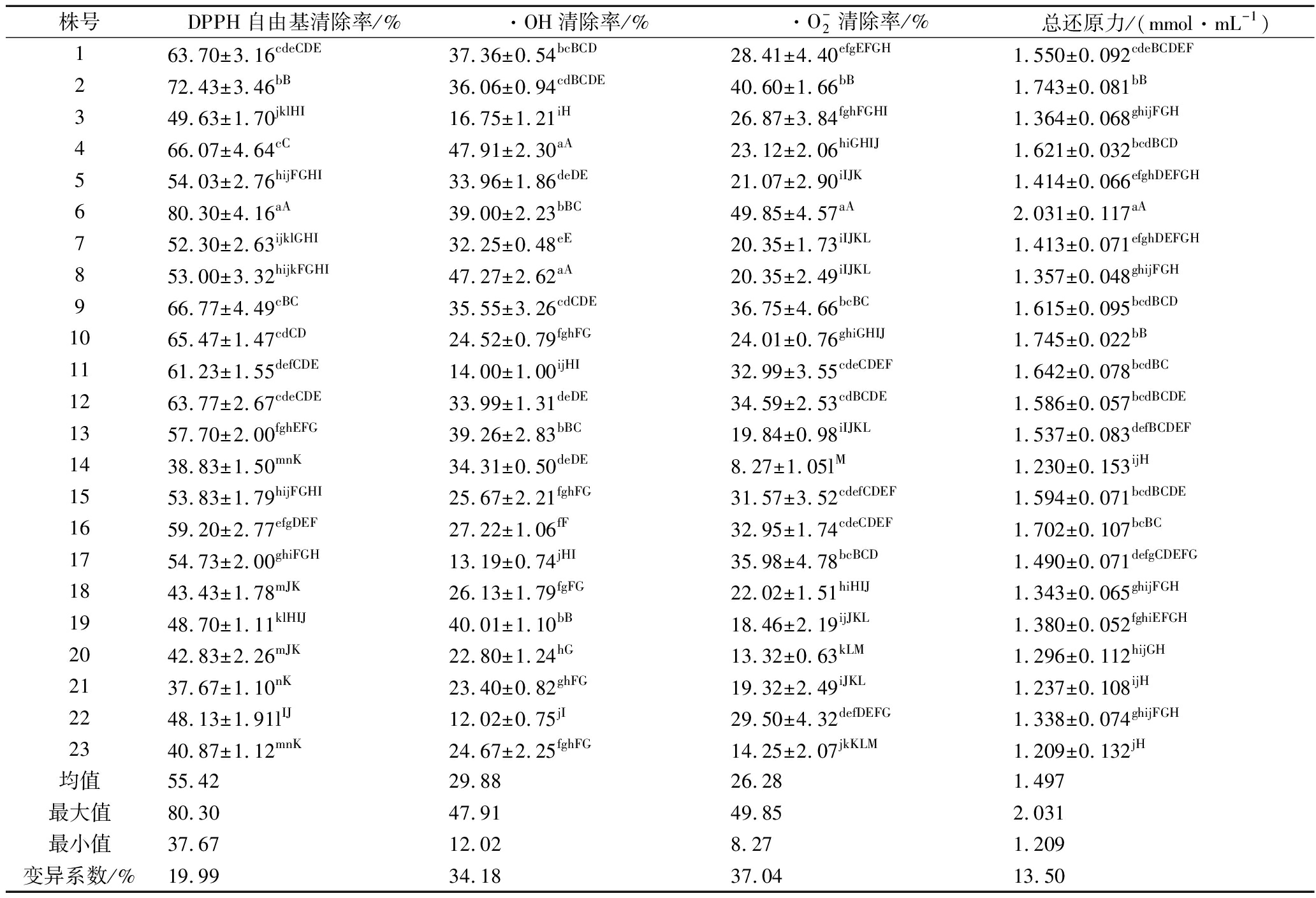
株号DPPH自由基清除率/%·OH清除率/%·O-2清除率/%总还原力/(mmol·mL-1)163.70±3.16cdeCDE37.36±0.54bcBCD28.41±4.40efgEFGH1.550±0.092cdeBCDEF272.43±3.46bB36.06±0.94cdBCDE40.60±1.66bB1.743±0.081bB349.63±1.70jklHI16.75±1.21iH26.87±3.84fghFGHI1.364±0.068ghijFGH466.07±4.64cC47.91±2.30aA23.12±2.06hiGHIJ1.621±0.032bcdBCD554.03±2.76hijFGHI33.96±1.86deDE21.07±2.90iIJK1.414±0.066efghDEFGH680.30±4.16aA39.00±2.23bBC49.85±4.57aA2.031±0.117aA752.30±2.63ijklGHI32.25±0.48eE20.35±1.73iIJKL1.413±0.071efghDEFGH853.00±3.32hijkFGHI47.27±2.62aA20.35±2.49iIJKL1.357±0.048ghijFGH966.77±4.49cBC35.55±3.26cdCDE36.75±4.66bcBC1.615±0.095bcdBCD1065.47±1.47cdCD24.52±0.79fghFG24.01±0.76ghiGHIJ1.745±0.022bB1161.23±1.55defCDE14.00±1.00ijHI32.99±3.55cdeCDEF1.642±0.078bcdBC1263.77±2.67cdeCDE33.99±1.31deDE34.59±2.53cdBCDE1.586±0.057bcdBCDE1357.70±2.00fghEFG39.26±2.83bBC19.84±0.98iIJKL1.537±0.083defBCDEF1438.83±1.50mnK34.31±0.50deDE8.27±1.05lM1.230±0.153ijH1553.83±1.79hijFGHI25.67±2.21fghFG31.57±3.52cdefCDEF1.594±0.071bcdBCDE1659.20±2.77efgDEF27.22±1.06fF32.95±1.74cdeCDEF1.702±0.107bcBC1754.73±2.00ghiFGH13.19±0.74jHI35.98±4.78bcBCD1.490±0.071defgCDEFG1843.43±1.78mJK26.13±1.79fgFG22.02±1.51hiHIJ1.343±0.065ghijFGH1948.70±1.11klHIJ40.01±1.10bB18.46±2.19ijJKL1.380±0.052fghiEFGH2042.83±2.26mJK22.80±1.24hG13.32±0.63kLM1.296±0.112hijGH2137.67±1.10nK23.40±0.82ghFG19.32±2.49iJKL1.237±0.108ijH2248.13±1.91lIJ12.02±0.75jI29.50±4.32defDEFG1.338±0.074ghijFGH2340.87±1.12mnK24.67±2.25fghFG14.25±2.07jkKLM1.209±0.132jH均值55.4229.8826.281.497最大值80.3047.9149.852.031最小值37.6712.028.271.209变异系数/%19.9934.1837.0413.50
注:同列不同小写字母表示差异显著(P<0.05);不同大写字母表示差异极显著(P<0.01)
由方差分析和多重比较可知,银杏雄株叶提取液的总黄酮、萜内酯、多糖、原花青素含量在单株间均存在极显著差异(P<0.01),对应功能性组分含量的变异系数分别为12.10%、9.30%、12.35%和15.63%,对应功能成分指标最高单株分别是最低单株的1.74、1.46、1.57、1.78倍(表2),表现出一定的变异性。总黄酮含量高于均值的单株有12个,由高到低依次为6#、16#、11#、2#、12#、9#、10#、21#、1#、3#、15#、5#;萜内酯含量高于均值的单株有11个,由高到低依次为21#、3#、22#、11#、23#、20#、9#、10#、2#、16#、17#;多糖含量高于均值的单株有9个,由高到低依次为20#、9#、22#、11#、13#、21#、23#、17#、1#;原花青素含量高于均值的单株有12个,由高到低依次为19#、17#、2#、18#、1#、23#、11#、9#、20#、22#、12#、21#。
表2 银杏叶提取液功能性组分含量的株间差异分析 单位:mg/g DW
Table 2 Functional components concentration in G.biloba extract
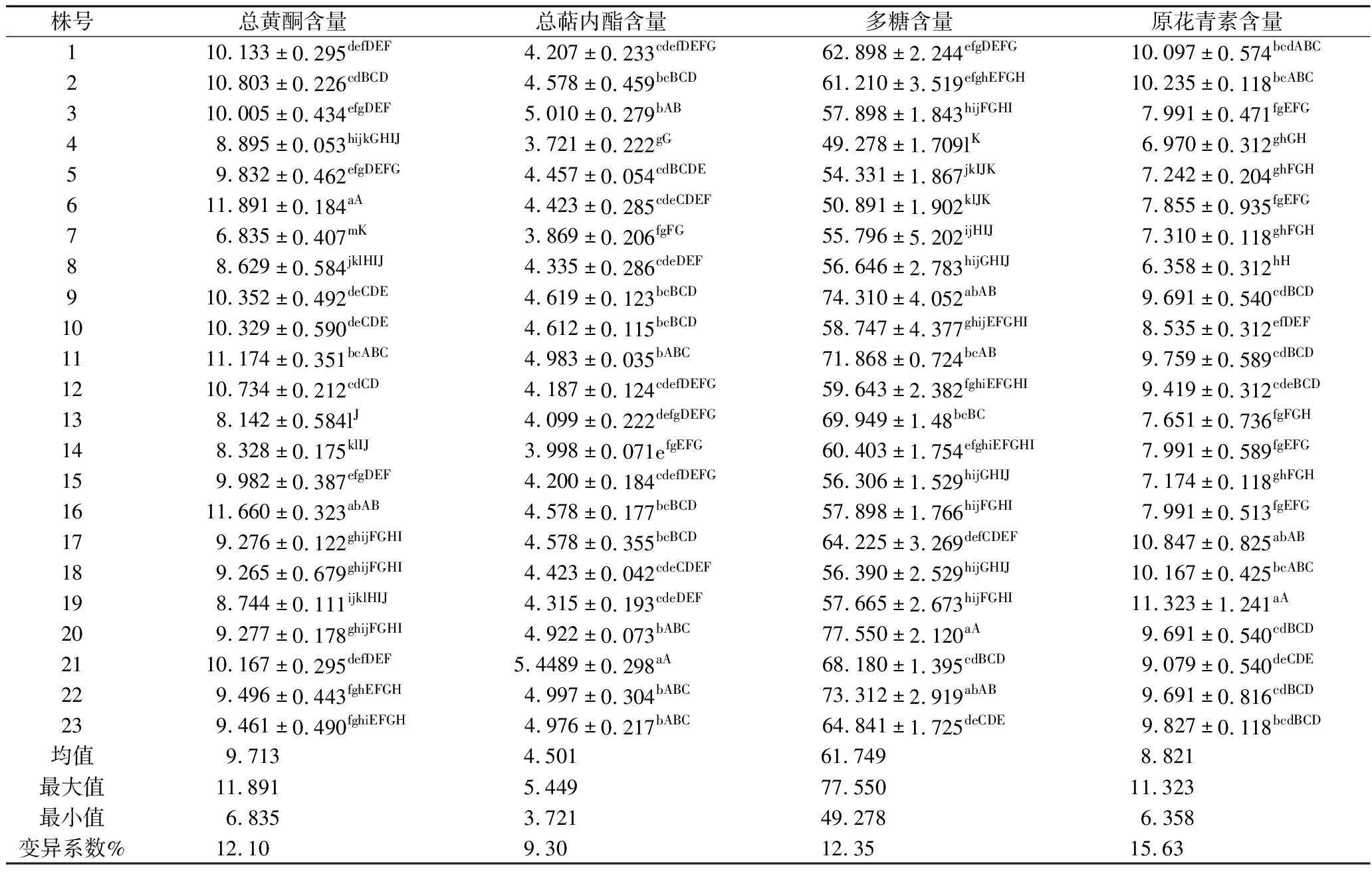
株号总黄酮含量总萜内酯含量多糖含量原花青素含量110.133±0.295defDEF4.207±0.233cdefDEFG62.898±2.244efgDEFG10.097±0.574bcdABC210.803±0.226cdBCD4.578±0.459bcBCD61.210±3.519efghEFGH10.235±0.118bcABC310.005±0.434efgDEF5.010±0.279bAB57.898±1.843hijFGHI7.991±0.471fgEFG48.895±0.053hijkGHIJ3.721±0.222gG49.278±1.709lK6.970±0.312ghGH59.832±0.462efgDEFG4.457±0.054cdBCDE54.331±1.867jkIJK7.242±0.204ghFGH611.891±0.184aA4.423±0.285cdeCDEF50.891±1.902klJK7.855±0.935fgEFG76.835±0.407mK3.869±0.206fgFG55.796±5.202ijHIJ7.310±0.118ghFGH88.629±0.584jklHIJ4.335±0.286cdeDEF56.646±2.783hijGHIJ6.358±0.312hH910.352±0.492deCDE4.619±0.123bcBCD74.310±4.052abAB9.691±0.540cdBCD1010.329±0.590deCDE4.612±0.115bcBCD58.747±4.377ghijEFGHI8.535±0.312efDEF1111.174±0.351bcABC4.983±0.035bABC71.868±0.724bcAB9.759±0.589cdBCD1210.734±0.212cdCD4.187±0.124cdefDEFG59.643±2.382fghiEFGHI9.419±0.312cdeBCD138.142±0.584lJ4.099±0.222defgDEFG69.949±1.48bcBC7.651±0.736fgFGH148.328±0.175klIJ3.998±0.071efgEFG60.403±1.754efghiEFGHI7.991±0.589fgEFG159.982±0.387efgDEF4.200±0.184cdefDEFG56.306±1.529hijGHIJ7.174±0.118ghFGH1611.660±0.323abAB4.578±0.177bcBCD57.898±1.766hijFGHI7.991±0.513fgEFG179.276±0.122ghijFGHI4.578±0.355bcBCD64.225±3.269defCDEF10.847±0.825abAB189.265±0.679ghijFGHI4.423±0.042cdeCDEF56.390±2.529hijGHIJ10.167±0.425bcABC198.744±0.111ijklHIJ4.315±0.193cdeDEF57.665±2.673hijFGHI11.323±1.241aA209.277±0.178ghijFGHI4.922±0.073bABC77.550±2.120aA9.691±0.540cdBCD2110.167±0.295defDEF5.4489±0.298aA68.180±1.395cdBCD9.079±0.540deCDE229.496±0.443fghEFGH4.997±0.304bABC73.312±2.919abAB9.691±0.816cdBCD239.461±0.490fghiEFGH4.976±0.217bABC64.841±1.725deCDE9.827±0.118bcdBCD均值9.7134.50161.7498.821最大值11.8915.44977.55011.323 最小值6.8353.72149.2786.358变异系数%12.109.3012.3515.63
如表3所示,银杏叶提取液中总黄酮含量与DPPH自由基清除率![]() 清除率、总还原力均呈极显著中强度正相关(P<0.01);萜内酯含量与·OH清除率呈极显著中强度负相关(P<0.01),与DPPH自由基清除率、总还原力呈弱度负相关;多糖含量与4个抗氧化指标呈中弱度负相关,其中与·OH清除率的相关性达到显著性水平(P<0.05);原花青素含量与
清除率、总还原力均呈极显著中强度正相关(P<0.01);萜内酯含量与·OH清除率呈极显著中强度负相关(P<0.01),与DPPH自由基清除率、总还原力呈弱度负相关;多糖含量与4个抗氧化指标呈中弱度负相关,其中与·OH清除率的相关性达到显著性水平(P<0.05);原花青素含量与![]() 清除率呈弱度正相关,而与DPPH自由基清除率、·OH清除率、总还原力呈中度或弱度的负相关。上述分析说明,总黄酮是银杏叶甲醇提取液抗氧化作用的主要物质基础。
清除率呈弱度正相关,而与DPPH自由基清除率、·OH清除率、总还原力呈中度或弱度的负相关。上述分析说明,总黄酮是银杏叶甲醇提取液抗氧化作用的主要物质基础。
表3 功能性组分含量与抗氧化能力的相关性分析
Table 3 Correlation analysis between functional components content and antioxidant capacity
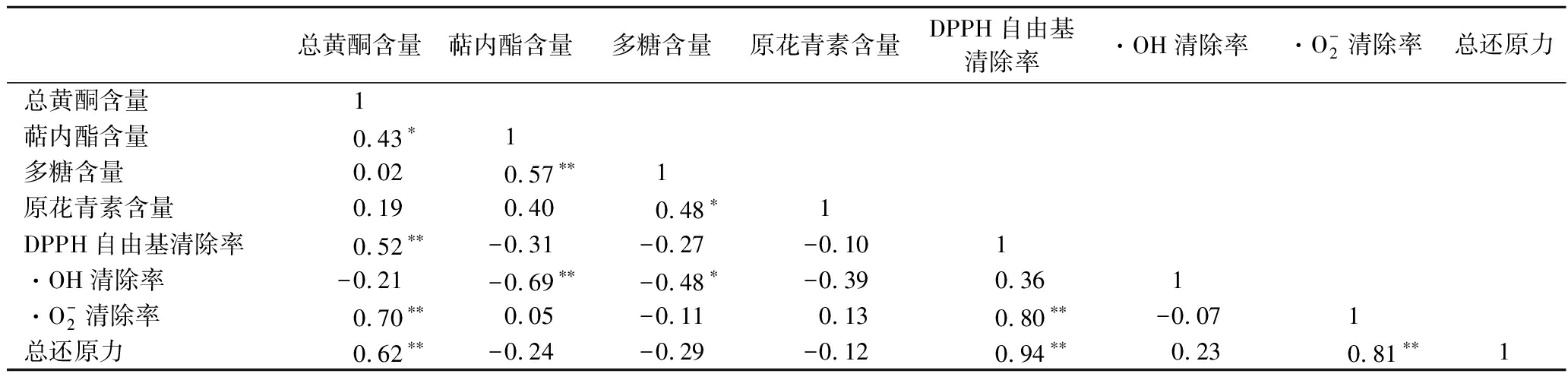
总黄酮含量萜内酯含量多糖含量原花青素含量DPPH自由基清除率·OH清除率·O-2清除率总还原力总黄酮含量1萜内酯含量0.43∗1多糖含量0.020.57∗∗1原花青素含量0.190.400.48∗1DPPH自由基清除率0.52∗∗-0.31-0.27-0.101·OH清除率-0.21-0.69∗∗-0.48∗-0.390.361·O-2清除率0.70∗∗0.05-0.110.130.80∗∗-0.071总还原力0.62∗∗-0.24-0.29-0.120.94∗∗0.230.81∗∗1
注:** 表示相关性极显著(P<0.01),* 表示相关性显著(P<0.05)
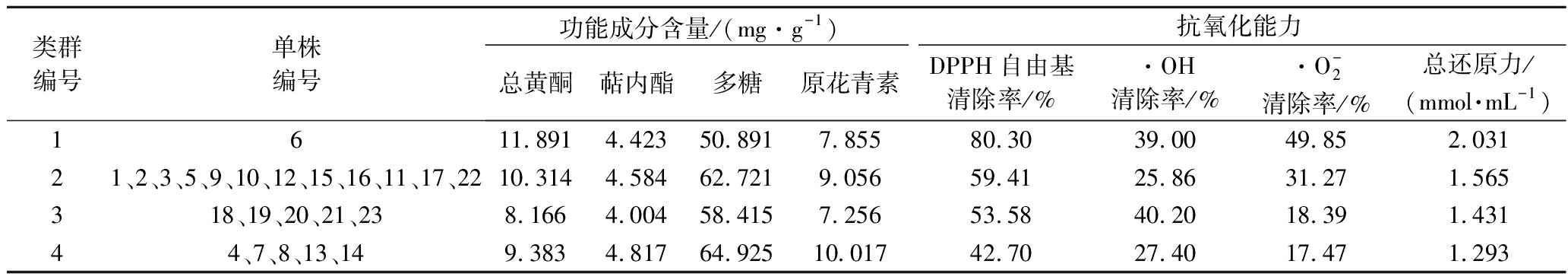
基于标准化的提取液抗氧化能力与功能性组分含量,采用欧氏距离和类平均法(UPGMA)聚类,根据距离系数的大小,结合图1的聚类特征,将23个银杏雄性单株划分为4个类群。其中第1类,仅有6#单株表现为总黄酮含量最高,萜内酯、原花青素含量较低,多糖含量最低,DPPH自由基清除率![]() 清除率及总还原力最高,·OH清除率较高;第2类包含12个单株(1#、2#、3#、5#、9#、10#、11#、12#、15#、16#、17#、22#),表现为总黄酮、萜内酯、多糖、原花青素含量较高,DPPH自由基清除率
清除率及总还原力最高,·OH清除率较高;第2类包含12个单株(1#、2#、3#、5#、9#、10#、11#、12#、15#、16#、17#、22#),表现为总黄酮、萜内酯、多糖、原花青素含量较高,DPPH自由基清除率![]() 清除率、总还原力较高,而·OH清除率最低;第3类包含5个单株(18#、19#、20#、21#、23#),表现为总黄酮、萜内酯、原花青素含量最低,多糖含量较低,DPPH自由基清除率
清除率、总还原力较高,而·OH清除率最低;第3类包含5个单株(18#、19#、20#、21#、23#),表现为总黄酮、萜内酯、原花青素含量最低,多糖含量较低,DPPH自由基清除率![]() 清除率、总还原力较低、·OH清除率最高;第4类包含5个单株(4#、7#、8#、13#、14#),表现为总黄酮含量较低,萜内酯、多糖和原花青素含量最高,DPPH自由基清除率
清除率、总还原力较低、·OH清除率最高;第4类包含5个单株(4#、7#、8#、13#、14#),表现为总黄酮含量较低,萜内酯、多糖和原花青素含量最高,DPPH自由基清除率![]() 清除率、总还原力最低,但·OH清除率较低(表4)。
清除率、总还原力最低,但·OH清除率较低(表4)。
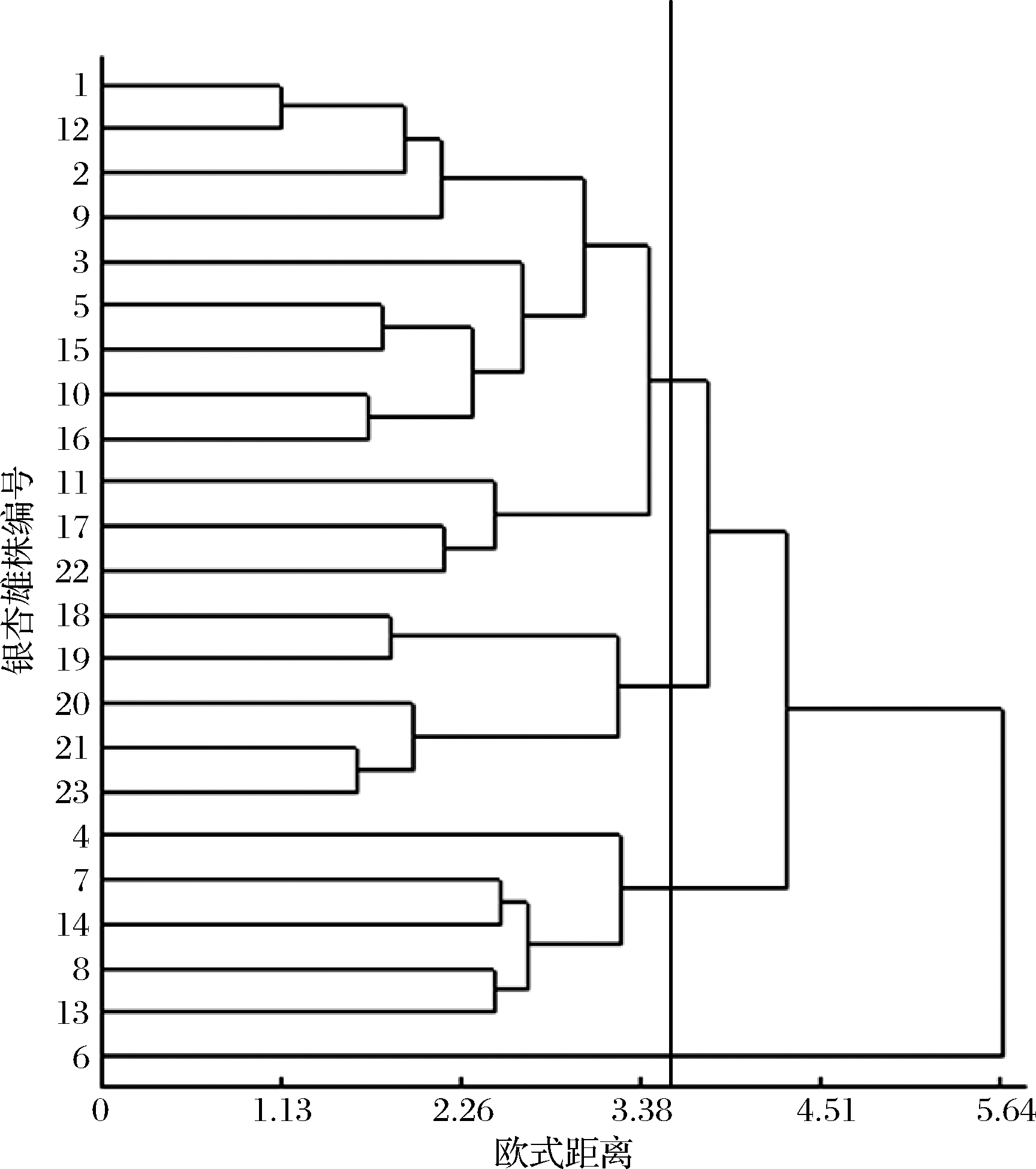
图1 基于提取液抗氧化能力与功能性组分含量的聚类分析
Fig.1 Cluster analysis based on antioxidant capacity and functional component content of extracts
表4 各类群的抗氧化能力与功能性组分含量
Table 4 Antioxidant capacity and functional component content of different groups
类群编号单株编号功能成分含量/(mg·g-1)抗氧化能力总黄酮萜内酯多糖原花青素DPPH自由基清除率/%·OH清除率/%·O-2清除率/%总还原力/(mmol·mL-1)1611.8914.42350.8917.85580.3039.0049.852.03121、2、3、5、9、10、12、15、16、11、17、2210.3144.58462.7219.05659.4125.8631.271.565318、19、20、21、238.1664.00458.4157.25653.5840.2018.391.43144、7、8、13、149.3834.81764.92510.01742.7027.4017.471.293
不同银杏雄株叶中抗氧化功能成分含量和抗氧化活性差异显著,具有丰富的遗传多样性,不同单株银杏叶甲醇提取液的抗氧化能力与功能性组分含量的差异分析表明,提取液的抗氧化能力(DPPH自由基![]() 清除率及总还原力)及功能性组分(总黄酮、萜内酯、多糖、原花青素)含量在单株间均呈极显著差异(P<0.01),表现出较高的变异性,这种差异性除了受遗传基因的控制外[5-10],还与栽培措施和生境等因素有关[15-21]。本研究的供试单株为地理环境和培育条件相同的同一资源圃里银杏雄株,所以基因型是造成供试银杏叶提取液抗氧化能力和功能组分含量差异的主要因素。这些广泛的基因型差异为后续高抗氧化种质筛选和育种奠定了基础。
清除率及总还原力)及功能性组分(总黄酮、萜内酯、多糖、原花青素)含量在单株间均呈极显著差异(P<0.01),表现出较高的变异性,这种差异性除了受遗传基因的控制外[5-10],还与栽培措施和生境等因素有关[15-21]。本研究的供试单株为地理环境和培育条件相同的同一资源圃里银杏雄株,所以基因型是造成供试银杏叶提取液抗氧化能力和功能组分含量差异的主要因素。这些广泛的基因型差异为后续高抗氧化种质筛选和育种奠定了基础。
总黄酮含量与抗氧化能力显著正相关,总黄酮是银杏叶甲醇提取液抗氧化作用的重要物质基础,银杏叶提取物具有较强的抗氧化活性[22-25]。本研究中甲醇能有效提取银杏叶中的总黄酮和萜内酯,其中总黄酮含量与抗氧化能力(DPPH自由基清除率![]() 清除率、总还原力)呈显著正相关,而萜内酯含量与抗氧化能力相关性不强,甚至呈负相关,这与前人得出的黄酮类是银杏叶抗氧化的主要活性成分,内酯类没有明显的抗氧化作用的结论相一致[24-26]。前人研究表明,银杏叶多糖和原花青素同样具有较强的抗氧化活性[27-28]。甲醇提取液中的多糖和原花青素仅为副产物,即甲醇对银杏叶多糖和原花青素未能有效地提取,造成甲醇提取液中两者的含量较低,加上两者的抗氧化能力存在剂量效应,导致多糖、原花青素含量与抗氧化能力相关性不强,甚至表现出一定的负效应[29-30]。韩京艳等[30]的研究表明银杏总黄酮和萜内酯清除自由基能力存在着明显的协同作用,其中两者的配比组表现出较强的抗氧化作用,总提取物在同等条件下未表现出明显的活性。基于此结论,本研究的甲醇提取液同时含有总黄酮、萜内酯、多糖和原花青素等功能性组分除了存在的剂量效应外,还可能存在着一定的拮抗作用,导致萜内酯、多糖和原花青素的抗氧化能力不强,甚至表现出一定的负效应[29-30]。综上可知,总黄酮是银杏叶甲醇提取液抗氧化作用的重要物质基础。这一研究结果为高抗氧化银杏种质的选育提供了有益信息,即在选育高抗氧化银杏叶用种质时,应优先考虑总黄酮含量。
清除率、总还原力)呈显著正相关,而萜内酯含量与抗氧化能力相关性不强,甚至呈负相关,这与前人得出的黄酮类是银杏叶抗氧化的主要活性成分,内酯类没有明显的抗氧化作用的结论相一致[24-26]。前人研究表明,银杏叶多糖和原花青素同样具有较强的抗氧化活性[27-28]。甲醇提取液中的多糖和原花青素仅为副产物,即甲醇对银杏叶多糖和原花青素未能有效地提取,造成甲醇提取液中两者的含量较低,加上两者的抗氧化能力存在剂量效应,导致多糖、原花青素含量与抗氧化能力相关性不强,甚至表现出一定的负效应[29-30]。韩京艳等[30]的研究表明银杏总黄酮和萜内酯清除自由基能力存在着明显的协同作用,其中两者的配比组表现出较强的抗氧化作用,总提取物在同等条件下未表现出明显的活性。基于此结论,本研究的甲醇提取液同时含有总黄酮、萜内酯、多糖和原花青素等功能性组分除了存在的剂量效应外,还可能存在着一定的拮抗作用,导致萜内酯、多糖和原花青素的抗氧化能力不强,甚至表现出一定的负效应[29-30]。综上可知,总黄酮是银杏叶甲醇提取液抗氧化作用的重要物质基础。这一研究结果为高抗氧化银杏种质的选育提供了有益信息,即在选育高抗氧化银杏叶用种质时,应优先考虑总黄酮含量。
聚类分析筛选出了高抗氧银杏雄株,为高含量高活性育种奠定了基础。基于银杏叶提取液的抗氧化活性及功能组分含量,通过聚类分析将23个银杏雄株划分成4个类群,各类群的功能组分(总黄酮、萜内酯、多糖、原花青素)含量和抗氧化能力(DPPH自由基![]() 清除率及还原力)各有特点,其中第1类群(6#)总体表现最好,具体表现为总黄酮含量最高,萜内酯、多糖、原花青素含量较低,DPPH自由基
清除率及还原力)各有特点,其中第1类群(6#)总体表现最好,具体表现为总黄酮含量最高,萜内酯、多糖、原花青素含量较低,DPPH自由基![]() 清除率及总还原力最高,·OH清除率较高,具有作为茶用或抗氧化产品原料推广的潜力。本研究仅有6#入选高抗氧化单株,下一步需要增加选育材料数量及雌性种质材料来筛选高抗氧化种质。值的注意的是,第3类群(18#、19#、20#、21#、23#)的总黄酮、萜内酯、原花青素含量最低,多糖含量较低,DPPH自由基清除率
清除率及总还原力最高,·OH清除率较高,具有作为茶用或抗氧化产品原料推广的潜力。本研究仅有6#入选高抗氧化单株,下一步需要增加选育材料数量及雌性种质材料来筛选高抗氧化种质。值的注意的是,第3类群(18#、19#、20#、21#、23#)的总黄酮、萜内酯、原花青素含量最低,多糖含量较低,DPPH自由基清除率![]() 清除率、总还原力较低、·OH清除率却是最高,推测甲醇提取液中可能存在其他能有效清除·OH的功能成分,有待进一步研究[2,29-30]。
清除率、总还原力较低、·OH清除率却是最高,推测甲醇提取液中可能存在其他能有效清除·OH的功能成分,有待进一步研究[2,29-30]。
[1] 徐艳芬,张丽娟,宋新波.银杏叶提取物的研究进展[J].药物评价研究,2010,33(6):452-456.
XU Y F,ZHANG L J,SONG X B.Advances in research on extract of Ginkgo biloba leaves[J].Drug Evaluation Research,2010,33(6):452-456.
[2] 李艳萍,张立虎,吴红雁,等.银杏叶功效群组分及其功效的研究进展[J].食品研究与开发,2020,41(15):182-187.
LI Y P,ZHANG L H,WU H Y,et al.Progress in the study of functional groups and health care efficacy of Ginkgo biloba leaves[J].Food Research and Development,2020,41(15):182-187.
[3] 姜爱丽,孟宪军,胡文忠,等.不同北高丛蓝莓品种的抗氧化成分及其抗氧化活性[J].食品与发酵工业,2011,37(9):161-165.
JIANG A L,MENG X J,HU Z W,et al.Study on the biological active substances and antioxidant capacity in various cultivars of northern highbush blueberry fruits[J].Food and Fermentation Industries,2020,41(15):182-187.
[4] 符群,王梦丽,李娜,等.暖木条荚蒾果抗氧化成分的制备及主要活性成分分析[J].中南林业科技大学学报,2019,39(12):114-122.
FU Q,WANG M L,LI N,et al.Extraction of antioxidant components from the fruits of Viburnum and analysis of its main active ingredient[J].Journal of Central South University of Forestry & Technology,2019,39(12):114-122.
[5] 何佳林,李潇雨,李秀红,等.不同银杏无性系叶片萜内酯含量的差异性研究[J].浙江林业科技,2020,40(2):30-35.
HE J L,LI X Y,LI X H,et al.Experiment on difference of terpene lactones content in leaves of 20 Ginkgo biloba clones[J].Journal of Zhejiang Forestry Science and Technology,2020,40(2):30-35.
[6] 韩晋,郁万文,曹福亮,等.基于叶和花粉中类黄酮含量的银杏雄性优株初选[J].经济林研究,2019,37(4):88-95.
HAN J,YU W W,CAO F L,et al.Preliminary selection of superior male Ginkgo biloba plants based on flavonoid content in leaves and pollen[J].Non-Wood Forest Research,2019,37(4):88-95.
[7] 吴岐奎,邢世岩,王萱,等.叶用银杏种质资源黄酮和萜内酯类含量及AFLP遗传多样性分析[J].园艺学报,2014,41(12):2 373-2 382.
WU Q K,XING S Y,WANG X,et al.Genetic diversity of leaf-used Ginkgo biloba germplasms based on flavonoids and ginkgolides contents and AFLP markers[J].Acta Horticultural Sinica,2014,41(12):2 373-2 382.
[8] 郁万文,刘新亮,曹福亮,等.不同银杏无性系叶药用成分差异及聚类分析[J].植物学报,2014,49(3):292-305.
YU W W,LIU X L,CAO F L,et al.Cluster analysis on the main medicinal components in differential leaves of ginkgo clones[J].Chinese Bulletin of Botany,2014,49(3):292-305.
[9] 李卫星,甄珍,周春华,等.银杏雄株叶片和花粉主要类黄酮成分含量分析[J].中国农业科学,2010,43(13):2 775-2 783.
LI W X,ZHEN Z,ZHOU C H,et al.Flavonoid content of the leaves and pollen of male Ginkgo biloba plants[J].Scientia Agricultura Sinica,2010,43(13):2 775-2 783.
[10] 邢世岩,吴德军,邢黎峰,等.银杏叶药物成分的数量遗传分析及多性状选择[J].遗传学报,2002,29(10):928-935.
XING S Y,WU D J,XING L F,et al.Quantitative genetic analysis and multiple trait selection of pharmaceutical composition on Ginkgo biloba L.leaves[J].Acta Genetica Sinica,2002,29(10):928-935.
[11] 姚鑫.不同来源银杏叶资源化学研究[D].南京:南京中医药大学,2013.
YAO X.Study on the resource chemistry of Ginkgo biloba leaves from different origin in China[D].Nanjing:Nanjing University of Chinese Medicine,2013.
[12] 张曦元.银杏黄酮的制备及其抗氧化性研究[D].大连:大连工业大学,2016.
ZHANG X Y.Preparation of Ginkgo flavonoids and study on its antioxidant activities[D].Dalian:Dalian Polytechnic University,2016.
[13] 张渝阳,王鑫,赵丽娟,等.分光光度法测定银杏萜内酯的含量[J].辽宁化工,2006,35(10):618-620.
ZHANG Y Y,WANG X,ZHAO L J,et al.Spectrophotometric determination of total terpenoids in ginkgo leaves[J].Liaoning Chemical Industry,2006,35(10):618-620.
[14] 乔洪翔,任红,陈君,等.银杏叶制剂中原花青素含量测定方法比较[J].海峡药学,2017,29(8):61-63.
QIAO H X,REN H,CHEN J.et al.Comparison of determination methods of proanthocyanidins in Ginkgo biloba preparations[J].Strait Pharmaceutical Journal,2017,29(8):61-63.
[15] 吴雅琼,国靖,周琦,等.不同产地银杏黄酮及相关活性物质含量变异分析[J].南京林业大学学报(自然科学版),2019,43(3):183-188.
WU Y Q,GUO J,ZHOU Q,et al.Variation analysis of flavonoids and related active substances content in ginkgo leaves from different regions[J].Journal of Nanjing Forestry University(Natural Sciences Edition),2019,43(3):183-188.
[16] 于国栋,夏米蕊,杨新成,等.银杏古树不同产地和家系子代生长及叶片药用成分含量的差异[J].北方园艺,2018,(11):144-150.
YU G D,XIA M R,YANG X C,et al.Growth and medicinal component contents of leaves for different families’ progenies originated in different seed sources of ancient Ginkgo biloba[J].Northern Horticulture,2018,(11):144-150.
[17] 辜夕容,江亚男,倪亚兰,等.叶用银杏的良种选育与定向培育研究进展[J].中草药,2017,48(15):3 218-3 227.
GU X R,JIANG Y N,NI Y L,et al.Research progress on breeding and cultivation of Ginkgo biloba for leaf use in China[J].Chinese Traditional and Herbal Drugs,2017,48(15):3 218-3 227.
[18] 刘芳瑞,胡晶红,李佳,等.银杏植株活性物质合成与积累的影响因素分析[J].山东中医药大学学报,2011,35(3):199-202.
LIU F R,HU J H,LI J,et al.Discussion on synthesis and accumulation factors of active substance of Ginkgo biloba[J].Journal of Shandong University of Traditional Chinese Medicine,2011,35(3):199-202.
[19] 李诚勇.修剪对叶用银杏黄酮和内酯类物质含量的影响[J].山东林业科技,2009,39(5):71-72.
LI C Y.Effects of pruning on the contents of flavonoids and lactones in Ginkgo biloba[J].Shandong Forestry Science and Technology,2009,39(5):71-72.
[20] 陈华圣,任莉,许爱华,等.不同龄期性别银杏叶多糖含量的比较研究[J].中药材,2006,29(11):1 139-1 141.
CHEN H S,REN L,XU A H,et al.Study on the comparison of polysaccharides in Ginkgo biloba leaves[J].Journal of Chinese Medicinal Materials,2006,29(11):1 139-1 141.
[21] 王晓红,孙延龙,李万忠,等.产地和生长年限对银杏叶中多糖和黄酮含量的影响[J].中药材,2016,39(6):1 341-1 342.
WANG X H,SUN Y L,LI W Z,et al.Effects of origin and growth years on the contents of polysaccharides and flavonoids in Ginkgo biloba leaves[J].Journal of Chinese Medicinal Materials,2016,39(6):1 341-1 342.
[22] 李无双,周燕.银杏叶提取物抗氧化作用的研究进展[J].世界最新医学信息文摘,2017,17(26):37-38.
LI W S,ZHOU Y.The research progress of Ginkgo biloba extract antioxidant effect[J].World Latest Medicine Information,2017,17(26):37-38.
[23] 张媛华,权美平.银杏叶提取物抗氧化功效的研究进展[J].黑龙江畜牧兽医,2016(11):69-71.
ZHANG Y H,QUAN M P.Research progress on antioxidant effect of Ginkgo biloba extract[J].Heilongjiang Animal Science and Veterinary Medicine,2016(11):69-71.
[24] 宋唯唯,刘芬芬,刘彩红.银杏叶提取物与其黄酮类物质抗氧化作用的比较[J].泰山医学院学报,2016,37(5):484-486.
SONG W W,LIU F F,LIU C H.Comparison of the antioxidant activity between Gingko biloba extract and its total flavonoids[J].Journal of Taishan Medical College,2016,37(5):484-486.
[25] LIU X P,LUAN J J,CHRISTOPHER E P G.Comparison of the antioxidant activity amongst Gingko biloba extract and its main components[J].Journal of Chinese Medicinal Material,2009,32(5):736-740.
[26] 牟玲丽,寇俊萍,朱丹妮,等.银杏叶的化学成分及其抗氧化活性[J].中国天然药物,2008,6(1):26-29.
MU L L,KOU J P,ZHU D N,et al.Antioxidant activities of the chemical constituents isolated from the leaves of Ginkgo biloba[J].Chinese Journal of Natural Medicines,2008,6(1):26-29.
[27] 黄海波,刘华春,金朱明,等.银杏叶原花青素的制备及其抗氧化活性研究[J].中国现代应用药学,2016,33(6):686-690.
HUANG H B,LIU H C,JIN Z M,et al.Proanthocyanidins from Ginkgo biloba L.and their anti-oxidant activities[J].Chinese Journal of Modern Applied Pharmacy,2016,33(6):686-690.
[28] 何钢,刘嵬,李会萍,等.银杏叶多糖分离纯化、结构鉴定及抗氧化活性研究[J].食品工业科技,2015,36(22):81-86.
HE G,LIU W,LI H P,et al.Isolation and purification,structure identification and antioxidant activity of polysaccharides of Ginkgo biloba leaf[J].Science and Technology of Food Industry,2015,36(22):81-86.
[29] 任佳伟,宋玉.银杏叶有效成分抗血小板聚集和清除DPPH自由基的量效关系和协同作用[J].世界科学技术-中医药现代化,2015,17(11):2 367-2 372.
REN J W,SONG Y.Dose-response relation and synergy effects of bioactive components in Ginkgo biloba on antiplatelet aggregation and DPPH free radical scavenging[J].Modernization of Traditional Chinese Medicine and Materia Medica-World Science and Technology,2015,17(11):2 367-2 372.
[30] 韩京艳,邢东明,孙虹,等.银杏叶黄酮内酯及天然配比抗氧化作用的比较[J].中国药理学通报,2002,18(1):115-117.
HAN J Y,XING D M,SUN H,et al.Comparison of flavonoids,terpenoids and the natural complex of them by Ginkgo biloba on antioxidant effect[J].Chinese Pharmacological Bulletin,2002,18(1):115-117.