天麻(Gastrodia elata Bl.)为兰科(Orchidaceae)天麻属多年生草本植物的干燥块茎,已于2019年纳入药食同源管理试点,具有极高的药用和食用价值[1]。中医认为天麻能够息风止痉、平抑肝阳、祛风通络。现代药理学研究发现天麻具有抗氧化、抗炎、镇痛、抗癫痫、改善心脑血管疾病、抗糖尿病和平喘等功效[2-3],这与其富含酚类、黄酮类、多糖类、甾醇类、有机酸、萜类、微量元素、挥发油等功效成分密切相关[4-5],其中天麻酚类及其苷类成分如天麻素、对羟基苯甲醇和巴利森苷类化合物等均是其主要药理活性来源[6]。
乌天麻是天麻中的优良品种[7-8],主要分布在云南、四川、贵州和重庆等地,近年来由于其重要的食用和药用价值已经引起国内外学者广泛关注。目前研究主要集中在不同产地天麻的化学成分[9-10]和功效[11]等方面,尤其是对天麻素的研究[12-13],也有关于其加工和贮藏的研究[14-15],但关于乌天麻的研究还很欠缺,制约了其产业发展。不同溶剂对植物提取物中活性物质的含量和抗氧化活性有很大影响,目前天麻的常用提取溶剂有甲醇、稀乙醇和水等,但有关不同溶剂提取乌天麻的研究还鲜见报道。试验以云阳乌天麻为原料,采用5种不同溶剂分别提取乌天麻,通过比较总多酚与总黄酮含量,并采用HPLC定性定量分析其主要的化学成分,评估不同溶剂提取物的抗氧化能力及与活性成分含量的相关性,以期为乌天麻的高效提取和利用及功能食品开发提供科学依据。
1 材料与方法
1.1 材料与试剂
干乌天麻(重庆云阳),重庆渝峰乌天麻集团有限公司。芦丁、抗坏血酸(均为分析纯),中国食品药品检定研究院;DPPH、NaNO2、NaOH、Na2CO3、没食子酸,山东西亚化学股份有限公司;ABTS(分析纯),美国Sigma公司;Al(NO3)3(分析纯),成都市科龙化工试剂厂;甲醇(分析纯),重庆川东化工有限公司;甲酸(色谱纯),麦克林;乙腈(色谱级),美国Fisher公司。腺苷(批号:58-61-7)、天麻素(批号:62499-27-8)、对羟基苯甲醇(批号:623-05-2)、巴利森苷E(批号:952068-57-4)、对羟基苯甲醛(批号:123-08-0)、巴利森苷B(批号:174972-79-3)、巴利森苷C(批号:174972-80-6)、巴利森苷A(批号:62499-28-9),上海源叶生物科技有限公司。
1.2 仪器与设备
752型紫外可见光分光光度计,上海舜宇恒平科技仪器有限公司;KQ3200E型超声波清洗器,昆山市超声仪器有限公司;YF-118B型高速药物粉碎机,浙江省瑞安市环球药械厂;AUW220D型分析天平、Shimadzu 20A高效液相色谱仪,日本岛津公司;TD-6M型低速离心机,四川蜀科仪器有限公司;T18Digital型高速分散机、RV10AUTO控制性旋转蒸发仪,IKA公司。
1.3 实验方法
1.3.1 乌天麻提取物制备
将干品乌天麻粉碎,准确称取乌天麻粉末2.0 g,置于100 mL离心管中,按照1∶25(g∶mL)料液比分别加入体积分数为70%丙酮、70%乙醇、70%乙腈、70%甲醇和水的溶剂,12 000 r/min均质2次,每次2 min,超声波(550 W,40 kHz)提取60 min,25 ℃冷却,补足减少的质量,4 000 r/min离心20 min,取上清液,抽滤,将滤液旋转蒸发浓缩至近干,残留物用10%乙腈溶解,定容至10 mL,即得提取物溶液,-18 ℃冷冻保存备用。
1.3.2 总多酚和总黄酮含量测定
参考LI等[16]的方法进行,取200 μL样液加入试管中,再依次加入800 μL去离子水、200 μL福林酚试剂,振摇混匀,避光保存6 min,再加入2 mL质量分数7% Na2CO3溶液和1.6 mL去离子水,避光条件下放置90 min后于波长760 nm处测定吸光度值。配制质量浓度为0、10、20、40、60、80、100、150、200 μg/mL的没食子酸标准溶液,以没食子酸质量浓度为横坐标(x),吸光度为纵坐标(y),绘制标准曲线,得回归方程为:y=0.004x+0.019(R2=0.997 0)。结果以每克乌天麻干品中所含没食子酸当量(mg GAE/g)表示。
参考熊双丽等[17]的方法进行,取5 mL样液加入试管中,加入0.3 mL质量分数5%亚硝酸钠,摇匀,静置6 min,再加入0.3 mL质量分数5%硝酸铝,摇匀,静置6 min,再加入4 mL质量分数4% NaOH溶液、0.4 mL质量分数30%乙醇水溶液,混匀,放置12 min后于波长510 nm处测定吸光度值。配制质量浓度为0、10、20、30、40、50、60、70 μg/mL的芦丁标液,以芦丁质量浓度为横坐标(x),吸光度值为纵坐标(y),绘制标准曲线,得回归方程为:y=0.005x+0.012(R2=0.999 0)。结果以每克乌天麻干品中所含芦丁当量(mg RE/g)表示。
1.3.3 乌天麻不同溶剂提取物组成成分分析
参考田孟华等[18]的方法,将乌天麻不同溶剂提取物和酚类标准品的乙腈溶液过0.45 μm微孔滤膜,用于HPLC分析。色谱条件:采用shim-pack VP-ODS色谱柱(4.6 mm×250 mm,5 μm);流动相为乙腈(A)-0.1%甲酸(B);流速1.0 mL/min;柱温35 ℃;进样量10 μL;检测波长270 nm。梯度洗脱程序:0~8 min,99%~98%B;8~15 min,98%~92%B;15~25 min,92%B;25~35 min,92%~85%B;35~45 min,85%B;45~50 min,85~80%B;50~60 min,80% B(均为体积分数)。
1.3.4 乌天麻不同溶剂提取物的抗氧化活性测定
1.3.4.1 DPPH自由基清除能力测定
参考CHEUNG等[19]的方法,并适当修改,将乌天麻提取物稀释成0、5、10、20、30、40、50 μg/mL的样液,分别吸取1 mL加入5 mL 0.1 mmol/L DPPH溶液,混匀,室温条件下避光静置50 min,4 000 r/min离心10 min,取上清液于517 nm处测定样品的吸光度Ai,以乙醇溶液为空白,测定其吸光度Aj。以抗坏血酸(VC)为对照。根据公式(1)计算样品对DPPH自由基的清除率。
DPPH自由基清除率![]()
(1)
1.3.4.2 ABTS阳离子自由基清除能力测定
参考SOONG等[20]的方法测定,制备ABTS阳离子自由基工作液,使其在室温条件下于734 nm处吸光度为(0.70±0.02)。分别取3 mL不同质量浓度(0.0、0.05、0.1、0.2、0.3、0.4、0.5 μg/mL)乌天麻提取液和1 mL ABTS工作液于试管中,混匀后30 ℃水浴反应6 min,于734 nm处测定样品的吸光度Ai,以乙醇溶液为空白,测定其吸光度Aj。以抗坏血酸(0~0.6 μg/mL)为对照。根据公式(2)计算样品对ABTS阳离子自由基的清除率。
ABTS阳离子自由基清除率![]()
(2)
1.3.5 数据统计分析
每个试验做3次平行,结果用平均值±标准偏差表示,采用SPSS 21软件进行显著性分析(Duncan法)和Pearson相关性分析。
2 结果与分析
2.1 乌天麻不同溶剂提取物中总多酚和总黄酮分析
由表1可知,乌天麻不同溶剂提取物中总多酚和总黄酮含量差异显著(P<0.05),总多酚含量为3.506~4.006 mg GAE/g,其中70%(体积分数)甲醇和水提取物中总多酚含量最高,显著高于70%(体积分数)乙腈、70%乙醇和70%丙酮(体积分数)提取物(P<0.05),但70%甲醇和水提取物中总多酚含量差异不显著,说明乌天麻中总多酚主要以强极性为主。与总多酚结果相似,70%甲醇提取物中总黄酮含量最高,为1.290 mg RE/g,显著高于其余溶剂提取物(P<0.05),且其余4种溶剂提取物中总黄酮含量无显著差异。结果表明,乌天麻70%甲醇提取物中总多酚和总黄酮含量最高,与山楂甲醇提取物中总多酚和总黄酮含量最高的研究报道相一致[21]。
表1 乌天麻不同溶剂提取物中总多酚和总黄酮含量
Table 1 Contents of total phenolics and flavonoids of different solvents extracts from G.elata Bl.f.glauca S.Chow

含量提取溶剂类型70%丙酮70%乙醇70%乙腈70%甲醇水总多酚/(mg GAE·g-1)3.506±0.102b3.527±0.025b3.527±0.056b4.006±0.045a4.000±0.152a总黄酮/(mg RE·g-1)1.135±0.007b1.115±0.007b1.135±0.021b1.290±0.014a1.100±0.028b
注:同一行不同字母表示差异显著(P<0.05)(下同)
2.2 乌天麻不同溶剂提取物组成成分分析
利用HPLC分析乌天麻不同溶剂提取物的组成成分及含量,混合标准品的色谱图如图1-a所示,乌天麻不同溶剂提取物的色谱图如图1-b~图1-f所示,鉴定出腺苷、天麻素、对羟基苯甲醇、巴利森苷E、对羟甲苯甲醛、巴利森苷B、巴利森苷C、巴利森苷A共8种主要成分,其分子结构见图2。以标准品峰面积对质量浓度进行线性回归,得到标准品的回归方程和提取物中主要成分含量结果见表2。
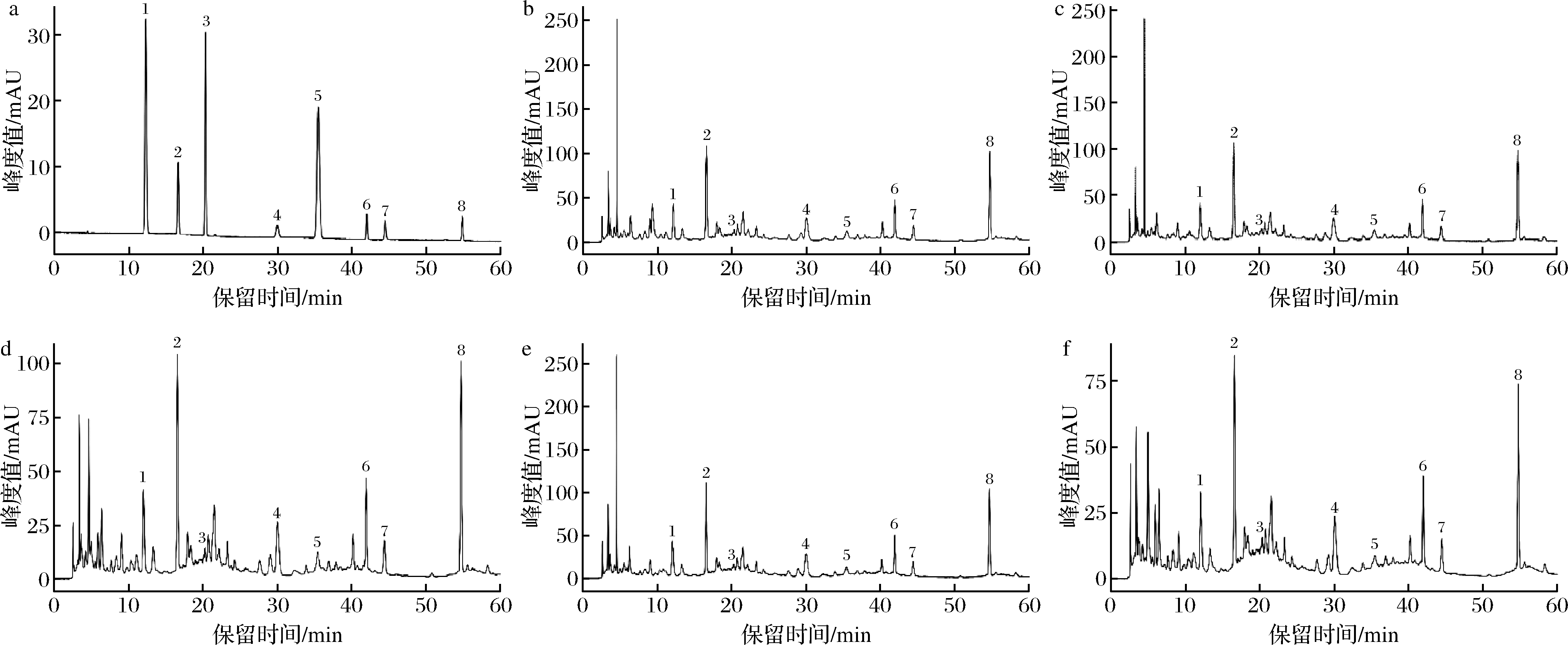
a-标准品;b-70%丙酮提取物;c-70%乙醇提取物;d-70%乙腈提取物;e-70%甲醇提取物;f-水溶剂提取物
图1 乌天麻不同溶剂提取物及标准品的HPLC图
Fig.1 HPLC chromatograms of standard mixtures and different solvents extracts from G.elata Bl.f.glauca S.Chow
注:1~8为图2中各活性成分

图2 乌天麻提取物中主要活性成分的分子结构
Fig.2 Molecular structure of the main active components existed in extracts from G.elata Bl.f.glauca S.Chow
由表2可知,乌天麻提取物中8种主要成分的含量高低依次为:天麻素>巴利森苷A>巴利森苷E>巴利森苷C>巴利森苷B>腺苷>对羟基苯甲醇>对羟基苯甲醛,表明乌天麻中含有较高的天麻素和巴利森苷类化合物。有研究报道,这些化合物具有较强的生理活性和多种药理作用[22-23]。对不同溶剂提取效果进行比较分析,可知乌天麻不同溶剂提取物的主要成分含量有显著性差异(P<0.05),其中70%丙酮提取物腺苷含量最高(0.108 mg/g),70%乙醇提取物天麻素含量最高(5.860 mg/g),均显著高于水提取物含量(P<0.05),但与其余溶剂无显著差异(P>0.05),陈琛等[24]在研究天麻水提取活性成分时发现天麻素含量高于总酚含量,与本研究结果相似,可能与测定方法原理有关。乌天麻水提取物对羟基苯甲醇含量最高,为0.078 mg/g,70%甲醇提取物中巴利森苷E(4.181 mg/g)、对羟基苯甲醛(0.014 mg/g)、巴利森苷B(1.745 mg/g)和巴利森苷C(2.255 mg/g)含量显著高于其余溶剂提取物(P<0.05),70%甲醇、70%乙腈和70%丙酮提取物中巴利森苷A含量高于70%乙醇(体积分数)和水提取物,且有显著性差异(P<0.05)。这与不同溶剂提取对牦牛酥油磷脂脂肪酸组成成分含量有影响的结果一致[25]。
表2 乌天麻不同溶剂提取物的活性成分含量 单位:mg/g
Table 2 Active components contents in different solvents extracts from G.elata Bl.f.glauca S.Chow
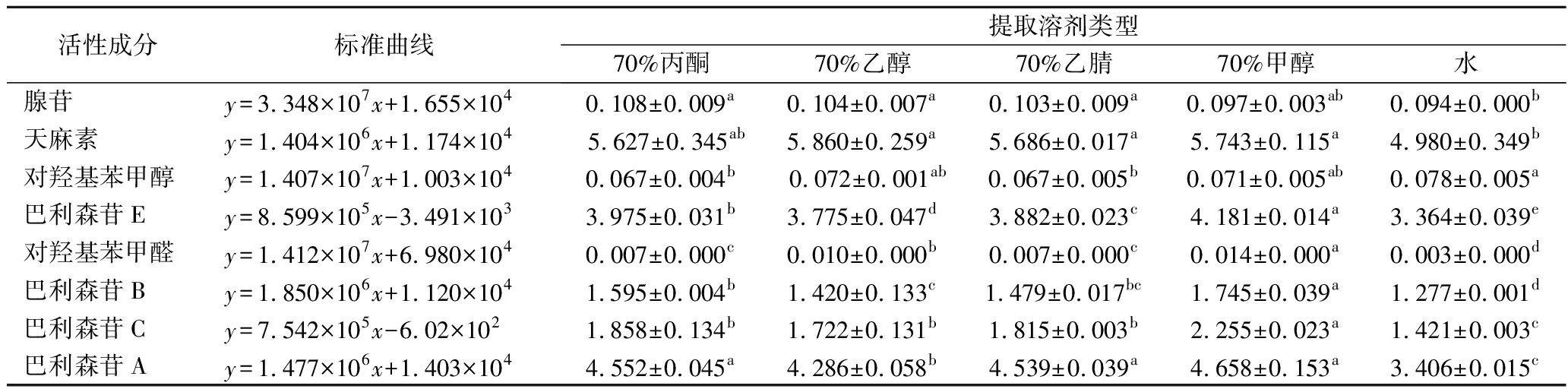
活性成分标准曲线提取溶剂类型70%丙酮70%乙醇70%乙腈70%甲醇水腺苷y=3.348×107x+1.655×1040.108±0.009a0.104±0.007a0.103±0.009a0.097±0.003ab0.094±0.000b天麻素y=1.404×106x+1.174×1045.627±0.345ab5.860±0.259a5.686±0.017a5.743±0.115a4.980±0.349b对羟基苯甲醇y=1.407×107x+1.003×1040.067±0.004b0.072±0.001ab0.067±0.005b0.071±0.005ab0.078±0.005a巴利森苷Ey=8.599×105x-3.491×1033.975±0.031b3.775±0.047d3.882±0.023c4.181±0.014a3.364±0.039e对羟基苯甲醛y=1.412×107x+6.980×1040.007±0.000c0.010±0.000b0.007±0.000c0.014±0.000a0.003±0.000d巴利森苷By=1.850×106x+1.120×1041.595±0.004b1.420±0.133c1.479±0.017bc1.745±0.039a1.277±0.001d巴利森苷Cy=7.542×105x-6.02×1021.858±0.134b1.722±0.131b1.815±0.003b2.255±0.023a1.421±0.003c巴利森苷Ay=1.477×106x+1.403×1044.552±0.045a4.286±0.058b4.539±0.039a4.658±0.153a3.406±0.015c
注:各标准曲线R2均>0.999 8
2.3 乌天麻不同溶剂提取物抗氧化活性分析
2.3.1 DPPH自由基清除作用
由图3-a可知,质量浓度为0~50 μg/mL时,乌天麻不同溶剂提取物清除DPPH自由基能力随质量浓度增大而增大,但清除能力均小于VC且相互之间有差异。由图3-b可知,水和70%甲醇提取物清除DPPH自由基的IC50值最小,分别是28.364和30.929 μg/mL,其次是70%乙腈、70%乙醇和70%丙酮提取物,IC50值分别为34.671、35.657、36.036 μg/mL,但均大于VC的IC50值23.345 μg/mL,所以水提取物清除DPPH自由基能力最好,70%丙酮提取物清除能力最弱。IC50值显著性分析表明,除70%乙醇和70%丙酮提取物外,其余溶剂提取物清除DPPH自由基能力之间差异显著(P<0.05),呈现出随溶剂极性增大,提取物清除DPPH自由基能力增强的趋势,可能与提取物中活性成分不同或含有多糖成分有关[26]。
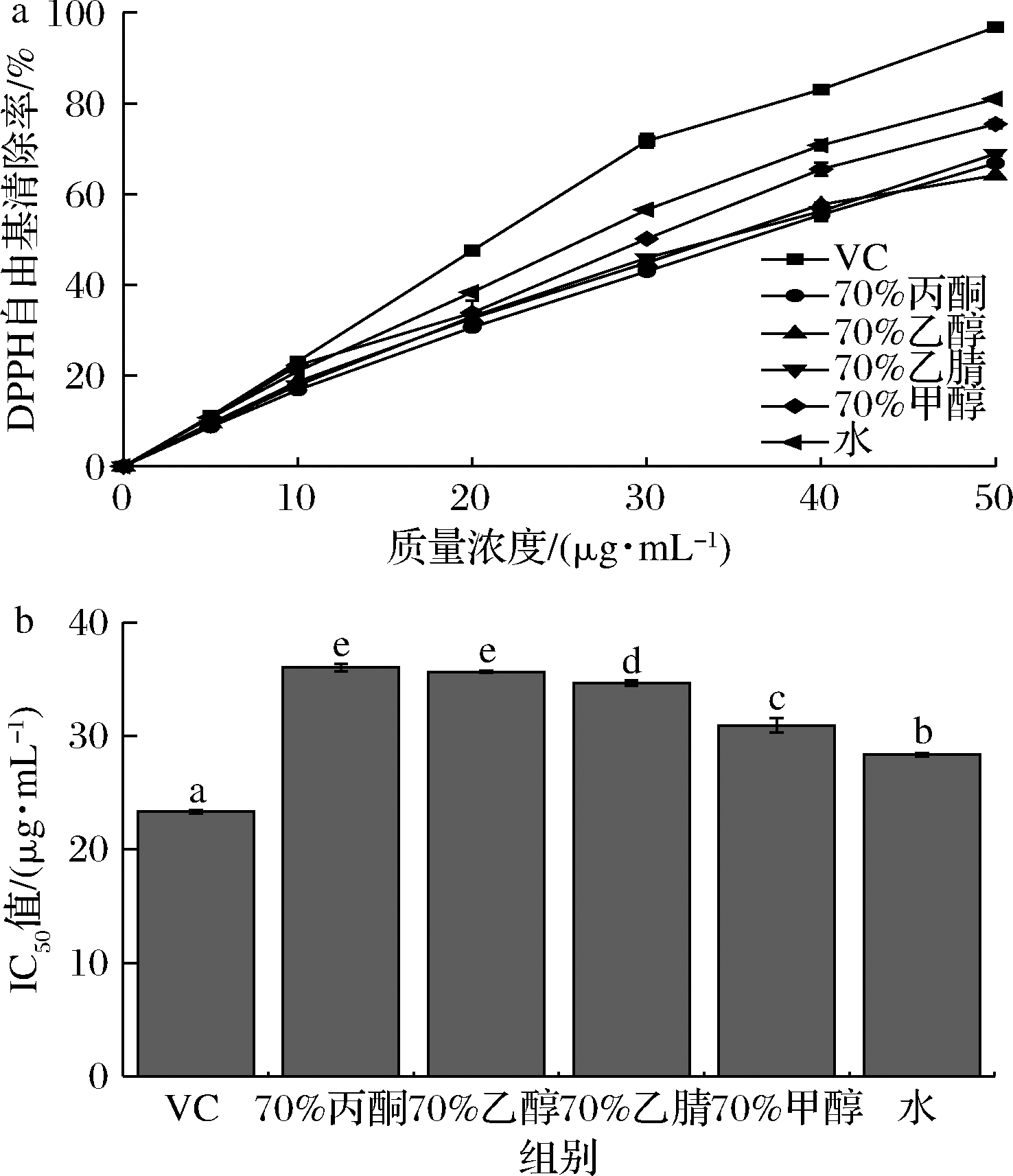
a-DPPH自由基清除能力;b-IC50
图3 不同溶剂提取物DPPH自由基清除能力及其IC50对比
Fig.3 DPPH free radical scavenging abilities and their IC50 values of extracts using different solvent
注:图中不同小写字母表示差异显著(P<0.05)(下同)
2.3.2 ABTS阳离子自由基清除作用
由图4-a可以看出,质量浓度为0~0.5 μg/mL时,乌天麻不同溶剂提取物清除ABTS阳离子自由基能力均强于VC,且随着质量浓度增加,提取物清除ABTS阳离子自由基能力增强,当达到0.3 μg/mL时,清除率均>87%,此后,清除ABTS阳离子自由基能力随浓度增加的递增趋势逐渐变缓。由图4-b可知,不同溶剂提取物清除ABTS阳离子自由基的IC50值大小顺序为:维生素C>水>70%丙酮>70%乙醇>70%乙腈>70%甲醇,表明70%甲醇提取物清除ABTS阳离子自由基能力最好,IC50值为0.070 μg/mL,显著高于水提取物IC50值0.099 μg/mL(P<0.05),但与其他3种溶剂提取物差异不显著。与CUI等[27]报道的银杏叶外果皮甲醇提取物抗氧化活性最强结果相似。
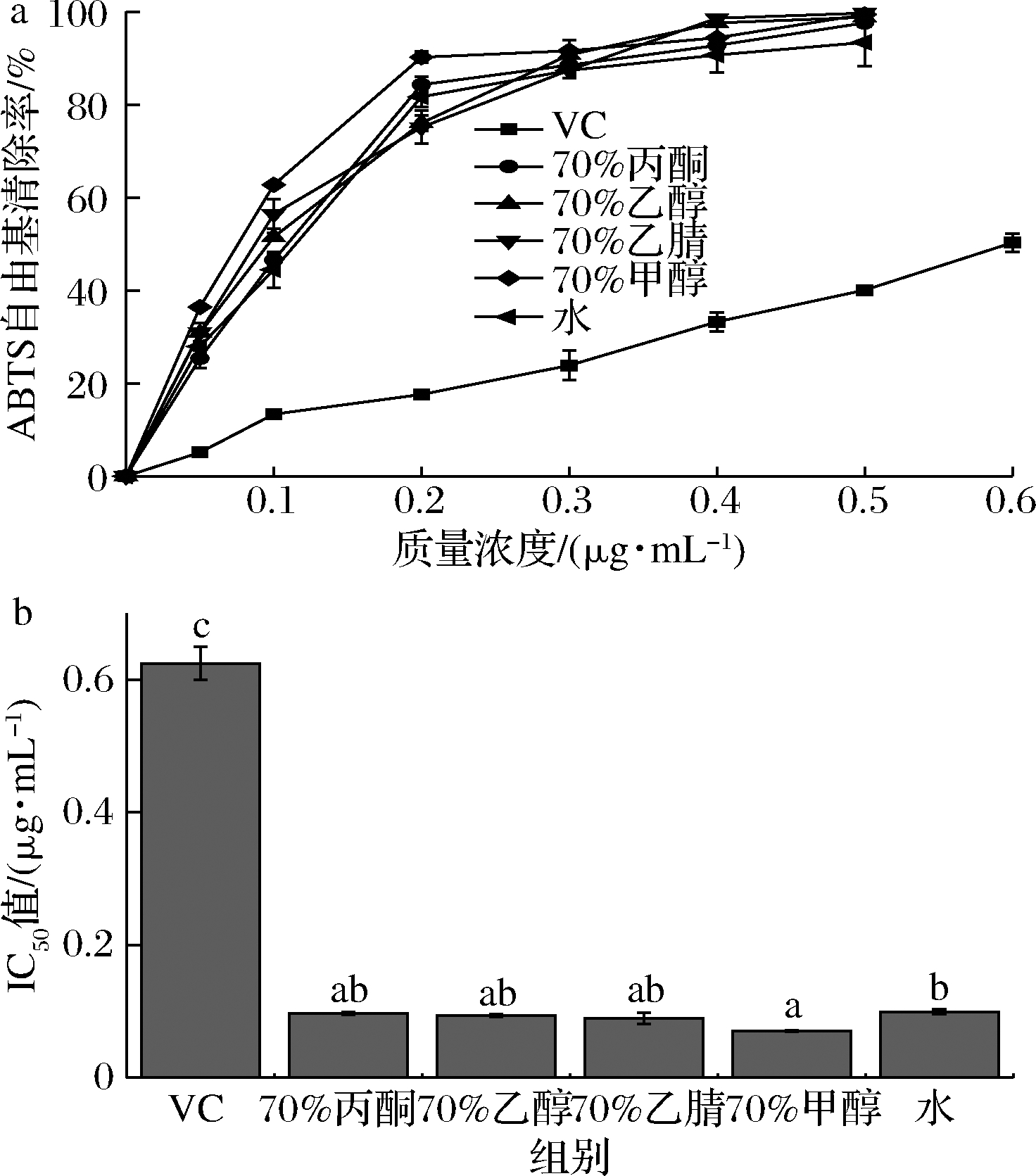
a-ABTS阳离子自由基清除能力;b-IC50
图4 不同溶剂提取物ABTS阳离子自由基清除能力及其IC50对比
Fig.4 ABTS cationic radical scavenging abilities and their IC50 values of extracts using different solvent
由上述结果可知,乌天麻不同溶剂提取物清除DPPH自由基和ABTS阳离子自由基能力的结果不完全一致,可能与提取溶剂极性、活性成分结构性质及抗氧化体系不同有关,总体来看,乌天麻不同溶剂提取物中70%甲醇提取物表现出较好的抗氧化活性。
2.4 乌天麻不同溶剂提取物中活性成分与抗氧化活性的相关性分析
乌天麻不同溶剂提取物的活性成分含量与抗氧化活性之间相关性分析结果如表3所示。乌天麻中总多酚含量与清除DPPH自由基能力呈显著正相关(P<0.05),总黄酮含量与清除ABTS阳离子自由基能力呈极显著正相关(P<0.01),与JAWHARI等[28]研究报道一致,即酚类和黄酮含量与抗氧化活性之间存在一定的相关性。乌天麻组成成分中腺苷、天麻素、对羟基苯甲醇、对羟基苯甲醛、巴利森苷E、巴利森苷C和巴利森苷A与抗氧化活性之间有一定相关性,其中对羟基苯甲醇含量与清除DPPH自由基能力达到显著正相关(P<0.05),腺苷含量与清除DPPH自由基能力呈极显著负相关(P<0.01),天麻素、巴利森苷A等成分含量与DPPH自由基清除能力呈负相关,该结果与华东覆盆子鞣花酸、没食子酸含量和DPPH自由基清除能力呈显著负相关以及芒果叶酚类成分含量与生物活性呈负相关的研究结果相似[29-30]。对羟基苯甲醛和巴利森苷C含量与清除ABTS阳离子自由基能力存在显著正相关关系(P<0.05),天麻素、巴利森苷E、巴利森苷B和巴利森苷A含量与清除ABTS阳离子自由基能力呈正相关,这与GAO等[31]结果相似,其在研究不同产地来源的天麻中发现对羟基苯甲醇含量高的天麻样品表现出较强的抗氧化活性。不同的是,研究发现几种乌天麻组成成分含量与DPPH自由基清除率呈负相关,造成这种组成成分含量与清除DPPH自由基能力不匹配的原因可能与水提取物8种组成成分含量最少而清除DPPH自由基能力却最好有关,PROVENZANO等[32]研究报道,一种苔藓植物的水提取物较80%甲醇和80%乙醇提取物氧化自由基吸收能力(oxygen radical absorbance capacity,ORAC)值最高。结果表明,乌天麻提取物的抗氧化活性可能是多种活性成分之间相互作用的结果,既与总多酚和总黄酮含量相关,又与组成成分种类和含量相关。
表3 乌天麻活性成分含量与抗氧化活性的相关性分析
Table 3 Correlation analysis between the contents of active components and antioxidant activities
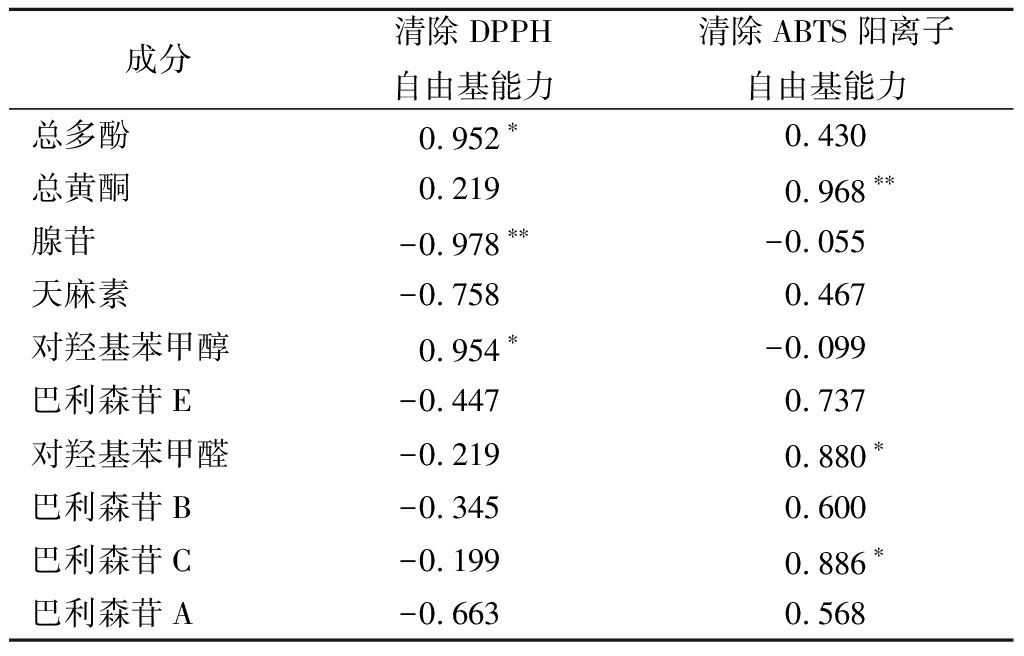
成分清除DPPH自由基能力清除ABTS阳离子自由基能力总多酚0.952∗0.430总黄酮0.2190.968∗∗腺苷-0.978∗∗-0.055天麻素-0.7580.467对羟基苯甲醇0.954∗-0.099巴利森苷E-0.4470.737对羟基苯甲醛-0.2190.880∗巴利森苷B-0.3450.600巴利森苷C-0.1990.886∗巴利森苷A-0.6630.568
注:*,显著相关(P<0.05);**,极显著相关(P<0.01)
过量的活性氧会触发自由基链式反应,导致健康问题,如老化和细胞损伤[33]。富含抗氧化成分的天然膳食已被发现是解决这一问题的有效方法,因为其能够中断这些反应,清除自由基、协助细胞再生、预防癌症和心血管疾病,从而提高健康水平。因此,发现和研究新的食用资源的抗氧化潜力具有重要意义。
3 结论
乌天麻不同溶剂[70%丙酮、70%乙醇、70%乙腈、70%甲醇(体积分数)和水]提取物的活性成分含量及抗氧化活性之间差异显著。乌天麻提取物的总多酚和总黄酮含量分别为3.506~4.006 mg GAE/g和1.100~1.290 mg RE/g,且70%甲醇提取物总多酚和总黄酮含量均最高;通过HPLC法对乌天麻提取物中组成成分进行分析,鉴定出8种主要成分,分别为腺苷、天麻素、对羟基苯甲醇、巴利森苷E、对羟基苯甲醛、巴利森苷B、巴利森苷C、巴利森苷A,其中70%乙醇提取物中天麻素含量最高,70%甲醇提取物中巴利森苷E、对羟基苯甲醛、巴利森苷B和巴利森苷C含量最高,并与其余溶剂提取物有显著性差异。对不同溶剂提取物的抗氧化活性进行评价,可知水提取物清除DPPH自由基能力最强,其次是70%甲醇提取物,而70%甲醇提取物清除ABTS阳离子自由基效果最好。相关性分析结果表明,乌天麻不同溶剂提取物的抗氧化活性与总多酚、总黄酮及其组成成分的含量之间存在较高的相关性,这表明乌天麻抗氧化活性是多种物质之间的协同作用,还有待进一步探索。
[1] YIP K L,ZHOU X L,CHOOK P,et al.Herb-drug interaction of Gastrodiae rhizoma on carbamazepine:A pharmacokinetic study in rats[J].Epilepsy Research,2020,165:106376.
[2] WANG M,DONG W R,WANG R Y,et al.Gastrodiae rhizoma water extract ameliorates hypothalamic-pituitary-adrenal axis hyperactivity and inflammation induced by chronic unpredictable mild stress in rats[J].BioMed Research International,2020,2020:8374614.
[3] JIANG Z,ZHENG X,GONG X,et al.Relative tissue distribution and excretion studies of gastrodin and parishin from powder and extract of Gastrodiae rhizoma in rat by UHPLC-ESI-MS/MS[J].Biomedical Chromatography,2017,31(7).DOI:10.1002/bmc.3909.
[4] ZHAN H D,ZHOU H Y,SUI Y P,et al.The rhizome of Gastrodia elata Blume-An ethnopharmacological review[J].Journal of Ethnopharmacology,2016,189:361-385.
[5] 付亚轩,孟宪钰,李明超,等.天麻抗抑郁药效物质及其作用机制研究进展[J].中草药,2020,51(21):5 622-5 630.
FU Y X,MENG X Y,LI M C,et al.Research progress on antidepressant substances and their mechanisms in Gastrodia elata[J].Chinese Traditional and Herbal Drugs,2020,51(21):5 622-5 630.
[6] LIU Y,GAO J L,PENG M,et al.A review on central nervous system effects of gastrodin[J].Frontiers in Pharmacology,2018,9:24.
[7] WANG Z W,LI Y,LIU D H,et al.Chemical constituents from the rhizomes of Gastrodia elata f.glauca and their potential neuroprotective effects[J].Phytochemistry Letters,2018,24:167-171.
[8] 蒋然.乌天麻不同炮制品的质量评价及药理活性研究[D].长春:吉林农业大学,2018.
JIANG R.Research on the quality evaluation and pharmacological activity of different processed products of Gastrodia elata Bl.f.glauca S.Chow[D].Changchun:Jilin Agricultural University,2018.
[9] DONG J J,JI D,SU L L,et al.A simplified LC-MS/MS approach for simultaneous quantification and pharmacokinetics of five compounds in rats following oral administration of Gastrodia elata extract[J].Journal of Analytical Science and Technology,2020,11:18.
[10] YU B C,LI Z,WU J Y,et al.Quality control of Gastrodia elata by high-performance liquid chromatography with fluorescence detection(HPLC-FLD)and principal component analysis(PCA)and hierarchical cluster analysis(HCA)[J].Analytical Letters,2020,53(5):746-759.
[11] KIM H M,KWON J,LEE K,et al.Constituents of Gastrodia elata and their neuroprotective effects in HT22 hippocampal neuronal,R28 retinal cells,and BV2 microglial cells[J].Plants,2020,9(8):1 051.
[12] CHEN J Y,HUANG Y L,HU X C,et al.Gastrodin prevents homocysteine-induced human umbilical vein endothelial cells injury via PI3K/Akt/eNOS and Nrf2/ARE pathway[J].Journal of Cellular and Molecular Medicine,2020,25(1):345-357.
[13] ZHENG B W,SHI C L,MUHAMMED F K,et al.Gastrodin alleviates bone damage by modulating protein expression and tissue redox state[J].FEBS Open Bio,2020,10(11):2 404-2 416.
[14] 吴力亚,吴天祥,汪玲.天麻参与灰树花固态发酵对基质主要活性成分的影响[J].食品与发酵工业,2021,47(16):40-45.
WU L Y,WU T X,WANG L.Effect of Rhizoma gastrodia participating in solid-state fermentation of Grifola frondosa on its main active components of culture medium[J].Food and Fermentation Industries,2021,47(16):40-45.
[15] 陈娜,李永强,李瑞平,等.不同包装条件下冷藏天麻的保鲜效果[J].食品与发酵工业,2020,46(1):251-255.
CHEN N,LI Y Q,LI R P,et al.Preservative effects of different packaging methods on Gastrodia elata under refrigeration conditions[J].Food and Fermentation Industries,2020,46(1):251-255.
[16] LI F H,ZHANG X L,ZHENG S J,et al.The composition,antioxidant and antiproliferative capacities of phenolic compounds extracted from tartary buckwheat bran[Fagopyrum tartaricum(L.)Gaerth][J].Journal of Functional Foods,2016,22:145-155.
[17] 熊双丽,李安林,任飞,等.苦荞和甜荞麦粉及麦壳中总黄酮的提取和自由基清除活性[J].食品科学,2009,30(3):118-122.
XIONG S L,LI A L,REN F,et al.Study on extraction of total flavonoids from powder or husks of different cultivars of buckwheat and analysis on their free radical scavenging activities[J].Food Science,2009,30(3):118-122.
[18] 田孟华,袁天军,周瑞,等.不同产地及变型天麻有效成分差异性分析[J].中成药,2020,42(7):1 824-1 829.
TIAN M H,YUAN T J,ZHOU R,et al.Difference analysis of effective constituents in different growing areas and varieties of Gastrodia elata[J].Chinese Traditional Patent Medicine,2020,42(7):1 824-1 829.
[19] CHEUNG L M,CHEUNG P C K,OOI V E C.Antioxidant activity and total phenolics of edible mushroom extracts[J].Food Chemistry,2003,81(2):249-255.
[20] SOONG Y Y,BARLOW P J.Antioxidant activity and phenolic content of selected fruit seeds[J].Food Chemistry,2004,88(3):411-417.
[21] 张亮亮,张展诺,闫可婧,等.山楂不同溶剂提取物的抗氧化活性及对DNA和蛋白质氧化损伤的保护作用[J].食品研究与开发,2020,41(7):63-68.
ZHANG L L,ZHANG Z N,YAN K J,et al.Antioxidant activity and protective effects on oxidative DNA and protein damage of different solvent extracts from hawthorn(Crataegus pinnatifida Bunge)[J].Food Research and Development,2020,41(7):63-68.
[22] TANG C L,WANG L,LIU X X,et al.Comparative pharmacokinetics of gastrodin in rats after intragastric administration of free gastrodin,parishin and Gastrodia elata extract[J].Journal of Ethnopharmacology,2015,176:49-54.
[23] ZHAO Y,GONG X J,ZHOU X,et al.Relative bioavailability of gastrodin and parishin from extract and powder of Gastrodiae rhizoma in rat[J].Journal of Pharmaceutical and Biomedical Analysis,2014,100:309-315.
[24] 陈琛,蔺蓓蓓,徐尤美,等.天麻水提物活性成分分析及其抗氧化活性[J].食品工业科技,2019,40(5):17-22.
CHEN C,LIN B B,XU Y M,et al.Analysis of active components and antioxidant activity of aqueous extract of Gastrodia elata[J].Science and Technology of Food Industry,2019,40(5):17-22.
[25] 雷有娟,孙万成,罗毅皓,等.不同溶剂提取牦牛酥油中的磷脂及其脂质组学研究[J].中国油脂,2020,45(5):110-116.
LEI Y J,SUN W C,LUO Y H,et al.Extraction of phospholipids from yak butter with different solvent and its lipidomics analysis[J].China Oils and Fats,2020,45(5):110-116.
[26] LIU J,YU Y,ZHAO Y P,et al.Interrelation of cholesterol-lowering,antioxidant activity and DNA damage protection to the different solvent extracts of mulberry(Morus alba L.)[J].Journal of Food Processing and Preservation,2020,45(1):e14 891.
[27] CUI N,ZHANG L L,QUAN M P,et al.Profile of the main bioactive compounds and in vitro biological activity of different solvent extracts from Ginkgo biloba exocarp[J].RSC Advances,2020,10(73):45 105-45 111.
[28] JAWHARI F Z,MOUSSAOUI A E L,BOURHIA M,et al.Anacyclus pyrethrum var.pyrethrum(L.)and Anacyclus pyrethrum var.depressus(Ball)Maire:Correlation between total phenolic and flavonoid contents with antioxidant and antimicrobial activities of chemically characterized extracts[J].Plants,2021,10(1):149.
[29] 陈青青,李柯,唐晓清,等.华东覆盆子果、茎与叶的酚类成分及抗氧化活性分析[J].食品科学,2020,41(24):209-215.
CHEN Q Q,LI K,TANG X Q,et al.Analysis of phenolic composition and antioxidant activities in fruits,stems and leaves of Rubus chingii Hu[J].Food Science,2020,41(24):209-215.
[30] WU L F,WU W H,CAI Y Z,et al.HPLC fingerprinting-based multivariate analysis of phenolic compounds in mango leaves varieties:Correlation to their antioxidant activity and in silico α-glucoidase inhibitory ability[J].Journal of Pharmaceutical and Biomedical Analysis,2020,191:113616.
[31] GAO X X,MIAO J,GUO X H,et al.Multicomponent quantitative analysis combined with antioxidant and alpha-glucosidase inhibitory activities for the quality evaluation of Gastrodia elata from different regions[J].Biomedical Chromatography,2019,33(7):e4 508.
[32] PROVENZANO F,S NCHEZ J L,RAO E,et al.Water extract of Cryphaea heteromalla(Hedw.)D.mohr bryophyte as a natural powerful source of biologically active compounds[J].International Journal of Molecular Sciences,2019,20(22):5 560.
NCHEZ J L,RAO E,et al.Water extract of Cryphaea heteromalla(Hedw.)D.mohr bryophyte as a natural powerful source of biologically active compounds[J].International Journal of Molecular Sciences,2019,20(22):5 560.
[33] KUO C T,LIU T H,HSU T H,et al.Antioxidant and antiglycation properties of different solvent extracts from Chinese olive(Canarium album L.)fruit[J].Asian Pacific Journal of Tropical Medicine,2015,8(12):1 013-1 021.