三文鱼,也称为鲑鱼或大马哈鱼,主要分布在挪威、加拿大、美国等高纬度地区,因其肉质鲜美,富含维生素A、B、D、E,各种矿物元素以及n-3系列不饱和脂肪酸,对人体健康极其有益,使得我国三文鱼市场消费量日益增加[1-2]。三文鱼的大量消费伴随产生大量的副产物三文鱼骨。这些数量巨大的三文鱼骨或被直接丢弃,或被用作饲料添加物,或用作生产鱼粉等附加值很低的产品,造成了三文鱼骨资源的严重浪费[3]。
课题组前期以三文鱼骨为原料,通过酶解法制得海洋鱼骨胶原低聚肽,也证明了海洋鱼骨胶原低聚肽中蛋白质含量高,具有很好的抗氧化性。此外海洋鱼骨胶原低聚肽还具有溶解性好、无副作用、安全性高等优点[4-5]。基于此,本研究以通过酶解制得的海洋鱼骨胶原低聚肽为研究对象,通过体外模拟胃肠道消化,利用分子质量分布测定、紫外全波长扫描、圆二色光谱扫描技术表征消化前后海洋鱼骨胶原低聚肽结构的变化;通过测定DPPH自由基清除能力、ABTS阳离子自由基清除能力、铁离子还原能力(ferric reduction ability plasma assay,FRAP)、氧自由基吸收能力(oxygen radical absorbance capacity,ORAC)4个抗氧化指标,研究消化前后海洋鱼骨胶原低聚肽抗氧化活性的变化。深入研究海洋鱼骨胶原低聚肽结构和抗氧化性的消化稳定性,为三文鱼骨的高附加值利用提供理论指导。
1 材料与方法
1.1 材料与仪器
1.1.1 材料
三文鱼骨,北京中食海氏生物技术有限公司;无水乙醇、NaOH、浓盐酸、KH2PO4、Na2HPO4、K2S2O8、醋酸钠,北京化学试剂公司;碱性蛋白酶、木瓜蛋白酶,诺维信生物技术有限公司;胰蛋白酶,北京Solarbio公司;DPPH、偶氮二异丁脒盐酸盐(AAPH)、Fluorescein(荧光指示剂)、Trolox(水溶性维生素E),均为色谱纯,胃蛋白酶,美国Sigma公司;ABTS,分析纯,南京森贝伽生物科技有限公司;2,4,6-三吡啶基-1,3,5-三嗪(tripyridine triazine,TPTZ),酷尔化学科技(北京)有限公司;FeCl3、FeSO4,广东汕头市西陇化工有限公司。
1.1.2 实验仪器
YG30型喷雾干燥机,无锡市阳光干燥设备厂;HH-4数显恒温水浴锅,普瑞斯机械有限公司;FE20K型pH计,瑞士梅特勒-托利多公司;KQ-250E超声波振荡器,昆山市超声仪器有限公司;J-810圆二色谱仪,美国Jasco公司;Spectra MR多功能酶标仪,美国Dynex公司;SpectraMax i3x多功能酶标仪,美国MD公司;LC-20AD高效液相色谱仪、UV-1780紫外可见分光光度计,日本SHIMADZU公司。
1.2 实验方法
1.2.1 海洋鱼骨胶原低聚肽的制备
将三文鱼骨做洁净处理,然后经粉碎机制得三文鱼骨粉。称取鱼骨粉30 g溶于500 mL蒸馏水中混均,于90 ℃水浴锅放置10 min,然后迅速降温到50 ℃,使用pH计调节溶液pH值为8.5,加入碱性蛋白酶反应3 h,反应完毕后收取200 mL反应液;将剩余反应液pH值调至7,维持温度在60 ℃,加入木瓜蛋白酶酶解2 h。反应完毕后,100 ℃灭酶10 min。待降至室温后,将上述经不同处理的反应液在10 000 r/min条件下离心30 min,取上清液。用孔径为200 nm的陶瓷膜过滤,取过滤清液,然后用截留分子质量为1 000 u的超滤膜超滤上清液,超滤过后的上清液进行喷雾干燥,进料温度25 ℃,进料速度14 mL/min,进风温度135 ℃,进风压力20 kPa,得到海洋鱼骨胶原低聚肽干粉[6]。
1.2.2 体外模拟胃肠道消化实验
1.2.2.1 模拟胃液消化实验
精确称取50 g海洋鱼骨胶原低聚肽干粉溶于1 L超纯水中,配制成质量浓度为50 mg/mL的溶液,取20 mL溶液于50 mL离心管中,用1 mol/L HCl溶液调节pH值为2,在37 ℃水浴锅中加热1 min,加入3%(酶底比)胃蛋白酶(≥250 units/mg),混匀,于37 ℃水浴锅中继续消化3 h,然后沸水浴灭酶活10 min,此为模拟胃液组。另做样品消化前对照组(未消化组)。待样品冷却至室温后,进行后续实验[5]。
1.2.2.2 模拟肠液消化实验
将样品配制成质量浓度为50 mg/mL的溶液,取20 mL溶液置于50 mL离心管中,调节pH值为6.8,37 ℃水浴加热1 min,加入3%(酶底比)胰蛋白酶(≥250 units/mg),混匀,于37 ℃水浴锅中继续消化3 h,灭酶活10 min,此为模拟肠液组。冷却至室温后,进行后续实验[5]。
1.2.2.3 模拟先胃液后肠液消化实验
按照1.2.2.1的方法进行胃蛋白酶消化后,调节pH值为6.8,37 ℃水浴加热1 min,加入3%(酶底比)胰蛋白酶(≥250 units/mg),混匀,于37 ℃水浴锅中继续消化3 h,灭酶活10 min,此为先胃后肠组。冷却至室温后,进行后续实验[5]。
1.2.3 分子质量分布测定
分子质量分布采用高效凝胶过滤色谱法测定。色谱条件为:色谱柱:TSKgel G2000 SW XL 300 mm×7.8 mm;流动相:V(乙腈)∶V(水)∶V(三氟乙酸)=45∶55∶0.1;流速:0.5 mL/min;进样体积:10 μL;检测波长:220 nm;柱温:30 ℃,紫外检测器检测。使用1 mg/mL的样品溶液进行测定,样品溶液经流动相配制,然后经孔径0.2 μm聚四氟乙烯过滤膜过滤后,用高效液相色谱仪进行凝胶过滤,数据使用Empower GPC软件处理。以乙氨酸-乙氨酸-乙氨酸(分子质量189 u)、乙氨酸-乙氨酸-酪氨酸-精氨酸(分子质量451 u)、杆菌酶(分子质量1 450 u)、细胞色素C(分子质量12 500 u)为肽标准品,配制质量分数0.1%溶液,过膜后进样,制作相对分子质量校正曲线[4]。
1.2.4 紫外全波长扫描
将质量浓度2.0 mg/mL的样品溶液置于石英比色皿中,利用紫外可见分光光度计进行紫外全波长扫描,扫描波长245~325 nm,狭缝1.0 mm,采样间隔0.5 nm,慢速扫描,用Origin Pro 8.5软件分析处理数据。
1.2.5 圆二色光谱扫描
取质量浓度1.0 mg/mL的样品溶液置于石英比色皿中,于圆二色光谱仪上进行检测,设定圆二色光谱条件:光源采用氙灯;氮气输出压力为0.4 MPa;带宽1.0 nm;光谱测量范围180~260 nm;步进0.5 nm;数据点采样时间0.25 s。对蛋白样品进行圆二色光谱采集,每个样品采集3次数据,用Origin Pro 8.5软件分析处理数据,用CDNN 2.1-Simple Spectra软件分析蛋白质中二级结构的组成与含量。
1.2.6 DPPH自由基清除能力测定
配制质量浓度为1.0、2.0、5.0、10.0、15.0 mg/mL的海洋鱼骨胶原低聚肽溶液,分别加入100 μL于96孔板中,再加入100 μL 0.1 mol/L DPPH-无水乙醇溶液,混合均匀后,室温避光反应30 min,立即利用酶标仪在波长517 nm处测定吸光值AX;以无水乙醇代替DPPH-无水乙醇溶液作为空白组,测定吸光值A0;以蒸馏水代替样品溶液作为对照组,测定吸光值A1。每个浓度的样品做3组平行。DPPH自由基清除率计算如公式(1)所示[6-7]:
DPPH自由基清除率![]()
(1)
1.2.7 ABTS阳离子自由基清除能力测定
使用超纯水将ABTS稀释至7 mmol/L制得ABTS储备液。将2.45 mmol/L的K2S2O8与ABTS储备液等体积混合,室温避光过夜,使其充分反应12~16 h。然后将反应后的ABTS工作母液稀释35倍得ABTS工作液。取96孔板,于96孔板中各加入200 μL的ABTS工作液,样品孔每孔加入10 μL的质量浓度1 mg/mL的待测样品,空白孔加入10 μL,0.1 mol/L,pH 7.4的PBS,标准孔加入不同浓度的Trolox标准溶液,每组试验做3组平行。然后轻轻晃动96孔板片刻,室温避光反应5 min,最后在734 nm处测定吸光度(optical density,OD)值。以标准品OD值为纵坐标,Trolox浓度为横坐标绘制标准曲线,根据标准曲线计算样品的ABTS自由基清除能力,以mmol Trolox/L表示[8-9]。
1.2.8 FRAP的测定
将300 mmol/L醋酸钠缓冲液(pH 3.6)、10 mmol/L TPTZ溶液、和20 mmol/L FeCl3溶液按体积10∶1∶1的比例制备得FRAP工作液。将FRAP工作液加热到37 ℃。取96孔板,每孔加入180 μL的FRAP工作液,空白对照孔加入5 μL的PBS,标准检测孔中加入5 μL的不同浓度的FeSO4标准溶液,样品检测孔内加入5 μL的1 mg/mL待测样品,轻轻晃动96孔板,混匀。37 ℃孵育5 min,在593 nm处测定OD值,根据FeSO4标准溶液制得的标准曲线计算样品的FRAP[10]。
1.2.9 ORAC值测定
预先配制好pH 7.4,75 mmol/L PBS,不同浓度的Trolox标准品,0.8 μmol/L的Fluorescein;150 mmol/L AAPH。取96孔板,空白孔中加入25 μL的PBS(pH 7.4,75 mmol/L),对照孔中加入25 μL的PBS,标准溶液孔中加入不同浓度梯度的Trolox标准溶液各25 μL,样品孔加入25 μL的1 mg/mL的样品。在避光条件下各孔加入100 μL的0.8 μmol/L Fluorescein,混匀后于37 ℃避光反应20 min。反应完毕,空白孔中加入75 μL的PBS,其余各孔迅速加入75 μL的150 mmol/L AAPH,然后在荧光酶标仪激发波长485 nm,发射波长530 nm条件下,每隔5 min测定1次,测定总时长为180 min。以Trolox标准溶液的浓度为横坐标和荧光衰减曲线保护面积为纵坐标绘制标准曲线,根据Trolox标准曲线计算样品的ORAC值,结果表示为μmol Trolox/g[11]。
2 结果与讨论
2.1 消化前后海洋鱼骨胶原低聚肽的分子质量分布
采用高效凝胶过滤色谱法测定海洋鱼骨胶原低聚肽经体外模拟胃肠道液化后的分子质量分布,结果如表1所示,经过不同的消化模式,海洋鱼骨胶原低聚肽的组分中分子质量<1 000 u的组分所占比例均有所升高,重均分子量均有所降低,其中模拟先胃液后肠液消化后分子质量<1 000 u的组分增加比例最大(约12.16%)和重均分子量降低最多(约23.95%)。这表明海洋鱼骨胶原低聚肽能够一定程度耐受胃肠道中胃蛋白酶和胰蛋白酶。与未消化组相比,经过模拟肠液、模拟先胃液后肠液消化后,1 000~2 000 u、2 000~3 000 u、3 000~5 000 u的组分和重均分子量均有所下降,而<150 u的组分所占比例升高。这表明分子质量相对较大的肽段经过消化后分解成小分子质量的肽段或氨基酸。此外,从表1可见,胰蛋白酶对海洋鱼骨胶原低聚肽的消化作用要强于胃蛋白酶,这表明胰蛋白酶更易破坏链内肽键,产生较小的肽段。杜枘宣[12]的研究同样表明酪蛋白在体外模拟肠液消化中的水解度显著高于胃液消化。在本研究的3种消化方式中,先经模拟先胃液后肠液消化后,海洋鱼骨胶原低聚肽中分子质量<1 000 u的组分升高最多。ZHANG等[13]以全脂大豆片为原料,通过模拟胃肠液消化处理以后,也报道了同样的多肽水解趋势,大豆蛋白水解物经先胃后胰处理后,>10 000 u的肽相对含量降低,<1 000 u的肽相对含量同时增加。
表1 不同处理的海洋鱼骨胶原低聚肽的分子质量分布
Table 1 Molecular weight distributions of MFBCO with different treatments
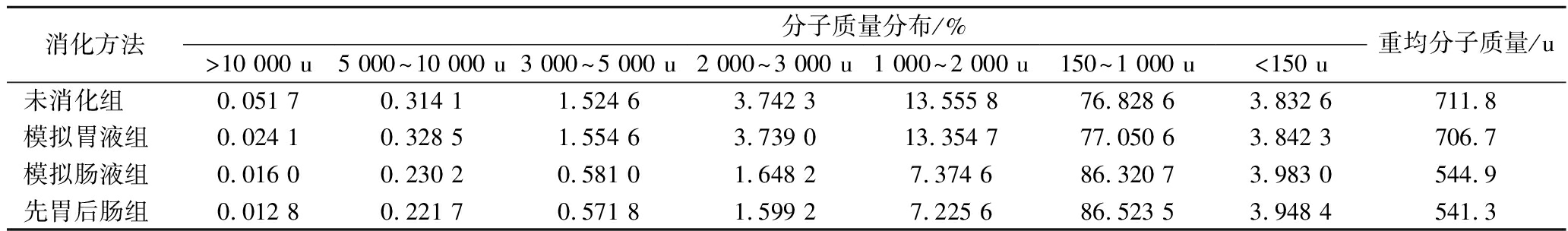
消化方法分子质量分布/%>10 000 u5 000~10 000 u3 000~5 000 u2 000~3 000 u1 000~2 000 u150~1 000 u<150 u重均分子质量/u未消化组0.051 70.314 11.524 63.742 313.555 876.828 63.832 6711.8模拟胃液组0.024 10.328 51.554 63.739 013.354 777.050 63.842 3706.7模拟肠液组0.016 00.230 20.581 01.648 27.374 686.320 73.983 0544.9先胃后肠组0.012 80.221 70.571 81.599 27.225 686.523 53.948 4541.3
2.2 消化前后海洋鱼骨胶原低聚肽的紫外全波长扫描
有研究表明,由于蛋白质中酪氨酸、色氨酸残基含有共轭双键,因此蛋白质溶液在275~280 nm处有1个紫外吸收峰,且其吸收峰值与酪氨酸、色氨酸含量成正比[14]。海洋鱼骨胶原低聚肽在分别经模拟胃液、模拟肠液及模拟先胃液后肠液消化之后,对其进行紫外全波长扫描,如图1所示,海洋鱼骨胶原低聚肽消化前后均在275~280 nm附近出现紫外吸收峰,表明在该波长范围内产生了价电子跃迁,其中未消化组吸收峰最低(吸光值为0.311 0),模拟胃液组吸收峰最高(吸光值为0.415 8),模拟先胃液后肠液消化处理后,与单独模拟胃液消化处理相比紫外吸收值差异不显著,前后变化量小于5%。胃蛋白酶的特异识别位点与酪氨酸、色氨酸等相关,表明了海洋鱼骨胶原低聚肽经模拟胃液消化以后部分肽链发生水解,使得溶液中游离酪氨酸或色氨酸含量增加。
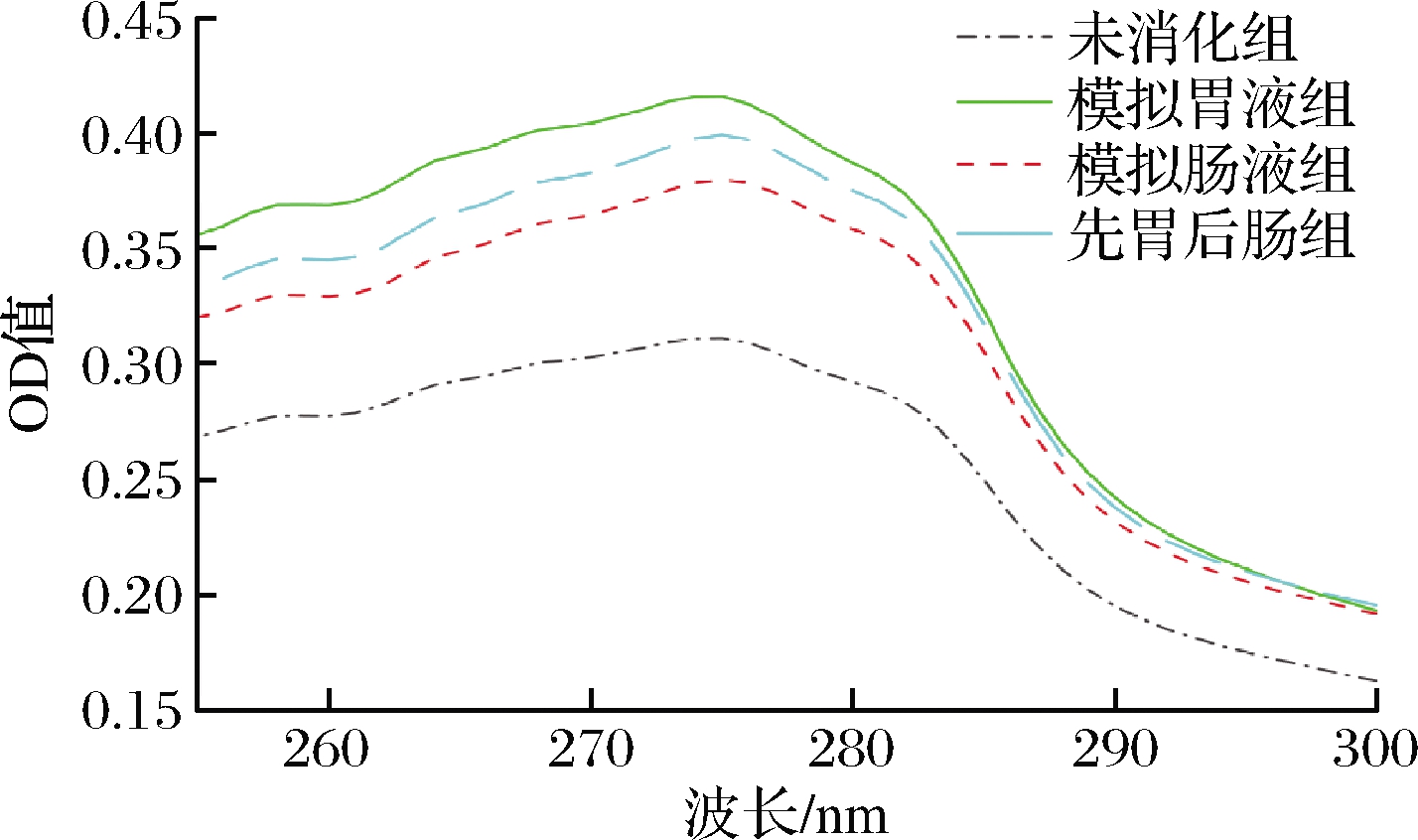
图1 不同处理的海洋鱼骨胶原低聚肽的紫外全波长扫描
Fig.1 UV full wavelength scanning of MFBCO with different treatments
2.3 消化前后海洋鱼骨胶原低聚肽的圆二色光谱扫描
通过圆二色光谱检测海洋鱼骨胶原低聚肽经不同消化酶处理后的二级结构,结果如图2所示,4组样品在195 nm附近均有1个负峰,使用CDNN 2.1-Simple Spectra软件对4组样品的CD图进行分析得到相应的二级结构组成,如表2所示。二级结构中,不规则卷曲比例最高,其次是反平行式β-折叠、β-转角、α-螺旋、平行式β-折叠。与未消化组相比,其余3组反平行式β-折叠比例均减少,其中模拟先胃液后肠液消化后减少最多,为24.12%;同时β-转角、不规则卷曲的比例增加,α-螺旋、平行式β-折叠消化前后变化不大,与未消化组相比,变化不超过8.33%。不同消化模式下,海洋鱼骨胶原低聚肽二级结构的差异可能是胃蛋白酶和胰蛋白酶的作用位点和机理不同。在不同酶的作用下,海洋鱼骨胶原低聚肽的分子间作用力发生改变及肽链构象和结构发生了改变[15]。
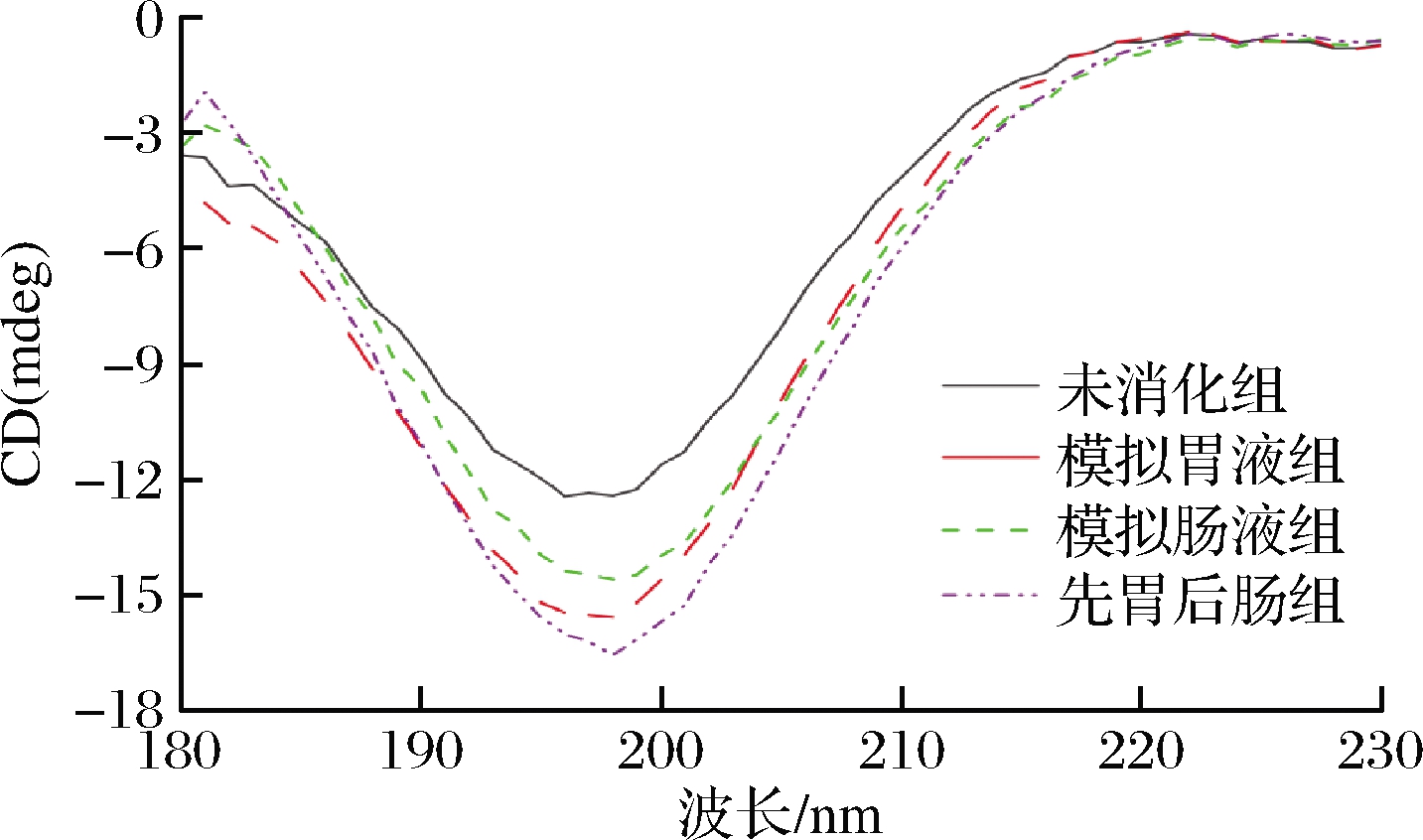
图2 不同处理的海洋鱼骨胶原低聚肽的圆二色光谱图
Fig.2 Circular dichroism spectrogram of MFBCO with different treatments
表2 不同处理的海洋鱼骨胶原低聚肽的二级结构 单位:%
Table 2 Secondary structures of MFBCO with different treatments
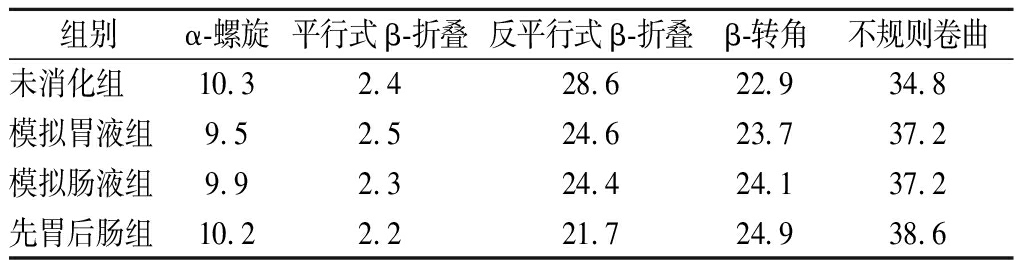
组别α-螺旋平行式β-折叠反平行式β-折叠β-转角不规则卷曲未消化组10.32.428.622.934.8模拟胃液组9.52.524.623.737.2模拟肠液组9.92.324.424.137.2先胃后肠组10.22.221.724.938.6
2.4 消化前后海洋鱼骨胶原低聚肽的DPPH自由基清除能力
海洋鱼骨胶原低聚肽经不同消化酶处理后的DPPH自由基清除能力如图3所示。
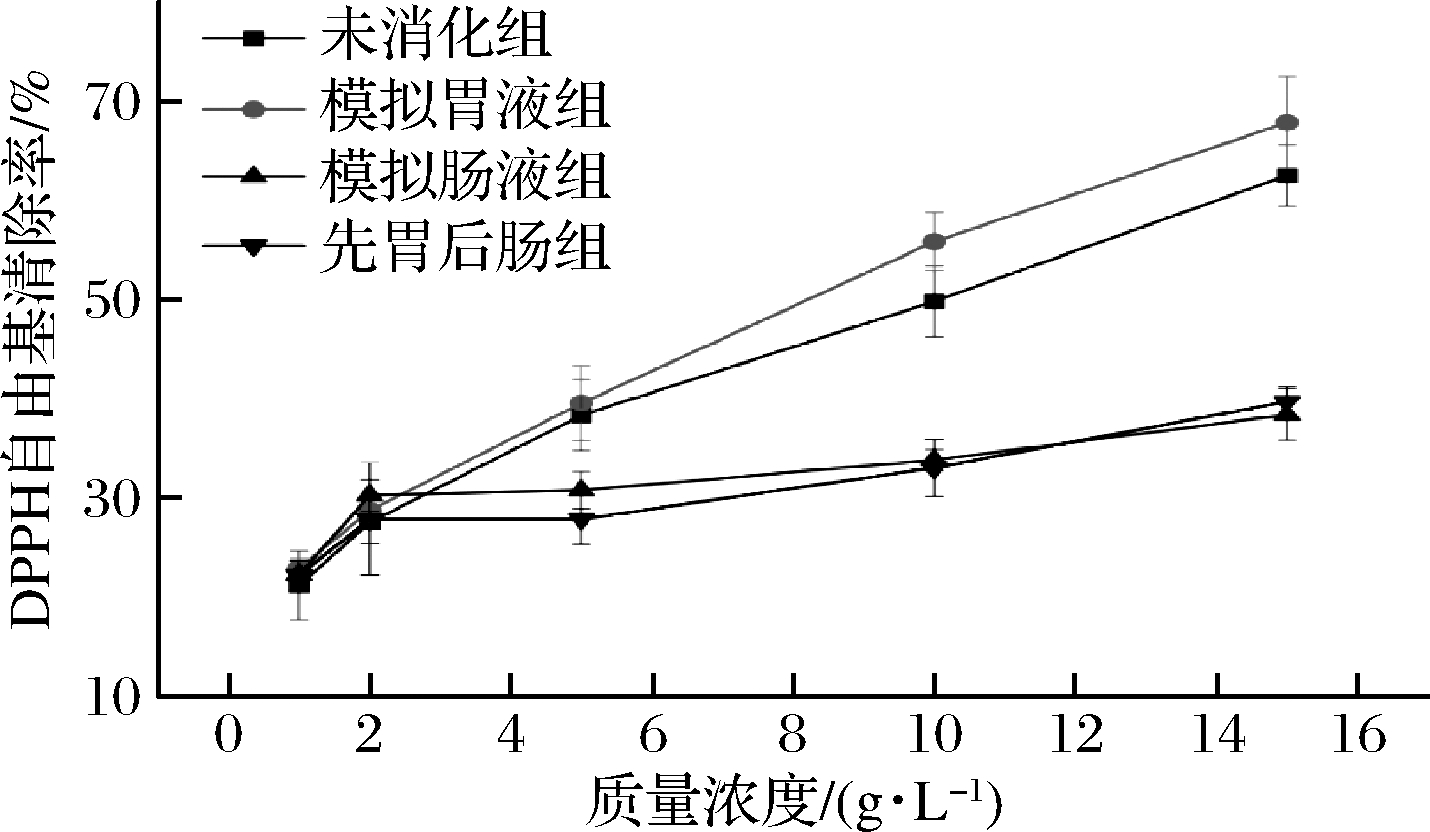
图3 不同处理的海洋鱼骨胶原低聚肽的DPPH自由基清除活性
Fig.3 DPPH free radical scavenging activities of MFBCO with different treatments
海洋鱼骨胶原低聚肽对DPPH自由基清除率呈剂量依赖关系,未消化、模拟胃液、模拟肠液及模拟先胃液后肠液消化消化后,海洋鱼骨胶原低聚肽对DPPH自由基清除率均随质量浓度增加而增加,且未消化组与模拟胃液组整体DPPH自由基清除率明显高于后2组,结合圆二色光谱分析结果,其原因可能是经模拟肠液处理后,海洋鱼骨胶原低聚肽具有抗氧化活性的肽段结构和构象部分发生变化,发生了二级结构的相互转换,导致了抗氧化活性的降低。或者可能是胰酶消化后使得三肽和二肽及氨基酸积累,产生的这些亲水性的水解物几乎不与脂溶性DPPH自由基反应[16]。李茹等[17]以新鲜萝卜苗为原料,利用胃蛋白酶、胰液素消化产生萝卜苗中活性物质,探索模拟胃肠道消化对萝卜苗中活性物质抗氧化活性的影响,其DPPH自由基清除率结果与本研究基本一致。
2.5 消化前后海洋鱼骨胶原低聚肽的ABTS阳离子自由基清除能力
以不同浓度的Trolox标准溶液为横坐标,相应的吸光值为纵坐标,制得ABTS标准曲线为y=0.670 22x+1.188 14(R2=0.998 73)。根据标准方程可得各处理组的ABTS阳离子自由基清除率,结果如表5所示,与未消化组相比,其余3组ABTS阳离子自由基清除能力均有一定程度的增加,但均无显著影响(P>0.05),这表明海洋鱼骨胶原低聚肽的ABTS阳离子自由基清除能力具有一定的消化稳定性。模拟胃肠液消化后,海洋鱼骨胶原低聚肽的ABTS阳离子自由基清除率稍有提高的原因可能是其经模拟胃、肠液消化处理后,产生了较多的亲水性的肽段和氨基酸,具有抗氧化活性的氨基酸残基更加充分暴露,使得产生的ABTS阳离子自由基更容易被抑制,因此与未消化组相比,经蛋白酶消化后的ABTS阳离子自由基清除能力有所提高[16]。顾敏[18]对青养蛋白抗氧化肽经凝胶过滤色谱分离组分的胃肠道消化特性进行了研究,结果与本研究一致,体外胃肠道消化体系均提高了其抗氧化活性。
表3 不同处理的海洋鱼骨胶原低聚肽的ABTS阳离子自由基清能力
Table 3 ABTS cation free radical scavenging activities of MFBCO treated with different treatments
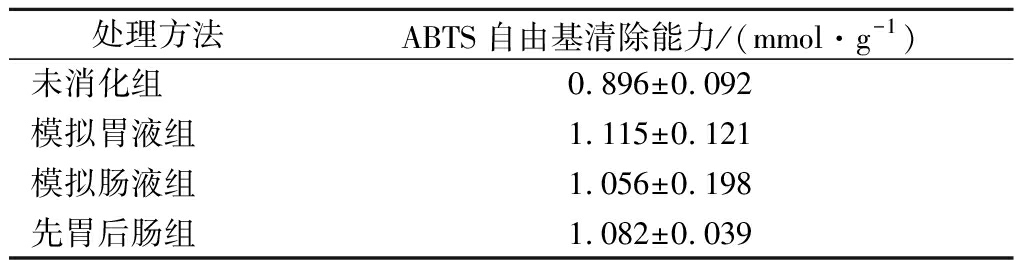
处理方法ABTS自由基清除能力/(mmol·g-1)未消化组0.896±0.092模拟胃液组1.115±0.121模拟肠液组1.056±0.198先胃后肠组1.082±0.039
2.6 消化前后海洋鱼骨胶原低聚肽的FRAP值
通过计算可得FRAP标准曲线表达式:y=0.276 4x+0.011 4,R2=0.994 3。根据标准曲线表达式及所测样品OD值,可得相应的FRAP值,如表4所示。经过模拟胃肠液消化处理后,海洋鱼骨胶原低聚肽均具有一定的铁离子还原能力,这表明海洋鱼骨胶原低聚肽能够通过氢原子转移阻断自由基链式反应过程实现抗氧化作用[19]。与未消化组相比,不同方式处理后的FRAP值无显著差异(P>0.05)。SILVA等[20]以亚麻籽粕为原料,通过不同蛋白酶酶解制备抗氧化活性肽,结果表明,分子质量较低的亚麻籽粕肽的FRAP值较高,可能是由于其包含某些活性氨基酸序列,或者具有大量疏水区的肽段特定结构,从而提高抗氧化活性。模拟人体胃肠液消化模式下,能够将海洋鱼骨胶原低聚肽酶解成更小分子质量的肽段,使得一些疏水性基团进一步暴露出来,导致表面疏水性提高,而高含量的疏水性氨基酸或肽通常与较高自由基清除活性有关。
表4 不同处理的海洋鱼骨胶原低聚肽的FRAP值
Table 4 FRAP values of MFBCO treated with different treatments
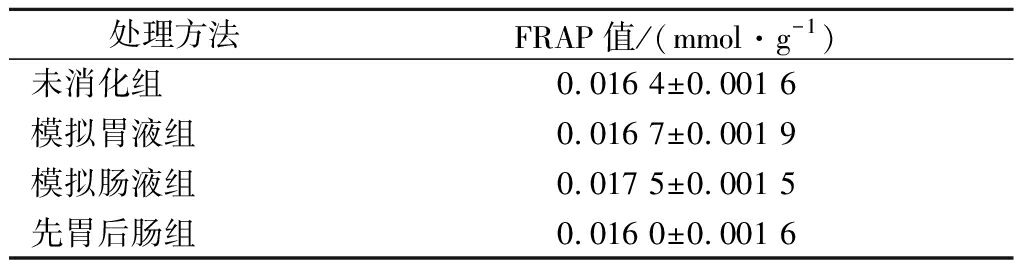
处理方法FRAP值/(mmol·g-1)未消化组0.016 4±0.001 6模拟胃液组0.016 7±0.001 9模拟肠液组0.017 5±0.001 5先胃后肠组0.016 0±0.001 6
2.7 消化前后海洋鱼骨胶原低聚肽的ORAC
不同浓度Trolox标准液的动态荧光衰减曲线如图4所示,由此绘制Trolox标准曲线方程为:y=0.019 5x+1.455 8(R2=0.997 6)。根据标准曲线表达式可得未消化组、模拟胃液组、模拟肠液组以及先胃后肠组,海洋鱼骨胶原低聚肽的ORAC值如图5所示。体外模拟消化显著提高海洋鱼骨胶原低聚肽的ORAC值(P>0.05)。
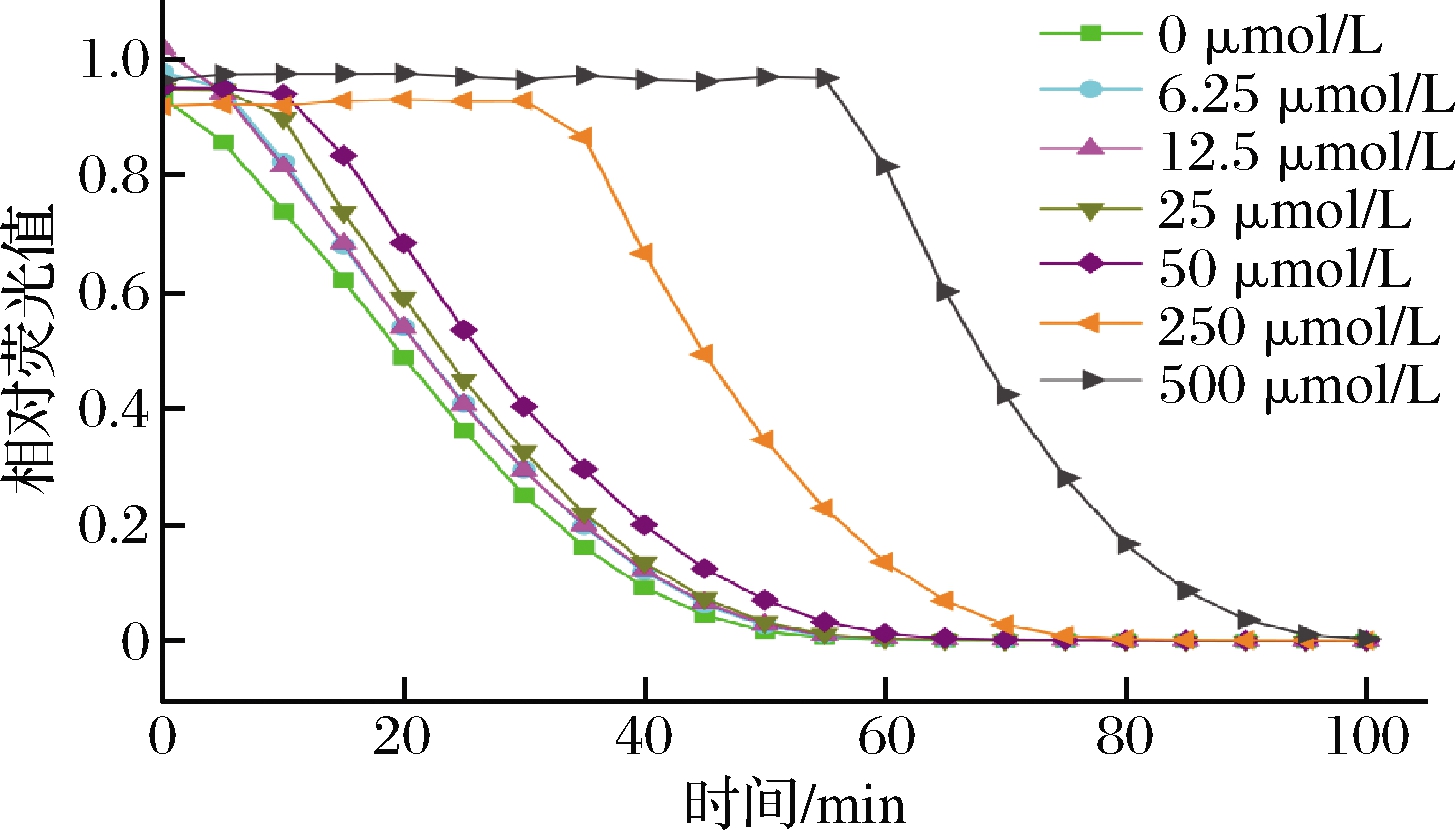
图4 不同浓度Trolox的动态荧光衰减曲线
Fig.4 Dynamic fluorescence attenuation curves of Trolox at different concentrations
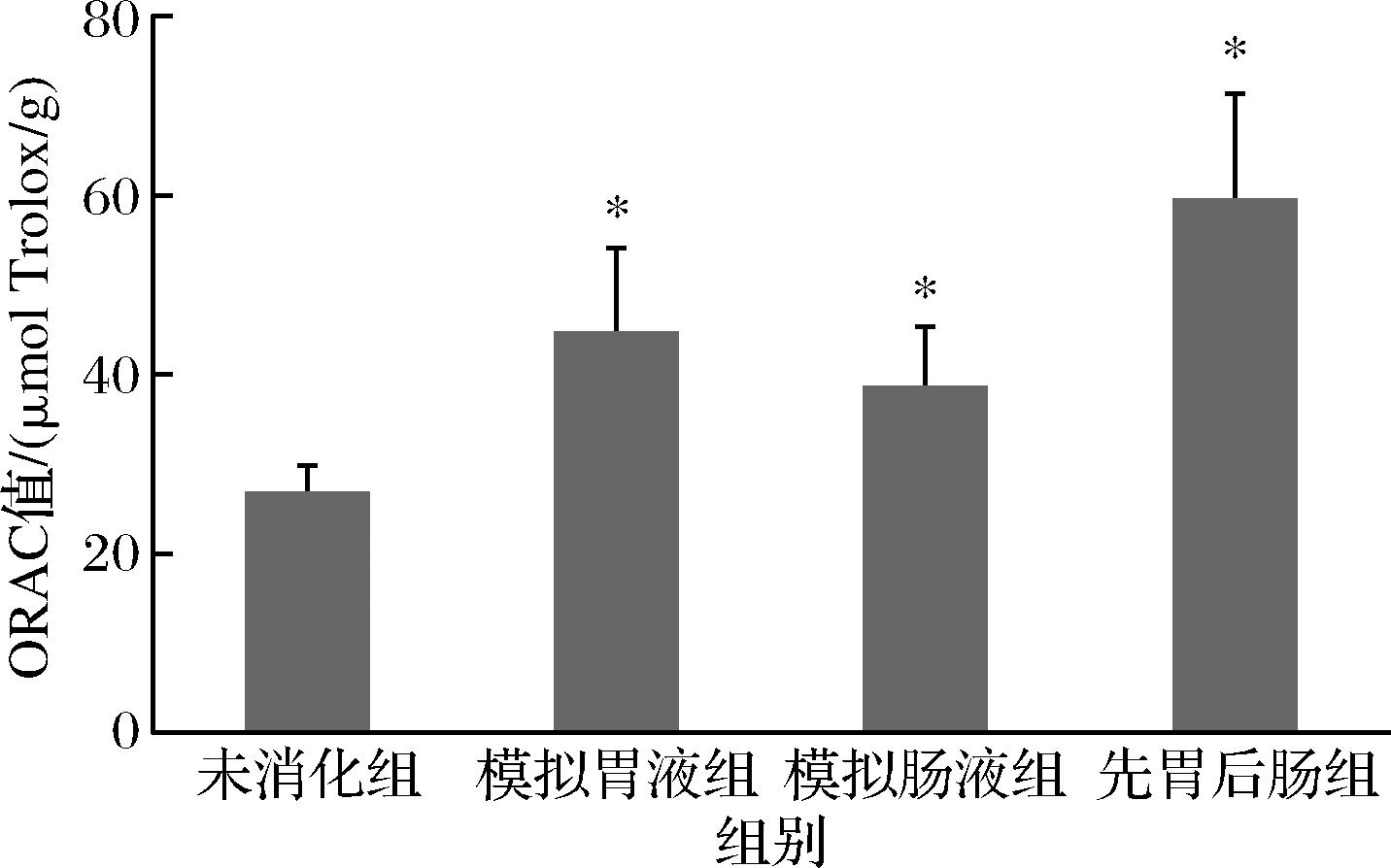
图5 不同处理的海洋鱼骨胶原低聚肽的ORAC值
Fig.5 ORAC values of MFBCO treated with different treatments
推测原因可能是海洋鱼骨胶低聚肽经胃蛋白酶、胰蛋白酶酶解后,暴露出更多活性基团,大大增加与自由基反应的机会,从而增强对自由基的清除能力,有利于进一步提高海洋鱼骨胶原低聚肽的抗氧化活性[21]。已知分子质量较小的肽段往往具有较高的抗氧化活性,吴明泽等[22]以中华圆田螺肉酶解产物为研究对象,证明了分子质量<1 000 u组分的ORAC值显著高于分子质量较大的组分(P<0.05)。本研究中,海洋鱼骨胶原低聚肽经模拟胃、肠液消化处理后分子质量分布范围主要集中于<1 000 u的短肽,这可能与其具有较高的ORAC值有关。
3 结论
通过模拟胃、肠液处理海洋鱼骨胶原低聚肽,分子质量分布结果表明海洋鱼骨胶原低聚肽能够在一定程度上耐受胃肠道中胃蛋白酶和胰蛋白酶作用。紫外全波长扫描结果显示4组样品在275~280 nm处吸收峰有差异,表明海洋鱼骨胶原低聚肽含有酶解特异序列。圆二色光谱结果显示了4组样品的反平行式β-折叠差异显著,同时4组间β-转角、不规则卷曲含量发生了相应的变化,表明了酶解使得海洋鱼骨胶原低聚肽分子间作用力发生改变及肽链构象和结构发生了改变。DPPH自由基清除能力经模拟胰液消化后有一定程度的降低,ABTS阳离子自由基清除能力、FRAP值及ORAC值,三者经模拟胃、肠液处理之后,抗氧化能力或有一定程度的提高或者保持稳定,4个抗氧化指标结果总体表明海洋鱼骨胶原低聚肽的抗氧化活性具有抗消化稳定性。后续将进一步筛选出特定的具有消化稳定性的抗氧化活性肽段,以期为海洋鱼骨胶原低聚肽在新型抗氧化功能食品的开发及应用提供理论基础。
[1] 张新林,谢晶,郝楷,等.不同低温条件下三文鱼的品质变化[J].食品工业科技,2016,37(17):316-321.
ZHANG X L,XIE J,HAO K,et al.Effects of different cold storage conditions on quality of salmon[J].Science and Technology of Food Industry,2016,37(17):316-321.
[2] 徐玉兰,牛洪波.三文鱼多不饱和脂肪酸分析及稳定性研究[J].烟台职业学院学报,2018,24(3):90-92.
XU Y L,NIU H B.Analysis and stability of polyunsaturated fatty acids in salmon[J].Journal of Yantai Vocational College,2018,24(3):90-92.
[3] 刘文颖,任玮,谷瑞增,等.海洋骨胶原低聚肽钙的分离纯化及结构鉴定[J].食品工业科技,2016,37(7):49-51.
LIU W Y,REN W,GU R Z,et al.Separation,purification and structural identification of calcium-chelating marine bone collagen oligopeptides[J].Science and Technology of Food Industry,2016,37(7):49-51.
[4] 刘文颖,姜思萌,林峰,等.海洋骨胶原低聚肽的理化特性及其抗氧化活性[J].食品工业,2014,35(10):197-201.
LIU W Y,JIANG S M,LIN F,et al.Physicochemical characterization and antioxidant activities of marine bone collagen oligopeptides[J].The Food Industry,2014,35(10):197-201.
[5] 刘文颖,谷瑞增,林峰,等.海洋骨胶原低聚肽钙配合物的稳定性[J].食品工业科技,2015,36(4):111-115.
LIU W Y,GU R Z,LIN F,et al.Stability of calcium-chelating marine bone collagen oligopeptides[J].Science and Technology of Food Industry,2015,36(4):111-115.
[6] SETHI S,JOSHI A,ARORA B,et al.Significance of FRAP,DPPH,and CUPRAC assays for antioxidant activity determination in apple fruit extracts[J].European Food Research and Technology,2020,246(3):591-598.
[7] ALMEHIZIA A A,ABUELIZZ H A,TAIE H A A,et al.Investigation the antioxidant activity of benzo[g]triazoloquinazolines correlated with a DFT study[J].Saudi Pharmaceutical Journal,2019,27(1):133-137.
[8] REZANEJAD R,HEIDARIEH M,OJAGH S M,et al.Values of antioxidant activities(ABTS and DPPH)and ferric reducing and chelating powers of gamma-irradiated rosemary extract[J].Radiochimica Acta,2020,108(6):477-482.
[9] ZHANG H,YANG Y F,ZHOU Z Q.Phenolic and flavonoid contents of mandarin(Citrus reticulata Blanco)fruit tissues and their antioxidant capacity as evaluated by DPPH and ABTS methods[J].Journal of Integrative Agriculture,2018,17(1):256-263.
[10] AMJADI A,MIRMIRANPOUR H,SOBHANI S O,et al.Intravenous laser wavelength radiation effect on LCAT,PON1,catalase,and FRAP in diabetic rats[J].Lasers in Medical Science,2020,35(1):131-138.
[11] BIER M C J,MEDEIROS A B P,DE KIMPE N,et al.Evaluation of antioxidant activity of the fermented product from the biotransformation of R-(+)-limonene in solid-state fermentation of orange waste by Diaporthe sp[J].Biotechnology Research and Innovation,2019,3(1):168-176.
[12] 杜枘宣.牛乳酪蛋白胃肠水解多肽检测及其Caco-2细胞吸收模型建立[D].西安:陕西科技大学,2016.
DU R X.Detection of gastrointestinal hydrolysis from milk casein and its absorption through Caco-2 monolayer cell model[D].Xi'an:Shaanxi University of Science & Technology,2016.
[13] ZHANG Q Z,TONG X H,QI B K,et al.Changes in antioxidant activity of alcalase-hydrolyzed soybean hydrolysate under simulated gastrointestinal digestion and transepithelial transport[J].Journal of Functional Foods,2018,42:298-305.
[14] 曹红翠.紫外分光光度法测定蛋白质的含量[J].广东化工,2007,34(8):93-94;84.
CAO H C.Determination of content in proteins by UV spectrophotometric[J].Guangdong Chemical Industry,2007,34(8):93-94;84.
[15] LIARDONY R,JOST R.Racemization of free and protein-bound amino acids in strong mineral acid[J].International Journal of Peptide and Protein Research,1981,18(5):500-505.
[16] ZHU L J,CHEN J,TANG X Y,et al.Reducing,radical scavenging,and chelation properties of in vitro digests of alcalase-treated zein hydrolysate[J].Journal of Agricultural and Food Chemistry,2008,56(8):2 714-2 721.
[17] 李茹,朱毅.体外模拟胃、肠消化对萝卜苗中活性物质、抗氧化功能及代谢差异物的影响[J].中国食品学报,2019,19(4):61-71.
LI R,ZHU Y.Effect of simulated gastrointestinal digestion in vitro on active substances,antioxidant function and differential metabolites of radish sprouts[J].Journal of Chinese Institute of Food Science and Technology,2019,19(4):61-71.
[18] 顾敏.青养蛋白抗氧化肽的分离纯化及胃肠道消化特性研究[D].广州:华南理工大学,2014.
GU M.Purification of antioxidant peptides from frog(Hylarana guentheri)protein hydrolysate and the properties of peptides during gastroinstinal digestion[D].Guangzhou:South China University of Technology,2014.
[19] PRIOR R L,WU X L,SCHAICH K.Standardized methods for the determination of antioxidant capacity and phenolics in foods and dietary supplements[J].Journal of Agricultural and Food Chemistry,2005,53(10):4 290-4 302.
[20] SILVA F G D E,HERN NDEZ L B,AMIGO L,et al.Identification of peptides released from flaxseed(Linum usitatissimum)protein by alcalase hydrolysis:Antioxidant activity[J].LWT-Food Science and Technology,2017,76:140-146.
NDEZ L B,AMIGO L,et al.Identification of peptides released from flaxseed(Linum usitatissimum)protein by alcalase hydrolysis:Antioxidant activity[J].LWT-Food Science and Technology,2017,76:140-146.
[21] ARCAN ![]() A.Antioxidant activity of protein extracts from heat-treated or thermally processed chickpeas and white beans[J].Food Chemistry,2007,103(2):301-312.
A.Antioxidant activity of protein extracts from heat-treated or thermally processed chickpeas and white beans[J].Food Chemistry,2007,103(2):301-312.
[22] 吴明泽,王笑,胡祥昊,等.中华圆田螺肉抗氧化肽的分离纯化及小鼠体内外活性研究[J].食品与机械,2019,35(12):151-157.
WU M Z,WANG X,HU X H,et al.Purification of antioxidant peptides from the meat of Oncomelania sinensis and its in vivo and in vitro of mice activity[J].Food and Machinery,2019,35(12):151-157.