2019年底爆发了全球性公共卫生事件“COVID-19”,有关研究表明,新型冠状病毒可消耗淋巴细胞,导致机体免疫功能紊乱[1],而提高免疫力有助于降低“新冠”、“流感”等流行性、传染性疾病的得病率,这让人们深刻意识到增强免疫力的重要性[2]。因此,为满足临床需要,开发具有提高免疫功能新的健康食品或治疗药物,具有一定的实用价值和可观的市场前景。
近年来,中医认为免疫疾病的致病因素之一是由人体阴阳失衡导致[3]。在中医药理论的指导下,以药食同源中药为主要原料,以改善人民健康状况、提升人民健康水平为目标的新资源功能性饮品的研发,受到了更多人的关注[4]。而人参和牡蛎均为我国传统的药食两用资源[5-6]。据《理虚元鉴》记载:人参大补元气,冲和粹美,不偏不倚,故在阴补阴,在阳补阳,能温能清,可升可降[7]。牡蛎为介质之属,生于池泽,潜伏于潭泽泥沼中,秉阴气日久,其味咸性寒,归肝肾经,入少阴,取象比类,属阴药范畴[8]。根据药对配伍原则:阴阳相配、寒热互补,或刚柔并济、升降同调,或补泻兼施、散敛并投,将人参与牡蛎二者进行组方开发,具有非加总效应[9]。人参与牡蛎中肽类成分因其分子质量小于蛋白质而具有更高的生物利用度,又因其多具有独特的生物活性而备受关注[10-11]。
因此,本实验以人参中人参糖肽、牡蛎中牡蛎低聚肽为原料,考察二者不同配比下对免疫功能的调节作用,从而明确人参牡蛎复合肽固体饮料中主要功能性成分的组成比例,在此基础上,以白砂糖等为辅料,通过感官评价确定最佳产品配方,以期得到一款能够提高机体免疫力、营养互补并具有独特风味和口感的新型固体饮料。
1 材料与方法
1.1 材料与试剂
人参糖肽,长春中医药大学中药资源开发实验室自制(纯度>85%);牡蛎低聚肽,编号:S53609,批号:YF20101441Z,厦门中坤食品有限公司;BALB/c小鼠,SPF级,体重18~21 g,雌性,许可证号为SCXK(辽)2020-0001,辽宁长生生物技术有限公司;环磷酰胺注射液,规格200 mg/支,Baxter Oncilogy Gat;香菇菌多糖片,规格15 mg/片(批号:2001-0104),开封制药(基团)有限公司;DNFB,Macklin;RPM1I640完全培养液,Gibco;YAC-1,中国科学院上海细胞库;乙二胺四乙酸二钾、印度墨汁、Na2CO3,上海源叶生物科技有限公司;Hank′s液、硝基氯化四氮唑、吩嗪二甲酯硫酸盐、氧化型辅酶Ⅰ、0.2 mol/L的Tris-HCl缓冲液、2.5%Triton,Solarbio;白砂糖,食品级,四川康百瑞生物科技有限公司;柠檬提取物、橙子提取物、草莓提取物、水蜜桃提取物、薄荷提取物,食品级,西安瑞盈生物科技有限公司;其他试剂,分析纯。
1.2 主要仪器与设备
XT200i型动物全血细胞分析仪,Sysmex;LS-CO150型CO2培养箱,Themo Fisher Scientific;LC-20A型高效液相色谱仪,SHIMADZU。
1.3 实验方法
1.3.1 主要原料配比的免疫力功能筛选
1.3.1.1 动物造模、分组及给药
将适应性饲养1周的210只BALB/c小鼠分为3批,每批70只,每批小鼠随机分7组(n=10)∶空白对照组(blank)、阳性对照组[香菇菌多糖片,20 mg/(kg·d),PC]、模型对照组[环磷酰胺,50 mg/(kg·d),model]、m(人参糖肽)∶m(牡蛎低聚肽)=1∶1低剂量组[140 mg/(kg·d),GO1-L]、m(人参糖肽)∶m(牡蛎低聚肽)=1∶1高剂量组[420 mg/(kg·d),GO1-H]、m(人参糖肽)∶m(牡蛎低聚肽)=1∶3低剂量组[280 mg/(kg·d),GO3-L]、m(人参糖肽)∶m(牡蛎低聚肽)=1∶3高剂量组[840 mg/(kg·d),GO3-H],各组连续灌胃给予受试物30 d,空白对照组与模型组给予等体积生理盐水。在第3周后开始以50 mg/(kg·d)的剂量隔天腹腔注射环磷酰胺,共注射5次,建立小鼠免疫力低下模型。实验结束后,颈椎脱臼法处死小鼠,分别进行免疫器官指数、小鼠碳廓清实验、迟发型变态反应、外周血白细胞总数及NK细胞活性测定实验。
1.3.1.2 外周白细胞总数测定
以摘除小鼠眼球的方法采集全血,24 h内以全血细胞分析仪检测白细胞总数。
1.3.1.3 小鼠碳廓清实验
将小鼠称重,以0.1 mL/10 g的注射量将生理盐水稀释4倍的印度墨汁注入小鼠尾静脉。注入墨汁后,立刻计时,在2和10 min分别从内眦静脉丛取血20 μL,立即加至2 mL Na2CO3溶液中,在酶标仪600 nm处测吸光度,以Na2CO3溶液为空白对照。用颈椎脱臼法处死小鼠,取肝脏、脾脏和胸腺,用滤纸吸干脏器表面血污,称量。一般以校正的吞噬指数a表示小鼠碳廓清能力,吞噬指数a的计算如公式(1)所示,廓清指数K的计算如公式(2)所示:
(1)
(2)
式中:a,吞噬指数;K,廓清指数;A1,2 min的吸光度;A2,10 min的吸光度;T1=2,min;T2=10,min。
1.3.1.4 小鼠迟发型变态反应(delayed type hypersensitivity,DTH)
用脱毛膏将每只小鼠腹部皮肤脱毛约1 cm×1 cm,用2,4-二硝基氟苯(2,4-dinitrofluorobenzene,DNFB)溶液50 μL均匀涂抹致敏,5 d后用DNFB溶液10 μL均匀涂抹于小鼠右耳(两面)进行攻击,放回笼子,24 h后用颈椎脱臼法处死小鼠,以左右耳重的差值作为迟发型超敏反应值。
1.3.1.5 NK细胞活性测定
实验前24 h将新鲜的且存活率应大于95%的靶细胞(YAC-1细胞)进行传代培养。应用前以Hank's液洗3次,用RPMI1640完全培养液调整细胞浓度为4×105个/mL。将每只小鼠颈椎脱臼处死,无菌取脾,置于盛有适量无菌 Hank’s液的小平皿中,用镊子轻轻将脾磨碎,制成单细胞悬液。用Hank’s液洗2次,1 000 r/min离心10 min,弃上清液。细胞沉淀加入红细胞裂解液,再加入Hank’s液,1 000 r/min离心10 min,用1 mL含10%小牛血清的RPMI1640完全培养液重悬,最后用RPMI1640完全培养液调整细胞浓度为2×107个/mL。取靶细胞和效应细胞各100 μL(效靶比50∶1),加入U型96孔培养板中;靶细胞自然释放孔加靶细胞和培养液各100 μL,靶细胞最大释放孔加靶细胞和2.5%Triton各100 μL;上述各项均设3个复孔,于37 ℃、5% CO2培养箱中培养4 h,然后将96孔培养板1 500 r/min离心5 min,每孔吸取上清液100 μL置平底96孔培养板中,同时加入LDH基质液100 μL,反应3 min,每孔加入30 μL 1 mol/L的比溶液,在酶标仪490 nm处测定吸光度,NK细胞活性计算如公式(3)所示:
NK细胞活性![]()
(3)
式中:A反应,反应孔吸光度;A自然,自然释放孔吸光度;Amax,最大释放孔吸光度。
1.3.2 以感官评分为评价指标优化配方
1.3.2.1 饮料制备的工艺流程
配料→过筛→混合→制粒→感官评价→包装→成品。
1.3.2.2 配方组成的确定
根据国家食品安全规定,人参的每日最大服用量不超过3 g,人参糖肽的提取率按照20%计算,人参糖肽每日最大服用量约0.6 g,故配方中初步确定人参糖肽的用量为0.5 g;根据药理学实验筛选的主要功能成分的最佳配比,即可确定牡蛎低聚肽配方含量。
在主成分含量确定的前提下,分别研究白砂糖添加量(0、1、3、5、7、9 g)、不同种类调味剂[柠檬提取物、橙子提取物、草莓提取物、水蜜桃提取物、薄荷提取物(各添加量2 g)]、最佳调味剂添加量(0、1、3、5、7、9 g)对饮料感官评价的影响。产品的感官评价是取适量样品颗粒,加入100 mL约30~50 ℃的温开水,使其充分溶解,请15名经验丰富的食品专业人员分别对各份饮品的色泽、组织形态、风味、口感4个方面进行感官评价,其具体评价标准见表1,满分为100分,样品最后得分为去掉最高分和最低分的平均分。
表1 感官评价表
Table 1 Sensory evaluation standard
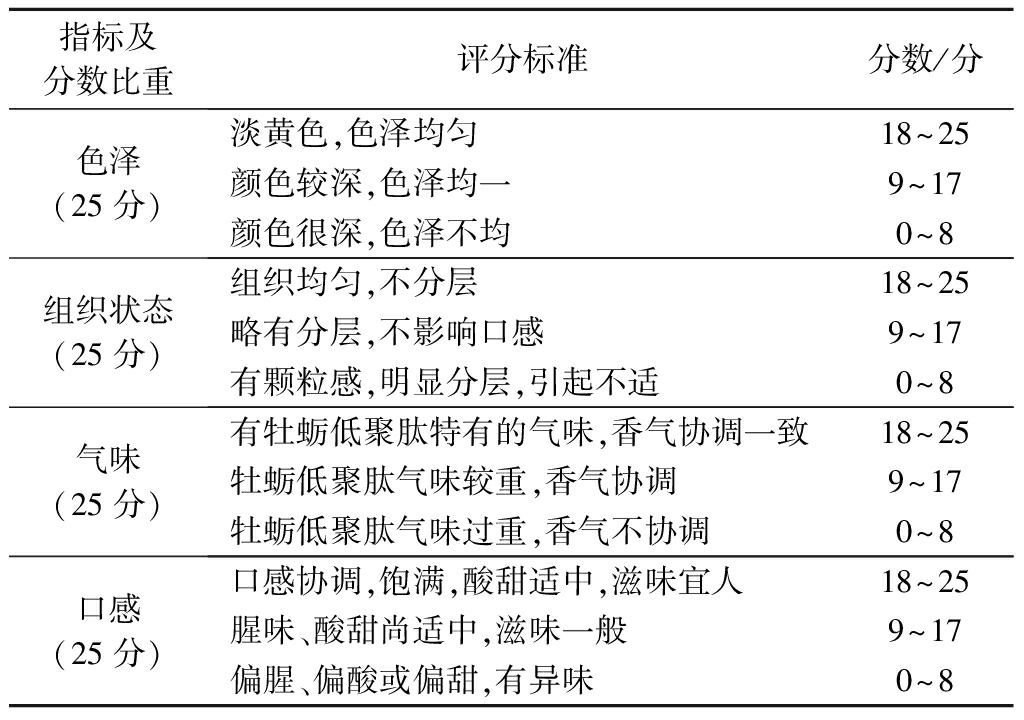
指标及分数比重评分标准分数/分色泽(25分)淡黄色,色泽均匀18~25颜色较深,色泽均一9~17颜色很深,色泽不均0~8组织状态(25分)组织均匀,不分层18~25略有分层,不影响口感 9~17有颗粒感,明显分层,引起不适 0~8气味(25分)有牡蛎低聚肽特有的气味,香气协调一致18~25牡蛎低聚肽气味较重,香气协调9~17牡蛎低聚肽气味过重,香气不协调0~8口感(25分)口感协调,饱满,酸甜适中,滋味宜人18~25腥味、酸甜尚适中,滋味一般9~17偏腥、偏酸或偏甜,有异味0~8
1.3.3 饮料主要功能成分的测定
蛋白质检测参照GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》第一法凯氏定氮法;多糖含量测定采用苯酚-硫酸法[12]。
1.3.4 数据统计
免疫学实验数据采用t检验法进行统计学分析,使用GraphPad Prism 7.0软件进行组间比较,数据以(x±SD)的形式表示,P<0.05为差异显著,P<0.01为差异极显著,P>0.05为差异不显著;单因素试验数据采用Excel软件进行统计分析,并通过Origin 2019软件作图。
2 结果与分析
2.1 不同配比的人参牡蛎复合肽增强免疫力功能实验
2.1.1 外周血白细胞总数测定实验结果
白细胞是参与免疫应答的血细胞,白细胞总数及各种白细胞百分比会因产生炎症或疾病而变化,因此白细胞数是评价免疫作用的重要标准之一[13]。model组白细胞计数明显低于blank组(图1-a,P<0.01)。与model组相比,4个不同配比的人参牡蛎复合肽组(GO1-L、GO1-H、GO3-L、GO3-H)均可使小鼠外周血白细胞数显著或极显著提高(P<0.05,P<0.01);4组配比组间相比,外周血白细胞数为GO1-L组≈GO1-H组>GO3-L组≈GO3-H组;GO1-L组与GO1-H组相比无显著性差异(P>0.05),GO3-L组与GO3-H组相比亦无显著性差异(P>0.05);GO1-L组与GO3-L组相比组间差异显著(P<0.01),GO1-H组与GO3-H组相比亦有差异显著。本实验中环磷酰胺可使小鼠的白细胞计数显著降低,使小鼠免疫功能下降。不同配比的人参牡蛎复合肽均能够促进环磷酰胺引起的免疫抑制小鼠白细胞的形成,提高机体免疫力作用,且低配比的人参牡蛎复合肽的效果更明显。
2.1.2 小鼠体重及免疫器官指数实验结果
如表2所示,灌胃给予不同配比的人参牡蛎复合肽30 d,不会导致小鼠死亡,与blank组相比体重无显著降低;表明人参牡蛎复合肽不会对小鼠产生毒性作用;与blank组相比,model组脾脏和胸腺指数均有显著或极显著下降(P<0.01);给药组与model组相比,免疫器官指数均有明显提高(P<0.01)。脾脏和胸腺作为外周免疫器官和中枢免疫器官,是参与免疫反应的主要场所。免疫器官指数的变化可以初步确定药物对免疫器官以及免疫调节是否具有影响[14]。本实验中不同配比的人参牡蛎复合肽能够在一定程度上逆转环磷酰胺所致的小鼠的免疫器官指数的下降,提示不同配比的人参牡蛎复合肽对两大免疫器官具有保护作用。
表2 小鼠体重及免疫器官指数实验结果(x±SD,n=10)
Table 2 Experimental results of mouse body weight and immune organ index(x±SD,n=10)
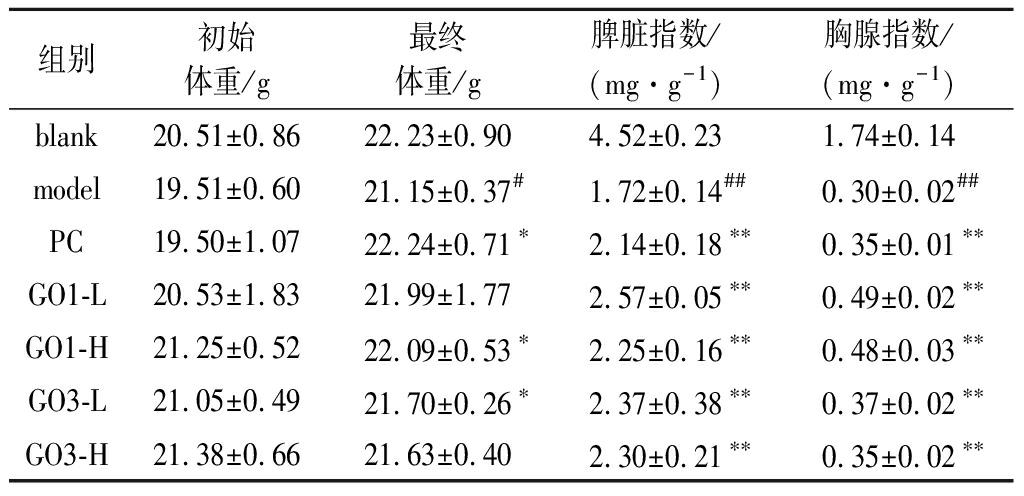
组别初始体重/g最终体重/g脾脏指数/(mg·g-1)胸腺指数/(mg·g-1)blank20.51±0.8622.23±0.904.52±0.231.74±0.14model19.51±0.6021.15±0.37#1.72±0.14##0.30±0.02##PC19.50±1.0722.24±0.71∗2.14±0.18∗∗0.35±0.01∗∗GO1-L20.53±1.8321.99±1.772.57±0.05∗∗0.49±0.02∗∗GO1-H21.25±0.5222.09±0.53∗2.25±0.16∗∗0.48±0.03∗∗GO3-L21.05±0.4921.70±0.26∗2.37±0.38∗∗0.37±0.02∗∗GO3-H21.38±0.6621.63±0.402.30±0.21∗∗0.35±0.02∗∗
注:脏器指数,脏器质量/体质量。经t检验,与blank组比较,#P<0.05、##P<0.01;与Model组比较,*P<0.05、** P<0.01
2.1.3 碳廓清实验结果
血液中的单核-巨噬细胞系统具有对进入体内的异物吞噬清除的功能,许多免疫调节因子根据巨噬细胞的活性来激活免疫反应,因此可通过吞噬率来反映单核-巨噬细胞系统的功能[15-16]。从图1-b可以看出,与blank相比,model组免疫抑制小鼠碳廓清吞噬指数显著降低(P<0.05)。与model组相比,4个不同配比的人参牡蛎复合肽组(GO1-L、GO1-H、GO3-L、GO3-H)的小鼠碳廓清的吞噬指数均极显著提高(P<0.01);4组配比组间相比,吞噬指数为GO1-L组≈GO1-H组>GO3-L组≈GO3-H组;相同配比之间,不同计量相比无显著性差异(P>0.05);不同配比之间,同剂量相比差异显著(P<0.01)。本实验中不同配比的人参牡蛎复合肽能够在一定程度上增强小鼠单核-巨噬细胞功能,提高小鼠的非特异性免疫应答水平。且1∶1配比的效果要明显好于1∶3的配比,提示人参牡蛎复合肽的吞噬能力可能与配比和剂量有关。
2.1.4 DTH实验结果
DTH是一种由T细胞介导的炎症免疫反应,DTH需要被激活的T淋巴细胞特异性识别特定抗原,从而增殖并释放细胞因子[17-18]。根据迟发型变态反应耳肿胀试验的结果(图1-c),model组与blank相比,model组DTH程度极显著降低(P<0.01)。与model组相比,4个不同配比的人参牡蛎复合肽组(GO1-L、GO1-H、GO3-L、GO3-H)的小鼠DTH程度均显著或极显著增加(P<0.01);4组配比组间相比,DTH程度为GO1-L组≈GO1-H组>GO3-L组≈GO3-H组;与GO1-H组相比,GO1-L组无明显变化(P>0.05),与GO3-L组相比,GO3-H组DTH程度均极显著提高(P<0.01);GO1-L组与GO3-L组、GO1-H组与GO3-H组相比均有极显著差异(P<0.01)。在本研究中,使用DNFB作为抗原诱导的耳部DTH反应来评估人参糖肽复合物在机体细胞免疫功能的状况。实验观察到,不同配比的人参牡蛎复合肽均能够在一定程度上改善环磷酰胺对DTH反应的抑制作用,增强环磷酰胺处理的小鼠细胞介导的免疫功能,结果提示,低剂量、低配比的人参牡蛎复合肽可能对细胞免疫增强效果更好。
2.1.5 NK细胞活性测定实验结果
NK细胞是天然免疫系统中的重要组成部分,是机体抗肿瘤、抗感染的一种重要免疫细胞[19]。如图1-d所示,与blank相比,model组NK细胞活性极显著降低(P<0.01)。与model组相比,4个不同配比的人参牡蛎复合肽组(GO1-L、GO1-H、GO3-L、GO3-H)的小鼠NK细胞活性均显著提高;4组配比组间相比,NK细胞活性为GO1-L组≈GO1-H组>GO3-L组≈GO3-H组;相同比例的人参牡蛎复合肽组间差异不明显,但不同比例的人参牡蛎复合肽组间差异极显著(P<0.01)。

a-白细胞计数;b-碳廓清实验;c-迟发型变态反应;d-NK细胞活性
图1 不同比例的人参牡蛎复合肽固体饮料对白细胞计数、碳廓清实验、迟发型变态反应、NK细胞活性的影响
Fig.1 Effects of different proportions of ginseng and oyster composite peptide solid beverages on white blood cell count,carbon clearance test,delayed type hypersensitivity and NK cell activity
注:测定值为x±SD,n=10;与blank组比较,##P<0.01、#P<0.05;与model组比较**P<0.01、*P<0.05;与GO1-H组比较,§§ P<0.01、ns P>0.05;与GO3-L组比较,△△ P<0.01、△P>0.05
本文采用LDH法测定环磷酰胺诱导的免疫抑制小鼠NK细胞活性。结果说明不同配比的人参牡蛎复合肽均能够在一定程度上增加NK细胞的活力,且效果与临床常用免疫促进剂药香菇菌多糖相似。因此,人参牡蛎复合肽可能通过促进环磷酰胺诱导免疫低下小鼠体内NK细胞活性来调节免疫反应,且其作用效果随配比的降低而增强。
2.2 配方组成结果与分析
2.2.1 白砂糖添加量对产品感官评价的影响
由图2可知,白砂糖添加量为0 g时感官评分相对较低,随着白砂糖添加量的增加,固体饮料甜味加强,感官评价分数亦逐渐升高,当添加量为3 g时感官评分达到最高,但继续增加至9 g时,固体饮料的感官评分不断下降,推测由于白砂糖的添加量过大,致使饮料口感过甜、欢迎度下降。

图2 白砂糖的添加量对产品感官评价的影响
Fig.2 Effect of the amount of sucrose added on the sensory evaluation of the product
注:测定值为(x±SD),(n=3)(下同)
2.2.2 不同种类调味剂对产品感官评价的影响
由图3可知,加入柠檬提取物的感官评分明显高于草莓提取物、水蜜桃提取物、橙子提取物、水蜜桃提取物、薄荷提取物的感官评价,因此可选用柠檬提取物做调味剂,原因可能是由于柠檬其特有酸味,可以去牡蛎的腥味,但又不失海鲜的原味[20],因此获得人们的喜爱。
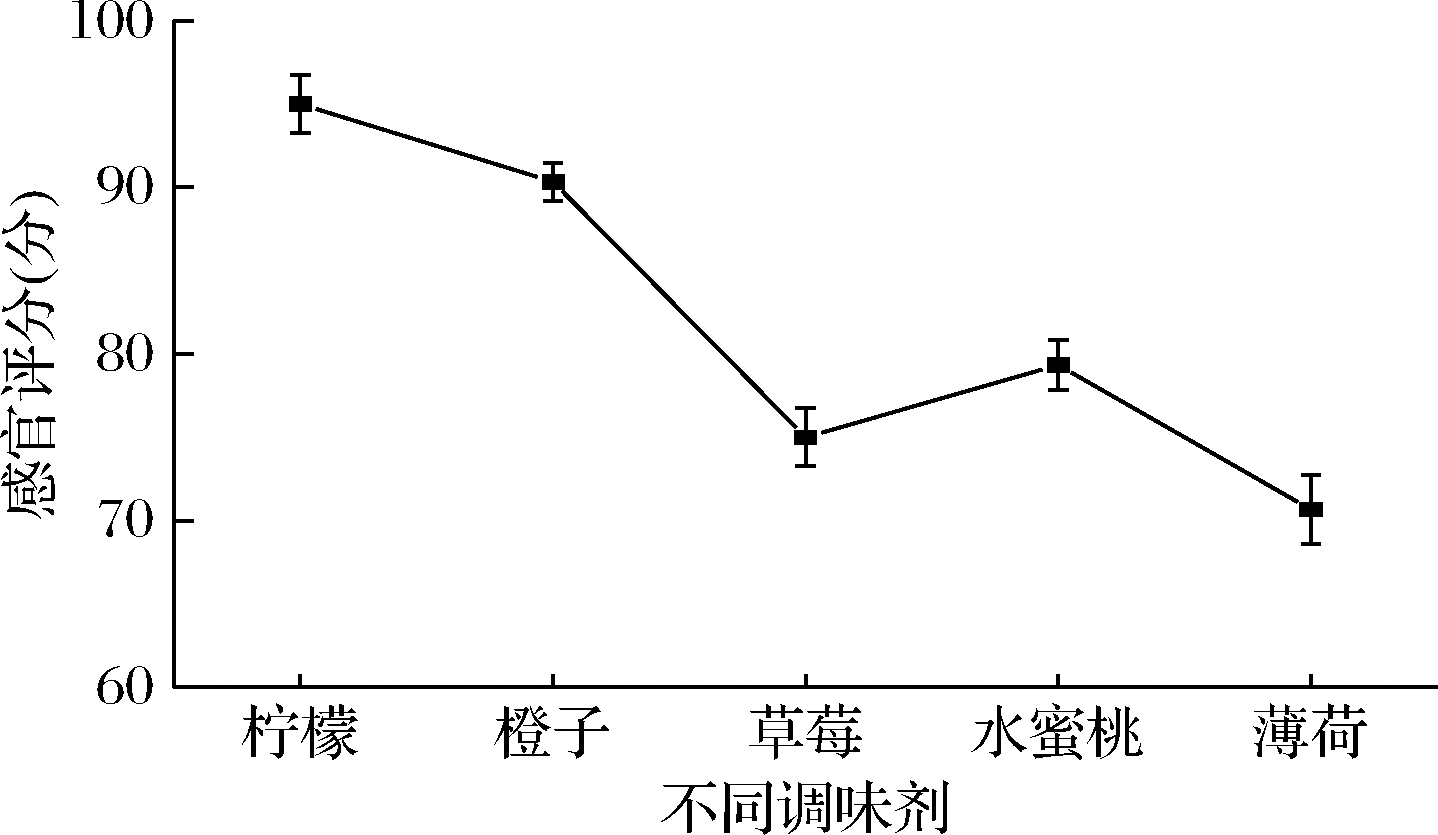
图3 不同种类调味剂对产品感官评价的影响
Fig.3 Effect of different flavorant on the sensory evaluation of products
2.2.3 柠檬提取物添加量对产品感官评价的影响
由图4可知,随着柠檬提取物添加量的增加,产品的感官评分呈先增加后降低的趋势,在添加量为3 g时口感最好,感官评分最高,但由于在考察不同种类调味剂对产品感官评价的影响时,选取的2 g柠檬提取物感官评分高于3 g添加量,因此2 g柠檬提取物为最佳添加量,推测由于柠檬提取物添加量不断增加,导致饮料越来越酸,过酸的口感给人带来不适。
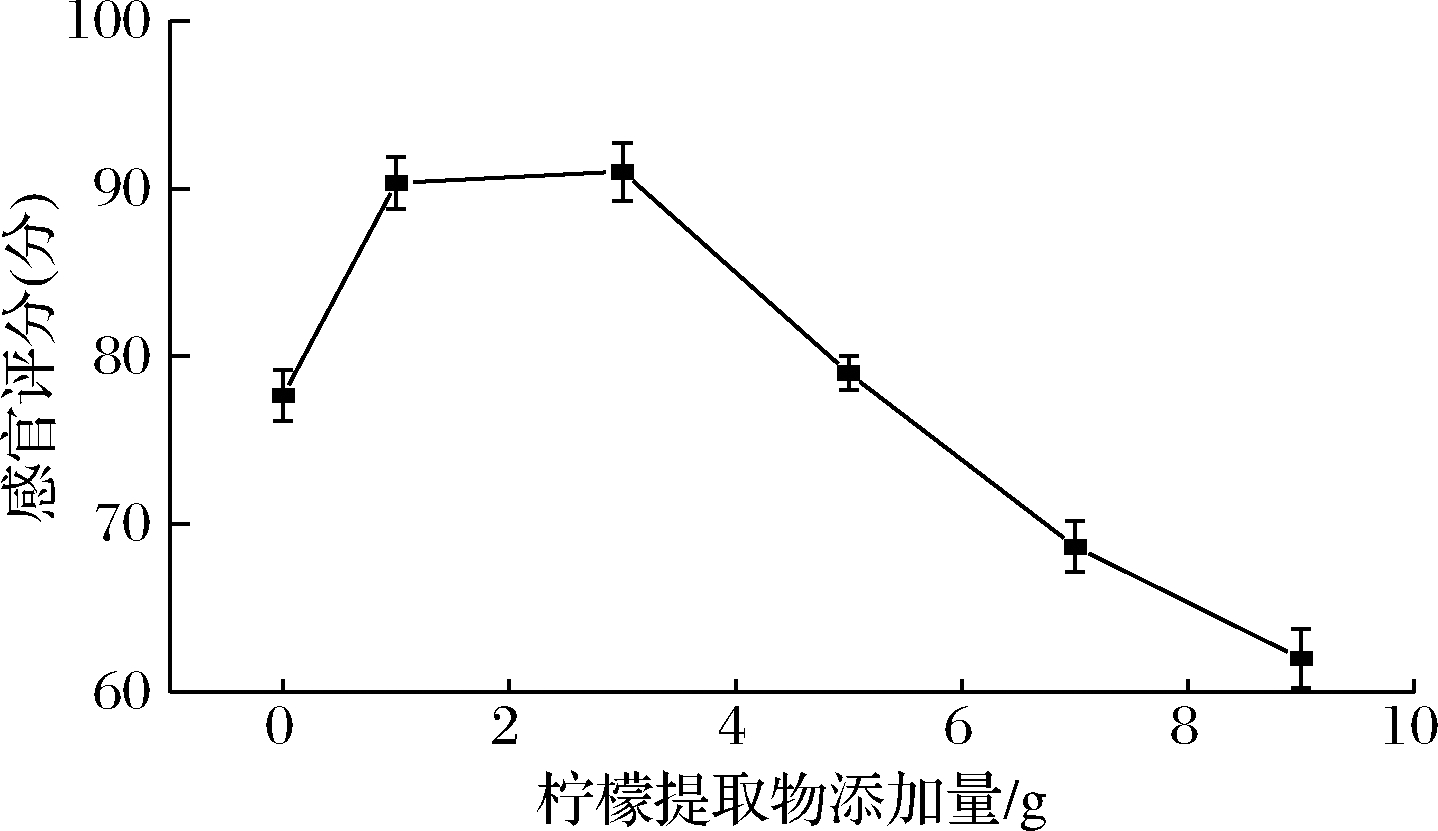
图4 柠檬提取物的添加量对产品感官评价的影响
Fig.4 Effect of lemon extract concentration on the sensory evaluation of the product
2.2.4 实验结果验证
通过单因素试验结合药理实验结果可知,本产品的最佳配方为人参糖肽为0.5 g、牡蛎低聚肽为0.5 g、白砂糖添加量为3 g、柠檬提取物添加量为2 g,在此条件下,经过3次重复性实验验证,感官评定平均综合评分为94.7分。
2.2.5 饮料主要功能成分的测定结果
对人参牡蛎复合肽固体饮料进行3次重复性实验,测得饮料的蛋白质含量为8.11 g/100 g,多糖含量为59.33 g/100 g。
3 讨论
药食同源是指国家卫生部公布的《按照传统既是食品又是中药材物质目录》中的原料,其既具丰富营养成分,也具药用保健功效。其常被应用到功能性饮料的开发中,为我国功能性饮料的发展起到巨大推动作用。近年来,由于植物源功能多肽的结构、制备方法以及药理作用的研究得到快速发展,多肽的保健功能作用亦愈发清晰,因而开发了众多新型多肽,如榛仁肽、大豆肽等,其中部分功能多肽已用于功能饮料产品的开发。目前,我国功能饮料市场正处于高速发展期,在可以满足消费者对于功能饮料的口味多样化、品类丰富化、原料健康化多样化的需求的同时,又可满足功能性的需求,将成为功能饮料未来发展中亟待解决的关键点[21-24]。
因此,通过对人参与牡蛎中肽类成分建立环磷酰胺致免疫低下模型,筛选出原料的最佳配比,采用单因素试验以感官评分为评价指标优化配方。综合考虑主要原料不同配比的实验结果,可发现不同配比的人参牡蛎复合肽成功地提高了环磷酰胺诱导的免疫抑制小鼠的免疫器官指数和NK细胞活性,改善了细胞免疫和单核-巨噬细胞功能,以上5个指标的实验结果皆显示比例为1∶1的效果更明显,基于中医学基础理论分析,推测原因可能是由于牡蛎属于阴药范畴[8],当牡蛎低聚肽的添加量过多时,导致阴阳失衡,致使人参牡蛎复合肽的吞噬能力随着给药浓度的增加和配比的增大而降低,并且由于1∶1低剂量组与高剂量组效果差距不大。因此可选用人参糖肽∶牡蛎低聚肽=1∶1低剂量组作为饮料的配方。基于原料的配比,本着0添加、纯天然、原生态的配方理念,致使本实验自变量较少,通过单因素试验即可满足配方筛选需求,由单因素结果可知,白砂糖添加量、不同种类调味剂及最佳调味剂添加量对饮料感官评价的影响较明显,且最终得到的最佳配比为人参糖肽:0.5 g、牡蛎低聚肽:0.5 g、白砂糖:3 g、柠檬提取物:2 g。本产品的研发将对人参、牡蛎系列食品的开发具有重要意义,同时填补了人参、牡蛎食品市场的空缺,具有良好的开发前景。
4 结论
通过建立小鼠免疫功能低下模型,考察原料对小鼠细胞免疫功能、单核-巨噬细胞吞噬功能和NK细胞活性的影响,以及选取白砂糖添加量、不同种类调味剂、最佳调味剂添加量对产品感官评价的影响的单因素试验。根据统计学分析和图形分析,获得人参牡蛎复合肽固体饮料的最佳配比为人参糖肽0.5 g、牡蛎低聚肽0.5 g、白砂糖3 g、柠檬提取物2 g。在此条件下,得到感官评分94.7分。采用人参糖肽和牡蛎低聚肽为主要原料可以制作出营养、保健性能均佳的新型固体饮料,具有较高的推广价值。
[1] 张乐,张艳,夏加伟,等.COVID-19患者急性期血常规和免疫指标变化对疾病评估的意义[J].中国急救医学,2020,40(5):377-381.
ZHANG L,ZHANG Y,XIA J W,et al.The significance of changes in blood routine and immune indexes in patients with COVID-19 in acute phase for disease evaluation[J].Chin J Crit Care,2020,40(5):377-381.
[2] 李锦成,刘民,刘珏.全球自然感染SARS-CoV-2人群的抗体水平研究[J].中国全科医学,2021,24(10):1 173-1 178.
LI J C,LIU M,LIU J.Antibody responses to SARS-CoV-2 in naturally infected population worldwide[J].Chinese General Practice,2021,24(10):1 173-1 178.
[3] 徐晓楠,方钰发,王妍.中医阴阳与免疫的关系初探[J].四川中医,2019,37(2):25-27.
XU X N,FANG Y F,WANG Y.Discussing on the relationship between yin and yang of traditional chinese medicine and immunity[J].Journal of Sichuan of Traditional Chinese Medicine,2019,37(2):25-27.
[4] 刘长喜.我国保健食品的理论与实践研究[D].北京:中国中医科学院,2006.
LIU C X.Study on theory and practice of health food in China[D].Beijing:China Academy of Chinese Medical Sciences,2006.
[5] 祁玉丽.人参多糖对肠道微生态及肠黏膜免疫作用的研究[D].长春:吉林农业大学,2019.
QI Y L.Effects of ginseng polysaccharides on intestinal microecology and mucosal immunity[D].Changchun:Jilin Agricultural University,2019.
[6] 邱娟,沈建东,翁凌,等.利用牡蛎制备ACE抑制肽的工艺优化[J].食品科学,2017,38(16):165-172.
QIU J,SHEN J D,WENG L,et al.Optimization of preparation of angiotensin-Ⅰconverting enzyme(ACE)inhibitory peptides derived from pacific oyster(Crassostrea gigas)[J].Food Science,2017,38(16):165-172.
[7] 刘敏.基于古今药方纵横的人参应用配伍及研究[D].济南:山东中医药大学,2009.
LIU M.The application and compatibility study based on the survey of traditional and modern prescription containing renshen(Panax ginseng C.A.Mey root)[D].Jinan:Shandong University of Traditional Chinese Medicine,2009.
[8] 吴振华,姚鹏宇,程广清.叶天士治疗不寐对药撷英[J].湖北中医杂志,2020,42(8):24-27.
WU Z H,YAO P Y,CHENG G Q.Ye Tianshi’s experience in treating insomnia with chinese medicine pair[J].Hubei Journal of Traditional Chinese Medicine,2020,42(8):24-27.
[9] 陈洁,姚树坤,肖琨珉,等.姚树坤运用药对治疗消化系统疾病经验采菁[J].中日友好医院学报,2020,34(1):46-47.
CHEN J,YAO S K,XIAO K M,et al.Yao Shukun’s experience in treating digestive system diseases with medicines[J].Journal of China-Japan Friendship Hospital,2020,34(1):46-47.
[10] 俞萍,张庆贺,陈长宝,等.人参糖肽研究进展[J].食品与机械,2020,36(10):215-218;227.
YU P,ZHANG Q H,CHEN C B,et al.The research progress of ginseng glycopeptide[J].Food & Machinery,2020,36(10):215-218;227.
[11] 刘瑜,张海欣,盛卓娴,等.牡蛎低聚肽对CTX诱导的PADAM大鼠性功能及生殖功能的干预作用[J].食品工业科技,2020,41(17):302-307.
LIU Y,ZHANG H X,SHENG Z X,et al.Intervention effects of oyster oligopeptides on sexual and reproductive functions of PADAM rats induced by CTX[J].Science and Technology of Food Industry,2020,41(17):302-307.
[12] 陈文博.西藏绵头雪莲花多糖的结构鉴定及生物活性的研究[D].广州:华南理工大学,2020.
CHEN W B.Structural elucidation and the biological activity of polysaccharides from saussurea laniceps[D].Guangzhou:South China University of Technology,2020.
[13] 张兆肖,郑铮,杨丽,等.骆驼初乳对环磷酰胺诱导小鼠免疫功能低下的调节作用[J].现代食品科技,2019,35(4):1-8.
ZHANG Z X,ZHENG Z,YANG L,et al.Effects of camel colostrum on cyclophosphamide-induced immunodeficiency in mice[J].Modern Food Science and Technology,2019,35(4):1-8.
[14] 王辉,秦翠丽,宫强,等.非消化寡糖对小鼠免疫调节的影响[J].食品与机械,2019,35(9):1-5.
WANG H,QIN C L,GONG Q,et al.Effects of non-digestible oligosaccharides their combinations on the immunomodulation of mice[J].Food & Machinery,2019,35(9):1-5.
[15] 陈金龙,张月巧,袁娅,等.植物多糖通过NF-κB信号通路对巨噬细胞的免疫调节作用研究进展[J].食品科学,2015,36(23):288-294.
CHEN J L,ZHANG Y Q,YUAN Y,et al.Progress in research on immune-regulatory effects of plant polysaccharides on macrophages through NF-κB signaling pathway[J].Food Science,2015,36(23):288-294.
[16] 徐荣,杨朴丽,徐通,等.诺丽果粉增强免疫力功能实验研究[J].食品工业科技,2017,38(24):297-302.
XU R,YANG P L,XU T,et al.Effect of morinda citrigolia fruit powder on strengthening immune function in mice[J].Science and Technology of Food Industry,2017,38(24):297-302.
[17] TILWARI A.Effect of five medicinal plants used in Indian system of medicines on immune function in Wistar rats[J].African Journal of Biotechnology,2011,10(73):16 637-16 645.
[18] 方笋,王萌,赵晓娟,等.芍芪多苷对迟发型变态反应小鼠细胞免疫功能的影响[J].中国药理学通报,2008,24(4):444-448.
FANG S,WANG M,ZHAO X J,et al.Effects of Shaoqi polyglycoside on cellular immunity function in mice with delayed type hypersensitivity[J].Chinese Pharmacological Bulletin,2008,24(4):444-448.
[19] 刘英姿,罗有梁,周铁忠.碎米花杜鹃原花青素A-1对小鼠免疫细胞的影响[J].中药药理与临床,2012,28(2):45-48.
LIU Y Z,LUO Y L,ZHOU T Z.Effects of proanthocyanidin A-1 from rhododendron spiciferum on mice immunocyte[J].Pharmacology and Clinics of Traditional Chinese Medicine,2012,28(2):46-49.
[20] 海鲜季:美味健康两不误[J].健康管理,2013(9):80-81.
Seafood season:Both delicious and healthy[J].Health Management,2013(9):80-81.
[21] 单峰,黄璐琦,郭娟,等.药食同源的历史和发展概况[J].生命科学,2015,27(8):1 061-1 069.
SHAN F,HUANG L Q,GUO J,et al.History and development of ‘one root of medicine and food’[J].Chinese Bulletin of Life Science,2015,27(8):1 061-1 069.
[22] 张翠凤.从营养学的角度谈肽饮料的功能作用及发展前景[J].饮料工业,2010,13(5):4-5;9.
ZHANG C F.A nutriological discussion of functions and prospects of peptide drinks[J].The Beverage Industry,2010,13(5):4-5;9.
[23] 郭显赫.榛仁肽饮料的加工工艺研究及其功能性评价[D].长春:长春理工大学,2020.
GUO X H.Study on processing technology and functional evaluation of hazelnut peptide beverage[D].Changchun:Changchun University of Science and Technology,2020.
[24] 师雯,李洲.中国功能饮料市场现状及发展趋势分析[J].食品与发酵科技,2020,56(5):97-100;104.
SHI W,LI Z.Analysis of the market situation and development trends of functional beverages in china[J].Food and Fermentation Sciences & Technology,2020,56(5):97-100;104.