豆腐是以大豆蛋白为骨架,在凝固剂作用下形成的三维网络状凝胶。传统豆腐制作是向经过热处理的豆浆中加入适当的凝固剂使其凝结形成胶状凝乳,再经倒模、压制成型等步骤制作而成。豆浆的凝固过程是豆腐生产中最重要的步骤,而不同种类的凝固剂会最终影响豆腐的产量和质量[1]。常见的豆腐凝固剂可分为盐类凝固剂(如镁盐、钙盐等),酸类凝固剂[如葡萄糖酸内酯(glucono-δ-lactone,GDL)]以及酶类凝固剂(如谷氨酰胺转氨酶,TG酶)等[2-5]。我国市售豆腐主要有3种,分别为南豆腐(多用CaSO4制作而成)、北豆腐(多用MgCl2制作而成)和内酯豆腐(GDL豆腐)。
凝固剂的种类和添加量对豆腐的得率、结构和风味有较为显著的影响。在豆腐品质方面,MgCl2能够极大保留大豆原有的风味,产生令人愉悦的香气,但由于其与豆乳的反应非常迅速,导致蛋白网状结构收缩、脱水,最终成品豆腐的持水性较差,质地粗糙,口感较硬。CaSO4与豆乳反应较慢,形成的豆腐结构光滑细腻,持水性较好,但CaSO4无法完全溶解,容易造成成品豆腐中残存部分CaSO4,使得豆腐口感略有苦涩,缺乏豆香味。GDL加入熟豆浆后,会缓慢释放H+,可以促使变性大豆蛋白凝聚,形成凝胶,其制成的豆腐口感软嫩,但硬度较差,口味平淡,略带酸味[6]。单一的凝固剂在使用时各有优缺点,而复合凝固剂是随机自动化,机械化以及工业化的发展而产生的,不仅可以克服单一凝固剂的缺点,而且还可使产品有更好的质地。
体内评估和体外模拟是研究食物消化的常用方法。体内实验可以准确地反映食物消化过程中的真实情况,但往往存在费用高、重现性差、受伦理道德约束等问题[7]。体外消化是以生物体胃肠道生理情况为依据,将物质在可控的环境下进行消化的过程,可以在一定程度上代表物质在生物体内的变化,具有简单、快速、费用低、可重复等优点,与体内消化模型相比,其在模拟人体胃肠道生理条件下研究食物摄入后结构变化及消化率的有效途径。且有诸多研究指出运用体外模拟消化的方法测定的结果与体内实验结果有很好的相关性[8-9]。因此,体外胃肠道消化在蛋白质的研究中得到广泛使用。
本论文拟采用单一的盐类凝固剂CaSO4、酸类凝固剂GDL及二者的复合凝固剂制作豆腐,采用体外模拟人体胃肠道消化模型来判断不同凝固剂制作的豆腐中大豆蛋白消化特性的区别,从可溶性蛋白含量、小肽、蛋白质消化率、水解度、SDS-PAGE等方面进行分析。通过体外胃肠道消化的方法比较测定使用哪种凝固剂更利于豆腐蛋白的消化吸收,从而确定较优品质的豆腐凝固剂类型,以此来改善人们的健康和饮食。
1 材料与方法
1.1 材料与试剂
大豆,购于超市;豆浆消泡剂、石膏凝固剂,安琪酵母有限公司;GDL,江西新黄海食品有限公司;甲醇、无水乙醇、乙酸、磷酸二氢钠、磷酸氢二钠、丙三醇、磷酸、盐酸、乙酸,均为分析纯,江苏强盛功能化学股份有限公司;(羟甲基)氨基甲烷,上海强顺化学试剂有限公司;溴酚蓝、牛血清白蛋白、考马斯亮蓝R250、考马斯亮蓝G250,福州飞净生物科技有限公司;十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、甘氨酸、十水合四硼酸钠、邻苯二甲醛(O-phthalaldehyde,OPA),上海罗恩化学技术有限公司;L-丝氨酸、胰酶粉(P7 340)、胃蛋白酶1∶3 000(P8 390)、猪胆盐(G8 310)、β-巯基乙醇,北京索莱宝科技有限公司;α-淀粉酶(酶活力50 000 U/g),河北万达生物工程有限公司;胰蛋白酶1∶400(猪胰),上海瑞永生物科技有限公司;糜蛋白酶(酶活力1 500 U/mg)、肽酶(酶活力2 000 U/g),上海源叶生物科技有限公司;二硫苏糖醇(dithiothreitol,DTT)、彩色蛋白Marker(15~130 kDa)、SDS-PAGE凝胶快速制备试剂盒,北京兰杰柯科技有限公司;超滤离心管10 kDa,Millipore密理博。
1.2 仪器与设备
MC-15K微型高速离心机,杭州佑宁仪器有限公司;Vortex-2漩涡混匀仪,上海叶拓科技有限公司;恒温振荡器,上海一恒科学仪器有限公司;FE20实验室pH计,上海梅特勒-托利多仪器有限公司;九阳破壁机,九阳股份有限公司;美的电磁炉,美的股份有限公司;UV1 800紫外可见分光光度计,上海美谱达仪器有限公司;Mini-protean型电泳仪,美国伯乐公司。
1.3 实验方法
1.3.1 凝固剂的选择与复配
分别选用盐类凝固剂CaSO4(添加量为6 g/L),酸类凝固剂GDL(添加量为3 g/L)以及两者复配(CaSO4添加量为3 g/L,GDL添加量为1.5 g/L)进行豆腐的制作。
1.3.2 豆腐的制作
挑选颗粒饱满的优质大豆清洗干净,将大豆以水豆比3∶1(mL∶g)在室温下浸泡12 h;泡好后捞出沥干,并以水豆比8∶1(mL∶g)进行打浆;然后,将过滤后的豆浆煮沸(保持沸腾5 min),后将豆浆冷却至80 ℃时加入CaSO4、GDL及其混合凝固剂,再放入80 ℃水浴锅保温30 min。
1.3.3 体外肠胃道消化模型的建立
采用SHIM等[10]的体外胃肠道消化模型进行实验,略有改动。豆腐与各消化酶溶液的添加比例为豆腐∶唾液淀粉酶溶液∶胃蛋白酶溶液∶胰蛋白酶溶液∶胆液=2.5∶1.0∶1.5∶1.0∶1.0(体积比)。体外消化具体操作方法如下:首先使用玻璃棒将豆腐样品搅碎,模拟咀嚼过程,取5 g样品作为未消化样品,编号P0。随后取60 g研磨后的样品加入24 mL唾液淀粉酶溶液(0.2 mg/mL,溶于20 mmol/L磷酸盐缓冲液,pH 7.0),在37 ℃恒温振荡摇床(转速55 r/min)反应3 min,取出7 g样品作为经过唾液消化后的样品,编号为P1。再用4 mol/L HCl溶液将体系内pH调至2.0,之后加入33 mL胃蛋白酶溶液(3.2 mg/mL,溶于0.1 mol/L HCl),转速保持不变,胃部消化时间为1 h,期间分别于第5、60 min吸取10 g样品,编号分别为P2-5和P2-60;再用4 mol/L NaOH溶液调节体系pH至7.0,加入18 mL胰蛋白酶溶液和18 mL胆液(0.4 mg/mL,溶于20 mmol/L 磷酸盐缓冲液,pH 7.0),于37 ℃,120 r/min条件下继续消化2 h后终止消化,期间分别于第30、120 min时吸取14 g样品分别编号为P3-30和P3-120。消化结束后,各消化阶段的样品均用去离子水定容至14 mL,以确保所有消化阶段样品中的蛋白质含量一致,并将定容后的样品置于沸水浴中5 min,使酶失活。然后吸取2 mL置于离心管中(10 000 r/min,5 min),离心结束后吸取上清液于收集管中,4 ℃冰箱保存。
1.3.4 可溶性蛋白含量测定
本实验采用考马斯亮蓝法(Bradford法)测定未消化及消化样品上清液中可溶性蛋白的含量[11]。1 mL上清液与5 mL考马斯亮蓝染色液混匀,室温反应5 min后,在可见光分光光度计上测定595 nm处的吸光值。可溶性蛋白含量用牛血清白蛋白当量表示,以蒸馏水代替样品反应,作为空白对照,牛血清白蛋白标准溶液(0~100 μg/mL)的线性回归方程为y=0.008 7x+0.028(R2=0.990 6)。
1.3.5 小肽含量测定
不同消化阶段样品中的小肽含量测定参考RUI等[12]的方法进行。将2 mL消化样转移至截留分子质量为10 kDa的Millipore超滤管中,在4 ℃、5 000 r/min条件下离心10 min,收集蛋白渗透液。吸取50 μL渗透液与2 mL 反应液混匀,室温下精确反应2 min,测定340 nm处吸光度。小肽含量用胰酪蛋白胨当量表示,以蒸馏水代替样品反应,作为空白对照,胰酪蛋白胨标准溶液(0~2.5 mg/mL)的线性回归方程为y=0.344 9x+0.002 4(R2=0.993 6)。反应液的配制如下:25 mL 100 mmol/L 的硼砂、2.5 mL 20%(质量分数)SDS、40 mg邻苯二甲醛(溶解于1 mL甲醇)和100 μL β-巯基乙醇混匀后定容至50 mL。
1.3.6 蛋白质水解度的测定
不同消化阶段样品中蛋白质的水解度采用NIELSEN等[13]的方法进行检测。以丝氨酸制作标准曲线,以去离子水代替样品反应,作为空白对照。分别取0、100、200、300、400 μL丝氨酸标准液(100 μg/mL)于5 mL试管中,用去离子水补足体积至400 μL,加入3 mL OPA试剂,混匀,精确反应2 min后在340 nm处测定吸光度。利用测得的吸光度与丝氨酸浓度做标准曲线,其线性回归方程为y=1.047 2x+0.008(R2=0.996 6)。
口腔-胃-肠各阶段消化后的样品均用去离子水稀释40倍,吸取400 μL的样品稀释液加入3 mL OPA试剂,振荡混匀,精确反应2 min后在340 nm处测定其吸光度,测定3次取平均值。OPA试剂的配制:首先将7.62 g四硼酸钠和200 mg SDS完全溶解于150 mL去离子水中,之后用4 mL乙醇溶解160 mg邻苯二甲醛并将其转移到上述150 mL溶液中,并用去离子水冲洗,混合后再向溶液中加入176 mg DTT,最后用去离子水定容至200 mL。水解度由公式(1)(2)(3)计算:
(1)
(2)
(3)
式中:W,每克蛋白质中含-NH2的量,mmol/g;C,根据测得的吸光度的平均值从标准曲线上计算得出,mmol/L;V,样品消化液的体积,L;N,消化液稀释倍数;m,样品质量,g;ω,样品中蛋白质质量分数,%;h,每克蛋白断裂的肽键毫摩尔数,mmol/g;htot,肽键总数(每克大豆蛋白所含的肽键毫摩尔数为7.8 mmol/g),mmol/g;α、β,分别用常数1.00、0.40表示。
1.3.7 蛋白质消化率测定
蛋白质的消化率是根据消化10 min后的pH值(X)来计算的[14],方程如下:消化率Y=210.46-18.10X。每个样品均进行3次平行试验,使用pH计准确记录10 min后pH值的下降情况(样品初始pH值调至8.0)。
1.3.8 SDS-PAGE
采用SDS-PAGE对消化前、口腔、胃、肠不同消化阶段样品中蛋白质分子质量的变化情况进行检测。将100 μL上清液与100 μL上样缓冲液(16 g/L SDS,体积分数12%甘油,体积分数4% β-巯基乙醇,0.25 g/L溴酚蓝,20 g/L蔗糖和62.5 mmol/L Tris-HCl,pH 6.8,混匀后定容至100 mL)混合均匀,经100 ℃水浴煮沸5 min后,取10 μL上样。采用12%分离胶和4%浓缩胶进行不连续垂直平板电泳分析。先接通电源,电压调至60 V并保持恒压,当样品进入分离胶后调节电压使电压恒定在120 V,溴酚蓝移动离底部约0.5 cm时,切断电源,停止电泳。使用Quantity One软件(Version 4.6.2,美国Bio-Rad公司)进行蛋白条带的数量及灰度值分析。
1.3.9 数据处理与分析
本实验采用 Microsoft Office 2013 处理数据,Origin 9.0软件作图,采用SPSS 16.0对各组变量的测试结果进行显著性差异分析,显著性水平P<0.05。
2 结果与分析
2.1 可溶性蛋白含量分析
不同的消化阶段豆腐中的可溶性蛋白含量的变化如图1所示。整体而言,由于各个消化阶段消化酶的存在,空白对照豆浆与3种豆腐的可溶性蛋白含量变化均较为明显。在消化前(P0阶段)可以看到豆浆的可溶性蛋白含量最高(8.99 mg/mL),而GDL豆腐、CaSO4豆腐、复配型豆腐的可溶性含量均较低(0.2 mg/mL左右)且三者无显著性差异(P>0.05)。由此表明大部分蛋白质在豆浆中以游离态存在,而3种豆腐中绝大部分的蛋白质保留在豆腐的凝胶基质中。这是由于豆浆中的大豆蛋白在高温下分子内部疏水基团暴露,聚集形成蛋白聚集体,在二价阳离子Ca2+、H+(GDL水解释放)等作用下,使蛋白质之间的斥力消失从而发生聚集效应,形成致密、稳定的三维蛋白网络结构[15],因此在高速离心时蛋白保留在豆腐基质中沉淀至离心管底部而上清液中含量较少。经口腔消化后(P1),3种豆腐的可溶性蛋白含量没有明显变化,而豆浆中的可溶性蛋白经过口腔消化后下降。在接下来的胃消化阶段(P2)5 min时,豆浆中的可溶性蛋白含量无明显变化,3种豆腐的可溶性蛋白含量大幅度上升,且存在显著性差异(P<0.05),CaSO4豆腐的可溶性蛋白含量最高(1.86 mg/mL)。到了胃消化阶段(P2)的60 min,在胃蛋白酶的作用下,豆浆中的可溶性蛋白含量显著降低至3.70 mg/mL,同时GDL豆腐和CaSO4豆腐的可溶性蛋白含量也稍有所下降,而复配型豆腐的可溶性蛋白含量却有所升高。而在肠消化阶段(P3)的2个时间点,豆浆中的可溶性蛋白含量无明显变化(3.09~3.12 mg/mL),3组豆腐的可溶性蛋白含量均呈下降趋势。究其原因,可能是因为在胰蛋白酶和胆液的作用下,蛋白质进一步水解成小分子质量的多肽和氨基酸,不能被考马斯亮蓝法测得,因此实验结果呈下降趋势。RIOUX等[16]在研究酪蛋白和乳清蛋白比例对酸奶消化的影响时也得到了相似的结果。RUI等[17]研究豆乳经乳酸菌发酵至不同pH值,然后通过体外消化后发现各样品在肠消化阶段可溶性蛋白含量均低于胃消化阶段。另外,胰蛋白酶液及胆盐溶液的添加起到一定的稀释作用,且体系中pH的变化以及快速的水解过程均导致了样品中可溶性蛋白含量的下降。
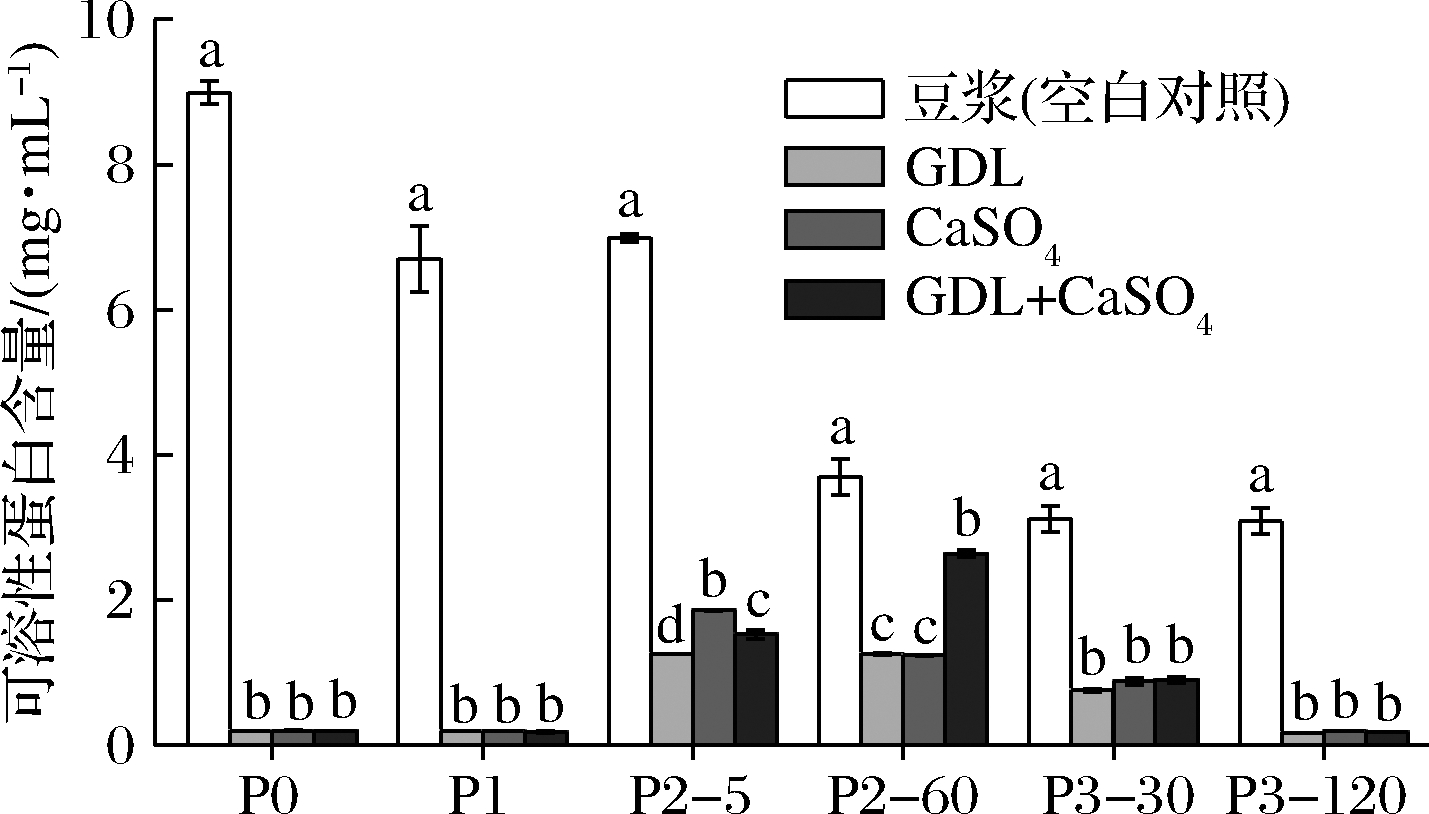
图1 体外消化过程中各样品的可溶性蛋白含量变化图
Fig.1 Soluble protein contents in different samples during in vitro gastrointestinal simulated digestion
总的来说,体外消化期间豆浆和3种豆腐的可溶性蛋白的含量变化主要是因为蛋白酶的水解作用。在GDL、CaSO4和复配凝固剂制备的大豆蛋白凝胶中,复配凝固剂的使用显著提高了大豆蛋白的消化率,从而使更多的营养物质在胃肠道中释放,更有利于人体的吸收。
2.2 小肽含量分析
研究指出,具有生物活性的多肽大多数为分子质量较小的肽,尤其是2~10个氨基酸长度的短肽[18]。不同消化阶段4组样品中分子质量低于10 kDa的小肽含量测定结果如图2所示。整体而言,小肽含量呈上升趋势且与可溶性蛋白含量变化相对应。消化前(P0),豆浆、GDL豆腐、CaSO4豆腐、复配型豆腐中小肽含量均较低(0.68~0.80 mg/mL)且彼此间无显著性差异(P>0.05),表明实验开始前因为未加消化酶,大部分大豆蛋白未分解成小肽和氨基酸等物质而仍以大分子的形式存在于样品溶液中。经口腔消化后(P1),4组样品中的小肽含量没有明显变化,依然较低,但豆浆中的小肽含量最低(0.71 mg/mL)且与其他3种豆腐相比存在显著性差异(P<0.05)。
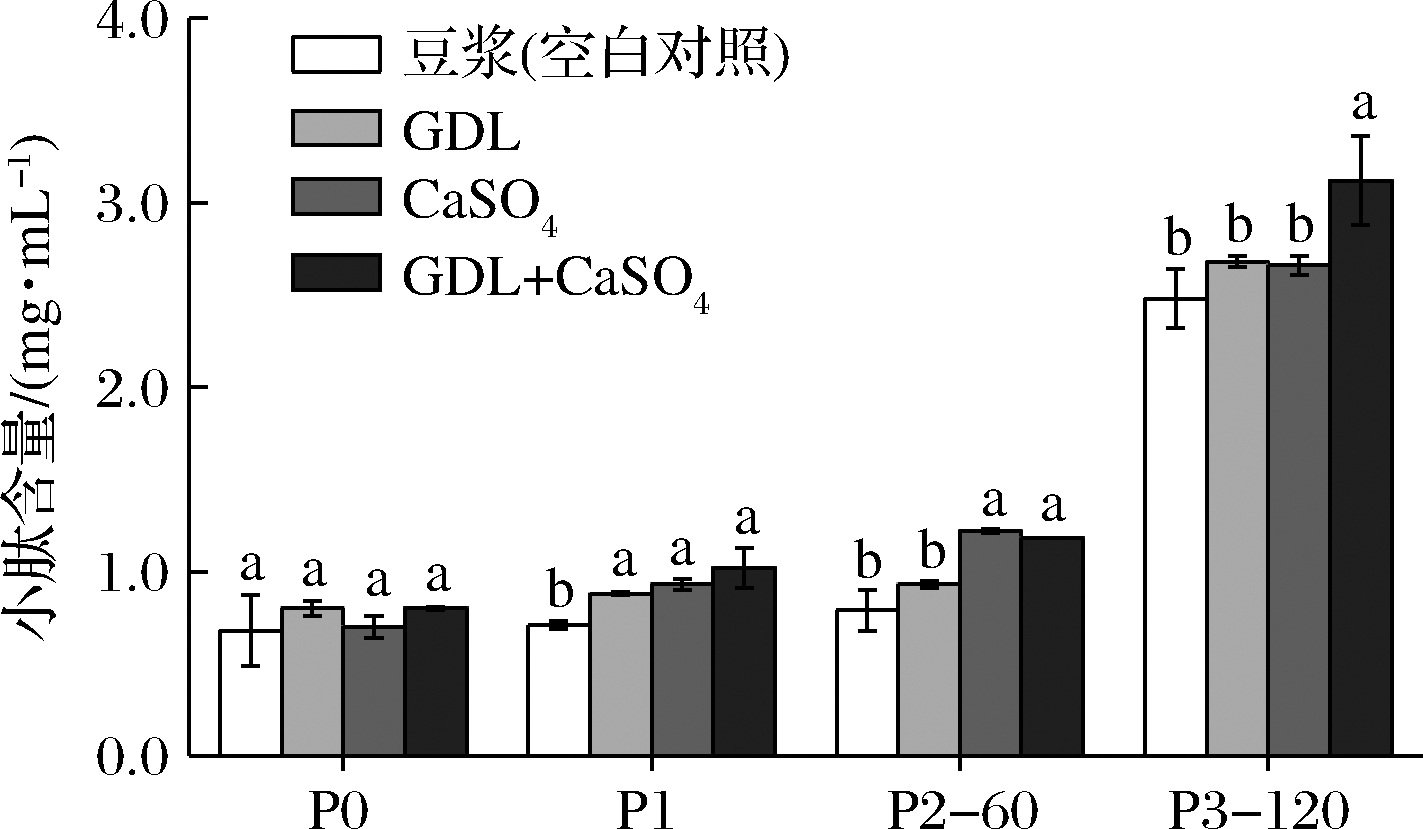
图2 体外消化过程中各样品中小肽含量变化图
Fig.2 Peptide contents in different samples during in vitro gastrointestinal simulated digestion
在胃消化末期(P2-60),小肽含量呈略微增加趋势,豆浆与GDL豆腐中的小肽含量差异不显著但均显著低于CaSO4豆腐和复配型豆腐的小肽含量(P<0.05)。因此可以得出,由于胃部诸多因素的影响,CaSO4豆腐、复配型豆腐较GDL豆腐更适合胃部的消化。在肠消化阶段末期(P3-120),在胰蛋白酶和胆液的作用下,蛋白质进一步水解成小分子质量的多肽和氨基酸,导致4组样品中的小肽含量急剧增加(2.48~3.12 mg/mL)且豆浆、GDL豆腐与CaSO4豆腐3组小肽含量无显著差异(P>0.05),而复配型豆腐中的小肽含量最高,为3.12 mg/mL。这与该时期可溶性蛋白含量较低相对应,在肠消化时期释放大量小肽类营养物质,而复配豆腐分解产生的小肽更多,更适合身体吸收营养。
2.3 豆腐中大豆蛋白水解度的分析
蛋白质水解度DH是指蛋白质分子中由于酶法水解而断裂的肽键占蛋白质分子中总肽键的比例[19]。在消化过程中,大豆蛋白被蛋白酶水解释放出多种形式的小肽类和游离氨基(—NH2)。蛋白质的水解度是通过邻苯二甲醛法测定消化期间游离的—NH2释放量来确定的。在消化的阶段中,每水解1个肽键便会释放1个游离的—NH2,游离的—NH2与邻苯二甲醛反应生成一种黄色络合物,可用紫外分光光度计在340 nm处测定其吸光值。因而,断裂的肽键数可通过水解后新形成的末端—NH2基团的量来确定,通过吸光值来间接得到水解度的大小,吸光值越大水解度也越大。
在不同的消化阶段,各豆腐样品中大豆蛋白水解度的测定结果如图3所示,展示了大豆蛋白4个消化阶段P0、P1、P2-60、P3-120的水解度变化。4组样品的蛋白质水解度整体呈现上升趋势,而且上升趋势较为明显。在消化前(P0阶段),由于没有加入消化酶,GDL豆腐、CaSO4豆腐、混合复配豆腐的水解度均较低,由此说明3组豆腐样品中大豆蛋白均未发生水解,仍以大分子蛋白质的形式存在。在P0阶段的可溶性蛋白含量测定中,豆浆的可溶性蛋白含量远远大于GDL豆腐、CaSO4豆腐、复配型豆腐3组样品的含量,从而豆浆的水解度要相对大于其他3组样品的水解度。
在口腔消化阶段(P1),3组豆腐样品的水解度仍较低,说明此时样品中大豆蛋白未有明显水解变化。究其原因可能是由于刚添加唾液淀粉酶进行消化的时间较短(3 min)且唾液淀粉酶水解蛋白的能力很弱,导致3组豆腐样品的水解度相对较低。但是在接下来的胃消化阶段,在胃消化酶的作用下,3组豆腐样品的水解度急剧增加。在胃消化末期(P2-60),GDL豆腐水解度为1.02%,CaSO4豆腐的水解度为2.66%,复配型豆腐的水解度为5.09%,三者具有显著性差异(P<0.05)。造成这一结果的原因有很多,主要是由于胃部环境的因素影响所导致的。胃消化期间的酸性pH消化环境,胃蛋白酶的存在,不停的机械振荡以及足够的消化时长导致各豆腐样品中蛋白水解度的上升,从而说明此时蛋白质发生了的水解,生成了各种氨基酸和小肽类物质,与图2的小肽含量在胃消化阶段结果相对应,胃消化阶段在蛋白消化中占据重要地位。
在肠消化末期(P3-120)阶段,3组样品中的蛋白水解度均大幅度上升,可能是在胰蛋白酶和胆液的作用下,大量的蛋白质被进一步水解成各种小肽类物质,使蛋白质中的肽键大量断裂,被OPA试剂识别,因此呈现大幅度上升趋势。在3组豆腐样品中,复配型豆腐的水解度仍为最高,GDL豆腐与CaSO4豆腐相比,增加幅度要大但是总体仍为后者较高。从图3可以看出,复配型豆腐的消化速率要优于其他2种豆腐,而CaSO4豆腐的消化特性要略微优于GDL豆腐。
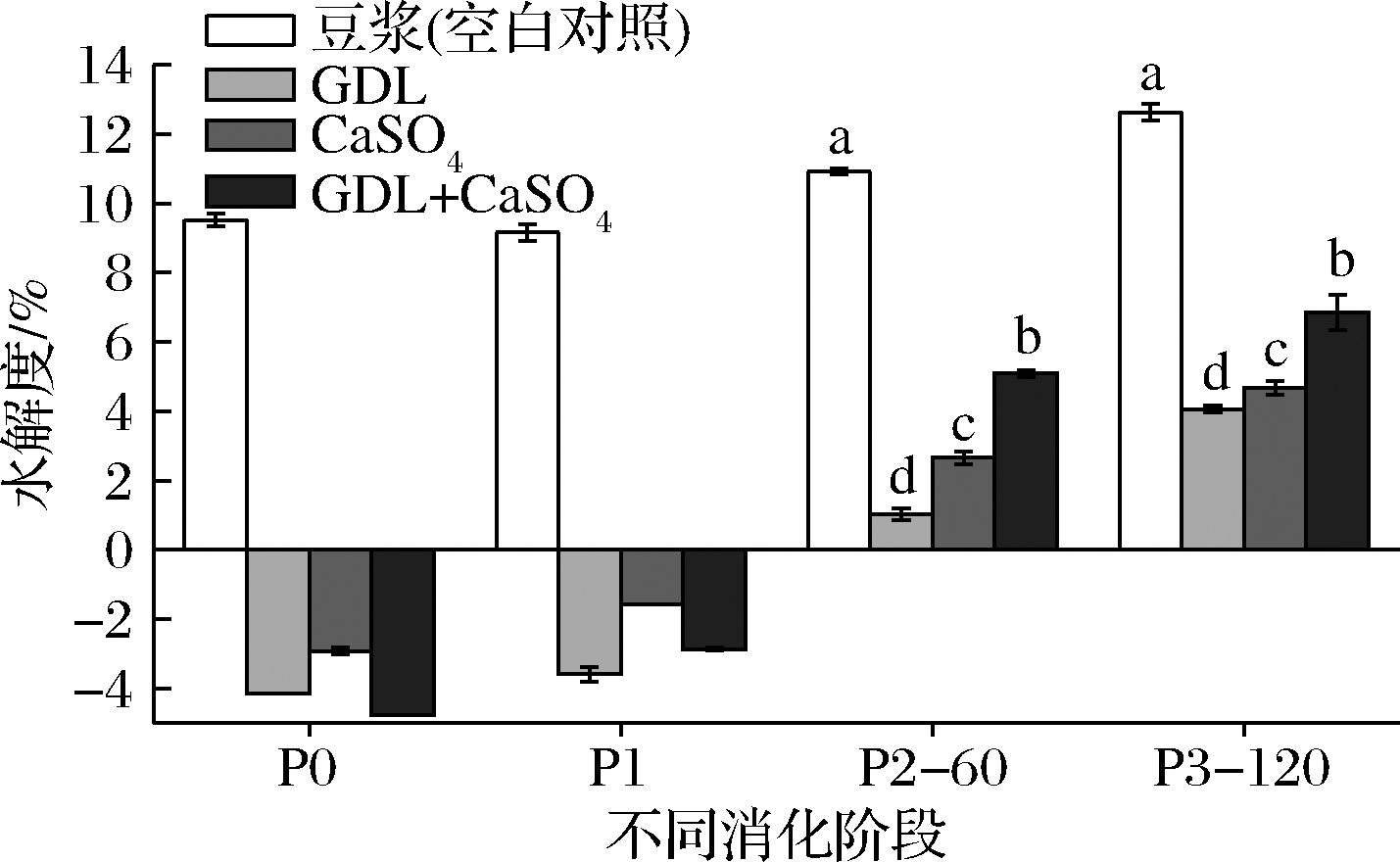
图3 体外消化期间各样品中蛋白质水解度的变化图
Fig.3 Degree of hydrolysis in different samples during in vitro gastrointestinal simulated digestion.
总的来说,蛋白质的快速水解及低分子质量多肽数量的增加是导致水解度持续升高的原因。从消化前的P0阶段到消化后的P3阶段的水解度的变化趋势发现,消化酶的不同、时间的不同以及pH的变化都会对水解度产生影响。从水解度的结果来看,样品蛋白质的水解主要发生在胃消化阶段和肠消化阶段,其中在肠消化阶段蛋白质的水解度最高,水解产生的小肽类物质较多,胃消化阶段略次于肠消化但是高于口腔消化。营养物质的吸收主要发生在肠道中,从豆腐样品以及空白对照的结果来看,复配型豆腐在胃肠道中营养物质释放最多,该部分实验结论与上述实验结论相一致。
2.4 豆腐的体外蛋白消化率分析
表1显示的是3种豆腐中蛋白质的体外消化率测定结果,GDL豆腐、CaSO4豆腐及复配型豆腐中蛋白消化率分别为:(81.70±0.14)%、(80.70±0.28)%、(81.65±0.35)%。该结果表明3种豆腐的体外蛋白质消化率相差不大,相对而言,GDL豆腐和复配型豆腐的蛋白质消化率无显著性差异,但均高于CaSO4豆腐(P<0.05)。
表1 三种凝固剂制备的豆腐的体外蛋白消化率
Table 1 In vitro digestibility of three kinds of tofu with different coagulant

样品蛋白质消化率/%GDL豆腐81.70±0.14aCaSO4豆腐80.70±0.28b复配型豆腐81.65±0.35a
注:不同小写字母表示在0.05 水平上存在显著性差异
2.5 SDS-PAGE电泳分析
通过SDS-PAGE测定每个样品的蛋白质图谱,结果如图4所示。众所周知,β-伴大豆球蛋白(7S)和大豆球蛋白(11S)是大豆蛋白中最主要的2种蛋白。β-伴大豆球蛋白由3种亚基构成(α′,α,β),大豆球蛋白是一种由二硫键连接酸性亚基和碱性亚基而组成的六聚体蛋白质[20]。P0阶段收集的豆浆中包含数条分子质量在20~100 kDa之间的条带,用数字1~6来指示(图4-a),其分子质量分别为81.00、73.89、47.89、37.88、36.54和20.42 kDa。根据先前的研究,推测它们分别对应于7S球蛋白α′亚基(条带1),7S球蛋白α亚基(条带2),7S球蛋白β亚基(条带3),11S A3亚基(条带4)、11S酸性亚基(条带5)、11S碱性亚基(条带6)[21]。
从图4可以看出,各豆腐样品在消化前(P0)蛋白条带较少,包括5个主要的条带(编号7~11),其相应的分子质量(kDa)分别为83.67(条带7)、58.22(条带8)、41.49(条带9)、25.60(条带10)、17.52(条带11),这与该阶段豆腐样品中测得较低的可溶性蛋白含量相一致。其中7S球蛋白α′亚基、11S酸性亚基在所研究的豆腐样品可溶性蛋白组分中均不存在,缺失的蛋白质条带可能分布在相应的豆腐基质中。而条带7、条带9以及条带11可能与7S球蛋白α亚基、11S A3亚基以及11S碱性亚基相关,这分别基于它们和条带1、条带4和条带6相似的分子质量。经过口腔消化后(P1),蛋白条带并未增加,这是因为唾液中不含有蛋白酶,不能使蛋白发生水解。而在胃蛋白酶的作用下(P2),各豆腐凝胶中的蛋白质得到释放,出现了相似的蛋白质图谱,形成分子质量在15~35 kDa内的诸多蛋白条带(此范围内条带编号12~16)。
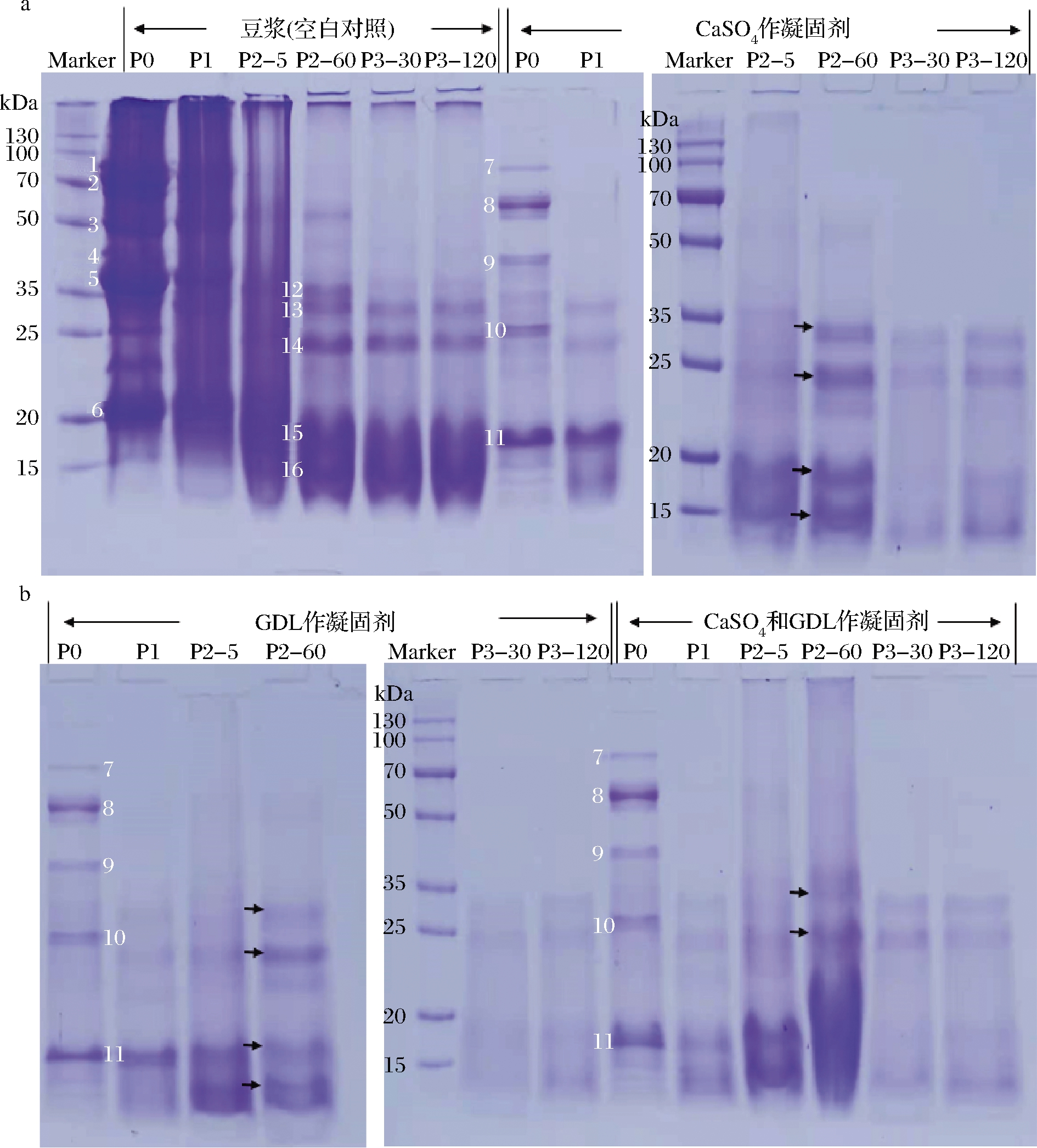
P0-消化前;P1-口腔消化后;P2-5,P2-60指胃消化的第5,60 min(P2阶段);P3-30,P3-120指肠消化的第30,120 min(P3阶段)
图4 各样品消化期间的蛋白电泳图谱
Fig.4 SDS-PAGE analysis of digested samples before the in vitro digestion
经过胃消化阶段后(P2-60)样品组CaSO4豆腐和GDL豆腐所出现的4个条带分子质量大致相同。在随后的P3阶段,各条带的光密度值以及数量逐渐减弱,蛋白浓度逐渐降低。而复配型豆腐中仅出现了2条带(条带13、条带14),没有观察到额外的完整条带,其灰度值明显低于空白对照组。随着肠消化阶段的进行,几乎无法观测出清晰的条带。
从条带亮度结果分析可知,空白组豆浆的蛋白质条带亮度最大,表明蛋白含量最高,这一结果与可溶性蛋白含量分析的结果相一致。综合实验可以发现4种样品的蛋白降解情况相似,但复配型豆腐中蛋白质的降解速率最快。随着消化过程的进行,各样品中可观察到的条带越来越模糊,消化效果进一步提升,可以得到可溶性蛋白含量进一步减少,小肽含量和水解度得到增加,这与上述实验结果相对应。
3 结论
在本研究中,使用CaSO4、GDL以及两者复配的混合型凝固剂制备豆腐,通过模拟体外消化实验来探究不同凝固剂对豆腐中大豆蛋白消化率的影响。通过可溶性蛋白含量、小肽含量、水解度、体外蛋白消化率、SDS-PAGE的测定结果综合分析得出,体外消化的主要阶段在胃-肠道消化时期,此时期可溶性蛋白含量呈先上升后下降的趋势,表明在此期间可溶性蛋白被大量释放然后消化吸收。在小肽含量测试和水解度分析中,在胃消化阶段的末期到肠消化阶段为体外消化变化的峰值,此时的大豆蛋白水解度最高,小肽类物质被大量释放。体外蛋白消化率的实验结果表明复配型凝固剂制备的豆腐其蛋白消化率要高于其他2组样品豆腐,而添加CaSO4作凝固剂的豆腐体外消化率低于GDL豆腐,二者差异显著且风味有所不同。通过SDS-PAGE图谱得出,3种豆腐样品胃肠道消化期间蛋白降解情况相似,但复配型豆腐中蛋白质的降解速率最快。综合上述,复配凝固剂制作豆腐更利于大豆蛋白的消化吸收。
[1] ZHANG Q,WANG C Z,LI B K,et al.Research progress in tofu processing:From raw materials to processing conditions[J].Critical Reviews in Food Science and Nutrition,2018,58(9):1 448-1 467.
[2] LI M,CHEN F S,YANG B,et al.Preparation of organic tofu using organic compatible magnesium chloride incorporated with polysaccharide coagulants[J].Food Chemistry,2015,167:168-174.
[3] SHEN Y R,KUO M I.Effects of different carrageenan types on the rheological and water-holding properties of tofu[J].LWT-Food Science and Technology,2017,78:122-128.
[4] TSENG Y C,XIONG Y L.Effect of inulin on the rheological properties of silken tofu coagulated with glucono-δ-lactone[J].Journal of Food Engineering,2009,90(4):511-516.
[5] CHANG Y H,SHIAU S Y,CHEN F B,et al.Effect of microbial transglutaminase on the rheological and textural characteristics of black soybean packed tofu coagulating with Agar[J].LWT-Food Science and Technology,2011,44(4):1 107-1 112.
[6] 刘宁,高艺笑,孙钰姬,等.豆腐凝固剂的研究进展[J].中国调味品,2021,46(3):189-194.
LIU N,GAO Y X,SUN Y J,et al.Research progress of tofu coagulants[J].China Condiment,2021,46(3):189-194.
[7] AUGUSTIN M A,SANGUANSRI L,RUSLI J K,et al.Digestion of microencapsulated oil powders:In vitro lipolysis and in vivo absorption from a food matrix[J].Food & Function,2014,5(11):2 905-2 912.
[8] HUR S J,LIM B O,DECKER E A,et al.In vitro human digestion models for food applications[J].Food Chemistry,2011,125(1):1-12.
[9] XING G L,RUI X,WANG D,et al.The effect of fermentation pH on the protein bioaccessibility of soymilk curd with added tea polyphenols as assessed by in vitro gastrointestinal digestion[J].Journal of Agricultural and Food Chemistry,2017,65(50):11 125-11 132.
[10] SHIM S M,CHOI M H,PARK S H,et al.Assessing the digestibility of genetically modified soybean:Physiologically based in vitro digestion and fermentation model[J].Food Research International,2010,43(1):40-45.
[11] BRADFORD M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry,1976,72(1-2):248-254.
[12] RUI X,FU Y T,ZHANG Q Q,et al.A comparison study of bioaccessibility of soy protein gel induced by magnesiumchloride,glucono-δ-lactone and microbial transglutaminase[J].LWT-Food Science and Technology,2016,71:234-242.
[13] NIELSEN P M,PETERSEN D,DAMBMANN C.Improved method for determining food protein degree of hydrolysis[J].Journal of Food Science,2001,66(5):642-646.
[14] KALPANADEVI V,MOHAN V R.Effect of processing on antinutrients and in vitro protein digestibility of the underutilized legume,Vigna unguiculata(L.)Walp subsp.unguiculata[J].LWT-Food Science and Technology,2013,51(2):455-461.
[15] 刘丽莎,金杨,张小飞,等.盐卤豆腐与内酯豆腐质构与分子间作用力比较研究[J].食品科技,2020,45(10):60-64.
LIU L S,JIN Y,ZHANG X F,et al.Comparative study on structure and chemical interaction between brine tofu and GDL tofu[J].Food Science and Technology,2020,45(10):60-64.
[16] RIOUX L E,TURGEON S L.The ratio of casein to whey protein impacts yogurt digestion in vitro[J].Food Digestion,2012,3(1-3):25-35.
[17] RUI X,ZHANG Q Q,HUANG J,et al.Does lactic fermentation influence soy yogurt protein digestibility:A comparative study between soymilk and soy yogurt at different pH[J].Journal of the Science of Food and Agriculture,2019,99(2):861-867.
[18] CARBONARO M,MASELLI P,NUCARA A.Structural aspects of legume proteins and nutraceutical properties[J].Food Research International,2015,76:19-30.
[19] 杨文博,张英华.蛋白质水解度的测定方法研究[J].中国调味品,2014,39(3):88-90.
YANG W B,ZHANG Y H.Study on the determination methods for hydrolysis degree of protein[J].China Condiment,2014,39(3):88-90.
[20] WANG Y T,WANG Z J,HANDA C L,et al.Effects of ultrasound pre-treatment on the structure of β-conglycinin and glycinin and the antioxidant activity of their hydrolysates[J].Food Chemistry,2017,218:165-172.
[21] HSIEH J F,YU C J,TSAI T Y.Proteomic profiling of the coagulation of soymilk proteins induced by magnesium chloride[J].Food Hydrocolloids,2012,29(1):219-225.