清香型小曲酒又称“川法小曲酒”,是用高粱、玉米等粮谷类原料,以清香型小曲作糖化发酵剂酿制的白酒,具有风格独特,清香怡人的特点[1]。邛崃米曲是我国小曲中的著名曲种之一,传统邛崃米曲中添加了72味中药成分,使所酿小曲酒极具特色风味。黄酒是我国历史悠久的传统发酵酒,与啤酒和葡萄酒并称为世界3大发酵酒,其风味独特、营养丰富,酒精含量8%~15%[2]。
日本酒主要有日本清酒(sake)、烧酒(shochu)、泡盛(awamori)3大类。日本清酒是借鉴中国黄酒的酿造法而发展起来的日本国酒,也是一种发酵酒[3],酒精含量大于15%,富含多种氨基酸和维生素。日本烧酒是一种蒸馏酒,酒精含量通常为25%,典型代表为本格烧酒[4]。米烧酒、红薯烧酒、黑糖烧酒通常采用米曲,麦烧酒一般用麦曲。日本泡盛酒是日本最古老的蒸馏酒,被称为日本烧酒的始祖,盛产于冲绳,酒精含量30%~45%,其酿造方法独特[5],是将精选泰国米制成米麴,将米麴和水一次性下料进行发酵,再蒸馏而成。
“曲乃酒之骨”,酒曲中的微生物决定酒曲品质。TANG等[6]利用高通量测序技术分析了小曲中微生物多样性,结果显示葡萄球菌属(Staphylococcus)、魏斯氏菌属(Weissella)、根霉属(Rhizopus)和假丝酵母属(Candida)为优势菌属。唐洁[7]利用变性梯度凝胶电泳(denatured gradient gel electrophoresis,DGGE)技术分析了清香型小曲微生物群落结构,结果发现小曲中主要的细菌菌属为乳酸菌属、芽胞菌属和葡萄菌属,主要酵母为扣囊复膜酵母(Saccharomycopsis fibuligera),主要霉菌有米根霉(Rhizopus oryzae)和土曲霉(Aspergillus terreus)。目前有关国内曲酒的研究已有很多,但鲜有与日本酒曲的对比研究,而且国内酒曲研究较多集中于大曲[8-10]。本研究选取的8种酒曲具有中日酒曲的典型代表性,且均制曲发酵周期较短,类似于中国小曲类酒曲,因此很有必要对其进行一个全面的对比研究。
宏基因组学技术[11]是针对样品中全部微生物的总DNA,从基因组文库中筛选功能基因或直接进行高通量测序,来分析微生物多样性并挖掘功能基因。近年来,宏基因组测序已广泛应用于泡菜、奶酪、香醋、酒、发酵香肠等发酵食品的功能微生物研究[11-12]。本研究采用宏基因组学技术对8种酒曲中微生物群落结构进行研究,旨在解析中日酒曲微生物种群结构的差异,同时对8种酒曲进行了基因功能预测,为后续筛选特定功能微生物,并进行功能强化曲制作工艺优化,开发出功能型强化酒曲提供了理论基础。
1 材料与方法
1.1 材料与试剂
酒曲样品:邛崃米曲MB,四川省邛崃市某酒厂制曲车间;清香型小曲QX,四川省泸州市某酒厂制曲车间;黄酒麦曲FHC,四川省南充市某黄酒厂制曲车间;黄酒麦曲TH,浙江省绍兴市某黄酒厂制曲车间;日本清酒米曲NP_MS、日本烧酒米曲NP_SJR、日本烧酒麦曲NP_SJW、日本泡盛酒曲NP_SY,均由日本合作高校采集并邮寄。
主要试剂:NaOH、无水乙酸钠、冰乙酸、KI、可溶性淀粉、CuSO4·5H2O、酒石酸钾钠、葡萄糖、甲醛溶液(37%~40%),均为分析纯,成都科龙化工试剂厂;E.Z.N.A.Soil DNA Kit,美国Omega公司。
1.2 仪器与设备
PHS-3C酸度计,上海仪电科学仪器股份有限公司;DYY-5琼脂糖凝胶电泳仪,北京六一仪器厂;Legend Micro 17R高速冷冻离心机,美国赛默飞公司;GeneAmp® 9700型PCR仪,美国ABI公司;Illumina Hiseq PE150高通量测序平台,美国Illumina公司。
1.3 实验方法
1.3.1 中日酒曲制曲工艺
中国酒曲:邛崃米曲是以大米为原料,经浸泡、碾碎、加入曲母和72味中草药拌曲、制胚、进箱培菌、出箱烘干等流程,经约90 h发酵而成的饼曲;清香型小曲是以麸皮、米糠和米粉为原料,经碾细、加入种曲拌和、踩曲、切曲、生火入房、保温、通气、关烧、烘曲等流程,经约90 h发酵而成的散曲;黄酒麦曲是以小麦为原料,经过轧碎、拌水、踩曲、压制成型、入房堆积等流程,经7 d左右发酵而成的块曲。
日本酒曲:清酒米曲[13]是以日本米为原料,经浸米、蒸米、干燥、冷却、入室堆置、加入种曲揉碎、搓拌翻转、重叠堆置、调换曲盘位置、出室放冷等流程,经约46 h发酵而成的散曲;烧酒曲是以日本米或小麦为原料,经浸泡、蒸煮、冷却、配种、恒温恒湿堆积培养、摊开混匀、再堆积、翻曲、干燥等流程,经约40 h发酵而成的散曲;泡盛酒曲是以泰国长粒米为原料,经浸泡、蒸米、配种、40 ℃恒温培养、干燥等流程,经约40 h发酵而成的散曲。
1.3.2 理化指标检测
参照QB/T 4257—2011《酿酒大曲通用分析方法》[14]测定样品中水分、糖化力、液化力、发酵力和酸度。还原糖测定采用标准葡萄糖液反滴定的还原糖测定法[15]。
1.3.3 DNA提取及测序
采用试剂盒提取酒曲微生物宏基因组DNA,用1%琼脂糖凝胶电泳检测提取DNA完整性,用NanoDrop2000检测纯度,用Quantus Fluorometer(Picogreen)检测浓度。建立宏基因组测序文库,送至上海美吉生物医药科技有限公司进行测序,测序平台为Illumina Hiseq PE150。
1.3.4 测序数据分析
对原始数据进行质控预处理,得到有效序列[16],用于后续分析。使用BLASTP(http://blast.ncbi.nlm.nih.gov/Blast.cgi)将非冗余基因集分别与NR数据库和KEGG(Kyoto Encyclopedia of Genes and Genomes)基因数据库(GENES)进行比对[17],然后通过NR库对应的分类学信息数据库获得物种注释结果,再使用物种对应的基因丰度总和计算该物种的丰度,获取各样本分别在门、属和种水平上的分类情况;根据与GENES的比对结果使用KOBAS 2.0(KEGG orthology based annotation system)进行功能注释[18]。用R语言的Vegan软件包进行典型对应分析(canonical correspondence analysis,CCA)并绘图。使用KO、Pathway、EC、Module对应的基因丰度总和计算该功能类别的丰度。使用Origin 2018软件对8种酒曲样品的优势微生物进行柱状图的绘制。
2 结果与讨论
2.1 八种中日酒曲理化指标对比
8种中日酒曲的各理化指标情况见表1。酒曲水分含量越低,即其发酵产生的游离水越多,在一定程度上反映出酒曲发酵的成熟度越好[19]。8种酒曲的水分含量依次为FHC>NP_SJW>NP_SY>TH>MB>NP_MS> NP_SJR>QX。还原糖由糖化酶酶解淀粉生成,FHC还原糖含量最低,NP_SJW最高。酒曲的酸度主要是由产酸微生物进行有机酸代谢产生的。8种酒曲的酸度由高到低为:NP_SY>FHC>MB>NP_MS>NP_SJW> NP_SJR=QX>TH,说明NP_SY内部微生物产酸代谢相对旺盛。糖化力和液化力往往呈正相关,且酒曲的糖化力和液化力越高,其原料利用率和出酒率就越高。NP_SJW、NP_SJR和NP_MS的糖化力和液化力最高,NP_SY和QX的糖化力最低,TH和NP_SY的液化力最低。发酵力是反映酒曲产酒能力的重要指标。酒曲的产酒能力是固态白酒发酵、生酯产香的基础。MB和QX的发酵力最高,均大于1.40 U,NP_SJR的发酵力最低,仅为0.04 U。总体来看,日本酒曲的平均糖化力、液化力和还原糖含量均略高于中国酒曲,中国酒曲的平均发酵力略高于日本酒曲。
表1 八种中日酒曲理化指标
Table 1 Physicochemical indexes of 8 kinds of Chinese Jiuqu and Japanese koji
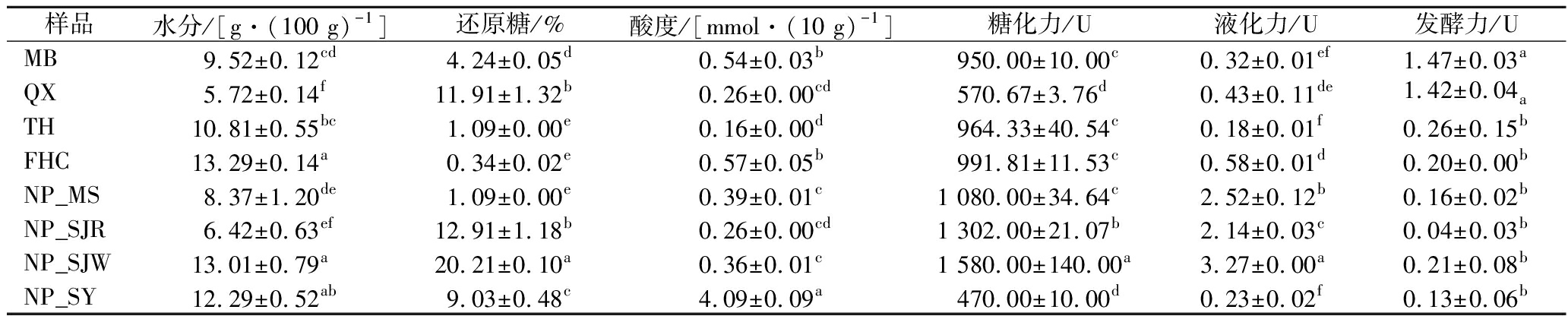
样品水分/[g·(100 g)-1]还原糖/%酸度/[mmol·(10 g)-1]糖化力/U液化力/U发酵力/UMB9.52±0.12cd4.24±0.05d0.54±0.03b950.00±10.00c0.32±0.01ef1.47±0.03aQX5.72±0.14f11.91±1.32b0.26±0.00cd570.67±3.76d0.43±0.11de1.42±0.04aTH10.81±0.55bc1.09±0.00e0.16±0.00d964.33±40.54c0.18±0.01f0.26±0.15bFHC13.29±0.14a0.34±0.02e0.57±0.05b991.81±11.53c0.58±0.01d0.20±0.00bNP_MS8.37±1.20de1.09±0.00e0.39±0.01c1 080.00±34.64c2.52±0.12b0.16±0.02bNP_SJR6.42±0.63ef12.91±1.18b0.26±0.00cd1 302.00±21.07b2.14±0.03c0.04±0.03bNP_SJW13.01±0.79a20.21±0.10a0.36±0.01c1 580.00±140.00a3.27±0.00a0.21±0.08bNP_SY12.29±0.52ab9.03±0.48c4.09±0.09a470.00±10.00d0.23±0.02f0.13±0.06b
2.2 八种中日酒曲宏基因组测序结果
经Illumina平台测序后从8个样品中共得到50 155 557 812 bp的原始碱基数;在原始测序数据中存在着部分低质量数据,为提高后续分析结果的准确可靠,需对原始测序数据进行质控预处理。具体测序及质控结果情况如表2。
表2 原始数据及质控结果
Table 2 Raw data and quality control results
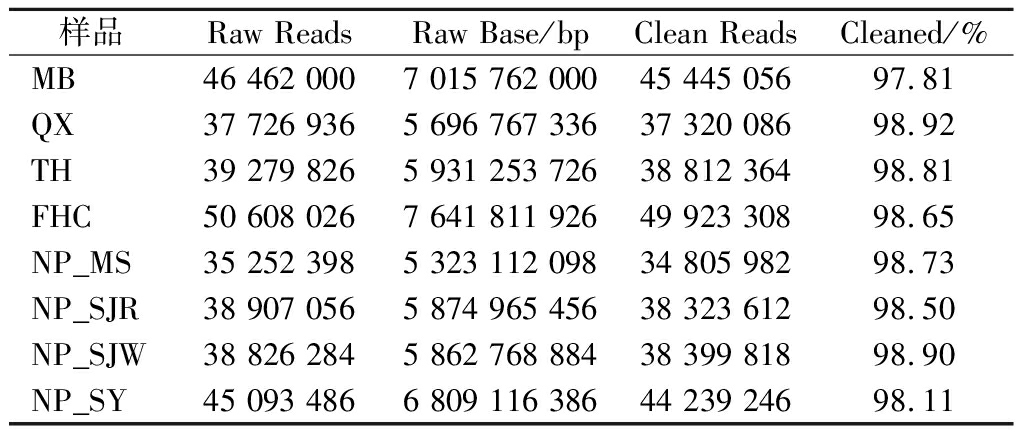
样品Raw ReadsRaw Base/bpClean ReadsCleaned/%MB46 462 000 7 015 762 000 45 445 056 97.81QX37 726 936 5 696 767 336 37 320 086 98.92TH39 279 826 5 931 253 726 38 812 364 98.81FHC50 608 026 7 641 811 926 49 923 308 98.65NP_MS35 252 398 5 323 112 098 34 805 982 98.73NP_SJR38 907 056 5 874 965 456 38 323 612 98.50NP_SJW38 826 284 5 862 768 884 38 399 818 98.90NP_SY45 093 486 6 809 116 386 44 239 246 98.11
注:Raw Reads,原始数据序列长度;Raw Base,原始数据序列碱基总数,bp;Clean Reads,过滤后的序列长度;Cleaned,过滤后的碱基数占原始序列碱基总数的百分比,%
2.3 八种中日酒曲的微生物群落结构分析
由图1-a可知,在门水平上,MB和QX主要为子囊菌门(Ascomycota,分别为9.29%、8.86%)、厚壁菌门(Firmicutes,分别为3.27%、5.21%)和变形菌门(Proteobacteria,分别为0.22%、1.59%)。TH主要为放线菌门(Actinobacteria,82.66%)、厚壁菌门(2.57%)、担子菌门(Basidiomycota,2.51%)和变形菌门(1.58%)。FHC主要为变形菌门(35.17%)、厚壁菌门(23.58%)、子囊菌门(7.46%)和担子菌门(2.48%)。日本酒曲均主要为子囊菌门(均>93%),NP_SJR和NP_SJW还有少量厚壁菌门(分别为6.38%、0.89%)。
由图1-b可知,在属水平上,MB和QX主要为根霉属(分别为81.39%、78.70%)。TH主要为糖多孢菌属(Saccharopolyspora,59.70%)。陈青柳[12]研究发现,糖多孢菌属(54.77%)是绍兴黄酒麦曲和发酵中特有的优势菌属,与本研究结果一致,其在黄酒发酵过程中的具体作用值得进一步研究。FHC物种组成相对最为丰富,主要有横梗霉属(Lichtheimia,25.02%)、葡萄球菌属(11.33%)、肠杆菌属(Enterobacter,9.51%)、克雷伯氏菌属(Klebsiella,9.37%)和曲霉属(Aspergillus,7.14%)。4种日本酒曲均主要为曲霉属(均>91%),NP_SJR还有少量葡萄球菌属(6.30%)。这与“日本酒神”坂口谨一郎[20]指出的中国为中心的东亚大陆到东南亚的曲的主要菌为根霉属和毛霉属(Mucor),日本酒曲的主要菌为曲霉属一致。由于曲霉属等丝状真菌有利于糖化酶的产生,因此日本酒曲的糖化力总体高于中国酒曲(表1),与徐岩等[21]的研究结果一致。
由图1-c可知,在种水平上,MB和QX主要有戴尔根霉(Rhizopus delemar,分别为67.11%、65.18%)和小孢根霉(Rhizopus microspores,分别为12.11%、11.82%)。TH主要有刺糖多胞菌(Saccharopolyspora spinosa,30.49%)、糖多孢红霉菌(Saccharopolyspora erythraea,14.62%)和糖多孢菌(Saccharopolyspora rectivirgula,14.52%);FHC主要有横梗霉(Lichtheimia ramosa,20.80%)、Klebsiella cf.planticola B43(6.19%)、阴沟肠杆菌(Enterobacter cloacae,5.94%)和木糖葡萄球菌(Staphylococcus xylosust,5.85%)。NP_MS、NP_SJR和NP_SJW的物种组成类似且较单一,均主要为米曲霉(均>50%)、黄曲霉(均>36%)、Aspergillus nomius(分别为1.87%、1.74%、1.86%)和寄生曲霉(Aspergillus parasiticus,分别为1.84%、1.73%、1.86%)。NP_SY主要为白曲霉(Aspergillus kawachii,44.63%)、琉球曲霉(Aspergillus luchuensis,31.55%)、黑曲霉(Aspergillus niger,18.04%)和米曲霉(1.74%)。这些霉菌能分泌丰富的多糖水解酶,被认为是酒曲中重要的糖化微生物[22]。日本酒曲中用于将淀粉原料分解为糖的曲霉主要为黄曲霉、白曲霉和黑曲霉。日本清酒米曲和烧酒酒曲中主要为不产柠檬酸的黄曲霉,而泡盛酒曲则主要为产柠檬酸的白曲霉和黑曲霉,用含酸量高的酒曲制出的酒醪因其他杂菌难以繁殖,具有不易腐败的特点[23]。

a-门水平;b-属水平;c-种水平
图1 八种中日酒曲在门、属和种水平上的微生物群落结构
Fig.1 Microbial community structure of 8 kinds of Chinese Jiuqu and Japanese koji based on phylum,genus and species level
2.4 八种中日酒曲微生物群落与理化因子的关联分析
典型关联分析(canonical correlation analysis,CCA)[22]是最常用的挖掘数据关联关系的算法之一。选择8种中日酒曲样品中相对丰度前10位的菌属与水分、糖化力、液化力、发酵力、还原糖和酸度等理化因子进行CCA。由图2可知,TH和FHC呈正相关,QX和MB呈正相关,4种日本酒曲呈正相关。糖化力与液化力、酸度、还原糖和水分均呈正相关,与发酵力呈负相关,其中发酵力、液化力和还原糖对物种的影响程度最大,酸度影响程度最小。曲霉属与水分、糖化力、液化力、酸度和还原糖呈正相关,与发酵力呈负相关。4种日本酒曲与曲霉属和葡萄球菌属呈正相关,TH和FHC与糖多孢菌属、肠杆菌属、横梗霉属、克雷伯氏菌属呈正相关,QX和MB与魏斯氏菌属、寄生霉菌属(Parasitella)、木霉属、毕赤酵母属、根霉属、酵母属和威克汉姆酵母属呈正相关。由此说明,中日酒曲中微生物的种群结构对其理化指标具有显著影响。
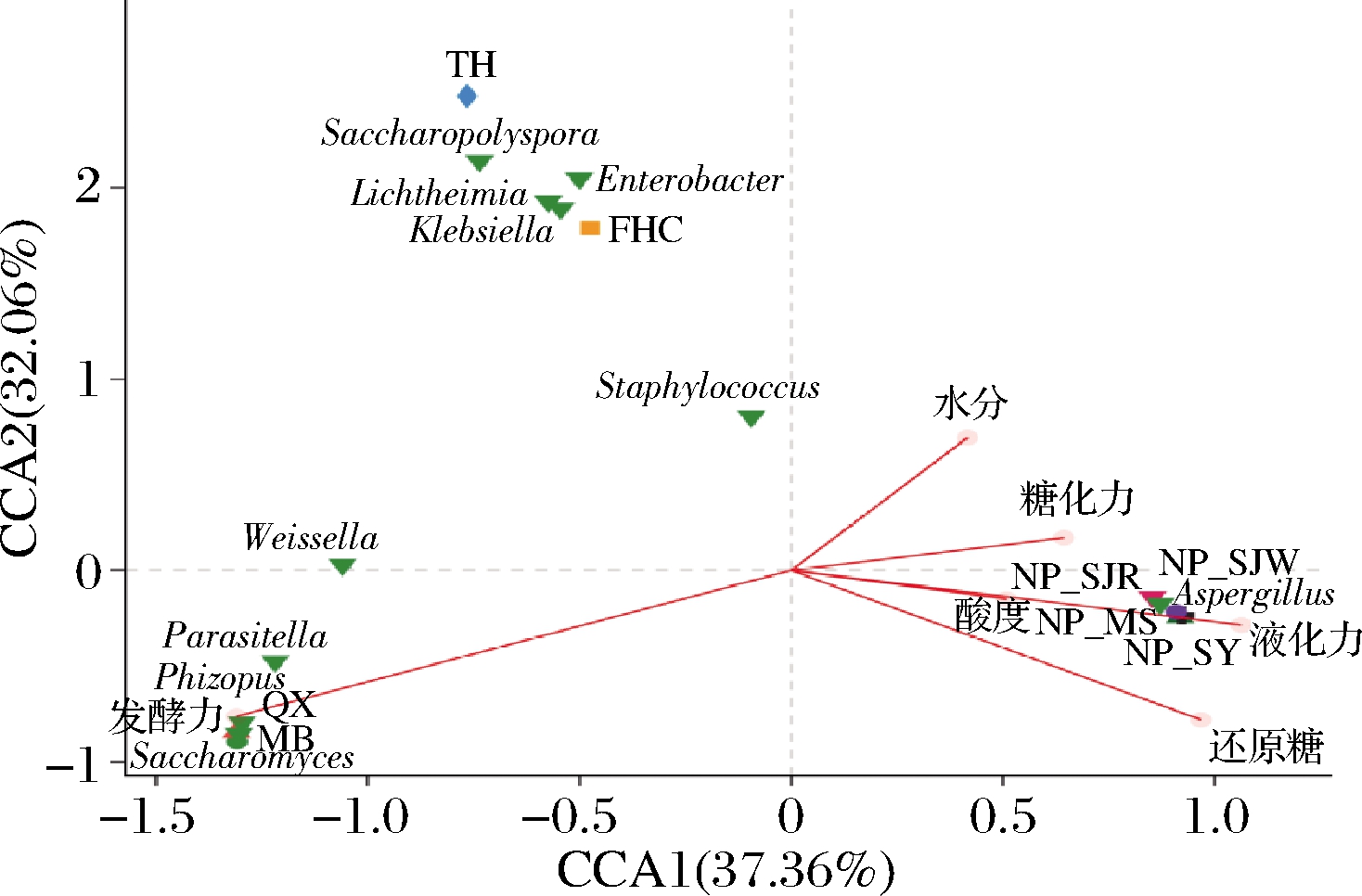
图2 八种中日酒曲微生物群落和理化因子的CCA分析
Fig.2 The CCA between microbial communities and physicochemical factors of 8 kinds of Chinese Jiuqu and Japanese koji
2.5 八种中日酒曲KEGG功能注释及差异分析
如图3所示,在KEGG一级代谢中共发现微生物代谢功能6类:代谢、人类疾病、生物体系统、遗传信息处理、环境信息处理和细胞过程。8种中日酒曲均以代谢为绝对优势功能(均>27%),说明酒曲内部微生物代谢活动均较为活跃,为各自风味的形成提供了物质基础。

图3 八种中日酒曲基因表达的KEGG一级代谢功能分析
Fig.3 KEGG analysis of gene expression on first level of 8 kinds of Chinese Jiuqu and Japanese koji
对代谢子功能进行具体分析和差异分析,如图4,共注释到12种代谢功能,由其丰度可知,8种中日酒曲中碳水化合物和氨基酸均存在较为旺盛的代谢特征。氨基酸决定了酒的风味,在酒的香型及口感形成中起着重要作用[24]。日本酒曲的氨基酸代谢和脂质代谢的相关基因表达量均高于中国酒曲,这可能是由于日本酒曲中主要为丝状真菌曲霉属,其具有较强的产糖化酶和蛋白酶能力。8种中日酒曲之间具有显著性差异的代谢功能有6个,分别为碳水化合物代谢、代谢通路总览、外源性生物降解和代谢、其他氨基酸代谢、其他次生代谢产物的生物合成、萜类和聚酮类代谢,其中中国酒曲的碳水化合物代谢、代谢通路总览、萜类和聚酮类代谢的相关基因表达量均高于日本酒曲,推测可能与中国酒曲中主要存在的根霉属、糖多孢菌属和横梗霉属有关。
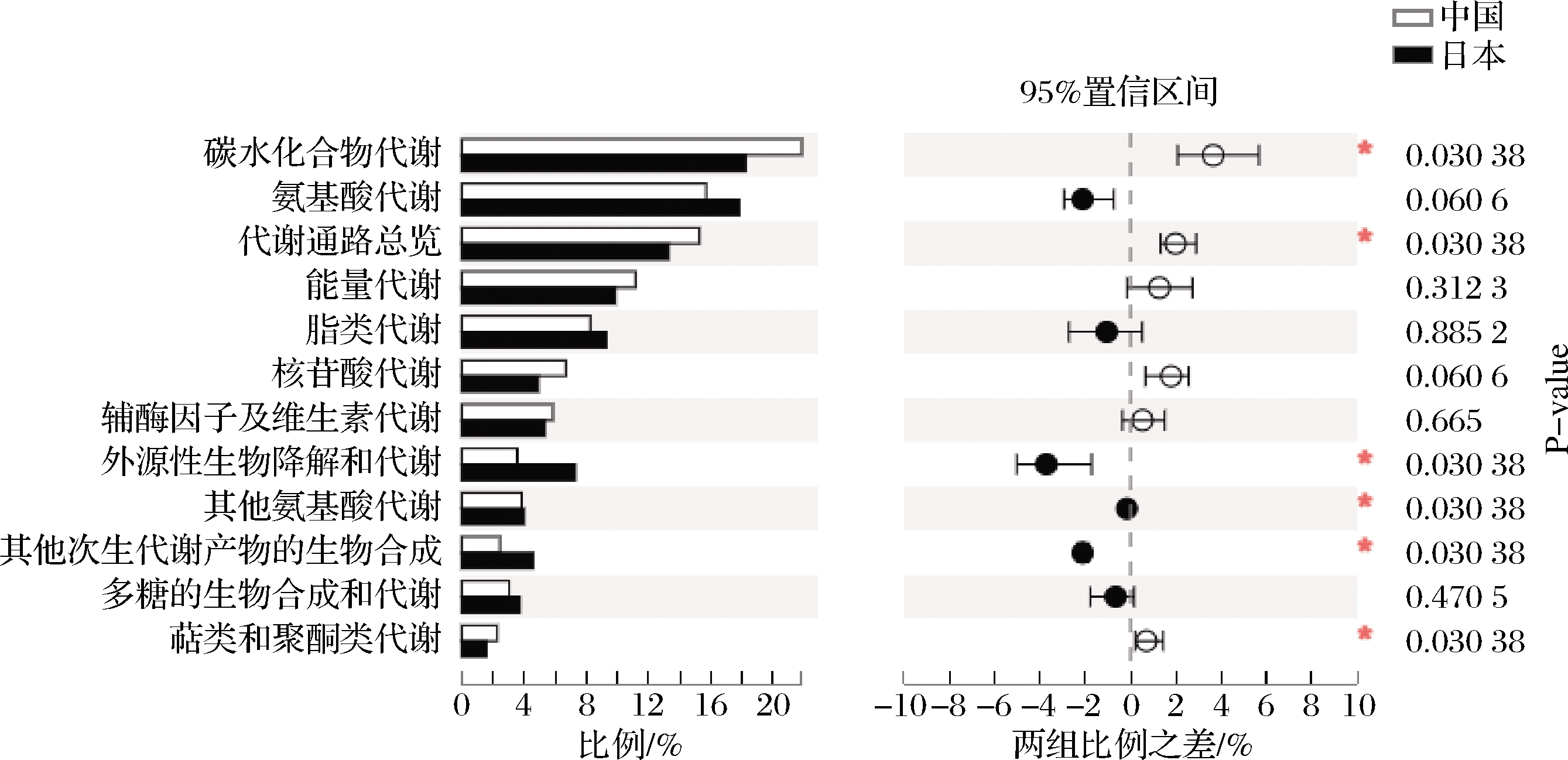
图4 八种中日酒曲代谢途径的基因表达KEGG二级代谢功能差异分析
Fig.4 KEGG variance analysis of gene expression on second level between metabolism of Chinese Jiuqu and Japanese koji
3 结论
本研究以8种中日典型酒曲为研究对象,通过宏基因组技术探究了中日酒曲的微生物多样性。总体而言,中日酒曲之间具有较显著差异的有曲霉属、根霉属、糖多孢菌属和横梗霉属,日本酒曲以曲霉属为主,中国酒曲以根霉属、糖多孢菌属和横梗霉属为主。同时对8种酒曲的理化特性进行了对比分析,其中日本酒曲的平均糖化力、液化力和还原糖含量均略高于中国酒曲,而中国酒曲的平均发酵力略高于日本酒曲。由CCA可知,8种中日酒曲中微生物的种群结构与其理化指标存在明显关联,且发酵力、液化力和还原糖含量与微生物物种分布相关程度最大。此外,对中日酒曲进行了KEGG功能注释,中日酒曲中微生物均主要参与代谢功能,集中在碳水化合物代谢、氨基酸代谢和代谢通路总览,其中中日酒曲之间具有显著性差异的有碳水化合物代谢、代谢通路总览。本文探究了中日酒曲中微生物群落及理化特性的对比差异及相互关系,有助于利用全基因组测序解析中日酒曲与各类风味物质形成相关功能微生物,后续可通过分析功能微生物具体代谢途径和机理来研究其对酒曲及酒的风味和品质的作用,进一步筛选特定功能微生物,开发出功能型强化酒曲,并将功能型强化酒曲应用于几类中国酒的试生产过程中,以期为我国酿酒工业化发展提供研究基础。
[1] 黄志久,赵金松,刘莎,等.小曲清香白酒生产工艺现状及发展趋势[J].酿酒,2018,45(6):17-19.
HUANG Z J,ZHAO J S,LIU S,et al.Introduction to Xiaoqu Qingxiang Baijiu production technology present situation and development trend[J].Liquor Making,2018,45(6):17-19.
[2] LIU R,FU Z K,ZHANG F J,et al.Effect of yellow rice wine on anti-aging ability in aged mice induced by D-galactose[J].Food Science and Human Wellness,2020,9(2):184-191.
[3] 菅间诚之助,周立平.日本酿造技术的发展与中国的关系[J].四川食品与发酵,1994,30(4):18-22.
SEINOSUKE S,ZHOU L P.Relationship ofthe brewing technology development between Japanese and China[J].Sichuan Food and Fermentation,1994,30(4):18-22.
[4] 本田建次,张文学.白酒と焼酎の製造法および成分の比較[J].でん粉と食品,2008(4):7-13.
KIDA K,ZHANG W X.Comparison of manufacturing methods and components of Baijiu and Shochu[J].Starch and Food,2008(4):7-13.
[5] 稲垣,真美.新ほんものの名酒·名品:日本酒·本格焼酎·泡盛·地ビール[M].东京:三一書房,2007.
YAMAMOTO S,TOMIMORI T.New Authentic Famous Wine:Japanese Sake,Shaochu,Awamori,Local Beer[M].Tokyo:San-Ichi Shobo,2007.
[6] TANG Q X,HE G Q,HUANG J,et al.Characterizing relationship of microbial diversity and metabolite in Sichuan Xiaoqu[J].Frontiers in Microbiology,2019,10:696.
[7] 唐洁.清香型小曲酒微生物群落结构及功能的研究[D].无锡:江南大学,2012.
TANG J.Characterization of the structure and function of the microbial community in light aroma type liquor started by Xiaoqu[D].Wuxi:Jiangnan University,2012.
[8] ZHANG K Z,LI Q,WU W C,et al.Wheat qu and its production technology,microbiota,flavor,and metabolites[J].Journal of Food Science,2019,84(9):2 373-2 386.
[9] LIU P H,ZHANG L H,DU X W,et al.Dynamic analysis of physicochemical and biochemical indices and microbial communities of light-flavor Daqu during storage[J].Journal of the American Society of Brewing Chemists,2019,77(4):287-294.
[10] GAN S H,YANG F,SAHU S K,et al.Deciphering the composition and functional profile of the microbial communities in Chinese Moutai liquor starters[J].Frontiers in Microbiology,2019,10:1 540.
[11] 雷忠华,陈聪聪,陈谷.基于宏基因组和宏转录组的发酵食品微生物研究进展[J].食品科学,2018,39(3):330-337.
LEI Z H,CHEN C C,CHEN G.Metagenomic and metatranscriptomic analysis of microbiota in fermented foods:Review of recent advances[J].Food Science,2018,39(3):330-337.
[12] 陈青柳.绍兴机械化黄酒风味形成途径和功能微生物的研究[D].无锡:江南大学,2018.
CHEN Q L.Study on the flavor formation and functional microorganism of Shaoxing mechanized Huangjiu[D].Wuxi:Jiangnan University,2018.
[13] ICHIKAWA E,HIRATA S,HATA Y,et al.Analysis of metabolites in Japanese alcoholic beverage sake made from the sake rice Koshitanrei[J].Bioscience,Biotechnology,and Biochemistry,2019,83(8):1 570-1 582.
[14] 中华人民共和国工业和信息化部.QB/T 4257—2011 酿酒大曲通用分析方法[S].北京:中国轻工业出版社,2011.
Ministry of Industry and Information Technology of the People’s Republic of China.QB/T 4257—2011 General methods of analysis for Daqu[S].Beijing:China Light Industry Press,2011.
[15] 沈怡方.白酒生产技术全书[M].北京:中国轻工业出版社,1998.
SHEN Y F.Encyclopedia of Liquor Production Technology[M].Beijing:China Light Industry Press,1998.
[16] XIAO M Y,HUANG T,XU Y Z,et al.Metatranscriptomics reveals the gene functions and metabolic properties of the major microbial community during Chinese Sichuan Paocai fermentation[J].Food Microbiology,2021,98:103573.
[17] ALTSCHUL S F,MADDEN T L,SCHFFER A A,et al.Gapped BLAST and PSI-BLAST:A new generation of protein database search programs[J].Nucleic Acids Research,1997,25(17):3 389-3 402.
[18] XIE C,MAO X Z,HUANG J J,et al.KOBAS 2.0:A web server for annotation and identification of enriched pathways and diseases[J].Nucleic Acids Research,2011,39(S2):W316-W322.
[19] 王俏,郭聃洋,王旭亮,等.中国白酒不同香型酒曲理化性能对比分析[J].酿酒科技,2015(6):6-10.
WANG Q,GUO D Y,WANG X L,et al.Comparative analysis of physiochemical properties of Baijiu(liquor)starter of different flavor types[J].Liquor-Making Science & Technology,2015(6):6-10.
[20] 坂口谨一郎.日本的酒[M].成都:四川人民出版社,2013.
SAKAGUCHI K,Nihon no Sake[M].Chengdu:Sichuan People’s Publishing House,2013.
[21] 徐岩,徐文琦,顾国贤,等.中国酒米曲霉与日本清酒米曲霉特性的研究[J].酿酒,1998,25(4):8-11.
XU Y,XU W Q,GU G X,et al.Study on the characteristics of Aspergillus oryzae in Chinese wine and Japanese sake[J].Liquor Making,1998,25(4):8-11.
[22] 唐鳗秋,夏玙,覃凤阳,等.四川黄酒麦曲发酵过程中理化特性及微生物多样性变化研究[J].食品与发酵工业,2021,47(24):35-40.
TANG M Q,XIA Y,QIN F Y,et al.Physicochemical characteristics and microbial diversity in wheat Qu serving for Sichuan Huangjiu during fermentation[J].Food and Fermentation Industries,2021,47(24):35-40.
[23] 袁华伟.浓郁型米烧酒的生产技术开发及其酒糟的再利用研究[D].成都:四川大学,2015.
YUAN H W.Researches on the development of a process for producing strong flavor rice shochu and recycling the stillage after distillation[D].Chengdu:Sichuan University,2015.
[24] 麻颖垚,胡萍,孙利林,等.宏基因组学分析酱香型白酒窖内发酵优势菌与代谢功能的相关性[J].现代食品科技,2020,36(6):128-136.
MA Y Y,HU P,SUN L L,et al.Metagenomics analyze the relationship between the dominant bacteria and fungi and metabolism function in the pit fermentation of Maotai-flavor liquor[J].Modern Food Science and Technology,2020,36(6):128-136.