食品安全引起的疾病影响人类健康和生命,会造成巨大经济损失[1]。其中最为常见的食源性致病菌为大肠杆菌、单增李斯特氏菌和沙门氏菌。根据《世界卫生报告》,全世界每年约有1/10的人因食物污染而生病,每年约有180万人因食源性疾病而死亡[2]。目前已有多种食源性致病菌的检测方法,广泛应用的有传统菌落分离的培养方法、免疫学方法和分子生物学法等。其中,分子生物学检测方法中的环介导等温扩增(loop mediated isothermal amplification,LAMP)技术仅需要一个恒温平台,便能将样品进行高效、快速的核酸扩增反应,达到检测数量[3],具有检测时间短、灵敏性高和检测结果准确等优势。但由于预处理时间长,需要专业的检测人员操作,不易在现场及基层推广。
微流控技术是将传统实验室的基本功能整合到仅有几平方厘米的芯片上,仅通过pL或μL体积的微量流体,便能实现生化分析的各个步骤。此方法具有微型化、集成化、高通量、自动化的优势,为实现现场检测、低成本的生化分析提供了经济简便的检测技术途径。目前微流控检测芯片已广泛应用于血液检测[4]、药物筛选[5]、核酸分析[6]、水质分析[7]及食品检测[8]等方面。
LAMP与微流控技术相结合,使病原菌检测更加快速、便捷。DOU等[9]使用聚二甲基硅氧烷与纸基结合的微型设备在LAMP反应后,使用便携式紫外线笔灯照射LAMP产物,可快速检测脑膜炎奈瑟氏球菌。此设备虽然成本较低,但是并不能实现高通量以及多样本的检测,而且在检测一些需要繁琐的DNA分离和纯化程序时,就显得尤为不足。LUO等[10]研发出的一种微流控多重电化学LAMP芯片,检测精度高,但是分析末端电信号的电化学检测器价格贵,且不具备高通量样品检测的能力。LIU等[11]研发出具有完全集成化的LAMP分析高通量液滴微流体系统,使用液滴技术结合磁珠在聚四氟乙烯毛细管进行结核分枝杆菌的检测。可同时处理多个样品耗时短临床敏感性特异性高,但此微流体平台需要外部设备微流体泵来控制液体流量,并需要辅助检测器进行扩增检测。
综上,需要外部设备来控制液体、检测器价格高、高通量样品检测能力是制约微流控技术用于食源性致病菌快速现场检测的原因。离心式微流控芯片能够通过离心力沿微流体通道泵送液体,无需复杂流体驱动设备,仅需使用普通的电机便能实现微流体的驱动,逐渐受到关注。显色结果将通过智能手机进行数据采集及计算,方便快捷适用于现场检测[12]。
本文基于LAMP设计制作出一种离心式微流控芯片,用于大肠杆菌、沙门氏菌和单增李斯特氏菌的3种食源性致病菌的快速可视化检测。首先,建立芯片上的LAMP反应体系并对反应条件进行优化,其次,通过离心式微流控平台实现食源性致病菌多样本、多指标的核酸等温扩增及可视化检测,最后对基于LAMP的离心式微流控芯片法检测多种食源性致病菌的特异性及灵敏性进行确认。
1 材料与方法
1.1 材料与试剂
材料:光学级聚甲基丙烯酸甲酯(polymethylmethacrylate,PMMA)板材,日本三菱;光学级双面胶,东莞富印胶粘科技有限公司;营养琼脂培养基,青岛海博;LB肉汤培养基,上海博微;DP705磁珠提取试剂盒,天根生化科技有限公司;B600001 Taq DNA聚合酶,上海生工。
菌株:大肠杆菌(ATCC 43895)、单增李斯特氏菌(ATCC 19117),北京生物保藏中心;甲型副伤寒沙门氏菌(IQCC 10518),上海保藏生物技术中心。
1.2 仪器与设备
VLS2.30二氧化碳激光雕刻机,美国UNIVERSAL;TBK508芯片贴合机,深圳市深旺达科技有限公司;YQ-620C超声波清洗机,上海易净超声波仪器有限公司;DW-86L828型超低温保存箱,青岛海尔科技有限公司;HD850超净台,江苏杰森博生物科技有限公司;GHP-9160恒温培养箱,上海一恒科学仪器有限公司;ST16低温离心机,北京赛默飞科技有限公司。
1.3 实验方法
1.3.1 检测原理
采用LAMP作为食源性致病菌的检测方法,使用羟基萘酚蓝(hydroxy naphthol blue,HNB)作为芯片上LAMP反应的金属离子指示剂,HNB在高浓度的 Mg2+中呈现紫罗兰色;随着LAMP反应的进行,Mg2+浓度降低,失去Mg2+的HNB变成天蓝色,而阴性对照仍为紫罗兰色,阴性和阳性结果差异明显[13]。
基本检测过程:将3种不同致病菌的引物预存储在芯片上,再将芯片放置在自制的恒温离心式微流控平台上;使用移液枪添加样品缓冲液,通过再调节不同的离心速度,使样品进入检测腔进行等温扩增,发生显色反应;用手机放在固定光源固定高度的拍摄点进行拍照,对显色溶液进行RGB值对比。
1.3.2 芯片的设计与制作
芯片材质均为PMMA,由盖板、通道层、池体层及底板4层组成,厚度分别为0.5、0.8、2.1及0.5 mm,其三维结构如图1-a所示。盖板层主要包括进样孔及通气孔;通道层主要包括进样腔、等分腔、废液腔、检测腔(1a,1b,1c,1d)、毛细管阀等结构;池体层主要包括进样腔、等分腔、废液腔、检测腔(1a,1b,1c,1d)、微通道等结构组成,各腔室具有固定的体积,分别为100、25、25及25 μL,如图1-b所示。与底板进行密封键合,键合完成后芯片实物如图1-c所示,芯片由5个相同的单元组成,能够同时执行20个独立的反应。芯片设计5 °的偏心结构,目的是使流体流入4个相同的等分腔进行等分,并将多余样品流入到废液腔内。
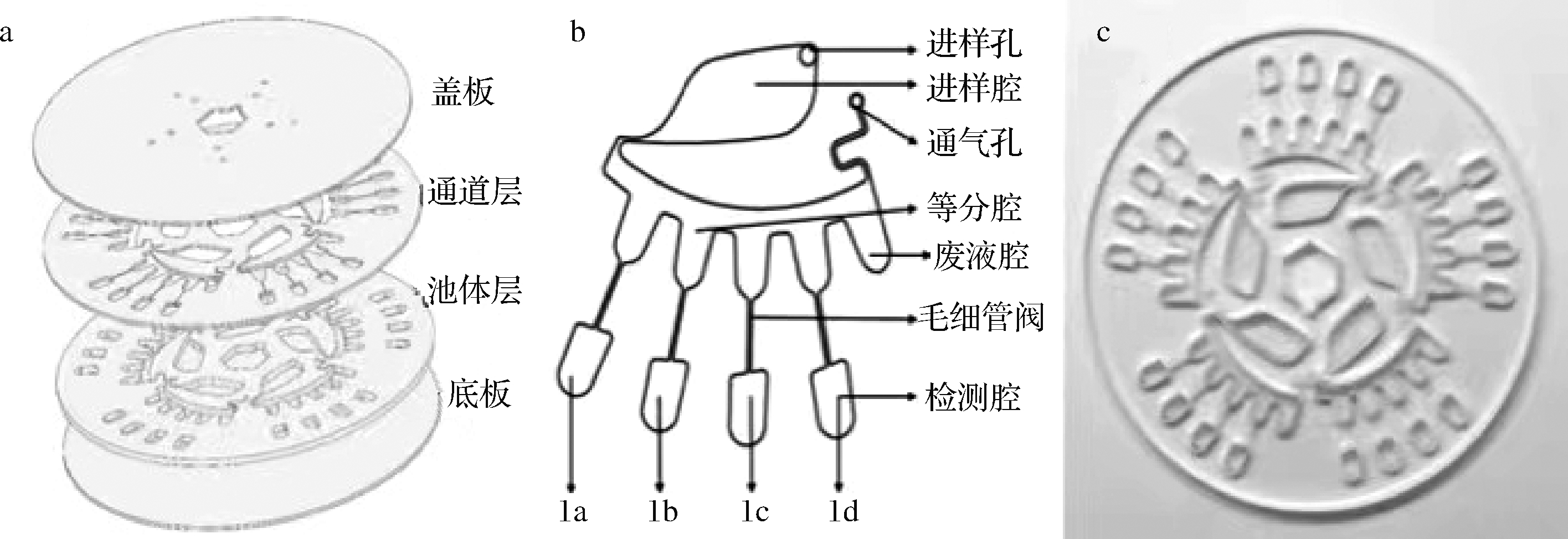
a-离心式微流控芯片三维结构;b-反应单元结构示意图;c-离心式微流控芯片实物图
图1 离心式微流控芯片结构示意图
Fig.1 Schematic diagram of the structure of centrifugal microfluidic chip
芯片制作采用二氧化碳激光雕刻法。采用Solidworks软件设计出芯片的三维立体结构图,并将立体结构分成3层平面图,包括顶层、通道层及底层;将各层的结构图形传输至激光雕刻机,进行平面加工,选择向量打印参数分别为:功率60 W,速度20 s,PPI 1000进行雕刻,得到二维的PMMA芯片;将雕刻完成的微流控芯片放入等离子超声波清洗器中清洗3次,功率100 W,清洗15 min,放入烘箱中烘干30 min;将烘干后的芯片模型置于真空贴合机中,设置键合参数为真空度100 kPa、键合压力4.2 kg/cm2、键合时间10 min,将3层结构对齐后进行压装;将芯片结构放入除泡室中,设置除泡压力为7.5 kg/cm2、除泡10 min,即获得最终芯片。
1.3.3 实验平台的搭建
为实现离心式微流控芯片上的流体控制、等温扩增及检测功能,设计并制作出一套离心式微流控核酸等温扩增装置,总体结构如图2所示。该装置主要由3个模块组成,分别为离心模块、加热模块及手机成像检测模块。该装置能够搭载不同设计原理的离心式微流控芯片,可实现转速控制离心、温度控制、可视化检测,具有较好的便携性和集成性。平均温度误差范围在±1 ℃,电机转速从低速向高速的过程中,误差能够控制在±10 r/min,微流控芯片中的试剂可以顺利通过设计的微通道,实现等温核酸扩增及检测。

图2 离心式微流控核酸等温扩增装置示意图
Fig.2 Schematic diagram of centrifugal microfluidic nucleic acid isothermal amplification device
1.3.4 离心式芯片的流体流动过程
在芯片键合之前,将4 μL的引物加入到每个反应腔中,并在低温冷冻干燥箱中干燥约40 min。在芯片使用前,进样孔及通气孔均用硅胶膜密封,以避免样品污染。从进样孔添加定量样品及LAMP缓冲液于进样腔内,再将离心式芯片固定到离心系统的旋转电机的芯轴上。调节转速,旋转方向为逆时针、旋转时间为15 s,测试流体分布的1次、2次离心速度。设定旋转速度从0 r/min开始,每增加100 r/min测试1次,当离心速度能将样品及缓冲液等分到偏心结构的4个独立腔体,并将多余样品流入到废液腔内,得到1次离心速度。当毛细管阀引起的毛细管力无法承受离心压力时,样品通过毛细管阀进入反应腔,得到2次离心速度。最终,当被检测样品进入检测腔后,使用硅胶密封贴将进样孔及通气孔密封,以防止液体蒸发形成气溶胶污染。
1.3.5 芯片上LAMP反应体系的建立
采用New England Biolabs试剂盒,配合大肠杆菌、单增李斯特氏菌及甲型副伤寒沙门氏菌等菌种的特异性引物进行核酸扩增,验证所建立芯片上LAMP反应体系的可行性。将提取的模板DNA作为质量分数为100%的源性成分DNA。LAMP反应试剂盒体系:10×ThermoPol 缓冲液、6 mmol/L MgSO4、1.4 mmol/L dNTP premix、1.6 μmol/L FIP/BIP、0.2 μmol/L F3/B3、40 U Bst DNA聚合酶、1 μL DNA模板及200 μmol/L的HNB溶液。
使用Primer Explorer V4软件(http://www.primerexplorer.jp/e/)为每种目标食源性致病菌设计了4种LAMP引物。有学者设计了4条特异性引物用于LAMP,包括2条内引物(FIP/BIP),2条外引物(F3/B3)[14-15],大肠杆菌、单核细胞增生李斯特氏菌及沙门氏菌的LAMP引物分别如表1~表3所示。引物由上海生工生物工程技术服务公司合成。
表1 大肠杆菌的LAMP引物
Table 1 LAMP primers of E.coli
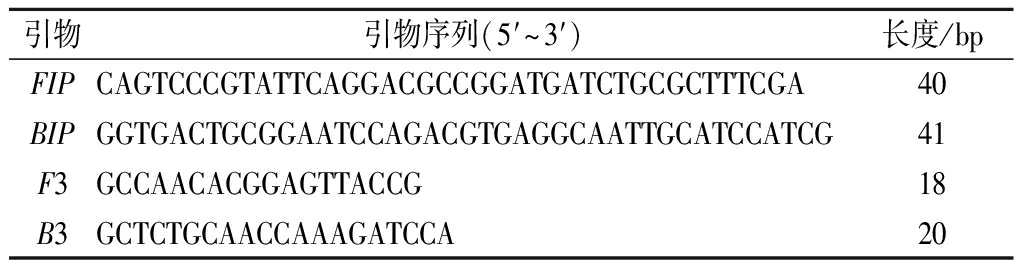
引物引物序列(5′~3′)长度/bpFIPCAGTCCCGTATTCAGGACGCCGGATGATCTGCGCTTTCGA40BIPGGTGACTGCGGAATCCAGACGTGAGGCAATTGCATCCATCG41F3GCCAACACGGAGTTACCG18B3GCTCTGCAACCAAAGATCCA20
表2 单核细胞增生李斯特氏菌的LAMP引物
Table 2 LAMP primers of Listeria monocytogenes
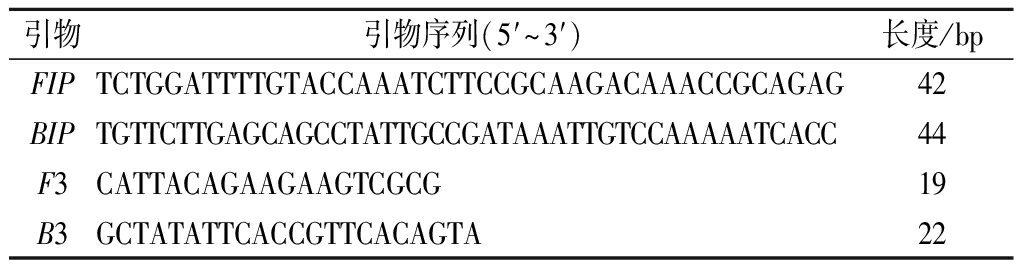
引物引物序列(5′~3′)长度/bpFIPTCTGGATTTTGTACCAAATCTTCCGCAAGACAAACCGCAGAG42BIPTGTTCTTGAGCAGCCTATTGCCGATAAATTGTCCAAAAATCACC44F3CATTACAGAAGAAGTCGCG19B3GCTATATTCACCGTTCACAGTA22
表3 沙门氏菌的LAMP引物
Table 3 LAMP primers of Salmonella paratyphi
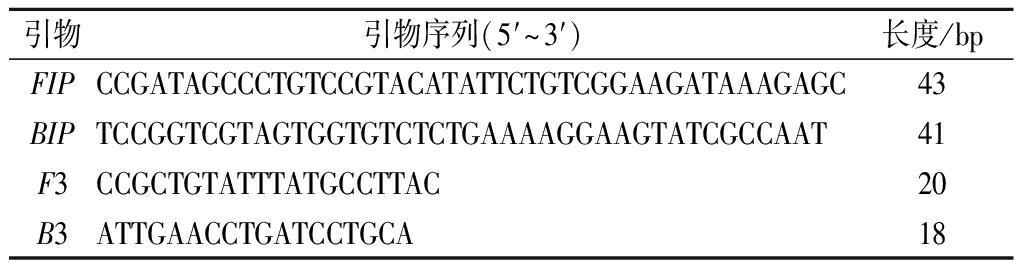
引物引物序列(5′~3′)长度/bpFIPCCGATAGCCCTGTCCGTACATATTCTGTCGGAAGATAAAGAGC43BIPTCCGGTCGTAGTGGTGTCTCTGAAAAGGAAGTATCGCCAAT41F3CCGCTGTATTTATGCCTTAC20B3ATTGAACCTGATCCTGCA18
1.3.6 芯片上LAMP实验条件的优化
为了进一步优化芯片上的可视化检测体系,采用上述芯片对浓度为1×109 CFU/mL大肠杆菌菌悬液提取核酸作为模板。芯片上LAMP反应试验温度选择65 ℃恒温60 min,选取终浓度为4、6、8、10 mmol/L的Mg2+缓冲液进行实验,探索对Mg2+浓度LAMP的影响;选用HNB浓度为120、150和200 μmol/L的HNB溶液进行试验,挑选显色反应可视化最明显的反应参数。
1.3.7 图像处理
为了提高颜色分析的可靠性,将不同引物下反应腔的颜色变化的结果,用基于RGB的图像处理方法进行表征。将手机拍摄的显色区域的图片导入Image J软件中,随机选取3个20×20的像素点,分析R、G、B 3个通道的直方图,分别记录R、G、B值,最后计算3个像素点R、G、B平均值。
使用RGB图像处理的方法对检测结果的颜色变化进行定量分析,计算出45个阴性反应G/R的平均比率为0.91,180个阳性反应G/R的平均比率为1.233,因此G/R阴性与阳性之差为0.323;计算出B/R的45个阴性反应的平均比率为1.44,180个阳性反应的平均比率为1.75,因此B/R阴性与阳性之差为0.31;计算出G/B的30个阴性反应的平均比率为0.67,180个阳性反应的平均比率为0.71,因此G/B阴性与阳性之差为0.04。从阳性和阴性反应之差的数值来看,G/R和B/R大于G/B,因此选取使用G/R和B/R值作为区分阴性阳性的标准。
1.3.8 芯片上检测多种食源性致病菌的特异性
在芯片的3个单元进行检测,图1-b中检测腔1a~1c分别预存储大肠杆菌、单增李斯特氏菌、沙门氏菌的引物,1d为冷冻干燥ddH2O阴性对照组。在1、2、3单元中分别添加仅含有大肠杆菌、单增李斯特氏菌、沙门氏菌的核酸缓冲液;按照1.3.5所述反应体系,进行LAMP扩增,验证一块芯片上同时分别检测3种病原菌的可能性。
在芯片的4个单元进行检测。将3种菌种的核酸缓冲液两两混合得到的3种混合核酸缓冲液分别添加至芯片的前3个单元中,4单元中添加含有3种菌的混合核酸缓冲液,按照1.3.5所述反应体系,在离心式微流控芯片上进行LAMP扩增,验证是否能够准确检测出多种病原菌,即微流控芯片检测是否具有特异性。
1.3.9 芯片上3种食源性致病菌的敏感性
在两块芯片的9个反应单元对3种食源性致病菌的敏感性进行测试。用上述3种食源性致病菌的核酸混合液,按照10倍浓度梯度进行稀释,得到10~109 copies/μL,加入到9个反应单元的进样腔中,根据显色结果,分析不同食源性致病菌核酸的检测限。
2 结果与分析
2.1 离心式芯片的流体流动过程验证结果
离心式微流控芯片中液体流动过程如图3所示,离心式微流控芯片的加样状态如图3-a所示,将LAMP试剂及DNA样品加载到离心式微流控芯片中。

a-加样状态;b-低速离心状态;c-高速离心状态
图3 微流控芯片流体流动过程
Fig.3 Fluid flow process in the microfluidic chip
在300 r/min下,LAMP试剂开始流入偏心等分通道中进行等分。在900 r/min时候,低速离心状态如图3-b所示,溶液充满等分腔,多余液体流入废液腔。在速度调节至2 300 r/min时候,高速离心状态如图3-c所示,毛细管阀被激活,等分完成后LAMP试剂进入检测腔与引物混合,开始DNA扩增。在DNA扩增之前,使用硅胶膜进行密封,以防止等温扩增过程中液体蒸发、损失及气溶胶性污染。
2.2 芯片上LAMP实验条件的优化结果
当Mg2+终浓度为4、6、8、10 mmol/L时,大肠杆菌完成LAMP反应后的显色结果,如图4所示。由图可以看出,在Mg2+终浓度8 mmol/L时,蓝色和紫色的区分程度最高,因此选取实验所用Mg2+浓度为8 mmol/L。

a-4 mmol/L;b-6 mmol/L;c-8 mmol/L;d-10 mmol/L
图4 不同Mg2+浓度时的显色结果
Fig.4 Color reaction results at different Mg2+concentrations
当HNB浓度为120、150和200 μmol/L时,大肠杆菌完成LAMP反应后的显色结果,如图5所示。由图可以看出,在HNB浓度为200 μmol/L时,蓝色和紫色的区分程度最高,因此选取实验所用HNB浓度为200 μmol/L。

a-120μmol/L;b-150μmol/L;c-200μmol/L
图5 不同HNB浓度的显色结果
Fig.5 Color reaction results at different HNB concentrations
2.3 芯片上多种食源性致病菌的特异性检测
为了证明离心式微流控芯片能够同时进行多种食源性致病菌的检测,采用大肠杆菌、单增李斯特氏菌、沙门氏菌进行LAMP反应,进行多重检测。
在图6-a中1单元中添加仅含有大肠杆菌核酸缓冲液,1a中颜色由紫罗兰色变为蓝色,其他区域均无颜色变化;在图6-a中2单元中添加仅含有单增李斯特氏菌核酸缓冲液,结果显示,仅1b发生颜色变化,其他区域均无颜色变化;在图6-a中3单元中添加仅含有沙门氏菌核酸缓冲液,结果显示,仅1c发生颜色变化,其他区域均无颜色变化。结果表明该芯片能够检测出单一菌株。
在图6-b中1单元添加含有大肠杆菌及单增李斯特氏菌的混合核酸缓冲液,仅1a与1b发生由颜色变化,其他区域均无颜色变化;图6-b中2单元添加含有大肠杆菌及沙门氏菌的混合核酸缓冲液,仅1a与1c发生颜色变化,其他区域均无颜色变化;图6-b中3单元添加含有单增李斯特氏菌及沙门氏菌的混合核酸缓冲液,仅1b与1c发生颜色变化,其他区域均无颜色变化;图6-b中4单元添加含有大肠杆菌、单增李斯特氏菌及沙门氏菌的混合核酸缓冲液,在1a~1c区域发生颜色变化,阴性对照组无颜色变化。综上所述,3组引物均对靶细胞具有特异性,并且没有发生引物混合物溶液和所得DNA扩增子的蒸发而产生污染问题,证明可以在单个离心式微流控芯片上进行3种食源性致病菌的检测。

a-一种食源性致病菌的检测;b-多种食源性致病菌的检测;c-一种食源性致病菌G/R与B/R的关系;d-多种食源性致病菌G/R与B/R的关系
图6 芯片上3种食源性致病菌的特异性检测
Fig.6 Specific detection of three foodborne pathogens on the chip
最终对可视化数据进行RGB图像处理的方法进行数据分析,结果如图6-c、图6-d所示。从1种食源性致病菌G/R与B/R的关系可以看出,1a,2b,3c可以确定为阳性反应结果,其余为阴性反应结果。从芯片上有多种食源性致病菌G/R与B/R的关系可以看出,1单元1a,1b为阳性,2单元2a、2c为阳性,3单元3b、3c为阳性,4单元4a、4b、4c均为阳性。此结果与可视化结果相同,说明能够用G/R和B/R的数值能够有效区分阴性和阳性,离心式微流控芯片方法可以进行3种食源性致病菌的同时检测,且特异性良好。
2.4 芯片上3种食源性致病菌的敏感性实验结果
将3种浓度为10~109 copies/μL食源性致病菌的核酸混合液分别加入9个反应单元的进样腔,在离心式微流控芯片上进行LAMP扩增后结果如图7所示。图7-a中在1~5区域中均有颜色变化,阴性对照组无颜色变化。图7-b中在1~2区域中发生颜色变化,阴性对照组无颜色变化。在3~4区域中1a、1b及1c区域及阴性对照组均无颜色变化。当浓度≤102 copies/μL时,不能检测出来,离心式芯片上3种食源性致病菌的检测限为103 copies/μL。
通过RGB图像处理的方法进行验证,图7-c~图7-e分别表示大肠杆菌、单增李斯特氏菌及沙门氏菌G/R与B/R的关系,当3种菌的浓度为102和10 copies/μL时,检测结果都出现在阴性区,3种菌的浓度≥103 copies/μL时,检测结果都出现在阳性区,说明3种食源性致病菌的检测限为103 copies/μL。RGB图像处理结果与可视化结果相同,这表明用G/R和B/R的数值区分阴性和阳性结果具有较高的准确率。
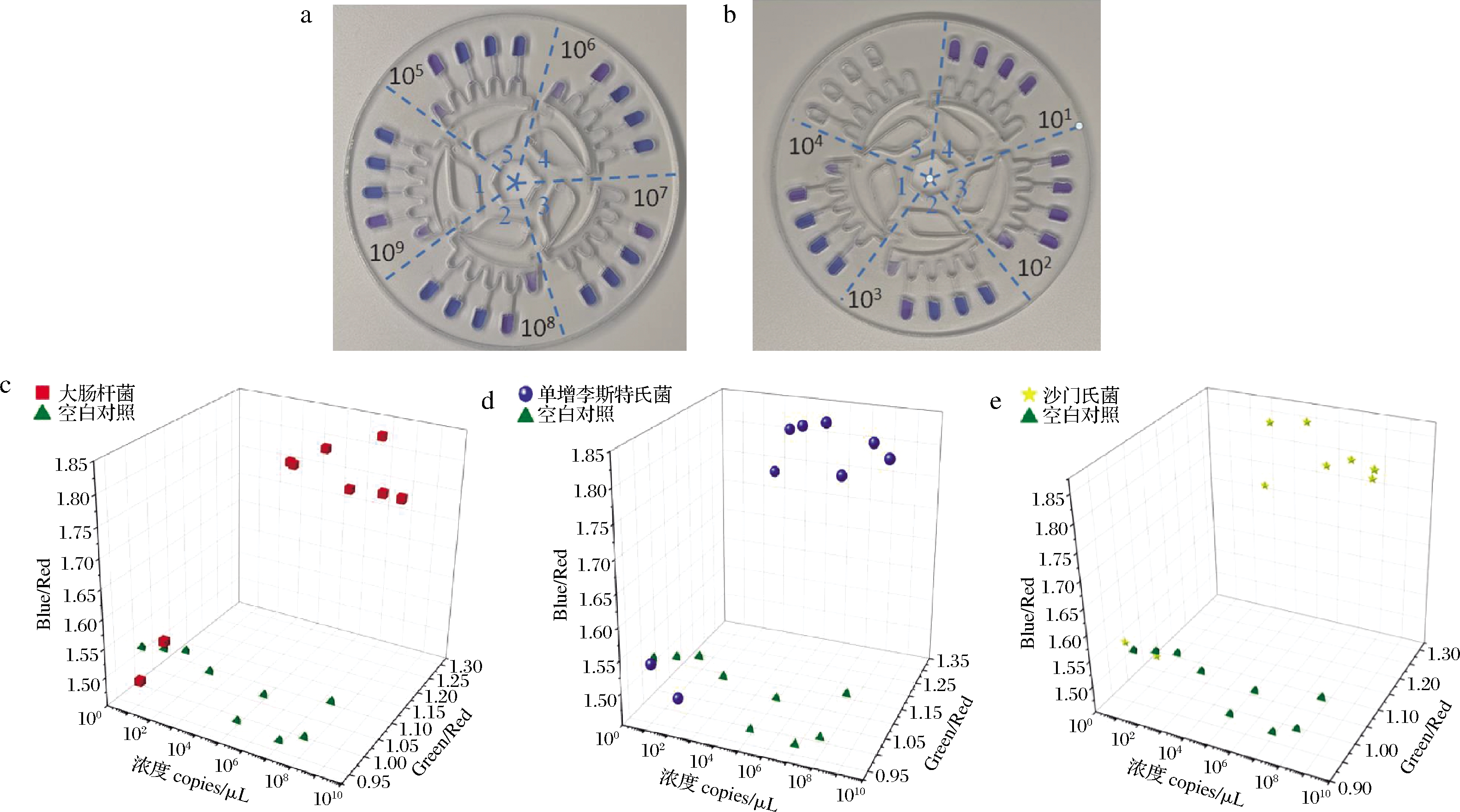
a-浓度为105-109 copies/μL的敏感性检测;b-浓度为10~104 copies/μL的敏感性检测;c-大肠杆菌G/R与B/R的关系;d-单增李斯特氏菌的G/R与B/R的关系;e-沙门氏菌的G/R与B/R的关系
图7 芯片上3种食源性致病菌的敏感性检测
Fig.7 Sensitivity detection of three food-borne pathogens on the chip
2.5 方法对比
将本文提出的离心式微流控LAMP等温扩增方法与已报道的LAMP扩增方法进行对比。吕观等[16]建立了金黄色葡萄球菌、沙门氏菌和大肠杆菌O157∶H7的实时荧光LAMP检测方法。通过配制完整的LAMP反应体系,对目标质粒进行扩增反应,在荧光定量 PCR仪上设置反应程序为:65 ℃预变性30 s;65 ℃,15 s,65 ℃;45 s,45个循环进行扩增,然后取25 μL反应产物和5 μL 6×载样缓冲液混合后2%凝胶电泳检测,测得沙门氏菌质粒的灵敏度为1.91×102 copies/μL,金黄色葡萄球菌质粒的灵敏度为2.72×102 copies/μL,大肠杆菌O157∶H7的质粒灵敏度为2.28×102 copies/μL。此方法使用EP管在PCR仪中进行恒温扩增,凝胶成像系统对扩增产物进行检测,整个检测过程耗时长,操作步骤繁多,不便于现场检测。LUO等[10]研发出一种微流控多重电化学LAMP芯片,将芯片置于智能恒温加热板上在63 ℃下进行扩增,通过数字光纤耦合的光学传感器系统进行电化学检测鉴定结核分枝杆菌、流感嗜血杆菌和肺炎克雷伯菌,检测限分别为28、17、16 copies/μL。此检测方法灵敏度很高,但需要昂贵的检测设备,不便于推广。上述研究中的检测过程都需要专门的检测设备,包括凝胶成像系统、光学传感器等。本文提出的离心式微流控LAMP等温扩增体系在检测灵敏度方面还有一定的提升空间,但此方法通过离心力沿微流体通道泵送液体,不需要复杂流体驱动设备,仅需使用普通的电机便能实现微流体的驱动;其次,整个检测过程不需要专门的检测设备,将显色结果通过智能手机进行数据采集及计算,区分阳性反应和阴性反应,实验条件更加方便,适用于现场检测;此外,可以同时进行5种样品的3种食源性致病菌的检测,大大提高了检测的通量。离心式微流控芯片法与ELISA法及实时荧光定量PCR法相比较,反应条件简单仅需恒定温度,便能快速扩增目的基因,敏感性与实时荧光定量PCR法相当,且基于LAMP的离心式微流控芯片具有反应时间短,试剂消耗量少,易于集成等优势,具有实现核酸提取、扩增、检测集成化、自动化的发展潜力。
3 结论
本文基于LAMP技术检测原理,设计了离心式微流控检测芯片,并通过对LAMP实验中的Mg2+浓度以及HNB浓度进行优化,使得可视化检测结果更加明显。实验结果表明,在900 r/min转速下,微流控芯片中溶液充满等分腔,多余液体流入废液腔,在2 300 r/min转速下,毛细管阀被激活,LAMP试剂进入检测腔与引物混合,进行核酸扩增。用羟基酚蓝染料作为指示剂,通过肉眼观察芯片上的颜色变化从紫罗兰色到天蓝色,结合LAMP反应的结果,使用RGB的数据处理与可视化结果进行对比,能够更加准确的区分阳性反应和阴性反应。采用离心式微流控检测芯片对大肠杆菌、沙门氏菌和单增李斯特氏菌进行检测,能够在60 min内完成,并且该芯片具有良好的特异性及敏感性,检测限为103 copies/μL。本研究还存在一定的局限性,如未考虑实际食源性致病菌检测的食品基质,且通过显色反应得出的检测结果精度还不够高,仅在现场快速检测的半定量分析。后续研究还可以将核酸提取及核酸扩增集成到一张芯片上,达到核酸提取、扩增、检测的集成化、自动化。
[1] SCHARFF R L,BESSER J,SHARP D J,et al.An economic evaluation of pulsenet[J].American Journal of Preventive Medicine,2016,50(5):S66-S73.
[2] SCALLAN E,HOEKSTRA R M,MAHON B E,et al.An assessment of the human health impact of seven leading foodborne pathogens in the United States using disability adjusted life years[J].Epidemiology and Infection,2015,143(13):2 795-2 804.
[3] BRASSARD D,GEISSLER M,DESCARREAUX M,et al.Extraction of nucleic acids from blood:Unveiling the potential of active pneumatic pumping in centrifugal microfluidics for integration and automation of sample preparation processes[J].Lab on a Chip,2019,19(11):1 941-1 952.
[4] MOON J M,KIM D M,KIM M H,et al.A disposable amperometric dual-sensor for the detection of hemoglobin and glycated hemoglobin in a finger prick blood sample[J].Biosensors & Bioelectronics,2017,91:128-135.
[5] KITAEVA K V,RUTLAND C S,RIZVANOV A A,et al.Cell culture based in vitro test systems for anticancer drug screening[J].Frontiers in Bioengineering and Biotechnology,2020,8:322.
[6] LIU R D,MCCONNELL E M,LI J X,et al.Advances in functional nucleic acid based paper sensors[J].Journal of Materials Chemistry.B,2020,8(16):3 213-3 230.
[7] NAVI M,ABBASI N,SALARI A,et al.Magnetic water-in-water droplet microfluidics:Systematic experiments and scaling mathematical analysis[J].Biomicrofluidics,2020,14(2):024101.
[8] GAMBINO-SHIRLEY K J,TESFAI A,SCHWENSOHN C A,et al.Multistate outbreak of Salmonella Virchow infections linked to a powdered meal replacement product—United States,2015-2016[J].Clinical Infectious Diseases,2018,67(6):890-896.
[9] DOU M W,DOMINGUEZ D C,LI X J,et al.A versatile PDMS/paper hybrid microfluidic platform for sensitive infectious disease diagnosis[J].Analytical Chemistry,2014,86(15):7 978-7 986.
[10] LUO J,FANG X E,YE D X,et al.A real-time microfluidic multiplex electrochemical loop-mediated isothermal amplification chip for differentiating bacteria[J].Biosensors & Bioelectronics,2014,60:84-91.
[11] LIU D Y,LIANG G T,ZHANG Q,et al.Detection of Mycobacterium tuberculosis using a capillary-array microsystem with integrated DNA extraction,loop-mediated isothermal amplification,and fluorescence detection[J].Analytical Chemistry,2013,85(9):4 698-4 704.
[12] CHOI M S,YOO J C.Automated centrifugal-microfluidic platform for DNA purification using laser burst valve and Coriolis effect[J].Applied Biochemistry and Biotechnology,2015,175(8):3 778-3 787.
[13] CHOOPARA I,ARUNRUT N,KIATPATHOMCHAI W,et al.Rapid and visual Chlamydia trachomatis detection using loop-mediated isothermal amplification and hydroxynaphthol blue[J].Letters in Applied Microbiology,2017,64(1):51-56.
[14] SEO J H,PARK B H,OH S J,et al.Development of a high-throughput centrifugal loop-mediated isothermal amplification microdevice for multiplex foodborne pathogenic bacteria detection[J].Sensors & Actuators B Chemical,2017,246:146-153.
[15] LIU Z M,YAO C H,WANG Y M,et al.A G-quadruplex DNAzyme-based LAMP biosensing platform for a novel colorimetric detection of Listeria monocytogenes[J].Analytical Methods,2018,10(8):848-854.
[16] 吕观.免疫磁珠-环介导等温扩增法快速检测三种食源性致病菌[D].广州:暨南大学,2020.
LYU G.Rapid detection of three food-borne pathogens by immunomagnetic bead-loop-mediated isothermal amplification method[D].Guangzhou:Jinan University,2020.