酸橙(Citrus aurantium L.)为芸香科柑橘属植物,广泛分布于浙江、四川、湖南、江西、福建等省份,可被用于香料、果汁和膳食营养补充剂的加工;在传统中药中,酸橙可作为枳实或者枳壳,治疗消化不良和胀气[1]。现代药理学研究表明酸橙具有抗氧化[2]、抗肿瘤[3]、抑菌[4]和防止动脉粥样硬化[5]等功效,其良好的健康效应与类黄酮、生物碱、类柠檬苦素等多种生物活性成分密切相关。
目前对于酸橙的研究较少且主要集中在其枳壳与枳实中的化学成分以及药理学方面,邓可众等[6]利用高效液相色谱建立了酸橙果实类药材中8种类黄酮和3种香豆素类化合物的定量分析方法。ANA等[7]利用UPLC-PDA-ESI-MS对酸橙中的9种酚类化合物(5种类黄酮和4种酚酸)进行了分析鉴定。张栋健等[8]通过UPLC-QTOF-MS/MS分析了发酵炮制过程对于枳壳中类黄酮和柠檬苦素成分的影响。以上研究仅集中于酸橙中的某一类生物活性成分,或者某一种酸橙品种的生物活性成分,难以反映药效物质基础。有研究表明,不同品种及不同部位中含有的生物活性成分往往存在较大差异[9],有必要对不同品种及不同部位酸橙果实的生物活性成分进行系统研究。从而为酸橙的质量评价和药效物质基础研究提供实验依据,并为酸橙资源的综合利用奠定基础。
本文基于本实验室前期建立的快速且能同时筛查柑橘中生物活性物质的超高效液相色谱-四极杆-飞行时间高分辨质谱的方法,同时结合数据库、标准品和相关文献对6个不同品种以及不同部位的酸橙生物活性物质进行靶向和非靶向高分辨率筛查,以期为酸橙资源的综合利用提供一定的参考。
1 材料和方法
1.1 材料和试剂
2020年12月于中国农业科学院柑桔研究所国家果树种质资源(重庆)柑橘圃采集6个品种的酸橙果实,包括小叶酸橙(XY)、代代酸橙(DD)、万木橙(WM)、蚌柑(BG)、摩洛哥酸橙(MLG)、黄皮酸橙(HP)。在各个方向上采集发育良好、无病虫害、处于成熟期的酸橙果实(图1)。

S1-小叶酸橙;S2-代代酸橙;S3-万木橙;S4-蚌柑;S5-摩洛哥酸橙;S6-黄皮酸橙(下同)
图1 六种酸橙果实的样品图
Fig.1 Pictures of six kinds of sour orange fruits
甲酸(色谱纯),上海吉至生化科技有限公司。本研究共使用95种标准物质,包括46种类黄酮、9种酚酸、3种类柠檬苦素、8种生物碱、29种香豆素。新北美圣草苷、5-降甲基蜜桔黄素、甲基橙皮苷、地奥司明、香叶木素、香蒲新苷等,成都克洛玛生物科技有限公司;花椒毒醇、白当归素、珊瑚菜素、蛇床子素、根皮苷、异槲皮苷、槲皮素、异橙黄酮、水仙苷等,上海源叶生物技术有限公司;辛弗林、N-甲基酪胺、香柠檬亭,美国ChromaDex;甲醇和乙腈(色谱纯)、苯肾上腺素、大麦芽碱、酪胺和橙皮油内酯,美国Sigma-Aldrich;章鱼胺,德国Dr.Ehrenstorfer GmbH。所有标准品纯度均大于95%以上,具体标准品信息参照庞雯辉等[10]的文献。
1.2 仪器
KQ5200DE超声波清洗仪,昆山市超声仪器有限公司;Milli-Q AdvantageA10超纯水系统,美国Millipore;3K15离心机,美国Sigma-Aldrich;PB3002-S/FACT分析天平(感量0.01 g),瑞士梅特勒-托利多公司;有机相针式滤器(13 mm,0.22 μm),上海安谱实验科技股份有限公司;Acquity UPLC HSS T3(2.1 mm×100 mm,1.8 μm)色谱柱,美国Waters公司;Nexera X2 UPLC超高效液相色谱,日本岛津公司;SCIEX X500R QTOF四极杆串联飞行时间高分辨质谱仪,美国AB SCIEX公司。
1.3 样品准备
样品采摘后用去离子水洗净擦干。参照GB/T 8210—2011《柑桔鲜果检验方法》样品前处理方法。
分别称取5.0 g鲜重样品(果皮、果肉、果汁)于50 mL离心管中,加入10 mL甲醇,其中果肉加入5 mL甲醇,超声提取30 min(25 ℃,200 W),转速为10 000 r/min,离心5 min,取上清液置于50 mL离心管中。上述提取和离心步骤再重复3次后,合并上清液,并用甲醇定容到50 mL,果肉定容到25 mL,将上述提取液用0.22 μm微孔有机滤膜过滤后放置于进样小瓶,上机检测。
1.4 UPLC-Q-TOF-HRMS测定
本研究采用IDA模式在正、负2种离子模式下,通过AB SCIEX X500R QTOF高分辨四极杆串联飞行时间质谱仪采集质谱数据。色谱质谱条件采用庞雯辉等[10]的方法进行实验。
1.5 数据分析
将UPLC-Q-TOF-HRMS数据平台采集得到的数据信息导入SCIEX OS软件,建立未知化合物的鉴定流程,设立偏差值为5.0×10-6,匹配得分>80,对原始数据进行峰提取和峰对齐,并将提取得到的色谱峰进行分子式拟合,结合中草药数据库和SCI Finder数据库、标准品和相关文献进行对比,从而进行化合物的分析与鉴定,采用Origin 2017绘制总离子色谱图和层次聚类热图。
2 结果分析
2.1 酸橙果皮的总离子色谱图
使用UPLC-Q-TOF-HRMS系统对6种酸橙品种的果皮、果肉以及果汁的甲醇提取物进行分析。共鉴定出化合物84种,包括类黄酮44种,酚酸8种,类柠檬苦素2种,香豆素22种,生物碱8种。图2为正负离子模式下6个酸橙品种的果皮提取液的色谱图。
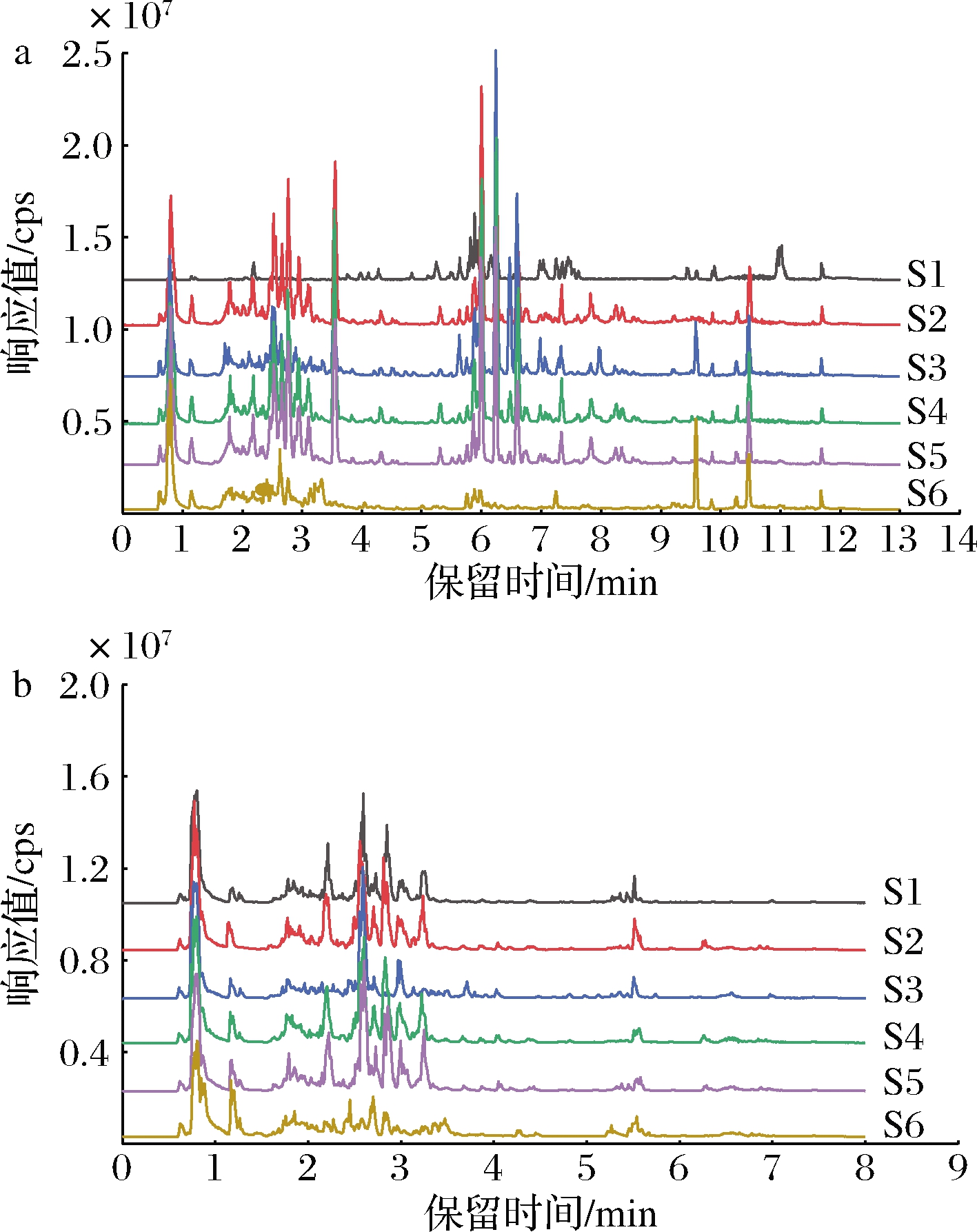
图2 六种酸橙果皮总离子图
Fig.2 Total ion chromatogram of the peel of six kinds of sour orange
通过比较色谱出峰可以发现,正负离子模式下,6种果皮提取液的色谱峰型和出峰数量具有一定的差异,表明不同酸橙品种的生物活性成分存在差异。
2.2 化合物的鉴定及裂解规律
2.2.1 类黄酮
类黄酮是柑橘中十分重要的多酚类化合物,影响柑橘水果的色泽和风味。其基本骨架为C6—C3—C6,根据取代基的不同,可分为黄酮、花青素、黄烷酮、黄酮醇等[11]。不同类型的黄酮苷元和黄酮糖具有特征的裂解模式,黄酮苷元容易发生中性丢失(糖基、—CH3、—CO、—H2O、—CH2O等自由基的丢失),或在苷元位置发生逆-狄尔斯-阿尔德反应(retro-Diels-Alder,RDA)裂解重排,产生特征碎片离子。黄酮糖苷包括O-糖苷、C-糖苷,其裂解模式存在差异。类黄酮-O-糖苷的特征碎片主要表现为糖苷键断裂从而丢失糖基形成苷元,常见丢失的离子碎片包括162 Da的葡萄糖,308 Da的O-二糖基,470 Da的O-三糖基等。然而类黄酮-C-糖苷不容易发生糖基脱落,而产生交叉环切除现象,正离子模式下产生[M+H-nH2O]+和[M+H-CH2O-2H2O]+等。负离子模式下产生[M-H-150]-、[M-H-120]-、[M-H-90]-和[M-H-60]-等常见的二级碎片。对于多甲氧基黄酮而言,优先发生中性丢失—CH3(15 Da),—CO(28 Da)等,或在C环上发生RDA裂解重排,可根据碎片判断取代基数目和种类。按照上述的裂解规律,根据标准品和相关文献比对靶向筛查鉴定了38种类黄酮,并通过相关文献比对和数据库匹配对其余6种类黄酮进行了非靶向鉴定筛查。现描述非靶向筛查鉴定过程:化合物11,在ESI-模式下,准分子离子峰m/z为447.11[M-H]-,通过分子拟合该化合物的分子式为C21H20O11,二级质谱中,脱去18 Da的H2O形成m/z为429.10[M-H-H2O]-,同时,二级碎片m/z分别为357.062 ![]() 和m/z
和m/z ![]() 表明从准分子离子峰[M-H]-中分别丢失了C3H6O3(90 Da),C4H8O4(120 Da)以及C5H10H5(150 Da),其为典型的类黄酮-C-糖苷。结合文献[12],初步推断其为异荭草素,该化合物在酸橙中首次报道。
表明从准分子离子峰[M-H]-中分别丢失了C3H6O3(90 Da),C4H8O4(120 Da)以及C5H10H5(150 Da),其为典型的类黄酮-C-糖苷。结合文献[12],初步推断其为异荭草素,该化合物在酸橙中首次报道。
化合物16,在ESI-模式下,准分子离子峰m/z为289.069 2[M-H]-,通过分子拟合该化合物分子式为C15H12O6。二级质谱中,产生碎片离子为![]() 和
和![]() 根据数据库及相关文献[13],初步推断该化合物为圣草酚。同理可以推断出化合物17和21分别为木犀草素和异鼠李素[14]。
根据数据库及相关文献[13],初步推断该化合物为圣草酚。同理可以推断出化合物17和21分别为木犀草素和异鼠李素[14]。
化合物78,在ESI-模式下,准分子离子峰m/z为461.114 0[M-H]-,经过分子拟合该化合物分子式为C22H22O11。二级质谱中,分别失去一分子的C3H6O3、C4H8O4、162 Da的葡萄糖产生二级碎片离子m/z为![]() 和m/z为
和m/z为![]() 以及m/z为298.047 3的[Y0-H]-,说明其化合物为六碳糖,含有1个葡萄糖基。结合相关文献[15],初步推断该化合物为木犀草素-3-甲氧基-6-C-葡萄糖苷,此化合物在酸橙中首次报道。
以及m/z为298.047 3的[Y0-H]-,说明其化合物为六碳糖,含有1个葡萄糖基。结合相关文献[15],初步推断该化合物为木犀草素-3-甲氧基-6-C-葡萄糖苷,此化合物在酸橙中首次报道。
化合物83,在ESI-模式下,准分子离子峰m/z为343.082 1[M-H]-。二级质谱中,连续经过脱去15 Da的CH3、28 Da的CO,产生特征碎片离子m/z分别为328.059 3的[M-H-CH3]-、313.035 4[M-H-2CH3]-、298.011 9[M-H-2CH3-CO]-,或发生RDA裂解重排后,失去—C2H2O产生m/z为163.002 7(0,4B--C2H2O),通过与数据库对比和文献[16]对比,初步推断该化合物为异泽兰黄素,该化合物在酸橙中首次报道。
2.2.2 酚酸
酚酸类化合物是具有一个羧酸基团的酚类化合物,主要以酰胺、酯或糖苷键的结合方式存在。分为基本骨架为C6—C3肉桂酸型和基本骨架为C6—C1苯甲酸型及其衍生物[17]。在二级质谱裂解过程中,容易丢失小分子基团如CO2,H2O,CH3,HCOOH等,产生[M-H-44]-、[M-H-18]-、[M-H-15]-、[M-H-46]-的碎片离子[18]。本实验在ESI-离子模式下共鉴定了8种酚酸,其中6种酚酸根据标准品和数据库靶向筛查进行鉴定。化合物71和72在ESI-模式下,准分子离子峰m/z均为353.089[M-H]-,二者在二级质谱裂解的规律基本一致,其主要的结构区别在于咖啡酸处于C—3位和C—5位。因此,可以根据不同的离子峰强度差异用于推断咖啡酸在奎宁酸上的取代位置。二级质谱中,其特征碎片离子m/z 191.057[M-H-C9H6O3]-、179.034 8[M-H-C7H10O5]-以及135.045 1[M-H-C7H12O6-CO2]-,通过标准品、数据库与文献[19]对比初步鉴定化合物71和72分别是绿原酸和新绿原酸。
2.2.3 生物碱
生物碱类是一类含氮碱性有机化合物,具有旋光性[20]。不同种类的生物碱的裂解规律往往存在差异,如麻黄碱类易发生脱水作用后产生稳定的共轭结构,然后在苯环的附近,以N原子为中心,沿侧链朝苯环方向逐步丢失甲基取代基,再进一步脱去氨基;异喹啉生物碱类易发生α裂解,然后失去CH2![]() N—CH3或—NH2CH等片段。本实验在ESI+模式下,共鉴定了8种生物碱,其中4种生物碱化合物通过标准品和数据库鉴定而来。此外,其余4种生物碱鉴定过程如下:
N—CH3或—NH2CH等片段。本实验在ESI+模式下,共鉴定了8种生物碱,其中4种生物碱化合物通过标准品和数据库鉴定而来。此外,其余4种生物碱鉴定过程如下:
化合物2,ESI+模式下,准分子离子峰m/z为144.100 9[M+H]+,经过分子拟合,分子式为C7H13NO2,其特征碎片离子m/z为84.080 5[M+H-COOH-CH3]+以及质谱响应值较高的碎片58.064 7(CH3CH2 N),后者为典型的季胺碱类生物碱的裂解特征。通过结合Sci Finder数据库并查阅相关文献[21],初步鉴定该化合物为水苏碱。按照同样的方法,鉴定化合物1为六氢吡啶羧酸。
化合物4,ESI+模式下,准分子离子峰m/z为268.104 0[M+H]+,分子拟合式为C10H13N5O4,丢失了1分子132 Da的呋喃核糖残基产生碎片离子m/z 136.061 8[M+H-C5H8O4]+特征离子碎片。根据数据库和相关文献[22]对比,初步推断该化合物为腺苷。
化合物8,ESI+模式下,准分子离子峰m/z为611.752 1[M+H]+,分子拟合式为C37H42N2O6,在二级质谱中,二级碎片离子m/z分别为580.026 7[M+H-NH2CH2]+、568.785 2[M+H-CH2![]() N—CH3]+、475.122 1[M+H-C9H12O]+的特征离子碎片,根据数据库和相关文献[23]推断该化合物为异莲心碱,此化合物在酸橙中首次报道。
N—CH3]+、475.122 1[M+H-C9H12O]+的特征离子碎片,根据数据库和相关文献[23]推断该化合物为异莲心碱,此化合物在酸橙中首次报道。
2.2.4 类柠檬苦素
类柠檬苦素是一类高度含氧的三萜类物质,主要以2种形式存在,一种是游离糖苷的形式,主要存在于柑橘种子中,另一种是以β-D-葡萄糖苷类形式,主要存在于柑橘果皮和果肉中[24]。酸橙中类柠檬苦素的种类较少,本实验仅筛查到2种类柠檬苦素,根据标准品比对,化合物68和69分别被鉴定为柠檬苦素和诺米林。
2.2.5 香豆素
香豆素指含有苯骈α-吡喃酮母核的肉桂酸型衍生物,具有芳香气味。根据取代基不同分为4大类:简单香豆素、呋喃香豆素、吡喃香豆素以及其他香豆素[25]。尽管香豆素环上的取代位点和取代基不同,但它们的断裂模式具有一定的规律。香豆素的基本骨架很难被裂解,主要通过丢失—CH3、—CO、—CO2和H2O等小分子基团来产生碎片离子。本实验共鉴定了22种香豆素,其中20种香豆素根据标准品和相关文献鉴定。
化合物64在ESI+模式下,准分子离子峰m/z为203.033 8[M+H]+,二级质谱中,连续丢失28 Da的CO,分别产生m/z为175.042 9[M+H-CO]+和m/z 147.044 1[M+H-2CO]+的碎片离子。再失去17 Da的OH产生m/z 131.049 7的[M+H-2CO-OH]-。根据数据库和相关文献[26],推断该化合物为花椒毒酚。
化合物47,ESI+模式下,准分子离子峰m/z为293.05的[M+H]+连续丢失—CO和—CH3,其碎片离子m/z 133.027[M+H-CO2-CH3]+,同时,失去CH3产生m/z 178.025的[M+H-CH3]+,继续失去CO产生m/z 150.030 Da的[M+H-CH3-CO]+和m/z 122.038 7的[M+H-CH3-2CO]+。根据数据库和相关文献[27],推断该化合物为异东莨内酯。
2.3 酸橙中生物活性成分的分布
在生物活性成分种类方面,如附表1所示,本研究共鉴定了84种生物活性成分,包括44种类黄酮、8种酚酸、22种香豆素、2种类柠檬苦素、8种生物碱,其中小叶酸橙、代代酸橙、万木橙、蚌柑、摩洛哥酸橙和黄皮酸橙分别筛查鉴定出72、71、68、71、71和66种生物活性成分。6个酸橙品种类黄酮种类筛查鉴定排序如下:小叶酸橙(41种)>代代酸橙(40种)>摩洛哥酸橙(39种)=蚌柑(39种)>万木橙(38种)>黄皮酸橙(33种)。44种类黄酮中,包括12种黄酮、14种多甲氧基黄酮、3种黄酮醇、15种黄烷酮。其中29种类黄酮在6个酸橙品种中均有检出,分别为9种黄酮(异荭草素、木犀草素、香叶木素、牡荆素等),9种多甲氧基黄酮(桔皮素、川陈皮素等),10种黄烷酮(新橙皮苷等)以及1种黄烷醇(香蒲新苷)。而牡荆素-2-O-鼠李糖苷仅小叶酸橙和黄皮酸橙中检出。3,4,7,8-四甲氧基黄酮、甜橙黄酮等6种多甲氧基黄酮在黄皮酸橙中未检出,而在其他品种中均有检出。8种酚酸中,D-奎宁酸、新绿原酸、绿原酸、对羟基苯甲酸、咖啡酸、芥子酸等8种酚酸均在6个酸橙品种的果皮中检出。8种生物碱中,六氢吡啶羧酸、水苏碱、辛弗林、腺苷、苯肾上腺素、N-甲基酪胺均在6个酸橙品种的不同部位均有检出。大麦芽碱、异莲心碱在小叶酸橙、代代酸橙、蚌柑和摩洛哥酸橙的果皮、果肉均有检出,而在4种酸橙的果汁中,大麦芽碱均有检出,异莲心碱未能检出。6个酸橙品种中均能筛查鉴定出柠檬苦素和诺米林。22种香豆素中,其中黄皮酸橙中鉴定出17种香豆素,而其余5种酸橙品种中均鉴定出13种香豆素。蛇床子素、花椒毒酚等8种香豆素在6个酸橙品种均有检出。欧前胡素、珊瑚菜素、8-氧甲基异欧前胡内酯、异茴芹内酯、水合氧化前胡素、滨蒿內酯、白当归素等仅在黄皮酸橙中有检出,而橙皮内酯水合物、橙皮内酯、6′,7′-二羟基香柠檬亭、6′,7′-环氧香柠檬仅在其余5种酸橙中检出。橙皮油内酯仅在万木橙和黄皮酸橙中检出,香柑醇仅在小叶酸橙、代代、蚌柑以及摩洛哥酸橙中检出。余柳仪等[26]从代代酸橙的花、茎、叶、果实中检测出了19个黄酮类化合物、12个多甲氧基黄酮、4个香豆素化合物、11个生物碱以及柠檬苦素,所检出的9种黄烷醇、9种多甲氧基、4种香豆素、3种生物碱及柠檬苦素与本研究一致。而在余柳仪的研究中未检测到大麦牙碱、异鼠李素-3-O-橙皮苷、诺米林等多种物质,本研究中均能检出。
在生物活性成分相对含量方面,如图3所示,对6个不同的酸橙品种以及果实不同部位中类黄酮、酚酸、生物碱、类柠檬苦素、香豆素的果皮峰面积进行层次聚类分析。因各品种果皮的生物活性物质种类最为丰富,因此以果皮为代表进行分析。不同酸橙品种的类黄酮、酚酸、生物碱、类柠檬苦素、香豆素的代谢具有多样性。代代酸橙和蚌柑的代谢积累模式接近,因此这2个品种在聚类分析中被归为一类,这2种酸橙依次与小叶酸橙、万木橙、摩洛哥酸橙、黄皮酸橙聚类之后组成更高的分类单元,后4种酸橙代谢物积累模式差异很大。黄皮酸橙的含量明显高于其他酸橙品种,如欧前胡素、珊瑚菜素、8-氧甲基异欧前胡内酯、异茴芹内酯、水合氧化前胡素、滨蒿內酯、白当归素。结合附表1筛查鉴定结果,这些成分仅仅存在于黄皮酸橙中,因此可认为是区别于其他品种的特征成分。万木橙中异槲皮苷、橙皮油内酯、柠檬苦素、伞形花内酯、芥子酸、新绿原酸、甜橙黄酮等12种多甲氧基黄酮含量明显高于其他酸橙品种。对于不同部位酸橙果实的类黄酮、酚酸、生物碱、香豆素、柠檬苦素的相对含量层次聚类研究发现,酸橙中果皮、果肉、果汁这3个部位的代谢具有组织特异性,其在果肉和果汁中的积累模式接近,而果皮中生物活性成分含量明显高于果肉和果汁。据相关文献报道,酸橙品种遗传的多样性与过氧化物同工酶、GOT等位基因、不同染色体上的单拷贝基因序(single-copy nuclear gene,SCNGS)等相关,表明酸橙具有复杂的遗传背景[28]。何发[29]基于SSR技术分析酸橙的起源,发现酸橙的亲本来源于柚和宽皮柑橘,在此基础上,柳俊杰[30]基于全基因组测序进行了不同品种的酸橙非加权组平均法(unweighted pair-group method with arithmetic means,UPGMA)聚类分析,表明黄皮酸橙为宽皮柑橘和宜昌橙的杂交品种,不属于酸橙纯种,而代代保留最原始的亲本柚的基因组信息,可为不同酸橙品种代谢物积累模式的多样性提供一定的参考。

a-不同品种酸橙果皮的生物活性成分相对含量;b-酸橙果实不同部位中生物活性成分相对含量
图3 类黄酮、酚酸、类柠檬苦素、生物碱和香豆素类化合物在不同酸橙品种和组织中的积累规律
Fig.3 Accumulation patterns of flavonoids,phenolic acids,limonoids,alkaloids and coumarins in different sour orange fruit species and tissues
注:图中物质的相对含量进行了归一化处理;由图例所示,从红到蓝依次递减
3 结论
本实验使用UPLC-Q-TOF-HRMS技术并采用靶向和非靶向筛查相结合的方法,对6个酸橙品种中的84种生物活性成分进行了分析和鉴定,包括44种类黄酮、8种酚酸、22种香豆素、2种类柠檬苦素、8种生物碱。其中,35种生物活性成分在酸橙中首次报道,此研究进一步丰富了酸橙生物活性成分的数据库。小叶酸橙、代代酸橙、万木橙、蚌柑、摩洛哥酸橙和黄皮酸橙分别筛查鉴定出72、71、68、71、71和66种生物活性成分。通过对84种生物活性成分的果皮峰面积层次聚类分析,研究发现黄皮酸橙果皮中有区别于其他酸橙品种的特征成分,如欧前胡素、珊瑚菜素、8-氧甲基异欧前胡内酯、异茴芹内酯、水合氧化前胡素、滨蒿內酯、白当归素等。同时发现果皮中所含有的生物活性成分的种类和数量远多于果汁和果肉中。此研究为酸橙的深加工和其中含有的多种生物活性成分的综合利用提供理论依据。
[1] FARAG M A,ABIB B,AYAD L,et al.Sweet and bitter oranges:An updated comparative review of theirbioactives,nutrition,food quality,therapeutic merits and biowaste valorization practices[J].Food Chemistry,2020,331:127306.
[2] SHEN C Y,WANG T X,ZHANG X M,et al.Various antioxidant effects were attributed to different components in the dried blossoms of Citrus aurantium L.var.Amaraengl[J].Journal of Agricultural and Food Chemistry,2017,65(30):6 087-6 092.
[3] NIDHI P,ROLTA R,KUMAR V,et al.Synergistic potential of Citrus aurantium L.essential oil with antibiotics against Candida albicans[J].Journal of Ethnopharmacology,2020,262:113135.
[4] DI NEZ F,SANTOS M,PARRA C,et al.Screening of antifungal activity of 12 essential oils against eight pathogenic fungi of vegetables and mushroom[J].Letters in Applied Microbiology,2018,67(4):400-410.
NEZ F,SANTOS M,PARRA C,et al.Screening of antifungal activity of 12 essential oils against eight pathogenic fungi of vegetables and mushroom[J].Letters in Applied Microbiology,2018,67(4):400-410.
[5] LIU L,SHAN S,ZHANG K,et al.Naringenin andhesperetin,two flavonoids derived from Citrus aurantium up-regulate transcription of adiponectin[J].Phytotherapy Research:PTR,2008,22(10):1 400-1 403.
[6] 邓可众,杨堃,邓敏芝,等.HPLC法同时分析酸橙果实类药材中黄酮和香豆素类成分[J].中药材,2016,39(3):575-578.
DENG K Z,YANG K,DENG M Z,et al.Analysis of flavonoids and coumarins in lime fruit by HPLC[J].Journal of Chinese Medicinal Materials,2016,39(3):575-578.
[7] ANA CC,JES S P V,HUGO E A,et al.Antioxidant capacity and UPLC-PDA ESI-MS polyphenolic profile of Citrus aurantium extracts obtained by ultrasound assisted extraction[J].Journal of Food Science and Technology,2018,55(12):5 106-5 114.
S P V,HUGO E A,et al.Antioxidant capacity and UPLC-PDA ESI-MS polyphenolic profile of Citrus aurantium extracts obtained by ultrasound assisted extraction[J].Journal of Food Science and Technology,2018,55(12):5 106-5 114.
[8] 张栋健,李薇,梁之桃,等.枳壳发酵炮制前后的成分变化及工艺优化[J].中国药房,2017,28(7):971-974.
ZHANG D J,LI W,LIANG Z T,et al.Composition changes ofaurantii fructus before and after fermentation processing and its technology optimization[J].China Pharmacy,2017,28(7):971-974.
[9] FENG S,NIU L Y,SUH J H,et al.Comprehensive metabolomics analysis of mandarins(Citrus reticulata)as a tool for variety,rootstock,and grove discrimination[J].Journal of Agricultural and Food Chemistry,2018,66(39):10 317-10 326.
[10] 庞雯辉,赵希娟,陈西,等.超高效液相色谱-四极杆-飞行时间高分辨质谱法快速筛查柠檬果实中的生物活性成分[J].食品与发酵工业,2021,47(4):222-230;235.
PANG W H,ZHAO X J,CHEN X,et al.Ultra-performance liquid chromatography-quadrupole-time-of-flight high-resolution mass spe-ctrometry method for rapid screening of bioactive compounds in lemon fruits[J].Food and Fermentation Industries,2021,47(4):222-230;235.
[11] GANDHI G R,VASCONCELOS A B S,WU D T,et al.Citrus flavonoids as promising phytochemicals targeting diabetes and related complications:A systematic review of in vitro and in vivo studies[J].Nutrients,2020,12(10):2907.
[12] QING Z X,ZHAO H,TANG Q,et al.Systematic identification offlavonols,flavonol glycosides,triterpene and siraitic acid glycosides from Siraitia grosvenorii using high-performance liquid chromatography/quadrupole-time-of-flight mass spectrometry combined with a screening strategy[J].Journal of Pharmaceutical and Biomedical Analysis,2017,138:240-248.
[13] JAYAPRAKASHA G K,DANDEKAR D V,TICHY S E,et al.Simultaneousseparation and identification of limonoids from citrus using liquid chromatography-collision-induced dissociation mass spectra[J].Journal of Separation Science,2011,34(1):2-10.
[14] ZHAO Y,LU H,WANG Q,et al.Rapid qualitative profiling and quantitative analysis of phenolics in Ribes meyeri leaves and their antioxidant and antidiabetic activities by HPLC-QTOF-MS/MS and UHPLC-MS/MS[J].J Sep Sci,2021,44(7):1 404-1 420.
[15] SHAO S Y,TING Y,WANG J,et al.Characterization and identification of the major flavonoids in Phyllostachys edulis leaf extract by UPLC-QTOF-MS/MS[J].Acta Chromatographica,2020,32(4):228-237.
[16] HAN B S,XIN Z Q,MA S S,et al.Comprehensive characterization and identification of antioxidants in Folium artemisiae Argyi using high-resolution tandem mass spectrometry[J].Journal of Chromatography B,2017,1 063:84-92.
[17] AZUMA A,YAKUSHIJI H,KOSHITA Y,et al.Flavonoid biosynthesis-related genes in grape skin are differentially regulated by temperature and light conditions[J].Planta,2012,236(4):1 067-1 080.
[18] MOHAMMAT A,YILI A,AISA H A.Rapid quantification and quantitation of alkaloids in Xinjiang Fritillaria byultra performance liquid chromatography-quadrupole time-of-flight mass spectrometry[J].Molecules,2017,22(5):719.
[19] 罗丹丹,彭华胜,张元,等.基于UPLC-Q-TOF-MS分析比较宽叶山蒿与艾的化学成分[J].中国中药杂志,2020,45(17):4 057-4 064.
LUO D D,PENG H S,ZHANG Y,et al.Comparison of chemical components between Artemisia stolonifera and Artemisia argyi using UPLC-Q-TOF-MS[J].China Journal of Chinese Materia Medica,2020,45(17):4 057-4 064.
[20] IBRAGIC ![]() E.Chemical composition of various Ephedra species[J].Bosnian Journal of Basic Medical Sciences,2015,15(3):21-27.
E.Chemical composition of various Ephedra species[J].Bosnian Journal of Basic Medical Sciences,2015,15(3):21-27.
[21] LI C,HILL R W,JONES A D.Determination of betaine metabolites anddimethylsulfoniopropionate in coral tissues using liquid chromatography-time-of-flight mass spectrometry and stable isotope-labeled internal standards[J].Journal of Chromatography B,2010,878(21):1 809-1 816.
[22] 胡瀚文,赵永艳,杨天龙,等.基于UPLC-Q-Orbitrap HRMS的川佛手化学成分分析[J].中国实验方剂学杂志,2020,26(7):148-155.
HU H W,ZHAO Y Y,YANG T L,et al.Analysis and identification of chemical constituents of Citri sarcodactylis fructus by UPLC-Q-orbitrap HRMS[J].Chinese Journal of Experimental Traditional Medical Formulae,2020,26(7):148-155.
[23] LIN Z,YANG R,GUAN Z,et al.Ultra-performance LC separation and quadrupole time-of-flight MS identification of major alkaloids in Plumulanelumbinis[J].Phytochemical Analysis,2014,25(6):485-494.
[24] GUALDANI R,CAVALLUZZI MM,LENTINI G,et al.The chemistry and pharmacology of citrus limonoids[J].Molecules(Basel,Switzerland),2016,21(11):1 530.
[25] S NCHEZ-ARREOLA E,MAITI R,VAZQUEZ-TORRES M,et al.Preliminary study on pharmacognosy and phytochemistry of two Mexican medicinal plants,“Gordolobo”(Bocconia frutescens L.[Papavaceae])and “Candelaria”(Ipomoea bracteata Cav.[Convolvulaceae])[J].Phyton,2002:107-111.
NCHEZ-ARREOLA E,MAITI R,VAZQUEZ-TORRES M,et al.Preliminary study on pharmacognosy and phytochemistry of two Mexican medicinal plants,“Gordolobo”(Bocconia frutescens L.[Papavaceae])and “Candelaria”(Ipomoea bracteata Cav.[Convolvulaceae])[J].Phyton,2002:107-111.
[26] YU L Y,CHEN M F,LIU J H,et al.Systematicdetection and identification of bioactive ingredients from Citrus aurantium L.var.Amara using HPLC-Q-TOF-MS combined with a screening method[J].Molecules(Basel,Switzerland),2020,25(2):357.
[27] WU M,ZHANG H W,ZHOU C,et al.Identification of the chemical constituents in aqueous extract of Zhi-Qiao and evaluation of its antidepressant effect[J].Molecules,2015,20(4):6 925-6 940.
[28] YANG X M,LI H,LIANG M,et al.Geneticdiversity and phylogenetic relationships of citron(Citrus medica L.)and its relatives in southwest China[J].Tree Genetics & Genomes,2015,11(6):1-13.
[29] 何发.酸橙与甜橙的遗传起源及柑橘糖酸变化初探[D].武汉:华中农业大学,2017.
HE F.The genetic origin of sour orange and sweet orange and a preliminary study on the change of sugar and acid in citrus[D].Wuhan:Huazhong Agricultural University,2017.
[30] 柳俊杰.酸橙资源发掘及遗传多样性分析[D].武汉:华中农业大学,2018.
LIU J J.Exploitation and genetic diversity analysis of sour orange germplasm[D].Wuhan:Huazhong Agricultural University,2018.