红茶,作为当今世界最受欢迎的茶叶,占茶叶消费市场份额的70%~80%[1-2]。红茶属全发酵茶,主要分为工夫红茶、小种红茶、红碎茶3大类[3-4]。其呈味物质和功能性成分包括儿茶素、茶黄素、茶红素等,这些内含成分不仅滋味爽口,还兼具多种保健作用,如消炎、抗氧化、抗肿瘤、延缓衰老、保肝护肝等[5-8]。红茶通过萎凋揉捻等工艺使得茶叶破碎,茶叶内含物与内源酶接触,发生酶促氧化反应[9]。茶叶中大分子物质发生水解反应,儿茶素等多酚类化合物发生氧化聚合,形成大量香气化合物及茶黄素、茶红素、茶褐素等有色物质,构成红茶鲜香馥郁、红汤红叶、滋味浓醇、回味悠长的品质特征[10]。儿茶素和茶黄素作为红茶的重要品质因子,其含量高低直接影响着红茶品质的优劣[11]。开发能快速准确的分析测定红茶中儿茶素和茶黄素含量的方法对有效判断红茶品质、控制红茶质量、指导红茶的科学生产、实现高品质红茶加工具有重要意义。
近年来,茶黄素和儿茶素检测主要采用HPLC-MS和UPLC等检测[12-13]。HPLC-MS和UPLC法设备采购价格较昂贵,仪器操作复杂,不适用于一般的实验室条件。而HPLC-UV法是一种常见的快速检测方法,设备价格低廉、易得,且分离效率高、准确度和精密度较好[14]。本研究基于HPLC-UV,通过优化检测条件,建立了一种可同时测定儿茶素和茶黄素的高效液相色谱方法。
1 材料与方法
1.1 材料与试剂
乙腈、甲酸(均为色谱纯),美国TEDIA公司;甲醇(分析纯),国药集团化学试剂有限公司;标准品咖啡碱(caffeine,Caf)、表没食子酸酯儿茶素(epigallocatechin,EGC)、儿茶素(DL-catechin,DL-C)、表儿茶素(epicatechin,EC)、表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)、没食子儿茶素没食子酸酯(gallocatechin gallate,GCG)、表儿茶素没食子酸酯(epicatechin gallate,ECG),成都普瑞法科技开发有限公司(纯度≥98%);茶黄素(theaflavin,TF)、茶黄素-3-没食子酸酯(theaflavin-3-gallate,TF-3-G)、茶黄素-3′-没食子酸酯(theaflavin-3′-gallate,TF-3′-G)、茶黄素-3,3′-双没食子酸酯(theaflavin-3,3′-digallate,TFDG),美国Sigma公司(纯度≥98%)。
6种红茶样品包含黄金茶红茶、祁门工夫、祁红毛峰、滇红、一炮红(台湾)、坦洋工夫(粉碎后过40目筛,备用),湖南省茶业集团股份有限公司。
1.2 仪器与设备
1260高效液相色谱仪、安捷伦SB-C18色谱柱(4.6 mm×250 mm,5 μm),美国安捷伦公司;MS204TS电子天平,梅特勒-托利多国际贸易(上海)有限公司;SB-3200DT超声波清洗机,宁波新芝生物科技有限公司;HHS-21-6电热恒温水浴锅,上海精宏实验设备有限公司;分析型超纯水机,上海叶拓科技有限公司;JGY-2500研磨器,浙江省永康市敏业工贸有限公司。
1.3 样品检测
1.3.1 标准品溶液配制
分别精密称取Caf、EGC、DL-C、EC、EGCG、GCG、ECG、TF、TF-3-G、TF-3′-G和TFDG对照品各12.5 mg(精确到0.000 1 g)于50 mL棕色容量瓶中,用体积分数为10%乙腈溶液溶解并定容,摇匀,得250 μg/mL的混合内含物质标准液。过0.45 μm微孔滤膜,进样量为20 μL,调节方法参数进行HPLC方法优化。
1.3.2 HPLC检测方法及优化
色谱柱:安捷伦SB-C18液相色谱柱(4.6 mm×250 mm,5 μm)。流动相A为0.1%(质量分数)甲酸-乙腈,流动相B为0.1%(质量分数)甲酸-水,流速1.0 mL/min,进样量为20 μL,检测波长为280 nm,柱温30 ℃。梯度洗脱设置见表1。以上述条件作为最初条件,根据11种茶叶内含物质的保留时间、分离度等因素,对HPLC检测方法的流动相酸度、柱温及洗脱梯度等几个方面进行优化。
表1 高效液相色谱洗脱梯度
Table 1 The elution gradient of HPLC
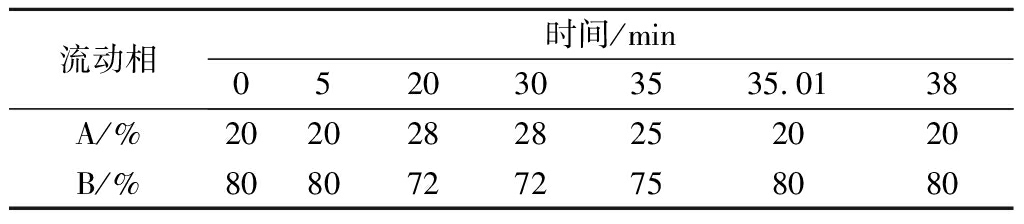
流动相时间/min0520303535.0138A/%20202828252020B/%80807272758080
设置不同酸浓度A相0.05%、0.1%、0.15%、0.2%甲酸水溶液(体积分数),B相0.05%、0.1%、0.15%、0.2%甲酸乙腈溶液(体积分数)条件下11种茶叶内含物质分离情况。设置25、30、35 ℃ 3个柱温对该方法分离效果的影响。根据峰型、分离度、保留时间等因素调整洗脱梯度以及检测时间。
1.4 方法学验证实验
使用外标法定量分析检测儿茶素和茶黄素的含量。分别精密称取11种茶叶内含物质标准品各12.5 mg(精确到0.000 1 g)于25 mL棕色容量瓶中,用体积分数为10%乙腈溶液溶解并定容,摇匀,得500 μg/mL的混合内含物质母液。分别移取母液1、2、3、4、5、8 mL至10 mL棕色容量瓶中,用体积分数为10%乙腈溶液定容,得到50、100、150、200、250、400、500 μg/mL的标准工作液。各浓度标准品过0.45 μm微孔滤膜,进样量为20 μL。以质量浓度(X)、峰面积(Y)绘制出标准工作曲线,并求回归方程和相关系数。将最低浓度的标准溶液进样,按照3倍信噪比(S/N)得到检测方法的检出限,按照10倍信噪比(S/N)得到检测方法的定量限。
准确称取使用研磨器均匀磨碎的滇红茶样品0.3 g于10 mL离心管中,加入5 mL体积分数为70%的甲醇溶液(70 ℃预热),摇匀,于70 ℃水浴振荡浸提10 min,冷却至室温,3 500 r/min离心10 min,取上清液于10 mL棕色容量瓶中。残渣再重复上述步骤。合并提取液,定容至10 mL,摇匀,过0.45 μm滤膜,制得滇红茶待测样品。
以该方法检测滇红茶待测样品,样品重复进样6次。根据所得峰面积分别计算11种茶叶内含成分的相对标准偏差(relative standard deviation,RSD),验证该方法的精密度,重复性。
在待测滇红茶样品中分别加入一定量的11种茶叶内含成分对照品,进行加标回收率试验,样品重复进样6次,考察该方法的准确度。加标回收率计算如公式(1)所示:
加标回收率![]()
(1)
将滇红茶待测样液放置不同时间(0、2、4、6、8、12、24 h),以该方法检测,根据11种茶叶内含成分的峰面积计算RSD值,考察方法的稳定性。
1.5 检测红茶样品
分别准确称取使用研磨器均匀磨碎的6种红茶样品0.3 g于10 mL离心管中,加入5 mL体积分数为70%的甲醇溶液(70 ℃预热),摇匀,于70 ℃水浴中振荡浸提10 min,冷却至室温,3 500 r/min离心10 min,取上清液于10 mL棕色容量瓶中。残渣再重复上述步骤,合并提取液,定容至10 mL,摇匀,过0.45 μm 滤膜,制得红茶待测样品。使用上述优化后的方法检测含有11种茶叶内含物质的对照样,6种红茶待测样。每个样品重复3次,外标法分析计算各茶样11种茶叶内含物质的含量。
1.6 数据处理
所有试验至少重复3次以上,使用Graphpad prism 8.0软件进行图表的绘制和相关数据的处理。
2 结果与分析
2.1 色谱条件的优化
乙腈-乙酸流动相体系中色谱图峰形差、拖尾严重,本研究选择甲酸调节酸浓度,设置流速1 mL/min,柱温30 ℃,以A相甲酸乙腈溶液、B相甲酸水溶液为流动相,用甲酸调节酸浓度,考察不同酸体积分数A相0.05%、0.1%、0.15%、0.2%甲酸水溶液,B相0.05%、0.1%、0.15%、0.2%甲酸乙腈溶液条件下11种茶叶内含物质分离情况。结果发现,流动相A和B酸浓度相互搭配,酸浓度越低,待测物质保留时间越短,分离效果越差,出现多峰重叠现象;随着酸浓度升高,11种茶叶内含物质分离效果越好,但保留时间也随之增长,且酸浓度过高易对色谱柱造成影响。综合考虑,流动相选择A相甲酸体积分数为0.1%、B相甲酸体积分数为0.1%时,分离效果好,保留时间适中且对仪器损伤较小。
以A相含0.1%(体积分数)甲酸-乙腈溶液、B相含0.1%(体积分数)甲酸-水溶液为流动相,在进样量为20 μL,流速为1 mL/min的条件下,分析25、30、35 ℃ 3个柱温对该方法分离效果的影响。结果发现,随着柱温升高,11种待检物质保留时间缩短,但分离效果变差,综合分析,30 ℃时待测物质分离效果最佳。
洗脱梯度是影响色谱出峰顺序和分离度的重要因素。本研究优化流动相洗脱梯度,在洗脱前期以8%的A相,92%的B相洗脱,能够使儿茶素各组分完全分开且分离度高,峰型良好。待儿茶素组分全部洗脱后加大A相比例,茶黄素组分也均匀分开。经多次优化后,以表2条件进行梯度洗脱可有效分离儿茶素和茶黄素,11种茶叶内含物峰型完整,分离效果优异(图1)。
表2 高效液相色谱洗脱梯度
Table 2 The elution gradient of HPLC
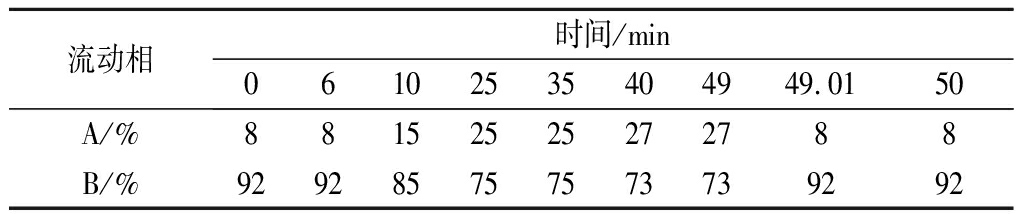
流动相时间/min06102535404949.0150A/%88152525272788B/%929285757573739292
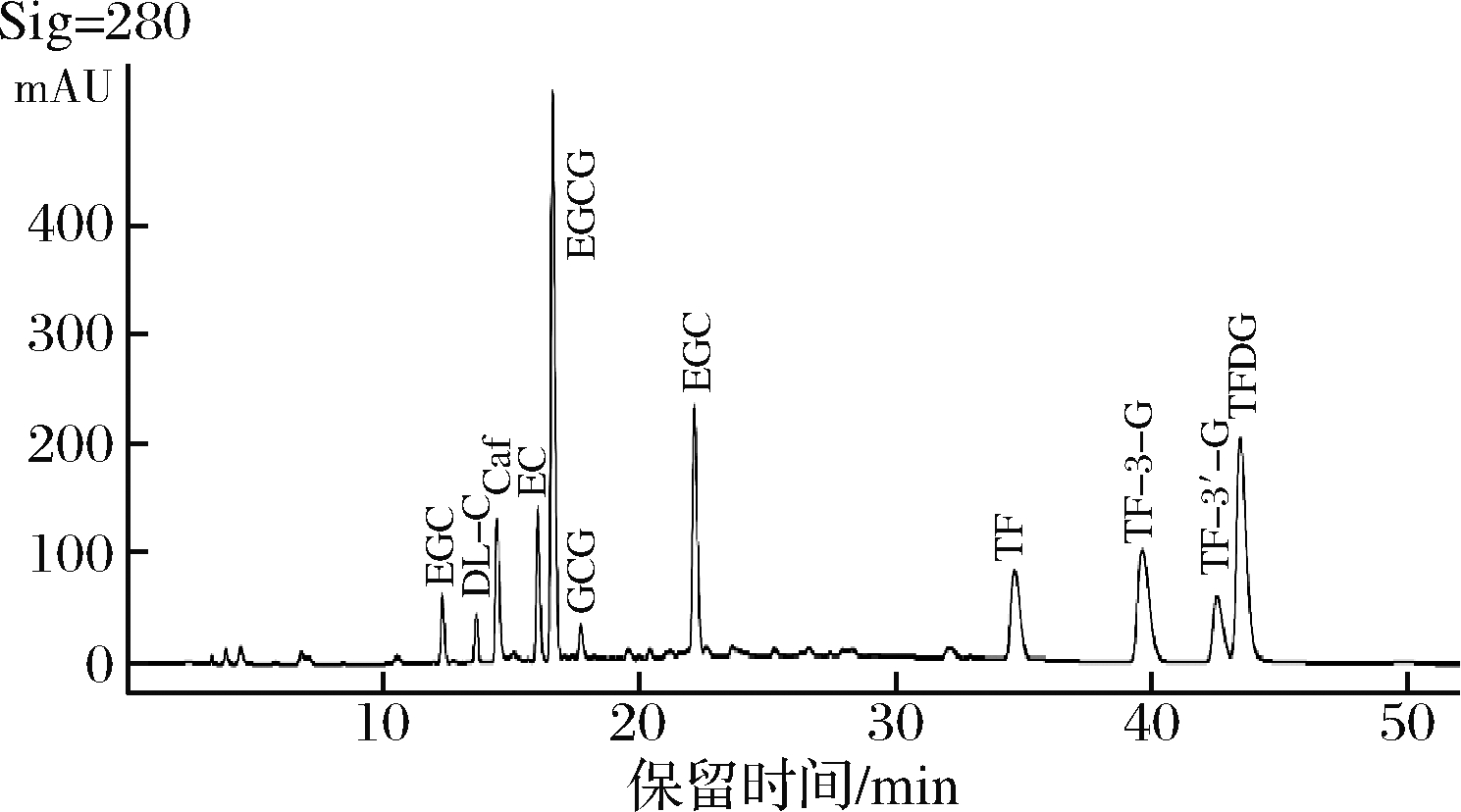
图1 最优条件下11种内含物质标样HPLC色谱图
Fig.1 HPLC chromatograms of 11 standards of contained substances under optimal conditions
2.2 方法学验证
检测质量浓度50~500 μg/mL的一系列标准工作液,得到11条标准曲线。如表3所示,各物质标准曲线的R2均>0.999 0,说明各单体的质量浓度和色谱峰面积具有良好的线性相关性。11种茶叶内含物的检出限范围为0.21~11.13 μg/mL,定量限范围为0.70~37.10 μg/mL。
表3 11种茶叶内含物质的标准曲线
Table 3 Standard curves of 11 contained substances
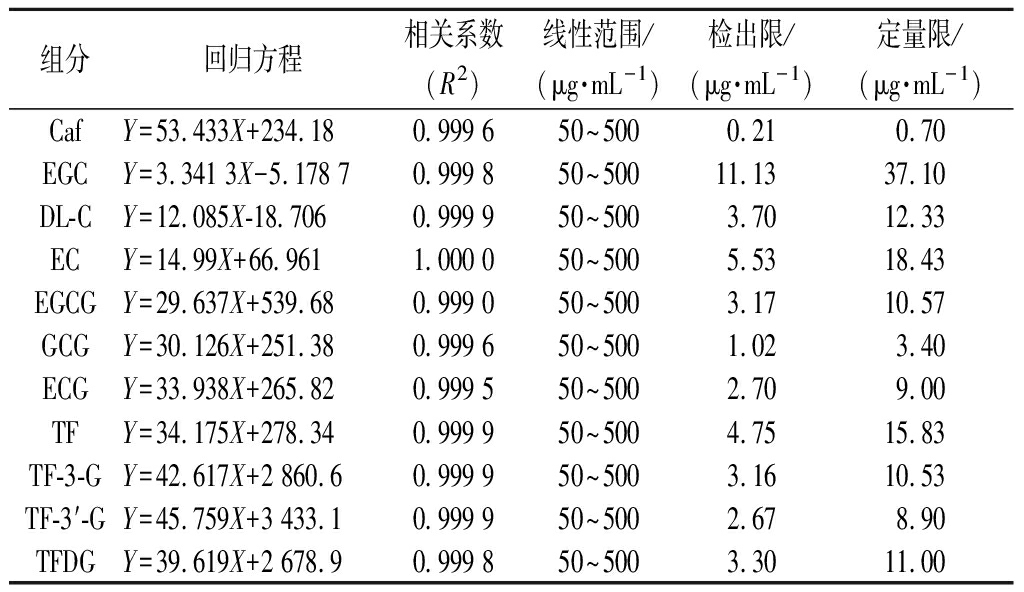
组分回归方程相关系数(R2)线性范围/(μg·mL-1)检出限/(μg·mL-1)定量限/(μg·mL-1)CafY=53.433X+234.180.999 650~5000.210.70EGCY=3.341 3X-5.178 70.999 850~50011.1337.10DL-CY=12.085X-18.7060.999 950~5003.7012.33ECY=14.99X+66.9611.000 050~5005.5318.43EGCGY=29.637X+539.680.999 050~5003.1710.57GCGY=30.126X+251.380.999 650~5001.023.40ECGY=33.938X+265.820.999 550~5002.709.00TFY=34.175X+278.340.999 950~5004.7515.83TF-3-GY=42.617X+2 860.60.999 950~5003.1610.53TF-3′-GY=45.759X+3 433.10.999 950~5002.678.90TFDGY=39.619X+2 678.90.999 850~5003.3011.00
精密度、重复性、稳定性是衡量HPLC检测方法准确性的一个重要指标。基于上述优化后的检测方法,精密度、重复性和稳定性范围分别为0.36%~3.40%、2.04%~4.82%、0.51%~3.83%(图2),均<5%。
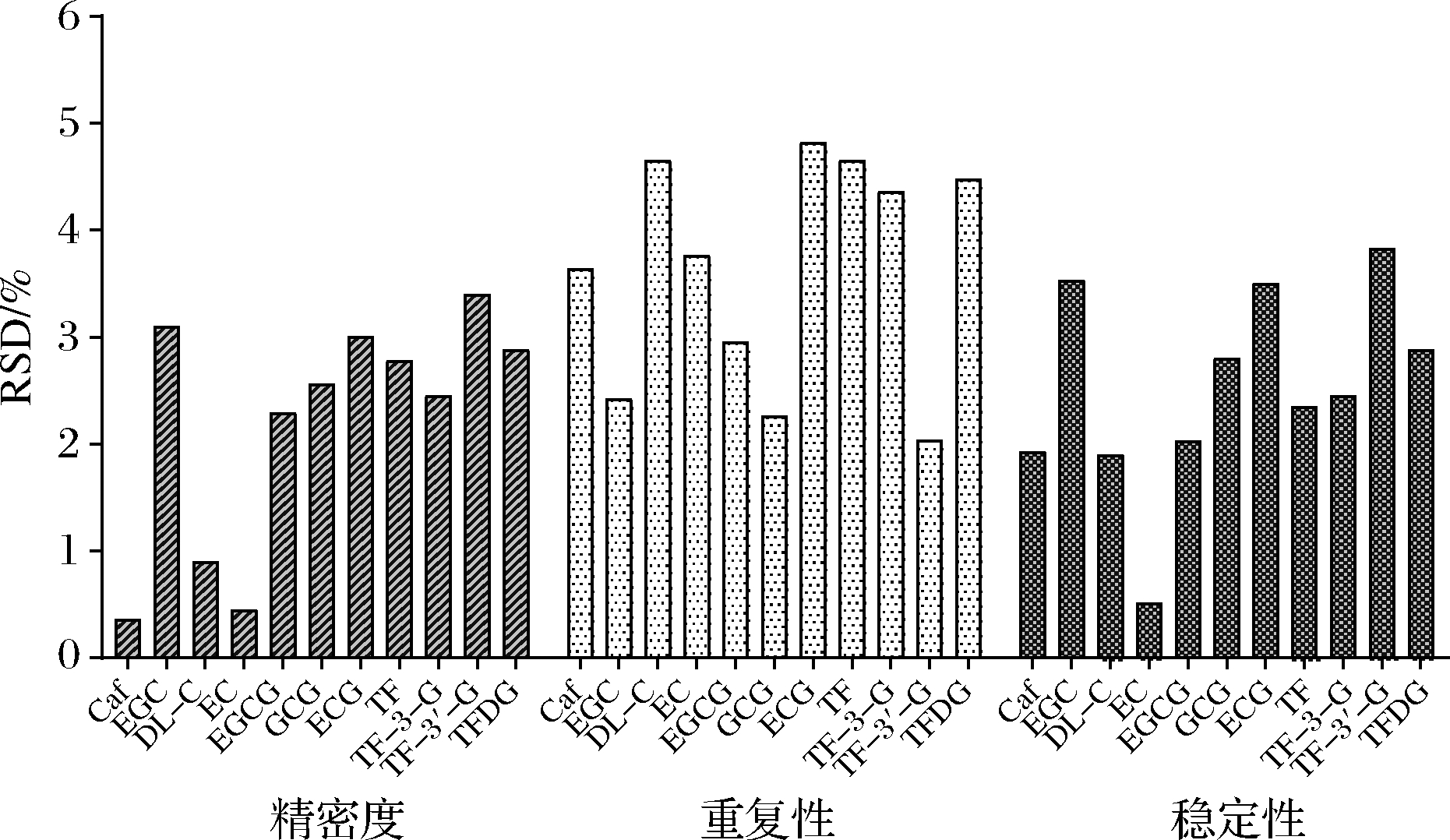
图2 检测方法仪器精密性、重复性、稳定性验证
Fig.2 The precision,repeatability and stability of instrument for testing method
表明该方法具有良好的精密性、重复性、稳定性,是一种可稳定准确检测茶叶中11种茶叶内含物质的方法。红茶样品加标回收实验结果显示加标回收率介于98.69%~104.77%,RSD均<5%(表4)。由此说明该方法准确度高,操作过程中损失少,回收率高。
表4 准确度试验结果(n=6)
Table 4 Accuracy tests for catechins and theaflavins(n=6)
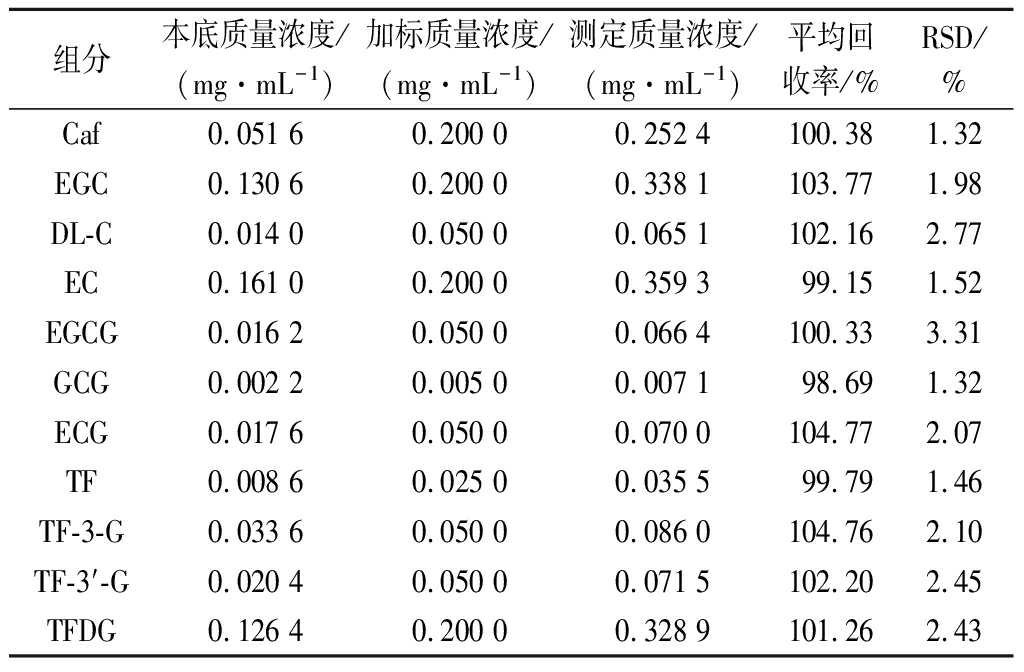
组分本底质量浓度/(mg·mL-1)加标质量浓度/(mg·mL-1)测定质量浓度/(mg·mL-1)平均回收率/%RSD/%Caf0.051 60.200 00.252 4100.381.32EGC0.130 60.200 00.338 1103.771.98DL-C0.014 00.050 00.065 1102.162.77EC0.161 00.200 00.359 399.151.52EGCG0.016 20.050 00.066 4100.333.31GCG0.002 20.005 00.007 198.691.32ECG0.017 60.050 00.070 0104.772.07TF0.008 60.025 00.035 599.791.46TF-3-G0.033 60.050 00.086 0104.762.10TF-3′-G0.020 40.050 00.071 5102.202.45TFDG0.126 40.200 00.328 9101.262.43
2.3 红茶样品测定
基于上述优化后的检测方法测定6种红茶样品,样品中茶黄素总量从高到低依次为黄金茶红茶、祁门工夫、祁红毛峰、滇红、坦洋功夫、一炮红(图3)。
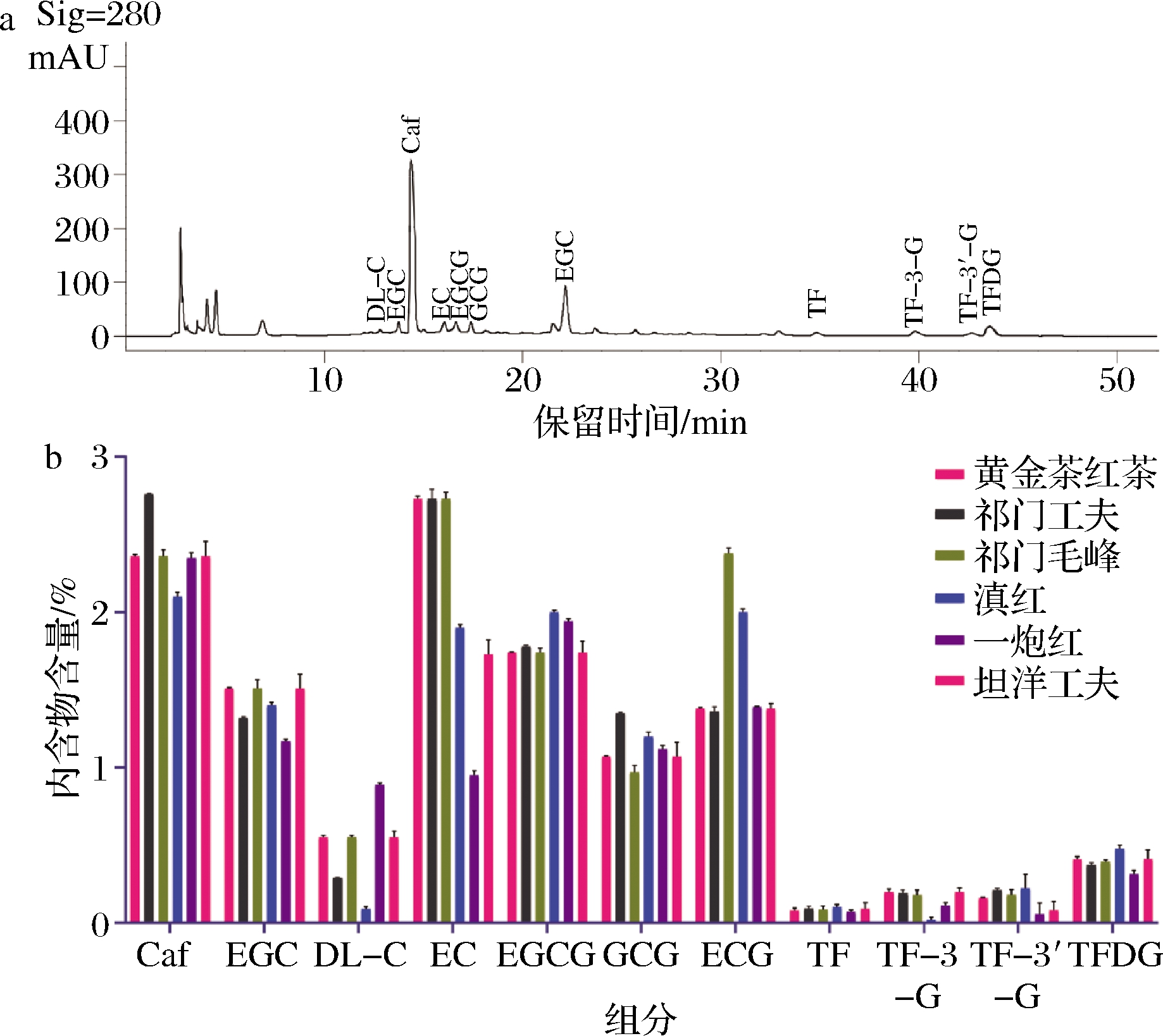
a-滇红茶HPLC色谱图;b-6种红茶样品中茶叶内含物含量
图3 滇红茶样品色谱图及6种红茶样品中11种内含物质的含量
Fig.3 The chromatogram of black tea samples and contents of contained substances in 6 black tea samples
各样品中4种主要茶黄素的含量范围为0.554%~0.863%,其中TFDG在所有茶中含量最高。儿茶素方面,红茶样品均表现为简单儿茶素的含量高于酯型儿茶素,这可能与茶鲜叶中的酯型儿茶素在发酵过程中被水解为简单儿茶素,且酯型儿茶素在酶的催化作用下氧化聚合成茶黄素、茶红素等有关,由此造成红茶中的酯型儿茶素含量较低。各样品中咖啡碱含量最高为2.76%(祁门毛峰),最低为2.1%(滇红茶)。所有检测值均在标准曲线有效测定范围内。
3 结论
HPLC法是利用高压泵将流动相压入色谱柱内,待测组分经过分配、吸附或者离子交换过程来完成分离,最后经过检测器进行检测的一项分离技术[15-16]。HPLC具有分离度好和准确度高的特点,是目前检测儿茶素应用最广泛、技术最成熟的方法。刘锦文等[17]以V(甲醇)∶V(1%磷酸水溶液)=68.32为流动相,通过Diamonsil C18色谱柱分离,在279 nm条件下检测到ECG和EGCG且分离效果好。付静等[18]利用UPLC检测出了绿茶中的5种儿茶素(C、EC、EGC、ECG、EGCG)均能达到较好的基线分离效果,方法具有良好的重复性和准确性。张爽等[19]建立了一种超高效液相色谱-紫外检测器测定茶饮料中没食子酸(gallic acid,GA)和5种儿茶素(C,EC,EGC,ECG,EGCG)的方法,6种组分在7 min内达到完全分离且各组分线性范围良好。尽管UPLC已运用于茶黄素、儿茶素的检测中,但仪器较昂贵,普及度不高,实验操作要求严格,难以大规模推广,且现有的检测方法不能同时测定儿茶素和茶黄素含量,或是存在分离度差,定量不准确等缺陷[20-21]。
本研究在HPLC检测茶黄素的基础上优化检测方法,建立了一种使用HPLC可同时、快速、准确、高效检测红茶中Caf、EGC、DL-C、EC、EGCG、GCG、ECG、TF、TF-3-G、TF-3′-G和TFDG等11种物质含量的方法。经流动相酸浓度、流速和柱温的优化,确定了最佳色谱条件。同时考察了线性范围、相关系数,并进行精密度、重复性、稳定性和准确度试验,RSD均<5%,加标回收率介于98.69%~104.77%,最后使用该方法对6种红茶中的儿茶素和茶黄素含量进行了检测和比较。本研究为红茶加工和生化品质研究提供了一种快速可靠的检测方法,以期更好地促进红茶产业发展。
[1] MA C H,HUNG Y C.Effect of brewing conditions using a single-serve coffee maker on black tea(Lapsang Souchong)quality[J].Food Science & Nutrition,2020,8(8):4 379-4 387.
[2] 胡林英,陈富桥,姜爱芹,等.2020年全国春茶产销形势分析[J].中国茶叶,2020,42(9):15-17;25.
HU L Y,CHEN F Q,JIANG A Q,et al.Analysis of the national spring tea production and marketing situation in 2020[J].China Tea,2020,42(9):15-17;25.
[3] HUA J J,XU Q,YUAN H B,et al.Effects of novel fermentation method on the biochemical components change and quality formation of Congou black tea[J].Journal of Food Composition and Analysis,2021,96:103751.
[4] 刘盼盼,郑鹏程,龚自明,等.工夫红茶品质分析与综合评价[J].食品科学,2021,42(12):195-205.
LIU P P,ZHENG P C,GONG Z M,et al.Quality analysis and comprehensive evaluation of Chinese congou black tea[J].Food Science,2021,42(12):195-205.
[5] ZHAN J F,CAO H J,HU T,et al.Efficient preparation of black tea extract(BTE)with the high content of theaflavin mono-and digallates and the protective effects of BTE on CCl4-induced rat liver and renal injury[J].Journal of Agricultural and Food Chemistry,2021,69(21):5 938-5 947.
[6] 刘昌伟,张梓莹,王俊懿,等.茶黄素生物学活性研究进展[J/OL].食品科学,2021.https://kns.cnki.net/kcms/detail/11.2206.ts.20210726.1739.022.html.
LIU C W,ZHANG Z Y,WANG J Y,et al.Research progress on bioactivity of theaflavins[J/OL].Food Science,2021.https://kns.cnki.net/kcms/detail/11.2206.ts.20210726.1739.022.html.
[7] QU Z H,LIU A L,LIU C W,et al.Theaflavin promotes mitochondrial abundance and glucose absorption in myotubes by activating the CaMKK2-AMPK signal axis via calcium-ion influx[J].Journal of Agricultural and Food Chemistry,2021,69(29):8 144-8 159.
[8] CAI Q S,JI S M,LI M W,et al.Theaflavin-regulated Imd condensates control Drosophila intestinal homeostasis and aging[J].iScience,2021,24(3):102150.
[9] 缪凤,王俊懿,朱海燕.外源纤维素酶对江华苦茶红茶品质的影响[J].食品工业科技,2021,42(17):38-46.
MIAO F,WANG J Y,ZHU H Y.Effects of exogenous cellulase on the quality of black tea of JiangHua-KuCha[J].Science and Technology of Food Industry,2021,42(17):38-46.
[10] 薛金金,尹鹏,张建勇,等.工夫红茶品质化学成分及加工工艺研究进展[J].食品研究与开发,2020,41(18):219-224.
XUE J J,YIN P,ZHANG J Y,et al.Research progress on quality-related chemical components and processing technology of congou black tea[J].Food Research and Development,2020,41(18):219-224.
[11] 王伟伟,施莉婷,苏威,等.不同嫩度鲜叶加工工夫红茶对品质和内含成分的影响[J].食品科技,2018,43(9):128-133.
WANG W W,SHI L T,SU W,et al.Effect of different fresh tea leaves on quality and component contents of black tea processing[J].Food Science and Technlogy,2018,43(9):128-133.
[12] 李伟,张春燕,李凤,等.超高效液相色谱-串联质谱法同时测定茶叶中儿茶素和茶黄素[J].现代预防医学,2019,46(22):4 179-4 184.
LI W,ZHANG C Y,LI F,et al.Simultaneous determination of catechins and theaflavins in tea by UPLC-MS/MS[J].Modern Preventive Medicine,2019,46(22):4 179-4 184.
[13] 潘海波.茶黄素的UPLC分析及其对人卵巢癌细胞抑制作用和机制的研究[D].杭州:浙江大学,2018.
PAN H B.Analysis of theaflavins and the inhibitory effects and mechanisms of theaflavins on human ovarian carcinoma cells[D].Hangzhou:Zhejinag University,2018.
[14] 吴敏,叶凤,干红女.HPLC法同时检测午时茶颗粒中4种色素的含量[J].中药材,2016,39(6):1 354-1 356.
WU M,YE F,GAN H N.Simultaneous determination of four pigments in Wushicha granules by HPLC[J].Journal of Chinese Medicinal Materials,2016,39(6):1 354-1 356.
[15] 朱小兰,陈波,罗旭彪,等.高效液相色谱法测定茶叶中的茶氨酸[J].色谱,2003,21(4):400-402.
ZHU X L,CHEN B,LUO X B,et al.Determination of theanine in tea by reversed-phase high performance liquid chromatography[J].Chinese Journal of Chromatography,2003,21(4):400-402.
[16] 刘雪娜,吴雪娇,刘顺航,等.高效液相色谱法测定速溶滇红茶制品中茶黄素含量[J].食品安全质量检测学报,2021,12(9):3 807-3 812.
LIU X N,WU X J,LIU S H,et al.Determination of theaflavins in instant Yunnan black tea products by high performance liquid chromatography[J].Journal of Food Safety and Quality,2021,12(9):3 807-3 812.
[17] 刘锦文,李红玉,石瑞君,等.高效液相色谱法测定茶多酚中EGCG和ECG的含量[J].食品工业科技,2010,31(11):372-374.
LIU J W,LI H Y,SHI R J,et al.Determination of content of EGCG and ECG in tea polypheenols by HPLC[J].Science and Technology of Food Industry,2010,31(11):372-374.
[18] 付静,江海,张玥.红茶制作过程中儿茶素及其组分的变化规律研究[J].食品科技,2013,38(10):74-76.
FU J,JIANG H,ZHANG Y,et al.The contents variation of catechins during black tea manufacture processing[J].Food Science and Technology,2013,38(10):74-76.
[19] 张爽,黄梦甜,焦妍津,等.超高效液相色谱-紫外检测器法快速测定茶饮料茶多酚中儿茶素类组成及含量[J].食品科学,2013,34(22):170-173.
ZHANG S,HUANG M T,JIAO Y J,et al.Rapid and high throughput quantitative analysis of catechin polyphenols in tea beverages by ultra-high performance liquid chromatography with photodiode array detection(UPLC-PDA)[J].Food Science,2013,34(22):170-173.
[20] 甘宾宾,蔡卓,蒋世琼,等.超高效液相色谱在现代分析检验中的应用进展[J].中国卫生检验杂志,2008,18(5):955-957.
GAN B B,CAI Z,JIANG S Q,et al.Application progress of ultra high performance liquid chromatography in modern analysis and testing[J].Chinese Journal of Health Laboratory Technology,2008,18(5):955-957.
[21] 黄彪,刘文静,方灵,等.基于UPLC-MS/MS同时分析福建乌龙茶和白茶中的儿茶素类物质[J].食品工业科技,2020,41(10):254-258;270.
HUANG B,LIU W J,FANG L,et al.Simultaneous analysis of catechins in several Fujian oolong tea and white tea products by UPLC-MS/MS[J].Science and Technology of Food Industry,2020,41(10):254-258;270.