4-羟基异亮氨酸(4-hydroxyisoleucine)为L-异亮氨酸的羟化物,是一种非蛋白质氨基酸,最早发现于胡芦巴种子中[1]。研究表明4-羟基异亮氨酸具有血糖浓度依赖的促进胰岛素分泌的活性,且可增强受体对胰岛素的敏感性;同时,4-羟基异亮氨酸还具有促进肌细胞对血糖吸收、加速脂肪代谢、降血脂和保护肝功能的作用[2-4]。作为有效预防和治疗Ⅱ型糖尿病及肥胖症的理想潜在药物,4-羟基异亮氨酸具有广泛的应用前景和市场需求[5]。本文总结了4-羟基异亮氨酸的功能和合成方法,重点综述了生物法合成4-羟基异亮氨酸的代谢工程策略。
1 4-羟基异亮氨酸的生物学功能
研究人员已发现8种构型的4-羟基异亮氨酸,但仅(2S,3R,4S)-4-羟基异亮氨酸具有生物学活性[1]。SAUVAIRE等[6]研究表明,4-羟基异亮氨酸在小鼠体外和体内均可促进胰岛素分泌,且4-羟基异亮氨酸的促胰岛素分泌作用具有血糖浓度依赖的特性:在低(3 mmol/L)或正常(5 mmol/L)血糖浓度下,4-羟基异亮氨酸没有明显的促胰岛素分泌作用;而在高血糖浓度下(6.6~16.7 mmol/L),4-羟基异亮氨酸显著促进胰岛素分泌,且与血糖浓度呈正相关趋势。MASIELLO等[7]研究发现,注射了4-羟基异亮氨酸的II型糖尿病病鼠干细胞和肌细胞吸收利用血糖的速率明显增加。MAURYA等[8]发现4-羟基异亮氨酸能够有效提高胞内葡萄糖转运蛋白的表达水平。SHARMA等[9]报道胡芦巴种子能够改善血脂异常,饲喂4-羟基异亮氨酸的小鼠甘油三酯、总胆固醇、甘油和游离脂肪酸的浓度明显下降。近年来研究发现,4-羟基异亮氨酸能够调控脂类代谢相关基因,还可缓解代谢综合症及巨噬细胞相关的慢性炎症[3-4]。目前尚未发现4-羟基异亮氨酸对机体产生副作用[6]。基于上述特性,4-羟基异亮氨酸被视为治疗糖尿病、高血脂和肥胖的潜在药物。
2 4-羟基异亮氨酸的生产
4-羟基异亮氨酸目前主要的生产方法有种子提取法、化学合成法、化学-酶法、酶法、微生物转化法和发酵法。
2.1 种子提取法
胡芦巴种子中4-羟基异亮氨酸占总氨基酸的80%,且有效构型(2S,3R,4S)-4-羟基异亮氨酸约占90%[1,10]。目前仅有提取分离法用于工业化生产4-羟基异亮氨酸。FOWDEN等[1]首次从胡芦巴种子中分离得到4-羟基异亮氨酸,其分离方法如下:用20%乙醇浸提胡芦巴种子,浸提液经Zeokarb 225柱(100 cm×10 cm,H+-型)分离并用氨水洗脱后获得氨基酸组分;洗脱液经真空浓缩后再用Dowex 50×8柱(100 cm×5 cm,H+-型)分离、氨水洗脱,洗脱液经浓缩结晶后获得4-羟基异亮氨酸粗品,其收率仅为0.091%。SAUVAIRE等[11]采用70%乙醇浸提-Amberlite IR 120 H+-型柱分离-氨水洗脱-薄层析分离-氯仿/甲醇/水洗脱-结晶的方法将总收率提升至0.6%。李玉山[12]进一步简化提取工艺,得到了纯度为40%的4-羟基异亮氨酸粗品,收率为0.32%。尽管提取法是目前工业化生产4-羟基异亮氨酸的主要手段,但存在原材料需求量大、分离纯化困难、提取率低(0.091%~0.6%)、成本高等不足。
2.2 化学合成法
化学法以葡萄糖、薄荷酮或α-甲基乙酰乙酸乙酯等为原料经多步化学反应生成4-羟基异亮氨酸。BEN-ISHAI等[13]首次报道了利用化学法合成4-羟基异亮氨酸,该方法以α-甲基乙酰乙酸乙酯和α-羟基苯甲酰氨基乙酸为底物先制备4-羟基异亮氨酸内酯,然后再合成4-羟基异亮氨酸。GULL等[14]在合成高丝氨酸的过程中,通过手性甘氨酸阴离子的等价物(杂环中间体)和环氧丁烷的不对称反应得到(3R,4R,5R)-和(3R,4S,5S)-4-羟基异亮氨酸内酯异构体的混合物(97.5∶2.5),总收率24%。INGHARDT等[15]利用三甲基铝连续诱发的苄基-2,3-脱水-4-O-叔丁基二甲基硅-γ-L-吡喃核糖苷的环氧和吡喃糖苷开环反应,合成了4-羟基异亮氨酸的两种对映异构体,(2S,3R,4R)-4-羟基异亮氨酸和(2S,3R,4R)-4-羟基异亮氨酸及相应的内酯。陈平等[16]对条件进行系统优化,包括对甲氧基苯胺和乙醛酸乙酯依次经缩合、(S)-脯氨酸催化不对称Mannich反应和1,8-二氮杂二环[5.4.0]十一烷-7-烯不对称转化制得(2S,3R)-2-(4-甲氧基苯胺基)-3-甲基-4-氧代戊酸乙酯,再经硝酸铈铵氧化脱保护、硼氢化钠还原和氢氧化锂水解得(2S,3R,4S)-4-羟基异亮氨酸,总收率约达到30%。总体而言,化学法分离困难、收率低(21%~30%),因此仍停留在实验室阶段。
2.3 化学-酶法及酶法
化学-酶法首先采用化学法合成4-羟基异亮氨酸前体物,然后再通过酶法合成4-羟基异亮氨酸。WANG等[17]首次报道了通过化学-酶合成法合成4-羟基异亮氨酸:先采用化学法合成2-甲基乙酰乙酸乙酯,然后利用白地霉(Geotrichum candidum)生物转化生成4-羟基异亮氨酸,总反应共8步,总收率为39%。FULCRAND等[18]先采用化学法合成N-苯基乙酰内酯,再利用环氧树脂固化的青霉素酰化酶催化生成4-羟基异亮氨酸,总反应共6步,总收率为38%。SMIRNOV等[19]报道了2步法合成4-羟基异亮氨酸,使用乙醛和α-酮丁酸在醛缩酶的作用下进行醛缩反应,其产物在分支链氨基酸转氨酶的作用下合成4-羟基异亮氨酸,尽管该方法大大简化了提取步骤,但是底物α-酮丁酸的转化率仅为4.3%。
SHI等[20]通过特异性位点突变的方法改造了短链脱氢酶/还原酶家族的4-羟基异亮氨酸脱氢酶,使其能够特异性催化(2S,3R)-2-氨基-3-甲基-4-酮戊二酸生成4-羟基异亮氨酸,其中(2S,3R,4S)-4-羟基异亮氨酸的纯度可达99.1%。酶法可特异性生成(2S,3R,4S)-4-羟基异亮氨酸,解决了化学法和化学-酶法产生4-羟基异亮氨酸构型较多的问题。然而,该方法所用底物(2S,3R)-2-氨基-3-甲基-4-酮戊二酸不易获取致使生产成本高。
2.4 生物法
生物法合成4-羟基异亮氨酸是在发现L-异亮氨酸双加氧酶(L-isoleucine dioxygenase,IDO)的基础发展起来的,根据是否添加底物L-异亮氨酸和(或)α-酮戊二酸可分为微生物转化法和发酵法。HAEFELÉ等[21]在胡芦巴种子破碎液中发现能够将L-异亮氨酸转化为(2S,3R,4S)-4-羟基异亮氨酸的活性组分,但至今未见后续研究报道。KODERA等[22]首次于苏云金芽孢杆菌Bacillus thuringiensis 2e2 AKU 0251中发现了IDO,该酶能够特异性催化L-异亮氨酸合成(2S,3R,4S)-4-羟基异亮氨酸(图1);并证实其属于α-酮戊二酸和Fe2+依赖的双加氧酶家族。
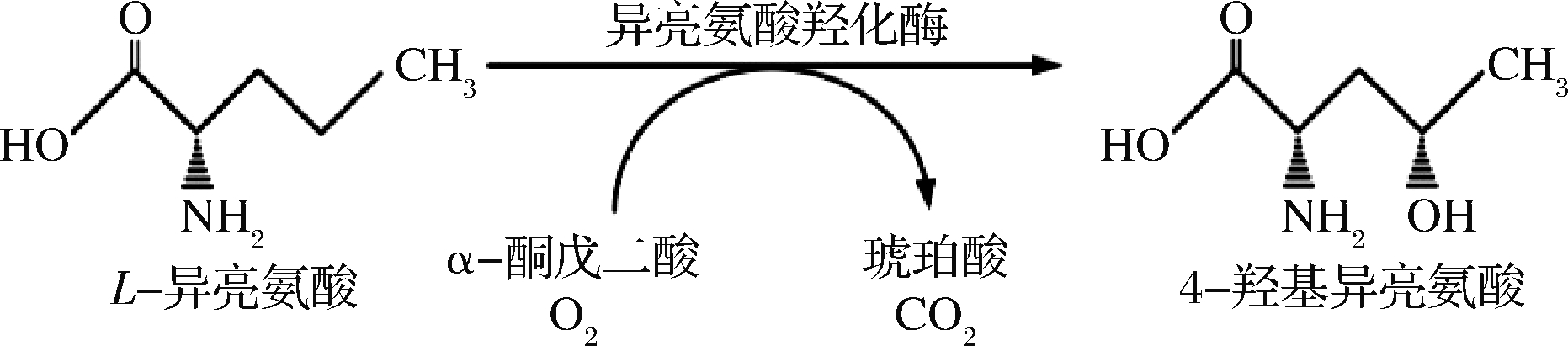
图1 IDO 催化生成 4-羟基异亮氨酸的反应
Fig.1 The reaction for synthesis of 4-hydroxyisoleucine catalyzed by IDO
KIVERO等[23]将上述IDO编码基因ido转化至大肠杆菌,通过在发酵过程中添加前体物L-异亮氨酸实现转化法合成4-羟基异亮氨酸,在优化条件下产量达到24.0 g/L,但该方法存在L-异亮氨酸被额外消耗及耗糖高等不足。SHI等[24-26]利用谷氨酸棒杆菌过表达ido,在添加α-酮戊二酸并优化条件下经144 h发酵,最高产量达到14.1 g/L。张成林等[27]从苏云金芽孢杆菌B.thuringiensis TCCC 11826中克隆出ido(Accession No.KC884243),其编码的IDO氨基酸序列与KODERA报道的IDO相似性为97.91%,Km和Vmax分别为0.18 mmol/L和2.10 μmol/(min·mg),催化效率略高于后者;在此基础上,利用该基因分别于大肠杆菌和谷氨酸棒杆菌建立了微生物转化法4-羟基异亮氨酸合成体系,4-羟基异亮氨酸产量分别达到6.6 g/L和5.3 g/L。ZHANG等[28]根据IDO偶联异亮氨酸羟化反应和α-酮戊二酸氧化反应的特性,利用琥珀酸缺陷型菌株建立了高活性IDO的高通量筛选体系,获得了催化效率显著提高的IDO突变体IDOL27I/E80D/G169H/S18D;利用该突变体可催化生成22.4 g/L 4-羟基异亮氨酸,转化率达到99.7%。为进一步提高4-羟基异亮氨酸产量和转化效率,李英滋等[29]构建了ido表达菌株Escherichia coli pET-ido并利用该细胞建立和优化了合成4-羟基异亮氨酸的静息细胞催化体系,4-羟基异亮氨酸产量和转化率分别达到36.7 g/L和99.8%。DU等[30]通过易错PCR结合基于NADH检测的高通量筛选方法筛选获得突变体IDOI162T/T182 N,表达该酶的静息细胞可将29.9 g/L L-异亮氨酸完全转化成4-羟基异亮氨酸。
总体而言,上述方法存在周期长,需添加1~2种前体物等不足,限制了4-羟基异亮氨酸的规模化生产。与之相比,直接发酵法是以葡萄糖为碳源,无需添加前体物L-异亮氨酸和α-酮戊二酸便可生成4-羟基异亮氨酸,故备受关注。TAN等[31]利用动态调控三羧酸(tricarboxylic acid,TCA)循环,增加菌株摄氧等策略实现4-羟基异亮氨酸的直接发酵合成,经144 h培养可生成19.9 g/L 4-羟基异亮氨酸[31]。ZHANG等[32]于L-异亮氨酸生产菌株Corynebacterium glutamicum YI中构建4-羟基异亮氨酸合成途径,并通过静态调控结合动态调控等系统代谢工程手段,获得1株4-羟基异亮氨酸高产菌株HIL18,该菌株以葡萄糖前体物可生成34.2 g/L的4-羟基异亮氨酸,为已报道直接发酵法合成4-羟基异亮氨酸的最高产量。
3 4-羟基异亮氨酸的生物合成途径
目前已在苏云金芽孢杆菌、蜡样芽孢杆菌等芽孢杆菌属中发现IDO,表明该类细菌含有4-羟基异亮氨酸的生物合成途径[30,33]。如图2所示,4-羟基异亮氨酸的生物合成途径以L-异亮氨酸和α-酮戊二酸为前体,由IDO催化生成。
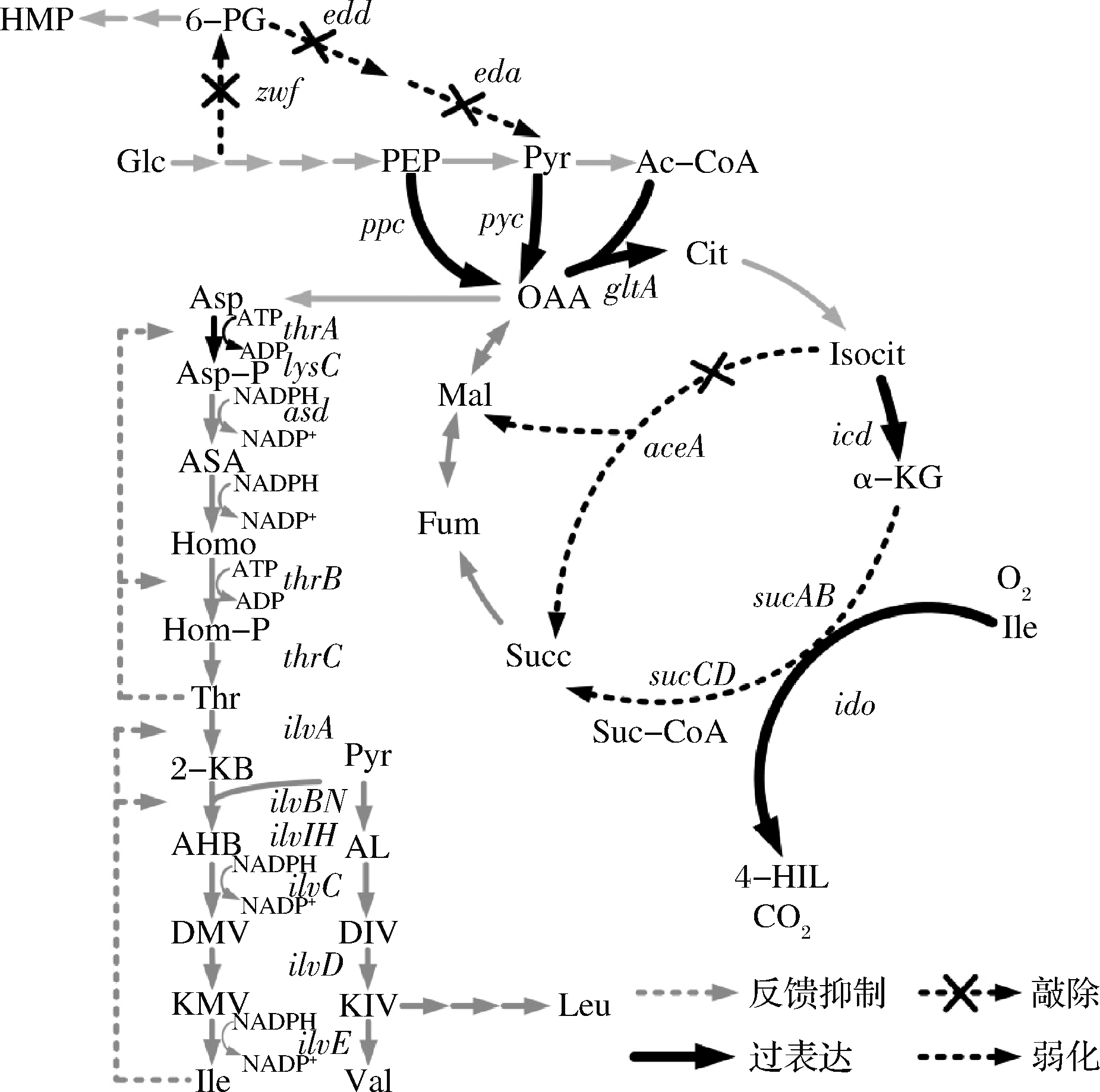
图2 4-羟基异亮氨酸的生物合成途径及其代谢工程改造策略
Fig.2 Biosynthesis pathway of 4-hydroxyisoleucine and strategies for its metabolic engineering
Glc-葡萄糖;6-PG-6-磷酸葡萄糖酸;PEP-磷酸烯醇式丙酮酸;Pyr-丙酮酸;Ac-CoA-乙酰辅酶A;Cit-柠檬酸;Isocit-异柠檬酸;α-KG-α-酮戊二酸;Suc-CoA-琥珀酰辅酶A;Succ-琥珀酸;Fum-延胡索酸;Mal-苹果酸;OAA-草酰乙酸;OAA-草酰乙酸;Asp-天冬氨酸;Asp-P-天冬氨酸磷酸;ASA-天冬氨酸-β-半醛;Homo-高丝氨酸;Hom-P-高丝氨酸磷酸;Thr-苏氨酸;α-KB-α-酮基丁酸;AHB-α-乙酰基-α-羟基丁酸;DMV-α-β-二羟基-β-甲基戊酸;KMV-α-酮基-β-甲基戊酸;AL-α-乙酰乳酸;DIV-α-β-二羟基异戊酸;KIV-α-酮基异戊酸;Ile-异亮氨酸;Val-缬氨酸;Leu-亮氨酸;4-HIL-4-羟基异亮氨酸;ppc-磷酸烯醇式丙酮酸羧化酶编码基因;pyc-丙酮酸羧化酶编码基因;zwf-6-磷酸葡萄糖酸脱氢酶;edd-6-磷酸葡萄糖酸脱水酶;edd-2-酮基-3-脱氧-6-磷酸葡萄糖酸醛缩酶;gltA-柠檬酸合酶编码基因;icd-异柠檬酸脱氢酶编码基因;aceA-异柠檬酸裂解酶编码基因;sucAB-α-酮戊二酸脱氢酶编码基因;sucCD-琥珀酰辅酶A合酶编码基因;lysC-天冬氨酸激酶编码基因;thrA-天冬氨酸激酶/高丝氨酸脱氢酶编码基因;asd-天冬氨酸半醛脱氢酶编码基因;thrB-高丝氨酸激酶编码基因;thrC-苏氨酸合成酶编码基因;ilvA-苏氨酸脱氢酶编码基因;ilvBN-乙酰羟基酸合成酶编码基因;ilvC-二羟酸还原异构酶编码基因;ilvD-二羟酸脱水酶编码基因;ilvE-分支链氨基酸转氨酶
葡萄糖进入细胞后经糖酵解途径和磷酸戊糖途径生成磷酸烯醇式丙酮酸和丙酮酸,二者分别在磷酸烯醇式丙酮酸羧化酶和丙酮酸羧化酶的作用下发生羧化反应,生成草酰乙酸。草酰乙酸和乙酰辅酶A依次在柠檬酸合酶、顺乌头酸酶及异柠檬酸脱氢酶的作用下生成α-酮戊二酸,其中柠檬酸合酶或(和)异柠檬酸脱氢酶为限速酶。α-酮戊二酸可经α-酮戊二酸脱氢酶复合体催化生成琥珀酰辅酶A继续完成TCA循环,也可在谷氨酸脱氢酶的催化下生成谷氨酸,还可与谷氨酰胺经谷氨酸合酶催化生成谷氨酸[34]。
草酰乙酸在转氨酶的作用下生成L-天冬氨酸,并由天冬氨酸激酶、天冬氨酸半醛脱氢酶、高丝氨酸脱氢酶、高丝氨酸激酶、苏氨酸合成酶、苏氨酸脱氢酶、乙酰羟基酸合成酶、二羟酸还原异构酶、二羟酸脱水酶和支链氨基酸转氨酶催化经10步反应生成L-异亮氨酸[35-36]。生成的α-酮戊二酸和L-异亮氨酸经IDO催化,在Fe2+存在的条件下生成4-羟基异亮氨酸,同时生成CO2。
4 4-羟基异亮氨酸生产菌株代谢工程选育
目前生物合成4-羟基异亮氨酸的代谢工程研究集中于大肠杆菌和谷氨酸棒杆菌。主要代谢工程策略包括构建合成途径、强化L-异亮氨酸合成、重构中代谢途径及增强辅因子合成等(表1)。
表1 4-羟基异亮氨酸生产菌株改造策略
Table 1 Strategies for metabolic engineering construction of 4-hydroxyisoleucine producing strain

底盘细胞策略周期/h产量/(g·L-1)L-异亮氨酸转化率/%参考文献谷氨酸棒杆菌过表达ppc、lysC14414.1-[25]敲除pknG、过表达POS514412.498[26] 敲除aceA、过表达mqo和vgb14417.299[37-38]采用不同强度RBS控制odhI表达,使用突变的的PbrnFE启动子动态调节ido、odhI和vgb的表达强度,敲除avtA或IdhA-pyk214420.695[31,39]过表达ppc、gltA、icd,敲除pck、pyk、aceA,利用PilvBNC动态调控odhA的转录6434.298[32]大肠杆菌敲除sucAB、aceA2012.182[22]敲除sucAB、aceA、zwf、edd、eda2224.088[23]
注:-未报道
4.1 构建4-羟基异亮氨酸合成途径
大肠杆菌和谷氨酸棒杆菌均不含ido,因此首先于菌株中表达外源ido构建4-羟基异亮氨酸合成途径。OGAWA等[33]于大肠杆菌E.coli Rosetta2(DE3)过表达了来源于B.thuringiensis ATCC 35646的ido,经诱导表达后,在添加α-酮戊二酸和L-异亮氨酸的条件下可合成1.9 g/L 4-羟基异亮氨酸。SHI等[34]利用来源于B.thuringiensis YBT-1520的ido于L-异亮氨酸生产菌C.glutamicum ssp.lactofermentum SN01构建了4-羟基异亮氨酸合成途径;获得的菌株Cgl/p4-ido经120 h摇瓶发酵产4-羟基异亮氨酸5.3 g/L,经优化生物素的添加量4-羟基异亮氨酸产量达到9.6 g/L。ZHANG等[32]于L-异亮氨酸生产菌C.glutamicum YI中过表达经密码子优化的ido(来源于B.thuringiensis TCCC 11826),经摇瓶发酵48 h,获得的菌株HIL04可产3.3 g/L 4-羟基异亮氨酸。SHI等[39]考察了18种核糖体结合位点序列对4-羟基异亮氨酸合成的影响,其产量范围为 1.2~15.3 g/L,由此可见ido的转录水平对4-羟基异亮氨酸合成影响较为显著。
4.2 强化L-异亮氨酸合成
草酰乙酸是合成L-异亮氨酸的重要前体物质。在谷氨酸棒杆菌中,草酰乙酸主要来源于由丙酮酸羧化酶(由pyc编码)和磷酸烯醇式丙酮酸羧化酶(由ppc编码)催化丙酮酸羧和磷酸烯醇式丙酮酸的回补途径[35]。SHI等[25]于4-羟基异亮氨酸菌株Cgl/p4-ido过表达ppc使得4-羟基异亮氨酸产量由10.9 g/L提升至14.1 g/L。ZHANG等[32]比较了过表达pyc和ppc对4-羟基异亮氨酸合成的影响,发现二者均能显著提升其合成效率,4-羟基异亮氨酸产量及生物量分别提高19%和31%及28.8%和42.3%,可见过表达ppc的效果优于pyc[32]。L-苏氨酸是合成L-异亮氨酸的直接前体物质,天冬氨酸激酶是该途径中的关键酶。然而在谷氨酸棒杆菌中过表达天冬氨酸激酶编码基因lysC抑制了4-羟基异亮氨酸的合成[25];推测过表达lysC使L-异亮氨酸合成代谢流过强,与α-酮戊二酸合成竞争前体物草酰乙酸。草酰乙酸可由磷酸烯醇式丙酮酸羧激酶催化,生成磷酸烯醇式丙酮酸,但敲除其编码基因pck对4-羟基异亮氨酸的合成无明显影响[32]。丙酮酸激酶催化磷酸烯醇式丙酮酸生成丙酮酸,故与草酰乙酸的合成竞争磷酸烯醇式丙酮酸。尽管敲除其编码基因pyk对4-羟基异亮氨酸产量无显著影响,但可明显降低L-亮氨酸和L-丙氨酸等副产物积累[32]。
4.3 重构中心代谢途径
4.3.1 中心代谢途的静态调控
研究证明,阻断大肠杆菌ED途径可提高L-天冬氨酸合成,故可促进L-异亮氨酸的合成[40-41]。KIVERO等[23]敲除大肠杆菌E.coli MG1655的ED途径关键基因edd和eda,却发现4-羟基异亮氨酸产量略有下降。但在此基础上敲除6-磷酸葡萄糖脱氢编码基因zwf使得4-羟基异亮氨酸产量由23.0 g/L提升至24.0 g/L,耗糖降低20%[23]。
柠檬酸合酶(由gltA编码)和异柠檬酸脱氢酶(由icd编码)是TCA循环的关键酶。在谷氨酸棒杆菌中过表达gltA使4-羟基异亮氨酸产量和生物量分别提高34.7%和9.6%,L-赖氨酸等副产物降低40%以上;在此基础上过表达icd使得4-羟基异亮氨酸产量、单位菌体产量和转化率分别提高44.2%、30.2%和29.9%,副产物积累量进一步下降[32]。上述结果表明,过表达gltA和icd将代谢流“拉”向TCA循环,从而增加α-酮戊二酸的供应[32]。乙醛酸循环与TCA循环竞争α-酮戊二酸前体物异柠檬酸,敲除其关键酶异柠檬酸裂解酶编码基因aceA使得4-羟基异亮氨酸产量提高6.3%[32]。以往认为,谷氨酸棒杆菌在碳源充足的条件下乙醛酸循环并不发挥作用,该结果显示乙醛酸循环会分配少量的代谢流。
谷氨酸脱氢酶(由gdh编码)和α-酮戊二酸脱氢酶(在大肠杆菌和谷氨酸棒杆菌中分别由sucAB和odhA编码)可将α-酮戊二酸分别催化生成L-谷氨酸和琥珀酰-CoA,与IDO竞争α-酮戊二酸。敲除谷氨酸棒杆菌中gdh1显著降低4-羟基异亮氨酸产量和菌体生物量,而敲除gdh2可使4-羟基异亮氨酸产量提高8.3%且对菌体生长无显著影响[32]。该结果提示谷氨酸棒杆菌2个谷氨酸脱氢酶中,GDH1发挥更大的作用。由于IDO合成4-羟基异亮氨酸的同时还生成琥珀酸,故该酶能够重新连接ΔsucAB菌株中阻断的TCA循环。SMIRNOV等敲除大肠杆菌E.coli MG1655 的aceA和sucAB并过表达ido,从而将菌体生长与4-羟基异亮氨酸耦联起来,在添加13.2 g/L L-异亮氨酸的条件下合成12.1 g/L 4-羟基异亮氨酸[22]。然而将该策略应用于谷氨酸棒杆菌时,4-羟基异亮氨酸产量和菌体生物量显著下降,推测可能发酵前期IDO活性或L-异亮氨酸合成不足致使生成的琥珀酸难以满足菌体生长[32]。在谷氨酸棒杆菌中,抑制蛋白OdhI与α-酮戊二酸脱氢酶结合后通过改变其构象抑制其活性。但OdhI被丝氨酸/苏氨酸蛋白激酶PknG磷酸化后无抑制作用[42]。敲除pknG使得4-羟基异亮氨酸产量由6.5 g/L提升至12.4 g/L,但仍有11.2 g/L L-异亮氨酸残留[26]。
4.3.2 中心代谢途的动态调控
由图2可知,4-羟基异亮氨酸的生物合成均涵盖中心代谢、分支代谢以及能量和辅酶代谢等多个代谢途径。这些代谢途径常因竞争共同前体物导致代谢流分配失衡,致使4-羟基异亮氨酸难以高效积累且前体物L-异亮氨酸大量残留[26,32]。近年来了报道的动态调控策略有效地协调了菌体生长和4-羟基异亮氨酸的高效合成。
L-异亮氨酸等分支链氨基酸能够介导转录激活因子Lrp与其输出蛋白编码基因brnFE启动子的结合,从而激活brnFE的转录[43]。研究发现,OdhI第14位苏氨酸突变后(T14A)不再被PknG磷酸化,故OdhIT14A一旦与α-酮戊二酸脱氢酶结合便不易解离[42]。ZHANG等[32]利用brnFE启动子PbrnFE调控OdhIT14A编码基因odhIA40G的转录,即仅当胞内有L-异亮氨酸积累时,odhIA40G的转录被激活,其编码的OdhIT14A抑制α-酮戊二酸脱氢酶活性从而有更多的α-酮戊二酸用于合成4-羟基异亮氨酸。摇瓶条件下,获得的菌株4-羟基异亮氨酸产量由4.95 g/L提升至5.36 g/L(提高8.3%)。SHI等[38]利用不同强度的PbrnFE突变体动态调控ido的表达使得4-羟基异亮氨酸产量提高6.7;当使用相同策略调控odhIA40GA43G时,4-羟基异亮氨酸产量却下降[38]。
谷氨酸棒杆菌ilvBNC操纵子的启动子中含弱化子,该弱化子中含L-异亮氨酸、L-缬氨酸和L-亮氨酸密码子,当胞内有L-异亮氨酸、L-缬氨酸和L-亮氨酸积累时,ilvBNC的转录受到弱化调控[44]。ZHANG等[32]利用该特性,将α-酮戊二酸脱氢酶编码基因odhA启动子替换为PilvBNC以动态调控其转录:发酵前期菌体生长速率高但L-异亮氨酸合成相对较少,此时胞内外无过量L-异亮氨酸积累,α-酮戊二酸除部分用于4-羟基异亮氨酸合成外,大部分用于TCA循环(生长);发酵中、后期菌体生长速率降低,且此时当胞内外有大量L-异亮氨酸积累,odhA转录被弱化,更多的α-酮戊二酸用于4-羟基异亮氨酸合成。结果显示,所获菌株HIL18的odhA转录水平与胞内L-异亮氨酸浓度呈负相关趋势,odhA的转录水平逐渐下降1.5~20倍、α-酮戊二酸脱氢酶活性下降10%~64%,证明PilvBNC能够很好地响应胞内L-异亮氨酸浓度从而动态调控α-酮戊二酸脱氢酶活性;在发酵初期即有少量4-羟基异亮氨酸积累,而对照菌株则无,发酵中期和后期4-羟基异亮氨酸合成速率显著提升,进一步证明了PilvBNC对α-酮戊二酸脱氢酶活性的动态调控作用;同时,HIL18的4-羟基异亮氨酸产量和转化率较对照菌株分别提高1.3倍和1.5倍,胞外L-异亮氨酸积累由10.98 g/L降低至0.62 g/L,其余副产物降低至0.5 g/L以下,表明动态调节TCA循环能够重新分配代谢流、平衡菌体生长和4-羟基异亮氨酸的高效合成,显著提高葡萄糖利用率[32]。综合来看,利用OdhI抑制α-酮戊二酸脱氢酶活性的策略对4-羟基异亮氨酸产量的提升水平有限;相比而言,弱化odhA转录的效果更为显著。推测原因是,OdhI对α-酮戊二酸脱氢酶活性的抑制作用是持续累加的,而odhA转录的弱化是随胞内L-异亮氨酸水平动态波动的,故后者效果更佳。
4.4 其他策略
如图2所示,合成1 mol L-异亮氨酸需要4 mol NADPH,故NADPH供应被认为是L-异亮氨酸合成的限制因素。研究发现,共表达zwf和NADH激酶编码基因pos5可使4-羟基异亮氨酸产量提高62.18%[26]。IDO催化的羟化反应需要O2,故推测菌体的摄氧能力可能影响4-羟基异亮氨酸合成。SHI等[39]过表达了来源于透明颤菌的血红蛋白编码基因vgb使菌株恢复生长且4-羟基异亮氨酸产量提升。
总体而言,目前利用谷氨酸棒杆菌直接发酵合成4-羟基异亮氨酸的研究较大肠杆菌深入。其主原因是,当前L-异亮氨酸生产菌均为谷氨酸棒杆菌,同时谷氨酸棒杆菌的α-酮戊二酸合成能力强,故在L-异亮氨酸生产菌的基础上进一步增强α-酮戊二酸合成代谢流更易实现。然而从长远来看,现有的L-异亮氨酸生产菌均经多轮诱变获得,存在L-缬氨酸等多种营养物质缺陷,故对营养要求高、生长相对于野生型菌株缓慢。同时,诱变菌株的遗传性状较野生型菌株发生很大改变,且遗传背景不够清晰,增加了进一步代谢工程选育的难度,大幅度提升合成效率的空间有限。相比而言,大肠杆菌生长快,营养要求低,遗传背景更为清晰,分子生物学工具手段更为丰富,故已成为L-苏氨酸、L-色氨酸、L-缬氨酸等多种氨基酸及其衍生物的细胞工厂。综上,大肠杆菌更有潜力作为4-羟基异亮氨酸高效从头的底盘细胞。
5 展望
近年来,随着系统生物学、合成生物学、代谢工程以及酶工程的飞速发展,包括4-羟基异亮氨酸在内的多种高附加值氨基酸及其衍生物实现了高效生物合成。尽管如此,其合成潜力和合成效率仍有望进一步提升。今后的工作可聚焦于如下方面:(1)综合利用生物信息学、计算生物学、酶工程等技术设计性状优良的关键酶和启动子,并通过途径模拟遴选出最佳候选代谢途径;(2)整合系统生物学、合成生物学、代谢工程等理论和技术重构代谢网络,优化代谢流分布;(3)运用多组学手段及代谢流定量分析,结合生产菌株代谢特性,进一步挖掘影响产物高效合成的限制因素,优化代谢途径和发酵条件。
[1] FOWDEN L,PRATT H M,SMITH A,et al.4-Hydroxyisoleucine from seeds of Trigonella foenum-graecum[J].Phytochemistry,1973,12(7):1 707-1 711.
[2] AHMAD A,ALGHAMDI SS,MAHMOOD K,et al.Fenugreek a multipurpose crop:potentialities and improvements[J].Saudi Journal of Biological Sciences,2016,23(2):300-310.
[3] MOHAMMAD-SADEGHIPOUR M,MAHMOODI M,KARIMABAD M N,et al.Diosgenin and 4-hydroxyisoleucine from fenugreek are regulators of genes involved in lipid metabolism in the human colorectal cancer cell line SW480[J].Cell Journal,2021,22(4):514-522.
[4] YANG J L,RAN Y H,YANG Y H,et al.4-Hydroxyisoleucine alleviates macrophage-related chronic inflammation and metabolic syndrome in mice fed a high-fat diet[J].Frontiers in Pharmacology,2021,11:606514.
[5] ZAFAR M I,GAO F.4-Hydroxyisoleucine:A potential new treatment for type 2 diabetes mellitus[J].BioDrugs:Clinical Immunotherapeutics,Biopharmaceuticals,2016,30(4):255-262.
[6] SAUVAIRE Y,PETIT P,BROCA C,et al.4-Hydroxyisoleucine,a novel amino acid potentiator of insulin secretion[J].Diabetes,1998,47(2):206-210.
[7] MASIELLO P,BROCA C,GROSS R,et al.Experimental NIDDM development of a new model in adult rats administered Streptozotocin and nicotinamide[J].Diabetes,1998,47(2):224-229.
[8] MAURYA C K,SINGH R,JAISWAL N,et al.4-Hydroxyisoleucine ameliorates fatty acid-induced insulin resistance and inflammatory response in skeletal muscle cells[J].Molecular & Cellsular Endocrinology,2014,395(1):51-60.
[9] SHARMA R D,RAGHURAM T C,RAO N S.Effect of fenugreek seeds on blood glucose and serum lipids in type I diabetes[J].European Journal of Clinical Nutrition,1990,44(4):301-306.
[10] GALINSKI E A,PFEIFFER H P,TRUPER H G.1,4,5,6-Tetrahydro-2-methyl-4-pyrimidinecarboxylic acid[J].European Journal of Biochemistry,1985,149(1):135-139.
[11] SAUVAIRE Y,GIRARDON P,BACCOU J C,et al.Changes in growth,proteins and free amino acids of developing seed and pod of fenugreek[J].Phytochemistry,1984,23(3):479-486.
[12] 李玉山.胡芦巴中4-羟基异亮氨酸的提取分离工艺研究[J].食品科学,2009,30(8):128-131.
LI Y S.Study on extraction and purification of 4-hydroxyisoleucine from Trigonella foenungraecum[J].Food Science,2009,30(8):128-131.
[13] BEN-ISHAI D,BERLER Z,ALTMAN J,et al.A new synthesis of α-amino acids.Amidoalkylation of active methylene compounds with glyoxylic acid derivatives[J].Journal of the Chemical Society Chemical Communications,1975,7(22):905-906.
[14] GULL R,SCHÖLLKOPF U.Asymmetric Syntheses via Heterocyclic Intermediates;XXVII1.Enantioselective synthesis of[2-methoxyethoxymethyl-protected](R)-homoserine methyl esters and(R)-α-methyl-homoserine methyl esters and of the corresponding α-amino-γ-lactones by the bis-lactim ether method[J].Synthesis,1985,1985(11):1 052-1 055.
[15] INGHARDT T,FREJD T,SVENSSON G.Organoaluminium induced ring opening of epoxypyranosides.IV.Synthesis and structure of γ-hydroxylsoleucine stereoisomers and their corresponding lactones[J].Tetrahedron,1991,47(32):6 469-6 482.
[16] 陈平,吴成龙,邓勇.(2S,3R,4S)-4-羟基异亮氨酸的不对称合成[J].中国医药工业杂志,2010,41(7):491-494.
CHEN P,WU C L,DENG Y.Asymmetric synthesis of(2S,3R,4S)-4-hydroxyisoleucine[J].Chinese Journal of Pharmaceuticals 2010,41(7):491-494.
[17] WANG Q,OUAZZANI J,SASAKI N A,et al.A practical synthesis of(2S,3R,4S)-4-hydroxyisoleucine,a potent insulinotropic α-amino acid from fenugreek[J].European Journal of Organic Chemistry,2002,5(1):834-839.
[18] FULCRAND V R,ROLLAND M,ROUMESTANT M L,et al.Chemoenzymatic synthesis of enantiomerically pure(2S,3R,4S)-4-hydroxyisoleucine,an insulinotropic amino acid isolated from fenugreek seeds[J].European Journal of Organic Chemistry,2004,2004(4):873-877.
[19] SMIRNOV S V,SAMSONOVA N N,NOVIKOVA A E,et al.A novel strategy for enzymatic synthesis of 4-hydroxyisoleucine:identification of an enzyme possessing HMKP(4-hydroxy-3-methyl-2-keto-pentanoate)aldolase activity[J].FEMS Microbiology Letters,2007,273(1):70-77.
[20] SHI X,MIYAKAWA T,NAKAMURA A,et al.Engineering a short-chain dehydrogenase/reductase for the stereoselective production of(2S,3R,4S)-4-hydroxyisoleucine with three asymmetric centers[J].Scientific Reports,2017,7:73703.
[21] HAEFELÉ C,BONFILS C,SAUVAIRE Y.Characterization of a dioxygenase from Trigonella foenum-graecum involved in 4-hydroxyisoleucine biosynthesis[J].Phytochemistry,1997,44(4):563-566.
[22] KODERA T,SMIRNOV S V,SAMSONOVA N N,et al.A novel L-isoleucine hydroxylating enzyme,L-isoleucine dioxygenase from Bacillus thuringiensis,produces(2S,3R,4S)-4-hydroxyisoleucine[J].Biochemical & Biophysical Research Communications,2009,390(3):506-510.
[23] KIVERO A D,NOVIKOVA A E,SMIRNOV S V.Modification of E.coli central metabolism to optimize the biotransformation of L-isoleucine into 4-hydroxyisoleucine by enzymatic hydroxylation[J].Applied Biochemistry and Microbiology,2012,48(7):639-644.
[24] SHI F,NIU T F,FANG H M.4-Hydroxyisoleucine production of recombinant Corynebacterium glutamicum ssp.lactofermentum under optimal corn steep liquor limitation[J].Applied microbiology and biotechnology,2015,99(9):3 851-3 863.
[25] SHI F,FANG H M,NIU T F,et al.Overexpression of ppc and lysC to improve the production of 4-hydroxyisoleucine and its precursor L-isoleucine in recombinant Corynebacterium glutamicum ssp.lactofermentum[J].Enzyme and Microbial Technology,2016,87-88:79-85.
[26] SHI F,ZHANG M L,LI Y F,et al.Sufficient NADPH supply and pknG deletion improve 4-hydroxyisoleucine production in recombinant Corynebacterium glutamicum[J].Enzyme and Microbial Technology,2018,115:1-8.
[27] 张成林,刘远,薛宁,等.苏云金芽孢杆菌重组L-异亮氨酸羟化酶的酶学性质及其在4-羟基异亮氨酸合成中的应用[J].微生物学报,2014,54(8):889-896.
ZHANG C L,LIU Y,XUE N,et al.Characterization of recombinant L-isoleucine-4-hydroxylase from Bacillus thuringiensis and its application in 4-hydroxyisoleucine biosynthesis[J].Acta Microbiologica Sinica,2014,54(8):889-896.
[28] ZHANG C L,MA J,LI Z X,et al.A strategy for L-isoleucine dioxygenase screening and 4-hydroxyisoleucine production by resting cells[J].Bioengineered,2018,9(1):72-79.
[29] 李英滋,张宇,王道安,等.合成4-羟基异亮氨酸的大肠杆菌构建及其催化体系优化[J].天津科技大学学报,2020,35(3):9-15.
LI Y Z,ZHANG Y,WANG D A,et al.Construction of Escherich coli strain for 4-hydroxyisoleucine biosynthesis and optimization of its biocatalyzing system[J].Journal of Tianjin University of Science & Technology,2020,35(3):9-15.
[30] DU P,YAN S,QIAN X L,et al.Engineering Bacillus subtilis isoleucine dioxygenase for efficient synthesis of(2S,3R,4S)-4-Hydroxyisoleucine[J].Journal of Agricultural and Food Chemistry,2020,68(49):14 555-14 563.
[31] TAN S Y,SHI F,LIU H Y,et al.Dynamic control of 4-hydroxyisoleucine biosynthesis by modified L-isoleucine biosensor in recombinant Corynebacterium glutamicum[J].ACS Synthetic Biology,2020,9(9):2 378-2 389.
[32] ZHANG C L,LI Y J,MA J,et al.High production of 4-hydroxyisoleucine in Corynebacterium glutamicum by multistep metabolic engineering[J].Metabolic Engineering,2018,49:287-298.
[33] OGAWA J,KODERA T,SMIRNOV S V,et al.A novel L-isoleucine metabolism in Bacillus thuringiensis generating(2S,3R,4S)-4-hydroxyisoleucine,a potential insulinotropic and anti-obesity amino acid[J].Applied Microbiology and Biotechnology,2011,89(6):1 929-1 938.
[34] 朱福周,董解荣,陈宁,等.生物法合成α-酮戊二酸及其衍生物的研究进展[J].中国酿造,2020,39(3):1-6.
ZHU F Z,DONG J R,CHEN N,et al.Research progress in biosynthesis of α-ketoglutarate and its derivatives[J].China Brewing,2020,49(3):287-298.
[35] YAMAMOTO K,TSUCHISAKA A,YUKAWA H.Branched-chain amino acids[J].Advances in Biochemical Engineer Biotechnology,2017,159:103-128.
[36] 芦楠,李宇虹,陈宁,等.L-异亮氨酸及其衍生物代谢工程研究进展[J].食品与发酵工业,2021,47(9):307-313.
LU N,LI Y H,CHEN N,et al.Advances on metabolic engineering of L-isoleucine and its derivatives[J].Food and Fermentation Industries,2021,47(9):307-313.
[37] 卢正珂,史锋.过表达mqo对重组谷氨酸棒杆菌L-异亮氨酸和4-羟基异亮氨酸合成的影响[J].食品与发酵工业,2017,43(10):30-35.
LU Z K,SHI F.Effects of mqo overexpression on the synthesis of L-isoleucine and 4-hydroxyisoleucine in recombinant Corynebacterium glutamicum[J].Food and Fermentation Industries,2017,43(10):30-35.
[38] SHI F,ZHANG S P,LI Y F,et al.Enhancement of substrate supply and ido expression to improve 4-hydroxyisoleucine production in recombinant Corynebacterium glutamicum ssp.lactofermentum[J].Applied Microbiology and Biotechnology,2019,103(10):4 113-4 124.
[39] SHI F,FAN Z Y,ZHANG S P,et al.Optimization of ribosomal binding site sequences for gene expression and 4-hydroxyisoleucine biosynthesis in recombinant Corynebacterium glutamicum[J].Enzyme and Microbial Technology,2020,140:109622.
[40] OGAWA J,KODERA T,SMIRNOV K S,et al.A novelL-isoleucine metabolism in Bacillus thuringiensis generating(2S,3R,4S)-4-hydroxyisoleucine,a potential insulinotropic and anti-obesity amino acid[J].Applied Microbiology and Biotechnology,2011,89:1 929-1 938.
[41] KIVERO A D,BOCHAROV E V,DOROSHENKO V G,et al.2D[1H,13C]NMR study of carbon fluxes during glucose utilization by Escherichia coli MG1655[J].Applied Microbiology and Biotechnology,2008,44(2):168-175.
[42] NIEBISCH A,KABUS A,SCHULTZ C,et al.Corynebacterial protein kinase G controls 2-oxoglutarate dehydrogenase activity via the phosphorylation status of the OdhI protein[J].Journal of Biological Chemistry,2006,281(18):12 300-12 307.
[43] LANGE C,MUSTAFI N,FRUNZKE J,et al.Lrp of Corynebacterium glutamicum controls expression of the brnFE operon encoding the export system for L-methionine and branched-chain amino acids[J].Journal of Biotechnology,2012,158(4):231-241.
[44] MORBACH S,JUNGER C,SAHM H,et al.Attenuation control of ilvBNC in Corynebacterium glutamicum:Evidence of leader peptide formation without the presence of a ribosome binding site[J].Journal of Bioscience and Bioengineering,2000,90(5):501-507.