早在三千多年前,我国就有栽培菌菇并作为食用菌的记载。食用菌类一般为高等真菌的子实体,在我国已发现的品种至少有350 种,常见的食用菌类型有蘑菇、草菇、香菇、灵芝、金针菇、黑木耳、松口蘑等。其中部分可作药用,如具有补中、固肾、益脾、补肺、止血作用的灵芝,滋阴、补肾、润肺、强精、补血提神的银耳,对消化道肿瘤有较好疗效、可治疗神经衰弱、消化不良等慢性疾病的猴头菇,止血外敷药的马勃等。国际上多糖被称为“生物反应调节物”(biological reaction modulator,BRM),作为食用菌一种重要的生理活性物质,食用菌多糖具有可提高人体免疫力、治疗肿瘤、哮喘和糖尿病等疾病等药用功效,可作为机体免疫的增强和激活剂,在临床治疗中已有广泛运用[1]。目前学者对食用菌多糖进行的热点研究集中于真菌多糖的提取效率和得率的提高,多糖结构、分子质量和生物活性等。提取工艺作为食用菌多糖研究的首要前处理环节,除了获得高得率的多糖外,往往对获得多糖结构变化产生重要的影响。因此本文对目前研究较常使用的食用菌多糖提取方式、得率和对应多糖结构变化进行概括和综述,为将来多糖构效关系的研究提供相应的理论基础。
1 食用菌多糖现代提取工艺
常用真菌多糖提取方法有热水提取法、酶提取法、超声辅助提取法、碱提取法等,多糖的提取率及结构的差异受提取温度、料液比、提取功率、提取次数等因素的影响。食用真菌多糖的提取方法和步骤与其他植物多糖相似,其工艺流程大致为:食用菌子实体→粉碎→加水浸提→过滤→蒸发浓缩→除蛋白→沉淀→离心→干燥→食用菌多糖。为了提高效率和提取率,科研工作者往往也使用一些其他方法进行辅助水浸提法,如:超声-微波协同法、超声波酶法、微波协同酶法。
1.1 超声-微波协同法
超声-微波协同提取法可克服单一超声波或微波提取处理的缺陷,如单一超声波法提取平均回收率较低,单一微波提取法易受溶剂特性影响、样品量大时温度分布不均等。超声-微波协同提取法与传统的微波和超声波提取相比更安全,并且具有检测样品量大、受溶剂影响小等优点。2种方法协同使用,可利用微波产生的能量和超声波对细胞的破坏能力加速有效成分的溶出,来减少萃取时间以及降低能耗。超声-微波协同法提取灵芝多糖比热水法减少了3/4的提取时间、效率可提高26.27%,提取率是热水提取的2倍,应用于水溶性膳食纤维的提取时,与传统酶法提取相比得率可提高46.88%[2]。
1.2 超声波酶法
超声波酶法是利用超声波将提取原料的细胞壁震碎破坏,扩大可溶性物质透过细胞多孔透析膜的通量,并协助酶更好地降解细胞内物质,如蛋白酶可破坏肽键,水解蛋白质;纤维素酶可以降解细胞中的纤维素,进而提取出更多的多糖并提高多糖提取率。超声波酶法提取粗提取物中的多糖含量比超声法提取多糖高20%以上,如超声波酶法提取灵芝多糖,粗提取物中的多糖含量达到57.62%,是超声波法提取多糖的1.8倍[3]。
1.3 微波协同酶法
微波辐射是高频电磁波穿透萃取介质到达物料细胞后,细胞吸收微波能后温度上升而产生内外压力的过程,压力使植物细胞膨胀破碎进而释放功能性成分。微波结合酶法是利用微波具有的加热高效性和酶对植物细胞组织间质中的胞间结构的破坏,使细胞破碎率进一步升高,同时水分子在微波场下高速转动形成激发态,并释放出能量传递给其他物质分子,促进了溶剂分子热运动加快,缩短萃取时间、降低萃取温度,溶出更多的多糖。因微波结合酶法具有高效性、操作简便、得率高、产物易于纯化等特点,已广泛应用于天然产物的提取,如微波协同酶法相比单一酶法提取的金针菇多糖得率可由17.26%提高至21.76%[4]。
1.4 超高压提取法
超高压提取全称为超高冷等静压提取,是指采用50~1 000 MPa的流体静压力处理目标物质。在超高压提取的升压过程中,溶剂通过渗透作用进入细胞内部,在此过程中细胞的结构在超高压下受到不同程度的破坏。在保压时,细胞内容物与进入细胞内部的溶剂接触并溶于溶剂中;而在泄压后细胞外部的压力减小至零,由于反向高渗透压差作用导致有效成分溶出,达到提取的目的,是一种非热力学提取法。CHEN等[5]运用超高压技术提取虫草多糖,多糖得率在300~400 MPa时迅速增加,在时间不变的情况下,多糖提取率随温度和压力的升高而增加。超高压过程中,细胞膜内外的压差很大,更多的溶剂进入细胞,细胞壁在较高压力下容易破坏和溶解,诱导更多化合物渗透至细胞膜中。高压破坏了蛋白质和糖之间的键,使膳食纤维溶于提取液中,从而增加了葡聚糖含量。另一方面,高静水压结合热水法提取可保护β-糖苷键不被破坏,较大程度地保留了多糖的生物活性。
不同提取方法会影响多糖的结构,如热水提取的灵芝子实体多糖主要以β-(1→3)、(1→4)、(1→6)糖苷键为主链的葡聚糖构成,而碱提法获得的多糖则以β-(1→3)糖苷键连接,具有前者结构的多糖具有较高抗氧化活性,而后者则有较强抗肿瘤活性和免疫调节作用[6]。此外提取方式对多糖中醛酸含量有重要影响,热水和超声提取灵芝多糖的醛酸含量分别约为9.89%和14.41%,后者具有较高的抗氧化活性[7]。目前的研究大多对一种食用真菌的不同提取方法进行对比,缺少系统性的概括,本文将不同提取方法和不同品种食用真菌间的多糖得率和结构进行归纳总结,便于筛选各食用真菌多糖的较优提取方法和结构特征,为食用真菌多糖深加工提供指导。
2 不同提取方法对多糖得率和结构的影响
2.1 灵芝多糖
灵芝多糖主要由葡萄糖、甘露糖、半乳糖、岩藻糖、木糖和阿拉伯糖组成,其具有分子质量和分支程度较高的三级结构以及不同的组分,包括β-葡聚糖、杂β-葡聚糖、杂聚糖或α-甘露聚糖、β-葡聚糖组成的复合物。同型葡聚糖是由α-或β-连接的葡萄糖单元组成的主链为直链或支链聚合物,如(1→3)、(1→6)-β-葡聚糖和α-(1→3)-葡聚糖,可以以非支链β-(1→3)-连接主链或具有β-(1→6)分支的β-(1→3)连接主链;杂葡聚糖侧链包含葡糖醛酸、木糖、半乳糖、甘露糖、阿拉伯糖或核糖作为主要成分或以不同形式组合。其他聚糖通常在主链中含有除葡萄糖以外的单元,根据主链的单糖组成可分为半乳聚糖、岩藻聚糖、木聚糖和甘露聚糖。杂聚糖侧链包含阿拉伯糖、甘露糖、岩藻糖、半乳糖、木糖、葡萄糖和葡萄糖醛酸,它们以不同组合的形式存在。热水提取的灵芝子实体多糖结构为以β-糖苷键连接的杂聚糖,其中菌丝体多糖则是以α-D-(1→6)葡萄糖、α-D-葡萄糖、α-D-甘露糖为主链的杂多糖,单糖组成为葡萄糖、鼠李糖、半乳糖、甘露糖、阿拉伯糖。子实体则由葡萄糖、鼠李糖、半乳糖、甘露糖、木糖、果糖构成。不同的提取方法对灵芝子实体的多糖组成也有差异,超声提取下的灵芝子实体多糖并未发现木糖和果糖,但存在岩藻糖。如表1所示,灵芝多糖的超声法提取得率比热水法更低,可能由于该多糖受提取温度影响大于超声波功率[8],同时超声提取时灵芝多糖更易被破坏降解,导致分子质量降低[7]。
表1 不同提取方法对灵芝多糖得率以及结构的影响
Table 1 Effects of different extraction methods on the yield and structure of Ganoderma lucidum polysaccharides
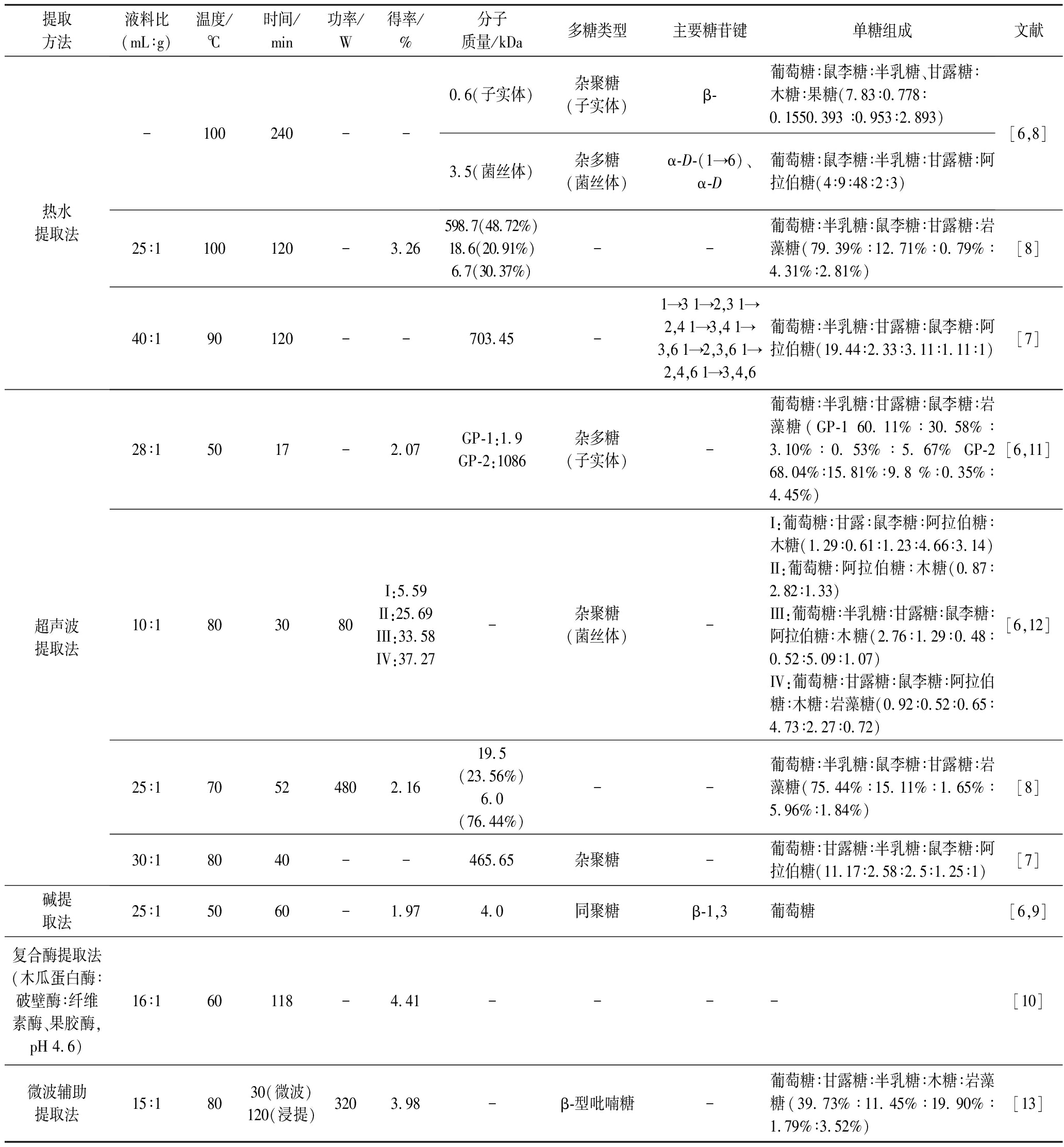
提取方法液料比(mL∶g)温度/℃时间/min功率/W得率/%分子质量/kDa多糖类型主要糖苷键单糖组成文献热水提取法-100240--0.6(子实体)杂聚糖(子实体)β-葡萄糖∶鼠李糖∶半乳糖、甘露糖∶木糖∶果糖(7.83∶0.778∶0.1550.393 ∶0.953∶2.893)3.5(菌丝体)杂多糖(菌丝体)α-D-(1→6)、α-D葡萄糖∶鼠李糖∶半乳糖∶甘露糖∶阿拉伯糖(4∶9∶48∶2∶3)[6,8]25∶1100120-3.26598.7(48.72%)18.6(20.91%)6.7(30.37%)--葡萄糖∶半乳糖∶鼠李糖∶甘露糖∶岩藻糖(79.39%∶12.71%∶0.79%∶4.31%∶2.81%)[8]40∶190120--703.45-1→3 1→2,3 1→2,4 1→3,4 1→3,6 1→2,3,6 1→2,4,6 1→3,4,6葡萄糖∶半乳糖∶甘露糖∶鼠李糖∶阿拉伯糖(19.44∶2.33∶3.11∶1.11∶1)[7]超声波提取法28∶15017-2.07GP-1:1.9 GP-2:1086杂多糖(子实体)-葡萄糖∶半乳糖∶甘露糖∶鼠李糖∶岩藻糖(GP-1 60.11%∶30.58%∶3.10%∶0.53%∶5.67% GP-2 68.04%∶15.81%∶9.8 %∶0.35%∶4.45%)[6,11]10∶1803080I:5.59 II:25.69 III:33.58 IV:37.27-杂聚糖(菌丝体)-I:葡萄糖∶甘露∶鼠李糖∶阿拉伯糖∶木糖(1.29∶0.61∶1.23∶4.66∶3.14) II:葡萄糖∶阿拉伯糖∶木糖(0.87∶2.82∶1.33)III:葡萄糖∶半乳糖∶甘露糖∶鼠李糖∶阿拉伯糖∶木糖(2.76∶1.29∶0.48∶0.52∶5.09∶1.07) IV:葡萄糖∶甘露糖∶鼠李糖∶阿拉伯糖∶木糖∶岩藻糖(0.92∶0.52∶0.65∶4.73∶2.27∶0.72)[6,12]25∶170524802.1619.5(23.56%)6.0(76.44%)--葡萄糖∶半乳糖∶鼠李糖∶甘露糖∶岩藻糖(75.44%∶15.11%∶1.65%∶5.96%∶1.84%)[8]30∶18040--465.65杂聚糖-葡萄糖∶甘露糖∶半乳糖∶鼠李糖∶阿拉伯糖(11.17∶2.58∶2.5∶1.25∶1)[7]碱提取法25∶15060-1.974.0同聚糖β-1,3葡萄糖[6,9]复合酶提取法(木瓜蛋白酶∶破壁酶∶纤维素酶、果胶酶,pH 4.6)16∶160118-4.41----[10]微波辅助提取法15∶18030(微波)120(浸提)3203.98-β-型吡喃糖-葡萄糖∶甘露糖∶半乳糖∶木糖∶岩藻糖(39.73%∶11.45%∶19.90%∶1.79%∶3.52%)[13]
微波功率和提取时间对灵芝多糖得率影响较大,一般微波功率越大,提取时间越短产率越高,但热稳定性化合物可能受高功率微波的影响发生分解而降低了萃取效率。酶法提取灵芝多糖效果相对较好,不同种类的酶复配及用量、酶解条件等对得率有很大影响。木瓜蛋白酶、破壁酶、纤维素酶和果胶酶都对灵芝粗多糖的提取效果较好,这可能是由于这些酶促进了细胞壁中果胶、纤维素等物质的溶解,并导致多糖的溶出[9-10]。
2.2 虫草多糖
虫草是一种稀有食品,目前已分离出4种天然虫草多糖,第1种天然虫草多糖为葡聚糖,主链重复的骨架大多数是以α-(1→4)键连接的葡萄糖,分支点主要位于C6位,此外还含有(1→3)糖苷键连接的半乳糖和(1→2)键连接的甘露糖残基,以及少量(1→6)和(1→4,6)连接的甘露糖残基,端基为葡萄糖;第2种多糖主要为α-(1→2)-连接的甘露糖,分支点位于甘露糖残基,支链部分由(1→3),(1→5),(1→4),(1→6)-半乳糖残基组成,非还原端为半乳糖和甘露糖;第3、4种都通过碱法提取的,第3种为甘露聚糖,主链部分是以α-(1→6)-甘露糖残基线性连接,在O-2和O-4位有分支,其中O-2与α-(1→2)-甘露糖残基或半乳呋喃糖链相连,O-4与半乳呋喃糖链相连,分支的半乳糖链由β-(1→5)-半乳糖和β-(1→6)-半乳糖交替连接或以β-(1→6)-半乳糖残基连接至甘露糖残基的O-2和O-4位,端基为半乳糖;第4种是一种β-(1→3)-葡聚糖,在葡萄糖的C-6位置分支,端基为葡萄糖。在天然虫草子实体中提取得到的3种多糖主链均为α-1,4-葡萄糖,单糖组成以葡萄糖为主,并含有少量半乳糖和甘露糖。而菌丝体多糖的结构较复杂,主要以1,4-葡萄糖和1,4-半乳糖为主链,由葡萄糖、半乳糖和甘露糖组成,以及少量的阿拉伯糖和半乳糖酸。
使用热水法提取虫草多糖过程中若热水温度>70 ℃、时间>40 min会造成多糖水解并降低得率。与热水提取法相比,微波与超声法的多糖得率较高,但应注意控制浸提时间和超声功率[14]。超声法利用空化作用使细胞破裂,但超声波空穴作用会产生较强的剪切力,而当超声功率>105 W、超声时间>40 min时会严重破坏虫草多糖的结构,并使其他杂质溶出而导致多糖得率下降[15];而微波辐射能直接穿透真菌细胞介质,由于极性物质在微波辐射过程中的强吸收作用,使多糖分子偶极矩发生变化并产生分子振动,从而加热物料使得细胞内部的水分气化,产生的压力能使真菌细胞壁破损,从而释放真菌细胞中的多糖[16]。使用酶提取法提取虫草多糖是利用酶使组织细胞壁以及壁上的纤维素等物质酶解提高得率,酸性蛋白酶效果优于碱性蛋白酶,这可能由于在酸性条件下对虫草细胞破坏更大所导致[17]。
冷热水、微波、超声、酶解提取虫草(菌丝体)多糖后对多糖的糖苷键和糖环的类别没有显著影响,其中微波和热水提取法的多糖得率较高,但提取率为酶解和微波法较高,冷热水的提取率较低;如表2所示,5种提取方法提取的虫草多糖分子质量分布于4.2~2 940 kDa,分子质量分布主要集中于极高分子质量的多糖中(2 414~2 940 kDa),分子质量大小为:微波>热水>超声>酶解>冷水,辅助提取后半乳糖和甘露糖的占比也随之升高,酶法提取最高;黏度大小为:酶解>微波>热水>超声>冷水,以上结果表明通过加热、微波等辅助手段的提取方式可能更容易破坏虫草组织细胞结构,促进高分子质量多糖的溶出,进而影响多糖组分分布;其中微波、热水和酶解处理可能会使虫草多糖的多螺旋结构向单螺旋或片状转变,而超声使其向介于螺旋形和片状之间的结构转变,总体而言对多糖结构影响较小[18]。
表2 不同提取方法对虫草多糖得率以及结构的影响
Table2 Effects of different extraction methods on yield and structure of Cordyceps sinensis polysaccharides
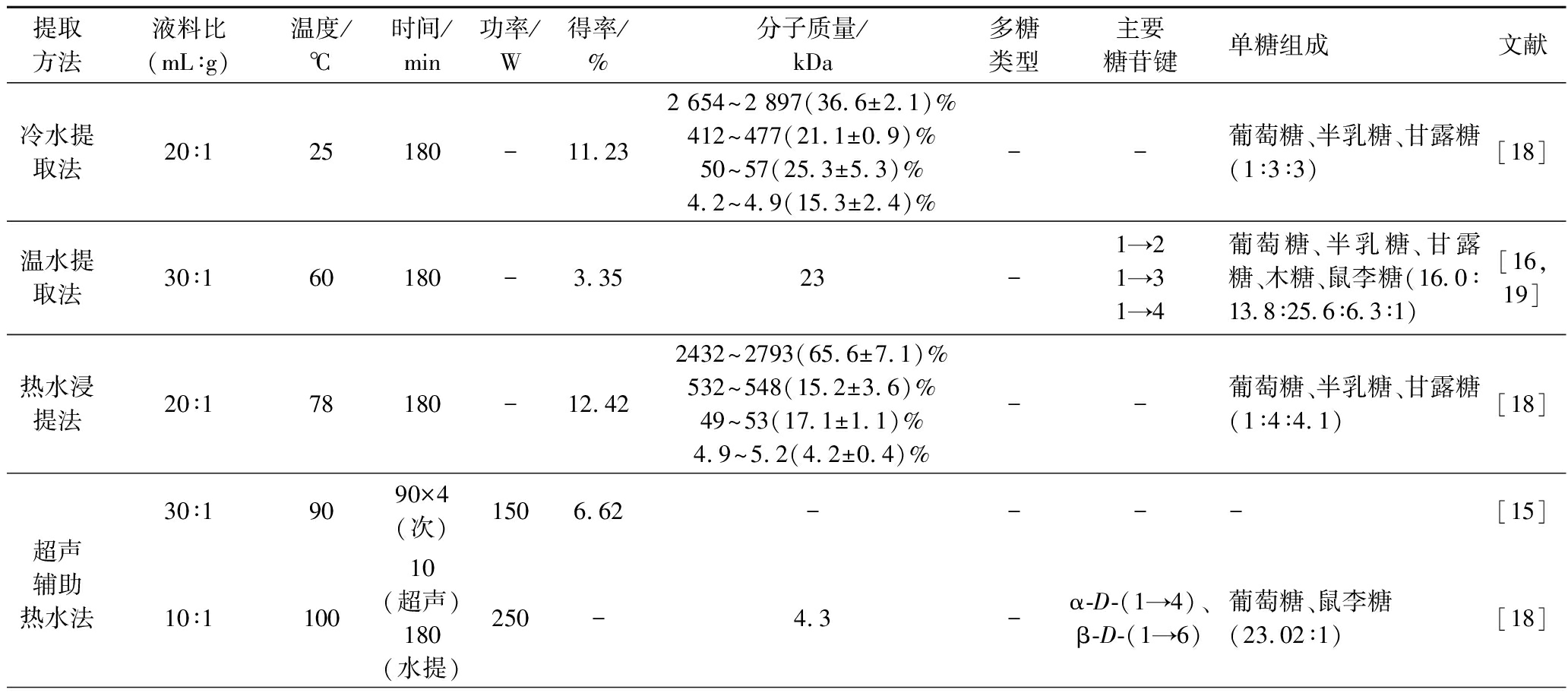
提取方法液料比(mL∶g)温度/℃时间/min功率/W得率/%分子质量/kDa多糖类型主要糖苷键单糖组成文献冷水提取法20∶125180-11.232 654~2 897(36.6±2.1)%412~477(21.1±0.9)%50~57(25.3±5.3)%4.2~4.9(15.3±2.4)%--葡萄糖、半乳糖、甘露糖(1∶3∶3)[18]温水提取法30∶160180-3.3523-1→21→31→4葡萄糖、半乳糖、甘露糖、木糖、鼠李糖(16.0∶13.8∶25.6∶6.3∶1)[16,19]热水浸提法20∶178180-12.422432~2793(65.6±7.1)%532~548(15.2±3.6)%49~53(17.1±1.1)%4.9~5.2(4.2±0.4)%--葡萄糖、半乳糖、甘露糖(1∶4∶4.1)[18]30∶19090×4(次)1506.62----[15]超声辅助热水法10∶110010(超声)180(水提)250-4.3-α-D-(1→4)、β-D-(1→6)葡萄糖、鼠李糖(23.02∶1)[18]
续表2
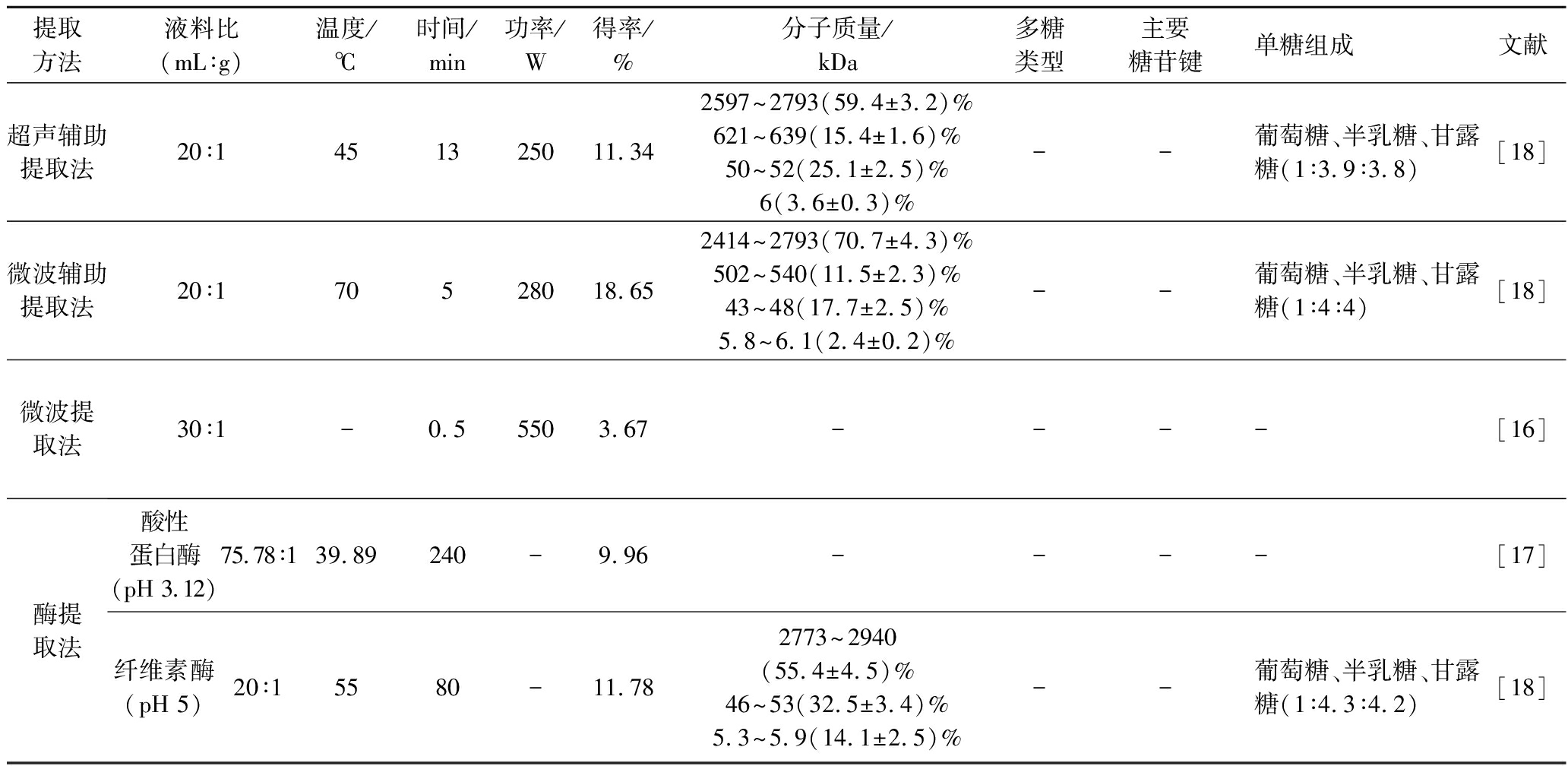
提取方法液料比(mL∶g)温度/℃时间/min功率/W得率/%分子质量/kDa多糖类型主要糖苷键单糖组成文献超声辅助提取法20∶1451325011.342597~2793(59.4±3.2)%621~639(15.4±1.6)%50~52(25.1±2.5)%6(3.6±0.3)%--葡萄糖、半乳糖、甘露糖(1∶3.9∶3.8)[18]微波辅助提取法20∶170528018.652414~2793(70.7±4.3)%502~540(11.5±2.3)%43~48(17.7±2.5)%5.8~6.1(2.4±0.2)%--葡萄糖、半乳糖、甘露糖(1∶4∶4)[18]微波提取法30∶1-0.55503.67----[16]酶提取法酸性蛋白酶(pH 3.12)75.78∶139.89240-9.96----[17]纤维素酶(pH 5)20∶15580-11.782773~2940(55.4±4.5)%46~53(32.5±3.4)%5.3~5.9(14.1±2.5)%--葡萄糖、半乳糖、甘露糖(1∶4.3∶4.2)[18]
2.3 银耳多糖
多糖的主要结构由单糖残基的位置和序列、糖苷键的位置和手性决定,这些因素导致多糖结构具有多样性。银耳多糖的主要结构以α-D-甘露糖为主链,其中甘露糖C-2连接有β-D-木糖、β-D-葡萄糖醛酸和β-D-木二糖,该链具有左旋三螺旋对称结构,此外连接有6个甘露糖残基组成的支链;还有研究发现其多糖链是由(1→3)连接的葡聚糖和(1→2)或(1→4)为主要糖苷键连接的甘露糖。银耳子实体和菌丝体多糖在单糖组成上存在细微差别,银耳子实体是以甘露糖为主链且有多个分支的酸性杂多糖,主要由甘露糖、葡萄糖醛酸、木糖和岩藻糖组成;菌丝体多糖则是由α-(1→3)-D-甘露糖为主链,C2位上连有β-D-葡萄糖醛酸和β-(1→2)-D-木糖残基,单糖组成为甘露糖、葡萄糖醛酸、木糖、半乳糖的吡喃型多糖。
超声提取的银耳多糖不含还原糖、淀粉型多糖和蛋白质,部分组分含有糖醛酸[20];多糖的得率受提取次数影响较大,超声处理时间过长很容易使银耳多糖结构破坏,提取次数超过2次之后得率即开始下降[21],这可能是由于超声的空化作用导致多糖分子质量降低。与热水浸提法相比,超声提取后银耳多糖的单糖组成缺少岩藻糖且葡萄糖醛酸转变为中性葡萄糖,可能是由于超声空化导致多糖糖苷键断裂,进而产生小分子质量多糖所致[22]。
高温高压法提取多糖时,100 ℃的高温有利于多糖的浸出,在2 h后趋于平缓,如表3所示,高温高压辅助提取银耳多糖的效果优于超声波处理效果[21]。碱和酶法也可用于银耳多糖的提取,多糖得率与碱浓度呈正相关性,碱处理有助于多糖的溶出,加入少量硼氢化钾可防止碱对多糖结构的降解;多糖得率:复合酶法>碱提法>水提法,且复合酶提取得率高于单一酶法提取[23];虽然酶法提取较为温和,但提取过程由于需要考虑调整pH,可能会出现多糖提取液黏度增大、难过滤、蛋白质杂质较多等问题[24],但银耳多糖提取液在pH 4.5~10.5具有良好的酸碱稳定性。
表3 不同提取方法对银耳多糖得率以及结构的影响
Table3 Effects of different extraction methods on the yield and structure of Tremella fuciformis polysaccharides
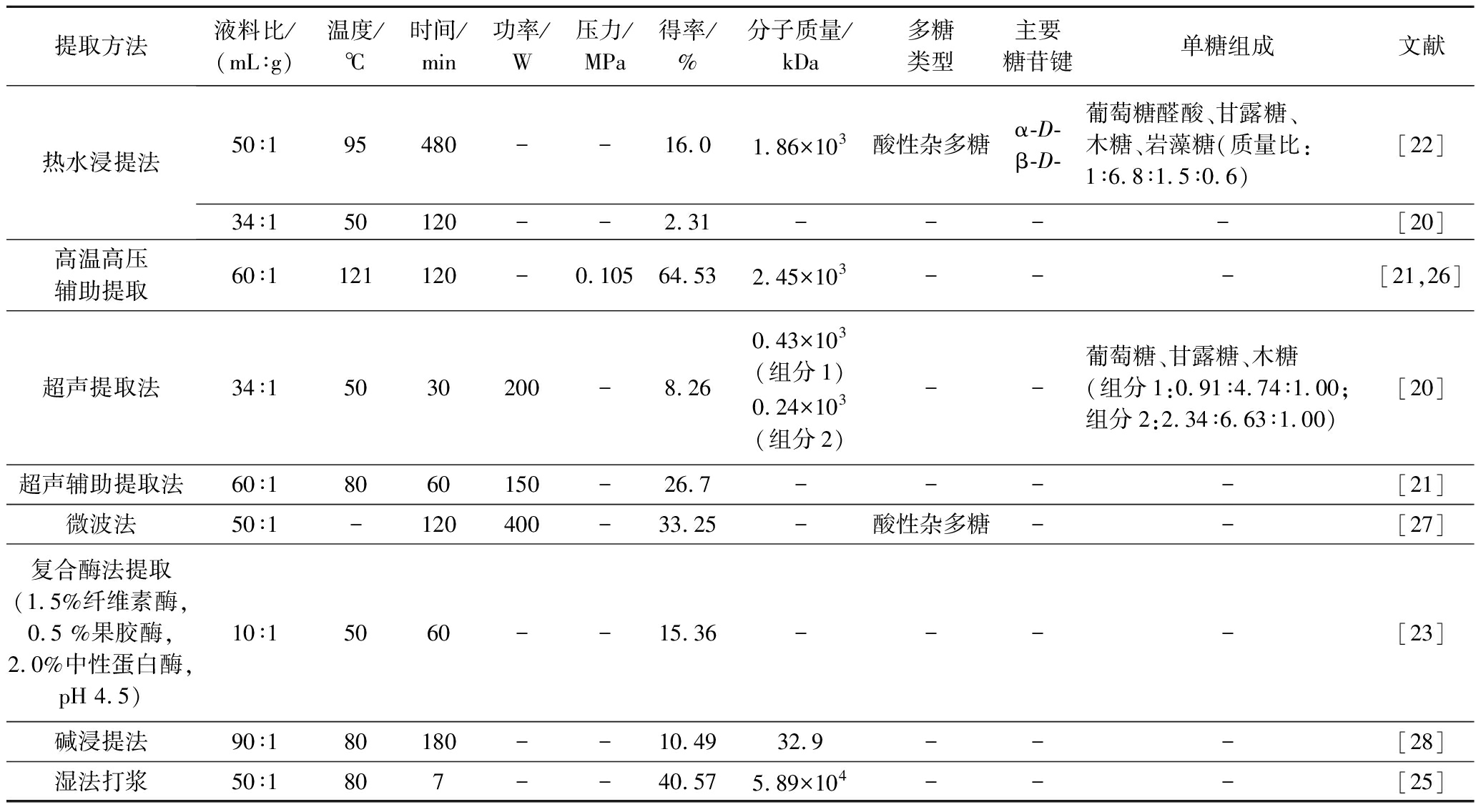
提取方法液料比/(mL∶g)温度/℃时间/min功率/W压力/MPa得率/%分子质量/kDa多糖类型主要糖苷键单糖组成文献热水浸提法50∶195480--16.01.86×103酸性杂多糖α-D-β-D-葡萄糖醛酸、甘露糖、木糖、岩藻糖(质量比:1∶6.8∶1.5∶0.6)[22]34∶150120--2.31--- -[20]高温高压辅助提取60∶1121120-0.10564.532.45×103---[21,26]超声提取法34∶15030200-8.260.43×103(组分1)0.24×103(组分2)--葡萄糖、甘露糖、木糖(组分1:0.91∶4.74∶1.00;组分2:2.34∶6.63∶1.00)[20]超声辅助提取法60∶18060150-26.7----[21]微波法50∶1-120400-33.25-酸性杂多糖--[27]复合酶法提取(1.5%纤维素酶,0.5 %果胶酶,2.0%中性蛋白酶,pH 4.5)10∶15060--15.36----[23]碱浸提法90∶180180--10.4932.9---[28]湿法打浆50∶1807--40.575.89×104---[25]
湿法打浆是部分真菌多糖提取方法的前处理步骤,但目前只在银耳提取中应用较多,暂无发现应用于其他真菌多糖的提取。当银耳吸水膨胀后,组织结构和质地变得松软,打浆机更易将组织细胞打碎从而溶出更多的多糖,湿法打浆能较好地保护银耳多糖结构。但由于银耳吸水后的细胞组织膨大,加上其胶质和糖类的溶解作用,导致打浆后的银耳提取液变黏稠而过滤困难。为提高过滤的效率,可采用提高料液比或离心后再用200目滤网过滤的方式进行处理,可减少溶液过滤而堵住滤孔。陈丽娟等[25]发现湿法打浆的得率是传统热水浸提法的2.2 倍,时间仅为其1/60,主要影响因素大小为:料液比>打浆时间>加水的温度,滤渣中多糖含量仅为(1.13±0.21)%,效能显著提升,2种方法提取的银耳多糖分子质量十分相近。
2.4 杏鲍菇多糖
杏鲍菇多糖为一种吡喃型多聚糖,ZHENG等[29]从中分离了2种多糖,其中一种由(1→4)-D-葡萄糖、(1→3,4)-D-葡萄糖、(1→6)-D-半乳糖、(1→3)-D-甘露糖和端基葡萄糖组成,另一种由(1→4)-D-葡萄糖、(1→3,4)-D葡萄糖、(1→6)-D-半乳糖、(1→3,6)-D-甘露糖、(1→3)-D-甘露糖、(1→3)-D-葡萄糖和端基葡萄糖组成。杏鲍菇子实体和菌丝中多糖组成成分相同,但是摩尔比例却有显著差异,菌丝中葡萄糖摩尔比较高[29]。
热水提取的杏鲍菇多糖没有蛋白质和核酸,微波和热水法提取杏鲍菇多糖得率相差不大,但微波提取时微波可穿透杏鲍菇细胞直接作用于内部,加快杏鲍菇多糖从原料内部向外部的界面扩散和扩散速度,增大多糖溶解度和介质驱动力,提取速度提高数倍[30]。
石翛然[31]利用超声法提取杏鲍菇多糖,发现超声功率在200 W和温度>60 ℃后得率变化不显著,可能是由于多糖分子运动速率减小和分解作用造成。
在温和的提取条件下为了避免多糖被分解,可以使用酶来辅助提取多糖,凡军民等[32]通过各单因素显著性分析对纤维素酶提取杏鲍菇多糖的最佳工艺条件进行优化,试验表明随着加水量的增大,多糖提取率也迅速增加,料液比在1∶30(g∶mL,下同)时基本达到最大。取1∶30为最优料液比加酶,当酶添加量为0.35%时多糖提取率达到最高,之后加酶量增加提取率保持不变,这可能是因为当酶添加量低于最佳酶量时,杏鲍菇酶解不完全导致多糖溶出较少,当酶添加量超过最佳时,酶与底物接触面积过剩反而降低了反应速率。由此可得出料液比1∶30、酶添加量0.35%、酶解温度50 ℃、酶解时间2 h、酶提一次为最优提取条件,在该条件下多糖提取率可达到18.57%,各提取方法如表4所示。
表4 不同提取方法对杏鲍菇多糖得率以及结构的影响
Table4 Effect of different extraction methods on yield and structure of Pleurotus eryngii polysaccharides
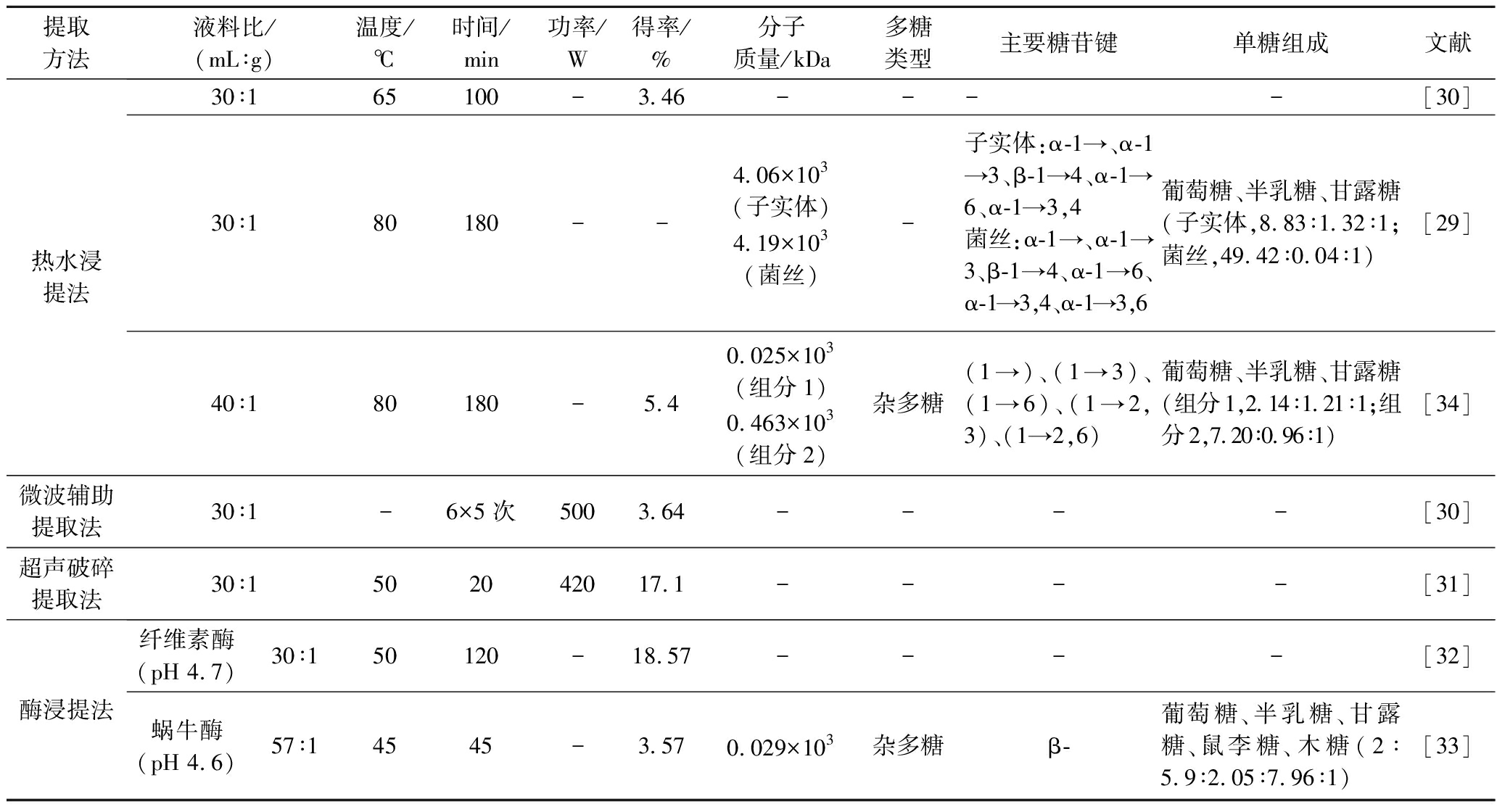
提取方法液料比/(mL∶g)温度/℃时间/min功率/W得率/%分子质量/kDa多糖类型主要糖苷键单糖组成文献热水浸提法30∶165100-3.46--- -[30]30∶180180--4.06×103(子实体)4.19×103(菌丝)-子实体:α-1→、α-1→3、β-1→4、α-1→6、α-1→3,4菌丝:α-1→、α-1→3、β-1→4、α-1→6、α-1→3,4、α-1→3,6葡萄糖、半乳糖、甘露糖(子实体,8.83∶1.32∶1;菌丝,49.42∶0.04∶1)[29]40∶180180-5.40.025×103(组分1)0.463×103(组分2)杂多糖(1→)、(1→3)、(1→6)、(1→2,3)、(1→2,6)葡萄糖、半乳糖、甘露糖(组分1,2.14∶1.21∶1;组分2,7.20∶0.96∶1)[34]微波辅助提取法30∶1-6×5次5003.64----[30]超声破碎提取法30∶1502042017.1----[31]酶浸提法纤维素酶(pH 4.7)30∶150120-18.57--- -[32]蜗牛酶(pH 4.6)57∶14545-3.570.029×103杂多糖β-葡萄糖、半乳糖、甘露糖、鼠李糖、木糖(2∶5.9∶2.05∶7.96∶1)[33]
多糖的分子质量和分子结构是影响多糖功能性的主要因素,蜗牛酶是从蜗牛的嗦囊和消化道中制备的,含有纤维素酶、果胶酶、淀粉酶、蛋白酶等共20多种的复合酶,JIAO等[33]发现使用蜗牛酶法提取的杏鲍菇多糖为非均一性多糖,平均分子质量为29.3 kDa;与热水提取的多糖分子质量相比有较大提升。REN等[34]从杏鲍菇子实体中得到的2种组分的多糖,分子质量分别为25.4 kDa和463 kDa,且较高分子质量多糖抑制癌细胞生长效果较好,多糖结构差异较大的原因可能是由于不同栽培品种、培养条件和提取程序的差异所致。
2.5 金针菇多糖
金针菇子实体多糖是由D-半乳糖、D-甘露糖、L-岩藻糖和D-葡萄糖组成的均一杂多糖,多糖主链由(1→2,4)-α-D-吡喃半乳糖、(1→6)-α-D-吡喃葡萄糖和(1→3)-β-D-吡喃葡萄糖构成,其中(1→4)-α-D-吡喃半乳糖上连接着(1→3)-α-D-吡喃甘露糖分支,以及连接在(1→3)-β-D-葡萄糖上的(1→6)-α-L-吡喃果糖分支。金针菇菌丝体中已分离提纯出2种多糖,单糖组成和连接方式均不同,一种由葡萄糖、半乳糖、甘露糖组成,并以α-D-(1→4)糖苷键连接主链,且带有α-D-(1→6)分支;另一种结构较复杂,多糖由葡萄糖、半乳糖、甘露糖、岩藻糖组成,此外在葡萄糖端基碳具有α、β两种构型。
热水、超声、微波和酶法提取后的金针菇多糖含有一定的蛋白质,但不含淀粉、还原糖、糖醛酸或多酚;多糖得率和蛋白含量基本呈正相关关系(微波>超声波>热水>酶解)[35]。超声提取法提取金针菇多糖后,空化气泡在粉末组织接触点产生很强的挤压力,使表面更易渗透破裂,并促进扩散过程,所产生的多糖得率、蛋白质和糖醛酸含量较高,作用产生的瞬时高压或剪切力可破坏金针菇多糖链的三螺旋结构并降解为分子质量多糖[36]。
微波辅助酶法提取,利用微波深入渗透细胞,快速升高提取温度;黄琼等[4]使用微波辅助纤维素酶、果胶酶及2种复合酶混合物提取金针菇多糖,发现果胶酶效果更好,原因可能是果胶酶能破坏金针菇组织间质中的胞间连结构促进多糖释放。游丽君等[37]使用纤维素酶、果胶酶、内切木聚糖酶、木瓜蛋白酶、胰酶分别作用于金针菇多糖,发现其中果胶酶和纤维素酶(特别是果胶酶)相比另外3种酶具有较好地特异性保护多糖主要组分片段,与原多糖具有相似的单糖组成,也说明果胶酶很可能是单一作用于细胞壁而非多糖的机制提高多糖得率。不同提取方法的金针菇多糖得率以及结构变化如表5所示。
表5 不同提取方法对金针菇多糖得率以及结构的影响
Table5 Effects of different extraction methods on the yield and structure of Flammulina velutipes polysaccharides
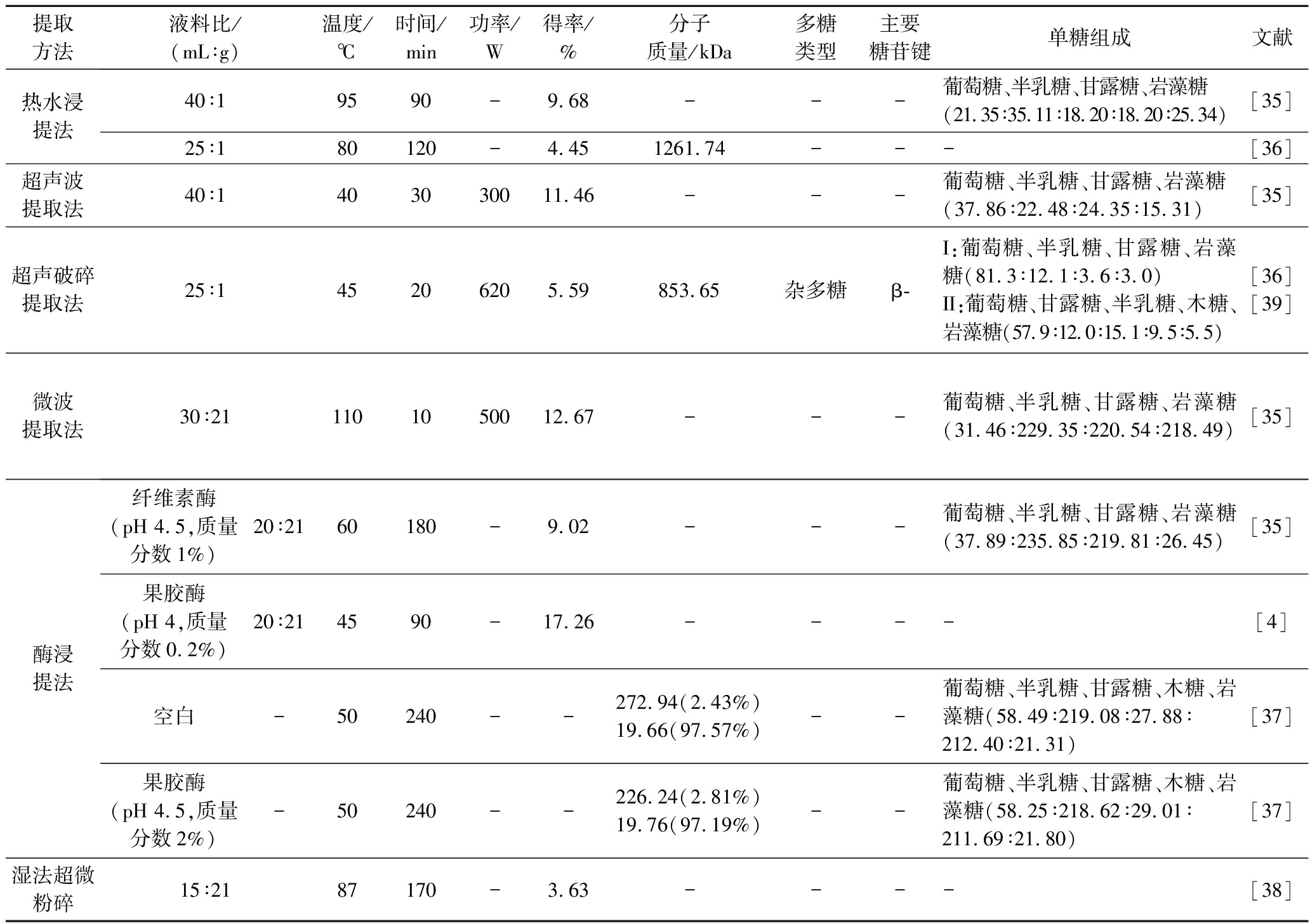
提取方法液料比/(mL∶g)温度/℃时间/min功率/W得率/%分子质量/kDa多糖类型主要糖苷键单糖组成文献热水浸提法40∶19590-9.68---葡萄糖、半乳糖、甘露糖、岩藻糖(21.35∶35.11∶18.20∶18.20∶25.34)[35]25∶180120-4.451261.74---[36]超声波提取法40∶1403030011.46---葡萄糖、半乳糖、甘露糖、岩藻糖(37.86∶22.48∶24.35∶15.31)[35]超声破碎提取法25∶145206205.59853.65杂多糖β-I:葡萄糖、半乳糖、甘露糖、岩藻糖(81.3∶12.1∶3.6∶3.0)II:葡萄糖、甘露糖、半乳糖、木糖、岩藻糖(57.9∶12.0∶15.1∶9.5∶5.5)[36][39]微波提取法30∶211101050012.67---葡萄糖、半乳糖、甘露糖、岩藻糖(31.46∶229.35∶220.54∶218.49)[35]酶浸提法纤维素酶(pH 4.5,质量分数1%)20∶2160180-9.02---葡萄糖、半乳糖、甘露糖、岩藻糖(37.89∶235.85∶219.81∶26.45)[35]果胶酶(pH 4,质量分数0.2%)20∶214590-17.26----[4]空白-50240--272.94(2.43%)19.66(97.57%)--葡萄糖、半乳糖、甘露糖、木糖、岩藻糖(58.49∶219.08∶27.88∶212.40∶21.31)[37]果胶酶(pH 4.5,质量分数2%)-50240--226.24(2.81%)19.76(97.19%)--葡萄糖、半乳糖、甘露糖、木糖、岩藻糖(58.25∶218.62∶29.01∶211.69∶21.80)[37]湿法超微粉碎15∶2187170-3.63----[38]
湿法超微粉碎技术首先使用胶体磨对金针菇进行胶磨,随后85 ℃热水提取90 min,其多糖得率较热水提取工艺提高75 %,但在此基础上再辅助超声波或微波工艺则得率提高并不显著;磨齿间隙越小越有利于细胞壁破壁,但植物细胞粒子太小会导致颗粒表面积吸附一部分金针菇多糖,磨齿间隙设置为42 μm时提取效果较优[38]。
2.6 香菇多糖
具有三股螺旋构象的香菇多糖重复单元不同于同样具有三螺旋构象真菌-裂褶菌(Schizophyllum commune Fr)所产的胞外多糖。ZHANG等[40]发现香菇多糖是一种以β-(1→3)-D-葡聚糖为多糖,且每5个线性(1→3)-β-吡喃葡萄糖苷键中具有2个(1→6)-β-吡喃葡萄糖糖的分支;而裂褶菌多糖也是以β-(1→3)-D-葡聚糖为主链,但每3个β-(1→3)-D-吡喃葡萄糖苷具有一个β-(1→6)-D-吡喃葡萄糖苷的分支。香菇子实体和菌丝体所提取多糖的单糖组成成分差别不大,主要有葡萄糖、甘露糖、半乳糖、阿拉伯糖、木糖、鼠李糖。不同的品种存在细微差别,部分香菇子实体分离得到的多糖中没有发现鼠李糖成分。
酸碱溶液相比热水提取可显著提高香菇多糖的得率,其中HCl浓度在0~0.4 mol/L,NaOH在0~0.8 mol/L时浓度与提取率呈正相关,这可能由于酸碱可溶解大量单糖和其他物质所致[41]。与超声复合酶法相比,单纯超声提取的多糖得率较低,这可能由于在酶作用下其首先破坏细胞壁和组织,导致固液相的接触表面积更大,进而使溶剂更好地接触细胞内活性成分。ZHAO等[42]在采用单一超声提取香菇多糖的过程中发现,超声功率对香菇多糖得率的影响最大,其次为提取时间和温度。超声复合酶法提取香菇多糖时先使用超声处理将细胞震碎,随后酶作用位点随之暴露,有利于加速酶和底物的反应;同时利用超声的空穴化作用将细胞进一步震碎也能提高多糖得率,但超声功率过大,其产生的热效应可能会影响酶的活性和得率;提取温度对得率影响不显著,在室温(25 ℃)下就可以进行提取,得到的香菇多糖可保持良好的DPPH清除活性[43]。
LI等[44]利用高压蒸煮法提取香菇多糖,与热水法相比,高压处理可以通过破坏氢键和疏水力来提高得率,但不会降解包括共价键在内的主链,增强溶剂向原料的传质,并改善可溶性成分,此处理得到的多糖分子质量也较低,这可能由于分子团聚体在高压环境下溶解所致,但对多糖组成成分并无明显差异。
动态高压微射流技术是一种新兴的动态高压剪切技术,与高静水技术压不同,其可产生高速冲击、高频振动、瞬时压降、强剪切、空化和高达200 MPa的超高压的合力;在提取香菇多糖时主要通过3个因素影响得率:(1)可能通过结合剪切、冲击力和高频振动来提高传质速率和细胞破碎程度;(2)细胞内外的压力差增大导致溶剂通量增大并加快效率;(3)空化引起的植物细胞解体。如表6所示,与热水提取法相比,此法提取后的多糖得率提高,但分子质量由965.361 kDa降低为913.329 kDa,这可能是由于高压机械力和空化作用导致的多糖降解,多糖表面变得更加松散[45]。
表6 不同提取方法对香菇多糖得率以及结构的影响
Table 6 Effects of different extraction methods on yield and structure of Lentinus edodes polysaccharides
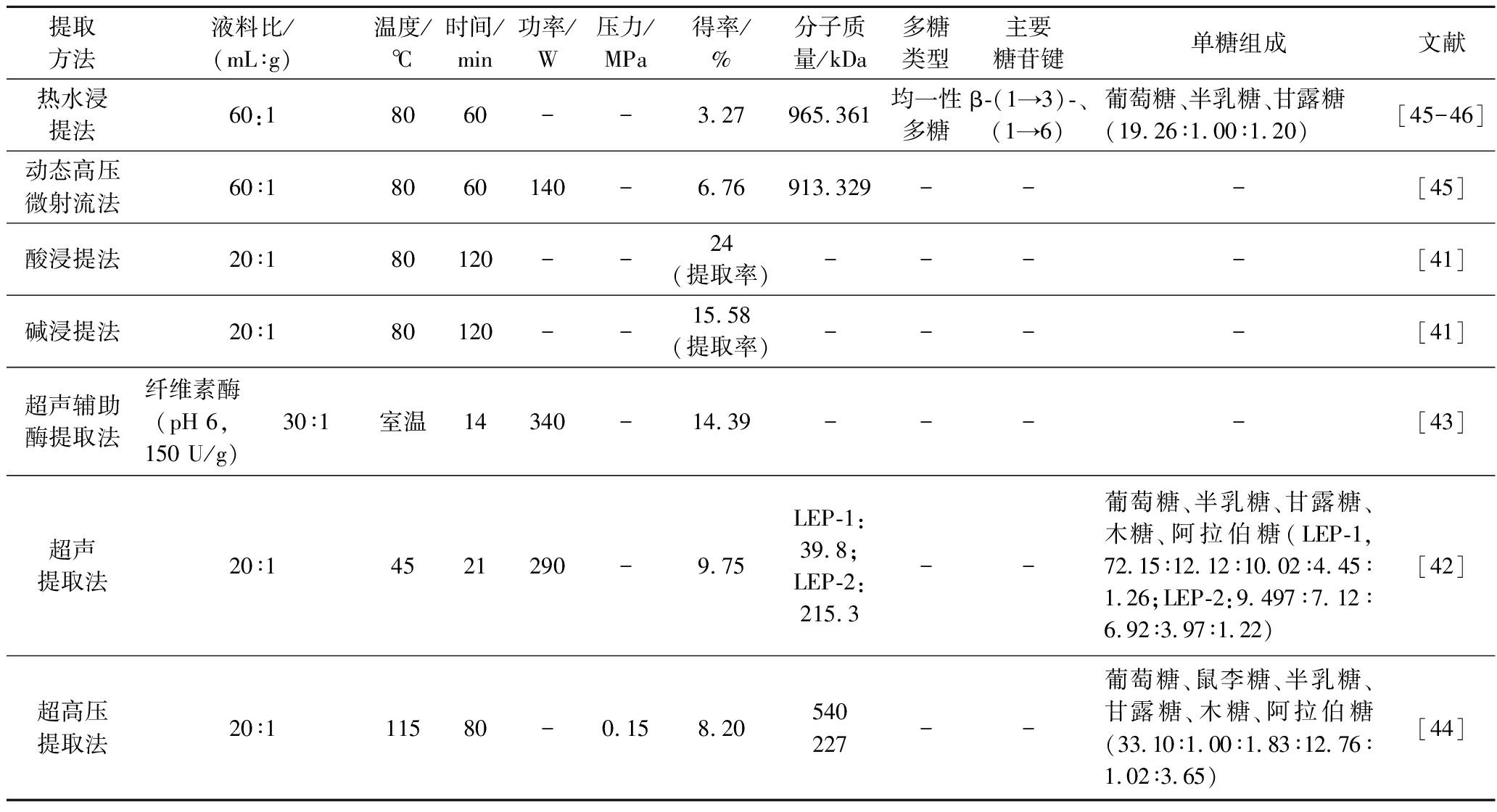
提取方法液料比/(mL∶g)温度/℃时间/min功率/W压力/MPa得率/%分子质量/kDa多糖类型主要糖苷键单糖组成文献热水浸提法60:18060--3.27965.361均一性多糖β-(1→3)-、(1→6)葡萄糖、半乳糖、甘露糖(19.26∶1.00∶1.20)[45-46]动态高压微射流法60∶18060140-6.76913.329---[45]酸浸提法20∶180120--24(提取率)----[41]碱浸提法20∶180120--15.58(提取率)----[41]超声辅助酶提取法纤维素酶(pH 6,150 U/g)30∶1室温14340-14.39----[43]超声提取法20∶14521290-9.75LEP-1:39.8;LEP-2:215.3--葡萄糖、半乳糖、甘露糖、木糖、阿拉伯糖(LEP-1,72.15∶12.12∶10.02∶4.45∶1.26;LEP-2:9.497∶7.12∶6.92∶3.97∶1.22)[42]超高压提取法20∶111580-0.158.20540227--葡萄糖、鼠李糖、半乳糖、甘露糖、木糖、阿拉伯糖(33.10∶1.00∶1.83∶12.76∶1.02∶3.65)[44]
2.7 猴头菇多糖
不同提取方法对猴头菇多糖得率以及结构的影响如表7所示。WANG等[47]报道了猴头菇子实体中得到的多糖大多数是由2种或多种单糖组成的杂多糖,当前的研究表明,杂多糖中广泛存在(1→6)连接的α-D-吡喃半乳糖基骨架,并且分支通常由O-2位置的α-L-呋喃葡糖组成。并且还发现具有(1→6)-连接的β-D-吡喃葡萄糖基残基作为主链并且具有(1→3)-连接的β-D-吡喃葡萄糖基支链的结构,其主要由岩藻糖、葡萄糖和半乳糖组成,某些品种含有少量的甘露糖。菌丝体的单糖组成成分和子实体有明显差异,主要由阿拉伯糖、木糖、葡萄糖和半乳糖组成,其中半乳糖的含量比子实体高。猴头菇的高分子质量多糖具有较强的抗氧化活性和生物活性,此外甘露糖、阿拉伯糖和半乳糖的单糖组成也与其生物活性有关。
单一酶法指提取时仅用一种酶辅助提取食用菌多糖,而复合酶法为多种酶联合使用提取。张素斌等[48]分别采用2种酶法分别提取猴头菇多糖,单一木瓜蛋白酶加酶量为0.5%,温度50 ℃,提取时间90 min,pH 4,多糖提取率为9.77%;复合酶的加酶量为纤维素酶、木瓜蛋白酶、果胶酶各0.5%,其他相同条件下提取率提高至10.89%。ZHU等[49]使用复合酶法提取猴头菇多糖时发现,与热水法相比得率可提高67.72%,产生的多糖为阳性(热水提取为阴性),但不改变基团结构;可能由于适宜的pH值对酶空间结构、构象和活性有影响,由分支和相互缠结的构象转变为更长的多糖链并增加了分子柔韧性,这种变化是由葡萄糖的船-椅式构象转变所引起,此外酶的种类如细胞壁降解酶会削弱或破坏细胞壁(即纤维素),使细胞内物质更易于提取;相比热水浸提法复合酶提取后产物中有较高比例的葡萄糖,而甘露糖和木糖的比例减少;对酶辅助提取得率的影响因素相对大小为:pH>温度>时间>酶浓度。超声复合酶法为在复合酶法的基础上辅助增加超声条件,超声的声空化作用有利于单一复合酶法的提取,提取率由10.89%提高至15.59%[48]。
多糖可溶于水、酸、碱,而不溶于乙醇、甲醇等有机溶剂,通过不同溶剂提取对多糖结构也具有影响。YAN等[50]对不同溶剂提取猴头菇多糖的效果进行研究,发现在相同的提取时间和温度下碱提法优于酸提法,特别是在95 ℃时可溶性长链多糖降解为短链的酸水解作用较强,短链游离糖可能不会被乙醇所沉淀;碱提过程中的碱可破坏细胞壁中纤维素与半纤维素之间的氢键,使不溶性多糖转化为可溶性,以上2种情况都导致酸提法的得率较低,并且不同的萃取溶剂对多糖组成成分的影响不大,差别可能是由于原料来源和提取方法。不同溶剂提取的猴头菇多糖都有2个主要的组分,如表7所示,热水提取法的2种多糖组分分子质量分别为597.6和314.7 kDa,盐提法为449.4和442.7 kDa,酸提法为263.6和229.8 kDa,碱提法为320.8和256.8 kDa;酸碱提取的多糖具有更高的蛋白质含量,此外分子质量和黏度明显低于热水和盐提取法,表明在此过程中多糖链可能受到一定程度的破坏和降解,一部分高分子质量组分转化为低分子质量组分,从而增加了猴头菇多糖中低分子质量组分的含量;不同溶剂提取对猴头菇多糖的有机基团并无显著影响[50]。
表7 不同提取方法对猴头菇多糖得率以及结构的影响
Table7 Effects of different extraction methods on the yield and structure of Hericium erinaceus polysaccharide

提取方法液料比/(mL∶g)温度/℃时间/min功率/W得率/%分子质量/kDa多糖类型主要糖苷键单糖组成文献酶提取法木瓜蛋白酶(pH 4)30∶15090-9.77(提取率)----[48]纤维素酶、木瓜蛋白酶、果胶酶(pH 4)30∶15090-10.89(提取率)----[48]纤维素酶、果胶酶、胰蛋白酶(pH 5.71)30∶152.0333.79-13.46--β-甘露糖、葡萄糖、木糖、半乳糖(15.16:5.55:4.21:1)[49]超声复合酶法纤维素酶、木瓜蛋白酶、果胶酶(pH 4)30∶15013050015.59(提取率)----[48]超声提取法20∶1-605006.41(提取率)----[48]热水浸提法10∶195480-8.10597.6314.7杂多糖β-(1→3)-葡萄糖∶半乳糖∶鼠李糖∶阿拉伯糖∶甘露糖(35.5∶6.1∶9.9∶1.6∶1.0)[50]盐提取法(0.9%NaCl)10∶195480-9.66449.4442.7杂多糖β-(1→3)-葡萄糖∶半乳糖∶鼠李糖∶阿拉伯糖∶甘露糖(30.7∶4.6∶1.7∶1.0∶1.0)[50]酸提取法(柠檬酸pH 3.0)10∶195480-8.84263.6229.8杂多糖β-(1→3)-葡萄糖∶半乳糖∶鼠李糖∶阿拉伯糖∶甘露糖(40.7∶7.5∶9.0∶2.0∶1.0)[50]碱提取法(1.25 mol/L NaOH)10∶125180-11.76320.8256.8杂多糖β-(1→3)-葡萄糖∶半乳糖∶鼠李糖∶阿拉伯糖∶甘露糖(66.5∶9.5∶3.3∶2.4∶1.0)[50]
3 结论
真菌多糖作为真菌细胞壁的结构性成分存在,由2种主要类型的多糖组成:一种是由几丁质(或纤维素)组成的刚性原纤维结构,另一种是由α-葡聚糖、β-葡聚糖和糖蛋白组成的基质样结构。不同提取方法提取的真菌多糖,由于提取工艺的差异对多糖得率、分子质量、结构等因素具有不同影响。与热水和酶法相比,超声和微波提取具有更高的效率、产量和更短的提取时间。超声波提取法主要利用声空化产生的气穴气泡的高强度冲击作用力产生强烈的压力、剪切力和温度梯度作用于细胞,使真菌细胞壁和糖链断裂,对大多数真菌多糖而言,超声处理可较好地提高效率,但在得率上具有差异,如银耳多糖较高,但对灵芝多糖作用不大,可能由于灵芝多糖受温度影响较大。微波辅助提取技术可穿透萃取介质,直接作用于物质内部,使材料内部累积了相当大的压力,这种高压极大地破坏真菌细胞并改善组织的毛细孔结构,增大了多糖溶解度并加速目标物质的扩散,微波功率对得率的影响比提取温度和时间等因素更大,此方法对金针菇多糖提取较为有效。酶法提取主要为酶对真菌细胞壁组织的酶解和多糖溶出作用,加速目标化合物从组织向周围环境的迁移并增加接触面积,是最温和且多糖保留较好的一种方式,有趣的是蛋白酶对真菌多糖也具有一定的效果,如木瓜和酸性蛋白酶分别对灵芝和虫草多糖的提取效果较好,对杏鲍菇而言则是纤维素酶较好等;当酶复配使用时要注意各种酶的加酶量,过多也可能会导致多糖分解,此外特别需要注意温度、时间和最适pH值,才能发挥最大提取效能。酸碱可降解多糖中的链和键,增加多糖溶解率等,但采用酸法提取时温度不宜过高,酸性多糖或糖醛酸含量高的多糖可采用碱提取法,适量浓度的碱能破除细胞壁聚合物分子间的结构,但过高浓度会造成多糖水解。酸碱法提取香菇多糖的得率最高,提取效果取决于酸碱浓度,香菇多糖碱浓度为0.8 mol/L、酸为0.4 mol/L,猴头菇最适碱浓度为1.25 mol/L;采用这些提取方法效率比传统热水提取的得率更高,所得多糖的生物活性和自由基清除能力等也会相对提高,但是相对分子质量有所降低。
食用菌多糖在临床治疗疾病具有重要作用,这需要多糖具有较高的活性,因此如何获得具有更高活性的多糖还需要进一步的研究。目前用于药用的真菌多糖大部分为单一多糖,各多糖间的协同作用也是今后研究的方向之一。
[1] 宋立立,张兆英.食用菌多糖的生物活性研究现状[J].中国食用菌,2019,38(2):14-16.
SONG L L,ZHANG Z Y.The status of biological activity of mushroom polysaccharides[J].Edible Fungi of China,2019,38(2):14-16.
[2] 周明,杜欣,杨德,等.超声波-微波协同萃取对灵芝多糖提取率的影响[J].湖北农业科学,2009,48(7):1 727-1 729.
ZHOU M,DU X,YANG D,et al.Effect of Ultrasound-microwave treatment on extracting rate of Ganoderma lucidum polysaccharides[J].Hubei Agricultural Sciences,2009,48(7):1 727-1 729.
[3] 郑静,常逎滔,林英,等.超声波法和超声波酶法提取灵芝多糖的条件研究[J].食用菌学报,2006,13(1):48-52.
ZHENG J,CHANG D T,LIN Y,et al.Study on the extraction conditions of Ganoderma lucidum polysaccharides by ultrasonic method and ultrasonic enzymatic method[J].Acta Edulis Fungi,2006,13(1):48-52.
[4] 黄琼,丁玲.微波协同酶法提取金针菇多糖工艺的优化[J].食品与机械,2013,29(1):128-130.
HUANG Q,DING L.Preparation of polysaccharides from Flammulina velutipes by microwave enzyme synergistic extraction[J].Food & Machinery,2013,29(1):128-130.
[5] CHEN R Z,JIN C G,LI H P,et al.Ultrahigh pressure extraction of polysaccharides from Cordyceps militaris and evaluation of antioxidant activity[J].Separation and Purification Technology,2014,134:90-99.
[6] 王颖,魏佳韵,吴思佳,等.灵芝多糖结构特征及药理作用的研究进展[J].中成药,2019,41(3):627-635.
WANG Y,WEI J Y,WU S J,et al.Research progress on the structural characteristics and pharmacological effects of Ganoderma lucidum polysaccharide[J].Chinese Traditional Patent Medicine,2019,41(3):627-635.
[7] KANG Q Z,CHEN S S,LI S F,et al.Comparison on characterization and antioxidant activity of polysaccharides from Ganoderma lucidum by ultrasound and conventional extraction[J].International Journal of Biological Macromolecules,2019,124:1 137-1 144.
[8] 刘钧发,冯梦莹,游丽君,等.超声和水提法提取灵芝多糖的结构和抗氧化性的比较研究[J].食品工业科技,2013,34(24):88-92.
LIU J F,FENG M Y,YOU L J,et al.Structure and antioxidant properties of Ganoderma lucidum polysaccharides extracted by ultrasonic wave and hot water[J].Science and Technology of Food Industry,2013,34(24):88-92.
[9] 张一帆,张智,魏志艳,等.四种方法提取灵芝粗多糖的得率比较试验[J].食用菌,2010,32(6):58-60.
ZHANG Y F,ZHANG Z,WEI Z Y,et al.Comparison of yields of crude polysaccharides extracted from Ganoderma lucidum by four methods[J].Edible Fungi,2010,32(6):58-60.
[10] 朱玲,史吉平,王晨光,等.响应面法优化灵芝多糖的酶法提取工艺研究[J].食品工业科技,2016,37(24):238-244.
ZHU L,SHI J P,WANG C G,et al.Optimization of enzymatic extraction of polysaccharides from Ganoderma lucidum using response surface methodology[J].Science and Technology of Food Industry,2016,37(24):238-244.
[11] ZHAO L Y,DONG Y H,CHEN G T,et al.Extraction,purification,characterization and antitumor activity of polysaccharides from Ganoderma lucidum[J].Carbohydrate Polymers,2010,80(3):783-789.
[12] SHI M,ZHANG Z Y,YANG Y N.Antioxidant and immunoregulatory activity of Ganoderma lucidum polysaccharide(GLP)[J].Carbohydrate Polymers,2013,95(1):200-206.
[13] 田淑雨,鹿士峰,吴杨洋,等.灵芝多糖不同提取方式的比较研究[J].食品安全质量检测学报,2018,9(18):4 921-4 928.
TIAN S Y,LU S F,WU Y Y,et al.Comparative study on different extraction methods of Ganoderma lucidum polysaccharide[J].Journal of Food Safety and Quality,2018,9(18):4 921-4 928.
[14] 元玲刚,常明昌,刘靖宇,等.北虫草多糖提取工艺优化及抗氧化作用研究[J].中国农学通报,2015,31(19):144-148.YUAN L G,CHANG M C,LIU J Y,et al.Study on extraction and antioxidation of Cordyceps polysaccharide[J].Chinese Agricultural Science Bulletin,2015,31(19):144-148.
[15] 郭洁,袁洪水.冬虫夏草产多糖菌株的筛选鉴定及多糖提取[J].江苏农业科学,2015,43(3):240-243.
GUO J,YUAN H S.Screening and Identification of polysaccharide-producing strains of Cordyceps sinensis and extraction of polysaccharides[J].Jiangsu Agricultural Sciences,2015,43(3):240-243.
[16] 赵怡红,邱玉华.微波法与传统工艺提取北冬虫夏草多糖的比较研究[J].内蒙古农业科技,2009,37(3):68-69.
ZHAO Y H,QIU Y H.Comparative study on polysaccharide extraction from northern Cordyceps by microwave method and traditional technology[J].Inner Mongolia Agricultural Science And Technology,2009,37(3):68-69.
[17] 安冬,朱蓓薇.响应面优化酶法提取蛹虫草培养基多糖的研究[J].安徽农业科学,2012,40(25):12 666-12 668;12 670.
AN D,ZHU B W.Optimization of enzyme extraction conditions of cordycepin polysaccharide by using response surface methodology[J].Journal of Anhui Agricultural Sciences,2012,40(25):12 666-12 668;12 670.
[18] ZHU Z Y,DONG F Y,LIU X C,et al.Effects of extraction methods on the yield,chemical structure and anti-tumor activity of polysaccharides from Cordyceps gunnii Mycelia[J].Carbohydrate Polymers,2016,140:461-471.
[19] ZHANG J X,WEN C T,DUAN Y Q,et al.Advance in Cordyceps militaris(Linn)link polysaccharides:Isolation,structure,and bioactivities:A review[J].International Journal of Biological Macromolecules,2019,132:906-914.
[20] YAN Y L,YU C H,CHEN J,et al.Ultrasonic-assisted extraction optimized by response surface methodology,chemical composition and antioxidant activity of polysaccharides from Tremella mesenterica[J].Carbohydrate Polymers,2011,83(1):217-224.
[21] 周雅琳,谭红军,杨勇.不同处理方式对银耳粗多糖提取效果及化学成分的影响[J].食品科技,2015,40(5):216-220.
ZHOU Y L,TAN H J YANG Y.Effect of extraction rate and chemical composition of crude polysaccharides in Tremella fuciformis Berk by different extraction methods[J].Food Science and Technology,2015,40(5):216-220.
[22] WANG D Q,WANG D G,YAN T X,et al.Nanostructures assembly and the property of polysaccharide extracted from Tremella fuciformis fruiting body[J].International Journal of Biological Macromolecules,2019,137:751-760.
[23] 鲍会梅.酶解法提取银耳多糖的工艺及稳定性研究[J].食品研究与开发,2015,36(11):17-21.
BAO H M.Study on extraction technology and stability of Tremella polysaccharide by enzymatic hydrolysis[J].Food Research and Development,2015,36(11):17-21.
[24] 曾丽萍,梁钻好,杨子银,等.银耳多糖提取优化及得率与质构相关性[J].农业工程,2016,6(5):61-64;69.
ZENG L P,LIANG Z H,YANG Z Y,et al.Tremella polysaccharides extraction optimization and correlation between yield and texture[J].Agricultural Engineering,2016,6(5):61-64;69.
[25] 陈丽娟,杨继国,宁正祥.银耳多糖湿法打浆快速提取工艺的研究[J].中国食品添加剂,2017,18(1):156-160.
CHEN L J,YANG J G,NING Z X.Study on the wet beating fast extraction process of polysaccharide from Tremella fuciformis[J].China Food Additives,2017,18(1):156-160.
[26] 陶瑞霄,贾冬英,姚开,等.高压提取银耳多糖研究[J].食品科技,2015(6):229-233.
TAO R X,JIA D Y,YAO K,et al.Extraction of polysaccharide from Tremella fuciformis under high pressure[J].Food Science and Technology,2015(6):229-233.
[27] 杨嘉丹,刘婷婷,张闪闪,等.微波辅助提取银耳多糖工艺优化及其流变、凝胶特性[J].食品科学,2019,40(14):289-295.
YANG J D,LIU T T,ZHANG S S,et al.Optimization of microwave-assisted extraction and rheological and gelling properties of polysaccharide from Tremella fuciformis[J].Food Science,2019,40(14):289-295.
[28] WU Q,DAI Y G,ZOU X F,et al.Isolation of alkai-soluble polysaccharide from Tremella fuciformis and its antioxidant activity in vitro[C]//2011 IEEE International Symposium on IT in Medicine and Education.IEEE,2012.
[29] ZHENG X M,SUN H Q,WU L R,et al.Structural characterization and inhibition on α-glucosidase of the polysaccharides from fruiting bodies and mycelia of Pleurotus eryngii[J].International Journal of Biological Macromolecules,2020,156:1 512-1 519.
[30] 朱月,宋义,毕晓丹,等.杏鲍菇多糖提取方法的比较[J].江苏农业科学,2015,43(2):259-262.
ZHU Y,SONG Y,BI X D,et al.Comparison of extraction methods of Pleurotus eryngii polysaccharides[J].Jiangsu Agricultural Sciences,2015,43(2):259-262.
[31] 石翛然.超声法提取杏鲍菇多糖的条件研究[J].广东化工,2017,44(12):53-57.
SHI H R.Study on the condition of ultrasonic extraction of Eryngii[J].Guangdong Chemical Industry,2017,44(12):53-57.
[32] 凡军民,谢春芹,贾君,等.纤维素酶法提取杏鲍菇多糖工艺优化[J].食品科技,2013,38(3):192-196.
FAN J M,XIE C Q,JIA J,et al.Opitimization of extraction processing on polysaccharides from Pleurotus eryngii by cellulase enzymolysis[J].Food Science and Technology,2013,38(3):192-196.
[33] JIAO F P,WANG X X,SONG X L,et al.Processing optimization and anti-oxidative activity of enzymatic extractable polysaccharides from Pleurotus djamor[J].International Journal of Biological Macromolecules,2017,98:469-478.
[34] REN D Y,WANG N,GUO J J,et al.Chemical characterization of Pleurotus eryngii polysaccharide and its tumor-inhibitory effects against human hepatoblastoma HepG-2 cells[J].Carbohydrate Polymers,2016,138:123-133.
[35] ZHANG Z F,LV G Y,HE W Q,et al.Effects of extraction methods on the antioxidant activities of polysaccharides obtained from Flammulina velutipes[J].Carbohydrate Polymers,2013,98(2):1 524-1 531.
[36] CHEN X,FANG D L,ZHAO R Q,et al.Effects of ultrasound-assisted extraction on antioxidant activity and bidirectional immunomodulatory activity of Flammulina velutipes polysaccharide[J].International Journal of Biological Macromolecules,2019,140:505-514.
[37] 游丽君,刘钧发,冯梦莹,等.酶法水解金针菇多糖及其产物特性分析[J].现代食品科技,2013,29(7):1 486-1 490.
YOU L J,LIU J F,FENG M Y,et al.Characteristics of Flammulina velutipes polysaccharides degraded by different proteases[J].Modern Food Science and Technology,2013,29(7):1 486-1 490.
[38] 孔晓雪,安辛欣,赵立艳,等.金针菇水溶性多糖物理提取工艺及优化[J].食品科学,2010,31(24):230-235.
KONG X X,AN X X,ZHAO L Y,et al.Optimization of extraction processing for water-soluble polysaccharides from Flammulina velutipes[J].Food Science,2010,31(24):230-235.
[39] YANG W J,PEI F,SHI Y,et al.Purification,characterization and anti-proliferation activity of polysaccharides from Flammulina velutipes[J].Carbohydrate Polymers,2012,88(2):474-480.
[40] ZHANG Y Y,LI S,WANG X H,et al.Advances in lentinan:Isolation,structure,chain conformation and bioactivities[J].Food Hydrocolloids,2011,25(2):196-206.
[41] 张锐,曾万勇,郭焕中,等.不同提取方法对香菇多糖得率影响的研究[J].科教导刊(中旬刊),2015(6):60-61.
ZHANG R,ZENG W Y,GUO H Z,et al.The study of extraction effect on Lentinan by different extraction methods[J].The Guide of Science & Education,2015(6):60-61.
[42] ZHAO Y M,YANG J M,LIU Y H,et al.Ultrasound assisted extraction of polysaccharides from Lentinus edodes and its anti-hepatitis B activity in vitro[J].International Journal of Biological Macromolecules,2018,107(Pt B):2 217-2 223.
[43] KE L Q.Optimization of ultrasonic extraction of polysaccharides from Lentinus edodes based on enzymatic treatment[J].Journal of Food Processing and Preservation,2015,39(3):254-259.
[44] LI W W,WANG J Y,CHEN Z Q,et al.Physicochemical properties of polysaccharides from Lentinus edodes under high pressure cooking treatment and its enhanced anticancer effects[J].International Journal of Biological Macromolecules,2018,115:994-1 001.
[45] HUANG X Q,TU Z C,JIANG Y,et al.Dynamic high pressure microfluidization-assisted extraction and antioxidant activities of sweet potato(Ipomoea batatas L.)leaves flavonoid[J].Food and Bioproducts Processing,2013,91(1):1-6.
[46] REN G M,XU L M,LU T Y,et al.Structural characterization and antiviral activity of lentinan from Lentinus edodes Mycelia against infectious hematopoietic necrosis virus[J].International Journal of Biological Macromolecules,2018,115:1 202-1 210.
[47] WANG X Y,ZHANG D D,YIN J Y,et al.Recent developments in Hericium erinaceus polysaccharides:Extraction,purification,structural characteristics and biological activities[J].Critical Review in Food Science and Nutrition,2019,59(sup1):S96-S115.
[48] 张素斌,黄劲峥.猴头菇多糖提取方法的比较[J].食品与发酵工业,2014,40(4):233-237.
ZHANG S B,HUANG J Z.Comparation on extraction methods of polysaccharide from Hericium erinaceus[J].Food and Fermentation Industries,2014,40(4):233-237.
[49] ZHU Y,LI Q,MAO G H,et al.Optimization of enzyme-assisted extraction and characterization of polysaccharides from Hericium erinaceus[J].Carbohydrate Polymers,2014,101:606-613.
[50] YAN J K,DING Z C,GAO X L,et al.Comparative study of physicochemical properties and bioactivity of Hericium erinaceus polysaccharides at different solvent extractions[J].Carbohydrate Polymers,2018,193:373-382.