甘蔗渣(sugarcane bagasse)是甘蔗制糖工业的主要固体副产物,联合国粮农组织2019年统计数据显示,全世界甘蔗渣产量达2.7亿t,占甘蔗总产量的15%,我国甘蔗种植业每年约产生2 000万t甘蔗渣[1-2]。以甘蔗渣为原料,开发生产动物饲料[3]、生物质板材[4]和绿色制浆造纸[5]等,已呈现广阔应用前景。甘蔗渣燃烧发电后的甘蔗渣灰,可用作砂浆或混凝土添加剂,增加抗压强度[6-7]。有研究表明,经化学修饰后的甘蔗渣对废水中的金属离子具有较好的吸附作用,有可能成为一类新型吸附剂[8]。但是,绝大部分的甘蔗渣仍被简单焚烧或丢弃,不仅对环境造成污染,对资源也是极大的浪费。
与其他木质生物质相似,甘蔗渣的基础组分为纤维素、半纤维素和木质素,经水解可生成可发酵糖,能作为发酵生产乙醇、乳酸等大宗产品的原料[9-10]。水解甘蔗渣为可发酵糖的常用方法包括化学法和酶解法。其中,化学法主要包括酸法、碱法和离子液体法等。硫酸由于价格低廉且水解效果好,常用于酸法水解,但是酸水解过程中生成的糠醛等物质会对后续发酵过程产生抑制作用[11]。碱法水解甘蔗渣可使甘蔗渣纤维内部发生膨胀、化学键断裂、生成孔隙,有利于后续水解的进行[12]。但酸法和碱法直接制备可发酵糖存在诸多问题,如原料转化率低、可发酵糖液需进一步纯化精制等。离子液体虽然对纤维素具有良好的溶解性,但因其成本过高,不能广泛应用于工业生产[13]。酶解法具有高效、专一、作用条件温和等特点,被视为最有应用前景的生物质糖化方法并得到广泛研究[14]。酶法水解甘蔗渣为可发酵糖理论上应配合使用纤维素酶、木聚糖酶、果胶酶和蛋白酶等,具体需要就甘蔗渣酶解高效酶制剂筛选及其酶解工艺进行系统研究。同时,降低酶制剂使用成本,也是甘蔗渣作为工业原料应用于大规模工业化生产亟待解决的关键问题[15-16]。
我国已经能够规模化生产生物质水解酶制剂,包括纤维素酶和木聚糖酶等。由于不同植物来源的生物质的组成差异明显,甘蔗渣中纤维素和半纤维素的组成和结构存在一定特殊性,相关酶制剂的作用效果也存在一定差异性。为此,本文在分析现有商品酶制剂水解甘蔗渣效果的基础上,进一步寻找新的生物质水解酶,通过实验优化获得酶的最优组合,最大程度的提高甘蔗渣的酶解效率并建立酶解工艺,进而通过发酵实验检验所获得的甘蔗渣水解糖直接用做工业发酵原料的可行性。
1 材料与方法
1.1 药品、试剂与菌种
甘蔗渣来自中国广西某糖厂,由广西科学院惠赠。商品纤维素酶(500 000 U/g)、木聚糖酶(290 000 U/g),江苏锐阳生物科技有限公司;胰蛋白胨、酵母膏,英国OXOID公司;其他试剂均为分析纯,国药集团化学试剂有限公司。
β-葡萄糖苷酶、外切葡聚糖酶和内切葡聚糖酶等生产菌株,为本实验室前期构建并保藏,通过发酵法进行酶液制备[17]。发酵葡萄糖产乙醇生产菌种Escherichia coli B0013-2012PA,为本实验室前期构建并保藏[18]。
1.2 仪器与设备
5 L离位磁力搅拌发酵罐,上海保兴公司;UV-1200紫外可见分光光度计,上海美谱达公司;SBA-40X生物传感分析仪,济南延和公司;1260高效液相色谱仪,美国安捷伦公司。
1.3 甘蔗渣的预处理
将甘蔗渣粉碎后过40目筛,与15 g/L的NaOH按照固液比1∶10(g∶mL)混合,在115 ℃下反应60 min,冷却至室温后用盐酸调节pH至5.0左右。
1.4 酶解方法与酶制剂的筛选
取1 g甘蔗渣预处理后置于100 mL三角瓶,加酶混合后置于50 ℃水浴振荡器,在120 r/min下进行酶解,定时取样分析游离单糖的含量。
向甘蔗渣中加入50 U/g的商品纤维素酶和25 U/g 的商品木聚糖酶作为基础和对照组,依次对β-葡萄糖苷酶、外切葡聚糖酶、内切葡聚糖酶进行筛选。利用纤维素酶间的协同作用,在外切葡聚糖酶和内切葡聚糖酶筛选时加入水解效果好的β-葡萄糖苷酶。酶解方法同上,定时取样分析游离单糖的含量。
1.5 甘蔗渣水解液发酵乙醇
用氨水将甘蔗渣水解液pH调至7.0后加入5 L发酵罐中,接入10%种子液,控制总体积为2.5 L,在37 ℃ 下开始发酵。生长阶段控制搅拌转速为200~800 r/min、空气流速为3~7 L/min,培养5 h后关闭通气转入厌氧发酵,控制搅拌转速为200 r/min。定时取样检测葡萄糖、木糖和乙醇浓度,待葡萄糖消耗殆尽且乙醇不再增加时结束发酵。
1.6 分析方法
1.6.1 甘蔗渣组分分析
参考美国可再生能源实验室(National Renewable Energy Laboratory,NREL)的方法[19],对甘蔗渣的组成成分进行分析。
1.6.2 酶活力测定
内切葡聚糖酶的酶活力测定采用黏度法[20],酶活力定义:在50 ℃和pH 6.0条件下,以CMC-Na为底物,1 min内降解1 mg CMC所需的酶量为1个酶活力单位(U)。外切葡聚糖酶的酶活力测定按照文献[17]方法进行,酶活力定义:在50 ℃和pH 5.0条件下,1 min内水解CMC-Na产生1 μmol纤维二糖所需的酶量定义为1个酶活力单位(U)。β-葡萄糖苷酶的酶活力测定,以10 mmol/L的纤维二糖为底物,在50 ℃、pH 5.0下反应10 min,用生物传感仪测定葡萄糖释放量;酶活力定义:在50 ℃和pH 5.0条件下,1 min 内水解纤维二糖反应产生1 μmol葡萄糖所需的酶量为1个酶活力单位(U)。
1.6.3 发酵产物分析
发酵过程中定时取样,生物传感仪法检测葡萄糖和乙醇含量,高效液相色谱法检测木糖含量[21]。色谱柱选择Prevail Carbohydrate ES 5u(250 mm×4.6 mm),采用蒸发光检测器,流动相为V(乙腈)∶V(水)=65∶35,流速为1 mL/min,柱温35 ℃,进样量15 μL。
2 结果与分析
2.1 商品酶对甘蔗渣的水解作用
使用NREL推荐方法对甘蔗渣组分进行分析,本研究使用的甘蔗渣样本含纤维素41.8%、半纤维素21.8%、木质素29.6%、灰分6.4%(质量分数)。
利用商品纤维素酶和商品木聚糖酶分别对甘蔗渣进行酶解,结果如图1所示。随着商品酶添加量的增加,甘蔗渣中纤维素和半纤维素的水解率也随之上升。当纤维素酶的添加量达到30 000 U/g甘蔗渣时,纤维素和半纤维素的水解率分别可达到90.65%(以葡萄糖计)和97.89%(以木糖计)(图1-a);当木聚糖酶添加量为25 000 U/g甘蔗渣时,纤维素和半纤维素的水解率分别为92.84%(以葡萄糖计)和97.32%(以木糖计),此时甘蔗渣中的纤维素和半纤维素几乎被完全水解(图1-b)。可见,在不考虑酶使用成本的前提下,现有商品纤维素酶和木聚糖酶皆可有效水解甘蔗渣;考虑使用成本,降低商品酶用量,则酶解效率和水解率大幅降低,其中纤维素的水解率降低尤为明显,实现90%以上半纤维素、17%以上纤维素的水解需要20 000 U/g 的商品纤维素酶或1 000 U/g的商品木聚糖酶(图1)。因同等活力的商品纤维素酶与商品木聚糖酶价格接近,故前者使用成本远高于后者。可见,找寻新的特别是针对甘蔗渣中纤维素水解的酶制剂并与现有商品酶复合使用,有可能从根本上解决甘蔗渣酶制剂的专业性和水解效率不足的问题,而本研究使用的商品木聚糖酶相对商品纤维素酶具有成本优势。

a-纤维素酶水解蔗渣;b-木聚糖酶水解蔗渣
图1 商品酶对甘蔗渣的水解作用
Fig.1 Bagasse hydrolysis by commercial enzymes
2.2 甘蔗渣新酶的优选
β-葡萄糖苷酶的主要底物为纤维二糖及纤维寡糖,可消除纤维素酶水解产物对纤维素酶的抑制作用,在纤维素水解中发挥重要且特殊的作用[22]。为此,以50 U/g商品纤维素酶和25 U/g商品木聚糖酶为基础和对照组,对多种β-葡萄糖苷酶的协同水解作用进行筛选,结果汇总于图2。10种β-葡萄糖苷酶对商品酶水解纤维素皆有协同作用,以BgA的协同作用最好,葡萄糖释放率较对照组提高了69.57%(2.34%/1.38%)。
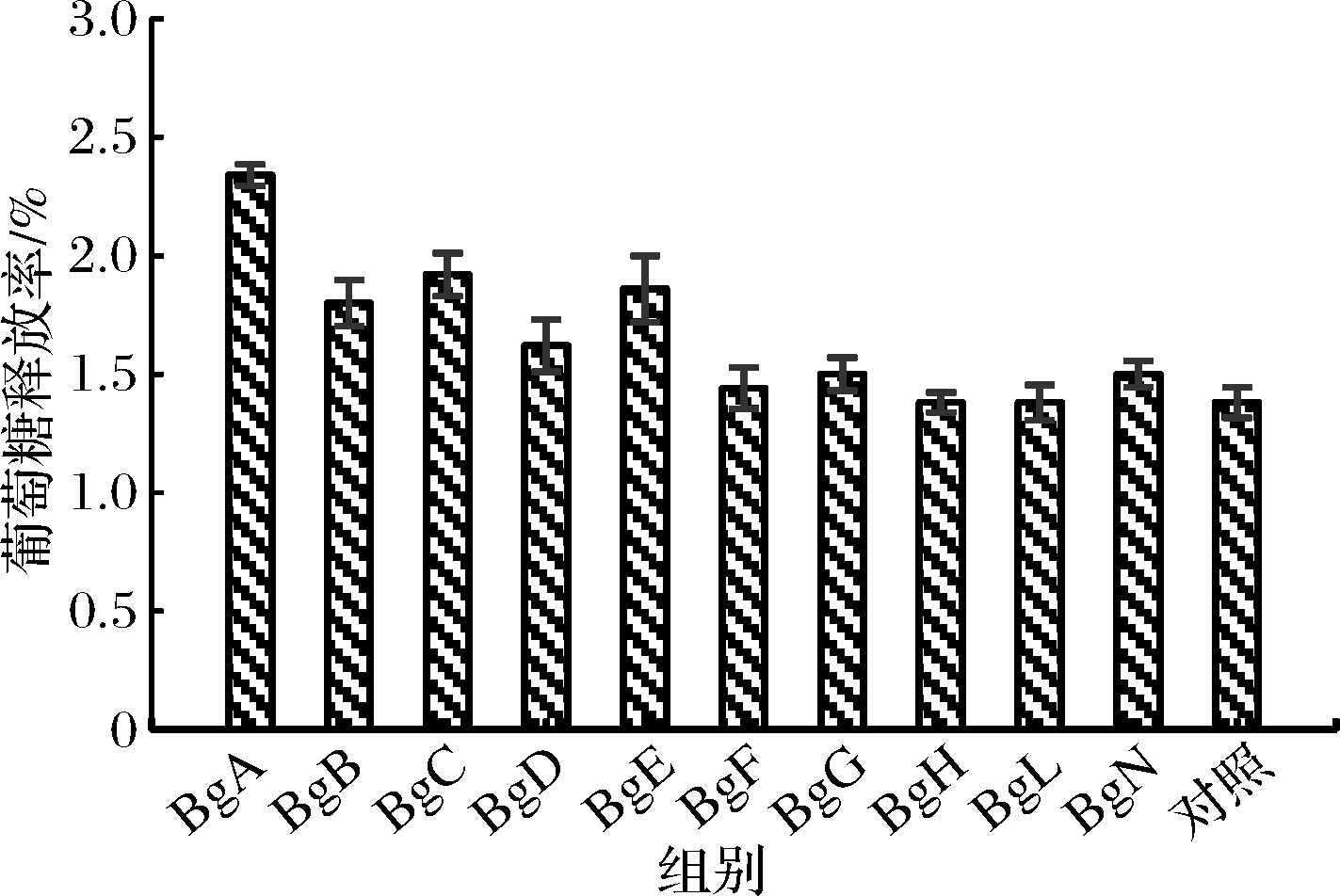
图2 β-葡萄糖苷酶的筛选
Fig.2 Screening of β-glucosidases
外切葡聚糖酶从纤维素分子的末端水解释放纤维二糖、葡萄糖和纤维寡糖,不同的外切葡聚糖酶的水解效率、底物结构和产物形成种类等皆不同[23]。通过筛选,获得3种具有较好协同水解作用的外切葡聚糖酶,其中CbhC的水解效果最好,葡萄糖释放率较只添加BgA时提高了38.24%(3.29%/2.38%)(图3)。
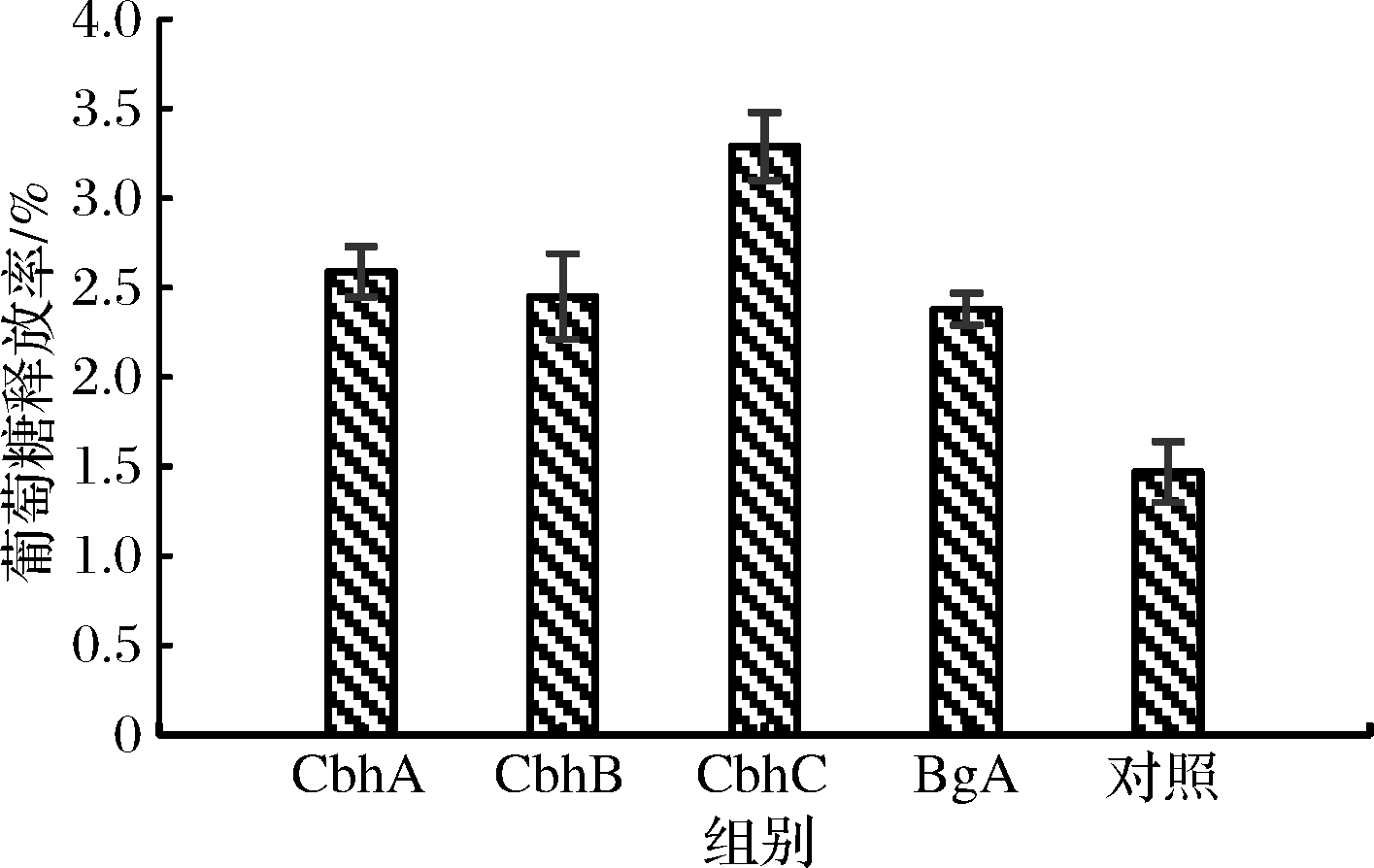
图3 外切葡聚糖酶的筛选
Fig.3 Screening of exo-glucanases
同样,通过筛选获得了16种内切葡聚糖酶具有协同水解甘蔗渣纤维素的作用,其中EnglA、EglD和En3gA的作用最为明显(图4)。

图4 内切葡聚糖酶的筛选
Fig.4 Screening of endoglucanases
2.3 酶组合与优化
考虑用酶成本,以商品木聚糖酶(1 000 U/g)为基础,进一步确认筛选得到的三类新酶与商品酶组合使用的协同效果,将BgA、CbhC、EnglA、En3gA和EglD 分别与商品酶复配,再进行甘蔗渣水解实验,结果见表1。
表1 复合酶水解甘蔗渣结果
Table 1 Bagasse hydrolysis by compound enzymes
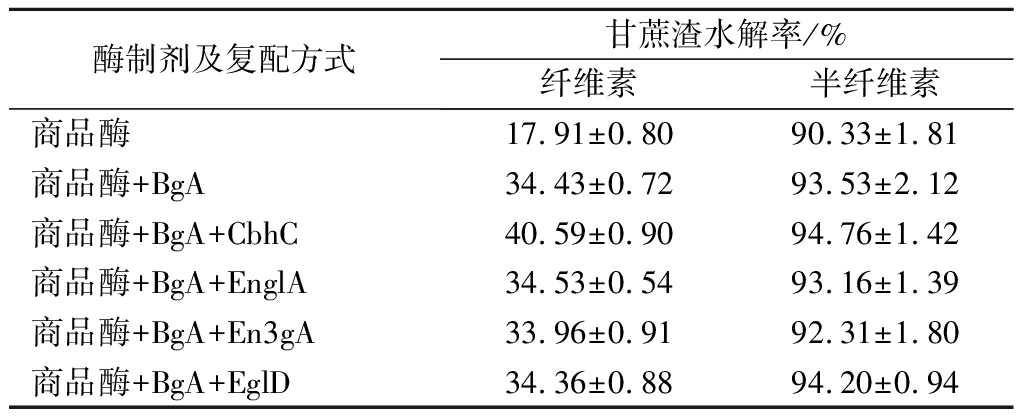
酶制剂及复配方式甘蔗渣水解率/%纤维素半纤维素商品酶17.91±0.8090.33±1.81商品酶+BgA34.43±0.7293.53±2.12商品酶+BgA+CbhC40.59±0.9094.76±1.42商品酶+BgA+EnglA34.53±0.5493.16±1.39商品酶+BgA+En3gA33.96±0.9192.31±1.80商品酶+BgA+EglD34.36±0.8894.20±0.94
可以看出,β-葡萄糖苷酶BgA与商品木聚糖酶复合水解时纤维素的水解率提高了16.52%,CbhC在与商品酶和BgA复合水解时纤维素的水解率较商品酶单独作用时提高了22.68%,半纤维素水解率也分别提高了3.20%和4.43%。内切葡聚糖酶在初期筛选时有一定的水解效果,但是当商品酶的添加量增加后,重组内切葡聚糖酶与商品酶复配时,两者间的协同作用不明显,这可能是由于商品酶制剂中内切葡聚糖酶的占比多,当商品酶的添加量增大时,内切葡聚糖酶将纤维素长链水解为短链后,占比相对较少的外切葡聚糖酶和β-葡萄糖苷酶不足以将短链纤维素完全酶解成葡萄糖,此时反应体系内纤维二糖的积累会对酶解反应产生抑制作用,降低酶解效率[24]。可见,β-葡萄糖苷酶BgA和外切葡聚糖酶CbhC与本研究中使用的商品酶具有最优的协同作用,而内切葡聚糖酶的协同作用不显著。
2.4 复合酶水解甘蔗渣工艺条件的优化
在50 ℃和pH 5.0的条件下,水解甘蔗渣24 h,以商品木聚糖酶(1 000 U/g)为基础,改变BgA的添加量,测定甘蔗渣中纤维素的水解率,结果如图5-a所示。随着BgA添加量的增加,纤维素的水解率也随之升高;当酶添加量为12 000 U/g时,纤维素水解率达到67.01%;继续增加BgA添加量,水解率增幅减缓。以1 000 U/g商品酶和12 000 U/g BgA为基础,改变CbhC的添加量,测定纤维素的水解率(图5-b)。当CbhC添加量为0.175 U/g时纤维素的水解率为 76.44%,继续增加用酶量,水解率没有明显提高。在此水解条件下,甘蔗渣中纤维素的水解率较只添加1 000 U/g商品酶时提高了59.42%。
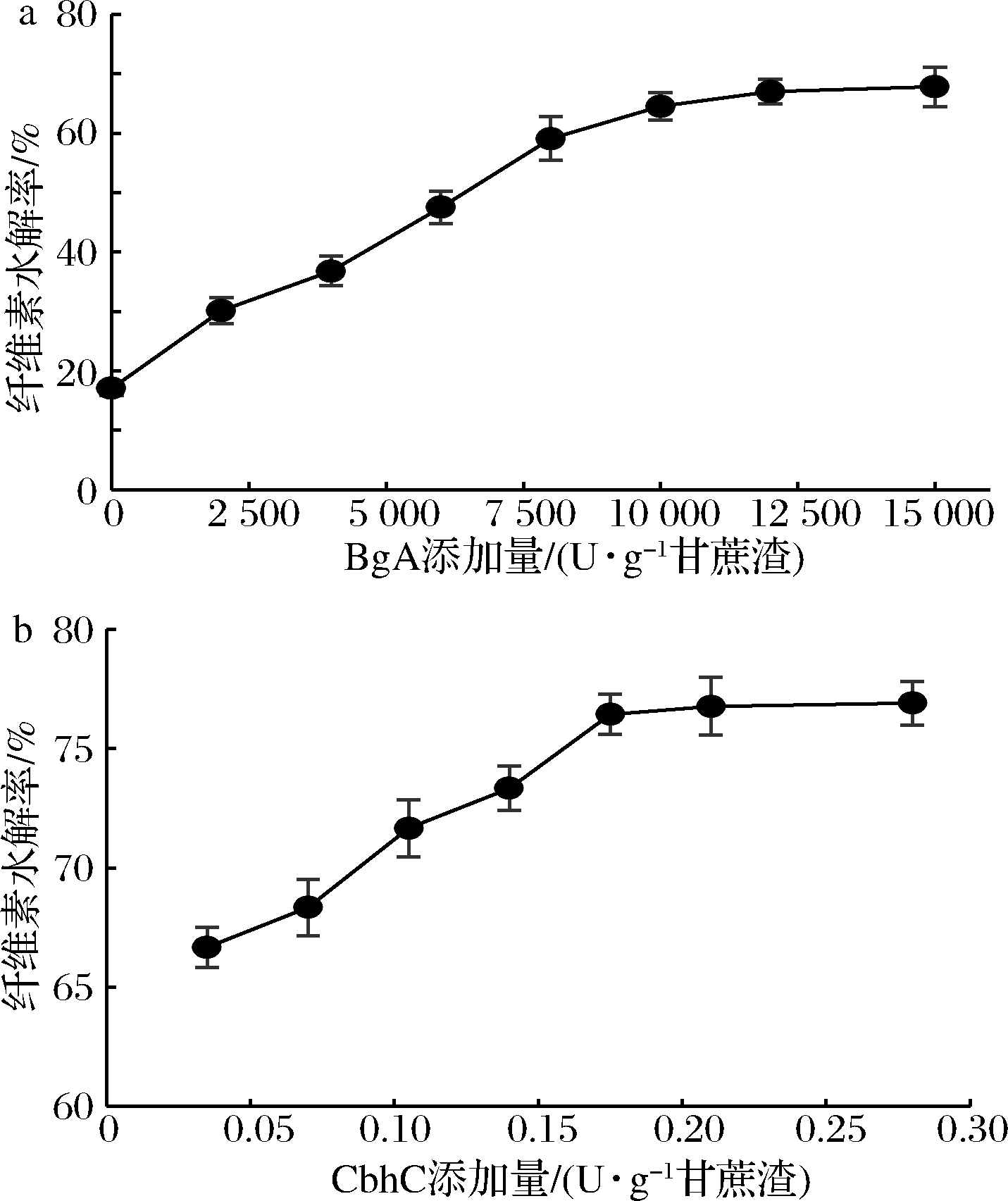
a-BgA的添加量;b-CbhC的添加量
图5 酶添加量对纤维素水解率的影响
Fig.5 Effect of enzyme doses on hydrolysis rate of cellulose
在上述最优酶添加量下,考察了不同酶解时间对酶解效率的影响,结果如图6所示。当水解时间达到36 h后,半纤维素水解率可达到93.56%,此时纤维素的水解率为81.31%,这是由于半纤维素较纤维素更易溶于水或在水中发生溶胀,更易与酶发生水解反应。继续延长酶解时间,半纤维素的水解率增幅明显减缓,而纤维素在60 h时水解率达到90.16%,延长酶解时间后水解率增幅减慢,因此选择60 h为最适酶解时间。

图6 酶解时间对水解率的影响
Fig.6 Effect of time on hydrolysis rate in enzymatic hydrolysis
至此,本研究获得了可以与现有商品酶复合作用以提高甘蔗渣酶解效率的新酶分子及其最优酶组合并对酶解工艺进行了优化。优化的甘蔗渣酶解工艺:商品酶1 000 U/g、BgA 12 000 U/g和CbhC 0.175 U/g,在50 ℃、pH 5.0和120 r/min条件下水解60 h。此时甘蔗渣中纤维素的水解率为90.16%(以葡萄糖计),半纤维素的水解率为95.65%(以木糖计)。在此复合酶的作用下,甘蔗渣中的纤维素和半纤维素均接近完全水解。
2.5 甘蔗渣水解液发酵生产乙醇
为检验优化酶解工艺制得的甘蔗渣水解液不经纯化精制直接应用于发酵的可行性,以其为碳源,在5 L发酵罐中进行乙醇发酵实验,结果如图7所示。厌氧发酵阶段消耗葡萄糖71.26 g/L,乙醇总产量为30.30 g/L,转化率为42.52%,达到理论转化率的82.92%;底物总转化率为12.63 g/100g甘蔗渣。
本研究中采用的发酵菌种为木糖不代谢型[18],菌种代谢葡萄糖为菌体和乙醇后,木糖几乎全部保留在发酵液中,木糖回收率为99.52%。可在将葡萄糖转化为乙醇的同时,从甘蔗渣酶解液中高效回收木糖,用于后续木糖的同步生产及木糖醇的制备[18]。
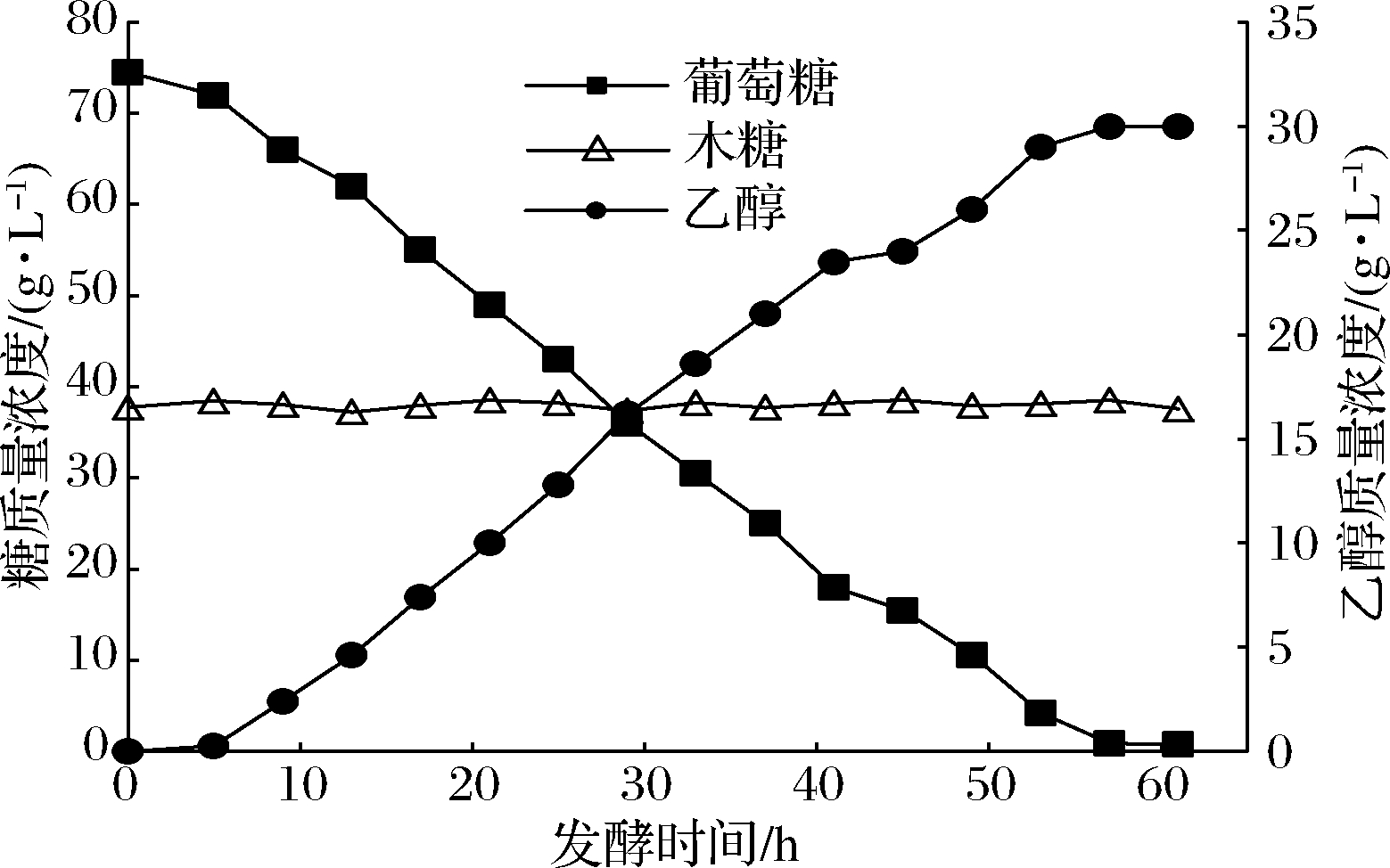
图7 蔗渣水解液作为碳源发酵产乙醇
Fig.7 Ethanol fermentation using bagasse hydrolysate as carbon source
3 结论
本研究揭示,β-葡萄糖苷酶BgA和外切葡聚糖酶CbhC对现有商品酶水解甘蔗渣具有最优的协同作用效果,可大幅降低商品酶的添加量并显著提高甘蔗渣的水解效率。使用本研究获得的酶制剂及其酶解条件,所制得的甘蔗渣水解液可以直接作为发酵碳源,应用于乙醇发酵和木糖同步回收。
4 致谢
广西科学院为本研究提供了宝贵原材料和实验方法;俄罗斯科学院联邦研究中心(Federal Research Centre of the Russian Academy of Sciences, Moscow, Russia)的Pavel Volkov博士在本研究过程中给予了宝贵帮助,在此一并致以衷心的感谢。
[1] 张小梅, 魏东.高效降解甘蔗渣的预处理技术新进展[J].纤维素科学与技术, 2008, 16(2):59-65.
ZHANG X M, WEI D.New advances on the pretreatment technology of bagasse for high-effective digestion[J].Journal of Cellulose Science and Technology, 2008, 16(2):59-65.
[2] 曹勇, 吴义强.甘蔗渣纤维增强聚丙烯复合材料的制备和力学性能[J].复合材料学报, 2007, 24(6):1-6.
CAO Y, WU Y Q.Fabrication and mechanical properties of bagasse fiber reinforced polypropylene composites[J].Acta Materiae Compositae Sinica, 2007, 24(6):1-6.
[3] 彭海芬, 和嘉荣, 李花, 等.甘蔗渣的饲用价值评价[J].中国农学通报, 2021, 37(2):129-133.
PENG H F, HE J R, LI H, et al.Evaluation on feeding value of sugarcane bagasse[J].Chinese Agricultural Science Bulletin, 2021, 37(2):129-133.
[4] 翁炎, 王秀仑.甘蔗渣生物质板材制作及性能分析[J].安徽农业科学, 2018, 46(13):181-184.
WENG Y, WANG X L.Manufacture and performance analysis of bagasse biomass plates[J].Journal of Anhui Agricultural Sciences, 2018, 46(13), 181-184.
[5] BHARDWAJ N K, KAUR D, CHAUDHRY S, et al.Approaches for converting sugarcane trash, a promising agro residue, into pulp and paper using soda pulping and elemental chlorine-free bleaching[J].Journal of Cleaner Production, 2019, 217:225-233.
[6] CABRAL M R, NAKANISHI E Y, FIORELLI J.Evaluation of the effect of accelerated carbonation in cement-bagasse panels after cycles of wetting and drying[J].Journal of Materials in Civil Engineering, 2017, 29(6):04017018.
[7] ZAREEI S A, AMERI F, BAHRAMI N.Microstructure, strength, and durability of eco-friendly concretes containing sugarcane bagasse ash[J].Construction and Building Materials, 2018, 184:258-268.
[8] 刘雪梅, 赵蓓.酸改性甘蔗渣对电镀废水中Cr(Ⅵ)的吸附特性研究[J].化工新型材料, 2020, 48(1):207-212.
LIU X M, ZHAO B.Adsorption characteristics of Cr(Ⅵ) in electroplating wastewater by acid modified bagasse[J].New Chemical Materials, 2020, 48(1):207-212.
[9] SARATALE G D, SARATALE R G, LO Y C, et al.Multicomponent cellulase production by Cellulomonas biazotea NCIM-2550 and its applications for cellulosic biohydrogen production[J].Biotechnology Progress, 2010, 26(2):406-416.
[10] S NCHEZ
NCHEZ  J, CARDONA C A.Trends in biotechnological production of fuel ethanol from different feedstocks[J].Bioresource Technology, 2008, 99(13):5 270-5 295.
J, CARDONA C A.Trends in biotechnological production of fuel ethanol from different feedstocks[J].Bioresource Technology, 2008, 99(13):5 270-5 295.
[11] PEDERSEN M, VIKSØ-NIELSEN A, MEYER A S.Monosaccharide yields and lignin removal from wheat straw in response to catalyst type and pH during mild thermal pretreatment[J].Process Biochemistry, 2010, 45(7):1 181-1 186.
[12] WAN C X, ZHOU Y G, LI Y B.Liquid hot water and alkaline pretreatment of soybean straw for improving cellulose digestibility[J].Bioresource Technology, 2011, 102(10):6 254-6 259.
[13] KUMAR A K, SHARMA S.Recent updates on different methods of pretreatment of lignocellulosic feedstocks:A review[J].Bioresources and Bioprocessing, 2017, 4(1):7.
[14] 王风芹, 汪媛媛, 谢慧, 等.木质纤维素水解糖制取的研究进展[J].纤维素科学与技术, 2013, 21(1):62-69.
WANG F Q, WANG Y Y, XIE H, et al.Progress in monosaccharide production from lignocelluloses[J].Journal of Cellulose Science and Technology, 2013, 21(1):62-69.
[15] MUKASEKURU R M, HU J G, ZHAO X Q, et al.Enhanced high-solids fed-batch enzymatic hydrolysis of sugar cane bagasse with accessory enzymes and additives at low cellulase loading[J].ACS Sustainable Chemistry and engineering, 2018, 6(10):12 787-12 796.
[16] NEDUMARAN M,SINGH S,JAMALDHEEN S B, et al.Assessment of combination of pretreatment of Sorghum durra stalk and production of chimeric enzyme (β-glucosidase and endo β-1,4 glucanase, CtGH1-L1-CtGH5-F194A) and cellobiohydrolase (CtCBH5A) for saccharification to produce bioethanol[J].Preparative Biochemistry and Biotechnology, 2020, 50(9):883-896.
[17] 佟新新.黑曲霉纤维素酶系的作用特征及其在蔗渣水解中的应用[D].天津:天津科技大学, 2017.
TONG X X.Characteristics of cellulase system of Aspergillus niger and its application in hydrolysis of bagasse[D].Tianjin:Tianjin University of Science and Technology, 2017.
[18] SUN J F, WANG J, TIAN K M, et al.A novel strategy for production of ethanol and recovery of xylose from simulated corncob hydrolysate[J].Biotechnology Letters, 2018, 40(5):781-788.
[19] SLUITER A, HAMES B, RUIZ R, et al.Determination of structural carbohydrates and lignin in biomass:NREL/TP-510-42618[R].Golden:U.S.Department of Energy Office of Energy Efficiency and Renewable Energy, 2008.
[20] 董自星, 李伟国, 佟新新, 等.黑曲霉内切β-1,3(4)-葡聚糖酶的基因克隆与酶学特性分析[J].食品与发酵工业, 2016, 42(11):58-64.
DONG Z X, LI W G, TONG X X, et al.Gene cloning and biochemical characterization of endo-1,3(4)-β-glucanases from Aspergillus niger[J].Food and Fermentation Industries, 2016, 42(11):58-64.
[21] 韦升坚.高效液相色谱-蒸发光散射法检测无糖饮料中7种糖类物质的含量[J].食品安全质量检测学报, 2019, 10(19):6 519-6 526.
WEI S J.Determination of 7 kinds of sugar substances in sugar-free beverage by high performance liquid chromatography-evaporative light scattering dection[J].Journal of Food Safety and Quality, 2019, 10(19):6 519-6 526.
[22] YANG B, DAI Z Y, DING S Y, et al.Enzymatic hydrolysis of cellulosic biomass[J].Biofuels, 2011, 2(4):421-449.
[23] YEOMAN C J, HAN Y J, DODD D, et al.Thermostable enzymes as biocatalysts in the biofuel industry[J].Advances in Applied Microbiology, 2010, 70:1-55.
[24] SINGHANIA R R,PATEL A K,SUKUMARAN R K, et al.Role and significance of beta-glucosidases in the hydrolysis of cellulose for bioethanol production[J].Bioresource Technology, 2013, 127:500-507.