近年来,随着全球人口的剧烈增长,人们对高蛋白食物的需求急剧增加[1]。肉类行业每年产生大量的屠宰副产物,例如动物内脏,其蛋白质含量较高[2]。然而,这些屠宰副产物常用于生产低附加值的产品,如动物饲料、宠物食品等[3],一定程度上造成了资源的浪费。如何更好地利用肉类加工副产物,使之成为食品工业的新原料十分重要[4]。目前,酶解肉类副产品是提取蛋白质的有效方法之一,但是蛋白酶解物通常具有苦味,限制其在食品加工中的进一步应用[5]。因此,降低或去除蛋白酶解物中的苦味成为亟待解决的关键问题。
蛋白酶解物的理化特性与其苦味密切相关[5-6]。肽的疏水性是苦味产生的关键因素之一。平均疏水性高的蛋白质所产生的肽,其苦味强度往往较高。此外,多肽的序列、肽链长度和空间结构等也对苦味具有影响[7]。据报道,苦味肽的氨基酸残基个数通常少于8个,且其苦味随着肽链长度的延长而增加,这是由于肽链长度增加使苦味肽与苦味受体结合增强[8]。苦味肽的苦味也可能受到水解度(degree of hydrolysis,DH)的影响。通常,当DH值很低时,苦味强度和DH呈正相关[9]。随着蛋白质水解程度的增加,更多的疏水性氨基酸暴露出来,导致其苦味增加[10]。然而,通过高强度的蛋白酶水解可以使苦味肽进一步降解成更小的肽或游离氨基酸,从而减少苦味[11]。此外,蛋白酶种类也可以影响其酶解物的苦味。由于不同蛋白酶具有独特的酶切特异性,导致产生不同的肽组分,进而造成其呈味特性的差别。整体上,苦味肽的确切构效关系尚未阐明。
目前,选择性脱除疏水性肽、苦味掩盖、酶解脱苦和包埋法等常用来降低蛋白酶解物的苦味[5]。采用外肽酶(包括氨肽酶和羧肽酶)对苦味肽进行酶解,可使蛋白酶解物的苦味降低,且不影响蛋白酶解物的产率[12]。外肽酶可以选择性酶切苦味肽的N端或C端肽键,释放出游离的疏水氨基酸,降低其苦味。此外,内肽酶和外肽酶的联合水解,已被证明可以减少小麦面筋蛋白酶解物的苦味[11]。CHEUNG等[13]研究表明,外肽酶处理后的乳清蛋白酶解物的苦味降低,鲜味提高。鲜味是一种可口的、像肉汤或肉类的味道。目前,一些鲜味肽已从各种食物中得到分离和鉴定,它们具有强烈的鲜味或鲜味增强特性[14-15]。通常,鲜味肽是分子质量<500 Da的典型酸性多肽[16]。鲜味肽可以通过与人类苦味受体结合,进而抑制苦味[17],这可以作为减少酶解物苦味的另一种策略。对于乳蛋白或植物蛋白,通过外肽酶处理可以降低苦味,但对于动物内脏(如心肌)是否也有类似效果仍未见相关研究。此外,蛋白酶解物的呈味特性与其结构特征之间的关系仍不清楚。基于此,本研究尝试开发一种有效的酶解方法,制备低苦味牛心肌蛋白酶解物,同时阐明蛋白酶解物的呈味特点与其结构的关系。
1 材料与方法
1.1 材料与试剂
牛心,重庆市北碚区永辉超市;Alcalase 2.4 L FG(2.4 AU/g)、Flavourzyme(1 000 LAPU/g)、Protamex(1.5 AU/g)、Neutrase 0.8 L(0.8 AU/g),诺维信公司;ProteAX(1 400 U/g)、Protease P 6SD(600 000 U/g)、Protease A 2SD(100 000 U/g)、Protease A,日本天野酶制品株式会社;Sumizyme BNP-L(45 000 U/g),新日本化工有限公司。邻苯二甲醛(o-phthalaldehyde,OPA)、乙酰基-半胱氨酸(纯度99%)、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、Papain P1(100 TU/mg)、Bromelain(100 TU/mg),山东亿宝莱生物科技有限公司;L-亮氨酸(纯度99%),瑞士阿达玛斯试剂有限公司;本研究其他所用试剂均为分析纯。
1.2 仪器与设备
85-2型磁力搅拌器,郑州长城科工贸有限公司;H3-16KR高速冷冻离心机,湖南可成仪器设备有限公司;UV-6100紫外分光光度计,上海元析仪器有限公司;电热恒温水浴锅,上海齐欣科学仪器有限公司;PB-10 pH计,Sartorius赛多利斯;Ultimate 3000高效液相色谱仪、EASY nLC 1200-Orbitrap Fusion Lumos液质联用仪,美国赛默飞世尔科技公司。
1.3 实验方法
1.3.1 基本营养成分测定
水分含量测定采用GB 5009.3—2016《食品中水分的测定》;蛋白质含量测定采用GB 5009.5—2016《食品中蛋白质的测定》;脂肪含量测定采用GB 5009.6—2016《食品中脂肪的测定》;灰分含量测定采用GB 5009.4—2016《食品中灰分的测定》。
1.3.2 蛋白酶解物的制备
牛心经绞肉机处理后,按100 g牛心与200 g水混合,调整pH至蛋白酶的最适pH值,并在最适温度下加入蛋白酶(酶底比为0.5%,质量分数),持续酶解1~5 h。10种蛋白酶最适温度和pH值如下:Alcalase(pH 7.5,50 ℃),Flavourzyme(pH 7.0,50 ℃),Protamex(pH 7.5,55 ℃),Neutrase(pH 7.0,50 ℃),ProteAX(pH 7.0,50 ℃),Protease P(pH 7.0,40 ℃),Protease A(pH 7.0,50 ℃),木瓜蛋白酶(pH 7.0,55 ℃),菠萝蛋白酶(pH 7.0,40 ℃)和Sumizyme BNP-L(pH 7.0,50 ℃)。酶解作用结束后,在95 ℃下灭酶15 min;冷却后,离心(8 000×g,15 min)后取上清液。
1.3.3 水解度的测定
采用OPA法测定水解产物的DH[18]。OPA试剂由10 mL的50 mmol/L OPA甲醇溶液、5 mL的20%(质量分数)SDS溶液、10 mL的50 mmol/L乙酰基-半胱氨酸水溶液和75 mL硼酸缓冲液(0.1 mol/L,pH 9.5)组成。取10 μL样品和1.2 mL OPA试剂混合,室温反应10 min后,在340 nm处测定吸光度。以亮氨酸为标准品绘制标准曲线,计算样品的亮氨酸当量浓度,进而计算DH。DH计算公式如公式(1)所示:
(1)
式中:(NH2)Tx为酶解产物的游离氨基含量,μmol/mL;(NH2)T0为未水解样品游离氨基含量,μmol/mL;(NH2)total为蛋白质样品中游离氨基的总量,μmol/mL;采用6 mol/L的HCl在110 ℃下水解样品24 h后测定。
1.3.4 肽分子质量分布测定
利用分子排阻色谱分析蛋白酶解物的分子质量分布情况,通过Chromeleon 7.0色谱软件进行数据获取和分析。蛋白酶解物(1 mg/mL)上样量为10 μL,采用含0.1%三氟乙酸(trifluoroacetic acid,TFA)的30%乙腈水溶液进行等浓度洗脱,流速0.5 mL/min,检测波长为214 nm。用Trp(204 Da)、GLV(287 Da)、Ser-Gly-Asn-Ile-Gly-Phe-Pro-Gly-Pro-Lys(1 114 Da)、胰岛素(5 700 Da)和肌红蛋白(17 600 Da)绘制标准曲线。计算公式如公式(2)所示:
lgMW=-0.608 6t+6.938 1
(2)
式中:MW为分子质量,Da;t为洗脱时间,min。
1.3.5 蛋白酶解物的感官评价
采用定量描述分析法对蛋白酶解物的呈味特性进行感官定量描述分析,由经过训练的感官评价小组[10人,4男6女,平均年龄(25±2)岁]评价10种蛋白酶制备的蛋白酶解物。在室温下,用纯水将蛋白酶解物稀释到蛋白质量分数为1%。根据每个样品的滋味强度,在15 cm线尺度上评估蛋白酶解物的苦、鲜、甜、咸、酸等感官属性以及总体香气强度。样品(25 mL)在室温下用带有塑料盖的黑色塑料杯盛装,使用3位数字编码。在感官评价前的培训中,向评价小组成员提供了以下参考溶液:咖啡因(0.4 g/L,苦味强度,5;0.8 g/L,苦味强度,10),谷氨酸钠(1.0 g/L,鲜味强度,5;2.0 g/L,鲜味强度,10)。
1.3.6 LC-MS/MS分析
液相色谱仪:Easy-nLC 1200系统;色谱柱:C18色谱柱(3 μm,100 Å,75 μm×15 cm);流动相A:0.1%甲酸的超纯水;流动相B:80%的乙腈水溶液。进样量为5 μL,流速为0.3 mL/min。质谱数据使用Orbitrap Fusion Lumos在高能离解(higher energy collisional dissociation, HCD)状态下进行检测。具体参数如下:喷雾电压:2.0 kV;毛细管温度:320 ℃;分辨率设置:一级120 000(m/z 200),二级30 000(m/z 200);离子扫描范围:350~1 550 m/z;MS1自动增益控制(automatic gain control,AGC):4e5。
采用Peptigram在线分析软件(http://bioware.ucd.ie/peptigram)对蛋白酶解物的肽谱图进行可视化分析。输入所需信息的CSV文件,包括肽序列、前体蛋白的UniProt ID、起始位置、终止位置、肽强度级别。肽图谱以绿色线条表示,具有不同的高度和强度水平。
1.3.7 蛋白酶切特异性分析
根据质谱所鉴定的肽序列,从不同样品中提取酶切位置的氨基酸信息,进而分析蛋白酶的酶切特异性。使用iceLogo软件(Version 1.2)在已识别的酶切位点附近的3个位置(P3,P2,P1,P1′,P2′,P3′)生成氨基酸的酶特异性logo,以代表酶切位置。
1.4 统计分析
所有实验数据均以3次独立重复测定的平均值和标准偏差表示。使用SPSS 22.0统计软件对数据进行单因素ANOVA分析及事后多重比较,采用Duncan分析各组间是否有显著性差异(P<0.05为显著)。采用主成分分析(principal component analysis,PCA)法分析感官数据。采用偏最小二乘回归(partial least squares regression,PLSR)模型分析呈味特性(因变量)和肽分子质量分布(自变量)的关系。PCA和PLSR分析均使用Unscrambler X10.3版软件进行分析。
2 结果与分析
2.1 牛心肌的一般化学组成特征
牛心肌的基本化学成分结果见表1,结果表明牛心肌是高蛋白含量原料,且脂肪含量较低,是一种良好的蛋白质资源,可用于后续的蛋白酶解。
表1 牛心肌基本营养成分分析 单位:%
Table 1 The proximate composition analysis of bovine cardiac muscle
成分蛋白质总脂肪灰分水分质量分数19.28±0.305.08±0.071.37±0.0674.90±0.27
牛心肌的氨基酸组成及含量见表2。牛心的8种必需氨基酸(essential amino acid,EAA)含量为7.33 g/100g,10种非必需氨基酸(non-essential amino acid,NEAA)含量为11.82 g/100g。世界卫生组织/联合国粮食及农业组织(World Health Organization/Food and Agriculture Organization of the United Nations,WHO/FAO)理想模式的EAA/NEAA为60 g/100g,而牛心的EAA/NEAA超过WHO/FAO理想模式,达到62.01 g/100g。此外,牛心中含有高比例的谷氨酸和天冬氨酸,其酶解产物可能具有良好的鲜味。因此,牛心有望用于开发呈味肽等调味类产品。
表2 牛心肌氨基酸组成及含量
Table 2 The amino acid composition and content of bovine cardiac muscle

必需氨基酸含量/[g·(100g)-1]非必需氨基酸含量/[g·(100g)-1]Lys1.66±0.06Asp1.83±0.07Phe0.87±0.03Ser0.94±0.03Val0.85±0.03Glu3.15±0.10Met0.26±0.01Gly1.02±0.05Trp0.26±0.02Ala1.25±0.04Leu1.75±0.05Cys0.17±0.01Ile0.73±0.02Tyr0.57±0.03Thr0.97±0.03His0.63±0.02Arg1.35±0.04Pro0.94±0.04
2.2 不同蛋白酶处理下的水解度
图1显示了10种不同蛋白酶酶解心肌后的水解度曲线。在酶解反应初期(1~3 h),水解速率较快,而水解度在5 h后达到最高。在预实验中,酶解到6 h的样品水解度未有较大程度的提升。从Protease A、Protease P、ProteAX、Alcalase得到的酶解物,其DH值高于其他蛋白酶得到的酶解物,主要由于它们同时具有内肽酶和外肽酶的活性。ProteaseA水解5 h后,牛心肌酶解物的DH值达到最高(30.9%),这表明这些蛋白酶可以有效地降解牛心肌蛋白为可溶性的小肽或氨基酸。然而,Neutrase和Sumizyme BNP-L酶解牛心肌后,其水解度较低,表明这2种蛋白酶对牛心肌水解效率相对较低。

图1 十种不同蛋白酶酶解心肌后的水解度曲线
Fig.1 DH curves of protein hydrolysates from bovine cardiac muscle hydrolyzed by 10 different proteases
2.3 酶解物中肽MW的分布特征
图2显示了不同酶解物的分子质量分布情况。MW分布范围分为5个部分,即>10 kDa、5~10 kDa、1~5 kDa、0.5~1 kDa和<0.5 kDa。总体而言,不同蛋白酶处理后的牛心肌蛋白酶解物主要由低分子质量(<1 kDa)肽组成,说明牛心肌蛋白大部分被降解为小肽或游离氨基酸。值得注意的是,Protease A、Protease P和ProteAX 3种蛋白酶释放的低分子质量肽组分(<1 kDa)比例最高,而Neutrase和Sumizyme BNP-L酶解后蛋白水解物的低分子质量肽组分含量较低。本研究结果与2.2部分的DH数据一致。

图2 十种不同的蛋白酶制备酶解物(5 h)的肽分子质量分布
Fig.2 The MW distribution of protein hydrolysates (5 h) from bovine cardiac muscle hydrolyzed by 10 different proteases
2.4 蛋白水解物的感官评价结果
通过感官评价不同蛋白酶解物的呈味特性,PCA如图3所示。10种牛心肌蛋白酶解物的PCA图的PC1+PC2为71%。其中,通过Protease A催化牛心肌水解得到的酶解产物的鲜味强度最高(7.50);Protease P得到的酶解产物的香气强度最高(7.68)。木瓜蛋白酶和菠萝蛋白酶得到的酶解产物具有一定的苦味;其余水解产物的香气强度均较低。
进一步剖析肽分子质量分布与蛋白酶解物的DH和呈味特性的关系,尤其是蛋白酶解物的鲜味和苦味,结果如图4-a和图4-b所示。通过PLSR和相关系数热图分析发现,鲜味与MW(<0.5 kDa)有中度的相关性(r=0.45),但与DH有很强的相关性(r=0.87)。苦味与MW(0.5~1 kDa)具有一定的相关性(r=0.44)。

图3 不同牛心肌酶解物的呈味特性的主成分分析
Fig.3 PCA based on sensory attribute for different protein hydrolysates from bovine cardiac muscle
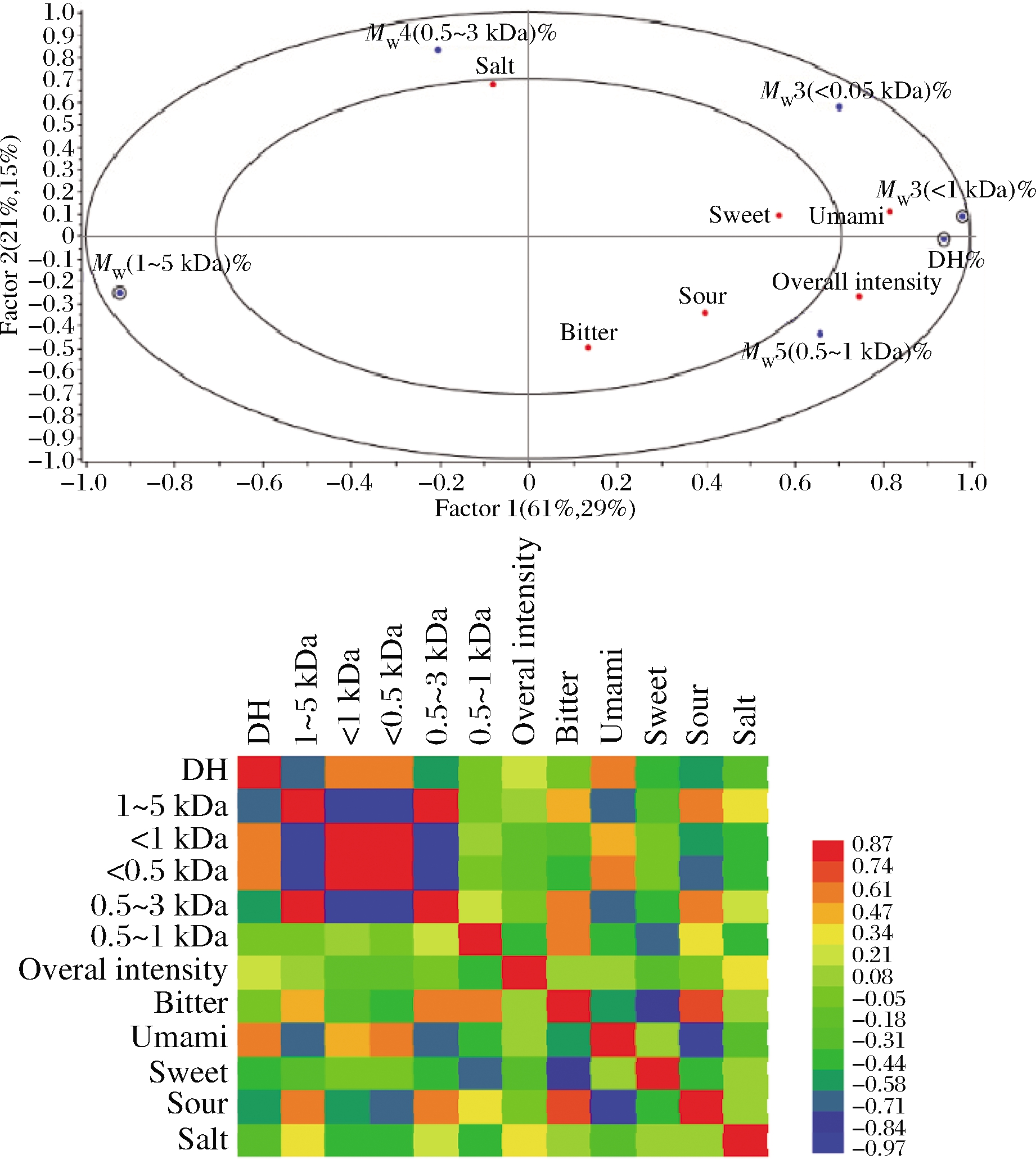
a-PLSR分析图;b-相关系数热图
图4 牛心水解蛋白的分子质量分布分别对呈味特性的 PLSR分析图及相关系数热图
Fig.4 Loading plots and heatmap from PLSR analysis of sensory attributes and MW distributions of protein hydrolysates from bovine cardiac muscle
2.5 蛋白酶的酶切特性
iceLogo揭示了10种蛋白酶的酶切特异性(图5)。根据不同蛋白酶的酶切特异性,构建了ice Logos中P3-P3′位点的氨基酸频率分布,氨基酸字母的大小对应氨基酸频率的差异。为了探究10种不同蛋白酶的酶切特异性,根据牛心肌蛋白酶解物的LC-MS/MS肽序列的鉴定结果,分析了酶切位点的氨基酸残基的相对丰度。iceLogos结果体现了不同氨基酸残基在P3-P2-P1-P1′-P2′-P3′位置的相对丰度(图5)。蛋白酶的酶切位点与其在N端和C端邻近肽键的氨基酸残基相关,酶切位置主要发生在P1和P1′残基之间。在所有蛋白酶中,P1和P1′位置分别以Lys和Ala为主。一些蛋白酶具有相似的酶特异性。例如,ProteAX、Protease A、Protease P、Flavourzyme和Neutrase具有相似的酶切位点,P1和P1′位置包括为Leu和Ala。
2.6 肽组分的可视化分析结果
图6显示10种不同蛋白酶酶解代表性前体蛋白(肌球蛋白和肌动蛋白)的肽谱图,分别包括牛心肌α-肌动蛋白(Q3ZC07)、肌球蛋白-2(Q9BE41)和肌球蛋白-7(Q9BE39)。在心肌肌动蛋白样品中,肌动蛋白的肽覆盖率要比肌球蛋白高,而肽的丰度值差异很大。ProteAX、Protease A、Protease P和Flavourzyme这4种蛋白酶具有类似的酶切结果,这可能与其酶特异性有关,这一结果也与2.5部分结果一致,即4种蛋白酶具有相似的酶切位点,可能是与其独特的酶切位点(Asp和Lys)有关。另外,Protease A、Protease P和ProteAX在氨基酸位置130附近的强度也高于其他蛋白酶。

图5 基于iceLogo分析10种蛋白酶的酶切特异性
Fig.5 The specificity of 10 proteases analyzed based on iceLogo

a-牛心肌肌动蛋白(Q3ZC07);b-肌球蛋白-2(Q9BE41);c- 肌球蛋白-7(Q9BE39)
图6 十种蛋白酶水解的代表性前体蛋白的肽谱
Fig.6 Peptide profiles of representative precursor proteins hydrolyzed by 10 proteases 注:绿色柱的高度和强度对应于肽的数量及该位置重叠的肽强度总和
3 讨论
3.1 水解度与蛋白酶解物呈味特性关系
通过比较蛋白酶解物DH的差异可以更好地了解不同蛋白酶的水解程度。Protease A、Protease P和ProteAX同时含有内肽酶和外肽酶,其酶切范围更广。因此,其样品的水解度值更高(图2)。相反,Flavourzyme作为内肽酶和外肽酶的混合物,由于外肽酶相对活性更高,因此不能产生高DH值[18]。已有研究表明,DH可能会对蛋白酶解物的苦味产生影响,但是对于DH在水解产物中苦味所起的作用具有争议。一般而言,在酶解初期,酶解物的苦味随着水解度的增加而逐渐增强,主要由于一些疏水性的苦味肽被逐渐释放出来,导致酶解物的苦味强度较高。而随着水解度继续提高,酶解物的苦味又呈下降趋势,主要由于这些苦味肽被进一步降解,导致苦味强度的降低[5]。在本研究中,Protease A、Protease P、ProteAX水解5 h后得到的高DH酶解物有助于降低蛋白酶解物的苦味,且提高其鲜味。这一现象可能归因于外肽酶的作用,蛋白酶解物中的苦味肽进一步降解,同时释放出大量小肽和游离氨基酸[9,13],这一结果与之前的研究类似。利用内肽酶和外肽酶联合酶解小麦面筋蛋白,制备了低苦味蛋白酶解物[11]。此外,PLSR分析表明,DH与鲜味之间存在高度正相关性(相关系数r分别为0.70和0.87)。在较高的DH下,苦味肽的N端或C端会进一步被降解为小肽(分子质量<1 kDa)和游离氨基酸,有助于酶解产物的苦味降低以及鲜味的提高[17]。
3.2 肽分子质量与蛋白酶解物呈味特性关系
多肽具有不同的呈味特性,其中包括苦味和鲜味[19]。疏水性小肽可能引起蛋白酶解物的苦味,这一点已被广泛证实。然而,蛋白酶解物中苦味肽的确切分子质量范围尚不明确。有研究表明,当多肽的分子质量达到1 kDa时,其苦味会增加[5]。大豆蛋白酶解物的苦味与分子质量低于1 kDa的疏水苦味肽具有相关性[20]。大豆蛋白中分子质量在1~4 kDa的肽组分最苦,而低于1 kDa的肽组分苦味较低[21]。在本研究中,蛋白酶解物的苦味与0.5~1 kDa肽组分具有高度相关性(图4)。这一结果与最近研究结果相一致,即苦味与0.5~1 kDa的肽组分呈正相关性[22]。从植物或动物来源的蛋白酶解物具有鲜味或鲜味增强特性,可能与分子质量<500 Da肽组分有关[16]。在本研究中,Protease A、Protease P和ProteAX所制备的酶解物鲜味明显,其肽组成以<0.5 kDa的部分(小肽和游离氨基酸)为主。PLSR分析结果表明,蛋白酶解物的鲜味与低分子质量的肽组分(<0.5 kDa)呈正相关,进一步解释了本研究中酶解物具有较高的鲜味强度的特点。此外,原料中具有高比例的谷氨酸和天冬氨酸,也是产生鲜味的可能原因。已有研究证实,鲜味肽对苦味具有一定的抑制作用[17],这也支持了本研究中水解产物具有高鲜味和低苦味的特征。
3.3 酶切特异性与蛋白酶解物呈味特性的关系
蛋白酶的酶切特异性会影响酶解物的呈味特性,不同蛋白酶可以产生不同的肽谱图[9]。内肽酶能够酶切蛋白质分子内的非末端肽键,而外肽酶可以酶切苦味肽中N端或C末端的氨基酸,进一步释放肽两端的游离氨基酸[12]。Protease A、Protease P、ProteAX和Flavourzyme 4种酶兼具内肽酶和外肽酶的活性,其余6种蛋白酶为不同酶切特异性的内肽酶。酶切特异性和肽谱图结果(图6)表明,Protease A、Protease P、ProteAX和Flavourzyme具有相似的酶切肽谱图,这主要是由于这些蛋白酶具有相似的微生物来源[18]。外肽酶处理方法已被证明可以有效减少蛋白酶解物的苦味,增加鲜味或咸味[11-12]。当前的研究结果与已报道研究结果一致,即采用含内肽酶和外肽酶的复合酶制剂所制备的酶解物具有高鲜味和低苦味特点。然而,利用木瓜蛋白酶和菠萝蛋白酶2种植物源的内肽酶所制备的酶解物却产生了相对较高强度的苦味。与其他蛋白酶相比,它们在肽谱图中覆盖范围和强度的差异主要是由于其不同的酶切特异性(图6)。木瓜蛋白酶(EC 3.4.22.2)和菠萝蛋白酶(EC 3.4.22.4)对样品中的疏水氨基酸具有一定的酶切特异性。因此,疏水氨基酸的释放可能是由于蛋白酶解物高苦味强度的原因。此外,Protemax酶解后的样品具有一定的咸味,这与使用Protamex酶解虾加工副产物后,其样品具有一定咸味强度的结果相一致[13]。类似地,有报道称鱼类蛋白质的酶水解物可以提高盐的味道[23],其确切的原因有待进一步研究。
4 结论
本研究利用10种不同蛋白酶分别酶解牛心肌,明确蛋白酶A可作为制备低苦味、高鲜味蛋白酶解物的最佳蛋白酶,并初步解释了蛋白酶解物的呈味特性与蛋白酶解物的水解度、分子质量分布及酶特异性的关系;其中,蛋白酶解物的鲜味与0.5 kDa以下的小肽呈正相关,而苦味与肽组分(0.5~1 kDa)呈正相关。本研究证明,由于不同蛋白酶具有不同的酶切特异性,造成了蛋白酶解物的肽谱图差异,进而产生了不同的呈味特性。本研究为蛋白酶解物的呈味特性与结构关系研究提供了理论依据。
[1] HENCHION M, HAYES M, MULLEN A M, et al.Future protein supply and demand:Strategies and factors influencing a sustainable equilibrium[J].Foods, 2017, 6(7):53.
[2] TOLDR F, MORA L, REIG M.New insights into meat by-product utilization[J].Meat Science, 2016, 120:54-59.
F, MORA L, REIG M.New insights into meat by-product utilization[J].Meat Science, 2016, 120:54-59.
[3] LONG J M, MOHAN A.Development of meat powder from beef byproduct as value-added food ingredient[J].LWT, 2021, 146:111460.
[4] MULLEN A M,  LVAREZ C, ZEUGOLIS D I, et al.Alternative uses for co-products:Harnessing the potential of valuable compounds from meat processing chains[J].Meat Science, 2017, 132:90-98.
LVAREZ C, ZEUGOLIS D I, et al.Alternative uses for co-products:Harnessing the potential of valuable compounds from meat processing chains[J].Meat Science, 2017, 132:90-98.
[5] FU Y, CHEN J R, BAK K H, et al.Valorisation of protein hydrolysates from animal by-products:Perspectives on bitter taste and debittering methods:A review[J].International Journal of Food Science & Technology, 2019, 54(4):978-986.
[6] MAEHASHI K, HUANG L.Bitter peptides and bitter taste receptors[J].Cellular and Molecular Life Sciences, 2009, 66(10):1 661-1 671.
[7] FU Y, BAK K H, LIU J, et al.Protein hydrolysates of porcine hemoglobin and blood:Peptide characteristics in relation to taste attributes and formation of volatile compounds[J].Food Research International, 2019, 121:28-38.
[8] 王知非, 林璐, 孙伟峰, 等.苦味肽和苦味受体研究进展[J].中国调味品, 2016, 41(9):152-156.
WANG Z F, LIN L, SUN W F, et al.Research progress of bitter peptides and bitter receptors[J].China Condiment, 2016, 41(9):152-156.
[9] NEWMAN J, EGAN T, HARBOURNE N, et al.Correlation of sensory bitterness in dairy protein hydrolysates:Comparison of prediction models built using sensory, chromatographic and electronic tongue data[J].Talanta, 2014, 126:46-53.
[10] SPELLMAN D, MCEVOY E, O′CUINN G, et al.Proteinase and exopeptidase hydrolysis of whey protein:Comparison of the TNBS, OPA and pH stat methods for quantification of degree of hydrolysis[J].International Dairy Journal, 2003, 13(6):447-453.
[11] LIU B Y, ZHU K X, GUO X N, et al.Changes in the enzyme-induced release of bitter peptides from wheat gluten hydrolysates[J].RSC Advances, 2016, 6(104):102 249-102 257.
[12] FU Y, LIU J, ZHANG W, et al.Exopeptidase treatment combined with Maillard reaction modification of protein hydrolysates derived from porcine muscle and plasma:Structure-taste relationship[J].Food Chemistry, 2020, 306:125613.
[13] CHEUNG L K Y, ALUKO R E, CLIFF M A, et al.Effects of exopeptidase treatment on antihypertensive activity and taste attributes of enzymatic whey protein hydrolysates[J].Journal of Functional Foods, 2015, 13:262-275.
[14] ZHANG J N, SUN-WATERHOUSE D, SU G W, et al.New insight into umami receptor, umami/umami-enhancing peptides and their derivatives:A review[J].Trends in Food Science & Technology, 2019, 88:429-438.
[15] LIU Z Y, ZHU Y W, WANG W L, et al.Seven novel umami peptides from Takifugu rubripes and their taste characteristics[J].Food Chemistry, 2020, 330:127204.
[16] WANG W L, ZHOU X R, LIU Y.Characterization and evaluation of umami taste:A review[J].TrAC Trends in Analytical Chemistry, 2020, 127:115876.
[17] KIM M J, SON H J, KIM Y, et al.Umami-bitter interactions:The suppression of bitterness by umami peptides via human bitter taste receptor[J].Biochemical and Biophysical Research Communications, 2015, 456(2):586-590.
[18] FU Y, LIU J, HANSEN E T, et al.Structural characteristics of low bitter and high umami protein hydrolysates prepared from bovine muscle and porcine plasma[J].Food Chemistry, 2018, 257:163-171.
[19] TEMUSSI P A.The good taste of peptides[J].Journal of Peptide Science, 2012, 18(2):73-82.
[20] 姜莉莉, 李杏元.呈味肽应用于食品的研究进展[J].中国调味品, 2019,44(11):187-189.
JIANG L L, LI X Y.Research progress on application of taste peptides in food[J].China Condiment, 2019, 44(11):187-189.
[21] ZHU X P, SUN-WATERHOUSE D, CHEN J H, et al.Bitter-tasting hydrophobic peptides prepared from soy sauce using aqueous ethanol solutions influence taste sensation[J].International Journal of Food Science & Technology, 2020, 55(1):146-156.
[22] ASPEVIK T, TOTLAND C, LEA P, et al.Sensory and surface-active properties of protein hydrolysates based on Atlantic salmon (Salmo salar) by-products[J].Process Biochemistry, 2016, 51(8):1 006-1 014.
[23] SCHINDLER A, DUNKEL A, STA HLER F, et al.Discovery of salt taste enhancing arginyl dipeptides in protein digests and fermented fish sauces by means of a sensomics approach[J].Journal of Agricultural and Food Chemistry, 2011, 59(23):12 578-12 588.
HLER F, et al.Discovery of salt taste enhancing arginyl dipeptides in protein digests and fermented fish sauces by means of a sensomics approach[J].Journal of Agricultural and Food Chemistry, 2011, 59(23):12 578-12 588.